環介導等溫擴增多重耐藥基因oqxAB的檢測引物、檢測試劑盒及檢測方法與流程
2023-10-10 20:43:04
本發明涉及細菌基因檢測技術領域,特別涉及環介導等溫擴增多重耐藥基因oqxAB的引物,還涉及一種用環介導等溫擴增方法檢測多重耐藥基因oqxAB的試劑盒,還涉及用環介導等溫擴增方法檢測多重耐藥基因oqxAB的檢測方法。
背景技術:
質粒編碼的多重耐藥外排泵oqxAB最早是在研究喹乙醇耐藥機制時予以發現。2003年,丹麥科學家Sorensen等首次從豬的糞便樣品分離的大腸桿菌中發現了介導喹乙醇耐藥性的質粒pOLA52。2004年,Hansen等從pOLA52質粒上發現了對喹乙醇耐藥的外排泵基因oqxAB。由於其耐藥機制非常符合RND家族的主動外排泵特徵,因此屬於質粒介導的RND家族。
Strahilevitz等研究發現,外排泵oqxAB基因可降低細菌對喹諾酮類藥物的敏感性,因此將其歸入質粒介導的喹諾酮類耐藥機制(plasmid-mediated quinolone resistance,PMQR)中。Lars等研究表明,oqxAB不僅可以介導喹乙醇、喹諾酮類、氯黴素的耐藥,其作用底物還包括洗必泰、西曲溴銨、三氯生等清潔劑、洗滌劑和消毒劑。另外研究中還發現,氟甲喹、卡巴氧、甲氧苄啶、四環素等藥物的耐藥現象也可以隨著oqxAB基因而轉移,分析原因表明oqxAB可以與其他藥物的耐藥基因共同轉移。
目前,oqxAB已經在世界各地廣泛發現,如丹麥、韓國、瑞士、日本、美國等,並大多出現於腸桿菌科細菌中,如大腸桿菌、沙門氏菌和肺炎克雷伯菌中。在研究人源和動物源oqxAB基因時,有關研究結果已經證實,動物源和人源耐藥菌株具有相同的耐藥特徵,並且來源於同一株克隆菌株。因此含有oqxAB的腸桿菌科細菌已威脅人類的健康,給臨床治療帶來了巨大的挑戰。
對於多重耐藥基因oqxAB的檢測,目前的實驗室診斷主要是基於PCR技術進行確證。但是PCR方法容易出現假陽性,並且檢測成本高,操作比較複雜,檢測時間長(一般需要2-3小時),這些都影響了臨床攜帶oqxAB基因的檢測結果。
環介導等溫擴增方法(LAMP)是近年來新興的一種基因擴增方法,對儀器設備要求不高,只需要一個恆溫水浴鍋或金屬浴就可以,成本低,且臨床上容易做到,檢測時間較短,不超過1個小時,為快速、準確診斷基因的一種新方法。環介導等溫擴增方法已經廣泛應用於檢測細菌的領域,並有很多相關專利獲得授權。目前國內外均未見使用LAMP方法檢測多重耐藥基因oqxAB的報導。
技術實現要素:
為了解決PCR擴增容易出現假陽性、檢測成本高、操作複雜、檢測時間長的問題,增補使用LAMP檢測多重耐藥基因oqxAB的空白,本發明提供了使用環介導等溫擴增多重耐藥基因oqxAB的引物。本發明建立了一種多重耐藥基因oqxAB的LAMP檢測方法,根據oqxAB基因保守區的6段序列提供了一對特異性內引物,一對特異性外引物和一對環引物。
本發明還提供了檢測多重耐藥基因oqxAB的試劑盒。
本發明還提供了檢測多重耐藥基因oqxAB的檢測方法。
本發明是通過以下措施實現的:
一種環介導等溫擴增多重耐藥基因oqxAB的引物,由一對外引物、一對內引物和一對環引物組成,其核苷酸序列分別如下:
外引物F3:5'-TGCGCGCGGAGTATCC-3'
外引物B3:5'-GAACCTGCGCCTGATCC-3'
內引物FIP:5'-TGTTTTCAACGCCGTTGATCGC-GGCGCCAACCCGAAAG-3'
內引物BIP:5'-TACATGAAATCGGTCGCCGGC-TACCCGGGCGGAAGGT-3'
環引物LF:5'-TGTTTTCAACGCCGTTGATCGC-3'
環引物LB: 5'-TACATGAAATCGGTCGCCGGC-3'
其中,外引物與內引物的摩爾比為1:8,外引物與環引物的摩爾比為1:4。
一種檢測多重耐藥基因oqxAB的試劑盒,包括若干個裝有反應液的LAMP反應管,其中每25 μl反應液中含有:12.5 μl 2×等溫反應緩衝液、1.0 μl Bst DNA聚合酶、40 pmol內引物FIP、40 pmol內引物BIP、 5 pmol外引物F3、5 pmol外引物B3、20 pmol環引物LF、20 pmol環引物LB,餘量為滅菌雙蒸水;其中Bst DNA聚合酶的活性單位為8 U/μl。2×等溫反應緩衝液中含有40 mM pH為8.8的Tris-HCl、20 mM KCl、16 mM MgSO4、20 mM (NH4)2SO4、0.2%wt% Tween20、1.6 M甜菜鹼、2.8 mM dNTP。
所述的試劑盒,還包括1μl鈣黃綠素。
一種檢測多重耐藥基因oqxAB的檢測方法,包括以下步驟:
(1)提取待檢測細菌基因組總DNA。
(2)使用所述的試劑盒進行檢測,具體操作為:將待檢細菌基因組DNA加入LAMP反應管的反應液中,混勻,同時設置陽性對照和陰性對照,陽性對照中加入反應液內的為含有oqxAB多重耐藥基因的基因組DNA,陰性對照中加入反應液內的為滅菌雙蒸水。將LAMP反應管置於水浴鍋中進行擴增,擴增條件為:65 ℃水浴恆溫反應45 min。
步驟(2)中待檢細菌基因組DNA為含DNA的濃度為0.003-300 ng/μl的DNA溶液。
所述的檢測方法,LAMP反應管中出現白色沉澱的為陽性結果,不出現白色沉澱的為陰性結果。
所述的檢測方法,其特徵是在擴增反應前的反應管中加入1μl的鈣黃綠素,反應結束後擴增產物變為綠色的是陽性結果,橙色的是陰性結果。
步驟(1)中提取的待檢細菌基因組DNA包括以下步驟:將待檢的細菌菌株過夜培養後,取1ml的菌液12000 rpm離心2 min,徹底棄去上清。取沉澱用細菌基因組DNA提取試劑盒提取細菌基因組總DNA,最後溶於50 μl滅菌雙蒸水中,測定細菌基因組DNA的濃度為52 ng/μl左右,-20 ℃保存備用。
本發明的有益效果:
1、採用LAMP技術,特異性強,比PCR檢測方法靈敏度高,不需要昂貴的PCR儀器,只需要普通的金屬浴或水浴鍋即可,且結果不必用凝膠電泳方法來觀察,通過肉眼觀察白色沉澱或使用螢光染料顯色肉眼直接觀察即可判定結果,時間大大縮短,從普通PCR儀器的2-3h縮短至45min左右,簡單而快速,可廣泛應用於獸醫及人醫領域包括實驗室及臨床基層對多重耐藥基因oqxAB的快速檢測;
2、解決了現有技術時間長、工作量大、交叉汙染、操作複雜等缺陷;
3、具有特異性強、靈敏度高、快速且成本低、操作方法更簡單,適於現場快速檢測的優點。
附圖說明
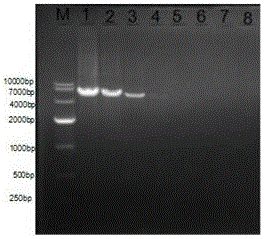
圖1為實施例3中普通PCR方法檢測oqxAB基因靈敏度檢測結果。其中1-7號管中加入的為倍比稀釋的含有oqxAB的大腸桿菌基因組DNA,8號管為陰性對照。其中1-7號管的基因組DNA濃度分別為52 ng/μl、5.2 ng/μl、0.52 ng/μl、5.2*10-2 ng/μl、5.2*10-3 ng/μl、5.2*10-4 ng/μl、5.2*10-5 ng/μl。結果顯示:1-4號能擴增到目的條帶,為陽性;5-8號沒有擴增到肉眼可見的目的條帶,為陰性。
圖2為實施例3中LAMP方法檢測oqxAB基因靈敏度檢測結果。1-7號管中加入的為倍比稀釋的含有oqxAB的大腸桿菌基因組DNA,8號管為陰性對照。其中1-7號管的基因組DNA濃度分別為52 ng/μl、5.2 ng/μl、0.52 ng/μl、5.2*10-2 ng/μl、5.2*10-3 ng/μl、5.2*10-4ng/μl、5.2*10-5 ng/μl;M為5000 bp。結果顯示,1-6號能擴增到目的條帶,為陽性;7-8號沒有擴增到肉眼可見的目的條帶,為陰性。
圖3為實施例4中普通PCR方法檢測oqxAB基因特異性檢測結果。其中,1-7號管中加入的模板分別為陽性對照、陰性對照、大腸桿菌(ATCC 25922,oqxAB 陰性)、沙門氏菌(ATCC 50035,oqxAB 陰性)、金黃色葡萄球菌(ATCC 29213,oqxAB 陰性)、銅綠假單胞菌(ATCC 27853,oqxAB 陰性)和肺炎雙球菌(ATCC 49619,oqxAB陰性);M為10000 bp。結果,只有陽性對照出現陽性條帶,其他結果均為陰性。
圖4為實施例4中LAMP方法方法檢測oqxAB基因特異性檢測結果。其中,1-6號管中加入的模板分別為大腸桿菌(ATCC 25922,oqxAB 陰性)、沙門氏菌(ATCC 50035,oqxAB 陰性)、金黃色葡萄球菌(ATCC 29213,oqxAB 陰性)、銅綠假單胞菌(ATCC 27853,oqxAB 陰性)、肺炎雙球菌(ATCC 49619,oqxAB陰性)和陽性對照;M為5000 bp;7號管加入陰性對照。結果,只有陽性對照出現陽性條帶,其他結果均為陰性。
具體實施方式:
為了更好的理解本發明,下面結合具體實例來進一步說明。
實施例1:製備檢測多重耐藥基因oqxAB的試劑盒
(1)檢測引物的設計
由於在設計LAMP引物時,一般要求序列的長度為≤2000 bp,而目前已知的oqxAB的基因序列大多數為5140 bp。因此,首先根據NCBI上已知的oqxAB基因的序列,比較大腸桿菌、沙門氏菌和肺炎克雷伯三種菌株的oqxAB基因的序列,找出保守區域,分別設計一對特異性內引物FIP、BIP,一對特異性外引物F3、B3,以及環引物LF、LB,用以對多重耐藥基因oqxAB進行檢測。在試驗過程中,每一對引物都設計了若干對,根據試驗結果,挑選出效果最好的引物,鹼基序列如下:
外引物F3:5'-TGCGCGCGGAGTATCC-3' (SEQ No.1)
外引物B3:5'-GAACCTGCGCCTGATCC-3' (SEQ No.2)
內引物FIP:5'-TGTTTTCAACGCCGTTGATCGC-GGCGCCAACCCGAAAG-3' (SEQ No.3)
內引物BIP:5'-TACATGAAATCGGTCGCCGGC-TACCCGGGCGGAAGGT-3' (SEQ No.4)
環引物LF:5'-TGTTTTCAACGCCGTTGATCGC-3' (SEQ No.5)
環引物LB: 5'-TACATGAAATCGGTCGCCGGC-3' (SEQ No.6)
(2)檢測試劑盒
設置檢測多重耐藥基因oqxAB的試劑盒,該試劑盒包括裝有反應液的LAMP反應管。
反應液以25 μl計,含有12.5 μl 2×等溫反應緩衝液、1.0 μl Bst DNA聚合酶、40 pmol內引物FIP、40 pmol內引物BIP、 5 pmol外引物F3、5 pmol外引物B3、20 pmol環引物LF、20 pmol環引物LB,餘量為滅菌雙蒸水。
其中Bst DNA聚合酶的活性單位為8 U/μl。
2×等溫反應緩衝液中含有40 mM pH為8.8的Tris-HCl、20 mM KCl、16 mM MgSO4、20 mM (NH4)2SO4、0.2%wt% Tween20、1.6 M甜菜鹼、2.8 mM dNTP。
其中,外引物與內引物的摩爾比為1:8,外引物與環引物的摩爾比為1:4.
為了設置對照組,每個試劑盒最少設置三個LAMP反應管,此試劑盒設置六個LAMP反應管。
擴增產物的副產物焦磷酸離子與Mg2+反應會產生焦磷酸鎂(白色沉澱)的衍生物,此衍生物與生成的擴增產物成正比,由於LAMP法能產生大量的擴增產物,衍生物產量也會大增,於是可以呈現出肉眼可見的白色沉澱,以此來驗證是否有靶基因的存在。
為了更明顯的觀察擴增結果,試劑盒中設置有螢光染料鈣黃綠素(螯合劑),與試劑中的錳離子(Mn2+)結合處於淬滅狀態,擴增產物的副產物焦磷酸離子與Mn2+結合釋放鈣黃綠素,淬滅狀態解除,發出黃綠色螢光。因此可以根據擴增產物的顏色變化來判斷擴增結果。
實施例2:用環介導等溫擴增方法檢測多重耐藥基因oqxAB的檢測方法
(1)提取待檢的臨床菌株的基因組DNA
將待檢的臨床菌株過夜培養後,取1 mL的菌液12000 rpm離心2 min,徹底棄上清。取沉澱用細菌基因組DNA提取試劑盒提取細菌基因組總DNA,最後溶於50 μl滅菌雙蒸水中, -20 ℃保存備用。
(2)LAMP擴增
使用實施例1中的試劑盒,設置一個檢測管、一個陽性對照管和一個陰性對照管。在檢測管內加入2 μl待檢DNA樣本,陽性對照管中加入2 μl 含oqxAB基因的大腸桿菌基因組DNA(DNA濃度為52 ng/μl),陰性對照管中加入2 μl滅菌雙蒸水。加完後混勻,稍離心,使沾在管壁上的樣品也溶解在反應液中。將反應管置水浴鍋中進行擴增,擴增條件為:65℃水浴恆溫反應45 min。
(3)結果分析:
觀察反應後的混合液顏色。陽性對照管和檢測管有沉澱,陰性對照管保持澄清。加入1 μl鈣黃綠素後,陽性對照管和檢測管變為綠色,陰性對照管保持橙色,說明待檢細菌中含有oqxAB基因。
實施例3:oqxAB基因LAMP檢測方法與普通PCR方法靈敏度比較
取含oqxAB基因的大腸桿菌基因組DNA(濃度為52 ng/μl),按10倍比稀釋,分別為原液的10-1、10-2、10-3、10-4、10-5、10-6倍,分別取2 μl作為LAMP反應和PCR反應的模板。在LAMP反應管和PCR反應管中分別加入以上倍比稀釋的含oqxAB基因的細菌基因組DNA 2 μl。
其中LAMP反應管置於65 ℃恆溫水浴鍋中反應45-60 min,反應結束後直接用肉眼觀察顏色變化,用電泳驗證結果。
PCR反應中所有引物為根據NCBI上已知的oqxAB基因的保守序列用Primer5.0軟體設計,按以下鹼基序列經DNA合成儀合成:
上遊引物F:5'-CCCTGGACCGCACATAAAG-3'
下遊引物R:5'-AAAGAACAAGATTCACCCGCAAC-3'
擴增目的片段大小為5140bp。PCR反應體系設置為:其中10×LA BufferⅡ (Mg2+plus)2.5μl、dNTP mixture 4.0 μl、10 μM上遊引物F 0.5 μl、10 μM 下遊引物R 0.5 μl、Takara LA Taq DNA聚合酶 0.25 μl、模板 2 μl、滅菌雙蒸水補齊25μl。PCR產應條件為:95℃ 5 min,然後進行30 個循環,循環條件為95 ℃ 1 min,54 ℃ 30 s,72 ℃ 5 min,最後72℃ 延伸10 min。反應結束後取8μl PCR產物進行1.2%的瓊脂糖凝膠電泳檢測,根據是否擴增目的條帶判定陽性和陰性。
PCR產物經電泳檢測,結果如圖1所示。反應管1-4均出現目的條帶,且條帶的顏色越來越淡,而5-8號未出現目的條帶。說明原液稀釋至10-3(5.2*10-2 ng/μl)還可以檢測到oqxAB基因。
LAMP方法中,加入鈣黃綠素後,1-6管的顏色為明顯的綠色,7-8管顏色為橙色,說明原液稀釋10-5(5.2*10-4 ng/μl)還可以檢測到oqxAB基因。電泳檢測結果如圖2所示。顏色變化與電泳圖譜結果一致。換算成拷貝數,普通PCR可實際檢測的濃度為5.2*10-2 ng/μl,拷貝數為9.38*106 copys/ml,LAMP方法實際可檢測濃度為5.2*10-4 ng/μl,拷貝數為9.38*104copys/ml,提高了2個數量級。
綜合LAMP和PCR反應結果可以看出,LAMP反應靈敏度要比普通的PCR反應高出2個數量級(100倍),反應時間比PCR短,且不需要凝膠電泳檢測,直接通過肉眼觀察即可判定結果。
實施例4:oqxAB基因LAMP檢測方法和普通PCR方法特異性比較
選擇大腸桿菌(ATCC 25922)、沙門氏菌(ATCC 50035)、金黃色葡萄球菌(ATCC 29213)、銅綠假單胞菌(ATCC 27853)和肺炎雙球菌(ATCC 49619)作為試驗菌株,分別提取基因組DNA,按照實施例2中所建立的oqxAB基因環介導等溫擴增檢測方法進行檢測;同時以以上基因組DNA為模板按照實施例3的PCR反應體系和檢測程序進行PCR擴增;都以大腸桿菌(含oqxAB基因)基因組DNA作為陽性對照,滅菌雙蒸水作為陰性對照,驗證本發明所建立的LAMP方法的特異性。
PCR擴增結果電泳圖譜見圖3,LAMP結果只有陽性對照管變為綠色,電泳圖譜如圖4所示。由於LAMP方法更加直觀簡便,且耗時短,因此更加適合臨床快速檢測的需要。
上述實施例為本發明較佳的實施方式,但本發明的實施方式並不受實施例的限制,其它任何未背離本發明的精神實質與原理下所做的改變、修飾、組合、替代、簡化均應為等效替換方式,都包含在本發明的保護範圍之內。
山東省農業科學院畜牧獸醫研究所
環介導等溫擴增多重耐藥基因oqxAB的檢測引物、檢測試劑盒及檢測方法
8
1
16
DNA
人工合成
1
TGCGCGCGGA GTATCC 16
2
17
DNA
人工合成
2
GAACCTGCGC CTGATCC 17
3
38
DNA
人工合成
3
TGTTTTCAAC GCCGTTGATC GCGGCGCCAA CCCGAAAG 38
4
37
DNA
人工合成
4
TACATGAAAT CGGTCGCCGG CTACCCGGGC GGAAGGT 37
5
22
DNA
人工合成
5
TGTTTTCAAC GCCGTTGATC GC 22
6
21
DNA
人工合成
6
TACATGAAAT CGGTCGCCGG C 21
7
19
DNA
人工合成
7
CCCTGGACCG CACATAAAG 19
8
23
DNA
人工合成
8
AAAGAACAAG ATTCACCCGC AAC 23
