檢測殺白細胞的毒素(PVL)的裝置和方法與流程
2023-10-17 11:39:04 2
本發明涉及檢測生物樣品中細菌毒素的裝置和方法。尤其本發明涉及一種用於識別樣品中存在的金黃色葡萄球菌菌株產生的生物分子如殺細胞毒素(Panton-ValentineLeukocidin,PVL)和PBP2a的橫向流檢測。
背景技術:
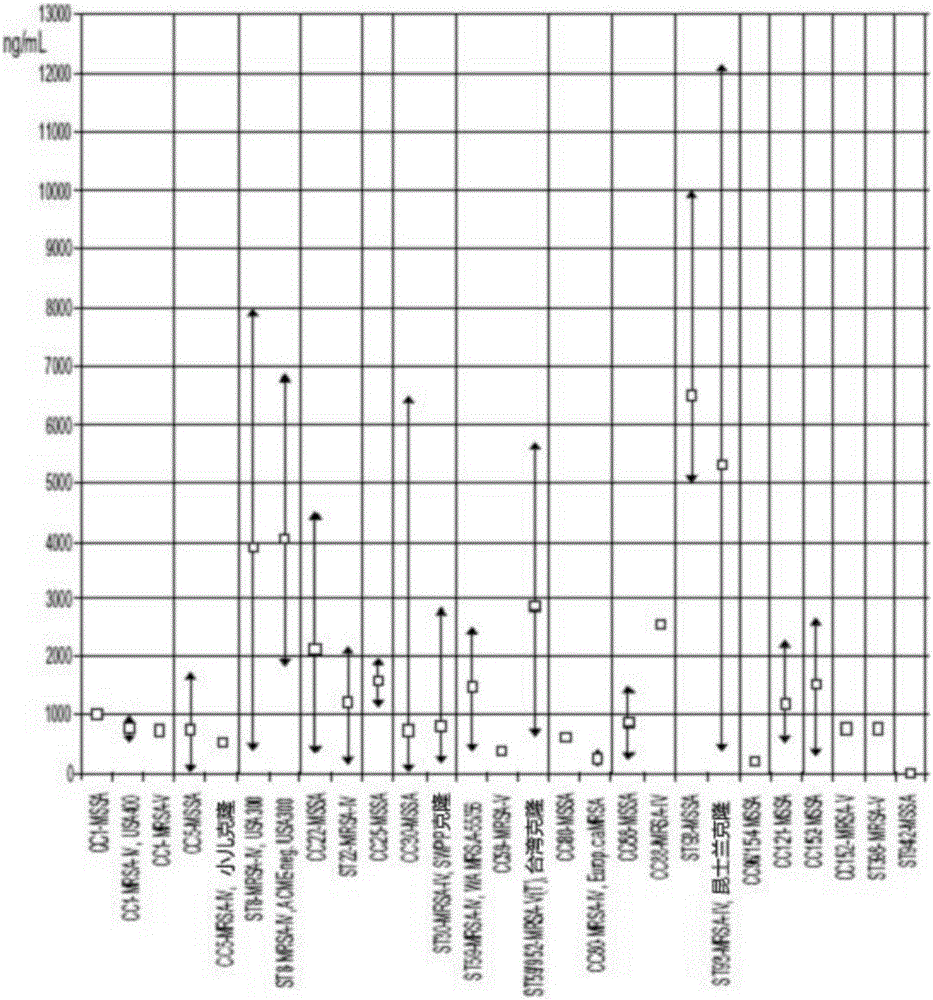
:接下去的背景信息旨在幫助讀者理解本發明,並不局限於當前領域。金黃色葡萄球菌是臨床醫學革蘭氏陽性菌。約20-30%的健康人群的黏膜上攜帶金黃色葡萄球菌。金黃色葡萄球菌可引起多種疾病,包括敗血症,中毒性休克,肺炎,皮膚和軟組織感染,骨和人造植入物的感染。金黃色葡萄球菌也在多種動物中被檢測到。耐甲氧西林金黃色葡萄球菌(MRSA)是含有被稱為PBP2a的另一種青黴素結合蛋白的金黃色葡萄球菌,PBP2a由基因mecA基因和不同的等位基因編碼。正如其名稱所示,MRSA的檢測是通過存在甲氧西林情況下觀察到金黃色葡萄球菌的生長,也可以是其他β-內醯胺類抗生素如青黴素類,頭孢菌素類和碳青黴烯類。由於治理方案有限,MRSA是住院患者發病和死亡的一個重要原因,並對感染控制和公共衛生提出了挑戰。由於需要昂貴的二線藥物和檢疫措施,MRSA花費了醫療服務提供者相當多的成本。世界上估計有5300萬MRSA攜帶者,美國有250萬MRSA攜帶者。殺白細胞毒素(PVL)的毒素是金黃色葡萄球菌的噬菌體源性致病因子。它是金黃色葡萄球菌和MRSA臨床上重要的噬菌體源性的致病因子。PVL是由兩個相鄰的共同表達基因lukS-PV和lukF-PV(lukS-PV,lukF-PV,GenBankBA000033.2:MW1378undMW1379)編碼。lukS-PV的T細胞表位能誘發LST細胞強烈增殖,該lukS-PV的T細胞表位目前具有以下特點:N169YISEVERQNSKSVQWGIKANSFIT193(Brown,etal.,OpenJ.Immunol.,2(3):111-115(2012))。這些分子的聚合物在人類白細胞細胞膜上形成孔,導致細胞死亡和細胞因子的是否。或者,其低濃度可誘導粒細胞的細胞凋亡。PVL與γ-溶血素(lukF/S-hlg)和其他殺白細胞素有關(金黃色葡萄球菌中的lukE/D,lukM/lukF-P83和中間葡萄球菌(S.intermedius)/假中間葡萄球菌(S.pseudintermedius)中的lukF/S-int)。PVL在結構上,按照序列相似性,與其它殺白細胞素有關,如金黃色葡萄球菌中的lukE/D,lukM/lukF-P83和中間葡萄球菌(S.intermedius)/假中間葡萄球菌(S.pseudintermedius)中的lukF/S-int,與hlgA/lukF/S-hlg–γ-溶血素/殺白細胞素位點。如上所述,PVL是人類白細胞素,引物它在白血細胞的細胞膜上形成聚合微孔。白細胞死亡導致細胞因子的釋放並吸引新的白血細胞。PVL基因為噬菌體源性並且是可移動的;它們被發現有非常多樣化的克隆物(例如CC1,5,8,15,22,25,30,45,59,72,80,88,93,96/154,121,188,398)。到目前為止,PVL僅限於從人體分離的金黃色葡萄球菌菌株中。來自反芻動物(如牛,山羊和綿羊)的金黃色葡萄球菌有另一種特異的殺白細胞素,由lukM和lukF-P83(例如,在CC479,151,133,97,30,20中)基因編碼。當皮膚和軟組織感染(SSTI)與慢性/復發性感染有關時,如癤病,尤其是在年輕人和曾健康的成年人中,從那裡分離出的金黃色葡萄球菌中PVL經常能被檢測到。PVL陽性的金黃色葡萄球菌也可引起更嚴重的疾病,例如壞死性肺炎。這種情況偶爾是其他呼吸道感染的併發症如感冒,其致死率可高達40%。與此相反,分離自健康攜帶者的金黃色葡萄球菌,或從那些與其他感染類型如菌血病有關的菌株中,PVL很少被分離到。雖然PVL在20世紀30年代才有描述,但在19世紀後期(28)就已假設PVL為由某些金黃色葡萄球菌菌株產生的一種強效殺白細胞素。在20世紀40年代和60年代,全球爆發PVL陽性,甲氧西林敏感的金黃色葡萄球菌,到20世紀90年代後期已經出現PVL陽性MRSA後天免疫性群體(caMRSA)。很多臨床狀況與PVL有關,包括皮膚和軟組織感染,膿腫,癤病(癤),和乳腺炎。這些狀況的範圍從輕微感染到威脅生命,例如壞死性筋膜炎。與PVL相關的感染往往是慢性或反覆出現的。金黃色葡萄球菌偶爾也引起肺炎,常作為重複感染或流行感冒的併發症。壞死性肺炎,肺炎的最嚴重形式,通常與PVL有關,並且往往是致命的。從健康攜帶者或與植入物有關的感染中分離到的金黃色葡萄球菌中,PVL是極罕見的。而來自如膿腫或癤等感染的菌株中,PVL是普遍的。由於傾向於引起慢性、復發性或特別嚴重感染,要確保對PVL陽性金黃色葡萄球菌菌株的治療不同於「正常」金黃色葡萄球菌,要更加積極。在英國,這是衛生防護局作出的指導方針的官方推薦。迄今為止,PVL檢測主要使用分子方法,該方法基本上局限於具有設備和經驗的參考中心和專業實驗室來進行這種測定。目前檢測PVL和PBP2a的方法包括聚合酶連結反應(PCR)來鑑定PVL和PBP2a的基因。PCR只能在專門的實驗室用專用硬體和訓練有素的人員來執行並且需要樣品的製備。那些具有家庭醫生和初級保健中心的患者不能使用這樣的實驗設施。這些不能確診案例因而可能沒有得到充分治療,對病人造成更大的健康風險,並對醫生和醫院造成潛在的經濟後果。鑑定產生PVL的金黃色葡萄球菌和耐甲氧西林的金黃色葡萄球菌的其他方法,諸如那些在美國2010/0129839中公開的方法,需要預處理生物樣品(即,加熱)以變性PVL,除了要耗費更多時間和工作的免疫性測定如ELISA。因此,最小限度樣品處理的快來速檢測PVL,PVP2a與金黃色葡萄球菌蛋白A(SPA)的方法和裝置,同時確保準確和可靠的結果,這個需求持續存在。一個簡單,快速的檢測可以促進在初級和二級保健機構對PVL相關疾病的診斷,並確定該菌株是否耐甲氧西林。快速檢測節省時間,因為來自參考實驗室的結果往往需要數天或數周。從PVL陰性MRSA菌株中區分PVL陽性的MASA菌株的測試可能最終對患者造成更大的治療益處,有助於在醫院內預防前者的傳播。另外,從PBP2a陰性MRSA菌株中區分PBP2a陽性MRSA菌株的測試可能最終對患者造成更大的治療益處,有助於在醫院內預防前者的傳播。技術實現要素:本發明提供了用於檢測生物分子如生物樣品中的PVL,PBP2a和SPV的快速橫向流測定。該測定包括利用噬菌體展示技術培育針對金黃色葡萄球菌的PVL,PBP2a和SPA的重組抗體。在一些實施例中,生物樣品是培養物,液體培養物,傷口拭子,鼻拭子,或在獸醫學中,傷口或乳房拭子。在實施例中,初代培養物是採自感染的患者,例如可能由多種病原體引起的癤病和膿腫。本發明上述的摘要不意味著限制,從接下去的詳細描述以及權利要求中將會明顯的發現本發明的其他特徵和優點。附圖說明圖1A是一個表格,所述數據來自本發明的毒素抗體測定實施例,顯示了代表菌株體外產生PVL的濃度。圖1B是一個圖,所述數據來自本發明的毒素抗體測定實施例,顯示了代表菌株體外產生PVL的濃度。圖2是一個表格,其所述數據來自本發明毒素抗體測定實施例,來說明產生不同濃度毒素的不同菌株被確認。圖3是一個表格,其所述數據來自本發明毒素抗體測定實施例。描述了一個矩陣用於序列測定,來確定抗體的最優組合。0,無反應;(+)到+++,活性從弱到強。圖4是一個圖形,顯示了本發明的一個實施例(PVL-1401)中抗體的DNA和蛋白質序列信息。圖5是一個圖形,顯示了本發明的一個實施例(PVL-1841)中抗體的DNA和蛋白質序列信息。圖6是一個圖形,顯示了本發明的一個實施例(PVL-1321)中抗體的DNA和蛋白質序列信息。圖7是一個圖形,顯示了本發明實施例中使用Binax卡片格式描述測定程序。圖8A的表格中描述數據來自本發明的毒素抗體測定實施例,說明產生不同濃度的毒素的不同菌株已經被確認。圖8B表格中描述數據來自本發明的毒素抗體測定實施例,說明產生不同濃度的毒素的不同菌株已經被確認。圖9是一個表格,所述數據來自本發明的毒素抗體測定實施例,來說明不同的固體培養基可以被使用。圖10是一個表格,所述數據來自本發明的毒素抗體測定實施例,來說明不同的液體培養基可以被使用。圖11的表格表示數據來自本發明的毒素抗體測定實施例。通過測定588個臨床分離物和12個參考菌株,同時平行的用分子手段(DNA晶片)定性,獲得敏感性,特異性,陽性和陰性預測值。圖12A列出了菌株和克隆物,並從複合物中鑑定PVL陽性的菌株,來開發本發明實施例中的毒素抗體測定。圖12B列出了菌株和克隆物,並從複合物中鑑定PVL陽性的菌株,來開發本發明實施例中的毒素抗體測定。圖13是一個表格,所示數據是來自幾個國家的臨床分離菌株的初試驗。圖14的表格表示通過位點研究獲得的PVL陰性MSSA,PVL陰性MRSA,PVL陽性MSSA和PVL陽性MRSA的概率。詳細描述本發明提供的裝置和方法用於確定樣品中被分析物的存在或存在數量。在一個實施例中,本發明提供檢測細菌生物分子或毒素的設備和方法,例如生物樣品中的金黃色葡萄球菌PVL或PVP2a。在一個實施例中,樣品是來自患者的生物樣品。用PCR產物來構建一個HisTaq-PVL融合質粒,該PCR產物包括來自已測序的參考菌株MW2/USA400中,PVL和lukF-PV兩個組分中的一個組分的完整開放讀碼框。純的lukF-PV融合蛋白被合成,分離和純化。將純化的材料作為抗原用於初次免疫,隨後通過特定的噬菌體展示技術產生抗體。用不同的技術天然和重組PV被用來來表現噬菌體展示技術。類似的方法被用於開發PVP2a和SPA的抗體。噬菌體展示抗體通過ELISA法初步定性,其的不同稀釋物在微量管/帶式蛋白質微晶片中被識別(專利ArrayTubeTM(AT)或ArrayStripTM(AS)的平臺,有Alere技術有限公司開發)。捕獲和檢測抗體的所有可能組合用微晶片檢測,來發現在已知濃度的重組和天然毒素製劑的特定條件下的最特異,最敏感的抗體對。因此,對這些抗體的每一種可能的組合進行了測定,並且對PVL,SPA或PBP2a具有最高的靈敏度和特異性的抗體對進行鑑定。針對重組生物分子產生的噬菌體展示抗體進行活性篩選,部件針對HisTaq融合蛋白,也針對生物分子的原始形式。微晶片分析結果表明,重組抗體能識別原始生物分子。然後這些抗體被用於開發快速橫向流測定,以檢測包括PVL,SPA和PBP2a的生物分子。通過一系列毒素稀釋物,橫向流的檢測極限大約是在1納克/毫升的數量級(見下文)。固定在微晶片上的抗體被用於評估金黃色葡萄球菌臨床分離物的生物分子產物。一般來說,在相同培養條件下克隆物從屬關係和外毒素產量間有一定的相關性。收集的USA300臨床分離物(ST8MRSA-IV,平均產生約4000納克/毫升PVL,F組分),昆士蘭克隆(ST93-MRSA-IV,約5000納克/毫升),ST93-MSSA(ca.6,500納克/毫升)和ST59-MRSA-VT(約3,000納克/毫升)顯然平均產生比其他PVL陽性MRSA或MSSA菌株更多PVL,例如ST80-MRSA-IV(ca.250納克/毫升),和CC5-MSSA(ca.750納克/毫升)。這些實驗證明,任何測試的菌株產生PVL產量的濃度明顯高於所選的抗體組合的檢測極限。在一個實施例中,在檢測設備中使用的抗體是PVL,SPA或PBP2a特異的重組噬菌體展示抗體。在實施例中,在檢測設備中使用的抗體是下列抗體克隆中的一個或多個:PVL-1031,PVL-1061,PVL-1101,PVL-1321,PVL-1401,PVL-1451,PVL-1631,PVL-1711,PVL-1771,PVL-1841,PVL-1881,PBP2a-1631,PBP2a-1721,PBP2a-1941,PBP2a-6G10,PBP2a-17A10,PBP2a-17C8,PBP2a-19B1,PBP2a-8A5,PBP2a-9C6,PBP2a-pc-2.1,PBP2a-pc-2.2,SPA-A135,andSPA-4412.在實施例中,抗體對包括抗體克隆PVL-1841,其可以與金顆粒軛合,包括抗體克隆PVL-1401,它可以被固定化,例如,在硝酸纖維素膜上作為捕獲抗體。在其他實施例中,抗體對包括抗體克隆PVL-1841,其可以與金顆粒軛合,包括抗體克隆PVL-1321和抗體克隆PVL-1401作為捕獲抗體被固定在,例如硝酸纖維素膜上。抗體克隆PVL-1321檢測人的PVL,而抗體克隆PVL-1401檢測人的PVL以及與牛乳腺炎的發病有關的牛變種(lukF-P83)。在一個實施例中,在基礎微生物實驗室的條件下化驗可以被用於檢測金黃色葡萄球菌培養物中的生物分子。在一些實施方案中,使用的基本設備來執行化驗,例如接種環,培養基,培養箱,和在細菌學和生物安全中的基本知識。本發明允許快速檢測PVL,PBP2a和SPA,例如,直接對過夜細菌培養物進行化驗,無需使用專門的設備,例如熱循環儀,不需要生物分子的變型,例如通過加熱,不需要專業分子生物學技術知識,如,核酸擴增。在實施例中,用從患者皮膚和軟組織感染中得到的拭子來執行化驗,拭子樣品可以在固體培養基上進行過夜初培養,金黃色葡萄球菌克隆在初培養中被鑑定並檢測PVL,PBP2a和/或SPA的存在。在混合培養物或具有皮膚植物區系汙染物的情況下,通過標準實驗程序分離金黃色葡萄球菌進行二次培養。無論在初次或者二次培養中的生物分子都用試驗設備檢測,例如橫向流試紙,卡或試劑盒。各種各樣的檢測設備可用於檢測生物樣品中生物分子的存在或不存在。在一個實施例中,測試裝置可以是一種免疫測定裝置,諸如橫向流測試條,其被廣泛用於測試各種分析物。然而,任何適宜的化驗裝置可以在本發明中被使用。在一個實施例中,也可使用摺疊卡片形式化驗裝置,例如霍華德錢德勒的美國專利號5468648(完整的引用在參考文獻中)所述。在另一個實施方案中,可使用帶盒式測定裝置。通過本發明中所述的測試裝置對各種分析物進行檢測或定量。該被分析物可以是傳染性病原體。測試試紙可被用於多種檢測形式,如免疫或化學檢測形式,用於檢測樣品中的目的被分析物。在特異結合化驗中,如免疫測定法,浸漬試劑測試條的使用,是眾所周知的(見,例如,May等的美國專利號5622871,完整的被引用在參考文獻中)。測試條也可配置在非競爭性或競爭性測定形式中。在一些格式中,具有樣品應用區,試劑區,和測試結果區的測試試紙條具有吸水材料。樣品被施加到樣品應用區並通過毛細管作用流入試劑區。在試劑區,樣品溶解並與檢測被分析物(如果存在)必需的試劑混合。現在樣品承載著試劑,繼續流至測試結果區域中。另外一些試劑被固定在測試結果區域中,諸如與被分析物特異結合的分子。這些試劑與被分析物(如果存在的話)或者來自試劑區的第一試劑中的一種反應,結合。用來提供可檢測的信號的標記存在於試劑區域中,或者在一個單獨的標記區域。一般,在非競爭性形式中,如果樣品中含有被分析物則產生信號,如果不存在被分析物則沒有信號產生。在競爭形式中,沒有被分析物存在時產生信號,如果被分析物存在則沒有信號產生。在被分析物通過信號產生系統被檢測的實施例中,例如通過與被分析物特異性反應的一種或多種酶,信號產生系統的一個或多個組件可以與測試條材料上的被分析物檢測區綁定,綁定的方式與上述的特異結合成分與檢測試紙條材料的相同。可替代的或附加的,包括在樣品應用區,試劑區,或測試條的分析物檢測區的信號產生系統的組成部分,或者被包括在整個測試條中的部分,可被浸漬到測試條的一種或多種材料中。可以通過這些組分溶液的表面處理,或通過一個或多個測試條材料浸沒入這些組分溶液來實現。一個或多個表面處理或一個或多個浸沒之後,測試條材料被乾燥。可替代的或附加的,包括在樣品應用區,試劑區,或測試條的被分析物檢測區的信號產生系統的組分,或包含在整個測試條中的組分,可被應用到一個或多個測試條的測試條材料表面,如同標記試劑一樣。使用過程中,一個取樣裝置,例如拭子,可用於收集生物樣品,如來自患者受感染的傷口的樣品。一旦樣品被收集,可以在培養基中培養,或直接施加到測定裝置。生物樣品可以在應用到測定裝置之前,先在固體或液體培養基中培養一段時間,下面的例子中有進一步描述。該樣品被施加到一個測定裝置以確定目的被分析物的存在或存在濃度。在實施例中,測定可用於單獨檢測金黃色葡萄球菌PVL、金黃色葡萄球菌PBP2a、SPA的存在,不存在,或存在濃度,或者用於檢測它們的任意組合,或包括其他相關標記組合例如,中毒性休克症候群毒素(TST1編碼),腸毒素A(entA或sea),腸毒素B(entB或seb),來自S.pseuintermedius,S.intermedius,或Sdelphinii的殺白細胞毒素,α毒素(α-溶血素,HLA)或β-溶血素(HLB)。在其它實施例中,上述的方法和裝置可用於檢測來源於動物樣品的金黃色葡萄球菌或其毒素。例如,在反芻動物的各種物種中,包括,金黃色葡萄球菌克隆物CC151和479佔主導地位,它們是引起牛乳腺炎的常見原因。顯然,大多數牛菌株攜帶殺白細胞素基因lukM/lukF-P83,它可以作為偶然在人菌株間傳播的牛群流行菌株變異的一個標記。如本文中所討論的,本發明提供了抗體,或能特異結合PVL毒素的功能性結合片段。所述抗體或抗體片段不需要預處理就能夠特異性結合生物分子,例如,通過生物分子的變性。在一個實施例中,抗體或它的功能性結合片段,其特異性結合下面的一個或多個基因的表達產物:LUKS-PV,lukF-PV,lukM,lukF-P83,mecA和spa。例如,本發明的抗體可以是對LUKS-PV的T細胞表位具有特異性的抗體:N169YISEVERQNSKSVQWGIKANSFIT193(Brown,etal.,OpenJ.Immunol.,2(3):111-115(2012))。在一個實施例中,本發明的抗體包括克隆PVL-1031,PVL-1061,PVL-1101,PVL-1321,PVL-1401,PVL-1451,PVL-1631,PVL-1711,PVL-1771,PVL-1841,PVL-1881,PBP2a-1631,PBP2a-1721,PBP2a-1941,PBP2a-6G10,PBP2a-17A10,PBP2a-17C8,PBP2a-19B1,PBP2a-8A5,PBP2a-9C6,PBP2a-PC-2.1,PBP2a-PC-2.2,SPA-A135和SPA-4412。然而,本領域技術人員應當理解,相同或基本相同的抗體可通過本領域已知的很多方法產生。特別地,對本文演示的PVL具有親和力的抗體可被鑑定,例如,通過使用公開抗體的競爭化驗法,特別是那些對PVL具有高親和力的公開抗體即,PVL-1321,PVL-1401和PVL-1841。抗體也可以是共享PVL表位結合區域的那些抗體。在這方面,這些領域的技術人員將熟悉那些識別抗體中結合區域的技術,包括但不限於Whitelegg和Rees,Marcatili,和Sivasubramanian所公開的模式技術(ProteinEngineering13(12):819–824(2000);Marcatili,etal.Bioinformatics,24(17):1953–1954(2008);andSivasubramanian,etal..Proteins,74(2):497–514(2009))。特別地,對本文演示的PVL具有親和力的抗體可被鑑定,例如,通過使用公開抗體的競爭化驗法,特別是那些對PVL具有高親和力的公開抗體即,PVL-1321,PVL-1401和PVL-1841。抗體也可以是共享PVL表位結合區域的那些抗體。在這方面,這些領域的技術人員將熟悉那些識別抗體中結合區域的技術,包括但不限於Whitelegg和Rees,Marcatili,和Sivasubramanian所公開的模式技術(ProteinEngineering13(12):819–824(2000);Marcatili,etal.Bioinformatics,24(17):1953–1954(2008);andSivasubramanian,etal..Proteins,74(2):497–514(2009))。如本文所用,術語「抗體」廣義上包括多克隆和單克隆抗體,以及這些抗體的功能性結合片段。在本發明中有用的抗體,或它的功能性結合片段的特徵在於,例如,對PVL毒素的表位具有特異性結合活性。就抗體而言,使用的術語「特異性結合」或「特異性結合活性」是指抗體的互作,或其功能性結合片段,與特定表位的相互作用具有一個解離常數,至少約為1×10-6,一般至少約1×10-7,通常至少約1×10-8,和特別地至少約1×10-9或1×10-10或更小。就此而言,保留了與PVL的表位特異性結合的抗體的Fab,F(AB')2,Fd和Fv片段被包括在抗體的定義內。此外,本文所用的術語「抗體」包括天然存在的抗體以及非天然存在的抗體,包括,例如,單鏈抗體,嵌合抗體,雙功能和人源化抗體,以及它的抗原結合片段。在不同實施例中,PVL,PBP2a和/或SPA的檢測可以組合一種或多種另外的被分析物。例如,本發明採用的方法和裝置可適於檢測一個或多個腸毒素A(entA)的,腸毒素B(entB),毒素休克綜合症毒素(tst1),α毒素,α溶血素(HLA),β溶血素(HLB),和葡萄球菌激酶(SAK)。下列實例被用來進一步說明本發明的實施例,但不意味著限制本發明的範圍。雖然這些實例是使用實例中的典範,也可以選擇使用本領域技術人員已知的其它程序,方法或技術。實施例子毒素抗體分析圖1A和1B顯示了PVL的濃度和許多金黃色葡萄球菌菌株(包括MRSA和MSSA)的克隆物的從屬關係。實施例子1培養參數以前鑑定的產PVL的金黃色葡萄球菌(產量高水平的,低水平的生產菌株和牛的變體)生長在Kato&Noda肉湯培養基中過夜培養產生PVL。培養物上清液用橫向流測定法檢測(試紙片形式)。如圖2所示,與微晶片測定的結果幾乎完全一致。在金黃色葡萄球菌菌株NCTC8235上觀察到微弱的假陽性結果。實施例子2培養參數以前鑑定的產PVL的金黃色葡萄球菌(產量高水平的,低水平的生產菌株和牛的變體)在Kato&Noda肉湯培養基中培養2小時用於檢測,用橫向流PVL試紙檢測PVL的產量。結果與微晶片測定的結果幾乎完全一致。實施例子3培養參數以前鑑定的產PVL的金黃色葡萄球菌(高水平的生產菌株,低水平的生產菌株和牛菌株變體,lukM/lukF-P83)被接種到血瓊脂平板上過夜培養,從過夜瓊脂平板上分離的克隆被直接檢測PVL的產量。結果與微晶片測定的結果幾乎完全一致。實施例子4培養參數以前鑑定的產PVL的金黃色葡萄球菌菌株(PVL陽性ST8-MRSA-IVUSA300和ST22-MRSA-IV)在不同的固體培養基上過夜培養後被直接檢測PVL的產量。從過夜瓊脂平板上分離的克隆被直接用於橫向流PVL測定(試紙形式)。所有的固體培養基都是陽性結果。實施例子5A培養參數以前鑑定的產PVL的金黃色葡萄球菌菌株(很多不同克隆物)用MRSAID顯色瓊脂(BioMerieux)過夜培養後在平板上被直接檢測PVL的產量。從過夜瓊脂平板上分離的克隆被直接用於橫向流PVL測定(試紙形式)。所有克隆物都是陽性結果。實施例子5B培養參數以前鑑定的PVL陰性的金黃色葡萄球菌菌株(很多不同克隆的複合物)用MRSAID顯色瓊脂(BioMerieux)過夜培養後在平板上被直接檢測PVL的產量。從過夜瓊脂平板上分離的克隆被直接用於橫向流PVL測定(試紙形式)。其結果與以不同克隆物為陰性對照的微晶片的結果幾乎完全一致。實施例子6金黃色葡萄球菌菌株ATCC25923(從文化的加藤和野田肉湯上清中純化)產生的一系列PVL毒素稀釋物被用來確定試紙檢測形式的檢測極限。抗原濃度為10微克/毫升。按手冊中所描述的,不同稀釋物(終濃度)被施加並應用到橫向流PVL檢測(試紙片形式)中。作為參考,用蛋白質晶片(ArrayStripTM)的檢出極限被確定為約0.5毫微克/毫升。加入200μl試劑A後的終濃度33.3ng/mL10ng/mL1ng/mL0.1ng/mL0.01ng/mL0.001ng/mL檢測極限被確定為~1納克/毫升。實施例子7來自金黃色葡萄球菌菌株ATCC25923上清液的未純化的PVL毒素用來確定橫向流PVL測定(浸漬片形式)受Kato和Noda培養基的所有組分影響的檢測極限。不同稀釋物(終濃度)如手冊上描述的那樣被施加並應用到橫向流PVL測定(浸漬片形式)上。檢測的檢出限被確定為約1納克/毫升。這些結果與實施例6相結合表明Kato&Noda肉湯培養基的組分似乎不影響測定的檢出極限。實施例子8通過凝固酶陰性的葡萄球菌(CNS)菌株作為陰性對照來確定橫向流PVL測定的特異性。在Columbia血瓊脂上和Kato&Noda肉湯培養基中過夜培養一批CNS菌株。從Columbia血瓊脂以及Kato&Noda上清液直接分離的菌落用橫向流PVL測定(浸漬片形式)進行檢測。生長在Columbia血瓊脂上的所有CNS菌株的PVL檢測結果呈陰性。當CNS菌株在Kato&Noda中生長,那些在人體中經常被發現的CNS菌株的小種,其PVL檢測結果呈陰性。實施例子9此前鑑定的包括高產PVL和低產PVL的金黃色葡萄球菌株,PVL陰性的菌株和產生假陽性結果的菌株(NCTC8325),在Kato&Noda肉湯培養基中生長後,分別劃線接種到Columbia血瓊脂上過夜培養。分離的克隆在葡萄糖肉湯和腦心浸劑肉湯中過夜再培養。每個生長培養基的樣品上清液直接用橫向流PVL檢測(試紙形式)PVL的產量。PVL陰性菌株在兩種培養基中仍然保持PVL陰性。在Kato&Noda肉湯培養基中呈假陽性的菌株在兩種培養基中PVL是陰性。用兩種培養基培養高產和低產PVL的菌株的橫向流PVL檢測是陽性。實施例子10以前鑑定的金黃色葡萄球菌(冷凍庫存珠子),包括高產PVL和低產PVL的菌株,劃線接種到哥倫比亞血瓊脂過夜。分離的克隆在葡萄糖肉湯與增加了人體血液或Fe++的葡萄糖肉湯培養基中過夜再培養。同樣的,分離的菌落在Schaedler液體肉湯培養基與增加了人體血液或Fe++的Schaedler肉湯培養基過夜再培養。每種生長培養基的上清液樣品直接用橫向流PVL檢測(試紙形式)PVL的產量。無論是培養基平板還是添加有Fe++的培養基都無PVL產生。然而,添加了人血到兩種培養基中的任意一種都導致PVL的表達。實施例子11設計一個研究來確定是否鼻腔樣品中的正常細菌群落和分泌物會干擾橫向流PVL的檢測。具體地說,使用Puritan25-3316鼻拭子從具有陽性和陰性的金黃色葡萄球菌的患者上收集鼻樣品。以前鑑定的金黃色葡萄球菌菌株加標後(~105CFU)直接進入鼻腔樣品。用該拭子樣品接種Kato&Noda液體培養基並培養過夜。用橫向流PVL測定(試紙片形式)檢測培養基中的PVL。正常鼻腔菌群並不幹預PVL的檢測。該實驗結果表明,該試驗具有篩選鼻腔樣品的潛力,並且這些樣品可被培養並用來檢測PVL。實施例子12為了評估在常規實驗室條件下使用的潛力,不同的接種時間和生長培養基被檢測。金黃色葡萄球菌用下列液體培養基中的一種在36℃搖床上生長3-12小時:葡萄糖肉湯,腦心浸液,或Kato和Noda培養基。用橫向流PVL測定(試紙片形式)過夜培養物中PVL的產量。測定按照提供的手冊進行。200微升檢測試劑移入含有測定軛合物沉澱的反應管中。渦旋管子直到測定軛合物(紫色沉澱)被懸浮。加入100微升過夜培養物並晃動管子。試紙插入含有檢測試劑和培養物樣品的反應管中。10分鐘後結果可被讀取。觀察到兩個條帶或線(檢測與對照)被視為陽性結果。僅觀察到對照線被認為是陰性結果。可選擇使用固體培養基,金黃色葡萄球菌在下列固體生長培養基的一種上36℃過夜生長:瓊脂,MuellerHinton瓊脂,MRSAIDTM顯色培養基(BioMerieux),Columbia血瓊脂,加血的MuellerHinton瓊脂,C.A.P.瓊脂和「巧克力」瓊脂。生長過夜後挑取分離的克隆並重懸浮在100微升下列緩衝液中的一種:緩衝液A1(來自AlereStaphytype測定),PBS,orTRIS/EDTA。200微升檢測試劑被移入含有軛合物(紫色的沉澱)的反應管。沉澱通過渦旋重懸浮。100微升重懸浮細菌加入反應管,通過渦旋混勻。或者挑取一個接種環的菌落直接溶解在含有200微升檢測試劑的反應管中。試紙片放入含有反應試劑和檢測樣品的反應管中。10分鐘後結果可讀取。觀察到兩個條帶或線(試驗與對照)被視為陽性結果。僅觀察到對照線被認為是陰性結果。PVL濃度大概從1-5納克/毫升開始,大於這個濃度可以被這個測定檢測到。實施例子13在本實例中,從臨床條件下分離的培養物被檢測,該臨床條件中PVL佔合理的比例。分離物來自下面的條件:皮膚膿腫,「蜘蛛咬傷」病變(尤其是慢性/復發),癤病(「疔瘡」),癰,膿腫形成乳腺炎,蜂窩組織炎,以及不尋常的或嚴重的皮膚及軟組織感染,如熱帶性膿皮病或壞死性筋膜炎。分別對金黃色葡萄球菌進行鑑定和藥敏試驗,以及通過分子手段檢測PVL基因並分配到克隆物和菌株。231個金黃色葡萄球菌分離物被檢測的,其來自美國、歐洲、澳大利亞、非洲和中東。屬於26個不同金黃色葡萄球菌菌種的123個分離物為PVL陽性。屬於33個金黃色葡萄球菌菌種的108個分離物是PVL陰性。橫向流PVL測定(試紙片形式)產生的結果如下列表1所示(包括重複試驗)。表1:橫向流PVL測定(試紙片形式)結果陽性結果124陰性結果108假陽性結果2假陰性結果0靈敏性100%特異性98.18%陽性預測值98.41%陰性預測值100%橫向流PVL測定(卡片形式)產生的結果如下列表2所示(包括重複試驗)。表2:橫向流PVL測定(卡片形式)結果陽性結果23陰性結果48假陽性結果6假陰性結果0靈敏性100%特異性88.89%陽性預測值79.31%陰性預測值100%實施例子14一項涉及快速檢測金黃色葡萄球菌培養物中的PVL的研究被執行,該研究使用單克隆抗體的橫向流測定。研究的目的是為了評估檢測PVL的橫向流測定。如這裡所述,PVL是金黃色葡萄球菌噬菌體源的致病因子。它包含2個部件(S和F組分),由2個雖然共定位共表達但獨立的基因編碼。這些分子的聚合物在人類白血球膜上形成孔導致細胞死亡。PVL與慢性/復發性皮膚和軟組織感染(SSTI)有關,尤其是在年輕人和以前健康的成年人中,和壞死性肺炎。由於其臨床相關性,攜帶PVL基因的金黃色葡萄球菌的檢測授權積極治療和感染控制措施(見全球資訊網hpa.org.uk/webc/HPAwebFile/HPAweb_C/1218699411960)。然而,因為PVL檢測是用分子的方法進行,目前該檢測基本上限制於參照中心和專業實驗室。為了促進快速,非分子的檢測在臨床實驗室中的應用,單克隆抗體被培育,橫向流測定被開發。通過噬菌體展示法過表達的PVL,F組分被用於產生單克隆抗體。接下去免疫小鼠,分離B細胞的mRNA並擴增。得到對抗體的抗原結合部分特異的cDNA,連接入噬菌體,然後轉化到大腸桿菌中。得到純化的抗體,通過ELISA初步定性,不同稀釋物在microtiterstrip-mounted蛋白質晶片上顯跡。這樣可以快速地確定捕捉和檢測抗體的最佳組合。這些抗體被用來設計橫向流測定如,免疫層析測定,在該測定中金標檢測抗體與樣品材料(金黃色葡萄球菌培養物)混合,通過毛細作用向固定了檢測抗體的區域流動。在陽性情況下,可觀察到一個明顯的線形成。製作兩種不同的測定形式(試紙和Binax卡)平行處理來優化操作過程和和條款。這個試驗被用於來自皮膚和軟組織感染的金黃色葡萄球菌分離物,平行的,分離物通過晶片雜交測定基因型,來確定菌株和克隆物的從屬關係以及它們的PVL狀態圖7描述了Binax卡片形式的檢測過程。對於試紙片形式,用接種環挑取培養物並攪拌放入含有標記抗體緩衝液的管子中。然後,試紙片放入管子中,10分鐘後結果可讀取。為了選擇捕捉和標記抗體的最優組合,每一種抗體的4種不同濃度在蛋白晶片上顯跡。這些晶片用重組PVLF組分,原始PVL(2種不同濃度,來自菌株ATCC25923)或來自獸醫CC705分離物的「牛殺白細胞素」lukM/lukF-P83以及所有抗體的所有生物素標記的製備物來檢測。根據這些結果,抗體5和抗體10的組合物被選定來建立檢測PVL(F組分)以及lukF-P83基因產物的橫向流測定。在最初的一系列的實驗中,檢測在不同的生長培養基中培養的已知菌株。如Kato&Noda或Schaedler描述的,在肉湯中,在腦心浸液中以及從普通瓊脂挑取的克隆材料中,具有或不具有血液的MuellerHinton瓊脂中,MRSAID瓊脂(BioMerieux),Columbia血,C.A.P.和「巧克力」瓊脂中被注意到有可檢測的PVL產量。在葡萄糖肉湯上偶爾觀察到假陰性結果,以及來自Kato&Noda肉湯或血瓊脂的克隆物CC8菌株的假陽性結果。這些橫向流測定用於篩選來自SSTI診斷標本中的共計450個臨床分離物。這些菌株源於澳大利亞,千里達及托巴哥,美國,英國,德國,瑞典,西班牙,挪威,日本,烏幹達和沙烏地阿拉伯。258株被證明是陽性。它們所屬的分離物屬於20個克隆物的37個不同的菌株。已檢測了192PVL陰性分離物屬於29克隆物的47個不同的菌株。PVL陽性分離物的比例在被檢測的全部SSTI分離物中佔10.5%(瑞典樣本)到81.4%(澳大利亞樣本)。該檢測允許PVL快速檢測在不能夠進行分子檢測的常規細菌學實驗室條件下進行。因為它利用標準培養基的過夜純培養(包括顯色瓊脂篩選MRSA),可以很容易地與這樣的實驗室的工作流程相結合。因此,預計將有助於及時幹預治療PVL相關感染病例,以及幫助選取一些分離物遞交參考中心進一步分型。實施例子15用篩選測定對使用PBP2a結合抗體的PBP2a檢測進行評估,PBP2a結合抗體通過這裡所討論的噬菌體展示技術產生。一系列來自金黃色葡萄球菌USA300的稀釋過的PBP2a被用於檢測評估。很多克隆物(數據未顯示)具有陽性結果。實施例子16此前鑑定的金黃色葡萄球菌(很多不同的克隆物)用本發明的抗體檢測PBP2a和SPA產量。很多克隆物(數據未顯示)具有陽性結果。實施例子17此前鑑定的金黃色葡萄球菌(很多不同的克隆物)用本發明的抗體檢測PVL,PBP2a和SPA產量。很多克隆物(數據未顯示)具有陽性結果。實施例子18這個實例描述了橫向流檢測法的發展,使用這裡所述的單克隆抗體在常規臨床微生物實驗室建立快速,非分子的PVL檢測。該測定對生長在各種不同培養基的分離物進行了驗證,然後利用從SSTI重新獲得的國際金黃色葡萄球菌對檢測進行評估。為了開發快速的表型測定,通過噬菌體展示法,重組PVL的F組分被用於產生單克隆抗體。在蛋白晶片上顯跡,用不同的lukF製備物和測定抗體篩選這些抗體。這樣就鑑定出了用於建立橫向流測定的最優抗體組合。這個試驗被用來檢測金黃色葡萄球菌培養物中的PVL。對純化的天然和重組抗原的檢測極限被確定為約1納克/毫升。各種固體和液體培養基的過夜培養物都適用於PVL檢測。600個被測定的菌株和臨床分離物來自美國、歐洲、澳大利亞,非洲和中東的患者。平行的分離物通過DNA晶片雜交確定基因型來證實PVL類型並被轉移到克隆表達中。這個試驗中測定的靈敏性,特異性,陽性和陰性預測值分別是99.7%,98.3%,98.4%和99.7%。302個臨床分離物和參考菌株是PVL陽性並被歸屬到21個不同的克隆物。總的來說,橫向流檢測允許在常規細菌學實驗室進行快速的經濟的PVL檢測。因為檢測利用標準培養基的培養物,不需要高級設備,可以簡單的整合到實驗室的工作流程中,有助於及時治療PVL相關感染病例。下面為所用的材料和方法重組PVL,F組分PVLF組分基因(lukF-PV)用在5』和3』端包含一個EcoR1酶切位點和Not1酶切位點的設計引物(lukF-PV_fw_5Eco,CCTGAATTCATGAAAAAAATAGTCAAATC(SEQIDNO:13)和lukF-PV_rev_5Not,ATAGCGGCCGCTTAGCTCATAGGATTTT(SEQIDNO:14))進行擴增。來自全測序ST1-MRSA-IV參考菌株MW2的DNA作為模板。PCR產物被克隆到一個市售載體(TOPOII,Invitrogen,Karlsruhe,德國)上並測序。得到的序列與GenBank登記的相應序列比較(BA000033.2;1529381:153035)。確認的克隆用EcoR1/Not1酶切,包含開放性讀碼框的DNA片段被插入pet28a表達載體(Novagen,Darmstadt,德國)連接後,表達載體轉化入大腸桿菌BL21.用50毫升異丙基-β-D-硫代半乳糖苷(IPTG,1毫摩爾)誘導後,在50毫升LB培養基中(LB培養基,添加了卡那黴素)獲得表達重組蛋白。離心收集大腸桿菌細胞並冰凍過夜。表達重組蛋白在鎳-次氮基三乙酸-瓊脂糖(Ni-NTA-瓊脂糖)柱(Qiagen,Hamburg,德國)上按照生產商家的說明書純化。每個步驟取出部分試樣通過十二烷基硫酸鈉-聚丙烯醯胺凝膠電泳分析重組蛋白的存在。每一個樣品中的蛋白質濃度用二辛可寧酸(BCA)蛋白質測定試劑盒(Pierce公司,波恩,德國)測定。噬菌體展示過程和抗體的初測定通過噬菌體展示法過表達的PVLF組分被用於產生單克隆抗體。接下去免疫小鼠,分離擴增B-細胞的mRNA。獲得對抗體的抗議結合部分特異的cDNA,被連入噬菌體,並轉化到大腸桿菌。獲得的抗體被純化,通過ELISA初鑑定,不同的稀釋物在microtiterstrip-mounted蛋白晶片顯跡。根據此前描述的手冊使用抗體晶片。為了選擇捕捉和標記抗體的最優組合,每一個選定的11種抗體中的5個不同濃度被點樣到蛋白晶片上。為了測定所有可能的組合,這些晶片用重組PVLF組分,天然的PVL(2種不同濃度,來自CC30-MSSA菌株ATCC25923)或「牛殺白細胞素」lukM/lukF-P83(來自獸用CC151/705分離物)作為抗原,以及用生物素標記的所有11種抗體的製備物作為檢測抗體來測定。然後通過鏈黴親和素-辣根過氧化物酶軛合物和通過過氧化物酶引發的染料沉澱來進行染色。這個途徑能確定捕捉檢測抗體的最優組合(見圖3).橫向流測定PVL的原理檢測金黃色葡萄球菌初代培養中PVL的橫向流測定是免疫層析膜測定,該測定用上述晶片選定的2個高靈敏性的噬菌體展示重組單克隆抗體。針對PVL的2個選定抗體被用於設計橫向流測定,其中一個抗體在檢測試紙上作為抗原俘虜,而第二種抗體在反應管內被金標記並包被。測定試紙由固定在膜支撐物上的PVL捕獲抗體和對照蛋白組成,加樣品和吸收劑後形成兩條明顯的線。T執行檢測時,金黃色葡萄球菌分離物或培養物上清液被加到包被的反應管中,反應管含有與已添加的萃取劑共軛的金標。然後PVL檢測試紙條被放入反應管支持液體樣品和軛合物。10分鐘後根據粉色到紫色樣品線的存在或不存在對檢測的結果進行解釋。兩條帶(PVL線和對照線)說明是有效的陽性結果,而一條線(對照線)說明有效的陰性結果。沒有明顯的對照線說明這是無效的檢測。執行測定對來自SSTI(見下文)的金黃色葡萄球菌的分離物進行檢測,該菌通過晶片雜交檢測基因型來確定菌株和克隆物的從屬關係和PVL狀態。280微升萃取劑被特異的加入含有凍幹抗體-金軛合物的包被反應管。挑取一個接種環的金黃色葡萄球菌克隆材料,放入管子,用接種環徹底混合直到細胞和軛合物沉澱全部溶解。使用液體培養基時,200微升緩衝液和100微升過夜液體培養物被加入反應管並混合。然後檢測試紙被插入反應管,在室溫下培養10分鐘後,檢測試紙離開管子並進行讀取。菌株和分離物檢測共計600個金黃色葡萄球菌菌株和分離物的lukF-PV產量,同時包括甲氧西林敏感(MSSA)和抗加氧西林(MRSA)的金黃色葡萄球菌。PVL陰性參考菌株是SangerMSSA476(測過序的ST1-MSSA-SCC/us,GenBank檢索號BX571857.1),Mu50andN315(同時測過序的ST5-MRSA-II,GenBankBA000017.4andBA000018.3),NCTC8325(測過序的ST8-MSSA,GenBankCP000253.1),COL(測過序的CC8/ST250-MRSA-I,GenBankCP000046.1)以及澳大利亞(WA)MRSA-8(ST75-MRSA-IV03-17848;(23))和WA-MRSA-59(具有非典型SCCmec元件的CC12-MRSA)PVL陽性參考菌株是MW2-USA400(測過序的ST1-MRSA-IV,GenBankBA000033.2),USA300-FPR3757(測過序的ST8-MRSA-IV,GenBankCP000255.1),ATCC25923(以質量控制為目的廣泛用於診斷生物學的著名分離物ST30-MSSA),昆士蘭caMRSA(ST93-MRSA-IV03-16790)和WA-MRSA-60/孟加拉海灣caMRSA(ST772-MRSA-V)。另外,包括從具有SSTI的患者上收集到的588個臨床分離物。源自澳大利亞的臨床分離物(作為全國性的澳大利亞集團金黃色葡萄球菌的耐藥性監測項目SAP2008andSAP2010的部分)可在全球資訊網www.agargroup.org/files/FED%20REP0RT%20SAP2008%20MRSA%20final.pdf和www.agargroup.org/files/FED%20REP0RT%20SAP210%20MRSA%20FINAL%20shrink.pdf上獲得。更多的臨床分離物來自德國的診斷實驗室(Dresden大學醫院),沙烏地阿拉伯(法赫德國王醫學城,利雅得),西班牙(HospitalUniversitariGermans,TriasiPujol,巴達洛納),瑞典(Oerebro大學附屬醫院),千里達及托巴哥共和國(從全國各地區醫院),烏幹達(在恩德培的醫學研究理事會)和英國(包括在布里斯托西南部的一個醫院,和國家葡萄球菌參考單位,HPA,倫敦)。所有來自英格蘭的分離物和來自其他國家(8個來自沙烏地阿拉伯,7個來自德國,3個來自澳大利亞)分離物的PVL狀態是已知的。這些菌株被包括是為了最大限度地代表廣泛的克隆物範圍,在對來源於不同的國家的PVL進行概率分析時,這些菌株被排除在外。另外,檢測17個分離物的LukF-P83;包括屬於家畜相關菌系CC133,CC151/705和CC479的獸醫來源(牛和羊)的P83陽性分離物。這些分離物來自以前的研究或參考弗裡德裡希洛弗勒研究所,德國耶拿。作為對照,3個lukM/lukF-P83陰性分離物被包括:2個CC133分離物,一個來自疣鼻天鵝,一個是來自Dresden大學醫院的人類分離物和來自牛的CC479分離物。沒有lukF-P83陰性CC151/705分離物可用於檢測。用不同培養基驗證橫向流測定液體培養基包括葡萄糖肉湯(OXOID,目錄為Nr.CM67加葡萄糖),腦心浸液(OXOID,CM225),2XTY(胰蛋白腖/酵母提取物),Schaedler肉湯+維生素K3(梅裡埃,42106)和Kato和Noda所描述的肉湯T接下去所用的固體培養基為:普通瓊脂(OXOID,CM3),加血與不加血的MuellerHinton瓊脂(OXOID,CM337),哥倫比亞血瓊脂(瓊脂主要成分OXOID,CM331和羊血OXOID,FSR1055),CAP瓊脂,「巧克力」瓊脂(瓊脂基礎OXOID,CM331和羊血OXOIDFSR1055加血晶素,賽瓦,24410,和NAD,默克,1.024542)和市售葡萄球菌MRSA顯色培養基(MRSAID瓊脂,bioMerieux,43459)。晶片程序為了確認PVL狀態並分配給相應的克隆物和菌株,所用分離物用DNA晶片雜交定性。根據生產商家的說明執行程序;引物、標記和進一步的細節同上所述。酶裂解後簡單的製備DNA。多重引物延伸來擴增和標記(通過混合生物素-16-dUTP)大概對應170個基因的共計333條靶序列。單鏈擴增產物與具有相應探針的晶片進行雜交。添加了能結合生物素標記的鏈黴親和辣根過氧化物酶結合物,並用過氧化物酶-引發染料沉澱,使雜交可視化。對由此產生的晶片上的斑點圖案進行掃描,分析,與此前模式菌株的參考數據相比較。在補充文件中提供了所有菌株和分離株的全雜交圖。獲得下列試驗結果抗體篩選根據圖3顯示的篩選結果,抗體1401(這裡也指PVL-1401)和抗體1841(這裡也指PVL-1841)的組合被選定來建立能檢測PVL(F組分)以及lukF-P83基因產物的橫向流測定。通過一些了稀釋,確定橫向流測定對純化的天然和重組抗原的檢測極限約為1納克/毫升。對不同生長培養基的橫向流檢測試驗在最初的一系列實驗中,檢測在不同生長培養基上培養的已知菌株。培養PVL陰性Mu50(ST5-MRSA-II),NCTC8523(ST8-MSSA),ST398-MRSA-V和ST8-MSSA的已知菌株以及PVL陽性的USA300-FPR3757(ST8-MRSA-IV,USA300),CC30-MSSA和ST93-MRSA-IV(昆士蘭克隆)分離物的液體生長培養基中(葡萄糖肉湯,腦心浸液,2XTY,Schaedler,Kato&Noda)被檢測。PVL陰性ST8-MSSA菌株NCTC8325在Kato&Noda所描述的生長培養基中具有微弱但一致的假陽性結果。用ST8-MSSA相同表型的臨床分離菌株沒有觀察到相同情況。所有其他的結果是正確的。從產生正確陽性結果的普通瓊脂,無血和有血MuellerHinton瓊脂,哥倫比亞血,C.A.P和「巧克力」瓊脂上挑取克隆材料(USA300-FPR3757和PVL陽性的ST22-MRSA-IV)。然後從哥倫比亞血瓊脂的過夜培養菌落篩選臨床分離株(見下文)。除了前述的生長培養基,對市售的用於檢測MRSA的發光培養基進行了測試(MRSAID瓊脂來自梅裡埃公司)。對以下的PVL陽性菌株進行了測試,並取得了正確的結果:CC1-MRSA-IV(MW2,USA400),CC5-MRSA-IV,ST8-MRSA-IV(USA300-FPR3757),ST22-MRSA-IV,ST30-MRSA-四(西南太平洋克隆),ST59/ST952-MRSA-V(T)(臺灣克隆),CC80-MRSA-IV(歐洲caMRSA克隆),CC88-MRSA-IV和CC152-MRSA-V。PVL陰性菌株CC1-MRSA-IV&SCC/us(WA-MRSA-1/45),ST22-MRSA-IV(UK-EMRSA-15/Barnim),ST45-MRSA-IV(柏林EMRSA),ST75-MRSA-IV(WA-MRSA-8),ST239-MRSA-III(維也納/匈牙利/巴西流行株),以及在MRSAID瓊脂上產生準確(陰性)結果的CC80-MRSA-IV的一個PVL陰性變體。LukF-P83的檢測14個lukF-P83陽性分離物(2個CC133,4個CC479和8個CC151)在橫向流測定中產生陽性結果。3個lukF-P83陰性分離物(2個CC133和1個CC479)被正確的鑑定為陰性。用橫向流測定和晶片篩選臨床分離物與晶片的基因分型數據比較時,301個實驗是真陽性,293個是真陰性;有5個假陽性,和1個假陰性。這相當於靈敏性99.7%,特異性98.3%,PPV98.4%和NPV99.7%。隨後對這六個錯誤結果的實驗進行重複並取得正確的結果,這說明在初級測定時操作錯誤。總的來說,297個檢定分離物和5個參考菌株是PVL陽性。通過晶片雜交,它們被分配到21個克隆物中,CC1(包括ST772),CC5,CC8(包括ST72),CC15,CC22,CC25,CC30,CC45,CC49,CC59,CC80,CC88,CC93,CC96,CC121,CC152,CC188,CC398和3個未鑑定的菌系(圖13)。它們中的一個產生1-141-1-1-128-3的MLST屬性(與STs1279/1496/1982有關).最常分離到的PVL陽性菌系是CC12(來自不同區域的50個分離物,都是MSSA),CC8(46個分離物包括來自特立尼達島和多巴哥島的MSSA,以及來自各區域的「US300」)和CC93(42個分離物,MSSA和ST93-MRSA-IV,昆士蘭caMRSA克隆,幾乎全部來自澳大利亞)。287個PVL陰性檢測分離物和7個參考菌株屬於31個不同克隆物:CC1,CC5,CC6,CC7,CC8(包括ST72和ST239),CC9(ST834),CC12,CC15,CC20,CC22,CC25,CC30(包括ST34),CC45,CC50,CC59,CC75,CC80,CC88,CC96,CC97,CC101,CC121,CC140,CC188,CC398,CC425,CC509,CC707和CC1021.一個CC不能分派2個分離物。陽性金黃色葡萄球菌在不同國家的流行在所有SSTI的分離物中流行的PVL陽性分離物在不同國家之間存在廣泛的變化。在澳大利亞的樣本中觀察到的PVL陽性率最高,有82.2%(90中的72)為PVL陽性。PVL陽性菌株的一半(74個中的37個)是CC93,並且其中大部分是MRSA(37個CC93分離物的29個,78%),這反映了目前所謂的昆士蘭caMRSA克隆所造成的負擔。第2位和第3位常在澳大利亞被分離到的PVL陽性克隆是CC121-MSSA(N=15)和CC93-MSSA(N=8)。僅有兩個ST8-MRSA-IV(USA300)菌株被鑑定。PVL陰性金黃色葡萄球菌菌株分別來自多個CC菌系,包括CC1,CC5,CC8,CC8/ST72,CC15,CC22,CC30,CC45,CC88和CC188,包括兩個MRSA克隆;ST22-MRSA-IV(UK-EMRSA-15/BarnimEMRSA)和ST5-MRSA-IV(小兒克隆/WA-MRSA-65)。來自德國的SSTI分離物中,有PVL概率是40%(50個中20個)。最常見的菌株是CC121-MSSA(n=7)和CC30-MSSA(n=4)。每一個ST8-MRSA-IV(USA300)和ST93-MRSA-IV(昆士蘭caMRSA克隆)分離物都被鑑定,後者與傳播到澳大利亞有關。在PVL陰性之中,CC30和CC8是最常被分離到的;其他CC包括CC5,CC7,CC8/ST72,CC15,CC22,CC45,CC101和CC398。屬於CC7-MRSA-IV,CC22-MRSA-IV(UK-EMRSA-15/BarnimEMRSA),ST5/ST225-MRSA-II(UK-EMRSA-3/Rhine-HesseEMRSA)和CC45-MRSA-IV(柏林EMRSA)的PVL陰性的MRSA單菌落被鑑定。對於來自沙烏地阿拉伯的分離物,47.3%被證實是PVL陽性。大約一半是MRSA(n=13),該MRSA具有屬於CC80-MRSA-IV(歐洲caMRSA克隆)的最常見的PVL陽性單克隆。最常見的分離物PVL-MSSA克隆是CC30-MSSA(n=4)和還未被鑑定的MSSA(n=3)。PVL陰性菌株屬於CC1,CC5,CC6,CC7,CC8,CC9/ST834,CC15,CC22,CC25,CC30,CC45,CC75(與ST1667有關),CC80,CC96,CC97,CC398(ST291/813),和一個未鑑定菌系。MRSA的比例高(29個PVL陰性中8個是MRSA);最常見的菌株是ST239-MRSA-III(維也納/匈牙利/巴西克隆,n=4)。其他MRSA屬於CC22-MRSA-IV的tstl-陽性變種,CC80-MRSA-IV的PVL陰性變種,僅知道來自馬爾他(27)的CC5-MRSA-IV&SCC/us菌株和CC9/ST834-MRSA-VI。第二高的PVL概率被發現在西班牙,具有75%(44個中33個)的PVL基因和分泌LukF-PV蛋白陽性。這裡最常見的克隆是ST8-MRSA-IV(USA300)的ACME陰性變種,有10個分離物被分配給該變種。接著是CC30-MSSA(n=6)和CC22-MSSA(n=5)。PVL陰性屬於各種各樣的CC(CC5,CC8/ST72,CC15,CC30,CC45,CC121,CC188和CC707),不包括任何MRSA。最低的PVL流行率在瑞典分離物中被發現,僅16.7%(114個中19個)是PVL陽性,都是MSSA。最常見的PVL陽性菌株是CC30-MSSA(n=4)和CC121-MSSA(n=3)。PVL陰性分離物是CC1,CC5,CC7,CC8,CC12,CC15,CC20,CC22,CC30,CC45,CC50,CC88,CC97,CC101,CC121,CC188,CC509andCC1021。CC45(n=19)和CC15(n=18)是最常見的CC分離物。MRSA沒有被發現。在特立尼達島和多巴哥島共和國,PVL流行率是50%(80個中40個分離物)。最豐富的PVL陽性菌株是CC8-MSSA(n=18),該菌株另外攜帶腸毒素基因sed,sej,ser,sek和seq。兩個CC8-MRSA-IV分離物被鑑定為具有相同的毒素屬性,但缺乏ACME,因此與WA-MRSA-62類似。ST8-MRSA-IV(USA300),即攜帶ACME位點和腸毒素基因sek和seq,在三種情況下被鑑定。其他分離到的常見的PVL陽性菌株是CC30-MSSA(n=10)和CC5-MSSA(n=5)。PVL陰性分離物包括CC1,CC6,CC7,CC8,CC8/ST72,CC8/ST239,CC12,CC15,CC45,CC59,CC101,CC121,CC188和與CC75(ST1223,ST1667)有關的不尋常菌株。PVL陰性MRSA菌株是CC59-MRSA-V&SCC/us和ST239-MRSA-III(維也納/匈牙利/巴西克隆)。與來自其他國家的收集菌株相對應的,英國的分離物的PVL狀態是已知的,因此其PVL率不能與其他國家的進行比較。很多不同的PVL-MRSA菌株在倫敦的分離物中被鑑定出,CC30-MRSA-IV(西南太平洋caMRSA克隆),CC5-MRSA-IV(小兒克隆),CC5-MRSA-V,CC80-MRSA-IV(歐洲caMRSA克隆),ST59/ST952-MRSA-V(T)(臺灣caMRSA克隆),ST772-MRSA-V(孟加拉海灣caMRSA克隆/WA-MRSA-60),ST8-MRSA-IV(USA300)和ST93-MRSA-IV(昆士蘭caMRSA克隆).PVL陰性分離物屬於CC1,CC8,CC8/ST239,CC12,CC22,CC25,CC30,CC45,CC59,CC121,CC425包括MRSA菌株CC1-MRSA-IV(WA-MRSA-1/57),ST239-MRSA-III(維也納/匈牙利/巴西克隆),CC22-MRSA-IV(UK-EMRSA-15/BarnimEMRSA)和ST59-MRSA-V。進一步包括來自英國西南部第二中心的已知為PVL陽性的28個分離物。這些分離物被排除在PVL概率分析之外,但他們的種群結構是值得注意的。這個組僅包括2個PVL陽性MRSA,ST772-MRSA-V(孟加拉海灣caMRSA克隆/WA-MRSA-60)andCC1-MRSA-IV(USA400)。也包括一個CC59-MSSA可能是ST59/ST952-MRSA-V(T)(臺灣caMRSA克隆)的SCCmec檢測突變體,根據抗性基因和毒性標記(erm(B),apha3,sat,tet(K),cat,fexA,seb/k/q,lukF/S-PV)的雜交屬性。這個組中最常見的菌株是PVL陽性CC22-MSSA(n=10)。另外5個具有SPA類型t417或t1601的PVL陽性CC22分離物攜帶「SCCfus」組件(ccrA/B-1,andQ6GD50,orfusC)。這些分離物來自平均年齡接近94歲的患者。這在PVL陽性中是不尋常的發現,這說明這個克隆物與這個區域護理設備間的可能聯繫。PVL是金黃色葡萄球菌獨特的毒力標誌,與臨床症狀的關聯非常普遍,這些症狀往往要麼慢性/反覆發作,或偶爾進展迅速而危及生命。因此PVL的診斷檢測能滿足目標患者的管理的需要。這裡所述的橫向流測定允許在不能輕易進行分子測定的常規細菌學實驗室中進行PVL快速檢測。當利用標準培養基的過夜培養物時,例如Columbia血瓊脂,這樣就能輕易的整合入常規診斷實驗室的工作流程中。因此測定可能有助於及時幹預PVL相關感染病例,也能幫助選擇一些需要遞交參考中心進一步分型的菌株。金黃色葡萄球菌體外分泌的PVL有廣泛的變化,然而基因型和表型間的高度一致說明lukS/F-PV陽性菌株在標準培養基條件下通常能表達可檢測數量的PVL。在這個研究中沒有鑑定到含有PVL基因卻不產生體外毒素的分離物。由於缺少體外表達造成假陰性的可能性是很低的。這個研究中所包括的PVL和lukM/lukF-P83陽性菌株的多樣性說明,可能的PVL序列特異變體菌系不會對PVL檢測造成障礙,PVL檢測使用這裡所述的抗體。這裡描述的菌株收集物進一步提供了與SSTI相關的金黃色葡萄球菌的分子流行病學的快照。在PVL陽性甲氧西林敏感的金黃色葡萄球菌中,CC121(總計50個分離物)和CC30(35個分離物)佔主導地位。在千里達及托巴哥共和國中PVL陽性CC8-MSSA是非常豐富的,雖然這個菌株在其他地方罕見。這印證了USA300菌株在加勒比海/拉丁美洲地區出現的假說。這個研究還顯示了MRSA在世界的不同部分造成了嚴重的問題。MRSA(在這個研究中)流行率低或沒的國家是瑞典和烏幹達,瑞典在MRSA感染控制是具有非常嚴格的政策,烏幹達在醫療保健和獸醫中使用抗生素對金黃色葡萄球菌的選擇壓力比其他國家有更多的限制。在別的地方,由PVL陽性/ACME陽性ST8-MRSA-IV(USA300),PVL陽性/ACME陰性ST8-MRSA-IV,PVL陽性ST80-MRSA-IV(歐洲caMRSA克隆)和ST93-MRSA-IV(昆士蘭caMRSA克隆)和PVL陰性ST239-MRSA-III主導的MRSA經常被分離到。橫向流測定與MRSA顯色篩選培養基相結合的可能性促進了新興的PVL陽性caMRSA菌株的快速篩選。這有助於捕獲它們的傳播和進一步的擴散。在澳大利亞和西班牙分離物中PVL陽性的高百分率以及ST93-MRSA-IV(昆士蘭caMRSA克隆)和ST8-MRSA-IV在這兩個國家的主導優勢說明,PVL陽性caMRSA的擴展沒有發生,是以建立PVL陽性MSSA種群為代價的,但除它之外。除了限制β-內醯胺的功效作為主要的治療選擇,PVL陽性caMRSA的出現可能因此導致PVL疾病相關的負擔增加。雖然在當前研究中分離物的數量不足以明白的證明這樣的趨勢,還需進行關於PVL陽性金黃色葡萄球菌的分子流行學的進一步研究。這裡所述的發明可以在缺少未具體公開的任何要素或多個要素,一個或多個限制的情況下實施。所採用的術語或表達被用作描述術語而不是限制,並且,這裡也沒有任何意圖在使用本發明的術語和解釋的時候,並沒有排除那些與本發明描述的特徵等同的例子,但是,可以認識到,很多機遇本發明權利要求範圍內的改動也是可能的。以你,可以理解,儘管本發明機遇很多的實施例子進行了揭示和描述,基於發明描述的精髓進行改進或改變是本領域一般技術人員可以進行的,這樣的改變和活便也被認為是屬於本發明哪些從屬權利要求所限定的範圍。本發明說明書中提到的所有專利和出版物都表示這些是本領域的公開技術,本發明可以使用。這裡所引用的所有專利和出版物都被同樣列在參考文獻中,跟每一個出版物具體的單獨被參考引用一樣。這裡採用的術語和表達方式所為描述方式,而不受其限制,這裡也沒有任何意圖來指明此書描述的這些術語和解釋排除了任何等同的特徵,但是可以知道,可以在本發明和權利要求的範圍內做任何合適的改變或修改。可以理解,本發明所描述的實施例子都是一些優選的實施例子和特點,任何本領域的一般技術人員都可以根據本發明描述的精髓下做一些更改和變化,這些更改和變化也被認為屬於本發明的範圍和獨立權利要求以及附屬權利要求所限制的範圍內。SEQUENCELISTING美艾利爾聖地牙哥公司檢測殺細胞的毒素(PVL)的裝置和方法US61/714,6492012-10-16US61/617,9742012-03-30US61/561,7672011-11-18US61/558,8482011-11-1114PatentInversion3.51660DNAArtificialSequenceSyntheticconstruct1gacgttgtgatgtcacagtctccatcctccctgactgtgacagcaggagagaaggtcact60atgagctgcaagtccagtcagagtctgttactcagtggaaatcaaaagaacctcttgacc120tggttccagcagaaaccagggcagcctcctaaactgttgatctactgggcatccactagg180gaatctggggtccctgatcgcttcacaggcagtggatctggaacagatttcactctcacc240atcagcagtgtgcaggctgaagacctggcagtttattactgtcagaatgattataattat300ccgtacacgttcggaggggggaccaagctggaaataaaacgggctgatgctgcaccaact360gtatccatcttcccaccatccagtgagcagttaacatctggaggtgcctcagtcgtgtgc420ttcttgaacaacttctaccccaaagacatcaatgtcaagtggaagattgatggcagtgaa480cgacaaaatggcgtcctgaacagttggactgatcaggacagcaaagacagcacctacagc540atgagcagcaccctcacgttgaccaaggacgagtatgaacgacataacagctatacctgt600gaggccactcacaagacatcaacttcacccattgtcaagagcttcaacaggaatgagtct6602220PRTArtificialSequenceSyntheticconstruct2AspValValMetSerGlnSerProSerSerLeuThrValThrAlaGly151015GluLysValThrMetSerCysLysSerSerGlnSerLeuLeuLeuSer202530GlyAsnGlnLysAsnLeuLeuThrTrpPheGlnGlnLysProGlyGln354045ProProLysLeuLeuIleTyrTrpAlaSerThrArgGluSerGlyVal505560ProAspArgPheThrGlySerGlySerGlyThrAspPheThrLeuThr65707580IleSerSerValGlnAlaGluAspLeuAlaValTyrTyrCysGlnAsn859095AspTyrAsnTyrProTyrThrPheGlyGlyGlyThrLysLeuGluIle100105110LysArgAlaAspAlaAlaProThrValSerIlePheProProSerSer115120125GluGlnLeuThrSerGlyGlyAlaSerValValCysPheLeuAsnAsn130135140PheTyrProLysAspIleAsnValLysTrpLysIleAspGlySerGlu145150155160ArgGlnAsnGlyValLeuAsnSerTrpThrAspGlnAspSerLysAsp165170175SerThrTyrSerMetSerSerThrLeuThrLeuThrLysAspGluTyr180185190GluArgHisAsnSerTyrThrCysGluAlaThrHisLysThrSerThr195200205SerProIleValLysSerPheAsnArgAsnGluSer2102152203681DNAArtificialSequenceSyntheticconstruct3caggtccagctgcagcagtctgggcctcagctggttaggcctggggcttcagtgaagata60tcctgcaaggcttctggtcactcattcaccacctactggatgcactgggtgaagcagagg120cctggacaaggtcttgagtggattggcatgattgatccttccgatagtgaaactaggtta180aatcagaagttcaaggacaaggccacattgactgtagacaaatcctccagcacagtctac240atgcaactcagcagcccgacatctgaagactctgtggtctattactgtgcaagctactat300ggcaattctatggactactggggtcaaggaacctcagtcaccgtctcctcagccaaaacg360acacccccatctgtctatccactggcccctggatctgctgcccaaactaactccatggtg420accctgggatgcctggtcaagggctatttccctgagccagtgacagtgacctggaactct480ggatccctgtccagcggtgtgcacaccttcccagctgtcctgcagtctgacctctacact540ctgagcagctcagtgactgtcccctccagcacctggcccagcgagaccgtcacctgcaac600gttgcccacccggccagcagcaccaaggtggacaagaaaattgtgcccagggattgtcat660catcaccatcaccatcactaa6814226PRTArtificialSequenceSyntheticconstruct4GlnValGlnLeuGlnGlnSerGlyProGlnLeuValArgProGlyAla151015SerValLysIleSerCysLysAlaSerGlyHisSerPheThrThrTyr202530TrpMetHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyMetIleAspProSerAspSerGluThrArgLeuAsnGlnLysPhe505560LysAspLysAlaThrLeuThrValAspLysSerSerSerThrValTyr65707580MetGlnLeuSerSerProThrSerGluAspSerValValTyrTyrCys859095AlaSerTyrTyrGlyAsnSerMetAspTyrTrpGlyGlnGlyThrSer100105110ValThrValSerSerAlaLysThrThrProProSerValTyrProLeu115120125AlaProGlySerAlaAlaGlnThrAsnSerMetValThrLeuGlyCys130135140LeuValLysGlyTyrPheProGluProValThrValThrTrpAsnSer145150155160GlySerLeuSerSerGlyValHisThrPheProAlaValLeuGlnSer165170175AspLeuTyrThrLeuSerSerSerValThrValProSerSerThrTrp180185190ProSerGluThrValThrCysAsnValAlaHisProAlaSerSerThr195200205LysValAspLysLysIleValProArgAspCysHisHisHisHisHis210215220HisHis2255657DNAArtificialSequenceSyntheticconstruct5gatgttgtggtgactcaaactccactctccctgcctgtcagtcttggagatcaagcctcc60atctcttgcagatctagtcagagccttgtacacagtgatggaaacacctatttacattgg120tacctgcagaagccaggccagtctccaaagctcctgatctacaaagtttccaaccgattt180tctggggtcccagacaggttcagtggcagtggatcagggacagatttcacactcaagatc240agcagagtggaggctgaagatctgggagtttatttctgctctcaaaatacacatgttcca300ttcacattcggctcggggacaaagttggaaataaaacgggctgatgctgcaccaactgta360tccatcttcccaccatccagtgagcagttaacatctggaggtgcctcagtcgtgtgcttc420ttgaacaacttctaccccaaagacatcaatgtcaagtggaagattgatggcagtgaacga480caaaatggcgtcctgaacagttggactgatcaggacagcaaagacagcacctacagcatg540agcagcaccctcacgttgaccaaggacgagtatgaacgacataacagctatacctgtgag600gccactcacaagacatcaacttcacccattgtcaagagcttcaacaggaatgagtct6576219PRTArtificialSequenceSyntheticconstruct6AspValValValThrGlnThrProLeuSerLeuProValSerLeuGly151015AspGlnAlaSerIleSerCysArgSerSerGlnSerLeuValHisSer202530AspGlyAsnThrTyrLeuHisTrpTyrLeuGlnLysProGlyGlnSer354045ProLysLeuLeuIleTyrLysValSerAsnArgPheSerGlyValPro505560AspArgPheSerGlySerGlySerGlyThrAspPheThrLeuLysIle65707580SerArgValGluAlaGluAspLeuGlyValTyrPheCysSerGlnAsn859095ThrHisValProPheThrPheGlySerGlyThrLysLeuGluIleLys100105110ArgAlaAspAlaAlaProThrValSerIlePheProProSerSerGlu115120125GlnLeuThrSerGlyGlyAlaSerValValCysPheLeuAsnAsnPhe130135140TyrProLysAspIleAsnValLysTrpLysIleAspGlySerGluArg145150155160GlnAsnGlyValLeuAsnSerTrpThrAspGlnAspSerLysAspSer165170175ThrTyrSerMetSerSerThrLeuThrLeuThrLysAspGluTyrGlu180185190ArgHisAsnSerTyrThrCysGluAlaThrHisLysThrSerThrSer195200205ProIleValLysSerPheAsnArgAsnGluSer2102157681DNAArtificialSequenceSyntheticconstruct7gagatccagctgcagcagtctggagctgagctggggaggcctgggtcctcagtgaagctg60tcctgcaagacttctggatatactttcacaaacttttatataacctggctgaaacagagg120cctggacagggcctggaatggattggatttatttatcctggaaatggttatactgcatac180aatgagaaattccagggagaggccacactgacttcagacacatcttccagcacagcctac240atgcacctcagaagcctgacatctgaggactctgcaatctatttctgtgcaagactggga300cgaaatgaagttgactactggggccaaggcaccactctcacagtctcctcagccaaaacg360acacccccatctgtctatccactggcccctggatctgctgcccaaactaactccatggtg420accctgggatgcctggtcaagggctatttccctgagccagtgacagtgacctggaactct480ggatccctgtccagcggtgtgcacaccttcccagctgtcctgcagtctgacctctacact540ctgagcagctcagtgactgtcccctccagcacctggcccagcgagaccgtcacctgcaac600gttgcccacccggccagcagcaccaaggtggacaagaaaattgtgcccagggattgtcat660catcaccatcaccatcactaa6818226PRTArtificialSequenceSyntheticconstruct8GluIleGlnLeuGlnGlnSerGlyAlaGluLeuGlyArgProGlySer151015SerValLysLeuSerCysLysThrSerGlyTyrThrPheThrAsnPhe202530TyrIleThrTrpLeuLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyPheIleTyrProGlyAsnGlyTyrThrAlaTyrAsnGluLysPhe505560GlnGlyGluAlaThrLeuThrSerAspThrSerSerSerThrAlaTyr65707580MetHisLeuArgSerLeuThrSerGluAspSerAlaIleTyrPheCys859095AlaArgLeuGlyArgAsnGluValAspTyrTrpGlyGlnGlyThrThr100105110LeuThrValSerSerAlaLysThrThrProProSerValTyrProLeu115120125AlaProGlySerAlaAlaGlnThrAsnSerMetValThrLeuGlyCys130135140LeuValLysGlyTyrPheProGluProValThrValThrTrpAsnSer145150155160GlySerLeuSerSerGlyValHisThrPheProAlaValLeuGlnSer165170175AspLeuTyrThrLeuSerSerSerValThrValProSerSerThrTrp180185190ProSerGluThrValThrCysAsnValAlaHisProAlaSerSerThr195200205LysValAspLysLysIleValProArgAspCysHisHisHisHisHis210215220HisHis2259660DNAArtificialSequenceSyntheticconstruct9gacatcgttatgtctcagtctccatcctccctagctgtgtcagttggagagacggttact60atgagctgcaagtccagtcagacccttttatatagtagcaatcaaaagaattacttggcc120tggtaccagcagaaaccaggacagtctcctaaattgctgatttactgggcatccactagg180gaatctggggtcccagatcgcttcacaggcagtggatctgggacagatttcactctcacc240atcagcagtgtgaaggctgaagacctggcagtttattactgtcagcaatattatgactat300ccgctcacgttcggtgctgggaccaagctggagctgaaacgggctgatgctgcaccaact360gtatccatcttcccaccatccagtgagcagttaacatctggaggtgcctcagtcgtgtgc420ttcttgaacaacttctaccccaaagacatcaatgtcaagtggaagattgatggcagtgaa480cgacaaaatggcgtcctgaacagttggactgatcaggacagcaaagacagcacctacagc540atgagcagcaccctcacgttgaccaaggacgagtatgaacgacataacagctatacctgt600gaggccactcacaagacatcaacttcacccattgtcaagagcttcaacaggaatgagtct66010220PRTArtificialSequenceSyntheticconstruct10AspIleValMetSerGlnSerProSerSerLeuAlaValSerValGly151015GluThrValThrMetSerCysLysSerSerGlnThrLeuLeuTyrSer202530SerAsnGlnLysAsnTyrLeuAlaTrpTyrGlnGlnLysProGlyGln354045SerProLysLeuLeuIleTyrTrpAlaSerThrArgGluSerGlyVal505560ProAspArgPheThrGlySerGlySerGlyThrAspPheThrLeuThr65707580IleSerSerValLysAlaGluAspLeuAlaValTyrTyrCysGlnGln859095TyrTyrAspTyrProLeuThrPheGlyAlaGlyThrLysLeuGluLeu100105110LysArgAlaAspAlaAlaProThrValSerIlePheProProSerSer115120125GluGlnLeuThrSerGlyGlyAlaSerValValCysPheLeuAsnAsn130135140PheTyrProLysAspIleAsnValLysTrpLysIleAspGlySerGlu145150155160ArgGlnAsnGlyValLeuAsnSerTrpThrAspGlnAspSerLysAsp165170175SerThrTyrSerMetSerSerThrLeuThrLeuThrLysAspGluTyr180185190GluArgHisAsnSerTyrThrCysGluAlaThrHisLysThrSerThr195200205SerProIleValLysSerPheAsnArgAsnGluSer21021522011684DNAArtificialSequenceSyntheticconstruct11gacgtgcaggtggtggagtctgggggaggcttagtgaagcctggagggtccctgaaactc60tcctgtgcagtctctggattcactttcagtagttatcacatgtcttgggttcgccagact120ccggcgaagaggctggagtgggtcgcaaccattagtggtggtggtggtaacacctactat180ccagacagtgtgaagggccgattcaccatctccagagacaatgccaagaacaccctgttc240ctgcaaatgagcagtctgaggtctgaggacacggccttgtattactgtgcaagacatgag300ggtccttactactccttcgatgtctggggcacagggaccacggtcaccgtctcttcagcc360aaaacgacacccccatctgtctatccactggcccctggatctgctgcccaaactaactcc420atggtgaccctgggatgcctggtcaagggctatttccctgagccagtgacagtgacctgg480aactctggatccctgtccagcggtgtgcacaccttcccagctgtcctgcagtctgacctc540tacactctgagcagctcagtgactgtcccctccagcacctggcccagcgagaccgtcacc600tgcaacgttgcccacccggccagcagcaccaaggtggacaagaaaattgtgcccagggat660tgtcatcatcaccatcaccatcac68412228PRTArtificialSequenceSyntheticconstruct12AspValGlnValValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuLysLeuSerCysAlaValSerGlyPheThrPheSerSerTyr202530HisMetSerTrpValArgGlnThrProAlaLysArgLeuGluTrpVal354045AlaThrIleSerGlyGlyGlyGlyAsnThrTyrTyrProAspSerVal505560LysGlyArgPheThrIleSerArgAspAsnAlaLysAsnThrLeuPhe65707580LeuGlnMetSerSerLeuArgSerGluAspThrAlaLeuTyrTyrCys859095AlaArgHisGluGlyProTyrTyrSerPheAspValTrpGlyThrGly100105110ThrThrValThrValSerSerAlaLysThrThrProProSerValTyr115120125ProLeuAlaProGlySerAlaAlaGlnThrAsnSerMetValThrLeu130135140GlyCysLeuValLysGlyTyrPheProGluProValThrValThrTrp145150155160AsnSerGlySerLeuSerSerGlyValHisThrPheProAlaValLeu165170175GlnSerAspLeuTyrThrLeuSerSerSerValThrValProSerSer180185190ThrTrpProSerGluThrValThrCysAsnValAlaHisProAlaSer195200205SerThrLysValAspLysLysIleValProArgAspCysHisHisHis210215220HisHisHisHis2251329DNAArtificialSequencePrimer13cctgaattcatgaaaaaaatagtcaaatc291428DNAArtificialSequencePrimer14atagcggccgcttagctcataggatttt28當前第1頁1 2 3 
