基於磁性傳感器的定量結合動力學分析的製作方法
2023-10-21 02:05:37 5
政府支持申明
本發明由美國政府支持通過國家癌症研究所(National Cancer Institute)的基金第1U54CA119367號以及國家科學基金會(National Science Foundation)的基金第ECCS-0801385-000號完成。所述政府在本發明中享有特定權益。
技術領域
本發明涉及一種定量地測定分子結合相互作用的結合動力學參數的方法。
背景技術:
生物過程決定於第一和第二分子的分子對之間的分子相互作用。這些分子相互作用的實例包括核酸雜交相互作用、蛋白質-蛋白質相互作用、蛋白質-核酸相互作用、酶-底物相互作用以及受體-配體相互作用,例如,抗體-抗原相互作用和受體-激動劑或拮抗劑相互作用。
對DNA雜交、抗原-抗體結合以及DNA-蛋白質相互作用的基於親和性的感應均已表明在基礎科研、臨床診斷、生物分子工程和藥物設計中發揮重要作用。隨著該領域進展狀況,對用於測定分子身份和反應細節的精確、敏感、高通量和迅速的方法的需求在分析方法的演化中造成持續的壓力。為滿足這些迫切需要,研究者已經轉向於分子標記物以期改善對稀少分子檢測的敏感度。然而,這些標記物可能會改變擴散以及空間排布現象。此外,高通量或速度的要求通常不允許經典的平衡方法的使用,因而詳細了解反應動力學、擴散現象以及表面固定化的含義對於獲取有意義的反應參數而言變得至關重要。
當評價給定分子相互作用的動力學時,多種定量動力學參數可能成為目標。一種目標定量動力學參數是結合速率常數。結合速率常數(即,ka、kon)是描述兩種分子在平衡中的結合親和性的數學常數,諸如抗體和抗原的結合親和性。另一種目標定量動力學參數是解離速率常數(即,kd、koff)。所述解離速率常數是描述較大物體可逆地分離(解離)成為較小組分的傾向的數學常數,如當受體/配體複合體解離成為其組分分子的時候。第三種目標動力學參數是擴散速率常數kM,該常數是描述標記的分子向傳感器進行擴散的速率的數學常數。
技術實現要素:
提供了對分子結合相互作用的結合動力學參數進行定量地測定的方法。本方法的實施方案的方面包括:製備磁性傳感器裝置,所述磁性傳感器裝置包含與分析混合物接觸的磁性傳感器,所述分析混合物包含磁性標記的分子以產生可檢測的分子結合相互作用;從所述磁性傳感器中獲取實時信號;以及由所述實時信號定量地確定所述分子結合相互作用的結合動力學參數。還提供了被配置為用於所述方法的系統和試劑盒。
本發明的方面包括定量測定分子結合相互作用的結合動力學參數的方法。所述方法包括:製備磁性傳感器裝置,所述磁性傳感器裝置包括與分析混合物接觸的磁性傳感器,所述分析混合物具有磁性標記的分子以產生可檢測的分子結合相互作用;從所述磁性傳感器中獲取實時信號;以及由所述實時信號定量地確定所述分子結合相互作用的結合動力學參數。
在某些實施方案中,所述結合動力學參數是結合速率常數(ka)。在一些情況下,所述結合動力學參數是解離速率常數(kd)。在某些情況下,所述結合動力學參數是擴散限制速率常數(kM)。在某些實施方案中,結合動力學參數為結合速率常數(ka)、解離速率常數(kd)和擴散限制速率常數(kM)中的至少一種。
在某些實施方案中,所述磁性傳感器包括與所述磁性標記的分子特異地結合的分子,並且所述接觸包括將所述磁性標記的分子塗覆於所述磁性傳感器。
在某些實施方案中,所述磁性傳感器包括捕獲探針,所述捕獲探針特異地結合於與所述磁性標記的分子特異地結合的分子,並且所述接觸包括將與所述磁性標記的分子特異地結合的分子和所述磁性標記的分子相繼地塗覆於所述磁性傳感器。
在一些情況下,所述磁性傳感器包括捕獲探針,所述捕獲探針特異地結合於與所述磁性標記的分子特異地結合的分子,並且所述接觸包括製備具有與所述磁性標記的分子特異地結合的分子和所述磁性標記的分子的反應混合物,並且隨後將所述反應混合物塗覆於所述磁性傳感器。
在某些實施方案中,所述磁性傳感器是自旋閥傳感器。在一些情況下,所述磁性傳感器是磁性隧道結傳感器。
在某些情況下,所述分子結合相互作用是諸如核酸雜交相互作用、蛋白質-蛋白質相互作用、受體-配體相互作用、酶-底物相互作用或蛋白質-核酸相互作用的結合相互作用。
在一些情況下,定量測定的步驟包括用擬合算法處理所述實時信號。在某些情況下,所述擬合算法是二室擬合算法(two-compartment fitting algorithm)。在一些實施方案中,所述二室擬合算法包括主體區室(bulk compartment)和表面區室(surface compartment)。
本發明的方面還包括定量測定兩種或更多種不同分子結合相互作用的結合動力學參數的方法,其中各個不同分子結合相互作用包括不同磁性標記的分子。所述方法包括:製備包括兩個或更多個不同的磁性傳感器的磁性傳感器裝置,各個磁性傳感器接觸具有磁性標記的分子的分析混合物從而產生兩種或更多種不同的分子結合相互作用;從各個磁性傳感器中獲取實時信號;以及從所述實時信號中定量測定針對所述兩種或更多種不同的分子結合相互作用中的每種的結合動力學參數。
在某些實施方案中,所述結合動力學參數是結合速率常數(ka)。在一些情況下,所述結合動力學參數是解離速率常數(kd)。在某些情況下,所述結合動力學參數是擴散限制速率常數(kM)。在某些實施方案中,結合動力學參數是結合速率常數(ka)、解離速率常數(kd)和擴散限制速率常數(kM)中的至少一種。
在某些實施方案中,所述結合相互作用是諸如核酸雜交相互作用、蛋白質-蛋白質相互作用、受體-配體相互作用、酶-底物相互作用或蛋白質-核酸相互作用的結合相互作用。
本發明的方面還包括磁性傳感器裝置。所述磁性傳感器裝置包括:磁性傳感器,所述磁性傳感器被配置為檢測磁性標記的分子;以及處理器,所述處理器被配置為從所述磁性傳感器中獲取實時信號和由所述實時信號定量地確定分子結合相互作用的結合動力學參數。
在某些實施方案中,所述結合動力學參數是結合速率常數(ka)。在一些情況下,所述結合動力學參數是解離速率常數(kd)。在某些情況下,所述結合動力學參數是擴散限制速率常數(kM)。在某些實施方案中,結合動力學參數是結合速率常數(ka)、解離速率常數(kd)和擴散限制速率常數(kM)中的至少一種。
在某些情況下,所述磁性傳感器是自旋閥傳感器。在一些情況下,所述磁性傳感器是磁性隧道結傳感器。
在某些實施方案中,所述磁性傳感器包括兩個或更多個感應區。在一些情況下,所述磁性傳感器包括四個或更多個感應區。在一些情況下,所述感應區以串聯和並聯的方式連接。
在某些情況下,所述裝置包括兩個或更多個不同的磁性傳感器。在一些情況下,所述裝置包括100個或更多個不同的磁性傳感器。在一些情況下,所述裝置包括1000個或更多個不同的磁性傳感器。
在某些實施方案中,所述裝置還包括所述磁性標記的分子和與所述磁性標記的分子特異地結合的分子。
本發明的方面還包括試劑盒,該試劑盒包括:(a)磁性標記物;以及(b)以下物質中的至少一種:(i)計算機可讀的媒介,其上儲存有電腦程式,當計算機執行該程序時,該程序操控計算機由獲自磁性傳感器的實時信號定量地確定分子結合相互作用的結合動力學參數;以及(ii)具有用於獲得所述電腦程式的地址的物理基板。
附圖說明
圖1(a)示出了根據本發明實施方案的使用與磁性傳感器結合的捕獲抗體、與所述捕獲抗體結合的分析物和與磁性標籤連接的檢測抗體進行的夾心分析法的示意圖。圖1(b)示出了根據本發明實施方案的使用與磁性傳感器結合的捕獲DNA、與所述捕獲DNA結合的靶DNA和與磁性標籤連接的檢測DNA進行的DNA夾心分析法的示意圖。
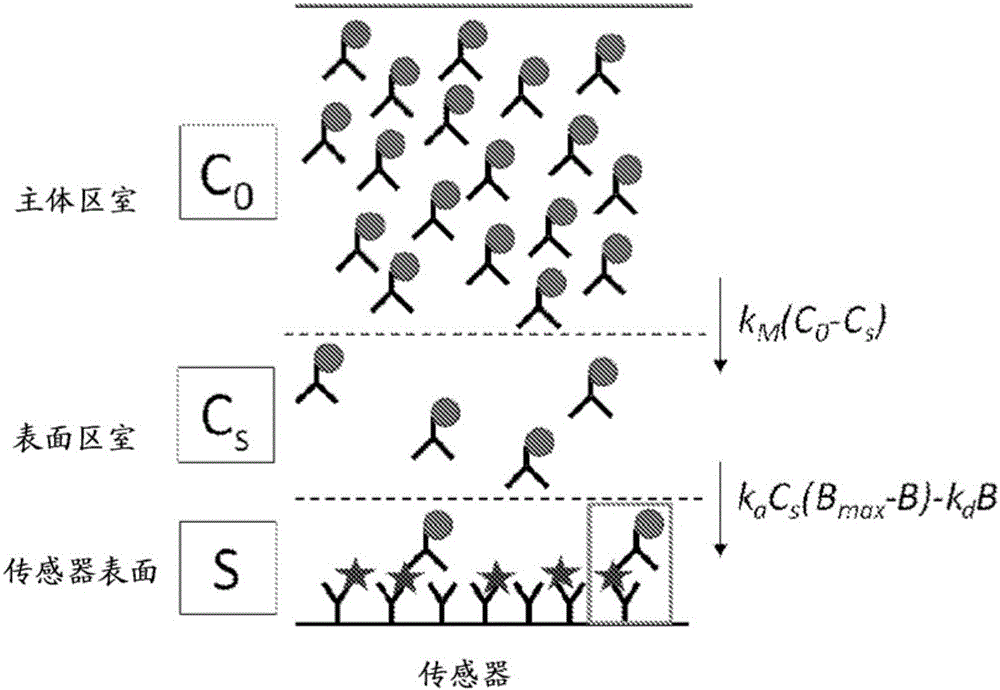
圖2提供了根據本發明實施方案的二室反應擴散模型的示意圖。標記的抗體通過運輸過程移向傳感器表面並且隨後通過結合流動(conjugation flux)進行結合和釋放。
圖3示出了根據本發明實施方案的鏈黴親和素-生物素結合相互作用的(a)和EpCAM抗體對EpCAM抗原的(b)的動力學模型與實時結合數據之間的比較圖。一旦所述模型與所述結合數據進行了擬合,由所述擬合計算所述結合速率常數、解離速率常數和擴散限制速率常數。圖3(c)和3(d)所示的實時結合曲線示出了根據本發明實施方案的以平行實驗進行的CEA抗體對CEA抗原的結合動力學監測從而比較磁性納米傳感器與表面等離子體共振(SPR)系統。所述GMR生物傳感器具有5.0×104M-1s-1的ka計算值以及4.4×10-4s-1的kd計算值,而SPR實驗產生了4.44×104M-1s-1的ka以及1.17×10-4s-1的kd。
圖4(a)示出了根據本發明實施方案的抗體-抗原結合(並非按比例繪製)的示意圖。在左側,用磁性標籤標記的抗體在濃度為Cs的溶液中靠近所述GMR傳感器表面。當未結合時,擴散磁性標記的抗體距離所述GMR傳感器過遠以致不能被檢測到。在所述傳感器表面的是抗原,其以nmax的初始表面濃度被固定。正如右側所描述,一旦所述磁性標記的抗體與所述抗原結合,來自所述磁性標籤的磁場就被下方的基於接近度的GMR傳感器檢出。所述捕獲的抗體-抗原複合體以n表示。圖4(b)示出了根據本發明實施方案的按比例繪製的磁性標記的抗體的示意圖。所述磁性標籤包括包埋於葡聚糖聚合物內的若干個氧化鐵核並且其隨後使用抗體或受體進行功能化。圖4(c)示出了根據本發明實施方案的包括1,008個磁性傳感器的1mm2晶片的照片。圖4(d)示出了根據本發明實施方案的經完全加工的晶片的光學顯微照片和掃描電子顯微鏡(SEM)圖像。1,008個GMR生物傳感器被分成16個亞陣列,並且各亞陣列佔90μm×90μm的面積。
圖5(a)示出了根據本發明實施方案的通過方程M.6中的分析模型(虛線)所預測的抗-EpCAM抗體對表面固定化的EpCAM抗原的結合曲線圖以及所測得的實驗數據(實線)的結合曲線圖,其中EpCAM蛋白的表面濃度以2×的系列稀釋度從5阿摩爾(nmax)被稀釋至20仄摩爾(zeptomole)(nmax/256)。本實驗中的全部曲線對通過所述模型所預測曲線的擬合誤差為R2=0.98。圖5(b)示出了根據本發明實施方案的分析模型所預測的(虛線)MNP-抗-EpCAM抗體對固定化於所述傳感器表面的833仄摩爾(nmax/6)的EpCAM抗原的結合曲線圖以及所測得的實驗數據(實線)的結合曲線圖,其中MNP-抗-EpCAM蛋白的溶液濃度為未經稀釋、2×稀釋和8×稀釋。全部曲線對通過所述模型的擬合誤差為R2=0.96。y-軸以百萬分比(ppm)顯示了對初始MR進行歸一化的MR變化。
圖6(a)示出了根據本發明實施方案的在12組重複傳感器上的抗CEA抗體對抗原的多元動力學分析以及在3組重複傳感器上的抗VEGF抗體對抗原的多重動力學分析圖。圖6(b)示出了監測生物素對鏈黴親和素結合動力學的25組重複傳感器示圖。圖6(c)示出了SPR圖並且圖6(d)示出了根據本發明實施方案的基於磁性納米傳感器的平臺的結果圖,當在平行實驗中對CEA抗體結合CEA抗原進行監測時所述圖提供了類似的實時結合曲線。
圖7示出了根據本發明實施方案的每傳感器的磁性標籤數量隨時間變化的圖。獲得了各個加載團塊的SEM圖像(示於圖7右側)用以對所述實驗中結合的MNP數量與所述模型預測的數量進行比較。
圖8示出了根據本發明實施方案的不同固定化抗原加載量隨時間的傳感器信號圖。
圖9(a)示出了根據本發明實施方案的針對表位分布和交叉反應因素的選擇性蛋白質定向的示意圖。圖9(b)示出了根據本發明實施方案的用抗-EGFR捕獲抗體(作為對照)功能化的抗-EGFR Ab傳感器的圖,其可捕獲EGFR並且當所述抗EGFR抗體-MNP複合體結合之時被檢出。圖9(c)示出了根據本發明實施方案的證實了被監測的動力學與結合EGFR的抗-EGFR抗體-MNP複合體相關的圖。y-軸以百萬分比(ppm)顯示了對初始MR進行歸一化的MR變化。
圖10示出了根據本發明實施方案的使用高密度GMR傳感器陣列產生的2D空間內不同時間下蛋白質擴散動力學的可視化效果。y-軸單位以百萬分比(ppm)顯示了對初始MR進行歸一化的MR變化。
圖11(a)示出了根據本發明實施方案的用於監測穿過使用磁性傳感器組的晶片陣列的蛋白質擴散動力學的實驗裝置照片。在圖11(a)中,使用捕獲抗體將四個四傳感器組選擇性地固定於CEA。在圖11(a)中被圈示的各個傳感器組對應於圖11(b)內圖中的匹配曲線。在將所述未反應捕獲抗體洗去之後,將以MNP標籤進行標記的檢測抗體在反應孔內進行孵育。圖11(b)示出了根據本發明實施方案的信號隨時間的變化圖。在向左上角的孔加入可溶的CEA抗原時,有可能在空間和時間上將CEA蛋白經過所述孔的移動可視化。
圖12示出了包含並聯和串聯的72組傳感器條GMR傳感器結構的光學顯微圖像。圖12中的插圖示出了GME傳感器的一個磁性傳感器條的掃描電子顯微鏡(SEM)圖像,其上具有多個結合的磁性納米顆粒標籤。
圖13示出了根據本發明實施方案的描述方程M.6中各項貢獻的對數圖,方程M.6是結合於所述傳感器表面的磁性標記抗體數量的函數。
圖14示出了根據本發明實施方案的由Langmuir吸附模型所預測的(虛線)和實驗測得的(實線)抗-EpCAM抗體對表面固定化的EpCAM抗原的結合曲線圖。
具體實施方式
提供了對分子結合相互作用的結合動力學參數進行定量地測定的方法。本方法的實施方案的方面包括:製備磁性傳感器裝置,所述磁性傳感器包含與分析混合物進行接觸的磁性傳感器,所述分析混合物包含磁性標記的分子以產生可檢測的分子結合相互作用;從所述磁性傳感器中獲取實時信號;以及由所述實時信號定量地確定所述分子結合相互作用的結合動力學參。還提供了被配製為用於所述方法的系統和試劑盒。
在對本發明進行更為詳盡的描述之前,應當了解本發明並不限於所描述的特定實施方案,因此本發明當然可以變化。還應了解,本文所使用的術語僅出於描述特定實施方案的目的並且並非意在進行限定,因為本發明的範圍應僅由所附的權利要求進行限定。
在提供數值範圍的情況下,應當了解本發明涵蓋了處於所述範圍的上限和下限之間的各中間數值以及該規定範圍中的任意所述或中間數值,除非上下文進行清楚地另行指明否則下限精確到十分位。這些較小範圍的上限和下限可被獨立地包含於所述較小範圍內並且亦被涵蓋於本發明之內,除在規定範圍被明確排除的任何範圍限制。在所規定範圍包含這些範圍限制的之一或全部的情況下,不包括這些被包含的範圍限制之一或全部的範圍也包含於本發明之內。
特定範圍限制在本文中以數值方式給出,其前具有術語「約」。本文所使用的術語「約」在本文中被用於為其後的精確數字以及接近或近似所述術語之後的數字的數字提供文字上的支持。在確定數字是否接近或近似明確提及的數字時,所述接近或近似的未提及數字可以是在其所處的上下文中提供了所述明確提及的數字的實質等價物的實質等效數字。
除非另行定義,否則本文所使用的全部技術和科學術語具有本發明所屬領域的普通技術人員所通常理解的含義。儘管與本文所述類似或等價的任意方法和材料也可被用於本發明的實施或測試,在此描述了代表性的說明性方法和材料。
本說明所引用的全部出版物和專利以引用的方式併入本文,正如各個出版物或專利被特定且個別地表明通過引用的方式併入,並且其以引用的方式併入本文用以公開和描述與所述出版物通過引用而進行關聯的方法和/或材料。任意出版物的引用是對所述出版物在本申報日期之前的公開內容的引用並且不應解釋為承認本發明無權通過以在先發明的方式從而先於這些出版物。此外,所提供的出版的日期可與實際出版日期不同,所述實際出版日期可能需要進行獨立證實。
應當認識到,本文以及所附的權利要求書中所使用單數形式的「一個」、「一種」和「所述」包含了複數個指示物,除非上下文明確地另行指明。進一步應認識到,所述權利要求書可被撰寫為排除任意可選的要素。同樣地,本申明意在用作為與權利要求要素有關的諸如「唯獨」、「僅」等等這些排它性術語的使用或「否定」限定的使用的前提基礎。
應當了解,出於明了澄清的目的而在不同獨立實施方案內所描述的本發明的特定特徵也可以結合形式提供於單一實施方案之中。反過來,出於簡要的目的而在單一實施方案內所描述本發明的多種特徵也可以分別提供或以任何適當的分組進行提供。所述實施方案的所有組合被明確地包含於本發明內並且在本文公開的方式正如各自每一組合被單獨和明確地進行公開,其程度使這些組合包含了可操作的加工和/或裝置/系統/試劑盒。此外,描述這些可變因素的實施方案中所列的所有亞組合也被本發明明確地包含並且在本文公開的方式正如各自每一化學群體亞組合被單獨和明確地在本文中被公開。
正如本領域的技術人員在閱讀本發明後所明了,本文所描述和說明的各個單獨實施方案具有分立的組分和特徵,其在不脫離本發明的範圍或精神的情況下可容易地同任意其它多個實施方案的特徵進行拆分和組合。任何提及的方法均可以所提及的事件為順序或以邏輯上可行的任何其它順序進行實施。
為進一步描述本發明的實施方案,首先將對本方法的實施方案的方面進行更為詳盡的描述。隨後討論了可用於實施本發明的方法的系統和試劑盒的實施方案。
方法
根據上文所總結,本發明的實施方案涉及對目標分子結合相互作用的結合動力學參數進行定量測定的方法。在某些實施方案中,所述目標結合相互作用是第一種和第二種分子之間的相互作用,例如第一種和第二種生物分子之間的相互作用。例如,所述第一種和第二種分子之一可以是磁性標記的分子,並且所述第一種和第二種分子之一可以是與所述磁性標記分子特異性結合的分子。「定量測定」意指以數量方式例如以數值的方式表達目標結合動力學參數。「結合動力學參數」意指可測量的結合動力學因子,其至少部分地定義給定分子相互作用並且可被用於定義其行為。目標結合動力學參數包括但不限於,結合速率常數(即,ka、kon)、解離速率常數(即,kd、koff)、擴散限制速率常數(即,kM)、活化能(即,EA)、傳輸參數如擴散率,等等。
根據上文所總結,本發明的方法可包含下列步驟:
製備與包含磁性標記的分子的分析混合物進行接觸的磁性傳感器裝置;
從磁性傳感器裝置中獲取實時信號;並且
由所述實時信號定量地確定分子結合相互作用的結合動力學參數。
這些步驟均各自進行更為詳盡地描述。
製備與包含磁性標記的分子的分析混合物進行接觸的磁性傳感器裝置
所述方法的方面包括製備與包含磁性標記的分子的分析混合物進行接觸的磁性傳感器裝置。所述方法包括,製備磁性傳感器與包含目標結合相互作用的構件分子(即,所述目標結合相互作用的結合對構件)和磁性標記物的組合物(如,分析混合物)接觸的裝置或結構,其中所述磁性標記物可以是所述目標結合相互作用的構件分子之一的部分或結構域,或是不同分子的組分,如,與所述目標結合相互作用的兩種構件分子之一特異結合的第三種分子。在與所述磁性傳感器進行接觸的組合物或分析混合物中,所述磁性標記物可以與所述結合對構件之一穩定地結合例如共價或非共價結合以產生磁性標記的分子。如將下文進一步所描述的,例如在所述結合對構件彼此何時接觸方面和或所述磁性傳感器方面、與裝置相關的所述結合對構件的配置方面,製備與包含磁性標記的分子的分析混合物進行接觸的磁性傳感器裝置的步驟可包含多種不同的過程亞組合。
結合對
根據本文所述的方法,用於進行定量動力學分析的給定結合相互作用可由分子的結合對組成,諸如第一種和第二種生物分子。分子結合對可根據所述目標結合相互作用而廣為變動。目標結合相互作用包括所述結合對分子之間的任意相互作用,其中所述結合相互作用以所述分子結合對在所述結合相互作用的環境條件下所具有的特異性而進行。目標結合相互作用的實例包括但不限於:核酸雜交相互作用、蛋白質-蛋白質相互作用、蛋白質-核酸相互作用、酶-底物相互作用以及受體-配體相互作用如抗體-抗原相互作用和受體-激動劑或拮抗劑相互作用。
具有目標分子結合相互作用的分子的實例包括但不限於:生物聚合物和小分子,所述小分子可以是有機或無機小分子。「生物聚合物」是一種或多種類型的重複單元的聚合物。生物聚合物可見於生物系統中(儘管它們可以通過合成而製備)並且可包含肽、聚核苷酸和多糖,以及這樣一些化合物,其包含胺基酸類似物或非胺基酸基團,或核苷酸類似物或非核苷酸基團或由以上這些所構成。同樣,生物聚合物包括常規骨架被非天然存在的或合成的骨架所取代的聚核苷酸,並且包括一個或多個常規鹼基被能夠參與沃森-克裡克(Watson-Crick)型氫鍵相互作用的基團(天然的或合成的)所取代的核酸(或合成的或天然存在的類似物)。例如,「生物聚合物」可包括DNA(包括cDNA)、RNA、寡核苷酸和PNA以及根據美國專利第5,948,902號及其引用參考中的描述其它聚核苷酸。「生物單體」指能夠與相同的或其它生物單體連接以形成生物聚合物的單一單元(例如,具有兩個連接基團的單一胺基酸或核苷酸,所述連接基團中的一個或兩個可具有可去除的保護基團)。
本文所使用的術語「肽」在本文中指通過一個胺基酸的α-羧基基團與另一個基團的α-氨基基團之間的醯胺形成而產生的任意聚合物化合物。所述術語「寡肽」在本文中指具有少於約10個至20個殘基即胺基酸單體單元的肽。本文所使用的術語「多肽」在本文中指具有多於約10個至20個殘基的肽。本文使用的術語「蛋白質」指具有多於約50個殘基的特定序列的多肽並且包括D和L形式、經修飾的形式等等。本文所使用的術語「多肽」和「蛋白質」可互換使用。
本文所使用的術語「核酸」在本文中指由核苷酸構成的聚合物,所述核苷酸的例子如脫氧核糖核苷酸或核糖核苷酸,或可與天然存在的核酸以序列特異性的方式雜交的合成製備的化合物(如,美國專利第5,948,902號及其引用參考中所述的PNA),所述雜交方式類似於兩種天然存在的核酸的雜交,例如,可參與沃森-克裡克鹼基配對相互作用。核酸可為任意長度,如2個鹼基或更長、10個鹼基或更長、100個鹼基或更長、500個鹼基或更長、1000個鹼基或更長,包括10,000個鹼基或更長。本文使用的術語「聚核苷酸」指由長度一般多於約100個核苷酸的核苷酸單體構成的單鏈或雙鏈聚合物。聚核苷酸包含單鏈或多鏈結構,其中所述鏈中的一個或多個可以完全或可以不完全與另一個對齊。本文所使用的術語「核糖核酸」和「RNA」在本文中指由核糖核苷酸構成的聚合物。本文所使用的術語「脫氧核糖核酸」和「DNA」在本文中指由脫氧核糖核苷酸構成的聚合物。本文所使用的術語「寡核苷酸」在本文中表示單鏈核苷酸多聚體,其長約10個至約200個核苷酸,諸如長約25個至約175個核苷酸,包括長約50個至約160個核苷酸,如長度為150個核苷酸。
在一些情況下,所述分子結合對是配體和受體,其中給定的受體或配體可以是或可以不是生物聚合物。本文所使用的術語「配體」在本文中指能夠與目標化合物共價地或以其它化學方式進行結合的部分。配體可以是天然存在的或人造的。配體的實例包括但不限於,細胞膜受體的激動劑和拮抗劑、毒素和毒液、病毒表位、激素、阿片劑、甾體類、肽、酶底物、輔因子、藥物、血凝素、糖類、寡核苷酸、核酸、寡糖、蛋白質等等。
本文所使用的術語「受體」在本文中指對配體具有親和性的部分。受體可以是天然存在的或人造的。它們可以其未改變的狀態或作為與其它物種的聚集體形式被使用。受體可共價地或非共價地、直接地或通過特異性結合物質連接於結合構件。受體的實例包括但不限於,抗體、細胞膜受體、與特異性抗原決定基具有反應性的單克隆抗體和抗血清、病毒、細胞、藥物、聚核苷酸、核酸、肽、輔因子、血凝素、糖類、多糖、細胞膜、細胞器等等。受體在本領域中有時被稱為抗配體。在本文使用術語受體時在含義上無差別。當兩個分子通過分子識別進行結合以形成複合體時,形成了「配體受體對」。
磁性傳感器裝置
目標磁性傳感器裝置是響應於與所述傳感器表面結合的磁性標記而產生電信號的裝置。目標磁性傳感器裝置包括但不限於磁阻傳感器裝置,包括巨磁阻(GMR)裝置。目標GMR裝置包括但不限於自旋閥檢測器,以及磁性隧道結(MTJ)檢測器。
自旋閥檢測器
在一些情況下,所述磁性傳感器是自旋閥檢測器。自旋閥檢測器是由非磁性層如銅間隔開的兩個鐵磁層的金屬多層薄膜結構。一個鐵磁層稱為扎層,其磁化被釘扎於固定方向,而另一鐵磁層被稱為自由層,其磁化可在外加磁場下自由轉動。自旋閥的電阻取決於所述自由層的磁化對於所述扎層的磁化的相對取向。當所述兩個磁化方向平行時,所述電阻最低,當反向平行時,所述電阻最高。電阻的相對變化被稱為磁阻(MR)比率。在一些情況下,自旋閥的MR比率可在小磁場例如約100Oe中達到高於約10%。因此,自旋閥可以用作檢測結合於所述傳感器表面的磁性標記的分子的感應元件。
在某些實施方案中,自旋閥磁阻(MR)比率為約1%至約20%,諸如約3%至約15%,包括約5%至約12%。因此,在某些實施方案中,自旋閥可以以窄帶寬(即,約1Hz或更低)或使用鎖定檢測(lock-in detection)對約10nm大小的單一磁性標記物進行檢測。在這些情況下,通過狹化所述噪音帶寬甚至可為單納米顆粒檢測獲得充分的信噪比(SNR)。
自旋閥檢測器可使用面內模式實施(參見,例如Li等,J.Appl.Phys.,93卷(10):7557(2003))。在其它實施方案中,當在所述檢測系統中可檢測到AC擾動場(tickling field)導致的電磁幹擾(EMI)時可使用垂直模式。所述EMI信號傾向於以所述AC擾動場的頻率f為中心,因此其可通過在頻率2f下進行的鎖定檢測而基本被消除或降低。此外,在一些情況下,可以使用2橋電路(2-bridge circuit)來基本去除殘餘EMI。可以使用具有處於兩個不同頻率下的AC調製傳感電流和AC擾動場的其它信號採集和處理方法(例如S-J Han,H.Yu,B.Murmann,N.Pourmand和S.X.Wang,IEEE International Solid-State Circuits Conference(ISSCC)Dig.Tech.Papers,San Francisco Marriott,CA,USA,2007年2月11-15)。
在某些實施方案中,除所述自旋閥自身的幾何特徵和偏置磁場之外,來自所述自旋閥檢測器的由所述磁性標記物所引起的信號還依賴於所述磁性標記物和所述自旋閥的自由層之間的距離。由單磁性標記物產生的檢測器電壓信號隨著所述顆粒中心與所述自旋閥自由層的中平面之間的距離的增加而降低。
在某些實施方案中,自旋閥的自由層位於扎層的頂部從而為磁性標記物的檢測提供便利,這是因為來自磁性顆粒的感應磁場隨著所述傳感器和該顆粒之間的距離而單調遞減。對包括保護所述自旋閥的保護層的厚度在內的所述磁性標記物和所述自由層的頂面之間距離的最小化可以為磁性顆粒的檢測提供便利。
在某些實施方案中,自旋閥傳感器可以包括在一個或多個檢測器表面上的鈍化層。在一些實施方案中,檢測器結合了鈍化薄(例如,60nm或更薄,諸如50nm或更薄,包括40nm或更薄、30nm或更薄、20nm或更薄或者10nm或更薄)層(例如,在檢測器被用於具有50nm或更低的平均直徑的磁性納米顆粒標籤的實施方案中)。在某些實施方案中,可使用較大的微米尺度的磁性顆粒。在一些情況下,適用於本文公開的檢測器的鈍化薄層可具有介於約1nm與約10nm之間的厚度,諸如介於約1nm與約5nm之間的厚度,包括介於約1nm與約3nm之間的厚度。在某些實施方案中,適用於本文公開的檢測器的鈍化薄層可具有介於約10nm與約50nm之間的厚度,諸如介於約20nm與約40nm之間的厚度,包括介於約25nm與約35nm之間的厚度。鈍化層可包括但不限於,Ta、Au或它們的氧化物、它們的組合,等等。
涉及自旋閥檢測器及它們的應用的方案的進一步細節被提供於美國專利公開號第2005/0100930號和第2009/0104707號;其公開內容以引用的方式併入本文。
磁性隧道結檢測器
在某些實施方案中,所述磁性傳感器是磁性隧道結(MTJ)檢測器。MTJ檢測器以類似於自旋閥檢測器的方式構建,區別在於磁性間隔層被替換成絕緣層(如,絕緣隧道阻擋層)如氧化鋁或MgO,通過該絕緣層所述感應電流垂直於薄膜平面流動。兩鐵磁電極之間的電子隧穿由兩鐵磁電極的相對磁化控制,即在其平行之時隧穿電流高並且在其反向平行時隧穿電流低。在某些實施方案中,MTJ檢測器包含底電極、布置在隧道阻擋層任一側的磁性多層以及頂電極。在一些情況下,MTJ檢測器具有超過200%的磁阻比率(S.Ikeda,J.Hayakawa,Y.M.Lee,F.Matsukura,Y.Ohno,T.Hanyu和H.Ohno,IEEE Transactions on Electron Devices,卷54,第5期,991-1001(2007))和大裝置磁阻,其產生了較高的輸出電壓信號。
在某些實施方案中,MTJ檢測器具有雙層頂電極。第一層可以是金屬層(如,金層),其中該層可在某些情況下具有60nm或更低的厚度,諸如50nm或更低,包括40nm或更低、30nm或更低、20nm或更低或者10nm或更低。第二層可以是導電金屬,例如銅、鋁、鈀、鈀合金、鈀氧化物、鉑、鉑合金、鉑氧化物、釕、釕合金、氧化釕、銀、銀合金、銀氧化物、錫、錫合金、錫氧化物、鈦、鈦合金、鈦氧化物、這些物質的組合,等等。在一些情況下,第二層的孔略小於MTJ的大小。在某些實施方案中,所述傳感器被配置為在使用期間使結合的磁性標記物與所述自由磁性層的頂表面之間的距離介於5nm與100nm之間,諸如介於5nm與50nm之間,包括介於5nm與30nm之間,諸如介於5nm與20nm之間,包括介於5nm與10nm之間。在一些情況下,這種布置為降低或基本防止頂電極中的電流聚集提供便利(參見,例如van de Veerdonk,R.J.M.等,Appl.Phys.Lett.,71:2839(1997)),該現象可在僅使用薄金電極的情況下出現。
除所述感應電流垂直於所述薄膜平面流動之外,MTJ檢測器可與自旋閥檢測器類似地運行,以所述外加調製場的面內模式或垂直模式均可。根據上文涉及自旋閥檢測器的討論,在某些實施方案中,外加調製場的垂直模式可被用於降低EMI,並且類似地,薄鈍化層也適用於MTJ檢測器。此外,MTJ檢測器上的薄金第一頂電極還可為電導、鈍化以及特定生物分子探針的吸附提供便利。
在某些實施方案中,在相同的檢測器寬度和顆粒-檢測器距離下,MTJ檢測器可給出比自旋閥檢測器更大的信號。例如,對於具有0.2μm乘0.2μm結面積和1kOhm-μm2的電阻-面積乘積,以250%的MR在250mV的偏壓和Hb=35Oe,Ht=100Oe rms下運行的MTJ檢測器,來自直徑11nm的中心距離所述自由層面心為35nm的單Co納米顆粒的電壓信號可為約200μV。在一些情況下,該電壓比類似大小的自旋閥檢測器的電壓高出一個或更多的數量級。
涉及MTJ檢測器及它們的應用的方案的進一步細節被提供於美國專利公開號第2005/0100930號和第2009/0104707號;其公開內容以引用的方式併入本文。
磁性傳感器裝置設置
磁性傳感器裝置可具有多種不同的設置,例如對傳感器的設置,無論傳感器被設置用於分批還是穿流應用等等。同樣,提供所述裝置的磁性傳感器以與目標分子結合相互作用的結合構件和磁性標記物的混合物任何設置均可被使用。因此,磁性傳感器裝置的設置可包括但不限於:井設置(其中所述傳感器與諸如井這樣的液體盛容結構的底部或壁連接);穿流設置,例如,其中所述傳感器與具有流體輸入和輸出的液流池(flow cell)的壁連接;等等。
在某些實施方案中,本發明的磁性傳感器裝置包含基板表面,其在所述基板表面上顯示兩種或更多種不同磁性傳感器。在某些實施方案中,所述磁性傳感器包含具有磁性傳感器陣列的基板表面。
「陣列」包含可尋址區域例如空間可尋址區域的任何二維或基本上二維(以及三維)的布置。當在所述陣列上具有定位於特定預設位置(即,地址)的多個傳感器時,陣列是「可尋址的」。陣列特徵(即,傳感器)可通過中間間隔而隔離。任意給定的基板可攜帶設置於所述基板前表面的一個、兩個、四個或更多個陣列。根據用途,任何或全部所述陣列可感應相同或彼此不同的目標並且各陣列可包含多個不同的磁性傳感器。陣列可包含一個或多個,包括兩個或更多個、四個或更多個、8個或更多個、10個或更多個、50個或更多個,或者100個或更多個、1000個或更多個、10,000個或更多個或者100,000個或更多個磁性傳感器。例如,64個磁性傳感器可被布置到8×8的陣列中。在某些實施方案中,所述磁性傳感器可被布置到陣列中,所述陣列具有10cm2或更小的面積,或者5cm2或更小的面積,例如1cm2或更小的面積,包括50mm2或更小的面積、20mm2或更小的面積,諸如10mm2或更小的面積,或者甚至更小的面積。例如,磁性傳感器可具有介於10μm×10μm與200μm×200μm之間的面積,包括100μm×100μm或更低的面積,諸如90μm×910μm或更低,例如50μm×50μm或更低。
在某些實施方案中,磁性傳感器可包括多個線性磁阻段。例如,磁性傳感器可包括4個或更多個,例如8個或更多個,包括12個或更多個,或者16個或更多個,例如32個或更多個,例如64個或更多個,或者72個或更多個,或者128個或更多個線性磁阻段。所述磁阻段可各自寬度為1000nm或更低,例如寬度為750nm或更低,或者寬度為500nm或更低,例如寬度為250nm或更低。在一些情況下,所述磁阻段可各自厚度為50nm或更低,例如厚度為40nm或更低,包括厚度為30nm或更低,或者厚度為20nm或更低,例如厚度為10nm或更低。所述磁阻段可各自長度為1000nm或更低,或者長度為750nm或更低,或者長度為500nm或更低,或者長度為250nm或更低,例如長度為100nm或更低,或者長度為50nm或更低。
所述磁阻段可以串聯方式連在一起,或者所述磁阻段可以並聯方式連在一起。在一些情況下,所述磁阻段以串聯和並聯的方式連接。在這些情況下,兩個或更多個磁阻段可以並聯方式連在一起,並且兩組或更多組這些並聯連接的磁阻段可以串聯方式連在一起。圖12中示出了包含以串聯和並聯方式連接的磁阻段的磁性傳感器的實例。
在某些實施方案中,給定裝置的磁性傳感器中的至少一些或全部具有在與傳感器表面穩定結合的結合對構件。所述結合對構件可根據所實施的特定分析的性質而有所不同。同樣,所述結合對構件可以是與目標分子結合相互作用中的分子特異性地結合的捕獲探針,或是參與目標分子結合相互作用的分子,例如與所述磁性標記的分子特異地結合的分子。「穩定結合」指的是在應用條件下所述結合對構件和傳感器表面以超過瞬時的時間保持相對於彼此的空間位置,所述應用條件的例子如所述分析條件。同樣,所述結合對構件和傳感器表面可非共價或共價地彼此穩定結合。非共價結合的實例包括非特異性吸附、基於靜電(如,離子、離子對相互作用)、疏水相互作用、氫鍵相互作用的結合、通過與所述支持物表面共價連接的特異性結合對構件所進行的特異性結合,等等。共價結合的實例包括結合對構件與存在於所述傳感器表面的官能團如-OH之間所形成的共價鍵,其中所述官能團可以是天然存在的或是作為被引入的連接群體中的一員而存在。因此,所述結合對構件可被吸附、物理吸附、化學吸附或共價連接於所述磁性傳感器表面。
在給定裝置包含兩個或更多個磁性傳感器的情況下,各傳感器可具有與其表面結合的相同或不同的結合對構件。因此,這些裝置的傳感器表面可存在與所述磁性標記的分子結合的不同的捕獲探針或分子,從而使各個磁性傳感器特異性地結合於不同的分子。這類裝置還可包含不具有任何結合對構件的傳感器(例如,在這些空白傳感器可作為參比或對照電信號來源的情況下)。
在多傳感器裝置中,所述磁性傳感器之間可存在不攜帶任何分析物特異性探針的區域。當這些傳感器間區域存在時,其可具有各種大小和設置。在一些情況下,這些傳感器間區域可被配置為降低或防止不同傳感器間的流體運動,例如在所述傳感器間區域包含疏水材料和/或流體屏障(諸如屏壁)的情況下。
在某些實施方案中,所述裝置的基板,例如可攜帶不同傳感器的一個或多個陣列的基板,一般被成形為矩形固體(儘管可能是其它形狀),其長度為1mm或更大和150mm或更小,諸如1mm或更大和100mm或更小,例如50mm或更小、10mm或更小;寬度為1mm或更大和150mm或更小,諸如100mm或更小,包括50mm或更小,或者10mm或更小;以及厚度為0.01mm或更大和5.0mm或更小,例如0.1mm或更大和2mm或更小,包括0.2mm或更大和1.5mm或更小,例如0.5mm或更大和1.5mm或更小。
可存在電子通訊元件,例如導電體,其被配置為將傳感器與「晶片外」組件電耦接,所述「晶片外」組件諸如裝置組件,例如處理器、顯示器,等等。
根據下文更為詳盡的描述,給定的磁性傳感器裝置除如上文所述的傳感器結構(如,陣列)外可包含多種組件。另外的裝置組件可包括但不限於,信號處理組件、數據顯示組件(如,圖形用戶界面);數據輸入和輸出裝置、電源、流體處理組件等等。
磁性標記物
在所述方法的實施方案中,可使用任意便利的磁性標記物。磁性標記物是在與磁性傳感器充分結合時可通過所述磁性傳感器檢測出並且導致所述磁性傳感器輸出信號的標記部分。在標記物的中心與所述傳感器的表面之間的距離為200nm或更近,諸如100nm或更近,包括50nm或更近的情況下,目標磁性標記物可充分地結合於磁性傳感器。
在某些實施方案中,所述磁性標記物是納米顆粒。在特定實施方案的實施中有用的納米顆粒是磁性(如,鐵磁性)膠體材料和顆粒。所述磁性納米顆粒可以是超順磁高磁矩磁性納米顆粒,或者包含兩層或更多層反鐵磁性偶聯的高磁矩鐵磁物的合成反鐵磁納米顆粒。這兩種類型的納米顆粒均在缺乏磁場的情況下表現出「非磁性」並且基本不聚團。根據某些實施方案,適用的可磁化納米顆粒包含一種或多種材料,例如但不限於,順磁、超順磁、鐵磁和亞鐵磁材料,以及它們的組合。
在某些實施方案中,所述磁性納米顆粒(本文亦稱為磁性標籤)具有低殘磁以使其在溶液中不聚團。具有低殘磁的磁性納米顆粒的實例包括超順磁顆粒和反鐵磁顆粒。在某些情況下,所述磁性標籤在約100Oe的磁場下具有可檢測的磁矩。在一些情況下,所述磁性標籤的大小與所述靶生物分子的大小是可比較的,從而使所述磁性標籤不幹擾目標分子間的結合相互作用。在某些實施方案中,所述磁性標籤在形狀上是基本均一的並且在生物環境中具有化學穩定性,其可輔助它們在分析條件下的應用。在一些情況下,所述磁性標籤是生物相容的,即水可溶並且經功能化從而使它們易於結合於目標生物分子,例如特異性結合於靶分析物的受體。
在某些實施方案中,所述磁性納米顆粒是高磁矩磁性納米顆粒,諸如Co、Fe或CoFe納米晶體,其在室溫下可以是超順磁的。所述磁性納米顆粒可通過化學方法進行製備,例如但不限於,適當溶液中的鹽還原或化合物分解。這些磁性納米顆粒的實例包括但不限於S.Sun和C.B.Murray,J.Appl.Phys.,85:4325(1999);C.B.Murray等,MRS Bulletin,26:985(2001);以及S.Sun,H.Zeng,D.B.Robinson,S.Raoux,P.M.Rice,S.X.Wang和G.Li,J.Am.Chem.Soc.,126,273-279(2004)所描述的納米顆粒。在某些實施方案中,所述磁性納米顆粒可以受控的大小(如,約5-12nm)被合成,具有單分散性並且使用油酸進行穩定化。適用於本文的磁性納米顆粒包括但不限於,Co、Co合金、鐵氧體、氮化鈷、氧化鈷、Co-Pd、Co-Pt、鐵、鐵合金、Fe-Au、Fe-Cr、Fe-N、Fe3O4、Fe-Pd、Fe-Pt、Fe-Zr-Nb-B、Mn-N、Nd-Fe-B、Nd-Fe-B-Nb-Cu、Ni、Ni合金,等等。在一些實施方案中,金薄層被鍍在磁性核芯之上,或者聚L-賴氨酸包埋的玻璃表面可被連接於磁性核芯。適當的納米顆粒可購自,例如Nanoprobes,Inc.(Northbrook,IL)和Reade Advanced Materials(Providence,RI)。
在一些情況下,磁性納米標籤可通過物理方法而不是化學方法來製備(參見,例如W.Hu,R.J.Wilson,A.Koh,A.Fu,A.Z.Faranesh,C.M.Earhart,S.J.Osterfeld,S.-J.Han,L.Xu,S.Guccione,R.Sinclair和S.X.Wang,Advanced Materials,20,1479–1483(2008)),並且其適用於對待檢測的所述靶生物分子進行標記。所述磁性標籤可包含兩個或更多個鐵磁層,諸如FexCo1-x,其中x介於0.5與0.7之間,或者如基於FexCo1-x的合金。在一些情況下,FexCo1-x具有24.5k高斯的飽和磁化。這些鐵磁層可被非磁性間隔層所隔離,所述非磁性間隔層諸如Ru、Cr、Au或其合金。在某些情況下,所述間隔層包含以反鐵磁方式耦接的鐵磁層,從而使所產生的顆粒的淨殘磁為零或接近於零。在某些實施方案中,所述反鐵磁結合可通過RKKY交換相互作用(參見,例如S.S.P.Parkin等,Phys.Rev.Lett.,64(19):2304(1990))和靜磁相互作用(J.C.Slonczewski等,IEEE Trans.Magn.,24(3):2045(1988))而實現。在一些情況下,所述反鐵磁耦合強度使得所述顆粒可被100Oe的外部磁場飽和(所有層的磁化變成平行)。在一些情況下,所述反鐵磁耦合強度依賴於所述間隔層的層厚和合金組成。
在某些實施方案中,為促進所述納米顆粒的生物偶聯,金覆蓋(或功能類似物或等同材料的覆蓋)被層疊於反鐵磁材料層之上從而使所述納米顆粒可以通過金-巰基或其它便利的連接而被偶聯於生物分子。表面活性劑可被用於所述納米顆粒,從而使所述納米顆粒可以成為水溶性的。就化學穩定性而言,所述納米顆粒的邊緣還可以用Au或其它惰性層鈍化。
任何便利的方案均可被用於製備本文所述的納米顆粒。例如,所述納米顆粒的層可包括沉積在具有基本光滑表面的基板或釋放層上的納米尺度的鐵磁層和間隔層。在一些情況下,通過壓印(imprinting)、蝕刻、自組裝等等可形成遮蔽層(mask layer)。隨後,可將所述遮蔽層和其它的不需要的層去除並完全清除掉。隨後可去除所述釋放層,升出為所述遮蔽層的負像(negative image)的納米顆粒。所述顆粒可隨後與表面活性劑和生物分子接觸。在一些情況下,所述基板可在完全清除和進行化學機械拋光(CMP)後重複使用。
在其它的實施方案中,所述納米顆粒可以使用消減製備法(substractive fabrication method)進行製備。在該情況下,所述層被直接沉積在釋放層之上並隨後沉積遮蔽層。通過所述遮蔽層蝕刻所述層並且最終從所述基板上釋放。這些納米顆粒產生於所述遮蔽層的正像(positive image),其與在所述添加製備法中情況相反。
在某些實施方案中,適用於本發明的磁性納米顆粒的大小與目標分子結合相互作用的生物分子的大小是可比較的,從而使所述納米顆粒不幹擾目標結合相互作用。因此,在一些實施方案中所述磁性納米顆粒的大小為亞微米尺度,例如介於5nm與250nm之間(平均直徑),諸如介於5nm與150nm之間,包括介於5nm與20nm之間。例如,具有5nm、6nm、7nm、8nm、9nm、10nm、11nm、12nm、13nm、14nm、15nm、16nm、17nm、18nm、19nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm、70nm、80nm、90nm、100nm、110nm、120nm、130nm、140nm、150nm和300nm的平均直徑的磁性納米顆粒以及具有介於這些數值任意二者之間的平均直徑的納米顆粒適用於本文。此外,除球形外,適用於本文的磁性納米顆粒可以被成形為片狀、棒狀、線圈、纖維等等。
在一些實施方案中,所述磁性標記物具膠體穩定性,例如,納米顆粒組合物可以穩定膠體的形式存在。膠體穩定指的是所述納米顆粒被均勻分散於溶液之中從而使所述納米顆粒基本不聚團。在某些實施方案中,為防止聚簇,所述納米顆粒在零外加場下可不具有淨磁矩(或具極小磁矩)。所有大小的反鐵磁顆粒在零場下均可具零磁矩。與之相反,對於鐵磁顆粒,其大小可低於「超順磁極限」,其在某些情況下是約20nm或更低,諸如約15nm或更低,包括約10nm或更低。
在某些實施方案中,可使用大晶圓(wafer)和標準真空薄膜沉積工藝而大量製備所述合成納米顆粒。例如,使用6英寸晶圓,假定各顆粒在所述晶圓上佔據60nm乘60nm的方形的情況下,可在約5×1012顆粒每次運行的速度下製備30-nm直徑的納米顆粒。
在一些情況下,給定的目標結合相互作用的分子和磁性標記物被穩定地結合於彼此。「穩定結合」指的是在應用條件如分析條件下所述生物分子和磁性標記物以超過瞬時的時間保持將相對於彼此的空間位置。同樣,所述生物分子和磁性標記物可非共價或共價地彼此穩定結合。非共價結合的實例包括非特異性吸附、基於靜電(如,離子、離子對相互作用)、疏水相互作用、氫鍵相互作用的結合、通過與所述支持物表面共價連接的特異性結合對構件所進行的特異性結合,等等。共價結合的實例包括所述生物分子與存在於所述標記物表面的功能基團如-OH之間所形成的共價鍵,其中所述功能基團可以是天然存在的或是以引入的連接基團的構件的形式存在。
分析混合物製備
可使用任意數量的不同方案製造包含與分析混合物接觸的磁性傳感器的磁性傳感器裝置,所述分析混合物包含磁性標記的分子。例如,與所述磁性標記的分子特異性結合的第一種分子可被結合於所述傳感器表面的捕獲探針,並且隨後與磁性標記的分子(如,可被磁性標記的第二種分子)接觸。在這些情況下的方法可包括提供具有磁性傳感器的磁性傳感器裝置,所述磁性傳感器展示出與所述第一種分子特異結合的捕獲探針,所述第一種分析還與所述磁性標記的分子特異地結合;並且隨後使所述磁性傳感器與所述第一種分子和所述磁性標記的分子接觸。所述接觸可包含依次地向所述磁性傳感器塗覆第一種分子,所述第一種分子與表面結合併且能夠與所述磁性標記的分子特異地結合,並且隨後塗覆所述磁性標記的分子。
或者,可以在與傳感器接觸之前將與所述磁性標記的分子特異地結合的第一種分子和所述磁性標記的分子合併以形成複合體,並且可使所產生的複合體與所述傳感器上的捕獲探針結合(如,在所述第一種分子和所述捕獲探針之間的結合相互作用的結合動力學是研究目標的情況下)。在這些情況下,所述接觸包含製備反應混合物,所述混合物包含與所述磁性標記的分子特異性結合的第一種分子以及所述磁性標記的分子,並且隨後將所述反應混合物塗覆於所述磁性傳感器。
在另一個實施方案中,與所述磁性標記的分子特異地結合的第一種分子被首先定位於所述傳感器上,並且隨後與磁性標記的第二種分子接觸。在這些情況下,所述方法包括提供具有磁性傳感器的磁性傳感器裝置,所述磁性傳感器展示出所述第一種分子(無中間捕獲探針),並且隨後使所述磁性傳感器與磁性標記的分子接觸。
圖1(a)和1(b)提供了可分別被應用於對抗體/分析物相互作用和核酸雜交相互作用的結合動力學分析的分析方案的示意圖。在圖1(a)中,所用的方案是夾心分析方案,該方案中與GMR傳感器表面穩定結合的捕獲抗體被結合於分析物,所述分析物隨後被結合於與磁性標籤相連接的檢測抗體。在圖1(b)中,所用的方案是DNA夾心分析,該方案中捕獲DNA被結合於GMR傳感器表面,靶DNA與所述捕獲DNA雜交,並且結合於磁性標籤的檢測DNA與所述靶DNA雜交。在製備根據圖1(a)和1(b)所示的方案的裝置中,所關注的可以是所述捕獲結合構件(如,捕獲抗體或捕獲DNA)和所述靶構件(如,分析物或靶DNA)之間的相互作用的結合動力學。在這些實施方案中,所述靶和標記的構件被首先在結合條件下彼此接觸,並且所產生的複合體與所述傳感器表面接觸。或者,在製備根據圖1(a)和1(b)所示的方案的裝置中,所關注的可以是標記的結合構件(如,標記的抗體或標記的DNA)和所述靶構件(如,分析物或靶DNA)之間的相互作用的結合動力學。在這些實施方案中,所述靶和捕獲構件首先在結合條件下彼此接觸,並且所產生的結合於傳感器表面的複合體與標記的構件接觸。
上述接觸(包括塗覆)步驟在可發生目標結合相互作用的條件下進行。儘管接觸的溫度可有所變化,但在一些情況下所述溫度在1℃至95℃的範圍,諸如5℃至60℃的範圍,並且包括20℃至40℃的範圍。所述分析的各種組分可存在與水性介質中,所述介質可包含或不包含其它的組分,諸如鹽、緩衝劑,等等。在一些情況下,接觸在嚴苛條件下進行。嚴苛條件特徵可在於比所述探針靶二聯體的融解溫度低15℃至35℃如20℃至30℃的溫度範圍,所述融解溫度取決於多種參數,例如,溫度、緩衝組合物、探針和靶的大小、探針和靶的濃度,等等。同樣地,所述雜交的溫度可在約55℃至70℃的範圍,通常在約60℃至68℃的範圍。在變性劑存在的情況下,所述溫度可在約35℃至約45℃的範圍,通常在37℃至42℃的範圍。嚴苛雜交條件特徵可在於存在雜交緩衝液,其中所述緩衝液特徵在於以下的特徵中的一個或多個:(a)具有高鹽濃度,如3至6×SSC(或具有類似濃度的其它鹽類);(b)去汙劑的存在,諸如SDS(0.1至20%)、Triton×100(0.01至1%)、monidet NP40(0.01至5%)等等;(c)其它添加劑,如EDTA(如,0.1至1μM)、四甲基氯化銨;(d)加速劑,如PEG、硫酸葡聚糖(5至10%)、CTAB、SDS等等;(e)變性劑,如甲醯胺、脲等;等等。嚴苛條件是在其中嚴苛性與上文所述的特定條件至少相同的條件。
與傳感器表面接觸的樣品可以是簡單樣品或複雜樣品。「單樣品」指的是包含所述結合相互作用的一個或多個構件的樣品並且除所述溶劑之外的其它分子種類即使有也是少數的。「複雜樣品」指的是包含目標結合相互作用的一個或多個構件並且還包含眾多不感興趣的不同蛋白質或其它分子的樣品。在某些實施方案中,所述複雜樣品是血樣,其為血液或其級分,例如血清。在某些實施方案中,所述複雜樣品是血清樣品。在某些實施方案中,在本發明的方法中進行分析的複雜樣品是包含10種或更多種,諸如20種或更多種,包括100種或更多種,例如103種或更多種、104種或更多種(諸如15,000種;20,000種甚或25,000種或更多)相區分的(即,不同的)分子實體的複合樣品,所述分子實體在分子結構方面相互不同。
從所述磁性傳感器中獲取實時信號
在製備包含與分析混合物(所述分析混合物包含目標結合相互作用的結合構件和磁性標記物,例如根據上文所述)接觸的磁性傳感器的裝置之後,所述方法的方面包括通過所述磁性傳感器獲取實時信號。同樣地,某些實施方案包括通過所述裝置獲取實時信號。因此,可觀測到與目標結合相互作用的發生相關聯的信號的實時演化。所述實時信號由給定的目標時間期間所獲得的兩個或更多個數據點組成,其中在某些實施方案中所獲得的信號是在給定的目標時間期間連續地獲得的數據點的連續集合(例如,以軌跡的形式)。目標時間期間可變動,其在一些情況下在1秒至10小時的範圍,諸如在10秒至1小時的範圍並且包括1分鐘至15分鐘的範圍。所述信號中的數據點的數量也可變動,其中在一些情況下,數據點的數量足以在所述實時信號的時間段上提供數據的連續延伸(continuous stretch)。
在一些實施方案中,當所述分析系統處於所述「溼」條件下時觀測所述信號,即,在包含分析成分(例如,所述結合構件和磁性標記物)的溶液仍處於與所述傳感器表面的接觸的情況下。由此,無須洗去全部非結合或無關分子。該「溼」檢測是可行的,這是因為所述磁性標籤納米顆粒(例如,如本文它處所述的具有150nm或更小的直徑)所產生的磁場隨著與所述納米顆粒的距離的增加而迅速降低。因此,與所捕獲的結合構件結合的標記物的傳感器處的磁場超過了來自溶液中的未結合的磁性標記物的磁場,所述非結合磁性標記物不僅與所述檢測器的距離較遠而且處於布朗運動之中。本文所使用的術語「鄰近檢測」指的是所結合的納米顆粒的傳感器的主導性。根據所述「鄰近檢測」設計,處於所述傳感器表面的特異結合的磁性標記的偶聯物可在不洗去溶液中的非特異磁性納米標籤的情況下被定量。
對於給定的目標結合相互作用,分析可包含獲得單結合對構件濃度或多個結合對濃度的實時信號,諸如2個或更多個、3個或更多個、5個或更多個、10個或更多個、100個或更多個、甚或1,000個或更多個不同的濃度。根據需要,給定的分析可使具有相同捕獲探針濃度的相同傳感器與多個不同的結合對構件濃度接觸,或以相反的方式進行接觸,或以捕獲探針和結合對構件的不同濃度組合進行接觸。
通過所述實時信號定量確定結合動力學參數
根據上文所總結,在獲得所述實時信號之後,所述方法可包括通過所述實時信號定量確定分子結合相互作用的結合動力學參數。換言之,所述實時信號被用於定量確定所述目標結合動力學參數,從而目標結合動力學參數獲得自所述實時信號。
在一些情況下,所述目標結合動力學參數通過使用擬合算法處理所述實時信號而進行定量確定。擬合算法指的是一套法則,其通過將方程與實時信號或獲自給定分析信號擬合,所述給定分析例如上文所述分析,從而確定目標結合動力學參數。可使用任意便利的擬合算法。
在一些實施方案中,二室模型被用於擬合所述實時數據。所關注的二室模型假定溶液中的磁性標記的結合分子通過傳輸過程(擴散或流動)接近表面結合的結合配對物如被捕獲的第一種生物分子,並且隨後通過結合和解離的化學過程與表面結合的結合配對物結合。在這些情況下,模型中的二室是主體區室和表面區室。圖2提供了一些實施方案中使用的二室反應-擴散模型的示意圖,其中標記的分子(以標記的抗體演示)通過傳輸過程向所述傳感器表面移動並且隨後通過結合流動而結合和釋放。在一些情況下,磁性標記分子的濃度被假定在各個區室中是均一的並且僅僅處於所述表面區室(Cs)中的磁性標記的分子將與所述傳感器表面的結合位點反應並且處於所述主體區室(C0)中的磁性標記的分子將向所述表面進行擴散。在一些情況下,所使用的二室模型並不假定發生「快速混合」。
該系統的支配方程寫作:
其邊界條件為:
Cs|t=0=C0 (3)
B|t=0=0 (4)
其中B是傳感器表面上所結合的第一/第二生物分子偶聯物的濃度,Bmax是初始有效受體濃度,ka(=kon)是結合速率常數,kd(=koff)是解離速率常數,並且kM是擴散限制的速率常數。由於對此常微分方程組無解析解,因此使用了數值擬合算法。
上述第一個方程被用於描述所述表面區室中標記的第二種分子的濃度Cs。該方程假定標記的第二種分子通過來自所述主體區室的擴散向所述表面區室的入流減去第二種分子通過與所述受體的結合和解離的淨出流等於Cs增加的速度。在這些實施方案中擴散是唯一的物質傳輸機制,其中在結合過程期間整個體系被靜置。
第二個方式被用於描述傳感器表面結合的第一/第二生物分子偶聯物濃度B。該方程假定標記的第二種生物分子通過結合而產生的入流減去解離等於B增加的速度。
最後,所述實時信號被假定與B成正比,即
V=gB,Vmax=gBmax. (5)
存在五個未知參數,其將是擬合參數ka、kd、kM、g和Vmax。在這五個擬合參數中,ka、kd、kM和g被假定對於在一個分析中具有相同捕獲、第一和第二生物分子的所有傳感器是相同的,並且因此被稱為全局擬合參數;Vmax對於各個傳感器是不同的,這是因為表面結合的結合配對物如固定化於所述傳感器表面的捕獲分子、第一種生物分子的濃度是難以被精確地控制的。即使在所有傳感器均位於相同的晶片並且受到相同處理的分析中,在Bmax中都會存在某些差別,並且因此在Vmax中會存在某些差別。
在一些情況下,所述二室模型是描述於D.Myszka等,Anal.Biochem.(1998)265:326-330中的二室模型的修正,例如其中所述模型被修改以適合於上述參數。
在需要的情況下,固定化的結合配對物的濃度可在不同傳感器中被特意地變動,因此可獲得並分析具有不同形狀的信號曲線,例如,在被稱為全局分析或全局擬合的方案中進行。在這些情況下,所述二室結合模型(如,根據上文所述的模型)被同時擬合於使用不同分析物濃度C(和/或不同水平的表面衍生化Bmax)而獲得的多種實時信號。本領域中被稱為「全局擬合」並且基於所述實時數據,這種全局擬合確定了單全局ka或kd是否將提供對全部數據的良好擬合。完成的擬合的結果可以圖形的方式被提供給以操作人員(operator),其將所擬合的曲線重疊於所述原始實時數據曲線之上進行顯示。
在需要的情況下,所述擬合的接近度還可通過卡方(X2)值的方式給出,其為一種標準的統計學度量。在一些情況下,當所述卡方值與實驗中的噪音處於相同的量級之下被認為給出了良好的擬合。可被稱為R2的測定係數,也可被用作為擬合良好度的指標。R2可被如下定義:如果所述信號曲線為si並且所述擬合曲線為fi,i=1,2,……n,當信號曲線中具有n個點時,則
其中是所述擬合的方差之和,並且是所述信號的總變差(total variations)。
如果存在來自一個分析的N條信號曲線,則各個信號曲線將具有R2值,應對1-R2的平均值進行最小化以獲得對全部N條曲線的最佳擬合。
在一些情況下,還可提供「殘差圖」,所述殘差圖給出了所述實驗數據偏離被擬合的曲線的程度的圖示,其顯示了各條曲線的實驗和擬合數據之間的差異。操作人員可隨後確定所述擬合是否足夠有效。如果不夠有效,則可排除表現出最差擬合的實時信號並且使用消減的實時信號集合重新運行所述擬合程序。可重複該程序直至所述擬合達到滿意程度。
所關注的另一種擬合算法包括特異性擬合算法,其公開於下文的實驗部分。
在需要的情況下,以上定量測定方案可在被配置為執行上述方案的軟體和/或硬體的輔助下進行。
多元分析
本發明方面包括使用同一傳感器對兩種或更多種不同的結合相互作用進行的多元分析。「多元分析」指的是不同組結合分子之間的兩種或更多種不同結合相互作用被定量分析,其中結合分子和/或磁性標記的分子彼此不同,例如區別於不同的序列。在一些情況下,所述組數量是2個或更多個,諸如4個或更多個、6個或更多個、8個或更多個等等,多達20個或更多個,例如50個或更多個,包括100個或更多個或者1000個或更多個不同組。同樣地,在一些情況下,所述磁性傳感器裝置可包含兩種或更多種不同的磁性傳感器,諸如2種或更多種、4種或更多種、6種或更多種、8種或更多種等等,多達20種或更多種,例如50種或更多種,包括100種或更多種或者1000種或更多種不同的磁性傳感器,各傳感器特異地檢測不同的結合相互作用。在某些實施方案中,所關注的是2至1000種不同結合相互作用的多元分析,諸如2至50種,或者2至20種不同的結合相互作用。因此,在這些實施方案中,所述磁性傳感器裝置可包含2至1000個不同的磁性傳感器,諸如4至1000個不同的磁性傳感器,其各自特異地分析不同的結合相互作用。在其它情況下,所述磁性傳感器裝置可包含20個或更少的不同磁性傳感器,諸如10個或更少,包括4個或更少的不同磁性傳感器,其各自特異地分析不同的結合相互作用。
裝置和系統
本發明的方面進一步包括磁性傳感器裝置和系統,其被配置為對目標分子結合相互作用的一種或多種結合動力學參數進行定量測定。所述裝置和系統一般包括磁性傳感器;以及定量分析模塊(如,處理器),所述定量分析模塊被配置為從所述磁性傳感器中接收實時信號並由所述實時信號定量地確定分子結合相互作用的結合動力學參數。這兩個組件可作為單一裝置被整合進入同一產品中,或分置入兩個或更多個不同裝置中(如,作為系統),其中所述兩個或更多個不同裝置彼此進行通訊,例如,通過有線或無線通訊協議。
因此,本發明的方面進一步包括系統,例如,基於計算機的系統,其被配置為定量評價根據上文所述的結合相互作用。「基於計算機的系統」指的是被用於分析本發明的信息的硬體裝置、軟體裝置和數據存儲裝置。所述基於計算機的系統的實施方案的最低硬體包括中央處理器(CPU)(如,處理器)、輸入裝置、輸出裝置和數據存儲裝置。任意一種當前存在的基於計算機的系統均可適用於本文公布的實施方案。所述數據存儲裝置可包括任意產品,其包含如上所述的本發明信息的記錄品,或者可訪問這種產品的存儲器訪問裝置。
在計算機可讀介質上「記錄」數據、編程或其它信息是指使用本領域已知的任何方法存儲信息的過程。根據所使用的訪問所存儲的信息的裝置,可選用任意便利的數據存儲結構。多種數據處理器程序和格式可被用於存儲,例如,文字處理文本文件,資料庫格式,等等。
「處理器」指的是執行其所需的功能的任何硬體和/或軟體組合。例如,本文的任何處理器可以是可編程的數字微處理器,諸如以電子控制器、大型機、伺服器或個人計算機(例如,桌面或可攜式)形式可用的微處理器。在所述處理器是可編程的情況下,適當的程序可從遠程位置通訊給所述處理器,或者以電腦程式產品的形式預先存儲(所述電腦程式產品諸如可攜式或固定化的計算機可讀存儲介質,無論是基於磁性、光學或固態裝置均可)。例如,磁性介質或光碟可攜帶所述程序,並且可通過在對應的站點與各處理器進行通訊的適當的讀取器讀取。
本系統的實施方案可包含下列組件:(a)通訊模塊,所述通訊模塊例如通過用戶計算機或工作站為所述系統與一位或多位用戶之間的信息傳遞提供便利;以及(b)處理模塊,所述處理模塊用於執行包括在所公開的定量分析方法中的一個或多個任務。
在某些實施方案中,描述了包含計算機可用介質的電腦程式產品,所述介質具有存儲於其中的控制邏輯(control logic)(計算機軟體程序,包括程序代碼)。當被所述計算機的處理器執行的時候,所述控制邏輯使所述處理器執行本文所述的功能。在其它的實施方案中,某些功能主要在使用例如硬體狀態機的硬體中實施。為執行本文所述功能的硬體狀態機的實施可通過使用任何便利的方法和工藝而實現。
除所述傳感器裝置和定量分析模塊之外,本發明的系統和裝置還可包含大量的其它組件,諸如數據輸出裝置如監視器、印表機和/或揚聲器,數據輸入裝置如交互埠、鍵盤等等,液體處理組件,電源等等。
用途
本方法、系統和試劑盒在需要定量測定目標結合相互作用的結合動力學參數的多種不同應用中顯現用途。在某些實施方案中,所述結合相互作用例如但不限於,核酸雜交、蛋白質-蛋白質相互作用(例如在下文實驗部分中被更為詳盡地描述的相互作用)、受體-配體相互作用、酶-底物相互作用、蛋白質-核酸相互作用,等等。
在一些情況下,本方法、系統和試劑盒在需要實時觀測分子結合相互作用的藥物開發方案中展現用途。例如,藥物開發方案可使用本方法、系統和試劑盒來實時監測抗體與抗原之間的分子結合相互作用、或核酸之間的雜交相互作用、或蛋白質之間的結合相互作用、或受體與配體之間的結合相互作用、或酶與底物之間的結合相互作用、或蛋白質與核酸之間的結合相互作用,等等。例如,CEA和VEGF是腫瘤標記物並且抗VEGF抗體藥物如貝伐單抗(bevacizumab)(阿瓦斯汀(Avastin);Genentech/Roche)是有效的抗癌症藥物。另一個實例為抗EpCAM抗體,其被製劑化成為化療藥物依決洛單抗(edrecolomab)。對諸如此類的結合相互作用的監測可為其它基於抗體的藥物的開發提供便利。
本方法、系統和試劑盒還在對包含在複雜樣品中的結合對之間的分子結合相互作用的分析中展現用途。在一些情況下,所述複雜樣品可被直接分析而不將目標結合分子與其它可能處於所述樣品中的非感興趣的蛋白質或分子進行分離。在某些情況下,非感興趣的蛋白質或分子的非特異性結合以及未結合的磁性納米顆粒在本方法、系統和試劑盒中基本不產生可檢測的信號。因此,本方法、系統和試劑盒在可能使用複雜樣品並且在對於目標結合相互作用的檢測無需洗滌所述傳感器的情況下可實時監測目標結合相互作用而的分析方案中展現用途。
本文公開的實時結合分析和動力學模型可在諸如表位定位的應用中展現用途。例如,所述GMR傳感器陣列具有以高度並行方式實施表位定位的能力。使用捕獲抗體,可將抗原選擇性地固定化於所述傳感器表面上的特定分子內結構之中。所述被捕獲抗原上暴露的表位的動力學相互作用可以針對多種受體或抗體的親和性而被探測。例如,表皮生長因子受體(EGFR)能夠結合EGF自身以及包含EGF樣重複的蛋白質如EpCAM。通過使用不同的單克隆抗體捕獲具有EGF樣重複的蛋白質以及對EGFR與這些定向蛋白質的結合進行的檢測,可測定表位定位以評價EGFR對於包含EGF樣重複的多種配體的親和性。使用GMR傳感器以探測暴露出的表位具有從使用特定靶進行的藥物相互作用的大規模篩選直至對蛋白質組中的特定目標結構域進行的平行篩選的應用。
本方法、系統和試劑盒還在對分子結合相互作用的空間上和時間上的監測中展現用途。例如,本方法、系統和試劑盒可被用於通過細胞內蛋白質的分泌蛋白質組(secretome)分析而監測定位化的細胞-細胞通訊。通過監測細胞內蛋白質分泌在空間和時間上的擴散,可測定細胞-細胞通訊的機制。
本方法、系統和試劑盒還在了解參與細胞生物學中的信號轉導的受體-配體結合相互作用以及在完整蛋白質組中對特定目標化合物進行特徵化的基礎研究中展現用途。此外,對於臨床醫學的應用範圍之廣可從定向蛋白質估測研究中的大規模篩選直至檢測藥物中靶(on-target)和離靶(off-target)交叉反應結合動力學。
計算機相關實施方案
特定實施方案的方面進一步包括多種計算機相關的實施方案。具體地,可使用計算機實施先前部分中所描述數據分析方法。因此,實施方案提供了基於計算機的系統以對使用上文方法所產生的分析數據進行分析,從而提供目標結合相互作用的結合動力學參數的定量測定。
在某些實施方案中,所述方法以「程序」的形式被編碼到計算機可讀的介質中,其中本文所使用的術語「計算機可讀的介質」指的是任何存儲或轉移介質,其參與對計算機提供用於執行和/或處理的指令和/或數據。存儲介質的實例包括軟盤、磁帶、CD-ROM、DVD、Blu-Ray、硬碟驅動器、ROM或集成電路、磁光碟或者計算機可讀卡如PCMICA卡或快閃記憶體卡,等等,無論這些裝置屬於所述計算機內置或者外置均可。包含信息的文件可被「存儲」於計算機可讀介質中,其中「存儲」指的是記錄信息從而使其在隨後的時間可為計算機所訪問和檢索。所需介質是非瞬時的介質,即,所述程序被關聯以實體結構的實體介質,例如被記錄於其上。非瞬時介質並不包含通過無線協議進行轉送的電子線號。
對於計算機可讀介質,「永久性存儲器」指的是處於永久狀態的存儲器。永久性存儲器不會由於對計算機或處理器的供電終止而消除。計算機硬碟驅動器、CD-ROM、Blu-Ray、軟盤和DVD是永久性存儲器的全部實例。隨機存取存儲器(RAM)是非永久性存儲器的一個實例。永久性存儲器中的文件是可編輯和重寫入的。
試劑盒
還提供了用於實施上述方法的一個或多個實施方案的試劑盒。本試劑盒可變動並且可包含多種裝置和試劑。目標試劑和裝置包括本文針對磁性傳感器裝置或其組件(諸如,磁性傳感器陣列或晶片)、磁性納米顆粒、結合試劑、緩衝液等等所描述的試劑和裝置。
在一些情況下,所述試劑盒至少包含在所述方法(如,上文所述的方法)中使用的試劑;以及存儲有電腦程式的計算機可讀介質,其中所述電腦程式當加載進入計算機時操作所述計算機由獲自磁性傳感器的實時信號定量地確定第一種和第二種分子之間的結合相互作用的結合動力學參數;以及具有用於獲得所述電腦程式的地址的物理基板。
除以上組件之外,本試劑盒可進一步包含實施本方法的說明。這些說明可以各種形式存在於在本試劑盒中,所述試劑盒中可存在一種或多種所述形式。這些說明可存在的一種形式是在合適的介質或基板上的印刷信息,例如,印有所述信息的紙件,處於所述試劑盒的包裝之中或在包裝插頁上等等。另一種方式為其上記錄有所述信息的計算機可讀介質,例如,磁碟、CD、DVD、Blu-Ray等等。可存在的另一種方式為網站地址,其可被用於通過國際網際網路在遠程站點獲取所述信息。本試劑盒中可存在任何便利的方式。
下列實施例通過說明的方式而非限制的方式提供。
實驗
I.結合動力學測定
A.材料與方法
描述於Osterfield等,Proc.Nat』l Acad.Sci USA(2008)150:20637-206340以及Xu等,Biosens.Bioelectron(2008)24:99-103的巨磁阻(GMR)傳感器陣列被用於以下一般方案:
1.表面功能化:傳感器表面被功能化以提供結合對構件在所述傳感器表面的穩定結合,結合對構件的實例如,捕獲抗體、第一種生物分子,等等。諸如聚乙烯亞胺(PEI)這樣的陽離子聚合物可被用於通過物理吸附將帶電的抗體非特異性結合於所述傳感器表面。或者,可利用所述抗體上的自由氨基或自由巰基基團使用共價化學反應。涉及用於寡核苷酸的穩定結合的表面功能化的另外細節提供於Xu等,Biosens.Bioelectron(2008)24:99-103並且對於抗體的穩定結合的表面功能化的另外細節提供於Osterfield等,Proc.Nat'l Acad.Sci USA(2008)150:20637-206340。目標結合對構件隨後被接觸所述傳感器表面用以將所述結合構件穩定地結合於所述傳感器表面。
2.在進行表面功能化和結合對結合之後,對所述傳感器表面進行封閉以防止所述分析期間的非特異性結合。為封閉所述表面,包含1%BSA的PBS的封閉緩衝液被加入反應孔內一小時。可用的其它封閉方案被描述於Xu等,Biosens.Bioelectron(2008)24:99-103以及Osterfield等,Proc.Nat'l Acad.Sci USA(2008)150:20637-206340。
3.在封閉之後,使所述傳感器表面與第一種目標生物分子的溶液如所述第一種生物分子的純化溶液或包含所述第一種生物分子的複合樣品接觸。對於本步驟,使用包含~1nL-100μL溶液的反應孔並且根據應用孵育時間在5分鐘至2小時的範圍。
4.在孵育之後,使包含經目標標籤(如,磁性納米顆粒)進行預標記的第二種生物分子的溶液與所述傳感器表面接觸。
5.隨後,檢測所述第二種生物分子與所述第一種生物分子的結合動力學並且用於根據結合軌跡而計算結合速率常數。
B.結果與討論
來自GMR生物傳感器的實時數據被用於計算生物素-鏈黴親和素相互作用的結合和解離速度(圖3(a))。生物素化雙鏈DNA被固定於所述傳感器表面並且經鏈黴親和素標記的磁性標籤被加入所述系統。結合速度經計算為4.45×106M-1s-1,擬合誤差為3.2%並且kM為4.4×10-4s-1。當使用BIAcore 3000表面等離子共振(SPR)儀器時進行了相同的生物素-鏈黴親和素結合實驗並且測得結合速度為5.5×106M-1s-1,接近於所述GMR傳感器分析。
隨後,論證了使用GMR傳感器陣列進行抗體抗原結合動力學研究的能力(圖2)。使用EpCAM蛋白在五至十組重複傳感器上以100μg/mL和10μg/mL的濃度對所述陣列中的傳感器進行功能化。使用該模型可以模擬經磁性標記的抗體與多種濃度的固定化抗原的結合過程。通過擬合數據(圖3(b)),根據測定,對於選定的EpCAM抗體-抗原相互作用ka為2.93×105M-1s-1,kd為2.83×10-3s-1,總擬合誤差為3.4%並且kM為4.2×10-4s-1。
進行了類似的實時實驗以對高親和性CEA抗原-抗體結合動力學進行定量。1μg/mL和10μg/mL CEA被固定於所述GMR傳感器表面並且通過SPR分析對20μg/mL、10μg/mL、5μg/mL、2.5μg/mL和1.2μg/mL進行測試。在各個平臺上監測了結合和解離速率常數並對結果進行比較(圖3(c)和3(d))。再一次,GMR傳感器陣列和SPR產生了類似的動力學速率常數。對於所述GMR生物傳感器,ka被測定為5.0×104M-1s-1並且kd為4.4×10-4s-1,而SPR實驗產生了4.44×104M-1s-1的ka和1.17×10-4s-1的kd。因此,這些結果顯示磁響應性生物傳感器可被用於精確測量結合速率常數。
II.用於抗體開發和藥物篩選的蛋白質相互作用高通量分析和動力學模型
A.材料與方法
1.傳感器
本實驗中所使用的巨磁阻(GMR)傳感器具有以下類型的底部自旋閥結構:Si/Ta(5)/晶種層/IrMn(8)/CoFe(2)/Ru/(0.8)/CoFe(2)/Cu(2.3)/CoFe(1.5)/Ta(3),括號內所有數字單位為納米。各個晶片均包含GMR傳感器陣列,所述陣列通過300nm厚的Ta/Au/Ta導線(lead)被連接於周邊結合墊(peripheral bonding pad)。為保護所述傳感器和導線免於腐蝕,通過離子束濺射法沉積兩個鈍化層:首先,SiO2(10nm)/Si3N4(20nm)/SiO2(10nm)的薄鈍化層被沉積於所有的傳感器和導線之上,僅暴露結合墊區域;其次,SiO2(100nm)/Si3N4(150nm)/SiO2(100nm)的厚保護層被沉積於參比傳感器和導線之上,暴露出活性傳感器和結合墊區域。在圖案化之後的磁阻比率約為12%。所述自旋閥的釘扎方向(pinning direction)在平面內並且垂直於所述傳感器條。通過形狀各向異性將所述自由層的易磁化軸設定為平行於所述傳感器條。這種結構允許所述GMR傳感器在其MR轉移曲線的最為敏感區域工作。
由於所述GMR效應,所述傳感器的電阻隨兩個磁性層的磁化取向而變化,所述兩個磁性層由銅間隔層進行分隔:
此處,R0是零磁場下的電阻,δRmax是最大電阻變化並且θ是所述兩磁性層之間的磁化方向間夾角。在所述底部自旋閥結構中,底部磁性層(扎層)的磁化被釘扎於固定方向,而頂磁性層(自由層)的磁場取向能夠隨外部磁場自由轉動。因此,所述磁性標記物的雜散場(stray field)可改變所述自由層的磁化並且因此改變所述傳感器的電阻。
2.磁性標記物
所述磁性標記物獲自Miltenyi Biotech Inc.,其稱為「MACS」顆粒。各MACS顆粒是10nm的Fe2O3納米顆粒的團簇,其通過葡聚糖基質相互結合。由於Fe2O3納米顆粒的細小尺寸,MACS顆粒具超順磁性,其總體直徑為50nm並且包含10%的磁性物質(重量/重量)。使用對應的要研究的分析物對MACS顆粒進行功能化,如對於EpCAM(CEA,VEGF)實驗,使用EpCam(CEA,VEGF)抗體對MACS顆粒進行功能化;對於生物素-鏈黴親和素實驗,使用鏈黴親和素對MACS顆粒進行功能化。
3.表面化學
首先使用丙酮、甲醇和異丙醇洗滌所述傳感器表面。隨後,所述傳感器被暴露於氧等離子體三分鐘。將2%(w/v)的聚烯丙基胺去離子水溶液塗覆於所述傳感器5分鐘。根據需要可使用其它溶液,例如但不限於,包括酐類、聚羧酸烯丙酯等在內的溶液。隨後使用去離子水洗滌晶片並且在150℃下烘烤45分鐘。對於羧化表面,隨後在室溫下將10%(w/v)的EDC溶液和10%(w/v)的NHS溶液加至所述傳感器表面1小時。捕獲蛋白(EpCAM(來自RD Systems的960-EP-050)、CEA(來自RD Systems的4128-CM-050)或VEGF(來自RD Systems的293-VE165)),或捕獲抗體(EpCAM的抗體(來自Abcam的ab20160或來自R&D的960)、CEA(來自BiosPacific的5910)或VEGF(來自Abcam的ab69479))以360皮升的液滴通過機器人加至各個傳感器上三次(總體積1鈉升)。為監測重現性,使用相同的捕獲蛋白對隨機分布於所述GMR傳感器陣列中的3至8個傳感器進行孵育。以類似的方式使用1mg/mL的BSA或非互補性抗體(一般為500μg/mL的抗生存素(survivin)抗體(H00000332-P01,來自Novus Biologicals,LLC))對對照傳感器進行固定化。使用1mg/mL的BSA的PBS溶液對所述傳感器陣列的整個表面進行30分鐘的封閉。
4.動力學分析
或者,所述動力學分析可如下進行建模:
在使用適當的捕獲蛋白對所述傳感器表面進行功能化之後,將GMR傳感器陣列置於測試器(test station)內並進行實時監測。洗去BSA封閉緩衝劑並將50μL的磁性標記的檢測抗體溶液(根據上文製備)加至反應孔內。在磁性標記的檢測抗體與對應蛋白質結合的時間裡對所述GMR傳感器陣列進行監測。可隨後對各個蛋白質所特有的結合曲線進行作圖並且可測定結合速率常數。所述分析進行5分鐘。
5.模型和擬合
兩分子相互作用以產生一種產物的過程可歸納為:
其中CS是溶液中處於所述表面附近的反應物濃度,L是處於所述表面上的配體或受體濃度,n是所述相互作用的產物的表面濃度。在簡單模型中,假定所述反應物中的至少一種是過量。但是,在本文所述的模型中,處於所述傳感器表面上的反應物受體並未受到補充。因此,L與n之和應等於L的原始濃度。
對於模型[L]0=[nmax],其中nmax受限於緊密堆積的MNP的最大濃度而非處於所述表面的分析物的最大濃度。使用GMR生物傳感器陣列監測在給定的時間與其目標結合的磁性標記的抗體數量n(t)。為對該相互作用的結合速率常數進行定量,通過假定反應物在體積V內和反應傳感器表面A內保持質量不變來導出分析模型。下文方程M1.1表達了所述溶液中被標記的抗體的變化速度,而方程M1.2表達了所述標記的抗體對所述傳感器表面的結合速度:
其中Cs是所述傳感器表面的磁性標籤化的抗體的濃度,C0是磁性標籤化抗體的本體濃度(bulk concentration),nmax是所述傳感器表面單位面積內的潛在結合位點的最大摩爾數,並且n是已經形成在所述傳感器上的被結合的MNP-抗體-抗原複合體的表面濃度。V是所述傳感器上的溶液體積,A是反應面積(在這種情況下是各傳感器的表面積)。此外,kon是結合速率常數,koff是解離速率常數。
該方程組可通過假定koff為零而進行簡化,這是因為抗體-抗原解離在本實驗的時間尺度內可忽略不計。因此,通過將簡化的方程M1.1和M1.2相加,所述守恆表達式如下:
假設邊界條件為t=0、n=0和Cs=C0,得Cs=C0-nA/V,因此
括號內的項分別表示本體反應物和有效表面位點的消耗。該方程具有方程M1.5的解析解,其精確地對觀察所得的結合動力學建立了模型。
<![CDATA[ n = C 0 V A 1 - e - k o n ( A / V ) ( C 0 ( V / A ) - n max ) t C 0 V n max A - e - k o n ( A / V ) ( C 0 ( V / A ) - n max ) t - - - ( M 1.5 ) ]]>
Cs是傳感器表面的磁性標籤化的抗體的濃度,C0是磁性標籤化抗體的本體濃度(bulk concentration),nmax是單位面積內的表面結合位點的最大摩爾數,並且n是已經形成在傳感器上的被結合的MNP-抗體-抗原複合體的表面濃度。V是傳感器上的溶液體積,並且A是所述反應面積(在這種情況下是各傳感器的表面積)。所述溶液具有V/A的比率,其被認為特徵性擴散高度。超過該特徵化高度之上的溶液中的任何物質應不會在所述實驗的時間範圍內結合所述傳感器。此外,kon是結合速率常數,koff是解離速率常數。
由於在體積和表面的動力學均被討論,不同的維度;因此n和nmax被表達為摩爾/cm2,而Cs和Co被表達為摩爾/cm3。通過以體積乘以所述溶液速度和以面積乘以所述表面速度,可在各個方程中以相同的單位表示結合速率常數(單位時間的摩爾數)。
存在四種擬合參數kon、C0、nmax和V/A(其為所述溶液的反應部分的有效厚度)。其中,kon和V/A是「全局擬合參數(global fitting parameter)」,其對於來自相同受體-分析物組對的所有的信號曲線是相同的;而nmax和C0是「局部擬合參數(local fitting parameter)」,其對於不同的信號曲線會有所不同,這是因為分析物的表面濃度或抗體-MNP複合體的溶液濃度在所有實驗中可能不是均勻的。
當C0V/A>>nmax時,所述分析模型化簡至所述Langmuir模型。
當假定在本實驗的時間尺度內koff可忽略不計時,該方程匹配所述Langmuir模型的解。上述方程與下文所述的方程M.25相同。
6.擬合誤差
擬合誤差如下進行定義:如果從一個晶片上測量了N個信號曲線,並且曲線j具有nj個數據點,並且如果設Di,j為曲線j中的第i個數據點,並且設Si,j為模擬曲線j的第i個數據點,則對於信號曲線j的擬合誤差為
其中Dmax,j是信號曲線的最大信號。通過該方式,將傳感器陣列中的各個實驗結合曲線與由該模型所預測的結合曲線進行了比較。隨後對該誤差進行最小化以獲得最佳擬合併計算kon。絕對誤差通過所述信號曲線的最大信號進行計量,因此所述擬合誤差是信號水平的百分比。因此,大信號曲線的基於百分比的相對擬合誤差與小信號曲線類似。總擬合誤差為:
該總擬合誤差在本文所提供的動力學數據的擬合中進行最小化。
7.傳統的二室模型
溶液中的配體與表面上的捕獲劑的結合動力學可以模化為二室反應。這使反應和傳輸動力學均得以被併入模型,其中所述表面區室中的可溶配體與所述表面通過結合和解離的化學過程進行反應(參見圖2),並且通過來自本體區室的擴散、流動和對流(convection)而逐步受到補充。在各區室之中,所述濃度被假定在空間內是均一的,但是可隨時間而變化。本體區室中的配體濃度C0被假定為恆定不變,而處於表面區室中的配體濃度Cs由於所述結合反應而被消耗,但是通過本體中的配體的擴散和表面結合複合體的解離而得到補充。該二室反應可被如下描述:
<![CDATA[ C 0 k M C s - - - ( M .4 ) ]]>
其中CS和C0是處於所述表面區室和本體區室中的磁性標籤化抗體的溶液濃度,R是固定化於所述表面的配體和受體的表面濃度(即,有效結合位點的表面密度),n是結合的MNP-抗體-抗原複合體的表面濃度,kM是擴散限制速率常數,kon和koff分別是結合和解離速率常數。CS和n的淨反應速度可通過以下方程組合進行定義:
由於在體積中和表面上均進行了動力學分析,因此R、n和nmax被表達為摩爾m-2,而CS和C0被表達為摩爾m-3。通過以表面區室體積V乘以溶液速度,並且以傳感器的面積A乘以表面速度,各個方程可以以相同的單位進行表示(摩爾/s)。處於時間t=0的起始條件為CS=C0和n=0。在釋放測量中,所有反應物被洗去,所以C0=0。
數值解法可被用於解方程M.6。表面等離子共振(SPR)的實驗設置限制了所述二室模型的簡化。使用SPR,所述可溶配體是非標記的(其導致快速擴散)並且其以高流速被引入所述反應表面。因此,所述物質傳輸限制的速率常數kM可在所觀測到的動力學相互作用中發揮主要作用。
8.具有解析解的經修正的二室模型
與SPR儀器運行呈對比,單孔GMR傳感器系統的實施方案利用了標記物以增強分子結合事件的信號並且在測量中無人為的流動(deliberate flow)。所述標記物的大小(如,46nm)和流動的缺乏顯著地降低了所述可溶配體在本體區室和表面區室之間擴散和對流的速度。如果擴散速度顯著地低於反應速度,傳統的二室模型有可能被化簡成為可進行解析求解的修正形式。
為驗證這一假設,使用數值解法對方程M.6和M.7進行求解以擬合EpCAM的實時結合數據(示於圖5(a))。我們的磁性標記抗體所得的kM為約1.0×10-4s-1。因此,根據圖13所示以及下段的解釋,可對結合速度、解離速度(假設koff對於大多數抗體處於1.0×10-6s-1的數量級)和擴散速度的貢獻進行作圖以確立方程M.6中各個組分的相對重要性。
通過速度方程M.6,所述方程右側各項被作為表面結合的EpCAM抗體-抗原複合體的數量n的函數進行作圖(圖13)。根據150個表面結合的MNP產生1ppm的MR信號的關係將歸一化的MR信號(單位是ppm)轉化成為n(單位是摩爾/μm2)(參見圖7)。在整個結合反應過程中,所述結合速度項與所述解離速度和擴散速度項相比均保持高出幾個數量級。因此,所述磁性納米顆粒標記物大到足夠顯著地減緩所述磁性標記的抗體向所述表面區室中的擴散。這暗示可溶抗體-MNP進入所述表面區室的再生過程可忽略不計(即,kM~0)。此外,圖13顯示在這些結合實驗中對koff可忽略不計的假設是有效的。但是,正如下文即將表明,koff在釋放動力學的測量中並非可忽略不計。
圖13示出了描述方程M.6中各項貢獻的對數圖,該方程是結合於所述傳感器表面的磁性標記抗體數量的函數。圖5(a)中所示的EpCAM結合實驗數據被用於對該圖的kon、koff和kM進行數值計算。x-軸表示在結合反應過程中結合於所述傳感器表面的磁性標記的抗體的表面濃度(圖中n值來自於實際實驗數據)。在n=0時所述實驗開始,並且在n~120摩爾/μm2時信號接近達到飽和或所述結合實驗結束。在整個結合反應過程中,所述結合速度項與所述解離速度和擴散速度項相比均保持高出幾個數量級。因此,對koff可忽略不計的假設是有效的(因為koff曲線遠低於kon曲線)。此外,所述磁性納米顆粒標記物大到足以僅僅允許磁性標記的抗體向所述反應區室的緩慢擴散(因為所述kM曲線遠遠低於所述kon曲線)。這暗示可溶抗體-MNP進入所述表面區室的遞送可忽略不計(即,kM約為零)。
由於所述表面區室中的MNP抗體並而受到來自主體區室的緩慢擴散的充分補充,因此質量平衡需要處於所述表面的溶液中未反應抗體-MNP濃度CS等於初始濃度C0減去產物形成所消耗的量nA與體積V的商,如:
類似地,質量平衡需要自由結合位點的表面濃度R等於其初始表面濃度R0與MNP-抗體-抗原複合體形成中所消耗的量之差。R0的量級必須略低於處於所述表面之上的緊密堆積的MNP的最大濃度,從而避免「親合力效應(avidity effect)」,在該效應中一個MNP與多個抗原結合。因此,R0被替代為抗原的最大沉積表面濃度nmax,如下所示:
R=R0-n=nmax-n (M.9)
因此,方程M.7化簡為:
此處括號內的兩項分別代表標籤化抗體在所述表面區室中的消耗以及有效表面結合位點的降低。方程M.7在此具有以下的分析解:
<![CDATA[ n = n max 1 - e - k o n ( C 0 - n m a x A / V ) t 1 - n max A C 0 V e - k o n ( C 0 - n max A / V ) t - - - ( M .11 ) ]]>
眾多可進行分析求解的動力學模型需要所述相互作用中的反應物之一保持過量以產生分析解。但是,根據方程M.11中的模型,兩種反應物在所述結合過程中可被顯著地耗盡。該模型的靈活性實現了更為一般化的實驗組合在不違背嚴格反應條件的情況下的實施。此外,多數動力學模型需要所述系統達到平衡以測定結合速率常數。但是,使用本文所示的模型,不是必須達到平衡並且所述結合速率常數可在5分鐘或更短時間內被測定,其遠在飽和之前。
所述分析模型中存在五個參數,kon、C0、nmax、V和A。在其中,kon、V和A對於所有曲線被固定為相同值,而在分析物表面濃度或抗體-MNP複合體的溶液濃度被改變的情況下nmax和C0會有所不同。
9.分析模型可化簡為Langmuir吸附
當C0V/A>>nmax時,對應於所述表面區室中可忽略的反應物損耗,方程M.10化簡為:
並且該分析模型化簡為Langmuir模型。因此,方程M.11化簡為:
結合koff可忽略不計的附加假設,該結果符合Langmuir結合動力學。我們的結合數據與Langmuir模型之間的比較示於圖14。分析模型的這一化簡形式方程M.13與下文所導出(方程M.14-25)並示於方程M.25中的Langmuir等溫線相同。
圖14示出了根據Langmuir吸附模型所預測的(虛線)和實驗測得的(實線)抗EpCAM抗體對表面固定化的EpCAM抗原的結合曲線。以2×的系列稀釋度將EpCAM蛋白的表面覆蓋從5阿摩爾(對應於nmax)稀釋降至19.5仄摩爾(對應於nmax/256)。根據所述疊置圖,所述Langmuir吸附模型並未充分描述所述GMR傳感器對於測試的濃度組所觀察到的實時結合動力學。因此,產生了新的模型從而對觀察到的所述結合動力學進行更好地描述。本文所示的分析模型包含用於解釋信號的快速開始和較緩慢持續升高的附加項。
所述Langmuir等溫線在固定的溫度下使固體表面的分子覆蓋或吸附關聯於所述表面上方的介質濃度。可通過考慮表面配體L、懸浮於所述介質中的標記分子C以及吸附分子複合體CL而導出所述Langmuir方程,隨後所述吸附過程可被表示為
所述結合速度Ra和解離速度Rd分別為,
Ra=kon[C][L] (M.15)
Rd=koff[CL] (M.16)
其中kon和koff是結合速率常數和解離速率常數,並且方括號表示濃度。
如果總有效配體濃度為[Lmax],並且吸附分子的歸一化表面覆蓋為θ,則
[L]+[CL]=[Lmax] (M.17)
θ=[CL]/[Lmax] (M.18)
因此,[L]如下:
[L]=(1-θ)[Lmax] (M.19)
將方程M.19和M.18分別代入方程M.15和M.16,可得如下:
Ra=kon(1-θ)[Lmax][C] (M.20)
Rd=koffθ[Lmax] (M.21)
假定koff在本實驗的時間尺度內可忽略不計,並對Ra求解,得出:
<![CDATA[ R a = d C L d t = k o n ( 1 - θ ) L m a x C - - - ( M .22 ) ]]>
<![CDATA[ d C L d t = k o n ( L m a x - C L ) C - - - ( M .23 ) ]]>
<![CDATA[ d C L L max - C L = k o n C d t - - - ( M .24 ) ]]>
假定[C]不依賴于于時間並且[Lmax]不依賴於[CL],並且通過分部積分進行求解,其解如下:
<![CDATA[ C L = L max ( 1 - e - k o n C t ) - - - ( M .25 ) ]]>
10.釋放動力學模型:
抗體以極高的親和性結合其目標。因此,所述解離速率常數一般較小,其需要更長的時間(如,分鐘)以觀測到這種釋放現象。此外,由於抗體的活動性,使用競爭抑制來監測釋放動力學。通過在溶液中置入高濃度的目標,可觀測到所述釋放動力學更為精確的測量。
抗體釋放速度的速度方程可如下列出:
因此,加入所述釋放溶液之後在時間t的表面結合MNP-抗體濃度為:
nRelease(t)=nmax e-kofft (M.28)
其中是n0為傳感器表面的初始吸附MNP-抗體濃度。
B.結果與討論
提供了測量結合動力學方法,所述方法使用可各自獨立尋址的磁性響應的納米傳感器同時地監測多種不同蛋白質的動力學,所述不同蛋白質與固定化於傳感器表面的標靶結合。這些磁性納米傳感器被成功地擴展至每1mm2晶片面積超過1,000個傳感器。展示了分析物的表位分布並且對溶液中的蛋白質擴散的空間動力學進行了可視化。結合這些實驗,可產生對標記的蛋白質與表面固定化的蛋白質的實時結合進行精確描述的分析動力學模型。所述分析模型與使用表面等離子共振進行的類似實驗以及來自文獻的數據具有緊密的一致性。該模型可以20仄摩爾(20×10-21)或更低溶質的敏感度應用於抗體-抗原結合。
1.GMR傳感器
使用磁性納米顆粒(MNP)對可溶配體進行預標記以監測配體與固定於所述傳感器表面的抗原的複合體的實時結合動力學(圖4(a))。在所述複合體被捕獲的實時過程中,來自所述抗體-MNP複合體的磁場誘導其下的GMR傳感器的電阻變化。由於所述GMR傳感器陣列的快速實時讀出,所述結合動力學被監測並且定量以測定結合速率常數。
根據TEM分析所測定,對目標蛋白質或抗體進行標記的MNP是包埋於葡聚糖聚合物中的12個10nm的氧化鐵核(圖4(b))。整個納米顆粒平均直徑46±13nm(根據動態光散射測量的數值)。根據斯託克斯-愛因斯坦關係(Stokes-Einstein relation),這些顆粒具有約8.56×10-12m2s-1的平動擴散係數。所述MNP具有-11mV的電動電位。這些顆粒是超順磁性的並且是膠體穩定的,因此它們在所述反應期間並不聚集或沉澱。此外,所述GMR傳感器以來自所述磁性標籤的偶極場的基於接近度的檢測器的形式運行;因此僅檢測傳感器表面的150nm以內的標籤。因此,未結合的MNP標籤在缺乏結合的情況下貢獻可忽略的信號。僅僅被結合的磁性標記的抗體可被其下的GMR傳感器測出,這使得這種MNP-GMR納米傳感器可用於實時動力學分析。
GMR傳感器陣列被製造成在1mm2晶片表面積上有1,008個傳感器(圖4(c))。所計算出的特徵密度為每cm2超過100,000個GMR傳感器。所述傳感器陣列被設計為亞陣列組的形式,其中各亞陣列佔據90μm×90μm的面積(圖4(d))。所述傳感器陣列適配於自動點樣儀(robotic spotters)。亞陣列中的各個傳感器通過行列解碼器經由使用VLSI技術製造的共享6-位控制總線進行可各自獨立地尋址。所述GMR傳感器陣列允許蛋白質結合動力學的平行多元監測。
圖12中示出了所述GMR傳感器的另一個實施方案。在圖12中,12個延伸的線性磁性傳感器段被以並聯的方式連接在一起,並且6組這樣的並聯段被以串聯的方連接在一起,其給出了具有總計72個磁性傳感器段的磁性傳感器。所述磁性傳感器為100μm×100μm。各個磁性傳感器段為750nm寬,20nm厚和100μm長。圖12中的插圖示出了與磁性傳感器段結合的納米顆粒的SEM圖像。
2.結合動力學模型:
根據上文描述,產生了能夠擬合實施結合動力學數據從而使技術人員能夠計算結合速率常數(kon)和解離速率常數(koff)的分析模型。
所述結合反應是二步過程,其中本體溶液中的抗體首先通過擴散和流動接近被表面捕獲的抗原,並且隨後通過結合與解離的化學過程與表面結合的標靶結合或從其上逃逸。如果本體體溶液中的抗體濃度在空間上是均一的,則
其中Cs是位於所述傳感器表面的磁性標記的抗體的濃度,C0是磁性標籤化的抗體的初始本體濃度,並且n是被結合的MNP-抗體-抗原複合體的表面濃度。V是參與所述結合反應之中的傳感器上的溶液體積,A是所述反應面積(在本情況下是一個傳感器的表面積)。根據簡單動力學,所述表面反應被描述如下:
括號內的兩項分別對應本體反應物和有效的表面位點,nmax是傳感器表面的潛在結合位點的濃度,kon是結合反應的結合速率常數,並且koff是結合反應的解離速率常數。在討論體積和表面濃度之時,n和nmax被表達為摩爾m-2,而Cs和C0被表達為摩爾m-3。注意nmax由緊密堆積的MNP最大濃度限定,而不是由表面上的分析物的最大濃度限定。因此,為排除與MNP在所述傳感器表面的聚集相關的空間效應,受測的最高分析物表面濃度至多為緊密堆積的抗體-MNP複合體表面濃度的十分之一。
該方程可通過假定koff為零而進行簡化,這是因為抗體-抗原解離在本實驗的時間尺度內可忽略不計。方程2在此具有以下的分析解:
<![CDATA[ n = n max 1 - e - k o n ( C 0 - n m a x A / V ) t 1 - n max A C 0 V e - k o n ( C 0 - n max A / V ) t - - - ( 3 ) ]]>
如果C0V>>nmaxA,這暗示超過有效表面位點的過量溶液分子,則所述動力學遵循Langmuir吸附。然而,當不處於該情況之時,所述溶液的反應物被顯著消耗,尤其是接近所述傳感器表面,因此反應速度將由於後續反應物在反應前需要進行跨宏觀距離(~V/A)的擴散而被減緩(特別是對於標記的分子)。通過定義參與所述結合反應的流體厚度,即可用於結合所述表面的溶液區室,而將這一特徵擴散距離V/A計入該動力學模型之中。超過所述特徵V/A高度的任何溶質在相關時間範圍內可能未在所述結合反應中有所貢獻。
C.實驗結果
為檢驗該解析解,使用上述模型測定了上皮細胞粘附分子(EpCAM)抗體-抗原結合動力學並將所述實驗結果與文獻進行了比較。
結合於傳感器的分子的改變濃度
在圖5所示的第一組實驗中,進行了MNP標記的抗EpCAM抗體與表面結合的EpCAM蛋白質的結合分析。所述模型中的是C0、nmax和V/A是根據尺寸和濃度所確定的固定值,並且通過以所述動力學模型所預測的結合曲線對實驗數據進行的最佳擬合來確定kon。進行了固定濃度的MNP-抗EpCAM抗體對改變濃度的表面結合EpCAM蛋白的結合分析。使用二倍稀釋以製備一系列的傳感器表面;其起始於5阿摩爾EpCAM蛋白的加載量(例如,結合於所述傳感器表面並且具功能的蛋白質的量)並且進行依次稀釋低至20仄摩爾。在結合曲線間變化的唯一參數是nmax,所有其它參數都是不變的。當使這一參數在所述模型中變化時,各實驗結合曲線被精確地擬合(圖5(a))。所述參數的數值為(未經稀釋)nmax=9.5×10-10mol m-2,C0=6.8×10-7M,A=5.4×10-9m2以及V=5.5×10-12m3。因此,kon=2.5×104M-1s-1對所述數據進行了最佳擬合。本實驗中的全部曲線對通過所述模型所預測的曲線的擬合誤差為R2=0.98。此外,在將所述MNP-抗體溶液洗去並用抗原加載緩衝液替換之後,通過將隨後的數據對基本指數衰減模型進行擬合而計算解離速率常數,nRelease(t)=nmaxe-koff(t),其中n0是結合MNP在洗滌時的表面濃度。因此,所述抗EpCAM抗體-抗原解離速率常數koff被測定為2.0×10-6s-1。這證實了上文對於koff與kon相比較時可忽略不計的假設。
分析混合物中的改變濃度的分析物
在圖5(b)所示的第二組實驗中,使用833仄摩爾的EpCAM蛋白的恆定加載量((圖5a)所使用的最大量的1/6)對各個傳感器進行固定化。塗覆於所述傳感器的抗體-MNP複合體的濃度在未稀釋、兩倍稀釋和八倍稀釋的抗體-MNP複合體溶液之間變動(對應於所述模型中的C0、C0/2和C0/8)。由於無論C0被改變還是nmax被改變,抗體-抗原相互作用均保持相同,描述以上相互作用的速率常數在這些實驗中保持相同。在對模型的擬合之中,獲得了2.5×104M-1s-1的相同kon,這支持了所述分析模型的有效性。全部曲線對通過所述模型的擬合誤差為R2=0.96。這些結果處於文獻所報導的正常範圍之內,這證實了所述動力學模型對於預測結合的有效性以及所產生的結果的精確度(參見表1)
為對MNP-抗癌胚抗原(CEA)抗體與CEA的結合動力學,MNP-抗血管內皮生長因子(VEGF)抗體與VEGF的結合動力學,以及MNP-鏈黴親和素與生物素的結合動力學進行定量而進行了類似的實時實驗(圖6(a)和6(d))。對於抗-CEA抗體,在GMR傳感器和SPR儀器上均使用相同的試劑對結合和解離速率常數進行了監測並對結果進行了比較(圖6(c)和6(d))。
圖6(a)所示為在12組重複傳感器上的抗CEA抗體對抗原的多元動力學分析以及在3組重複傳感器上的抗VEGF抗體對抗原的多種動力學分析圖。CEA抗體-抗原的kon為3.3×104M-1s-1,其平均擬合誤差為2.8%,並且VEGF抗體-抗原的kon為1.6×104M-1s-1,其平均擬合誤差為8.2%。圖6(b)示出了監測生物素對鏈黴親和素的結合動力學的25組重複傳感器示圖。kon為4.67×106M-1s-1,其平均擬合誤差為1.6%。還是用競爭生物素分析監測了釋放動力學。圖6(c)示出了SPR圖並且圖6(d)示出了基於磁納米傳感器的平臺,當在平行實驗中監測CEA抗體與CEA抗原結合的動力學時所述平臺提供了類似的實時結合曲線。GMR生物傳感器提供了5.0×104M-1s-1的kon以及4.4×10-4s-1的koff,而SPR實驗產生了5.2×104M-1s-1的kon以及3.03×10-4s-1的koff。SPR的動態範圍低於兩個數量級,而所述GMR傳感器具有4個數量級或更大的動態範圍。GMR傳感器的動態範圍可使用更高的溶質濃度而進一步提高。在圖6(d)中,所述結合曲線的最初1000秒被用於獲得根據所述分析模型的kon值。
所述GMR傳感器陣列和SPR測量產生了相互一致的動力學速率常數並且一致於文獻所報導的數值(表1),這表明當使用本文給出的分析模型之時所述MNP標記對於所測得的速率常數基本無影響。
表1
表1示出了當使用所述GMR傳感器陣列和SPR之時,對生物素與鏈黴親和素結合的結合速率常數、EpCAM抗原與EpCAM抗體的結合速率常數、CEA抗原與CEA抗體的結合速率常數以及VEGF抗原與VEGF抗體的結合速率常數的比較。對於SPR和GMR傳感器實驗均使用了相同的抗體對。動力學分析的兩種方法均與文獻相一致。
與傳感器結合的磁性標籤數量的定量
掃描電子顯微鏡(SEM)證實,所述分析系統能夠對各個傳感器之上所捕獲的蛋白質數量進行定量。因此,通過將所述GMR信號對結合於所述傳感器表面的磁性標籤的絕對數量進行校準而獲得了所結合的蛋白質的量和每MNP所產生的信號。例如,在三至八組重複傳感器上,EpCAM蛋白從2.5阿摩爾開始被以兩倍的降幅進行系列稀釋直至78仄摩爾。向全部傳感器添加20倍稀釋度的MNP-抗體複合體並監測所述結合動力學。在20分鐘的孵育時間之後,洗去磁性標記的抗體的溶液以終止所述結合反應,在該點通過SEM對具有各個表面濃度的傳感器進行成像(圖7)。通過對所述實時實驗數據進行歸一化並且將其對所述模型進行擬合,以對所述初始MR(ΔMR/MR0)進行歸一化的MR形式測得的傳感器信號被轉換成為與各傳感器結合的磁性標籤的數量。例如,使用2.5阿摩爾的EpCAM蛋白進行功能化的傳感器在所述實驗時間內捕獲了192,000個磁性標籤。SEM成像顯示所述實驗結果符合所述動力學模型。因此,所述動力學模型可被用於對各傳感器所結合的標籤數量以及給定反應期間結合的蛋白質數量進行定量。
使用該模型,每150個MNP產生1ppm的信號。所述傳感器的檢測下限(LOD)約為20ppm(通過經非互補抗體包埋的傳感器的平均背景信號加上兩倍標準差所定義)。因此,可檢測0.6顆粒/μm2或者更低。
此外,所述模型能夠解釋所述傳感器表面將在何時發生飽和。隨著提高分析物的加載量以使蛋白質的表面濃度接近所述傳感器表面的最大MACS濃度,可在所述信號中觀察到飽和。該飽和在5阿摩爾或更高的加載量下發生。所述加載量通過將已知濃度和體積的蛋白質沉積於所述傳感器表面而進行計算。在洗去所述未反應蛋白質之後,使用納米顆粒對結合蛋白質的量進行標記。通過掃描電子顯微鏡對具活性的並且被結合的蛋白質的數量進行定量。在5阿摩爾或更高的加載量下,納米顆粒間的空間效應變得明顯。在全部實驗中使用了5阿摩爾或更低的加載量。當在傳感器表面沉積低蛋白質濃度時,所述傳感器表面的結合蛋白質的距離將超過1個MNP直徑,由此防止了各個納米顆粒結合超過一個抗原。例如,在所檢測的最高加載量5阿摩爾下,所述傳感器表面的平均距離約為60nm。由於所述MNP直徑僅為46nm,單一MNP結合極不可能同時結合超過一個被結合蛋白。因此,親合力(例如,兩個或更多個分子之間的多重結合相互作用的組合強度)基本可忽略不計。例如,當在傳感器表面沉積10阿摩爾蛋白質時,實驗中顯現當與5阿摩爾和更低量的信號相比所述傳感器表面接近飽和(圖8)。通過所述模型,10阿摩爾的加載量據描述相當於nmax等於1.95×10-9mol m-2。當將所述模型預測的這一飽和值與所述傳感器的物理限制和緊密堆積的MNP幾何形狀進行比較時,這些數據緊密吻合。單層中受限於MNP大小的蛋白質最大表面濃度為1.0×10-9摩爾m-2。
表位定位
使用本文所述的實時結合分析和動力學模型進行表位定位實驗。將一組不同的抗EpCAM單克隆抗體固定於所述GMR傳感器。使用抗EGFR抗體進行功能化的傳感器作為內部對照被包含在內。隨後將EpCAM加入溶液中並且對以獨特的結構在各個捕獲抗體上被捕獲。隨後加入EGFR蛋白。如果所述捕獲的EpCAM暴露出EGF樣重複,則EGFR能夠進行結合。然而,如果所述捕獲的EpCAM蛋白以遮蔽所述EGF樣重複的方式取向,則EGFR不能進行結合(圖9(a))。
圖9(b)顯示,抗EpCAM抗體#1結合EpCAM蛋白以暴露所述EGF樣結構域;然而,EpCAM-抗-EpCAM抗體#2複合體遮藏了所述EGF樣結構域。使用特異於EpCAM的獨特表位的單克隆抗EpCAM抗體對抗EpCAM Ab#1傳感器和抗EpCAM Ab#2傳感器進行功能化。當EpCAM結合抗EpCAM抗體#1時,EGF樣結構域被暴露並且抗EGFR抗體-MNP複合體能夠進行結合。然而,當被捕獲的EpCAM蛋白結合於抗EpCAM抗體#2時,EGF樣結構域未被暴露並且不發生結合。
當將所述抗EGFR抗體-MNP複合體與由EpCAM或由EGFR捕獲抗體所捕獲的EGFR蛋白的結合曲線進行歸一化時,所述歸一化結合曲線顯示結合的動力學相同(圖9(c))。即使各個傳感器上的大分子結構配製有所不同,所述動力學相互作用仍然相同。在圖9(c)中所述結合曲線被歸一化。由於兩曲線遵循相同的結合軌跡,這兩個實驗所涉及的動力學相互作用相同。
分子結合相互作用的空間和時間監測
使用所述實時結合分析進行的另一個實驗是在空間(由於所述陣列結構的高密度)和時間(由於迅速和實時的讀出)上對蛋白質結合事件進行監測。單克隆抗CEA捕獲抗體被結合於傳感器陣列。在遞送所述CEA抗原蛋白質之前,將溶液中以抗CEA抗體標記的磁性標籤在所述傳感器陣列之上進行孵育。將CEA抗原注入所述陣列,並且當的磁性標記的檢測抗原與被捕獲的CEA抗原蛋白質結合時,對CEA抗原在所述陣列上的擴散進行監測。CEA抗原蛋白與所述傳感器表面的結合以及隨後磁性標記的抗體的結合沿著空間分布的傳感器產生MR信號的變化。通過觀測所述MNP-抗-CEA抗體與所述結合於傳感器的CEA抗原的結合動力學而對CEA抗原與所述傳感器的結合進行了可視化(圖10和圖11(a)和11(b))。對四個四磁性傳感器組檢測了所述信號隨時間的變化(圖11(a)和11(b))。以高空間和時間解析度對蛋白質結合事件、蛋白質擴散和蛋白質動力學進行了分析。可通過使用蛋白質擴散模型擬合不同傳感器位點的MR信號的時間過程而產生傳輸參數,諸如被注入蛋白質的擴散率。
實驗結果顯示,本文公開的實時磁性傳感器裝置是用於檢測蛋白質-蛋白質相互作用的高通量、高敏感度、實時的結合分析。以上產生的動力學模型提供了參與標記蛋白質-蛋白質相互作用的主要過程的分析模型。所述實時分析結合分析和分析模型被用於測量蛋白質結合速率常數以及對結合於給定傳感器的蛋白質數量進行精確定量。還進行了蛋白質表位定位實驗和蛋白質擴散實驗。
儘管通過說明和實施例已經對前述發明進行了以明確和了解為目的的一定細節的描述,本領域的技術人員通過本發明的指導易於了解,在不背離由附屬權利要求書精神和範圍的前提下可以作出特定改變和修改。
因此,前文僅僅是對本發明的原理的說明。應當了解,本領域的技術人員應能夠設計多種裝置,儘管未在本文明確描述或展示,所述裝置具體實施了本發明的原理並且被包含於本發明的精神和範圍之內。此外,本文描述的全部實施例和和條件性語言主要意在用於幫助讀者理解本發明的原理以及發明人在現有技術基礎上作出的構思,並且不應解釋為對具體描述的實施例和條件的限制。進一步,描述本發明原理、方面和實施方案的本文全部申明及其具體的實施例被用於涵蓋其結構上的和功能上的等價物。此外,這些等價物被預期包含當前已知的等價物和未來所開發出的等價物,即,被開發的實施相同功能的任意元件,無論其結構如何。因此,本發明的範圍並不意在受限於本文所展示和描述的示例性的實施方案。更確切而言,本發明的範圍和精神由附屬權利要求書所具體規定。
