轉錄因子組合誘導成纖維細胞轉分化為類睪丸間質細胞的方法與流程
2023-05-30 22:34:12
本發明屬生物醫學領域,涉及細胞轉分化的過程及其用途,具體涉及利用慢病毒載體表達多種轉錄因子誘導成纖維細胞轉分化為具有雄激素合成分泌功能的類睪丸間質細胞的方法,同時利用這種類睪丸間質細胞移植到雄性睪丸間質內,為治療雄性性腺機能減退症候群提供新的治療方法。
背景技術:
睪丸間質細胞是雄性個體睪酮的主要來源,對雄性精子發生、性別分化和第二性徵的發育和維持起著至關重要的作用。睪丸間質細胞合成睪酮能力在青春期後隨著年齡的增長而逐漸下降。與此同時,環境汙染、生活節奏的加快、和人口老齡化等因素使得睪丸間質細胞自身功能障礙引發的雄激素不足或缺乏症,即性腺機能減退(hypogonadism)的發病率逐年升高。傳統的雄性激素進行替代治療對性腺機能減退有一定的作用,但這種治療要持續終身,副作用十分顯著,容易出現肝臟功能損害、精子生成減少、前列腺癌等併發症,有副作用的同時還給患者帶來極大的經濟壓力(Wang等,J.Androl.,2009,32(1):1-10;Chen等,Endocrindogy,2002,143(5):1637-1642)。
隨著組織工程技術的發展,國內外專家嘗試開展了近親供體移植術或幹細胞移植術治療性腺機能減退,取得了較好的效果。但睪丸間質細胞僅存於睪丸,數量有限(僅佔睪丸細胞總量的2-5%),雖然對睪丸間質細胞已經有了較為成熟的分離方法,但分離過程中的細胞損失不可避免,且成年睪丸間質細胞不能再進行有絲分裂,未成熟的睪丸間質細胞在後續培養中又會失去其分裂特性,這些因素加劇了睪丸間質種子細胞的稀缺。此外,這種移植普遍依靠同種異體供應,患者術後需要長期服用免疫抑制劑,副作用大的同時還承受著一系列倫理學爭議,極大地限制了該技術在臨床上的廣泛應用。
儘管間充質幹細胞或胚胎幹細胞也可用於誘導分化為能產生類固醇的類睪丸間質細胞,但要將這些細胞用於臨床研究仍然存在著以下幾方面的缺陷:(1)誘導幹細胞或者iPSCs(induced pluripotent stem cells,即,誘導的多能幹細胞)分化為睪丸間質細胞的分化效率和純度都很低,且得到的細胞生成類固醇的能力非常有限;(2)胚胎幹細胞面臨免疫排斥、倫理道德問題及植入部位形成畸胎瘤風險;(3)間充質幹細胞表型不均一,其鑑定無明確標準,分離純化及大量擴增面臨技術困難;(4)雖然iPSCs規避了胚胎幹細胞帶來的倫理問題,但是其來源的可靠性和技術安全性仍是臨床應用中所面臨的最大障礙。
成體細胞轉分化技術與幹細胞定向分化技術相比具有誘導時間短,誘導效率高,細胞致瘤性低,且轉分化過程不需要依賴於細胞的分裂等明顯的優勢,因而被認為是未來人類再生醫學的重要的技術手段。該技術能直接將體細胞轉分化為其它類型細胞,為再生醫學提供了極其寶貴的資源,它使得用非胚胎材料獲得病人特異的任何譜系的細胞成為可能。近年來已經有研究表明,轉錄因子能被誘導成纖維細胞轉分化多種類型的細胞,包括心肌細胞、神經細胞、肝樣細胞、軟骨細胞等,這些都充分體現了轉分化技術在再生醫學領域的巨大潛能。如果能將成纖維細胞轉分化為具雄激素合成和分泌功能的類睪丸間質細胞,則可同時解決臨床細胞治療中睪丸間質細胞移植種子細胞來源不足以及免疫排斥兩個實際問題。這是目前本領域研究的焦點。但是,目前還沒有關於利用何種轉錄因子或轉錄因子組合能夠誘導類睪丸間質細胞的相關報導。
技術實現要素:
鑑於現有技術的缺點,本發明主要解決的技術問題是提供一種利用轉錄因子組合誘導成纖維細胞轉分化為類睪丸間質細胞的方法。通過該方法獲得的類睪丸間質細胞(Induced Leydig-like cells,iLCs)可用於治療雄性性腺機能缺乏症候群。
在第一方面,本發明提供一種利用轉錄因子組合誘導成纖維細胞轉分化為類睪丸間質細胞的方法,所述方法包括將所需轉錄因子分別克隆至慢病毒載體,包裝成病毒顆粒並轉染至成纖維細胞;利用過表達轉錄因子的方法誘導成纖維細胞轉分化為誘導型睪丸間質細胞。
本領域技術人員應該理解,用於本發明的成纖維細胞可以從相應地動物或人體中提取(主要是胚胎成纖維細胞和成體成纖維細胞),或者通過基因工程方法誘導胚胎幹細胞或者iPSCs分化所得的成纖維細胞(Yang Y,et al.Stem cells and development,2015,24(4):459-70;Sonoyama T,et al.Endocrinology,2012,153(9):4336-45)。可用的成纖維細胞可以來源於皮膚,例如鼠尾或者人皮膚的成纖維細胞,也可以是內臟成纖維細胞(例如,心臟等的成纖維細胞)或者是胚胎成纖維細胞。
用於本發明的轉錄因子可以從相應的動物或者人體細胞中提取,來源可以包括,但不限於,人、小鼠和大鼠。而這些轉錄因子的核苷酸序列可以按照Itatura等人所述的方法(Science,1977,198:1056-1063)來合成,也可以利用本領域已知的技術從宿主基因組中獲得和鑑定基因。本領域已知的技術包括進行基因的合成、克隆和表達載體的構建、DNA序列分析及鑑定、宿主細胞的轉化和培養以及表達產物的分離鑑定等操作(參見Sambrook et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY,1989)。
用於本發明的轉錄因子選自Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1或Gata4。優選地,用於本發明的轉錄因子是選自由Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4組成的組中的部分或全部轉錄因子的組合。所述轉錄因子組合可以為Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4的組合;Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Nr5a1和Gata4的組合;Dmrt1、Sp1、Wt1、AP1、Nr5a1和Gata4的組合;Dmrtl、Wt1、AP1、Nr5a1和Gata4的組合;Dmrt1、Sp1、Wt1、Nr5a1和Gata4的組合;Dmrt1、Sp1、AP1、Nr5a1和Gata4的組合;Dmrt1、Nr5a1、Gata4和Wt1的組合或者Nr5a1、Gata4、Dmrt1和AP1的組合;或Dmrt1、Gata4和Nr5a1的組合。
最優的轉錄因子組合為Dmrt1、Nr5a1和Gata4的組合;其次是Dmrt1、Nr5a1、Gata4和Wt1的組合或者Nr5a1、Gata4、Dmrt1和AP1的組合;再次是Dmrt1、Sp1、Wt1、AP1、Nr5a1和Gata4;最後為11種因子的組合,即Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4的組合。
本發明中所述的轉錄因子Dmrt1(Doublesex and Mab-3Related Transcription factor 1)核苷酸序列為SEQ ID Nos:1-3;
本發明中所述的轉錄因子Nr0b1(nuclear receptor subfamily 0group B member 1)核苷酸序列為SEQ ID Nos:4-6;
本發明中所述的轉錄因子Sp1(transcription factor Sp1)核苷酸序列為SEQ ID Nos:7-9;
本發明中所述的轉錄因子Wt1(Wilms tumor 1)核苷酸序列為SEQ ID No:10-12s;
本發明中所述的轉錄因子Nr4a1(nuclear receptor subfamily 4group A member 1)核苷酸序列為SEQ ID Nos:13-15;
本發明中所述的轉錄因子Nr5a2(nuclear receptor subfamily 4group A member2)核苷酸序列為SEQ ID Nos:16-18;
本發明中所述的轉錄因子AP1(Jun proto-oncogene)核苷酸序列為SEQ ID Nos:19-21;
本發明中所述的轉錄因子Creb1(cAMP responsive element binding protein 1)核苷酸序列為SEQ ID Nos:22-24;
本發明中所述的轉錄因子Smad3(SMAD family member 3)核苷酸序列為SEQ ID Nos:25-27;
本發明中所述的轉錄因子Nr5a1(nuclear receptor subfamily 5,group A,member 1)核苷酸序列為SEQ ID Nos:28-30;
本發明中所述的轉錄因子Gata4(GATA binding protein 4)核苷酸序列為SEQ ID Nos:31-33。
在優選的實施方案中,本發明涉及一種利用轉錄因子組合誘導成纖維細胞轉分化為類睪丸間質細胞的方法,該方法包括以下步驟:
1)分離並純化用於病毒載體感染的成纖維細胞;這些成纖維細胞可以來源於皮膚(鼠尾或者人皮膚)、內臟成纖維細胞(心臟等)或者胚胎成纖維細胞;
2)獲得用於成纖維細胞轉分化為類睪丸間質細胞的11種轉錄因子的核苷酸序列,並分別克隆到慢病毒表達載體pLVX-EF1α-IRES-ZsGreen1(Cat:#631982,Clonetch,大連寶生物工程有限公司,中國),該重組載體可以表達綠色螢光作為報告基因;
3)將11種表達轉錄因子的慢病毒載體分別轉染293T細胞(Cat:#632180,Clonetch,大連寶生物工程有限公司,中國)中,獲得完整包裝的病毒顆粒;
4)構建表達櫻桃紅螢光報告蛋白(cherry)的小鼠胚胎成纖維細胞株;首先利用鏈式聚合酶反應(PCR)獲得膽固醇側鏈裂解酶基因cyp11a1(cytochrome P450,family 11,subfamily a,polypeptide 1)的啟動子序列和編碼櫻桃紅螢光報告蛋白基因的融合DNA片段(SEQ ID No:34),並將其克隆到慢病毒載體(pEZX-LvPM02,購自GeneCopoeia Inc.,USA)中;獲得完整包裝的病毒顆粒後,轉染成纖維細胞,利用嘌呤黴素篩選1周後,挑選陽性克隆並用常規的細胞培養方法獲得含報告基因的成纖維細胞株;
5)將3)獲得的包裝完整的11種表達轉錄因子的慢病毒顆粒,等量同時轉染4)種獲得的含報告基因的成纖維細胞株;培養3-7天後,利用流式細胞儀分析表達紅色螢光陽性細胞的百分比,並利用I-125放射性酶聯免疫方法檢測培養細胞上清中睪酮的含量;
6)將3)獲得的包裝完整的11種表達轉錄因子的慢病毒顆粒,組成11種轉錄因子組合,每個組合內分別含有10種轉錄因子(即每種組合缺失一種不同的轉錄因子);將這些轉錄因子組合,按照5)所述的方法感染含報告基因的成纖維細胞,然後分析表達紅色螢光的陽性細胞的百分比及細胞上清中睪酮的含量;將這些數據與5)中獲得的數據進行對比和統計分析;對於存在顯著差異的結果則表明,缺失的轉錄因子在成纖維細胞轉分化為類睪丸間質細胞過程中具有重要的調控作用;
7)將6)中沒有顯著差異調控作用的轉錄因子排除(共有5種),然後將剩餘的轉錄因子重新組合(共6種),然後按照6)的方法繼續篩選,以睪酮產量作為分析指標,最終獲得合成和分泌睪酮量最高的轉錄因子組合;
8)按照7)所述的方法,最優的轉錄因子組合為Dmrt1、Nr5a1和Gata4;其次是Dmrt1、Nr5a1、Gata4、Dmrt1和Wt1或者Nr5a1、Gata4、Dmrt1和AP1;再次是Nr5a1、Gata4、Dmrt1、Sp1、Wt1和AP1;最後為11種因子組合Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4;
9)按照5)的方法,將最優的轉錄因子組合轉染按1)方法分離得到成纖維細胞,再培養3-10天,利用分子生物學方法,如實時螢光定量PCR、蛋白雜交、基因晶片等,檢測這些轉分化細胞中睪酮合成和分泌通路中各必需基因及蛋白的表達情況,並利用I-125放射性酶聯免疫方法檢測培養細胞上清中睪酮的產量;
10)將轉分化後的細胞用於治療雄性性腺機能低下相關疾病。
本領域技術人員應該理解,可以將用來誘導成纖維細胞轉分化為類睪丸間質細胞的試劑包裝成試劑盒。因此,在本發明第二方面,本發明還提供一種用於誘導成纖維細胞轉分化為類睪丸間質的試劑盒,所述試劑盒包括用於獲得成纖維細胞的試劑、慢病毒載體和轉錄因子的組合。其中所述轉錄因子來源於人、小鼠或大鼠,並且所述轉錄因子的組合為選自由Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4組成的組中的部分或全部轉錄因子的組合。對於轉錄因子的組合的選擇與上述誘導成纖維細胞轉分化為類睪丸間質的方法對於轉錄因子組合的選擇相同。所用的成纖維細胞為胚胎成纖維細胞、內臟成纖維細胞或皮膚成纖維細胞。
在第三方面,本發明提供由本發明第一方面的方法誘導分化的類睪丸間質細胞,所述類睪丸間質細胞可以用於治療雄性性腺機能缺乏症候群。
在第四方面,本發明提供由本發明第一方面的方法誘導分化的類睪丸間質細胞在製備用於治療雄性性腺機能缺乏症候群的試劑盒中的應用。
在第五方面,本發明提供一種治療雄性性腺機能缺乏症候群的方法,所述方法包括向有此需要的患者的兩側睪丸的睪丸間質內注射有效量的由本發明第一方面的方法誘導分化的類睪丸間質細胞。
在第六方面,本發明提供一種用於治療雄性性腺機能缺乏症候群的試劑盒,所述試劑盒包括由本發明第一方面的方法誘導分化的類睪丸間質細胞。
睪丸間質細胞(Leydig cell,LC)是哺乳動物睪丸間質中最主要的一種細胞,是雄性體內雄激素合成和分泌的最主要來源。已有研究顯示,睪丸間質細胞的增殖分化異常、數量減少及激素合成分泌功能減退都會導致體內雄激素缺乏,進而引起多種雄性生殖疾病的發生。
所述的雄性性腺機能低下症候群包括,但不限於先天性性腺機能減退、衰老所致性腺機能減退、及睪丸間質細胞損傷而造成的性腺機能低下。
利用轉分化的類睪丸間質細胞治療雄性性腺機能缺乏症候群的步驟如下:
1)利用流式細胞儀將轉分化的類睪丸間質細胞分選出來並擴大培養;
2)將細胞用胰蛋白酶消化後,磷酸緩衝液(PBS)洗滌和重懸,調整密度至每毫升1-5×106個;
3)將動物或者人麻醉後,將其平躺於實驗臺,露出兩側睪丸。每側睪丸用微量注射器將106-107個細胞注射到睪丸間質中,並於移植後7-60天取血清檢測血清睪酮含量。
綜上所述,本發明提供下述技術方案:
1.一種誘導成纖維細胞轉分化為類睪丸間質細胞的方法,其特徵在於將所需轉錄因子分別克隆至慢病毒載體,包裝成病毒顆粒並轉染至成纖維細胞;利用過表達轉錄因子的方法誘導成纖維細胞轉分化為誘導型睪丸間質細胞,
其中所述轉錄因子來源於人、小鼠或大鼠,並且所述轉錄因子為選自由Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4組成的組中的部分或全部轉錄因子的組合。
2.根據第1項所述的方法,其中所述轉錄因子組合為Dmrt1、Gata4和Nr5a1的組合。
3.根據第1項所述的方法,其中所述轉錄因子組合為Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Nr5a1和Gata4的組合。
4.根據第1項所述的方法,其中所述轉錄因子組合為Dmrt1、Sp1、Wt1、AP1、Nr5a1和Gata4的組合。
5.根據第1項所述的方法,其中所述轉錄因子組合為Dmrt1、Wt1、AP1、Nr5a1和Gata4的組合。
6.根據第1項所述的方法,其中所述轉錄因子組合為Dmrt1、Sp1、Wt1、Nr5a1和Gata4的組合。
7.根據第1項所述的方法,其中所述轉錄因子組合為Dmrt1、Sp1、AP1、Nr5a1和Gata4的組合。
8.根據第1項所述的方法,其中所述轉錄因子組合為Dmrt1、Gata4、Nr5a1和AP1的組合或Dmrt1、Gata4、Nr5a1和Wt1的組合。
9.根據第1項所述的方法,其中所述轉錄因子組合為Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4的組合。
10.根據第1項所述的方法,其中所述成纖維細胞為胚胎成纖維細胞、內臟成纖維細胞或皮膚成纖維細胞。
11.一種用於誘導成纖維細胞轉分化為類睪丸間質的試劑盒,所述試劑盒包括用於獲得成纖維細胞的試劑、慢病毒載體和轉錄因子的組合,其中所述轉錄因子來源於人、小鼠或大鼠,並且所述轉錄因子的組合為選自由Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4組成的組中的部分或全部轉錄因子的組合。
12.根據第11項所述的試劑盒,其中所述轉錄因子組合為Dmrt1、Gata4和Nr5a1的組合。
13.根據第11項所述的試劑盒,其中所述轉錄因子組合為Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Nr5a1和Gata4的組合。
14.根據第11項所述的試劑盒,其中所述轉錄因子組合為Dmrt1、Sp1、Wt1、AP1、Nr5a1和Gata4的組合。
15.根據第11項所述的試劑盒,其中所述轉錄因子組合為Dmrt1、Wt1、AP1、Nr5a1和Gata4的組合。
16.根據第11項所述的試劑盒,其中所述轉錄因子組合為Dmrt1、Sp1、Wt1、Nr5a1和Gata4的組合。
17.根據第11項所述的試劑盒,其中所述轉錄因子組合為Dmrt1、Sp1、AP1、Nr5a1和Gata4的組合。
18.根據第11項所述的試劑盒,其中所述轉錄因子組合為Dmrt1、Gata4和Nr5a1的組合。
19.根據第11項所述的試劑盒,其中所述轉錄因子組合為Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4的組合。
20.根據第11項所述的試劑盒,其中所述試劑盒所用的成纖維細胞為胚胎成纖維細胞、內臟成纖維細胞或皮膚成纖維細胞。
21.一種治療雄性性腺機能缺乏症候群的方法,所述方法包括向有此需要的患者的兩側睪丸的睪丸間質內注射有效量的第1-10項中任一項的方法誘導分化的類睪丸間質細胞。
22.一種治療雄性性腺機能缺乏症候群的試劑盒,所述試劑盒包括由第1-10項中任一項的方法誘導分化的類睪丸間質細胞。
本發明較傳統幹細胞誘導分化方法體現出了兩個明顯優勢:1)耗時短,在成纖維細胞中過表達轉錄因子後第3天,即可在宿主細胞中檢測到雄激素合成關鍵酶基因的表達,其表達量及合成睪酮的能力隨著培養時間的延長不斷增加,到第10天後達到穩定。整個分化過程顯著優於傳統iPSCs誘導分化所需時間(20天以上);2)規避了畸胎瘤的風險及倫理問題。由於轉分化過程中細胞數量沒有明顯增殖,且分化過程並不經過多能幹細胞階段,因而規避了畸胎瘤的風險及醫學倫理等問題;3)供體細胞可來源於受用人自身。
附圖說明
從下面結合附圖的詳細描述中,本發明的上述特徵和優點將更明顯,其中:
圖1、PCR擴增11種轉錄因子基因的瓊脂糖凝膠電泳分析。M,DNA分子量梯度;1,Dmrt1;2,Nr0b1;3,Sp1;4,Wt1;5,Nr4a1;6,Nr5a2;7,AP1;8,Creb1;9,Smad3;10,Nr5a1;11,Gata4。
圖2、11種轉錄因子組成的組合誘導胚胎成纖維細胞轉分化為類睪丸間質細胞。(A)轉分化後細胞形態;(B)轉分化後細胞合成和分泌睪酮的含量;(C、D)轉分化後流式分析結果。
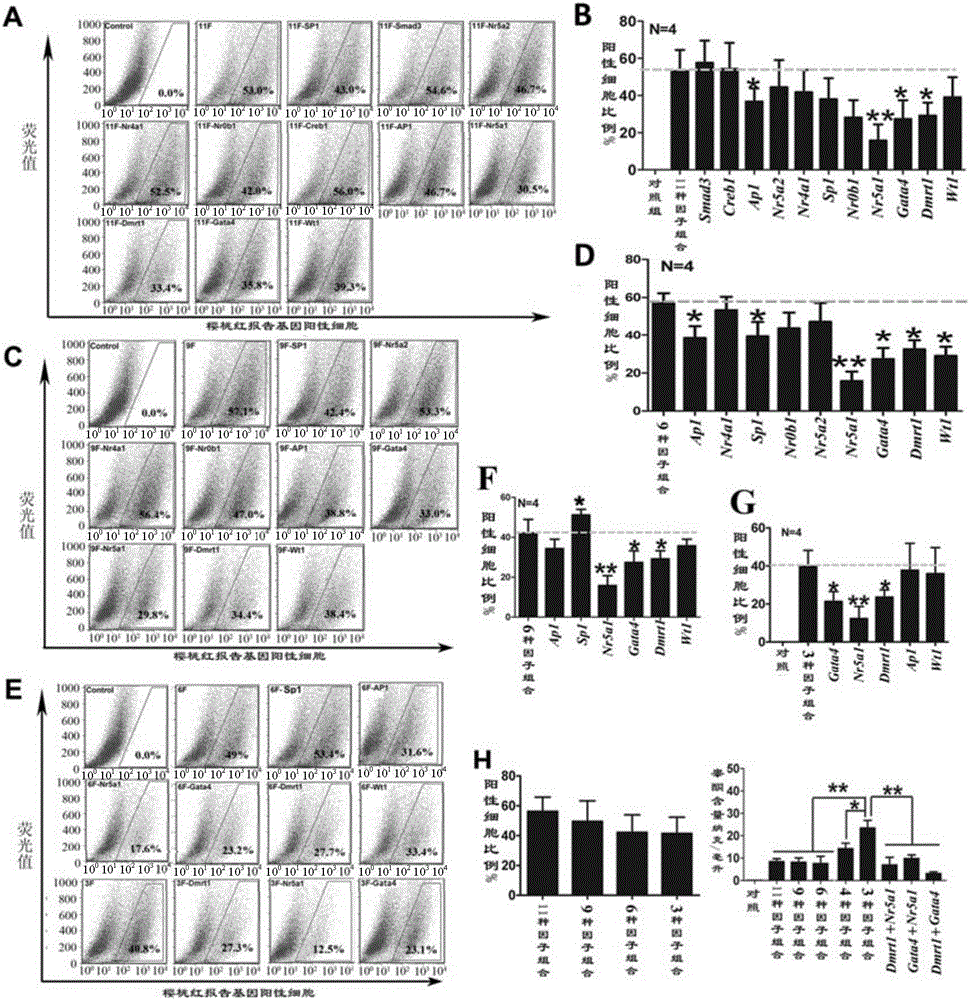
圖3、誘導成纖維細胞轉分化的轉錄因子組合篩選結果分析。(A,C,E)不同轉錄因子組合誘導成纖維細胞轉分化後的流式分析結果;(B,D,F,G,H)流式分析後報告基因陽性細胞率統計結果圖;(I)不同轉錄因子組合誘導後細胞合成和分泌睪酮的情況;數據以均數±標準差(Mean±SD)表示,P<0.05用*表示,P<0.01用**表示,P<0.001用***表示;N=4代表本數據是由4次重複實驗結果分析得到。
圖4、類睪丸間質細胞的雄激素合成相關蛋白表達及睪酮合成變化趨勢。(A)轉分化細胞中睪丸間質細胞標記蛋白的免疫螢光結果;(B)蛋白雜交實驗結果;(C)類睪丸間質細胞合成睪酮產量的分析。
圖5、類睪丸間質細胞移植後對雄激素低下模型大鼠血清睪酮的恢復分析。(A)細胞移植操作流程;(B)細胞移植前後睪丸切片蘇木精-伊紅染色分析;(C)EDS造模後7天血清睪酮變化;(D)細胞移植4、14、21、28天後模型大鼠血清睪酮含量的變化;(E)類睪丸間質細胞移植後大鼠體重變化;(F)細胞移植後大鼠睪丸重量變化;數據以均數±標準差表示,P<0.05用*表示,P<0.01用**表示,P<0.001用***表示;ns代表組間數據沒有顯著性差異。
圖6、類睪丸間質細胞移植14天和28天後在大鼠睪丸中的分布及睪丸間質細胞特異性蛋白表達分析。
縮略詞:GFP代表綠色螢光蛋白;
Merge代表兩種螢光重合圖;
CYP11A1代表膽固醇側鏈裂解酶;
CYP17A1代表17α-羥化酶,17、20-裂解酶;
StAR代表類固醇激素合成急性調節蛋白;
HSD3B代表羥基-δ-5-類固醇脫氫酶,3β-固醇δ異構酶;
HSD17b3代表17β-羥基類固醇脫氫酶3;
LHCGR代表促黃體生成激素受體;
EDS代表的乙烷二甲烷硫碸;
control代表對照細胞;
iLCs代表轉分化細胞;
MEFs代表成纖維細胞;
testis代表動物睪丸;
model代表模型動物處理組
序列表說明
為了清楚起見,以下對後附序列表中各個序列作簡要說明:
表1.本發明中所述轉錄因子/融合蛋白的序列號及其相關信息
具體實施方式
以下通過實施例來進一步闡明本發明。但是應該理解,所述實施例只是舉例說明的目的,並不意欲限制本發明的範圍和精神。需要說明的是,本領域技術人員應該理解或者根據已有的技術方法,本發明及下列實施例中所用的試劑、酶類、PCR反應所需引物序列等除特別說明外,均為可從試劑公司商購分析純級別的試劑、酶類及自行設計的引物。
實施例1、11種轉錄因子慢病毒表達載體的構建及病毒包裝
首先,利用RNA抽提試劑盒(Cat.#:74134,Qiagen,購自廣州健侖生物科技有限公司,中國)從小鼠睪丸中獲得總RNA。然後再利用PrimeScriptTM II 1st Strand cDNA Synthesis Kit(Cat.#:6210A,大連寶生物科技有限公司,中國)合成cDNA,並置於-80℃保存。由華大基因公司分別設計併合成用於擴增轉錄因子Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4基因的上下遊引物,並在正向與反向引物兩端分別引入酶切位點(下劃線部分,表2)。
按照常規的PCR方法,以小鼠睪丸cDNA為模板,添加上下遊引物(表2),然後設立PCR反應條件,94℃變性3min後進入循環,循環參數為94℃變性30秒,55℃退火15秒,72℃延伸30秒,共30個循環。電泳檢測目的DNA片段(圖1)。按照已有的方法建立標準的限制性內切酶消化體系,然後利用BamH I(購自New England Biolabs,Inc.,USA)和EcoR I(購自New England Biolabs,Inc.,USA)處理並回收這些目的DNA片段。然後,與利用相同限制性內切酶處理並回收的慢病毒表達載體pLVX-EF1α-IRES-ZsGreen1相連,分別構建出重組表達質粒pLVX-Dmrt1、pLVX-Nr0b1、pLVX-Sp1、pLVX-Wt1、pLVX-Nr4a1、pLVX-Nr5a2、pLVX-AP1、pLVX-Creb1、pLVX-Smad3、pLVX-Nr5a1和pLVX-Gata4(具體操作參考Sambrook et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY,1989)。利用相同的方法將編碼cyp11a1-mcherry的目的DNA片段(SEQ ID No:34)用限制性內切酶消化後,連接到相同處理的慢病毒表達載體pEZX-LvPM02(購自GeneCopoeia Inc.,USA)中,構建出重組表達質粒pEZX-cyp11a1-mcherry。
復甦並培養293T細胞(Cat:#632180,購自大連寶生物工程有限公司,中國),然後將1.5×106個293T細胞鋪在10cm2的培養皿上,加入10毫升含有10%胎牛血清的DMEM(Dulbecco′s Modified Eagle Medium)培養基(Cat.#:12100-046,invitrogen Inc.,USA),於37℃含5%二氧化碳的培養箱中培養48小時。按照慢病毒包裝試劑盒(Cat.#:631247,Lenti-XTM HTX Packaging System,Clontech Inc.USA)操作說明進行慢病毒包裝。簡言之,在無菌的聚丙烯管中,將2.5μg的慢病毒表達質粒和5.0μl(0.5μg/μl)Lenti-Pac HIV混合物(Cat.#:HPK-LvTR-20,GeneCopoeia Inc.,USA)稀釋到200μl的Opti-MEMI溶液(Cat.#:31985-062,invitrogen Inc.,USA)中,室溫孵育25分鐘後形成複合物。將該複合物直接添加到含有293T細胞的培養皿中,37℃孵育過夜(12小時)。更換新鮮DMEM培養基(Cat.#:12100-046,invitrogen Inc.,USA)並繼續放回二氧化碳培養箱中培養48-72小時。用15毫升離心管收集含有病毒的培養基,500xg離心10分鐘,收集上清並利用PCR方法檢測慢病毒的滴度後,分裝並儲存在-80℃中備用。
實施例2、用於轉分化的胚胎成纖維細胞及成體成纖維細胞的分離
為了獲得胚胎成纖維細胞(mouse embryonic fibroblasts,MEFs),首先處死懷孕12.5天-14.5天的孕鼠,然後,用剪刀切開腹部和子宮,取出胚胎。再用無菌鑷子剔除胚胎周圍的包膜、胚胎的四肢、頭及內臟。磷酸緩衝液清洗後將胚胎組織塊轉移至青黴素瓶中用剪刀絞碎,加入2毫升胰酶,37℃孵育10分鐘。250xg離心5分鐘,棄上清,用含有10%牛血清和抗生素的DMEM培養基(Cat.#:12100-046,invitrogen Inc.,USA)重懸細胞,並接種到培養皿中;培養24小時後,更換新鮮DMEM培養基;待細胞長滿,可收穫並凍存於液氮中。
對於成體成纖維細胞的分離,本發明採用小鼠尾尖成纖維細胞(Tail-tip fibroblasts,TTFs)。首先,剪取成年小鼠尾尖,磷酸緩衝液衝洗。用注射器針頭,將表皮層和真皮層剝離後,將剩餘部分用剪刀絞成1cm3左右的組織塊。將組織塊轉移至明膠包被的培養皿中,並在培養皿中加入6毫升DMEM培養基中培養5天。棄舊培養基,磷酸緩衝液洗滌兩次後,胰酶消化1分鐘,並吹打成細胞懸液。將細胞懸液收集至15毫升離心管中,250xg離心5分鐘。棄上清,加入新鮮培養基培養至慢病毒轉化實驗。
實施例3、構建表達報告基因cyp11a1-mcherry的小鼠成纖維細胞株(cyp11a1-mcherry-Fibroblasts)
從實施例1中獲得足夠數量的慢病毒質粒pEZX-cyp11a1-mcherry,然後將1×108U滴度的慢病毒加入到含有1×106個MEFs或者TTFs(實施例2分離)的培養皿中並培養24小時。棄去含病毒的DMEM培養基(Cat.#:12100-046,invitrogen Inc.,USA),更換新鮮DMEM培養基,繼續培養72小時後,加入終濃度為2微克/毫升(μg/ml)的嘌呤黴素進行篩選,連續篩選1周(圖2A)。隨機挑取陽性克隆進行擴增,用PCR及蛋白雜交等分子生物學方法進行驗證。
實施例4、轉錄因子Dmrt1、Nr0b1、Sp1、Wt1、Nr4a1、Nr5a2、AP1、Creb1、Smad3、Nr5a1和Gata4組合誘導小鼠胚胎成纖維細胞轉分化為睪丸間質細胞
按照實施例3中,將1×106個含有報告基因的成纖維細胞(cyp11a1-mcherry-Fibroblasts)接種到新鮮DMEM培養基中。培養72小時後,將11種轉錄因子慢病毒顆粒按照等質量比例混合(所有病毒顆粒的總質量濃度為10微克/毫升),然後加入到細胞培養基中感染培養24小時。去掉含病毒的培養基,更換新鮮DMEM培養基繼續培養7天。胰酶消化,利用流式細胞儀檢測能表達櫻桃紅報告基因的陽性細胞比例,同時,利用放射性酶聯免疫方法檢測轉染後細胞上清中睪酮的含量(Liu et al.,Journal of steriod biochemistry and molecular biology,2014,144:483-91)。
實驗結果表明,在含有報告基因的成纖維細胞(cyp11a1-mCherry-fibroblasts)加入全部11個轉錄因子感染後,表達櫻桃紅報告基因的陽性細胞比例為53%(圖2C、D),且這些陽性細胞具有合成和分泌睪酮的能力,其平均濃度達到8.46納克/毫升(ng/ml)(圖2B)。這個結果也提示,這11個轉錄因子組成的組合可以誘導成纖維細胞轉分化為具合成分泌睪酮能力的類睪丸間質細胞。
實施例5、促進成纖維細胞轉分化為類睪丸間質細胞的最優轉錄因子組合的篩選
通過逐一排除法,將不顯著影響表達櫻桃紅報告基因陽性細胞的百分比或睪酮合成產量的轉錄因子排除。對11種轉錄因子進行重新組合,每個組合內分別含有10種轉錄因子(即每種組合缺失一種不同的轉錄因子),然後轉染含有報告基因的成纖維細胞株。培養3-10天後,利用流式細胞儀分析表達櫻桃紅報告基因陽性細胞的比例及通過放射性酶聯免疫方法檢測培養基上清睪酮的含量。
第一輪篩選結果顯示,在含有11種轉錄因子的組合中去掉Smad3和Creb1不影響表達櫻桃紅報告基因陽性細胞的比例及細胞合成睪酮的能力,因此,將Smad3和Creb1作為非必需的因子而排除(圖3A,B)。
第二輪篩選結果顯示,在9因子中刪除Nr5a2、Nr4a1和Nr0b1也不會顯著的影響表達櫻桃紅報告基因陽性細胞的百分比及細胞合成睪酮的能力,因此,將Nr5a2、Nr4a1和Nr0b1也作為非必須的轉錄因子從9個因子中排除,而餘下的6個因子保留作下一輪篩選(圖3C,D)。
第三輪篩選結果顯示,在6因子中刪除SP1、AP1或Wt1同樣不會顯著影響櫻桃紅報告基因陽性細胞的百分比及細胞合成睪酮的能力,而分別刪除Dmrt1、Gata4或Nr5a1可顯著影響表達櫻桃紅報告基因陽性細胞平均百分比,使其從49%分別降至27.7%、23.2%及17.6%。而Dmrt1、Gata4和Nr5a1共同感染成纖維細胞後表達櫻桃紅報告基因細胞的百分比平均則為40.8%(圖3E);而該組合轉分化後的細胞培養上清中睪酮平均濃度達到23.4納克/毫升(ng/ml),與6因子及11因子相比,分別上調了3.1倍及2.76倍。
由此可見,Dmrt1、Gata4和Nr5a1組合為成纖維細胞轉分化為類睪酮間質細胞的最優轉錄因子組合(圖3E-G)。在這3因子中加入AP1或Wt1均不會顯著增加櫻桃紅報告基因陽性細胞的百分比,但能提高轉分化細胞合成睪酮的能力(圖3G、H、I)。因此,Dmrt1、Gata4、Nr5a1和AP1的組合或Dmrt1、Gata4、Nr5a1和Wt1的組合也是具有顯著促進成纖維細胞轉分化為具睪酮合成能力的類睪丸間質細胞的能力。
實施例6、類睪丸間質細胞表達睪丸間質細胞特異性標記蛋白及睪酮合成能力分析
免疫螢光、Western鑑定轉分化後的細胞是否表達Leydig細胞關鍵蛋白,結果顯示,轉分化後的細胞表達膽固醇側鏈裂解酶(cytochrome P450,family 11,subfamily a,polypeptide 1,Cyp11a1)、類固醇激素合成急性調節蛋白(Steroidogenic acute regulatory protein,StAR)、羥基-δ-5-類固醇脫氫酶,3β固醇δ異構酶1(hydroxy-delta-5-steroid dehydrogenase,3beta-and steroid delta-isomerase 1,hsd3b1)、17β-羥基類固醇脫氫酶3(hydroxysteroid(17-beta)dehydrogenase 3,hsd17b3)及促黃體生成激素受體蛋白(Luteinizing hormone receptor,LHCGR)(圖4A),蛋白雜交實驗進一步證實了這些結果(圖4B)。對成纖維細胞及轉分化細胞的睪酮合成能力進行分析,結果顯示,轉染2天後,轉分化細胞的培養上清中即可檢測到睪酮,且睪酮濃度隨著培養時間的延長而逐漸升高,第10天達到頂峰(圖4C)。而作為對照,成纖維細胞既不能表達睪丸間質細胞特異性蛋白,也不具有合成睪酮功能(圖4C)。
實施例7、建立了成體睪丸間質細胞「敲除」鼠模型
成年大鼠或者小鼠睪丸含有大量的成體睪丸間質細胞,這些細胞能大量合成和分泌雄性激素。按照90毫克/公斤體重劑量,在雄性鼠(購自廣東省醫學動物實驗中心,12周齡)腹腔注射乙烷二甲烷硫碸(Ethane Dimefhane sulfonaft,EDS)。注射7天後,鼠睪丸中所有成熟睪丸間質細胞(ALCs)會發生凋亡,而動物體內血清睪酮含量將下降至放射性同位素酶聯免疫檢測方法的下限。這種成體睪丸間質細胞「敲除」動物可以用作研究先天性性腺機能減退、衰老所致性腺機能減退、及睪丸間質細胞損傷而造成的性腺機能低下等疾病的模型。
實施例8、移植類睪丸間質細胞可提升睪丸間質細胞「敲除」鼠的血清睪酮至正常水平
轉分化的類睪丸間質細胞在動物體內用於恢復雄激素低下模型鼠血清睪酮的實驗過程如圖5A所示。簡言之,首先在雄性大鼠腹腔注射EDS進行造模,造模7天後進行細胞移植。將轉分化的類睪丸間質細胞用磷酸緩衝液洗滌重懸,調整細胞密度為每毫升1×107個。將模型鼠用戊巴比妥鈉麻醉後,將其平躺於實驗臺,露出兩側睪丸。用75%酒精溶液擦拭睪丸外皮膚,然後,用微量注射器取100萬個類睪丸間質細胞注射入睪丸間質中。注射後留針5分鐘,再繼續注射另一側睪丸。分別在注射後0天,14天,21天,28天取血清及組織樣品進行檢測。
實驗結果顯示,細胞移植後7天,模型組睪丸間質細胞急劇減少,而曲細精管中的細胞無顯著變化,說明EDS可選擇性地促進睪丸間質細胞發生凋亡。而移植的成纖維細胞(MEFs)及類睪丸間質細胞(iLCs)能在模型鼠睪丸間質中均勻分布(圖5B)。血清睪酮檢測結果表明,移植後7天,模型組動物的血清睪酮顯著下降(圖5C)。而類睪丸間質細胞移植14天後,檢測結果顯示,模型鼠的血清睪酮開始上升,21天時恢復至正常水平的50%,而28天後基本恢復到正常水平,而成纖維細胞移植組及模型組的血清睪酮水平未見明顯提升(圖5D)。
由於睪酮對雄性體重及睪丸發育有著重要的影響,因此對細胞移植前後大鼠體重及睪丸稱重檢測發現,血清睪酮低下會顯著導致大鼠的體重及睪丸重量減輕。類睪丸間質細胞移植可促進體重及睪丸重量恢復至正常水平,而模型組及成纖維細胞移植組則無明顯的幫助(圖5E,F)。
利用綠色螢光報告蛋白對移植後的細胞定位進行追蹤,結果發現,移植後14天、28天GFP標記的類睪丸間質細胞均分布於睪丸間質中,同時還表達睪丸間質細胞特異標記蛋白膽固醇側鏈裂解酶(cytochrome P450,family 11,subfamily a,polypeptide 1,Cyp11a1)。儘管螢光蛋白標記的成纖維細胞(MEFs)也能定殖於睪丸間質中,但其並不能表達睪丸間質細胞特異標記蛋白(圖6)。
綜上所述,轉分化的類睪丸間質細胞移植後可定殖於雄性鼠睪丸間質中,同時表達睪丸間質細胞特異標記蛋白,也可以合成和分泌雄激素,這些具雄激素合成功能的轉分化細胞可促進雄激素低下模型大鼠血清睪酮的恢復,並具有治療先天性性腺機能減退、衰老所致性腺機能減退、及睪丸間質細胞損傷而造成的性腺機能低下等疾病的潛在應用價值。
應該理解,儘管參考其示例性的實施方案,已經對本發明進行具體地顯示和描述,但是本領域的普通技術人員應該理解,在不背離由權利要求書所定義的本發明的精神和範圍的條件下,可以在其中進行各種形式和細節的變化,可以進行各種實施方案的任意組合。因此,本發明的範圍包括在權利說明書等同目的和範圍內的所用修改。
