新的抗人Tie‑2抗體的製作方法
2023-09-19 21:41:20 3
本發明涉及新的抗人Tie-2抗體。
背景技術:
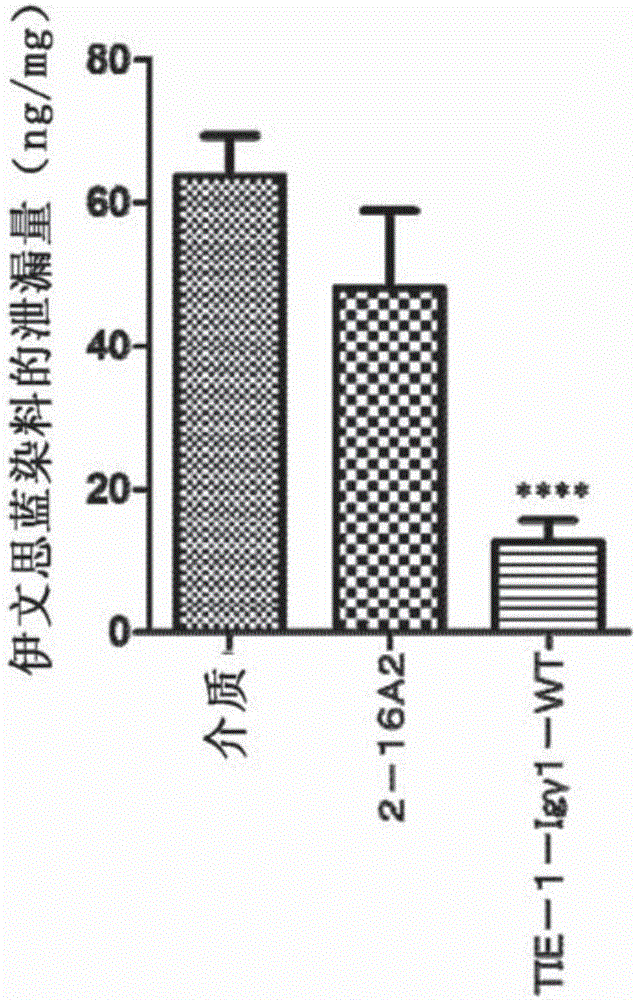
:具有Ig和EGF同源結構域2的酪氨酸激酶(Tie2)是一種受體型酪氨酸激酶。已知Tie2主要在血管內皮細胞中表達。作為配體,已知的是作為多聚體類型的分泌糖蛋白的血管生成素-1(Ang-1)和血管生成素-2(Ang-2)。Ang-1起到Tie2的激動劑的作用。已發現,當Tie2結合到Ang-1時,它通過形成多聚體被自身磷酸化並將信號發送到細胞內,由此促進血管內皮細胞的抗凋亡作用、通過血管的滲透抑制作用的血管穩定化作用、成熟和重塑(Cell,1996,Vol.87,pp.1171-1180;GenesDev.,1994,Vol.8,pp.1897-1909;Science,1999,Vol.286,pp.2511-2514;和Nat.Struct.Biol.,2003,Vol.10,pp.38-44)。此外,還已知道,Ang-1通過經Tie2活化產生一氧化氮來發揮血管舒張和血流增強作用(Pharmacol.Res.,2014,Vol.80,pp.43-51)。此外,據信Ang-1通過經Tie2活化抑制血管內皮鈣粘蛋白的內化而有助於血管的穩定化(Dev.Cell,2008,Vol.14,pp.25-36)。另一方面,據信Ang-2能夠活化血管內皮細胞上的Tie2,但是與Ang-1相比它的活化據信是部分的(Mol.CellBiol.,2009,Vol.29,pp.2011-2022)。Ang-2以與Ang-1基本上相同的親和性結合到Tie2的相同位點,作為結果,已提出從Ang-1對Tie2的活化被Ang-2的部分活化代替的觀點來看,Ang-2起到內源Tie2拮抗劑的作用(Science,1997,Vol.277,pp.55-60)。已報導在由血管脆弱引起的疾病中血液中Ang-2的濃度升高,而血管脆弱被認為是諸如糖尿病、糖尿病性視網膜病變、膿毒症和急性腎衰竭的疾病的病因之一(Atherosclerosis,2005,Vol.180,pp.113-118;Br.J.Ophthalmol.,2004,Vol.88,pp.1543-1546;CriticalCare,2009,Vol.13,p.207;和IntensiveCareMed.,2010,Vol.36,pp.462-470)。對於與糖尿病性視網膜病變和糖尿病性黃斑水腫的相關性而言,已報導在患者的血漿或玻璃體液中Ang-2的濃度升高(Br.J.Ophthalmol.,2004,Vol.88,pp.1543-1546;和Br.J.Ophthalmol.,2005,Vol.89,pp.480-483)。此外,在患有糖尿病性視網膜病變的患者的視網膜血管中,也已知道作為主要的Ang-1生產細胞的周細胞的喪失(Cell,1996,Vol.87,pp.1161-1169),是特徵性病變之一(《視網膜》(Retina),2013,第五版,pp.925-939)。已知糖尿病性黃斑水腫包括黃斑區增厚作為其病症之一,但也已報導在由於玻璃體移除手術而造成眼內Ang-1濃度提高的患者中,黃斑區的增厚減小(Br.J.Ophthalmol.,2005,Vol.89,pp.480-483)。此外,從在視網膜血管中周細胞喪失的視網膜水腫小鼠模型中觀察到視網膜水腫和視網膜出血,並且疾病的發作受到Ang-1的玻璃體內給藥的抑制(J.Clin.Invest.,2002,Vol.110,pp.1619-1628),以及在使用具有糖尿病性視網膜病變的小鼠模型的試驗中,視網膜中的血管內皮細胞障礙受到含有編碼Ang-1基因的腺病毒給藥的抑制(Am.J.Pathol.,2002,Vol.160,pp.1683-1693)的觀點來看,已建議Ang-1具有改善所述病症的作用。同時,已報導在視網膜中具有Ang-2特異性過表達的遺傳修飾小鼠中,視網膜細胞的損傷增加(Acta.Diabetol.2010,Vol.47,pp.59-64)。已報導,對於嚴重肢體缺血來說,在患有外周動脈疾病的患者中血漿中的Ang-2量增加,並且在患有嚴重肢體缺血的患者中,在缺血的肢體肌肉或皮膚組織中表達的Ang-2的量高(J.Am.Coll.Cardial.,2008,Vol.52,pp.387-393;和Int.Angiol.,2011,Vol.30,pp.25-34)。此外,在使用具有後肢缺血的大鼠模型的試驗中,通過給藥含有編碼Ang-1的基因的病毒載體,促進了缺血肢體中的血流恢復和抗凋亡效應(Angiogenesis,2009,Vol.12,pp.243-249)。從已報導在作為具有2型糖尿病的動物模型的db/db小鼠的冠狀動脈結紮模型中,通過給藥含有編碼Ang-1的基因的病毒增加了梗塞區域的邊界區中被平滑肌細胞覆蓋的成熟血管(Diabetes,2008,Vol.57,pp.3335-3343)的觀點來看,通過Tie2信號的活化可以預期到促進不穩定的新血管成熟的效果。作為對人Tie2顯示出激動作用的抗體,已報導了一種鼠類單克隆抗體15B8(專利文獻1)。已報導在人血管內皮細胞HUVEC中,15B8結合到人Tie2以誘導抗凋亡作用(專利文獻1)。相關技術專利文獻[專利文獻1]WO2000/018804技術實現要素:本發明待解決的問題本發明的目的是提供一種抗人Tie2抗體,其通過結合到人Tie2以活化所述人Tie2,用於預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血。解決問題的手段本發明人在抗人Tie2抗體的製備中重複地進行了大量創造性的研究,作為結果,他們發現製備了一種四價抗人Tie2抗體,其包含由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成的重鏈可變區和由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成的輕鏈可變區(實施例1至8),並且因此所述抗人Tie2抗體結合到人Tie2(實施例12),在表達人Tie2的BaF3細胞中誘導抗凋亡作用(實施例9和11),並在具有血管通透性增高的大鼠模型中抑制血管通透性增高(實施例10和13)。作為結果,他們提供了這種抗人Tie2抗體,由此完成了本發明。也就是說,本發明可以包括下列發明作為在醫學或工業上適用的材料或方法。[1]一種抗人Tie2抗體或其抗原結合片段,其包含4個重鏈可變區和4個輕鏈可變區,其中所述重鏈可變區包含由SEQIDNO:2的第31至35位胺基酸的胺基酸序列構成的CDR1、由SEQIDNO:2的第50至66位胺基酸的胺基酸序列構成的CDR2和由SEQIDNO:2的第99至111位胺基酸的胺基酸序列構成的CDR3;所述輕鏈可變區包含由SEQIDNO:4的第24至39位胺基酸的胺基酸序列構成的CDR1、由SEQIDNO:4的第55至61位胺基酸的胺基酸序列構成的CDR2和由SEQIDNO:4的第94至102位胺基酸的胺基酸序列構成的CDR3;並且一個所述重鏈可變區和一個所述輕鏈可變區組成一個抗原結合位點,並且所述抗體或抗原結合片段包含4個抗原結合位點。[2][1]的抗人Tie2抗體或其抗原結合片段,其選自下列(1)或(2):(1)一種抗人Tie2抗體或其抗原結合片段,其包含4個重鏈可變區和4個輕鏈可變區,其中所述重鏈可變區由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成,所述輕鏈可變區由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成,並且一個所述重鏈可變區和一個所述輕鏈可變區組成一個抗原結合位點,並且所述抗體或抗原結合片段包含4個抗原結合位點;以及(2)一種抗人Tie2抗體或其抗原結合片段,其是源自於(1)的抗人Tie2抗體或其抗原結合片段的翻譯後修飾的抗體或其抗原結合片段。[3][1]的抗人Tie2抗體,其中所述抗體包含兩條重鏈和四條輕鏈;每條重鏈包含兩個由重鏈可變區以及CH1區構成的結構、CH2區和CH3區,所述重鏈可變區包含由SEQIDNO:2的第31至35位胺基酸的胺基酸序列構成的CDR1、由SEQIDNO:2的第50至66位胺基酸的胺基酸序列構成的CDR2和由SEQIDNO:2的第99至111位胺基酸的胺基酸序列構成的CDR3,並且一個所述結構的羧基端(C端)通過連接物連接到另一個結構的氨基端(N端);並且每條輕鏈包含輕鏈可變區和輕鏈恆定區,所述輕鏈可變區包含由SEQIDNO:4的第24至39位胺基酸的胺基酸序列構成的CDR1、由SEQIDNO:4的第55至61位胺基酸的胺基酸序列構成的CDR2和由SEQIDNO:4的第94至102位胺基酸的胺基酸序列構成的CDR3。[4][3]的抗人Tie2抗體,其選自下列(1)或(2):(1)一種抗人Tie2抗體,其包含兩條重鏈和四條輕鏈,其中每條重鏈包含兩個由重鏈可變區以及CH1區構成的結構、CH2區和CH3區,所述重鏈可變區由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成,並且一個所述結構的C端通過連接物連接到另一個結構的N端;並且每條輕鏈包含由SEQIDNO:4的1至113位胺基酸的胺基酸序列構成的輕鏈可變區,和輕鏈恆定區;以及(2)一種抗人Tie2抗體,其是源自於(1)的抗人Tie2抗體的翻譯後修飾的抗體。[5][4]的抗人Tie2抗體,其中所述抗人Tie2抗體包含兩條重鏈和四條輕鏈;每條重鏈包含兩個由重鏈可變區以及CH1區構成的結構、CH2區和CH3區,所述重鏈可變區由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成,並且一個所述結構的C端通過連接物連接到另一個結構的N端;並且每條輕鏈包含由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成的輕鏈可變區,和輕鏈恆定區。[6]一種抗人Tie2抗體,其是源自於[5]的抗人Tie2抗體的翻譯後修飾的抗體。[7][6]的抗人Tie2抗體,其中所述翻譯後修飾是所述重鏈可變區的N端處的焦穀氨醯化和/或所述重鏈的C端處賴氨酸的缺失。[8][3]至[7]任一項的抗人Tie2抗體,其包含作為人Igγ1恆定區或人Igγ4恆定區的重鏈恆定區。[9][8]的抗人Tie2抗體,其中所述人Igγ1恆定區是具有胺基酸變異L234A、L235A和P331S的人Igγ1恆定區或具有胺基酸變異L234A、L235A、P331S和I253A的人Igγ1恆定區。[10][8]的抗人Tie2抗體,其中所述人Igγ4恆定區是具有胺基酸變異S228P和L235E的人Igγ4恆定區。[11][3]至[7]任一項的抗人Tie2抗體,其包含作為人Igκ恆定區的輕鏈恆定區。[12][3]至[7]任一項的抗人Tie2抗體,其包含作為人Igγ1恆定區或人Igγ4恆定區的重鏈恆定區和作為人Igκ恆定區的輕鏈恆定區。[13][12]的抗人Tie2抗體,其中所述人Igγ1恆定區是具有胺基酸變異L234A、L235A和P331S的人Igγ1恆定區或具有胺基酸變異L234A、L235A、P331S和I253A的人Igγ1恆定區。[14][12]的抗人Tie2抗體,其中所述人Igγ4恆定區是具有胺基酸變異S228P和L235E的人Igγ4恆定區。[15][3]至[7]任一項的抗人Tie2抗體,其中所述連接物是包含5至70個胺基酸的肽連接物。[16][15]的抗人Tie2抗體,其中所述連接物包含鉸鏈區或其一部分的胺基酸序列。[17][16]的抗人Tie2抗體,其中所述連接物包含由SEQIDNO:13所示的胺基酸序列。[18][4]的抗人Tie2抗體,其包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。[19][4]的抗人Tie2抗體,其包含兩條由SEQIDNO:6所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。[20][4]的抗人Tie2抗體,其包含兩條由SEQIDNO:10所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。[21]一種抗人Tie2抗體,其是源自於[18]至[20]任一項的抗人Tie2抗體的翻譯後修飾的抗體。[22][21]的抗人Tie2抗體,其中所述翻譯後修飾是所述重鏈可變區的N端處的焦穀氨醯化和/或所述重鏈的C端處賴氨酸的缺失。[23][21]的抗人Tie2抗體,其包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。[24]一種四價抗人Tie2抗體或其抗原結合片段,其與[18]或[23]的抗人Tie2抗體結合相同的人Tie2表位。[25][24]的四價抗人Tie2抗體或其抗原結合片段,其中所述人Tie2表位是含有登錄號NP_000450.2的第192、195和197位胺基酸的胺基酸的人Tie2表位。[26]一種多核苷酸,其包含編碼[2]的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列。[27]一種多核苷酸,其包含編碼[2]的抗人Tie2抗體或其抗原結合片段的輕鏈可變區的鹼基序列。[28]一種多核苷酸,其包含編碼[18]至[20]任一項的抗人Tie2抗體的重鏈的鹼基序列。[29]一種多核苷酸,其包含編碼[18]至[20]任一項的抗人Tie2抗體的輕鏈的鹼基序列。[30]一種表達載體,其包含[26]和/或[27]的多核苷酸。[31]一種表達載體,其包含[28]和/或[29]的多核苷酸。[32]一種用[30]的表達載體轉化的宿主細胞,其選自下列(a)至(d):(a)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼[2]的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸和含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸;(b)一種用以下兩個表達載體轉化的宿主細胞:一個表達載體包含含有編碼[2]的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸;(c)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼[2]的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸;以及(d)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼[2]的抗人Tie2抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸。[33]一種用[31]的表達載體轉化的宿主細胞,其選自下列(a)至(d):(a)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼[18]至[20]任一項的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸和含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸;(b)一種用以下兩個表達載體轉化的宿主細胞:一個表達載體包含含有編碼[18]至[20]任一項的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸;(c)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼[18]至[20]任一項的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸;以及(d)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼[18]至[20]任一項的抗人Tie2抗體的輕鏈的鹼基序列的多核苷酸。[34]一種生產抗人Tie2抗體或其抗原結合片段的方法,所述方法包括培養選自下列(a)至(c)的宿主細胞以表達四價抗人Tie2抗體或其抗原結合片段:(a)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼[2]的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸和含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸;(b)一種用以下兩個表達載體轉化的宿主細胞:一個表達載體包含含有編碼[2]的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸;以及(c)兩種宿主細胞,一種宿主細胞用包含含有編碼[2]的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸的表達載體轉化,另一種宿主細胞用包含含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸的表達載體轉化。[35]一種生產抗人Tie2抗體的方法,所述方法包括培養選自下列(a)至(c)的宿主細胞以表達抗人Tie2抗體:(a)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼[18]至[20]任一項的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸和含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸;(b)一種用以下兩個表達載體轉化的宿主細胞:一個表達載體包含含有編碼[18]至[20]任一項的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸;以及(c)兩種宿主細胞,一種宿主細胞用包含含有編碼[18]至[20]任一項的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸的表達載體轉化,另一種宿主細胞用包含含有編碼所述抗人Tie2抗體的輕鏈的鹼基序列的多核苷酸的表達載體轉化。[36]一種抗人Tie2抗體或其抗原結合片段,其通過[34]的方法生產。[37]一種抗人Tie2抗體,其通過[35]的方法生產。[38]一種藥物組合物,其包含[1]至[23]、[36]和[37]任一項的抗人Tie2抗體或其抗原結合片段和可藥用賦形劑。[39]一種藥物組合物,其包含[5]的抗人Tie2抗體、[6]的抗人Tie2抗體和可藥用賦形劑。[40]一種藥物組合物,其包含[18]的抗人Tie2抗體、[23]的抗人Tie2抗體和可藥用賦形劑。[41][38]至[40]任一項的藥物組合物,其是用於預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血的藥物組合物。[42]一種用於預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血的方法,所述方法包括給藥治療有效量的[1]至[23]、[36]和[37]任一項的抗人Tie2抗體或其抗原結合片段。[43][1]至[23]、[36]和[37]任一項的抗人Tie2抗體或其抗原結合片段,其用於預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血。[44][1]至[23]、[36]和[37]任一項的抗人Tie2抗體或其抗原結合片段的用途,其用於製造藥物組合物以預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血。所述抗人Tie-2抗體或其抗原結合片段包括所述抗體與另一種肽或蛋白質的融合物,以及具有結合於它的修飾劑的修飾。本發明的效果本發明的抗人Tie2抗體可用作藥劑,通過結合到人Tie2以活化所述人Tie2來預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血。附圖簡述圖1示出了本發明的四價抗人Tie2抗體的格式的實例。圖2示出了在具有血管通透性的大鼠模型中全人2-16A2和TIE-1-Igγ1-WT的血管通透性抑制作用。縱軸指示伊文思藍染料的洩漏量(****:相對於介質組p<0.0001)。圖3示出了在具有血管通透性的大鼠模型中TIE-1-Igγ1-LALA的血管通透性抑制作用。縱軸指示伊文思藍染料的洩漏量(****:相對於介質組p<0.0001)。圖4示出了在視網膜血管中具有周細胞喪失的小鼠模型中TIE-1-Igγ1-LALA的視網膜水腫抑制作用。縱軸指示視網膜神經纖維層和視網膜神經節細胞層之和(##:相對於對照組p<0.005,*:相對於介質組p<0.05)。圖5示出了在具有後肢缺血的小鼠模型中TIE-1-Igγ1-LALA的血流改善作用。縱軸指示血流量(*:相對於對照組p<0.05,**:相對於對照組p<0.01)。圖6示出了作為TIE-1-Igγ1-LALA的表位分析的表面等離子體共振現象的結果的代表性實例。縱軸指示結合響應性(共振單位:RU),橫軸指示時間(秒)。圖7示出了作為TIE-1-Igγ1-LALA的表位分析的的ELISA的結果。縱軸指示發光強度,橫軸指示TIE-1-Igγ1-LALA的濃度(ng/mL)。執行本發明的實施方式在後文中將詳細描述本發明。在抗體中存在5種類別,即IgG、IgM、IgA、IgD和IgE。在每種所述類別中,抗體分子的基本結構由分子量為50000至70000的重鏈和分子量為20000至30000的輕鏈共同組成。重鏈通常由包含約440個胺基酸的多肽鏈構成,每種類別具有不同的結構,並且被稱為Igγ、Igμ、Igα、Igδ和Igε,分別對應於IgG、IgM、IgA、IgD和IgE。此外,在IgG中存在4個亞類,即IgG1、IgG2、IgG3和IgG4,並且分別對應於它們的重鏈被稱為Igγ1、Igγ2、Igγ3和Igγ4。輕鏈通常由包含約220個胺基酸的多肽鏈構成,已知存在兩種類型即L型和K型,並且被稱為Igλ和Igκ。在抗體分子的基本結構的肽組態中,兩條同源的重鏈和兩條同源的輕鏈通過二硫鍵(S-S鍵)和非共價鍵結合,並且其分子量為150000至190000。兩種輕鏈可以與任何重鏈配對。對於鏈內S-S鍵來說,在重鏈中存在4個S-S鍵(在Igμ和Igε中5個),在輕鏈中存在兩個;每100至110個胺基酸殘基形成一個環,這種立體結構在不同環之間是相似的,並被稱為結構單元或結構域。位於重鏈和輕鏈兩者中氨基端側(N端側)的結構域,其胺基酸序列即使在樣品來自於同一種動物的同一類別(亞類)的情形中也不是恆定的,被稱為可變區,並且相應的結構域被稱為重鏈可變區和輕鏈可變區。所述可變區的羧基端側(C端側)的胺基酸序列在每種類型或亞類中是幾乎恆定的,並被稱為恆定區。抗體的抗原結合位點由重鏈可變區(VH)和輕鏈可變區(VL)構成,並且結合特異性取決於這個位點的胺基酸序列。另一方面,生物活性例如與補體和各種不同細胞的結合反映出每一類Ig之間恆定區結構的差異。應該理解,輕鏈和重鏈的可變區的可變性主要限制到兩種鏈中存在的三個小的超變區,並且這些區被稱為互補性決定區(CDR:從N端側起CDR1、CDR2和CDR3)。可變區的其餘部分被稱為構架區(FR)並且相對恆定。對於恆定區而言,重鏈恆定區由三個區構成,其從可變區一側起依次被稱為CH1區、CH2區和CH3區。輕鏈恆定區由一個區構成。在CH1區與CH2區之間存在被稱為鉸鏈區的肽序列。鉸鏈區對由重鏈可變區和CH1區構成的結構的遷移率有貢獻。此外,包含抗體的VH和VL的各種不同種類的抗原結合片段具有抗原結合活性。例如,單鏈可變區片段(scFv)、Fab、Fab』和F(ab』)2是典型的抗原結合片段的實例。Fab是單價抗原結合片段,其由輕鏈和包含VH、CH1區的重鏈片段和一部分鉸鏈區構成。Fab』是單價抗原結合片段,其由輕鏈和包含VH、CH1區的重鏈片段和一部分鉸鏈區構成,並且構成重鏈間S-S鍵的半胱氨酸殘基被包含在所述一部分鉸鏈區中。F(ab』)2是具有二聚體結構的二價抗原結合片段,其中兩個Fab』片段通過鉸鏈區中的重鏈間S-S鍵彼此相連。scFv是單價抗原結合片段,其由用連接物肽相連的VH和VL構成。具有兩個或更多個抗原結合位點的抗體被稱為多價抗體。其中,具有4個抗原結合位點的抗體被稱為四價抗體。對於四價抗體來說,已報導了各種不同的格式(結構)(Nat.Rev.Immunol.2010,Vol.10,pp.301-316;J.Immunol.,2003,Vol.170,pp.4854-4861;Mol.Immunol.,2000,Vol.37,pp.1067-1077;Biochem.J.,2007,Vol.406,pp.237-246;和J.Immunol.Methods,2003,Vol.279,pp.219-232)。例如,已經報導了其中將二價抗體的重鏈可變區和輕鏈可變區的N端通過連接物各自連接到重鏈可變區和輕鏈可變區的C端的四價抗體;包含兩條重鏈和四條輕鏈的四價抗體,其中每條重鏈包含兩個由重鏈可變區和CH1區構成的結構;其中將scFv的C端逐一鍵合到四聚體鏈親和素的每個鏈親和素的四價抗體;其中將scFv的C端逐一鍵合到四聚體p53的每個p53的四價抗體;以及其中將CH3區的N端通過連接物連接到二聚體scFv的C端的四價抗體。本發明的抗人Tie2抗體或其抗原結合片段包括具有下列特徵的抗人Tie2抗體或其抗原結合片段。一種抗人Tie2抗體或其抗原結合片段,其包含4個重鏈可變區和4個輕鏈可變區,其中所述重鏈可變區由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成,所述輕鏈可變區由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成,並且一個所述重鏈可變區和一個所述輕鏈可變區組成一個抗原結合位點,並且所述抗體或其抗原結合片段包含4個抗原結合位點。對本發明的抗人Tie2抗體或其抗原結合片段沒有特別限制,只要它是四價抗體即可,並且可以將在例如下列文獻中描述的各種不同格式的四價抗體用於本發明的抗人Tie2抗體或其抗原結合片段:Nat.Rev.Immunol.2010,Vol.10,pp.301-316;J.Immunol.,2003,Vol.170,pp.4854-4861;Mol.Immunol.,2000,Vol.37,pp.1067-1077;Biochem.J.,2007,Vol.406,pp.237-246;J.Immunol.Methods,2003,Vol.279,pp.219-232;等等。優選地,本發明的抗人Tie2抗體包含兩條重鏈和四條輕鏈,每條重鏈包含兩個由重鏈可變區以及CH1區構成的結構、CH2區和CH3區,所述重鏈可變區由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成,並且一個所述結構的C端通過連接物連接到另一個結構的N端;並且每條輕鏈包含由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成的輕鏈可變區,和輕鏈恆定區。在後文中,採取所述格式的四價抗體被稱為串聯抗體,其實例示出在圖1中。在本發明的抗人Tie2抗體是串聯抗體的情況下,可以選擇任何亞類中的恆定區(例如作為重鏈恆定區的Igγ1、Igγ2、Igγ3或Igγ4的恆定區,以及作為輕鏈恆定區的Igλ或Igκ的恆定區)作為所述恆定區。所述重鏈恆定區(包括CH1區、CH2區和CH3區)優選為人Igγ1恆定區或人Igγ4恆定區。所述輕鏈恆定區優選為人Igκ恆定區。在使用人Igγ1恆定區作為本發明的抗人Tie2抗體的重鏈恆定區的情況下,人Igγ1恆定區的CH1區、CH2區和CH3區的實例包含由SEQIDNO:8的第350至447位胺基酸的胺基酸序列構成的CH1區、由SEQIDNO:8的第463至572位胺基酸的胺基酸序列構成的CH2區和由SEQIDNO:8的第573至679位胺基酸的胺基酸序列構成的CH3區。在使用人Igγ1恆定區作為本發明的抗人Tie2抗體的重鏈恆定區的情況下,也可以使用具有導入的胺基酸變異例如L234A(根據EU索引例如Kabat,第234胺基酸位置處的亮氨酸被丙氨酸替代)、L235A(根據EU索引例如Kabat,第235胺基酸位置處的亮氨酸被丙氨酸替代)和P331S(根據EU索引例如Kabat,第331胺基酸位置處的脯氨酸被絲氨酸替代)的人Igγ1恆定區,以便降低所述抗體的抗體依賴性細胞毒性或補體依賴性細胞毒性活性(Mol.Immunol.,1992,Vol.29,No.5,pp.633-639)。此外,從藥物動力學的觀點來看,也可以使用已導入胺基酸變異例如I253A(根據EU索引例如Kabat,第253胺基酸位置處的異亮氨酸被丙氨酸替代)的人Igγ1恆定區,以便獲得在血液中的快速喪失(J.Immunol.,1997,Vol.158,pp.2211-2217)。在本說明書中使用的關於抗體恆定區中引入胺基酸變異的殘基編號是根據EU索引(Kabat等,1991,《免疫學重要的蛋白質的序列》(SequencesofProteinsofImmunologicalInterest),第五版,UnitedStatesPublicHealthService,NationalInstituteofHealth,Bethesda)。在使用人Igγ1恆定區作為本發明的抗人Tie2抗體的重鏈恆定區的情況下,所述人Igγ1恆定區優選為具有胺基酸變異L234A、L235A和P331S或L234A、L235A、P331S和I253A的人Igγ1恆定區。所述具有胺基酸變異L234A、L235A和P331S的人Igγ1恆定區的CH1區、CH2區和CH3區的實例,包含由SEQIDNO:2的第350至447位胺基酸的胺基酸序列構成的CH1區、由SEQIDNO:2的第463至572位胺基酸的胺基酸序列構成的CH2區和由SEQIDNO:2的第573至679位胺基酸的胺基酸序列構成的CH3區。所述具有胺基酸變異L234A、L235A、P331S和I253A的人Igγ1恆定區的CH1區、CH2區和CH3區的實例,包含由SEQIDNO:6的第350至447位胺基酸的胺基酸序列構成的CH1區、由SEQIDNO:6的第463至572位胺基酸的胺基酸序列構成的CH2區和由SEQIDNO:6的第573至679位胺基酸的胺基酸序列構成的CH3區.在使用人Igγ4恆定區作為本發明的抗人Tie2抗體的重鏈恆定區的情況下,也可以使用具有導入的胺基酸變異例如S228P(根據EU索引例如Kabat,第228胺基酸位置處的絲氨酸被脯氨酸替代)和L235E(根據EU索引例如Kabat,第235胺基酸位置處的亮氨酸被穀氨酸替代)的人Igγ4恆定區,以便抑制Fab臂交換(DrugMetab.Dispos.,2010,Vol.38,No.1,pp.84-91)。在使用人Igγ4恆定區作為本發明的抗人Tie2抗體的重鏈恆定區的情況下,所述人Igγ4恆定區優選為具有胺基酸變異S228P和L235E的人Igγ4恆定區。所述具有胺基酸變異S228P和L235E的人Igγ4恆定區的CH1區、CH2區和CH3區的實例,包含由SEQIDNO:10的第350至447位胺基酸的胺基酸序列構成的CH1區、由SEQIDNO:10的第460至569位胺基酸的胺基酸序列構成的CH2區和由SEQIDNO:10的第570至676位胺基酸的胺基酸序列構成的CH3區.所述人Igκ恆定區的實例包括由SEQIDNO:4的第114至219位胺基酸的胺基酸序列構成的人Igκ恆定區。優選地,在本發明的抗人Tie2抗體是串聯抗體的情況下,所述重鏈恆定區是人Igγ1恆定區或人Igγ4恆定區,並且所述輕鏈恆定區是人Igκ恆定區。在所述重鏈恆定區是人Igγ1恆定區的情況下,所述人Igγ1恆定區優選為具有胺基酸變異L234A、L235A和P331S的人Igγ1恆定區或具有胺基酸變異L234A、L235A、P331S和I253A的人Igγ1恆定區。在所述重鏈恆定區是人Igγ4恆定區的情況下,所述人Igγ4恆定區優選為具有胺基酸變異S228P和L235E的人Igγ4恆定區。在本發明的抗人Tie2抗體是串聯抗體的情況下,作為連接由重鏈可變區和CH1區構成的結構的連接物,可以使用任何肽(肽連接物),只要所述抗體具有這種功能即可。所述肽連接物的長度和胺基酸序列可以由本領域技術人員適合地選擇。所述肽連接物優選具有5至70個胺基酸的長度。所述肽連接物優選包含鉸鏈區或其一部分的胺基酸序列。鉸鏈區意味著存在於抗體的CH1區與CH2區之間的區,並且所使用的鉸鏈區的實例包括IgG1或IgG3的鉸鏈區。鉸鏈區的一部分意味著具有鉸鏈區中的至少5個連續胺基酸的區,並且優選地意味著具有從鉸鏈區的N端起至少5個連續胺基酸的區。鉸鏈區的一部分的實例包括在IgG1的鉸鏈區的情況下具有從N端起5個連續胺基酸(由SEQIDNO:13的第1至5位胺基酸的胺基酸序列構成)的區,和在IgG3的鉸鏈區的情況下具有從N端起12個連續胺基酸(由SEQIDNO:14的第1至12位胺基酸的胺基酸序列構成)的區。在一種實施方式中,所述連接物包含具有從鉸鏈區的N端起至少5個連續胺基酸的區的胺基酸序列,並在所述連接物的C端處包含胺基酸序列GlySer。這種連接物的實例包括由SEQIDNO:13至20任一者所示的胺基酸序列構成的肽連接物,並且所述連接物優選地由SEQIDNO:13所示的胺基酸序列構成。在一種實施方式中,本發明的抗人Tie2抗體是具有下列特徵i)至iv)任一項的抗人Tie2抗體。i)一種抗人Tie2抗體,其包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。ii)一種抗人Tie2抗體,其包含兩條由SEQIDNO:6所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。iii)一種抗人Tie2抗體,其包含兩條由SEQIDNO:8所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。iv)一種抗人Tie2抗體,其包含兩條由SEQIDNO:10所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。已知當抗體在細胞中表達時,所述抗體在翻譯後被修飾。所述翻譯後修飾的實例包括用羧肽酶切開重鏈C端處的賴氨酸,通過焦穀氨醯化將重鏈和輕鏈的N端處的穀氨醯胺或穀氨酸修飾成焦穀氨酸,糖基化,氧化,脫醯胺化和糖化,並且已知在各種不同抗體中發生這些翻譯後修飾(JournalofPharmaceuticalSciences,2008,Vol.97,p.2426-2447)。本發明的抗人Tie2抗體或其抗原結合片段包括已經歷翻譯後修飾的抗人Tie2抗體或其抗原結合片段。本發明的已經歷過翻譯後修飾的抗人Tie2抗體或其抗原結合片段的實例,包括在重鏈可變區的N端處已經歷焦穀氨醯化和/或在重鏈的C端處缺失賴氨酸的抗人Tie2抗體或其抗原結合片段。在本領域中,已知這種由N端處的焦穀氨醯化和C端處賴氨酸的缺失造成的翻譯後修飾對抗體的活性沒有任何影響(AnalyticalBiochemistry,2006,Vol.348,p.24-39)。在一種實施方式中,本發明的抗人Tie2抗體是具有下列特徵(1)至(4)任一項的抗人Tie2抗體。(1)包含兩條重鏈和四條輕鏈的抗人Tie2抗體,所述重鏈由其中SEQIDNO:2的第1位胺基酸的穀氨酸被修飾成焦穀氨酸和/或SEQIDNO:2的第679位胺基酸的賴氨酸被缺失的胺基酸序列構成,並且所述輕鏈由SEQIDNO:4所示的胺基酸序列構成。(2)包含兩條重鏈和四條輕鏈的抗人Tie2抗體,所述重鏈由其中SEQIDNO:6的第1位胺基酸的穀氨酸被修飾成焦穀氨酸和/或SEQIDNO:6的第679位胺基酸的賴氨酸被缺失的胺基酸序列構成,並且所述輕鏈由SEQIDNO:4所示的胺基酸序列構成。(3)包含兩條重鏈和四條輕鏈的抗人Tie2抗體,所述重鏈由其中SEQIDNO:8的第1位胺基酸的穀氨酸被修飾成焦穀氨酸和/或SEQIDNO:8的第679位胺基酸的賴氨酸被缺失的胺基酸序列構成,並且所述輕鏈由SEQIDNO:4所示的胺基酸序列構成。(4)包含兩條重鏈和四條輕鏈的抗人Tie2抗體,所述重鏈由其中SEQIDNO:10的第1位胺基酸的穀氨酸被修飾成焦穀氨酸和/或SEQIDNO:10的第676位胺基酸的賴氨酸被缺失的胺基酸序列構成,並且所述輕鏈由SEQIDNO:4所示的胺基酸序列構成。在一種實施方式中,本發明的抗人Tie2抗體是具有下列特徵的抗人Tie2抗體。包含兩條重鏈和四條輕鏈的抗人Tie2抗體,所述重鏈由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成,並且所述輕鏈由SEQIDNO:4所示的胺基酸序列構成。本發明還包括具有下列特徵的抗人Tie2抗體或其抗原結合片段。一種抗人Tie2抗體或其抗原結合片段,其包含4個重鏈可變區和4個輕鏈可變區,其中所述重鏈可變區包含由SEQIDNO:2的第31至35位胺基酸的胺基酸序列構成的CDR1、由SEQIDNO:2的第50至66位胺基酸的胺基酸序列構成的CDR2和由SEQIDNO:2的第99至111位胺基酸的胺基酸序列構成的CDR3,所述輕鏈可變區包含由SEQIDNO:4的第24至39位胺基酸的胺基酸序列構成的CDR1、由SEQIDNO:4的第55至61位胺基酸的胺基酸序列構成的CDR2和由SEQIDNO:4的第94至102位胺基酸的胺基酸序列構成的CDR3;並且一個所述重鏈可變區和一個所述輕鏈可變區組成一個抗原結合位點,並且所述抗體或其抗原結合片段包含4個抗原結合位點。此外,本發明還包括具有下列特徵的抗人Tie2抗體。一種抗人Tie2抗體,其包含兩條重鏈和四條輕鏈,其中每條重鏈包含兩個由重鏈可變區以及CH1區構成的結構、CH2區和CH3區,所述重鏈可變區包含由SEQIDNO:2的第31至35位胺基酸的胺基酸序列構成的CDR1、由SEQIDNO:2的第50至66位胺基酸的胺基酸序列構成的CDR2和由SEQIDNO:2的第99至111位胺基酸的胺基酸序列構成的CDR3,並且一個所述結構的羧基端通過連接物連接到另一個結構的氨基端,並且每條輕鏈包含輕鏈可變區和輕鏈恆定區,所述輕鏈可變區包含由SEQIDNO:4的第24至39位胺基酸的胺基酸序列構成的CDR1、由SEQIDNO:4的第55至61位胺基酸的胺基酸序列構成的CDR2和由SEQIDNO:4的第94至102位胺基酸的胺基酸序列構成的CDR3。本發明的抗人Tie2抗體是結合於人Tie2的抗體。所述抗體是否結合於人Tie2(登錄號NP_000450.2),可以使用已知的結合活性測量方法來驗證。結合活性測量方法的實例包括酶聯免疫吸附測定(ELISA)方法等。在使用ELISA的情況下,在示例性方法中,將通過人Tie2與人Fc的融合形成的蛋白固定在ELISA板上,並向其添加試驗抗體以進行反應。將第二抗體例如生物素標記的抗IgG抗體與生成物反應,洗滌,然後與結合有酶例如鹼性磷酸酶的鏈親和素反應。在清洗後,可以通過使用活性檢測試劑(例如在鹼性磷酸酶的情況下,化學發光超靈敏AP微孔和/或膜底物(450nm)(BioFX,APU4-0100-01)等)進行活性測量,來驗證所述試驗抗體是否結合於人Tie2。作為評估活性的特異性方法,可以使用例如與在後文中所描述的實施例12中描述的方法相同的方法。本發明的抗人Tie2抗體還包括除了結合人Tie2之外還結合源自於其他動物的Tie2(例如猴Tie2)的抗體,只要它是結合人Tie2的抗體即可。優選地,本發明的抗人Tie2抗體結合人Tie2,並且此外對表達人Tie2的細胞具有抗凋亡活性。作為評估抗體是否對表達人Tie2的細胞具有抗凋亡活性的特異性方法,可以使用與在後文中所描述的實施例4中描述的方法相同的方法。本發明的抗人Tie2抗體或其抗原結合片段包括四價抗人Tie2抗體或其抗原結合片段,其與包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體,或與包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體結合相同的人Tie2表位。在這裡,表位是指被抗體識別的抗原位點。本發明的抗人Tie2抗體或其抗原結合片段包括一種四價抗人Tie2抗體或其抗原結合片段,其結合於包含人Tie2(登錄號NP_000450.2)的第192、195和197位胺基酸中的至少一個胺基酸的表位。此外,本發明的抗人Tie2抗體或其抗原結合片段包含一種四價抗人Tie2抗體或其抗原結合片段,其結合於包含人Tie2(登錄號NP_000450.2)的第192、195和197位胺基酸的表位。所述與包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體,或與包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體結合相同的人Tie2表位的四價抗人Tie2抗體或其抗原結合片段,可以通過使用已知用於確定表位的方法來獲取。用於確定表位的方法的實例包括氫/氘交換質譜術、X-射線晶體結構分析、ELISA和使用人Tie2的胺基酸置換突變體、人Tie2的部分肽等的表面等離子體共振現象等。通過使用如上所述用於確定表位的公知方法,可以檢查試驗抗體是否與所述包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體,或與所述包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體結合相同的人Tie2表位。在使用氫/氘交換質譜術的情況下,將在不存在試驗抗體的情況下具有氘置換的人Tie2和在存在試驗抗體的情況下具有氘置換的人Tie2各自分解成肽,並測量每種肽分子的量以計算氘置換的比率。試驗抗體的人Tie2表位,可以從在存在或不存在試驗抗體的情況下人Tie2的氘置換比率的差異來確定。在使用ELISA的情況下,製備人Tie2的點突變體。將所述突變的人Tie2固定,並向其添加試驗抗體以經歷反應。在反應後,與第二抗體例如生物素標記的抗人κ輕鏈抗體反應並清洗。隨後,將鹼性磷酸酶標記的親和素(ThermoFisherScientific,21324)與其進行反應並清洗。此外,可以通過使用化學發光超靈敏AP微孔和/或膜底物(450nm)等進行活性測量,來鑑定所述試驗抗體是否結合於所述突變的人Tie2。通過評估與各種不同類型的突變人Tie2的結合活性,可以確定試驗抗體的表位。在試驗抗體的表位包含所述包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體或所述包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體的表位中的至少一個胺基酸的情況下,可以確定所述試驗抗體與所述包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體,或與所述包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體結合相同的人Tie2表位。本發明的抗人Tie2抗體或其抗原結合片段,可以由本領域技術人員在本說明書中所公開的本發明的抗體的重鏈可變區和輕鏈可變區的序列信息的基礎上,使用本領域中已知的方法容易地製備。對本發明的抗人Tie2抗體或其抗原結合片段沒有特別限制,但是可以按照例如在後文中描述的中描述的方法來生產。本發明的抗人Tie2抗體或其抗原結合片段可以按照常規方法根據需要進一步純化並配製。它可用於預防或治療與血管相關的疾病例如糖尿病性視網膜病變、糖尿病性黃斑水腫、膿毒症、急性肝障礙、急性腎障礙、急性肺障礙、系統性炎性反應症候群、外周動脈阻塞疾病或嚴重肢體缺血。本發明的多核苷酸包括包含編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸和包含編碼本發明的抗人Tie2抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸。在一種實施方式中,所述包含編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸,是包含編碼由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成的重鏈可變區的鹼基序列的多核苷酸。所述包含編碼由SEQIDNO:2的第1至122位胺基酸的胺基酸序列所示的重鏈可變區的鹼基序列的多核苷酸的實例,包括包含SEQIDNO:1的第1至366位鹼基的鹼基序列的多核苷酸。在優選實施方式中,所述包含編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸,是包含編碼由SEQIDNO:2所示的胺基酸序列構成的重鏈的鹼基序列的多核苷酸、包含編碼由SEQIDNO:6所示的胺基酸序列構成的重鏈的鹼基序列的多核苷酸、包含編碼由SEQIDNO:8所示的胺基酸序列構成的重鏈的鹼基序列的多核苷酸或包含編碼由SEQIDNO:10所示的胺基酸序列構成的重鏈的鹼基序列的多核苷酸.所述包含編碼由SEQIDNO:2所示的胺基酸序列構成的重鏈的鹼基序列的多核苷酸的實例,包括包含由SEQIDNO:1所示的鹼基序列的多核苷酸。所述包含編碼由SEQIDNO:6所示的胺基酸序列構成的重鏈的鹼基序列的多核苷酸的實例,包括包含由SEQIDNO:5所示的鹼基序列的多核苷酸。所述包含編碼由SEQIDNO:8所示的胺基酸序列構成的重鏈的鹼基序列的多核苷酸的實例,包括包含由SEQIDNO:7所示的鹼基序列的多核苷酸。所述包含編碼由SEQIDNO:10所示的胺基酸序列構成的重鏈的鹼基序列的多核苷酸的實例,包括包含由SEQIDNO:9所示的鹼基序列的多核苷酸。在一種實施方式中,所述包含編碼本發明的抗人Tie2抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸,是包含編碼由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成的輕鏈可變區的鹼基序列的多核苷酸。所述包含編碼由SEQIDNO:4的第1至113位胺基酸的胺基酸序列所示的輕鏈可變區的鹼基序列的多核苷酸的實例,包括包含SEQIDNO:3的第1至339位鹼基的鹼基序列的多核苷酸。在優選實施方式中,所述包含編碼本發明的抗人Tie2抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸,是包含編碼由SEQIDNO:4所示的胺基酸序列構成的輕鏈的鹼基序列的多核苷酸。所述包含編碼由SEQIDNO:4所示的胺基酸序列構成的輕鏈的鹼基序列的多核苷酸的實例,包括包含由SEQIDNO:3所示的鹼基序列的多核苷酸。本發明的多核苷酸可以由本領域技術人員在鹼基序列的基礎上,使用本領域已知方法容易地製備。例如,本發明的多核苷酸可以使用本領域中已知的基因合成方法來合成。作為基因合成方法,可以使用本領域技術人員已知的各種不同方法,例如在WO90/07861中描述的抗體基因合成方法。此外,一旦獲得本發明的多核苷酸之後,可以通過將變異導入到所述多核苷酸的預定位點中,來獲得本發明的其他多核苷酸。作為這種導入變異的方法,可以使用本領域技術人員已知的各種不同方法,例如定點誘變方法(《分子生物學現代方法》(CurrentProtocolsinMolecularBiology),1987,JohnWiley&SonsSection8.1-8.5)。本發明的表達載體包括包含編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸和/或包含編碼本發明的抗人Tie2抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸。各種不同格式的四價抗體及其生產方法在本領域中是公知的,並且本發明的表達載體可以由本領域技術人員根據這些生產方法或待表達的四價抗體的格式容易地建立。本發明的表達載體的優選實例包括包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸的表達載體、包含含有編碼本發明的抗人Tie2抗體的輕鏈的鹼基序列的多核苷酸的表達載體、以及包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸和包含含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸的表達載體。對用於表達本發明的多核苷酸的表達載體沒有特別限制,只要包含編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸和/或包含編碼本發明的抗人Tie2抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸可以在真核細胞(例如動物細胞、昆蟲細胞、植物細胞和酵母)和/或原核細胞(例如大腸埃希氏桿菌)的各種不同宿主細胞中表達,並且由它們編碼的多肽可以生產即可。所述表達載體的實例包括質粒載體、病毒載體(例如腺病毒、腺相關病毒、仙臺病毒或反轉錄病毒)等。優選地,可以使用pEE6.4或pEE12.4(Lonza公司)。此外,抗體基因可以通過使用事先包含人Ig恆定區基因的表達載體例如AG-γ1或AG-κ來表達(例如參見WO94/20632)。本發明的表達載體可以包含與本發明的多核苷酸可操作連接的啟動子。用於使用動物細胞表達本發明的多核苷酸的啟動子的實例包括病毒衍生的啟動子例如CMV、RSV或SV40、肌動蛋白啟動子、EF(延伸因子)1α啟動子和熱休克啟動子。用於通過細菌(例如大腸埃希氏桿菌)表達的啟動子的實例包括trp啟動子、lac啟動子、λPL啟動子和tac啟動子。此外,用於通過酵母表達的啟動子的實例包括GAL1啟動子、GAL10啟動子、PH05啟動子、PGK啟動子、GAP啟動子和ADH啟動子。在使用動物細胞、昆蟲細胞或酵母作為宿主細胞的情況下,本發明的表達載體可以包含起始密碼子和終止密碼子。在這種情況下,本發明的表達載體可以包含增強子序列、編碼本發明的抗體或重鏈可變區或輕鏈可變區的基因的5』側和3』側上的非翻譯區、分泌信號序列、剪接接頭、聚腺苷化位點或可複製單元。當使用大腸埃希氏桿菌作為宿主細胞時,本發明的表達載體可以包含起始密碼子、終止密碼子、終止子區和可複製單元。在這種情況下,本發明的表達載體可以包含選擇標記(例如四環素抗性基因、氨苄青黴素抗性基因、卡那黴素抗性基因、新黴素抗性基因或二氫葉酸還原酶基因),其一般根據需要使用。本發明的轉化的宿主細胞包括用本發明的表達載體轉化的宿主細胞,其選自下列(a)至(d):(a)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸和含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸;(b)一種用以下兩個表達載體轉化的宿主細胞:一個表達載體包含含有編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸;(c)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸;以及(d)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼本發明的抗人Tie2抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸。在一種實施方式中,本發明的轉化的宿主細胞是用本發明的表達載體轉化的宿主細胞,其選自下列(a)至(d):(a)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸和含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸;(b)一種用以下兩個表達載體轉化的宿主細胞:一個表達載體包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸;(c)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸;以及(d)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼本發明的抗人Tie2抗體的輕鏈的鹼基序列的多核苷酸。本發明的轉化的宿主細胞的優選實例包括用包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸和含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸的表達載體轉化的宿主細胞,以及用以下兩個表達載體轉化的宿主細胞,其中一個表達載體包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸。對所述轉化的宿主細胞沒有特別限制,只要所述宿主細胞適合於所使用的表達載體、被所述表達載體轉化並且可以表達所述抗體即可。轉化的宿主細胞的實例包括在本發明的領域中通常使用的各種不同細胞,例如天然細胞或人工建立的細胞(例如動物細胞(例如CHO-K1SV細胞),昆蟲細胞(例如Sf9),細菌(例如大腸埃希氏桿菌),酵母(例如酵母菌或畢赤酵母)等)。優選地,可以使用培養的細胞例如CHO細胞(CHO-K1SV細胞、CHO-DG44細胞等)、293細胞或NS0細胞。對轉化所述宿主細胞的方法沒有特別限制,但可以使用例如磷酸鈣方法或電穿孔方法。用於生產本發明的抗人Tie2抗體或其抗原結合片段的方法的實例包括一種生產抗人Tie2抗體或其抗原結合片段的方法,所述方法包括培養選自下列(a)至(c)的宿主細胞以表達四價抗人Tie2抗體或其抗原結合片段:(a)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸和含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸;(b)一種用以下兩個表達載體轉化的宿主細胞:一個表達載體包含含有編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸;以及(c)兩種宿主細胞,一種宿主細胞用包含含有編碼本發明的抗人Tie2抗體或其抗原結合片段的重鏈可變區的鹼基序列的多核苷酸的表達載體轉化,另一種宿主細胞用包含含有編碼所述抗體或其抗原結合片段的輕鏈可變區的鹼基序列的多核苷酸的表達載體轉化。在一種實施方式中,用於生產本發明的抗人Tie2抗體的方法的實例包括一種用於生產抗人Tie2抗體的方法,所述方法包括培養選自下列(a)至(c)的宿主細胞以表達抗人Tie2抗體:(a)一種用表達載體轉化的宿主細胞,所述表達載體包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸和含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸;(b)一種用以下兩個表達載體轉化的宿主細胞:一個表達載體包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸,另一個表達載體包含含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸;以及(c)兩種宿主細胞,一種宿主細胞用包含含有編碼本發明的抗人Tie2抗體的重鏈的鹼基序列的多核苷酸的表達載體轉化,另一種宿主細胞用包含含有編碼所述抗體的輕鏈的鹼基序列的多核苷酸的表達載體轉化。對用於生產本發明的抗人Tie2抗體的方法沒有特別限制,只要它包含培養本發明的轉化的宿主細胞以表達所述抗人Tie2抗體的步驟即可。在所述方法中使用的優選的宿主細胞的實例包括如上所述的本發明的優選的轉化的宿主細胞。所述轉化的宿主細胞可以通過已知方法來培養。適當地選擇培養條件例如溫度、培養基的pH和培養時間。在所述宿主細胞是動物細胞的情況下,培養基的實例包括增補有約5%至20%的胎牛血清的MEM培養基(Science,1959,Vol.130,No.3373,p.432to7)、DMEM培養基(Virology,1959,Vol.8,p.396)和RPMI1640培養基(J.Am.Mde.Assoc.,1967,Vol.199,p.519)、199培養基(Exp.Biol.Med.,1950,Vol.73,p.1to8)。所述培養基的pH優選地約為6至8,並且培養通常在約30℃至40℃下進行約15小時至72小時,同時如有必要,通入空氣並攪拌。在所述宿主細胞是昆蟲細胞的情況下,作為培養基,可以使用例如增補有胎牛血清的Grace’s培養基(Proc.Natl.Acad.Sci.USA,1985,Vol.82,p.8404)。所述培養基的pH優選為約5至8,並且培養通常在約20℃至40℃下進行約15小時至100小時,同時如有必要,通入空氣並攪拌。在所述宿主細胞是大腸埃希氏桿菌或酵母的情況下,作為培養基,例如增補有營養源的液體培養基是適合的。優選地,所述營養培養基含有所述轉化的宿主細胞生長所必需的碳源、無機氮源或有機氮源。所述碳源的實例包括葡萄糖、葡聚糖、可溶性澱粉和蔗糖,所述無機氮源或有機氮源的實例包括銨鹽、硝酸鹽、胺基酸、玉米漿、蛋白腖、酪蛋白、肉汁、大豆粉和馬鈴薯提取物。如果需要,可以包含其他營養物(例如無機鹽(如氯化鈣、磷酸二氫鈉和氯化鎂)、維生素)和抗生素(例如四環素、新黴素、氨苄青黴素和卡那黴素)。所述培養基的pH優選為約5至8。在所述宿主細胞是大腸埃希氏桿菌的情況下,培養基的優選實例包括LB培養基和M9培養基(Mol.Clo.,ColdSpringHarborLaboratory,Vol.3,A2.2)。培養通常在約14℃至39℃下進行約3小時至24小時,同時如有必要,通入空氣並攪拌。在所述宿主細胞是酵母的情況下,作為培養基,可以使用例如Burkholder最低培養基(Proc.Natl.Acad,Sci,USA,1980,Vol.77,p.4505)。培養通常在約20℃至35℃下進行約14小時至144小時,同時如有必要,通入空氣並攪拌。通過以上述方式進行培養,可以表達本發明的抗人Tie2抗體或其抗原結合片段。所述生產本發明的抗人Tie2抗體或其抗原結合片段的方法除了培養本發明的轉化的宿主細胞以表達所述抗人Tie2抗體或其抗原結合片段之外,還可以包括從所述轉化的宿主細胞回收、優選地分離或純化所述抗人Tie2抗體或其抗原結合片段。分離或純化方法的實例包括利用溶解度的方法例如鹽析和溶劑沉澱方法,利用分子量差異的方法例如透析、超濾和凝膠過濾,利用電荷的方法例如離子交換層析和羥基磷灰石層析,利用特定親和性的方法例如親和層析,利用疏水性差異的方法例如反相高效液相色譜,以及利用等電點差異的方法例如等電聚焦電泳。優選地,積累在培養上清液中的抗體可以通過各種不同的層析例如使用蛋白A柱或蛋白G柱的柱層析來純化。本發明的抗人Tie2抗體或其抗原結合片段還包括通過所述生產本發明的抗人Tie2抗體或其抗原結合片段的方法生產的抗人Tie2抗體或其抗原結合片段。本發明的藥物組合物包括包含本發明的抗人Tie2抗體或其抗原結合片段和可藥用賦形劑的藥物組合物。本發明的藥物組合物可以通過通常使用的方法,使用本領域中常用的賦形劑即用於藥物的賦形劑或用於藥物的載體來製備。所述藥物組合物的劑型的實例包括腸胃外藥物例如注射藥物和滴注藥物,並且這些藥物可以通過靜脈內給藥、皮下給藥、眼內給藥等來給藥。在藥物製備中,符合所述劑型的賦形劑、載體和添加劑可以在製藥學上可接受的範圍內使用。本發明的藥物組合物可以包含多種本發明的抗人Tie2抗體或其抗原結合片段。例如,本發明包括包含不經歷翻譯後修飾的抗體或其抗原結合片段以及源自於所述抗體或其抗原結合片段的翻譯後修飾的抗體或其抗原結合片段的藥物組合物。在一種實施方式中,本發明的包含抗人Tie2抗體或其抗原結合片段的藥物組合物包括如下所述的藥物組合物。一種藥物組合物,其包含一種抗人Tie2抗體或其抗原結合片段,其中所述抗人Tie2抗體或其抗原結合片段包含4個重鏈可變區和4個輕鏈可變區,所述重鏈可變區由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成,所述輕鏈可變區由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成,一個所述重鏈可變區和一個所述輕鏈可變區組成一個抗原結合位點,並且所述抗體或其抗原結合片段包含4個抗原結合位點;以及源自於所述抗體或其抗原結合片段的翻譯後修飾的抗體或其抗原結合片段。在一種實施方式中,本發明的包含抗人Tie2抗體的藥物組合物包括如下所述的藥物組合物。一種藥物組合物,其包含:一種抗人Tie2抗體,所述抗體是抗人Tie2抗體和通過所述抗體的翻譯後修飾形成的抗體,其包含兩條重鏈和四條輕鏈,其中每條重鏈包含兩個由重鏈可變區以及CH1區構成的結構、CH2區和CH3區,所述重鏈可變區由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成,並且一個所述結構的C端通過連接物連接到另一個結構的N端,並且每條輕鏈包含由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成的輕鏈可變區,和輕鏈恆定區,並且所述抗體包含四個抗原結合位點;以及源自於所述抗體的翻譯後修飾的抗體。本發明的藥物組合物還包括一種藥物組合物,其包含其中重鏈C端的賴氨酸被缺失的抗體、N端具有翻譯後修飾的抗體或其抗原結合片段、其中重鏈C端的賴氨酸被缺失並且對N端做出翻譯後修飾的抗體、和/或在重鏈的C端中具有賴氨酸並且N端沒有翻譯後修飾的抗體。在一種實施方式中,本發明的包含抗人Tie2抗體的藥物組合物包括一種藥物組合物,其包含選自下列(1)至(4)的至少兩種抗人Tie2抗體。(1)一種抗人Tie2抗體,其包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(2)一種抗人Tie2抗體,其包含兩條由SEQIDNO:2的胺基酸序列構成並且其中第1位胺基酸的穀氨酸被修飾成焦穀氨酸的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(3)一種抗人Tie2抗體,其包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成並且其中第1位胺基酸的穀氨酸被修飾成焦穀氨酸的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(4)一種抗人Tie2抗體,其包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。在一種實施方式中,本發明的包含抗人Tie2抗體的藥物組合物包括一種藥物組合物,其包含選自下列(1)至(4)的至少兩種抗人Tie2抗體。(1)一種抗人Tie2抗體,其包含兩條由SEQIDNO:6的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(2)一種抗人Tie2抗體,其包含兩條由SEQIDNO:6的胺基酸序列構成並且其中第1位胺基酸的穀氨酸被修飾成焦穀氨酸的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(3)一種抗人Tie2抗體,其包含兩條由SEQIDNO:6的第1至678位胺基酸的胺基酸序列構成並且其中第1位胺基酸的穀氨酸被修飾成焦穀氨酸的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(4)一種抗人Tie2抗體,其包含兩條由SEQIDNO:6所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。在一種實施方式中,本發明的包含抗人Tie2抗體的藥物組合物包括一種藥物組合物,其包含選自下列(1)至(4)的至少兩種抗人Tie2抗體。(1)一種抗人Tie2抗體,其包含兩條由SEQIDNO:8的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(2)一種抗人Tie2抗體,其包含兩條由SEQIDNO:8的胺基酸序列構成並且其中第1位胺基酸的穀氨酸被修飾成焦穀氨酸的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(3)一種抗人Tie2抗體,其包含兩條由SEQIDNO:8的第1至678位胺基酸的胺基酸序列構成並且其中第1位胺基酸的穀氨酸被修飾成焦穀氨酸的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(4)一種抗人Tie2抗體,其包含兩條由SEQIDNO:8所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。在一種實施方式中,本發明的包含抗人Tie2抗體的藥物組合物包括一種藥物組合物,其包含選自下列(1)至(4)的至少兩種抗人Tie2抗體。(1)一種抗人Tie2抗體,其包含兩條由SEQIDNO:10的第1至675位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(2)一種抗人Tie2抗體,其包含兩條由SEQIDNO:10的胺基酸序列構成並且其中第1位胺基酸的穀氨酸被修飾成焦穀氨酸的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(3)一種抗人Tie2抗體,其包含兩條由SEQIDNO:10的第1至675位胺基酸的胺基酸序列構成並且其中第1位胺基酸的穀氨酸被修飾成焦穀氨酸的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。(4)一種抗人Tie2抗體,其包含兩條由SEQIDNO:10所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈。在一種實施方式中,本發明的包含抗人Tie2抗體或其抗原結合片段的藥物組合物還包括如下所述的藥物組合物。一種藥物組合物,其包含:包含兩條由SEQIDNO:2所示的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體;包含兩條由SEQIDNO:2的第1至678位胺基酸的胺基酸序列構成的重鏈和四條由SEQIDNO:4所示的胺基酸序列構成的輕鏈的抗人Tie2抗體;以及可藥用賦形劑。在配方中添加的本發明的抗人Tie2抗體或其抗原結合片段的量隨著症狀程度和患者年齡、待使用的製劑的劑型、抗體的結合滴度等而變,例如,可以使用約0.001mg/kg至100mg/kg的添加量。本發明的藥物組合物可作為藥劑用於預防或治療與血管相關的疾病例如糖尿病性視網膜病變、糖尿病性黃斑水腫、膿毒症、急性肝障礙、急性腎障礙、急性肺障礙、系統性炎性反應症候群、外周動脈阻塞性疾病或嚴重肢體缺血。本發明包括用於預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血的藥物組合物,其包含本發明的抗人Tie2抗體。此外,本發明包括用於預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血的方法,所述方法包括給藥有效量的本發明的抗人Tie2抗體。此外,本發明包括用於預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血的本發明的抗人Tie2抗體。另外,本發明包括本發明的抗人Tie2抗體的用途,其用於製備藥物組合物以預防或治療糖尿病性黃斑水腫、糖尿病性視網膜病變或嚴重肢體缺血。使用本領域中已知的方法,本領域的任何技術人員可以製備將抗體或其抗原結合片段與另一個肽或蛋白質融合的融合抗體,並且也可以製備結合有修飾劑的修飾抗體。本發明的抗人Tie2抗體或其抗原結合片段包括採取這種融合或修飾形式的抗體及其抗原結合片段。例如,所述抗人Tie2抗體或其抗原結合片段包括與另一個肽或蛋白質融合的抗人Tie2抗體或其抗原結合片段和結合有修飾劑的抗人Tie2抗體或其抗原結合片段,所述抗體或其抗原結合片段包含4個重鏈可變區重鏈可變區和4個輕鏈可變區,其中所述重鏈可變區由SEQIDNO:2的第1至122位胺基酸的胺基酸序列構成,所述輕鏈可變區由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成,一個所述重鏈可變區和一個所述輕鏈可變區組成一個抗原結合位點,並且所述抗體或其抗原結合片段包含4個抗原結合位點。對用於所述融合體中的所述另一個肽或蛋白沒有特別限制,只要本發明的抗體或其抗原結合片段作為融合體對人Tie2具有結合活性即可,其實例包括人血清白蛋白、各種標籤肽、人造螺旋基序肽、麥芽糖結合蛋白、穀胱甘肽S轉移酶、各種不同毒素和能夠促進多聚體化的其他肽或蛋白質。對用於所述修飾中的修飾劑沒有特別限制,只要本發明的抗體或其抗原結合片段作為修飾抗體對人Tie2具有結合活性即可,其實例包括聚乙二醇、糖鏈、磷酯類、脂質體和低分子量化合物。本發明已被描述,並且為更好的理解而參考的具體實施例將被提供,但是它們僅僅是實例,並且本發明不限於此。實施例對於使用可商購試劑盒或試劑的部分來說,除非另有具體指明,否則實驗按照所描述的流程來進行。為方便起見,以mol/L為單位的濃度用M表示。例如,1M氧化鈉水溶液意味著1mol/L的氧化鈉水溶液。(實施例1:生產抗人Tie2抗體的雜交瘤的製備)使用「VelocImmune」(VelocImmune抗體技術:Regeneron公司.(美國專利號6596541))-人單克隆抗體開發技術-小鼠來製備抗體。將重組人Tie2-Fc嵌合蛋白(R&D,313-TI-100)與用於引起免疫反應的佐劑一起注射到VelocImmune小鼠中,以便進行免疫接種。按照通常方法,提取被免疫接種小鼠的淋巴結,收集淋巴細胞並與小鼠來源的骨髓瘤細胞SP2/0(ATCC:CRL-1581)進行細胞融合,由此製備雜交瘤。將所述雜交瘤單克隆化,並將每個克隆培養在作為無血清培養基的CD雜交瘤培養基(Invitrogen)中。使用蛋白G柱(GEHealthcare)從得到的培養上清液純化抗體。所述使用VelocImmune技術獲得的抗體是具有人抗體的可變區和小鼠抗體的恆定區的抗體(也被稱為嵌合抗體)。(實施例2:細胞ELISA測定法)為了測量所述抗體的抗原結合活性,使用表達人Tie2的CHO細胞、表達猴Tie2的CHO細胞、表達大鼠Tie2的CHO細胞和表達小鼠Tie2的CHO細胞,通過細胞ELISA測定法各自評估所述抗體與人Tie2、猴Tie2、大鼠Tie2和小鼠Tie2的結合。(實施例3:使用修飾的Ang-1評估競爭活性)為了評估所述抗體的Ang-2競爭活性,評估了修飾的Ang-1(Proc.Natl.Acad.Sci.,2004,Vol.101,pp.5547-5552,也被稱為COMP-Ang1)與Tie2的結合的抑制。COMP-Ang1是一種修飾的Ang-1,其中不參與結合到Tie2的位點被修飾,並且從COMP-Ang1與Tie2的結合能力得以維持(Proc.Natl.Acad.Sci.2004,Vol.101,pp.5547-5552),並且Ang-1和Ang-2以相同的親和力水平結合到Tie2的相同位點(Science,1997,Vol.277,pp.55-60)的觀點來看,它對抗Ang-2的競爭作用可以通過評估對抗COMP-Ang1的競爭作用來評估。將COMP-Ang1的表達載體導入到HEK293細胞中。從所述HEK293細胞的培養上清液純化COMP-Ang1並進行生物素標記。將所述生物素標記的COMP-Ang1與在實施例1中獲得的純化的抗體混合,並將所述混合物添加到固定化有重組人Tie2-Fc嵌合蛋白的板。為了檢測由此結合的生物素標記的COMP-Ang1,使用鏈親和素標記的HRP。向其添加TMB顯色劑(Dako,S1599)並靜置。此外,隨後向其添加2M硫酸以終止反應,並測量在450nm處的吸收。通過這種方式,評估了所述抗體對抗COMP-Ang1的競爭作用。(實施例4:使用表達人Tie2的BaF3細胞評估抗凋亡活性)穩定表達人Tie2的小鼠前B細胞株BaF3細胞(在後文中也被稱為表達人Tie2的BaF3細胞),按照在Immunity,1998,Vol.9,pp.677-686中描述的方法,通過電穿孔將含有由SEQIDNO:21所示的人Tie2基因的質粒導入到所述細胞中來製備。隨後,使用同一細胞來評估抗體的抗凋亡活性。將表達人Tie2的BaF3細胞以2×105個細胞/mL懸浮在增補有0.05%胎牛血清白蛋白的RPMI1640培養基(LifeTechnologies)中,並以每孔80μL的量分配在96孔板中用於懸浮細胞(住友電木株式會社,MS-8096R)。隨後,向其添加20μL在實施例1中獲得的純化的抗體或Ang-1。在設置到37℃的CO2溫育箱中培養72小時後,將50μL細胞懸液轉移到白色96孔板(Nunc,236108)。按照細胞內ATP定量試劑CellTiterGlo發光細胞存活率試劑盒(Promega),通過向細胞懸液添加50μL用隨附的緩衝液稀釋的底物溶液,測量細胞的存活率,由此評估抗凋亡活性。從實施例2至4的結果,發現了對人Tie2、猴Tie2、大鼠Tie2和小鼠Tie2具有結合活性,具有COMP-Ang1競爭活性並對人Tie2具有抗凋亡活性的抗體。包含將在後文中描述的被命名為2-16的抗人Tie2抗體的純化的抗體溶液,表現出與實施例4中的Ang-1基本上相同的抗凋亡活性,但包含小鼠抗人Tie2抗體15B8(專利文獻1)的純化的抗體溶液僅表現出Ang-1的最大活性的約60%。(實施例5:使用孔徑排阻層析和電泳分析純化的抗體溶液)將在上面的實施例2至4中鑑定的純化的抗體溶液通過孔徑排阻層析進行分析。作為結果,從相應的純化的抗體溶液檢測到3個級分。作為通過電泳分析相應級分溶液的結果,發現相應的級分分別包括所述抗體的單體、二聚體、三聚體或更高價的多聚體。接下來,通過實施例4中示出的方法評估相應級分溶液的抗凋亡活性。作為結果,在包含二聚體的級分和包含三聚體或更高價多聚體的級分中,識別到強烈的抗凋亡活性。另一方面,在包含來自於相應抗體的單體的級分中,基本上不能識別到抗凋亡活性。也通過如上所述的孔徑排阻層析對15B8進行了分析,並且作為結果,檢測到顯示出二聚體或更高價多聚體的級分,但是基本上未檢測到包含單體的級分。從上述結果發現,在實施例2至4中鑑定的任何抗體中,包含形成為二聚體或更高階多聚體的抗體的級分涉及強烈的抗凋亡活性。已建議,具有四價或更高價的抗體通過Tie2活化具有強的抗凋亡活性,因為二聚體是四價抗體。(實施例6:通過交聯抗體評估抗凋亡活性)從實施例5中的調查,認為將抗人Tie2抗體的價數調整到4或更高,對於通過Tie2誘導抗凋亡活性來說是重要的。因此,評估了通過與抗小鼠IgG抗體進行交聯而多聚體化的抗人Tie2抗體的抗凋亡活性。作為細胞,使用表達人Tie2的BaF3細胞和內源性表達人Tie2的人血管內皮細胞HUVEC。將表達人Tie2的BaF3細胞和HUVEC分別培養在RPMI1640培養基和EBM-2無血清培養基(Lonza)中,已向所述培養基添加了包含在實施例2至4中鑑定到的抗人Tie2抗體的抗體溶液。向其添加抗小鼠IgG抗體以交聯所述抗體。通過使用CellTiterGlo發光細胞存活率測定法,測量細胞的存活率。通過計算存活率,對抗凋亡活性進行評估。作為結果,發現被命名為2-16的抗人Tie2抗體(嵌合抗體)的交聯的抗體對人Tie2具有強烈的抗凋亡活性。(實施例7:二價抗人Tie2抗體的測序)從生產抗人Tie2抗體2-16的雜交瘤克隆編碼抗體的重鏈和輕鏈的基因,並進行測序。在對抗體測序後,將2-16的輕鏈和重鏈的構架區(FR)用另一個人抗體的FR替換,以便提高抗體的物理性質和穩定性,由此製備了抗人Tie2抗體2-16A2的修飾的可變區。將編碼信號序列的基因(ProteinEngineering,1987,Vol.1,No.6,pp.499-505)和人Igγ1恆定區基因(由SEQIDNO:11的第367至1356位鹼基的鹼基序列構成)分別連接到2-16A2的重鏈可變區基因的5』側和3』側,並將所述重鏈基因插入到GS載體pEE6.4中。另外,將編碼信號序列的基因(ProteinEngineering,1987,Vol.1,No.6,pp.499-505)和人κ鏈的恆定區基因(由SEQIDNO:3的第340至657位鹼基的鹼基序列構成)分別連接到輕鏈可變區基因的5』側和3』側。將該輕鏈基因插入到GS載體pEE12.4中。使用測序儀分析製備的抗體的重鏈基因序列和輕鏈基因序列。完全的人抗體2-16A2(完全的人2-16A2)的重鏈的鹼基序列和由所述鹼基序列編碼的胺基酸序列分別由SEQIDNO:11和12示出。此外,所述抗體的輕鏈的鹼基序列和由所述鹼基序列編碼的胺基酸序列分別由SEQIDNO:3和4示出。SEQIDNO:12所示的重鏈的可變區由SEQIDNO:12的第1至122位胺基酸的胺基酸序列構成,SEQIDNO:4所示的輕鏈的可變區由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成。通過使用如上所述的已各自插入完全的人2-16A2的重鏈和輕鏈的基因的GS載體,通過使用兩種方法即瞬時表達和穩定表達來進行所述抗體的表達。對於瞬時表達來說,使用轉染試劑盒293Fectin(Invitrogen),將在FreeStyle293表達培養基(Invitrogen)中培養的FreeStyle293細胞(Invitrogen)以約1,000,000個細胞/mL的密度用如上所述的重鏈和輕鏈的兩種表達載體轉染,並培養5天。或者,使用轉染試劑盒ExpiFectamine293轉染試劑盒(Invitrogen),將在Expi293表達培養基(Invitrogen)中培養的Expi293細胞(Invitrogen)以約3,000,000個細胞/mL的密度用如上所述的重鏈和輕鏈的兩種表達載體轉染,並培養7天。或者,使用電穿孔方法,將在CD-CHO培養基(Invitrogen)中培養的CHO-K1SV細胞(Lonza)以約10,000,000個細胞/mL的密度用如上所述的重鏈和輕鏈的兩種表達載體轉染,並培養7天。使用蛋白A柱或蛋白G柱(GEHealthCare)從每種培養上清液純化所述完全的人抗體。對於穩定表達來說,將如上所述的已各自插入有抗體的重鏈和輕鏈基因的GS載體用限制性酶NotI和PvuI消化,並使用作為用於連接的試劑盒的Ligation-Convenience試劑盒(NIPPONGENE)或連接試劑LigationhighVer.2(TOYOBO)進行連接,由此構建其中插入有重鏈和輕鏈兩個基因的GS載體。通過將所述表達載體轉染到CHO-K1SV細胞中來表達所述抗體。通過蛋白A柱、蛋白G柱或MabSelectSuRe(GEHealthcare,17-5438-02)從培養上清液純化所述完全的人抗體。(實施例8:四價抗人Tie2抗體的製備)製備四價抗人Tie2抗體。在本實施例中製備的四價抗體包括兩條重鏈和四條輕鏈。每條重鏈包含兩個由重鏈可變區和CH1區構成的結構,並且還包含CH2區和CH3區,其中一個由重鏈可變區和CH1區構成的結構的C端通過連接物連接到另一個結構的N端。每條輕鏈包含輕鏈可變區和輕鏈恆定區。本四價抗體的格式示出在圖1中。製備了編碼四價抗人Tie2抗體重鏈的基因,在所述重鏈中將由完全的人2-16A2的重鏈可變區和CH1區構成的結構(由SEQIDNO:12的第1至220位胺基酸的胺基酸序列構成)的C端,通過由SEQIDNO:13所示的胺基酸序列構成的連接物連接到完全的人2-16A2重鏈的N端。將編碼信號序列的基因(ProteinEngineering,1987,Vol.1,No.6,pp.499-505)連接到製備的重鏈基因的5』側,並插入到GS載體pEE6.4中。將上述重鏈載體和其中插入有在實施例7中製備的完全的人抗體2-16A2的輕鏈基因的GS載體pEE12.4組合,使用與實施例7中描述的相同的抗體表達和純化方法來製備四價抗人Tie2抗體。所述四價抗人Tie2抗體被稱為TIE-1-Igγ1-WT。製備了編碼四價抗人Tie2抗體重鏈的基因,所述重鏈的TIE-1-Igγ1-WT的重鏈恆定區已被人Igγ4恆定區(由SEQIDNO:10的第123至220位胺基酸的胺基酸序列構成,並由SEQIDNO:10的第350至676位胺基酸的胺基酸序列構成)置換,並具有胺基酸突變S228P和L235E。將編碼信號肽的基因(ProteinEngineering,1987,Vol.1,No.6,pp.499-505)連接到製備的重鏈基因的5』側,並插入到GS載體pEE6.4中。將上述重鏈載體和其中插入有在實施例7中製備的完全的人2-16A2的輕鏈基因的GS載體pEE12.4組合,使用與實施例7中描述的相同的抗體表達和純化方法來製備四價抗人Tie2抗體。所述具有IgG4的四價抗人Tie2抗體被稱為TIE-1-Igγ4-PE。TIE-1-Igγ1-WT的重鏈的鹼基序列和由所述鹼基序列編碼的胺基酸序列分別由SEQIDNO:7和8示出。TIE-1-Igγ4-PE的重鏈的鹼基序列和由所述鹼基序列編碼的胺基酸序列分別由SEQIDNO:9和10示出。所述兩種抗體的輕鏈與完全的人抗體2-16A2的輕鏈相同,所述抗體的輕鏈的鹼基序列和由所述鹼基序列編碼的胺基酸序列分別由SEQIDNO:3和4示出。通過使用相同的方法,製備了其中已向TIE-1-Igγ1-WT的重鏈的恆定區導入胺基酸變異L234A、L235A和P331S的四價抗人Tie2抗體(被稱為TIE-1-Igγ1-LALA)和其中已向TIE-1-Igγ1-WT的重鏈的恆定區導入胺基酸變異L234A、L235A、P331S和I253A的四價抗人Tie2抗體(被稱為TIE-1-Igγ1-I253A)。TIE-1-Igγ1-LALA的重鏈的鹼基序列和由所述鹼基序列編碼的胺基酸序列分別由SEQIDNO:1和2示出。TIE-1-Igγ1-I253A的重鏈的鹼基序列和由所述鹼基序列編碼的胺基酸序列分別由SEQIDNO:5和6示出。所述兩種抗體的輕鏈與完全的人2-16A2的輕鏈相同,所述抗體的輕鏈的鹼基序列和由所述鹼基序列編碼的胺基酸序列分別由SEQIDNO:3和4示出。由SEQIDNO:2、6、8和10示出的四種四價抗人Tie2抗體的重鏈的可變區是共同的,並由SEQIDNO:2的第1至120位胺基酸的胺基酸序列構成。所述重鏈可變區的CDR1、CDR2和CDR3各自由SEQIDNO:2的第31至35、50至66和99至111位胺基酸的胺基酸序列構成。由SEQIDNO:4示出的四種四價抗人Tie2抗體的輕鏈的可變區各自由SEQIDNO:4的第1至113位胺基酸的胺基酸序列構成。所述輕鏈可變區的CDR1、CDR2和CDR3分別由SEQIDNO:4的第24至39、55至61和94至102位胺基酸的胺基酸序列構成。作為純化的TIE-1-Igγ1-LALA的胺基酸修飾分析的結果,發現在大多數純化的抗體中,發生了在重鏈的C端處賴氨酸的缺失。此外,通過使用相同的方法,製備了四價抗人Tie2抗體(總共11種),其中相對於TIE-1-Igγ1-WT和TIE-1-Igγ4-PE,連接物(由SEQIDNO:13所示的胺基酸序列構成)已被其他連接物(四種相對於TIE-1-Igγ1-WT由SEQIDNO:17至20所示的胺基酸序列構成的連接物,和七種相對於TIE-1-Igγ4-PE由SEQIDNO:14至20所示的胺基酸序列構成的連接物)置換。調查了長度為7個胺基酸的連接物(由SEQIDNO:13所示的胺基酸序列構成的連接物)至長度為64個胺基酸的連接物(由SEQIDNO:20所示的胺基酸序列構成的連接物)。作為對TIE-1-Igγ1-WT、TIE-1-Igγ4-PE和11種其中連接物已被置換的抗體進行調查的結果,發現按照實施例4的方法,所有抗人Tie2抗體具有基本上相同的抗凋亡活性。(實施例9:二價抗人Tie2抗體和四價抗人Tie2抗體的抗凋亡作用的評估)從實施例5的結果,已建議四價或更高價抗體通過人Tie2活化具有強烈的抗凋亡活性。因此,通過測量對表達人Tie2的BaF3細胞的抗凋亡作用作為指標,將二價抗人Tie2抗體的效能與四價抗人Tie2抗體的效能進行比較。按照實施例4的方法,使用表達人Tie2的BaF3細胞,評估了作為二價抗體的完全的人2-16A2和作為四價抗體的TIE-1-Igγ1-WT的抗凋亡作用。將作為試驗抗體的完全的人2-16A2和TIE-1-Igγ1-WT通過MabSelectSuRe進行純化並通過孔徑排阻層析分級成單體級分,由此分別獲得99.98%和99.74%的單體純度。將相應的抗體用磷酸鹽緩衝鹽水(PBS)以約3倍的共同比率通過7步稀釋到5ng/mL至5000ng/mL,並以每孔20μL的量添加。作為對照,分別製備代替試驗抗體已添加PBS或用PBS稀釋的Ang-1(R&D,923-AN-025/CF,終濃度為1ng/m至1000ng/mL,以約3倍的共同比率通過7步稀釋)的孔。為了計算在每個試驗抗體濃度下的抗凋亡活性,將代替試驗抗體添加PBS的孔的實測值設定到0%,並將代替試驗抗體分別添加濃度為300ng/mL和1000ng/mL的Ang-1的孔的實測值的平均值設定到100%。通過使用Sigmoid-Emax模型非線性回歸分析來分析計算的抗凋亡活性,來計算試驗抗體的EC50值。表1:二價抗人Tie2抗體和四價抗人Tie2抗體的抗凋亡活性[表1]EC50值抗凋亡活性的最大活性TIE-1-Igγ1-WT7.10ng/mL104%完全的人2-16A237.6ng/mL22%作為結果,已發現作為四價抗體的TIE-1-Igγ1-WT具有強烈抗凋亡作用。從上述結果發現,四價抗體與二價抗體相比具有優越的抗凋亡活性。(實施例10:在大鼠中二價抗人Tie2抗體和四價抗人Tie2抗體的血管通透性抑制作用的評估)芥子油誘導的血管通透性模型是一種對已被廣泛用作血漿滲漏評估系統的Miles測定法(J.Physiol.,1952,Vol.118,pp.228-257)做出改良的模型,並且已報導在這種模型中Ang-1抑制血管通透性增高(NatureMedicine,2000,Vol.6,pp.460-463)。因此,為了比較二價抗人Tie2抗體與四價抗人Tie2抗體的血管通透性抑制作用,使用這種模型評估了完全的人2-16A2和TIE-1-Igγ1-WT。將用PBS稀釋的完全的人2-16A2或TIE-1-Igγ1-WT皮下給藥到SD大鼠(雄性,4-5周齡,日本CharlesRiverLaboratories公司)。處理組如下設置。[處理組(每組6隻大鼠)]介質組:代替抗體給藥PBS的組完全的人2-16A2給藥組:給藥完全的人2-16A2(0.3mg/kg)的組TIE-1-Igγ1-WT給藥組:給藥TIE-1-Igγ1-WT(0.3mg/kg)的組在抗體給藥後48小時,靜脈內給藥溶解在生理鹽水中的伊文思藍染料(45mg/kg,Sigma-AldrichCorporation,E2129),立即將用礦物油(Sigma-AldrichCorporation,M8410)稀釋的5%異硫氰酸烯丙酯(也被稱為芥子油,NacalaiTesque公司,01415-92)施加到一隻耳上,同時將礦物油施加到對側耳上,量為20μL。30分鐘後,對兩隻耳取樣、稱重,然後浸泡在1mL甲醯胺中,並在70℃下溫育過夜,以提取耳組織中的伊文思藍染料。從提取物的吸收值(測量波長為620nm,對照波長為740nm)確定伊文思藍染料濃度,以計算提取物中伊文思藍染料的量。隨後,通過用伊文思藍染料的量除以耳的重量,計算每單位重量的耳的染料洩漏量。計算通過從同一個體中其上施加有芥子油的耳的伊文思藍染料的洩漏量中減去其上施加有礦物油的耳的伊文思藍染料的洩漏量而獲得的量,作為每個個體的伊文思藍染料的最終洩漏量。將所述伊文思藍染料的洩漏量用作血管通透性的指標。結果示出在圖2中。確定每個組的平均值和標準誤差。使用Studentt-檢驗來確定介質組與每個給藥抗體的組之間的顯著差異。p<0.05的情況意在指示存在顯著差異。如圖2中所示,與介質組相比,作為二價抗體的完全的人2-16A2不抑制染料洩漏,而作為四價抗體的TIE-1-Igγ1-WT顯著抑制染料洩漏。已發現,作為四價抗體的TIE-1-Igγ1-WT抑制血管通透性增高。從上述結果發現,與二價抗體相比,四價抗體具有優越的血管通透性增高抑制作用。從實施例9和10的結果發現,四價抗Tie2抗體強烈誘導通過Tie2的作用。(實施例11:四價抗人Tie2抗體的抗凋亡作用的評估(2))對於TIE-1-Igγ1-LALA和TIE-1-Igγ1-I253A來說,按照實施例9的方法,在表達人Tie2的BaF3細胞上評估了所述抗體的抗凋亡活性。在與實施例9中相同的濃度範圍內,進行每種四價抗人Tie2抗體的評估。就此而言,當將已添加每種100ng/mL、300ng/mL和1000ng/mLAng-1的孔的實測值的平均值取為100%時,評估每種抗體的EC50值和抗凋亡活性的最大活性。表2:每種四價抗人Tie2抗體的抗凋亡活性[表2]EC50值抗凋亡活性的最大活性TIE-1-Igγ1-LALA3.65ng/mL88%TIE-1-Igγ1-I253A5.06ng/mL94%作為結果,已發現TIE-1-Igγ1-LALA和TIE-1-Igγ1-I253A兩者表現出與Ang-1基本上等同的抗凋亡活性。(參比例1:15B8的抗凋亡作用的評估)對於15B8來說,按照實施例9的方法,在表達人Tie2的BaF3細胞上評估了抗凋亡活性。在與實施例9中相同的抗體濃度範圍內,進行15B8(專利文獻1)的評估。以與用於Ang-1相同的方式,進行Ang-2(R&D,623-AN-025)的評估。就此而言,當將已添加1000ng/mLAng-1的孔的實測值的平均值取為100%時,評估EC50值和抗凋亡活性的最大活性。表3:15B8的抗凋亡活性[表3]EC50值抗凋亡活性的最大活性15B826.6ng/mL64%Ang-239.3ng/mL67%作為結果,已發現15B8的抗凋亡活性約為Ang-1的64%,並具有與Ang-2基本上等同的抗凋亡活性。當與實施例11的結果相結合時,發現TIE-1-Igγ1-LALA表現出與Ang-1基本上等同的抗凋亡活性,而15B8表現出與Ang-2基本上等同的部分抗凋亡活性。(實施例12:TIE-1-Igγ1-LALA對Tie2的結合活性的評估)對於TIE-1-Igγ1-LALA來說,評估了對每個物種的Tie2蛋白的結合活性。在PBS中製備1μg/mL的重組人Tie2-Fc嵌合蛋白(R&D,313-TI-100)、重組猴Tie2-Fc嵌合蛋白(SinoBiological公司,90292-C02H)、重組大鼠Tie2-Fc嵌合蛋白(R&D,3874-T2-100)或重組小鼠Tie2-Fc嵌合蛋白(R&D,762-T2-100),以每孔20μL的量添加到白色Maxisorp384孔板(Nunc,460372),並在4℃下溫育過夜以進行固定。第二天,除去固定化溶液,並以每孔50μL的量向其添加含有20%BlockingOne(NacalaiTesque公司,03953-95)的Tris緩衝鹽水(TBS)-0.05%Tween(Wako,310-7375)(在後文中被稱為TBS-T溶液),在室溫留置1小時。將作為試驗抗體的TIE-1-Igγ1-LALA用含有5%BlockingOne的TBS-T溶液以3倍的共同比率通過8步稀釋到0.03ng/mL至100ng/mL,並以每孔20μL的量添加。作為對照,製備代替試驗抗體添加有TBS-T溶液的孔。將得到的板在室溫溫育1.5小時,然後用TBS-T溶液清洗。作為第二抗體,以每孔20μL的量向其添加已用含有5%BlockingOne的TBS-T溶液稀釋到0.1μg/mL的生物素標記的抗人κ輕鏈抗體(免疫生物研究所,17249)。將得到的板在室溫溫育1小時,然後用TBS-T溶液清洗,並以每孔20μL的量向其添加已用含有5%BlockingOne的TBS-T溶液稀釋到0.1μg/mL的鹼性磷酸酶標記的鏈親和素(ThermoFisherScientific公司,21324)。將得到的板在室溫溫育1小時,然後用TBS-T溶液清洗,並以20μL的量添加作為底物的已用含有1mMMgCl2的20mMTBS(pH9.8)稀釋5倍的化學發光超靈敏AP微孔和/或膜底物(450nm)(BioFX,APU4-0100-01)。將得到的板在室溫溫育30分鐘,然後通過EnVisionTM多標記物計數器(PerkinElmer公司)測量其化學發光。通過使用Sigmoid-Emax模型非線性回歸分析計算的結合活性,來計算試驗抗體的EC50值。表4:TIE-1-Igγ1-LALA的結合活性[表4]作為結果,已發現TIE-1-Igγ1-LALA對人Tie2、猴Tie2、大鼠Tie2和小鼠Tie2具有基本上同樣高的結合活性。(參比例2:15B8對Tie2的結合活性的評估)按照實施例12的方法,評估了15B8對每個物種的Tie2蛋白的結合活性。就此而言,使用HRP標記的抗小鼠κ輕鏈抗體(SouthernBiotech,1050-05)作為第二抗體、TMB顯色劑作為底物和ARVO多標記物讀板器(PerkinElmer公司)作為測量裝置,測量在450nm處的吸收值。此外,以約3倍的共同比率將15B8抗體濃度調整為從1000ng/mL至0.3ng/mL(通過8步稀釋),作為試驗抗體。通過使用Sigmoid-Emax模型非線性回歸分析計算的結合活性,來計算試驗抗體的EC50值(表5)。表5:15B8的結合活性[表5]作為結果,觀察到15B8對人Tie2和猴Tie2具有結合活性,但發現15B8對大鼠Tie2和小鼠Tie2具有低的結合活性。從實施例12的結果觀察到TIE-1-Igγ1-LALA對人Tie2、猴Tie2、大鼠Tie2和小鼠Tie2具有高的結合活性,在其中沒有物種差異。另一方面,觀察到15B8在結合活性中具有物種差異。從上述結果,提示TIE-1-Igγ1-LALA的人Tie2表位不同於15B8的表位。(實施例13:大鼠中TIE-1-Igγ1-LALA的血管通透性抑制作用的評估)按照實施例10的方法,評估在大鼠中TIE-1-Igγ1-LALA的血管通透性抑制作用。就此而言,使用TIE-1-Igγ1-LALA作為試驗抗體,並將抗體劑量調整為0.1mg/kg和0.3mg/kg。結果示出在圖3中。確定每個組的平均值和標準誤差。使用Dunnett多重比較檢驗來確定介質組與給藥抗體的每個組之間的顯著差異。p<0.05的情況意在指示存在顯著差異。如圖3中所示,與介質組相比,TIE-1-Igγ1-LALA顯著抑制染料洩漏。從上述結果發現,TIE-1-Igγ1-LALA抑制血管通透性增高。(實施例14:在具有周細胞喪失的小鼠中的視網膜水腫抑制作用)在患有糖尿病性視網膜病變的患者的視網膜血管中,周細胞的喪失是特徵性病變之一(《視網膜》(Retina),2013,第五版,pp.925-939)。儘管具有鏈脲黴素誘導的糖尿病的大鼠模型被廣泛用於糖尿病性視網膜病變研究,但在下列方面所述模型的有用性存在限制:直至觀察到周細胞的喪失要花費幾個月的時間段,沒有觀察到據認為由周細胞的喪失引起視網膜微動脈瘤,周細胞與內皮細胞的比率與人的不同(《視網膜》(Retina),2013,第五版,pp.925-939),並且沒有觀察到明顯的視網膜水腫(DiabetesMetab.J.,2013,Vol.37,pp.217-224)。另一方面,在通過給藥抗PDGF受體β(PDGFRβ)抗體而使視網膜血管具有周細胞喪失的小鼠中,觀察到與在糖尿病性視網膜病變和糖尿病性黃斑水腫中看到的相似的病變,例如視網膜血管的擴張、視網膜水腫和出血,表明由於周細胞的喪失,血管被弱化,如同糖尿病性視網膜病變和糖尿病性黃斑水腫,儘管沒有觀察到高血糖(J.Clin.Invest.,2002,Vol.110,pp.1619-1628)。因此,使用具有顯示出周細胞喪失這種患有糖尿病性視網膜病變的患者中特徵性的病變的病症的模型評估對視網膜水腫的抑制作用,可用於評估對糖尿病性視網膜病變和糖尿病性黃斑水腫的有效性。使用在J.Clin.Invest.,2002,Vol.110,pp.1619-1628中報導的方法並進行了略微修改,來製備由周細胞的喪失引起的視網膜水腫。也就是說,將用PBS稀釋的抗PDGFRβ單克隆抗體1B3(WO2008/130704)以25mg/kg的量皮下給藥到出生後第二天的C57BL/6J小鼠(日本CharlesRiverLaboratories公司),以在視網膜血管中誘導周細胞的喪失。[處理組]對照組:17隻小鼠未給藥抗PDGFRβ抗體並且給藥PBS的組介質組:24隻小鼠給藥抗PDGFRβ抗體並且代替TIE-1-Igγ1-LALA給藥PBS的組TIE-1-Igγ1-LALA組(0.1mg/kg、0.3mg/kg和1mg/kg):分別為23隻小鼠、21隻小鼠和21隻小鼠給藥抗PDGFRβ抗體並且給藥每種劑量的TIE-1-Igγ1-LALA的組在給藥抗PDGFRβ抗體之前90分鐘,將用PBS稀釋的TIE-1-Igγ1-LALA以0.1mg/kg、0.3mg/kg和1mg/kg皮下給藥。在抗體給藥後1周,評估視網膜水腫。具體來說,摘取眼球並用含有1%戊二醛和2.5%甲醛的溶液固定,然後製備石蠟包埋的切片移植物。使用虛擬載片掃描儀(NanoZoomerXR,HamamatsuPhotonicsK.K.)對蘇木精-曙紅染色的樣本進行掃描,以轉變圖像數據。在該模型中,報導了視網膜神經纖維層(NFL)中的視網膜水腫(J.Clin.Invest.,2002,Vol.110,pp.1619-1628),因此通過使用NPDview2(HamamatsuPhotonics公司)測量NFL和相鄰的視網膜神經節細胞層的面積來進行視網膜水腫的定量。結果示出在圖4中。確定每個組的平均值和標準誤差。使用Dunnett多重比較檢驗作為用於確定介質組與給藥TIE-1-Igγ1-LALA的每個組之間的顯著差異的測定法。使用Studentt-檢驗作為用於確定對照組與介質組之間的顯著差異的測定法。p<0.05的情況意在指示在每種情況下存在顯著差異。如圖4中所示,發現與介質組相比,TIE-1-Igγ1-LALA組(1mg/kg)顯著抑制視網膜血管具有周細胞喪失的視網膜水腫。從TIE-1-Igγ1-LALA抑制由具有周細胞喪失的視網膜血管引起的視網膜水腫的觀點來看,表明TIE-1-Igγ1-LALA對糖尿病性黃斑水腫和糖尿病性視網膜病變有效(實施例15:在具有後肢缺血的小鼠中的缺血肢體血流改善作用)具有後肢缺血的模型是在後肢組織中具有由結紮和一側後肢中血管的切除引起的缺血的模型,並且也是用於評估缺血症狀的改善的代表性模型(J.Vasc.Surg.,2012,Vol.56,pp.1669-1679)。在10周齡C57BL/6J小鼠(日本CLEA公司)中結紮左後肢上的股動脈和靜脈以及隱動脈和靜脈的腹股溝區。此外,在結紮其間的分支血管後,將結紮點之間的血管切除。手術在使用戊巴比妥鈉(60mg/kg,東京化成工業)麻醉下進行。在血管切除後1周,使用雷射都卜勒灌注成像儀MoorLDI2(MoorInstruments公司),在使用戊巴比妥的麻醉下測量後肢中的血流。在驗證了待處理肢體中的血流減小之後,將處理組設置如下。[處理組(每組10隻小鼠)]對照組:代替抗體給藥PBS的組TIE-1-Igγ1-LALA組(1mg/kg):給藥TIE-1-Igγ1-LALA的組將用PBS稀釋的TIE-1-Igγ1-LALA以1mg/kg的量皮下給藥,並在抗體給藥後1周測量正常肢體和缺血肢體的皮膚血流量。具體來說,將戊巴比妥鈉(60mg/kg)腹膜內給藥,然後置於加熱板上,以便在麻醉劑給藥後15分鐘測量足部的皮膚血流。通過取足的底部部分作為目標區(ROI)測量的血流的結果,示出在圖5中。確定每個組的平均值和標準誤差。使用Studentt-檢驗確定對照組與TIE-1-Igγ1-LALA組之間的顯著差異。p<0.05的情況意在指明存在顯著差異。如圖5中所示,發現與對照組相比,TIE-1-Igγ1-LALA組顯著提高正常肢體和缺血肢體的血流量。因此,表明了TIE-1-Igγ1-LALA對外周動脈疾病例如嚴重肢體缺血的有效性。(實施例16:TIE-1-Igγ1-LALA的表位的評估:氫氘交換質譜術)為了鑑定TIE-1-Igγ1-LALA的識別表位,製備了實施例7中的完全的人2-16A2的Fab(在後文中被稱為完全的人2-16A2-Fab)。由於完全的人2-16A2-Fab具有與TIE-1-Igγ1-LALA相同的可變區,因此這些抗體識別相同的表位。作為抗原,製備了由登錄號NP_000450.2的第1至452位胺基酸構成的人Tie2蛋白(在後文中被稱為人Tie2(1-452))。所述胺基酸序列是在鑑定Ang-2的Tie2結合位點時使用的相同位點(Nat.Struct.Mol.Biol.,Vol.13,pp.524-532)。具體來說,通過將其中插入了編碼由完全的人2-16A2的重鏈可變區和CH1區構成的結構(由SEQIDNO:12的第1至221位胺基酸的胺基酸序列構成)的重鏈基因的GS載體pEE6.4和其中插入了完全的人2-16A2的輕鏈基因的GS載體pEE12.4相組合,並使用與實施例7中描述的用於抗體的表達方法和純化方法相同的方法,製備了完全的人2-16A2-Fab。為了獲得人Tie2(1-452),首先,製備通過將人Fc(由SEQIDNO:23所示的胺基酸序列構成)與作為連接物的凝血酶識別序列(由SEQIDNO:22所示的胺基酸序列構成)融合而獲得的人Tie2(1-452)(在後文中被稱為人Tie2(1-452)-Fc嵌合蛋白)。具體來說,通過將編碼人Tie2(1-452)-Fc嵌合蛋白的基因插入到GS載體pEE12.4中,並使用與實施例7中描述的相同的表達方法和純化方法,製備所述人Tie2(1-452)-Fc嵌合蛋白。接下來,將製備的人Tie2(1-452)-Fc嵌合蛋白與凝血酶(GEHealthcare,27-0846-01)在22℃溫育16小時以切開Fc部分,並通過BenzamidineSepharose4FastFlow(highsub)(GEHealthcare)和MabSelectSuRe除去凝血酶和人Fc,由此製備人Tie2(1-452).出於鑑定表位位點的目的,使用NanoAQUITYUPLCHDX系統(Waters)進行氫/氘交換質譜術(在後文中被稱為H/D交換質譜術,Anal.Bioanal.Chem.,2010,Vol.397,pp.967-979)。具體來說,使用含有120mM氯化鈉的20mM檸檬酸緩衝液(pH6)製備完全的人2-16A2-Fab和人Tie2(1-452)混合液體(終濃度分別為50μM和25μM),並在37℃溫育過夜。作為對照,使用含有120mM氯化鈉的20mM檸檬酸緩衝液(pH6)製備僅含有人Tie2(1-452)的溶液。隨後,將所述溶液添加到使用重水(關東化學)製備的PBS緩衝溶液,並分別溫育20秒、1分鐘、10分鐘、60分鐘和120分鐘,進行氘化。然後,在0℃下向其添加含有100mM二硫蘇糖醇(NacalaiTesque)和4M鹽酸胍(和光純藥)的水性溶液(pH2.5),然後使用胃蛋白酶柱(Proszyme(註冊商標),固定化的胃蛋白酶柱套,AppliedBiosystems)進行消化,並將消化的肽用捕獲柱(ACQUITYUPLCBEHC181.7μmVanGuardPre-Column,Waters)捕獲。然後,使用C18柱(AQUITYUPLCBEHC181.7μm,Waters)通過反相色譜進行分離,並使用質譜儀(SynaptG2-Si,Waters)測量分子量。計算所有檢測到的肽的同位素分布的質心值,並與已經歷氘交換的僅僅人Tie2(1-452)的同位素分布的質心值進行比較,根據每個氘化時間長度計算氘化置換存在的變化量。作為H/D交換質譜術的結果,證實了登錄號NP_000450.2的第27至37、29至37、29至38、43至60、82至100、98至107、111至124、116至125、116至129、119至129、189至198和190至198位胺基酸的肽在抗體共存的情況下具有被抑制的氘化。將這些肽的冗餘結構域進行排列,此外,添加不具有受抑制的氘化的肽的信息,並考慮到N-端側的兩個胺基酸容易經歷逆向變化(Proteins,1993,Vol.17,75-86),發現了5個具有受抑制的氘化置換的區域作為表位候選位點,即登錄號NP_000450.2的第29至38、84至102、113至120、126至129和191至198位胺基酸。此外,作為H/D交換質譜術的結果,發現在TIE-1-Igγ1-LALA與由這5個胺基酸區段構成的區域相互作用或在發生由抗體結合引起的立體結構改變或別構效應的情況下,這些殘基受到保護以免於氫/氘交換。(實施例17:TIE-1-Igγ1-LALA的表位的評估:表面等離子體共振分析和ELISA)從實施例16的H/D交換質譜術鑑定了TIE-1-Igγ1-LALA的人Tie2的候選表位。為了預測詳細的表位部分,製備了人Tie2(1-452)-Fc嵌合蛋白的胺基酸突變體,並使用表面等離子體共振分析(SPR分析)和ELISA評估結合活性。在H/D交換質譜術的結果以及Ang-1和Ang-2結合到Tie2的區域的報告(Nat.Struct.Mol.Biol.,2006,Vol.13,pp.524-532;Proc.Natl.Acad.Sci.USA,2013,Vol.110,7205-7210)的基礎上,製備了23種胺基酸突變蛋白作為人Tie2(1-452)的胺基酸突變蛋白,在所述突變蛋白中人Tie2(1-452)-Fc嵌合蛋白中人Tie2(1-452)的第1至4個胺基酸被丙氨酸(在一種情況下,穀氨酸)替換(表6)。通過與用於實施例16中製備的人Tie2(1-452)-Fc嵌合蛋白相同的製備方法,製備各種不同突變體。表6:突變的人Tie2(1-452)-Fc嵌合蛋白[表6]進行SPR分析以便評估人Tie2(1-452)-Fc嵌合蛋白及其23種突變蛋白對完全的人2-16A2-Fab的結合活性。對於SPR分析來說,使用BiacoreT200(GEHealthcare)。將抗人IgG(Fc)抗體(人抗體捕獲試劑盒,GEHealthcare)固定在CM5傳感器晶片上。允許用HBS-EP(GEHealthcare)稀釋的5μg/mL的人Tie2(1-452)-Fc嵌合蛋白及其23種突變蛋白各自固定,並測量捕獲量。隨後,將完全的人2-16A2-Fab用HBS-EP稀釋到50nM,並測量其與人Tie2(1-452)-Fc嵌合蛋白及其23種突變蛋白的結合量。此外,通過用結合量除以捕獲量,計算單位固定化的抗原中抗體的結合量(在後文中被稱為結合比率)。三個實驗的算術平均值和取人Tie2(1-452)-Fc嵌合蛋白的結合比率為100%時每種突變蛋白的結合比率的相對值,示出在表7中。此外,代表性的測量數據示出在圖6中。在Biacore中進行結合量的相對比較的方法,描述在例如AnalyticalBiochemistry,2003,Vol.312,pp.113-124中。作為結果,發現與人Tie2(1-452)-Fc嵌合蛋白相比,在人Tie2(1-452)g1-Fc、人Tie2(1-452)g2-Fc、人Tie2(1-452)g3-Fc、人Tie2(1-452)g4-Fc、人Tie2(1-452)g5-Fc、人Tie2(1-452)m3-Fc、人Tie2(1-452)A1-Fc、人Tie2(1-452)A2-Fc、人Tie2(1-452)A3-Fc和人Tie2(1-452)A4-Fc中完全的人2-16A2-Fab的結合降低。表7:SPR分析的結果[表7]結合比率相對值(%)人Tie2(1-452)-Fc嵌合蛋白0.29100人Tie2(1-452)r1-Fc0.29102人Tie2(1-452)r2-Fc0.2898人Tie2(1-452)r3-Fc0.34119人Tie2(1-452)r4-Fc0.33113人Tie2(1-452)r5-Fc0.2999人Tie2(1-452)r6-Fc0.29100人Tie2(1-452)r7-Fc0.30106人Tie2(1-452)g1-Fc0.000人Tie2(1-452)g2-Fc0.039人Tie2(1-452)g3-Fc0.0623人Tie2(1-452)g4-Fc0.027人Tie2(1-452)g5-Fc0.039人Tie2(1-452)g6-Fc0.38131人Tie2(1-452)m1-Fc0.31107人Tie2(1-452)m3-Fc0.0412人Tie2(1-452)y1-Fc0.2587人Tie2(1-452)c1-Fc0.54189人Tie2(1-452)A1-Fc0.1034人Tie2(1-452)A2-Fc0.0829人Tie2(1-452)A3-Fc0.1759人Tie2(1-452)A4-Fc0.1344人Tie2(1-452)A5-Fc0.39135人Tie2(1-452)A6-Fc0.31109通過實施例12中的方法進行ELSA,以便評估TIE-1-Igγ1-LALA與人Tie2(1-452)-Fc嵌合蛋白及其23種突變蛋白的結合活性。將人Tie2(1-452)-Fc嵌合蛋白及其23種突變蛋白用PBS稀釋到1μg/mL,以每孔20μL的量添加到白色Maxisorp384孔板,並在4℃溫浴過夜以進行固定。第二天,除去固定化溶液,將板用TBS-T溶液清洗,並添加50μLBlockerTM酪蛋白(ThermoFisherScientific公司,37532)在TBS中的溶液,溫浴60分鐘以進行阻斷。將得到的板用TBS-T溶液清洗,並以每孔20μL的量向其添加用含有0.05%Tween20(NacalaiTesque公司,28353-85)的BlockerTM酪蛋白在TBS中的溶液通過8步稀釋的從0.03ng/mL至100ng/mL的TIE-1-Igγ1-LALA。將得到的板在室溫溫浴90分鐘,然後用TBS-T溶液清洗三次,並向其添加20μL已用含有0.05%Tween20的BlockerTM酪蛋白在TBS中的溶液稀釋到0.1μg/mL的生物素標記的抗人κ輕鏈抗體。將得到的板在室溫溫浴60分鐘,然後用TBS-T溶液清洗三次,並向其添加20μL已用含有0.05%Tween20的BlockerTM酪蛋白在TBS中的溶液稀釋到0.1μg/mL的鹼性磷酸酶標記的鏈親和素。將得到的板在室溫溫浴60分鐘,然後用TBS-T溶液清洗三次,並向其添加50μL已用含有1mMMgCl2的20mMTBS(pH9.8)稀釋5倍的化學發光超靈敏AP微孔和/或膜底物(450nm)作為底物。將得到的板在遮光下在室溫溫浴40分鐘,然後使用EnVisionTM多標記物計數器測量其發光強度。計算TIE-1-Igγ1-LALA針對人Tie2(1-452)-Fc嵌合蛋白及其23種突變蛋白的EC50值。計算在取TIE-1-Igγ1-LALA結合到人Tie2(1-452)-Fc嵌合蛋白的S形曲線的收斂值為100%時,作為最大濃度點的100ng/mLTIE-1-Igγ1-LALA針對人Tie2(1-452)-Fc嵌合蛋白及其23種突變蛋白的發光強度的相對值(表8和表9)。此外,通過Sigmoid-Emax模型非線性回歸分析,計算EC50值和收斂值。ELISA的結果示出在圖7中。作為結果,已發現與人Tie2(1-452)-Fc嵌合蛋白相比,TIE-1-Igγ1-LALA針對突變蛋白Tie2(1-452)g1-Fc、Tie2(1-452)g2-Fc和Tie2(1-452)g4-Fc具有顯著降低的相對值。此外,已發現與人Tie2(1-452)-Fc嵌合蛋白相比,TIE-1-Igγ1-LALA針對突變蛋白Tie2(1-452)g5-Fc具有降低的相對值和增加的EC50值。從這些結果發現,與人Tie2(1-452)-Fc嵌合蛋白不同,TIE-1-Igγ1-LALA對Tie2(1-452)g1-Fc、Tie2(1-452)g2-Fc、Tie2(1-452)g4-Fc和Tie2(1-452)g5-Fc具有降低的結合活性。由於TIE-1-Igγ1-LALA針對Tie2(1-452)A1-Fc具有降低的相對值和相似的EC50值,因此確定TIE-1-Igγ1-LALA與Tie2(1-452)A1-Fc的結合活性沒有變化。表8:ELISA的結果[表8]表9:ELISA的結果[表9]從兩個獨立實驗ELISA和SPR分析的結果,鑑定到Tie2(1-452)g1-Fc、Tie2(1-452)g2-Fc、Tie2(1-452)g4-Fc和Tie2(1-452)g5-Fc是在兩個實驗中與TIE-1-Igγ1-LALA或完全的人2-16A2-Fab的結合活性降低的突變蛋白。發現在4種突變蛋白中第192、194、195、197和198位胺基酸是TIE-1-Igγ1-LALA結合人Tie2的非常重要的表位候選者。在這裡,具有胺基酸變異I194A、N197A和L198A的Tie2(1-452)g1-Fc的結合活性在ELISA測定法中降低,而相對於TIE-1-Igγ1-LALA具有胺基酸變異I194A的Tie2(1-452)g3-Fc的結合活性在ELISA測定法中不變。具有胺基酸變異L198A的Tie2(1-452)g6-Fc的結合活性不論是在ELISA測定法中還是在SPR分析中都不改變。這些結果表明,Tie2(1-452)g1-Fc中第197位胺基酸的突變是作為表位的最關鍵的胺基酸。最後,發現TIE-1-Igγ1-LALA結合到登錄號NP_000450.2的作為表位的第192、195和197位胺基酸。工業實用性本發明的抗人Tie2抗體可用於預防或治療各種不同的與血管相關的疾病。此外,本發明的多核苷酸、表達載體、轉化的宿主細胞和生產抗體的方法可用於生產抗人Tie2抗體。序列表自由文本在下面的編號標題的序列表中,對「人工序列」進行了描述。具體來說,序列表中由SEQIDNO:1所示的鹼基序列是TIE-1-Igγ1-LALA的重鏈的鹼基序列,由SEQIDNO:2所示的胺基酸序列是由SEQIDNO:1編碼的重鏈的胺基酸序列。序列表中由SEQIDNO:3所示的鹼基序列是TIE-1-Igγ1-LALA、TIE-1-Igγ1-I253A、TIE-1-Igγ1-WT、TIE-1-Igγ4-PE和完全的人2-16A2的輕鏈的鹼基序列,由SEQIDNO:4所示的胺基酸序列是由SEQIDNO:3編碼的輕鏈的胺基酸序列。序列表中由SEQIDNO:5所示的鹼基序列是TIE-1-Igγ1-I253A的重鏈的鹼基序列,由SEQIDNO:6所示的胺基酸序列是由SEQIDNO:5編碼的重鏈的胺基酸序列。序列表中由SEQIDNO:7所示的鹼基序列是TIE-1-Igγ1-WT的重鏈的鹼基序列,由SEQIDNO:8所示的胺基酸序列是由SEQIDNO:7編碼的重鏈的胺基酸序列。序列表中由SEQIDNO:9所示的鹼基序列是TIE-1-Igγ4-PE的重鏈的鹼基序列,由SEQIDNO:10所示的胺基酸序列是由SEQIDNO:9編碼的重鏈的胺基酸序列。序列表中由SEQIDNO:11所示的鹼基序列是完全的人2-16A2的重鏈的鹼基序列,由SEQIDNO:12所示的胺基酸序列是由SEQIDNO:11編碼的重鏈的胺基酸序列。序列表中由SEQIDNO:13至20所示的胺基酸序列是連接物的胺基酸序列。序列表中由SEQIDNO:22所示的胺基酸序列是凝血酶識別位點。當前第1頁1 2 3 
