兩親性的具有聚集誘導發光特性的發光物及其應用的製作方法
2023-05-13 21:06:14
本發明涉及螢光材料技術領域,具體涉及一種兩親性的具有聚集誘導發光特性的發光物及其應用。
背景技術:
近年來,已經發現一系列螺旋狀分子在溶液中不發光,但通過聚合形成後會被誘導發出強光,這種聚集誘導發光(aggregation-induced eimission,AIE)的現象與傳統螢光素表現出的聚集螢光淬滅效應是完全相反的。利用這個新效應,AIE發光材料可以在許多高科技領域進行應用,如化學傳感器、生物探頭、免疫標記、刺激反應材料和固態發射器等[Chem.Commun.2001,18,1740;J.Mater.Chem.,2001,11,2974;Chem.Soc.Rev.,2011,40,5361;Adv.Funct.Mater.,2012,22,771;Chem.Commun.,2011,47,7323;Adv.Healthcare Mater.,2013,2,500;Acc.Chem.Res.,2013,46,2441;Chem.Commun.2013,49,11335;Biomaterials 2008,29,1345;US 8,029,767;US 2013/0029325;CN103175768]。四苯乙烯(tetraphenylethene,TPE)和六苯基矽雜環戊二烯(hexaphenylsiole,HPS)是原型AIE分子,其具有易合成、固態情況下的高量子產率以及高化學穩定性和光穩定性等優勢,但是其疏水性質極大地限制了在生物領域的應用,為了降低其疏水性或提高其親水性,在其結構中引入了帶電的功能基團。例如,帶有兩個或四個銨基的TPE在水性溶液中發光較弱,但加入帶陰電荷的生物分子就變成強發光體,如加入小牛胸腺DNA和牛血清白蛋白(BSA)[Chem.Commun.,2006,3705;Chem.–Eur.J.,2008,14,6428.]。該陰離子TPE衍生物將磺酸基團帶入進BSA的主體摺疊結構的疏水腔內,由於分子內旋轉的限制(restriction of intramolecular rotation,RIR)使得發光增強。當通過引入表面活性劑(如十二烷基硫酸鈉SDS)使得BSA不摺疊時,則不再發光[J.Phys.Chem.B,2007,111,11817]。Tang和他的共同工作者們報導了包含有TPE配基的聚N-異丙基丙烯醯胺(PNIPAM)的聚合物[Chem.Commun.,2009,4974],通過螢光技術,TPE標記的PNIPAM鏈可以用於跟蹤溫度引起的聚合物的構象變化。另一方面,很少有研究和報導兩親性的AIE分子。在結構上,兩親性分子為表面活性劑以及通常既含有疏水結構單元又含有親水結構單元的有機化合物。大部分兩親性分子的疏水尾為支鏈、直鏈或芳族烴鏈,同時親水頭不帶電荷、負電荷和正電荷,有時分別被稱為非離子表面活性劑、陰離子表面活性劑和陽離子表面活性劑。因此,兩親性分子由水不溶性配基和水溶性配基構成。在水性溶液中,兩親性分子形成聚合物,如膠體和膠團等,其中疏水尾聚集形成核心,親水頭集中於表面並與周圍的水環境相接觸。聚合物的形狀和大小主要取決於兩親性分子的結構以及分子的親水性和疏水性的平衡關係。兩親性分子廣泛存在於我們的日常生活物品,包括清潔劑、織物柔軟劑、乳劑、繪畫顏料、墨水和化妝品等,以及存在於生物利用方面,如蛋白提取、細胞質膜、給藥等等。兩親性和AIE特性的結合可以產生一系列新的螢光分子用於化學和生物應用方面。
技術實現要素:
本發明的目的是提供一種兩親性的具有聚集誘導發光特性的發光物及其應用,解決現有技術中的具有聚集誘導發光特性的發光物為疏水性的發光物而導致應用受限的問題。
本發明解決技術問題所採用的技術方案是:一種兩親性的具有聚集誘導發光特性的發光物,包含具有聚集誘導/增強發光特性的疏水性單元,在具有聚集誘導/增強發光特性的疏水單元上連接有親水性單元,所述發光物的結構式選自以下I、II、III、IV、V和VI中的任一種;
其中,表示具有聚集誘導/增強發光特性的疏水性單元;
表示親水性單元;
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述發光物可溶於水,且所述發光物形成的水溶液的濃度≥臨界膠束濃度時可形成膠束。
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述具有聚集誘導/增強發光特性的疏水性單元包括至少一第一主體結構,所述主體結構選自包含有下述任一結構的基團:
其中,R和R(X)分別表示與所述具有聚集誘導/增強發光特性的疏水性單元相連接的親水性單元。
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述親水性單元分別選自含有OH、銨鹽、氨基、硫醇、乙基乙二醇、磺酸鹽、磷酸鹽和羧酸鹽中至少一種的基團。
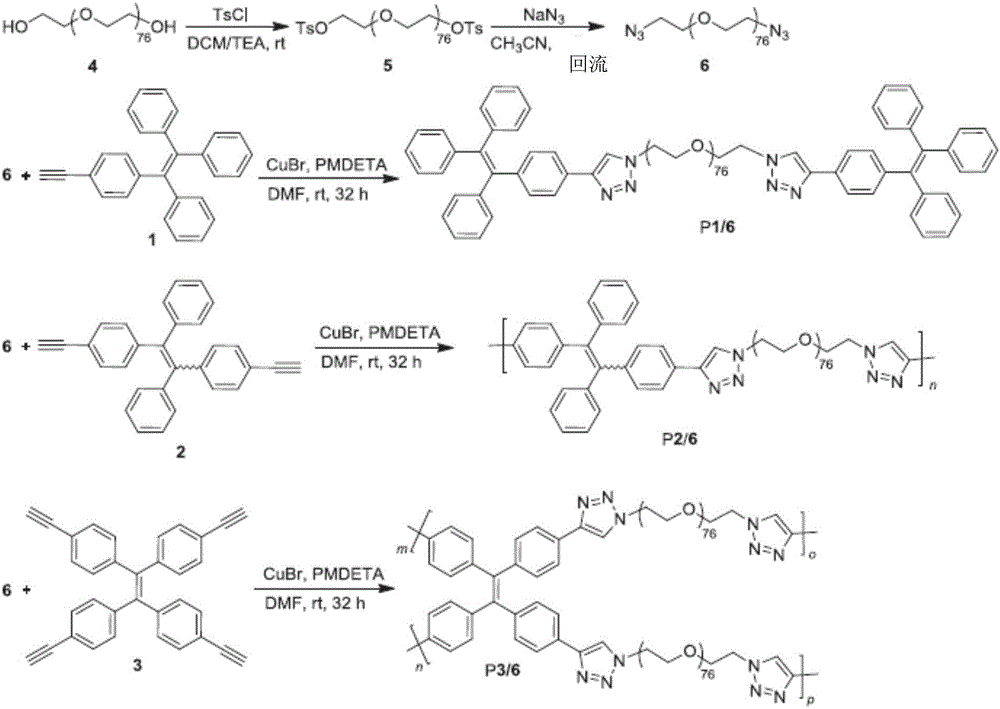
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述具有聚集誘導/增強發光特性的疏水性單元包含有結構為的基團,所述親水性單元包含有乙基乙二醇基團;具體地,所述發光物包含有下述結構式P1/6、P2/6和P3/6中任一結構式的基團:其中n、m、o和p分別表示2~3000的自然數,
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述發光物在追蹤細胞中的應用、在製備細胞追蹤器中的應用、在製備用於追蹤細胞的探針中的應用或在監測細胞內藥物釋放過程中的應用。
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述親水性單元包含至少一第二主體結構,所述第二主體結構選自包含有下述任一結構的基團:
其中R1、R2、R3、R4和R5分別選自包含有H、烷基、不飽合烷基、異烷基、環烷基、異環烷基、芳烴基、異芳烴基、以及CnH2n+1、C10H7、C12H9、OC6H5、OC10H7、OC12H9、CnH2nCOOH、CnH2nNCS、CnH2nN3、CnH2nNH2、CnH2nSH、CnH2nCl、CnH2nBr、CnH2nI中的至少一種的基團,n為自然數;
X-為反荷離子,X-選自於I-、Cl-、Br-、PF6-、ClO4-、BF4-、BPh4-、CH3PhSO3-。
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述具有聚集誘導/增強發光特性的疏水性單元包含有結構為的基團,所述親水性單元包含有結構為的基團,其中R1為丙烷基,X-為Br-;具體地,所述發光物包含有下述結構式TPE-MEM的基團:
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述發光物在特異性選擇細胞膜染色中的應用、在製備特異性選擇細胞膜染色劑中的 應用、在製備特異性選擇細胞膜染色的探針中的應用、在製備光敏劑中的應用以及在製備光線療法藥物中的應用或在製備用於治療癌症的光線療法藥物中的應用。
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述發光物可以與金屬離子複合,所述金屬離子選自La3+、Pr3+、Nd3+、Pm3+、Sm3+、Eu3+、Gd3+、Tb3+、Ce3+、Dy3+、Ho3+、Er3+、Tm3+、Yb3+和Lu3+中的至少一種。
在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述金屬離子為Gd3+,所述具有聚集誘導/增強發光特性的疏水性單元包含有結構為 的基團,所述親水性單元包含有乙基乙二醇基團;具體地,所述發光物包含有下述結構式TPE-2Gd的基團:
在本發明的兩親性的具有聚集誘導發光特性的發光物中,在本發明的兩親性的具有聚集誘導發光特性的發光物中,所述發光物在特異性選擇細胞質區染色中的應用,在製備特異性選擇細胞質區染色的染色劑中的應用、在細胞成像中的應用、在追蹤腫瘤細胞中的應用、在製備追蹤腫瘤細胞的腫瘤細胞追蹤器中的應用或在製備核磁共振成像造影劑中的應用。
本發明還詳細說明了上述兩親性的具有聚集誘導發光特性的發光物在追蹤細胞中的應用、在製備細胞追蹤器中的應用、在製備用於追蹤細胞的探針中的應用、在監測細胞內藥物釋放過程中的應用、在特異性選擇細胞 膜染色中的應用、在製備特異性選擇細胞膜染色劑中的應用、在製備特異性選擇細胞膜染色的探針中的應用、在製備光敏劑中的應用、在製備光線療法藥物中的應用或在製備用於治療癌症的光線療法藥物中的應用、在特異性選擇細胞質區染色中的應用,在製備特異性選擇細胞質區染色的染色劑中的應用、在細胞成像中的應用、在追蹤腫瘤細胞中的應用、在製備追蹤腫瘤細胞的腫瘤細胞追蹤器中的應用或在製備核磁共振成像造影劑中的應用。
實施本發明的兩親性的具有聚集誘導發光特性的發光物及其應用,具有以下有益效果:本發明的發光物通過在典型的聚集誘導發光特性(AIE)的疏水性單元上連接親水性單元製備而成,該發光物可用於特異性選擇細胞膜染色、用於製備特異性選擇細胞膜染色劑、用於製備特異性選擇細胞膜染色的探針、製備光敏劑等,進而用於製備光線療法藥物和用於製備治療癌症的光線療法藥物。具體地,本發明製備了陽離子的四苯乙烯基的吡啶鹽發光物,其具有AIE特性,可選擇性對細胞膜染色,該發光物在房間燈光照射下還可以產生活性氧(ROS),這使得在溫和的條件下就可以觀察到細胞壞死和光療的效果。
附圖說明
圖1為本發明實施例1中P1/6、P2/6和P3/6發光物的合成路線圖;
圖2為本發明實施例2中TPE-MEM發光物的合成路線圖;
圖3為本發明實施例3中TPE-2Gd發光物的合成路線圖;
圖4A為P1/6發光物(0.25mg/mL)在不同含水量的THF/H2O混合液中由365nm波長的紫外光照射的照片;
圖4B為P1/6發光物(0.25mg/mL)在不同己烷含量的THF/己烷混合液中由365nm波長的紫外光照射的照片;
圖4C為P1/6、P2/6和P3/6發光物分別在不同組成的THF/H2O混合液中的相對強度與不同組成的THF/H2O混合液中含水量之間的相關曲線圖; 其中,發光物濃度為0.25mg/mL,激發波長(nm):320(P1/6)、335(P2/6)以及350(P3/6);
圖4D為P1/6、P2/6和P3/6發光物分別在不同組成的THF/己烷混合液中的相對強度與不同組成的THF/己烷混合液中己烷含量之間的相關曲線圖;其中,發光物濃度為0.25mg/mL,激發波長(nm):320(P1/6)、335(P2/6)以及350(P3/6);
圖5A為不同濃度的P1/6發光物的水溶液(0.002-2mg/mL)由365nm波長的紫外光照射的照片;
圖5B為不同濃度的P1/6發光物的水溶液的PL光譜圖;
圖5C為P1/6、P2/6和P3/6發光物的I/I0值與對應在水中的濃度之間的相關曲線圖;
圖6為利用CCK8實驗分析P1/6發光物對HepG2細胞的24小時的細胞毒性的相關圖;
圖7為不同濃度的P1/6發光物對活的HepG2細胞染色12小時的成像圖;
圖8為200μg/mL濃度的P2/6和P3/6發光物對活的HepG2細胞染色24小時的成像圖;
圖9為長期追蹤由150μg/mL的P1/6發光物染色24小時後的第一代至第五代的HepG2細胞的成像圖;
圖10為TPE-MEM(40μM)在水中的UV和PL光譜圖,激發波長為405nm;
圖11A為TPE-MEM在含有不同含量的THF(fTHF)的THF/DMSO混合溶劑中的PL光譜圖,其中TPE-MEM濃度為25μM,激發波長為405nm;
圖11B為TPE-MEM在625nm的PL強度與THF/DMSO混合溶劑中的fTHF之間的相關曲線圖,其中TPE-MEM濃度為25μM;內部的插圖為TPE-MEM分別在DMSO溶劑和THF/DMSO混合溶劑(fTHF=99%)中由365nm波長的紫外光照射的照片;
圖12A為TPE-MEM在600nm的PL強度與濃度之間的相關曲線圖; 內部的插圖為不同濃度的TPE-MEM由365nm波長的紫外光照射的照片;
圖13A為透射電子顯微鏡(TEM)測定的TPE-MEM(100μM)在水性溶液中的粒徑照片;
圖13B為電動電勢粒度分析儀測定的不同濃度的TPE-MEM的粒徑曲線圖;內部的插圖為由電動電勢粒度分析儀測定的TPE-MEM(100μM)在水性溶液中的粒徑分布圖;
圖14為MTT法測定的TPE-MEM對HeLa細胞增殖的影響的分析圖;細胞暴露於不同濃度的TPE-MEM 6小時;
圖15A為TPE-MEM(5μM,λex=405nm和λem=550±70nm)對HeLa細胞染色的雷射掃描共聚焦顯微鏡成像圖;
圖15B為CellMaskTM深紅色細胞膜染色劑(C10046,5μg/mL,λex=633nm和λem=685±55nm)對HeLa細胞染色的雷射掃描共聚焦顯微鏡成像圖;
圖15C為圖15B相對應的明視野成像圖;
圖15D為圖15A-15C的合併成像圖,圖15A與圖15B的重疊係數計算為72%;
圖16為隨著掃描時間的增加過程中TPE-MEM(實線圓)螢光發射的信號損失(%)的變化曲線圖;內部的插圖分別為在325.7s連續掃描以前和連續掃描以後的由TPE-MEM(5μM)染色的活的HeLa細胞的螢光成像圖,λex=405nm和λem=550±50nm;
圖17A為存在有TPE-MEM(10μM)的H2DCFDA(1μM)在房間燈光照射下的PL光譜圖,激發波長為488nm;
圖17B為照射時間分別對含有TPE-MEM的溶液、含有H2DCFDA的溶液或者TPE-MEM和H2DCFDA二者均含有的溶液在535nm的PL強度的影響的曲線圖;
圖18中的A-D照片為在照射前TPE-MEM和PI染色的HeLa細胞的共聚焦成像圖;E-H照片為在照射後TPE-MEM和PI染色的HeLa細胞的共聚焦成像圖;I-L照片為在照射後僅用PI染色的HeLa細胞的共聚焦成像 圖;C、G和K照片分別為A、E、I相對應的明視野的成像圖;D、H和L分別是A/B/C的合併成像圖、E/F/G的合併成像圖和I/J/K的合併成像圖;[TPE-MEM]=5μM;[PI]=3μM;Channel I:λex=405nm,λem=550±50nm;Channel II:λex=560nm,λem=620±65nm;
圖19為通過MTT法測定房間燈光照射TPE-MEM以及未照射TPE-MEM分別對HeLa細胞增殖的影響的對比圖;
圖20A為TPE-2Gd在不同含水量(fw)的THF/H2O混合溶液中由365nm的紫外光照射的照片;
圖20B為TPE-2Gd在不同含水量(fw)的THF/H2O混合溶液中的發射光譜圖,濃度為100μM,激發波長為330nm;
圖20C為不同濃度TPE-2Gd(1μM and 100μM)的相對PL強度(I/I0)與THF/H2O混合溶液中的含水量之間的相關曲線圖;
圖21A為不同濃度的TPE-2Gd水溶液在紫外光照射下的照片;
圖21B為不同濃度的TPE-2Gd水溶液的發射光譜圖,激發波長為330nm;
圖21C為TPE-2Gd的PL強度與在水中的濃度之間的相關曲線圖,TPE-2Gd的臨界膠團濃度(CMC)為70μM;
圖22A為TPE-2Gd(100μM)在水中的透射電子顯微鏡成像圖;
圖22B為TPE-2Gd(100μM)在水中的粒徑分析圖;
圖23A為TPE-2Gd染色的HeLa細胞的螢光成像圖,[TPE-2Gd]=30μM;
圖23B為TPE-2Gd染色之後的PI染色的HeLa細胞的螢光成像圖,[TPE-2Gd]=30μM;
圖23C為圖23A與圖23B的合併成像圖,[TPE-2Gd]=30μM;
圖23D為HeLa細胞的明視野成像圖,[TPE-2Gd]=30μM;
圖24為通過MTT法測定的TPE-2Gd對HeLa細胞的細胞增殖情況的分析圖,細胞暴露於不同濃度的TPE-2Gd 4小時,更換新鮮的培養基後繼續培養24小時;
圖25為不同Gd3+濃度的TPE-2Gd和商用對照品的T1-加權核磁共振圖譜(MR),樣品由生理鹽水進行稀釋;
圖26為不同Gd3+濃度的TPE-2Gd和商用對照品的水質子縱向弛豫速率(1/T1)的曲線圖,根據方程式:1/T1=1/T1,0+R1×[CGd],弛豫速度R1,TPE-2Gd=3.36±0.10mM-1·s-1;R1,magnevist=3.70±0.02mM-1·s-1;
圖27為分別給小鼠靜脈注射含有G d3+離子濃度為0.1mmol/kg的TPE-2Gd和後的冠狀的T1-加權核磁共振(MR)成像圖;
圖28A為心臟的T1-加權成像的定量分析圖;
圖28B為肝的T1-加權成像的定量分析圖;
圖29為分別給小鼠的肝內靜脈注射含有G d3+離子濃度為0.1mmol/kg的TPE-2Gd和後的軸向的T1-加權核磁共振(MR)成像圖。
具體實施方式
下面結合附圖和實施例,對本發明的兩親性的具有聚集誘導發光特性的發光物及其應用作進一步說明:
在2001年由Tang發現了聚集誘導發光(aggregation-induced eimission,AIE)現象,目前AIE現象因其在有機發光二極體(OLEDs)、化學傳感器、生物傳感器以及體內外的生物成像劑等方面的潛在應用已經成為世界上最熱研究領域之一,但大部分AIE分子都是由芳環構成,因此AIE分子呈疏水性,不溶於水性介質。另一方面,很少有報導關於水溶性AIE分子或兩親性AIE分子。從這方面考慮,本發明設計合成了一些水溶性和兩親性AIE分子,開發了它們的潛在生物應用。
以下實施例僅是本發明的說明性的示例,而不是限制性的。
實施例1:合成非離子兩親性的發光物P1/6、P2/6和P3/6並對其進行應用方面的實驗研究
(1)合成(n、m、o和p分別表示2~3000的自然數)
如圖1所示,合成發光物P1/6所用的試劑的供給比例如下,第六化合物6、第一化合物1、CuBr和PMDETA之間的濃度比[6]/[1]/[CuBr]/[PMDETA]為1/4/4/4,合成發光物P2/6和P3/6的試劑的供給比例使用濃度的比例與發光物P1/6不同之處是第六化合物6分別與第二化合物2和第三化合物3的濃度比為[6]/[2]/[3]=1/1/0.5。室溫下,在裝有30mLDMF、CuBr(172mg,1.2mmol)和5.3mL PMDETA(1.2mmol)的50mL的Schlenk瓶中,第六化合物6(1.05mg,0.3mmol)和第一化合物1(430mg,1.2mmol)進行連結反應,進行攪拌36小時後,用水(300mL)將反應混合物稀釋,用二氯甲烷對該水溶液提取四次,將所有有機相混合在一起,進一步由濃鹽水衝洗六次,並通過Na2SO4乾燥。溶劑蒸發後,殘留物濃縮至~20mL,在乙醚(300mL)中沉澱3次,過濾沉澱物並用過量的乙醚衝洗得到相應的產物。
發光物P1/6,產率82%,Mw 3200;Mw/Mn 1.03;IR(KBr),ν(cm-1):3435,2885,1641,1466,1346,1281,1244,1111,953,841,756,700,623,581,523;1H NMR(400MHz,DMSO-d6),δ(ppm):8.46(2H,s,苯三唑triazole-H),7.62(4H,d,J=8.0Hz,苯三唑triazole-Ar-H),7.17-6.99(34H,m,Ar-H),4.56(4H,t,J=4.8Hz,CH2-triazole苯三唑),3.85(4H,t,J=4.8Hz,CH2CH2-triazole苯三唑),3.53–3.46(300H,m,OCH2);13C NMR(100MHz,DMSO-d6),δ(ppm):145.86,143.15,143.02,142.63,140.77,140.19,131.20,130.70,130.65,128.97,127.86,127.82,126.62,124.50,121.72,72.36,69.90,69.73,69.64,68.67,60.23,49.58。
發光物P2/6,產率81%,Mw 34700;Mw/Mn 1.39;IR(KBr),ν(cm-1):3416,2880,1639,1466,1352,1281,1250,1113,951,845,770,704,675,527;1H NMR(400MHz,DMSO-d6),δ(ppm):8.41(2H,s,triazole-H),7.57(4H,t,J=8.0Hz,苯三唑triazole-Ar-H),7.14-6.99(14H,m,Ar-H),4.50(4H,m,CH2-triazole苯三唑),3.80(4H,t,J=4.8Hz,OCH2CH2-triazole苯三唑),3.60–3.39(300H,m,OCH2);13C NMR(100MHz,DMSO-d6),δ(ppm):145.87,145.86,143.06,142.65,140.42,131.26,130.77,129.03,127.93,126.77,124.52,121.76,72.37,69.92,69.74,69.53,68.69.60.25,49.60。
發光物P3/6,產率88%,Mw 27,600;Mw/Mn 1.39;IR(KBr),ν(cm-1):3439,3136,2873,1639,1463,1350,1286,1249,1109,954,840,663,530;1H NMR(400MHz,DMSO-d6),δ(ppm):8.41(4H,s,苯三唑triazole-H),7.61(8H,d,J=8.0Hz,苯三唑triazole-Ar-H),7.07(8H,d,J=8.0Hz,Ar-H),4.49(8H,s,CH2-triazole苯三唑),3.79(8H,s,OCH2CH2-triazole苯三唑),3.64–3.40(600H,m,OCH2);13C NMR(100MHz,DMSO-d6),δ(ppm):145.85,142.53,140.21,131.42,129.24,124.66,121.79,72.36,69.68,68.68,60.23,49.59。
(2)應用研究:
通過疊氮-炔的環加成作用合成帶有不同鏈數聚乙二醇(PEG)的非離子的水溶性的四苯乙烯(TPE)-功能化的聚乙二醇(PEG)發光物(P1/6、P2/6和P3/6),將疏水性的TPE變成親水分子。這些發光物顯示出較好的 熱穩定性,參見表1,其中P1/6、P2/6和P3/6的Td分別為351.6℃、342.2℃和352.1℃。如圖4A-4D所示,這些合成後的聚合物是水溶性和兩親性的,在THF/水溶劑系統和THF/己烷溶劑系統中均顯示出AIE特性。在大量水溶液中,這些聚合物超過臨界膠團濃度(CMC)時形成膠束聚合物。如圖5A、5B和5C所示,通過利用這些聚合物聚集狀態時自身螢光發光的性質得到P1/6、P2/6和P3/6的CMC分別為0.09mM、0.12mM和0.20mM,粒徑分別約為100nm。所有結果表明,這些聚合物的膠束由在內側的非極性的TPE頭和指向水性介質的親水性的PEG鏈組成。這些聚合物在CMC以下,則單獨溶於介質中且不發光,當增加濃度至CMC以上時,這些聚合物開始形成膠束,TPE部分聚集在疏水內部,顯示出較強的螢光發光。因此,由於分子內旋轉的限制(restriction of intramolecular rotation,RIR)對膠束化的影響,這些聚合物變得可以發光。
為了研究P1/6對活細胞的影響,利用CCK8進行了細胞毒性分析。WST-8([2-(2-methoxy-4-nitropheny)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2H-tetrazoliun,monosodium salt],[2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-雙磺苯基)-2H-四氮唑,穀氨酸鈉鹽]通過細胞內的脫氫酶轉變為甲瓚,其與活細胞的數量成正比。如圖6所示,P1/6的細胞毒性在P1/6暴露於HepG2細胞24h後呈劑量依賴性。濃度為50、75、100、125μg/mL所對應的細胞存活率分別為99.93%、98.1%、95.82%和92.94%,在濃度達到150μg/mL時,細胞存活率依然保持超過86%。所有數據表明P1/6具有用於活細胞成像的較好生物相容性。
表1:P1/6、P2/6和P3/6的分子量以及熱學性能
作為藥物載體用於臨床應用方面,PEG是生物可相容的且適用於傳遞有機染色劑至細胞內。純染色劑TPE因其高度疏水性無法透入進細胞內區域(未顯示數據)。由於具有AIE性質的較佳的光學特性,使用TPE-功能化的PEG聚合物對貼壁型HepG2細胞染色作為生物探針。兩親性聚合物在水性溶液中傾向於形成納米聚合物,其可以通過內吞作用促進細胞攝取。如圖7所示,當HepG2細胞由P1/6染色12h時,從胞質區會發光。隨著P1/6濃度的增加,螢光變得更強,表明內吞作用的效率取決於P1/6在培養基中的劑量。如圖8所示,儘管細胞與高濃度的P2/6和P3/6進行培養更長的時間,但與P1/6相比發光要弱得多。這種差異歸因於TPE與PEG之間的比例。
為了長時間監測細胞形態,生產商已經盡力改善染色後的負載時間。例如,商業細胞追蹤器,CellTrackerTM藍色CMAC(7-Amino-4-Chloromethylcoumarin,7-氨基-4-氯甲基香豆素)和藍色CMHC(4-chloromethyl-7-hydroxycoumarin,4-氯甲基-7-羥基香豆素)由氯甲基官能團功能化。當追蹤器的探針進入細胞內時,探針可以與蛋白質和多肽上的硫醇進行反應,但是根據協議染色劑在染色後僅可以照亮細胞大約24小時。如圖9所示,作為第一代,活的HepG2細胞暴露於P1/6聚合物24小時,發出強光。由於在細胞內生物大分子PEG會鎖住螢光團,細胞內的P1/6被傳遞至子細胞內。儘管增生代的增加使得螢光變弱,但是探針還是能夠追蹤至第五代。因此,P1/6可用作長期活細胞追蹤器,是潛在的替代方式。因此,該螢光聚合物可應用於監測細胞內藥物釋放。
實施例2:合成陽離子兩親性的發光物TPE-MEM並對其進行應用方面的實驗研究
(1)合成
如圖2所示,在氮氣環境下,1-(3-三甲基胺基丙烷基)-4-甲基吡啶二溴化物(1-(3-trimethylammoniopropyl)-4-methylpyridinium dibromide)(0.5g,1.4mmol)和第三化合物3(1.5016g,2.8mmol)的溶液在無水乙醇中回流反應,加入三滴哌啶進行催化,冷卻至室溫後,在減壓條件下蒸發溶劑,通過矽膠柱色譜法對殘留物進行純化,使用二氯甲烷和甲醇(2:1v/v)的混合溶劑作為洗脫劑,得到黃色產物TPE-MEM(0.72g,59%)。1H NMR(400MHz,甲醇-d4,δ):8.948(d,2H,J=6.8Hz),8.213-8.190(m,2H),7.946(6,1H,J=16Hz),7.737-7.717(m,2H),7.576(d,2H,J=8Hz),7.430-7.331(m,3H),7.061-6.843(m,14H),6.605-6.570(m,2H),4.698(t,2H,J=15.2Hz),3.797(t,2H,J=14.8Hz),3.644(t,2H,J=16.4Hz),3.240(s,9H),2.663-2.581(m,2H),1.693-1.619(m,2H),1.421-1.262(m,6H),0.871(t,3H,J=14.4Hz);13C NMR(100MHz,CDCl3,δ):157.362,157.260,153.875,143.411,143.306,143.250,143.227,143.198,141.993,140.990,140.597,138.760,136.680,135.055,133.295,131.619,131.584,131.140,130.482,128.135,126.902,126.855,126.798,126.683,126.281,125.676,125.507,125.457,125.216,125.115,123.440,121.585,112.874,112.700,66.856,61.787,55.965,52.066,30.728,30.716,28.311,24.791,24.216,21.625,12.399;HRMS(MALDI-TOF)m/z:計算值,791.3571[M-Br-]+;測定值,791.3570[M-Br-]+。
(2)應用研究
細胞膜為細胞的保護屏障,對於細胞的完整性、生長和死亡至關重要。迫切需要在活細胞和瀕死細胞內對細胞膜成像的發光物。在本實施例中提供一種新的兩親性以四苯乙烯為基礎的吡啶鹽(tetraphenylethene-based pyridinium salt,TPE-MEM),具有顯著的聚集誘導發光(AIE)特性,並用於選擇性細胞膜染色。該高產率的發光物的螢光探針(TPE-MEM)通過下述反應合成,包括不對稱McMurry反應、Suzuki耦合反應以及帶雙電荷的吡啶鹽和己氧基四苯乙烯苯甲醛(hexyloxytetraphenylethene benzaldehyde)之間的縮合反應。由於雙電荷特性,TPE-MEM在非極性溶劑中具有較差的溶解性,如在THF和DCM非極性溶劑中,但在極性溶劑中可溶,如在水、DMF、DMSO和甲醇中可溶。
圖10顯示了TPE-MEM在水性溶液(40μM)中的紫外(UV)和光致發光(PL)光譜。TPE-MEM的吸收最大波長落在395nm。為了方便生物應用,使用405nm作為激發波長進行PL測定。水性溶液的光激發誘導在590nm發黃光,表示發生了185nm的大量位移,這是由擴展共軛作用以及從電子供體TPE配基至電子受體吡啶單元的分子內電荷轉移(intramolecular charge transfer,ICT)造成的。
如圖11A和11B所示,TPE-MEM顯示出明顯相反的AIE性質,這是由於其強極性的性質導致的。TPE-MEM(25μM)的DMSO溶液發光較弱,而在含量99%的THF中,在625nm發光變強。考慮到TPE-MEM的分子結構,推測兩親性TPE-MEM分子在高濃度情況下可以形成膠團。得益於AIE的性質,TPE-MEM的臨界膠團濃度(CMC)可以利用其自身的螢光強度進行測定。如圖12所示,TPE-MEM的濃度在CMC以下時是分子溶解,因此不產生螢光;在0.01mM以上,PL強度急劇增強;PL強度與染色劑濃度之間的相關曲線產生兩條線,兩條線的交叉點確定CMC為0.02mM。如圖13A和13B所示,通過透射電子顯微鏡和電動電勢粒度分析儀也證實了在高染色劑濃度中納米聚合物的形成以及CMC值。含水膠束的有效直徑為77.4nm,隨著脫水有效直徑縮減到40nm。當TPE-MEM在CMC以下是分子溶解的時候,不能檢測到微粒;當在CMC(0.02mM)以上時,可以觀察到微粒。由PL測定的曲折點與CMC值相同。此外,納米聚合物的粒徑既適合於體外細胞攝取和體內循環,又適合於生物分布。
在細胞成像以前,利用MTT比色法在HeLa細胞內可以測定TPE-MEM 的細胞活性和細胞毒性。在37℃條件下,在黑暗的CO2培養器內細胞暴露於不同濃度(0、2.5μM、5μM、10μM、20μM)的TPE-MEM 6小時,然後在培養器的新鮮的培養基內再培養18小時進行細胞增殖。如圖14所示,結果顯示在黑暗中TPE-MEM的濃度即使達到20μM也一般沒有細胞毒性。然後正如預期的,對TPE-MEM用於選擇性的細胞膜染色進行評估。如圖15A-15D所示,使用CellMaskTMDeep Red細胞膜染色劑(C10046)進行的聯合染色實驗表明從TPE-MEM觀察到的螢光是來自於活的HeLa細胞的細胞膜,其中該細胞膜染色劑是一種商業上可獲得的細胞膜成像劑。通過使用共聚焦顯微鏡(CLSM LSM7;Carl Zeiss,Germany)的軟體,測定圖15A和圖15B之間的重疊係數為72%。重疊係數相當高,這是由於薄層細胞膜結構以及兩種染色劑之間的競爭抑制。與C10046相比,TPE-MEM顯示出較少的內在化作用,且對細胞膜的成像表現出較好的成像解析度。更甚地,通過TPE-MEM還可以清楚地看到細胞微絨毛。除了複合染色實驗,還進行了Z型CLSM掃描(Z-stack CLSM scanning)。
細胞膜是在膜的界面上顯示較大負電位的細胞器,在該細胞器上磷脂雙分子層主要由薄的兩親性磷脂雙分子層構成。因此,細胞膜目標生物染色劑通常需要符合是兩親性的和陽離子的。協調平衡分子的疏水性和親水性以滿足細胞膜的兩親性,這對於設計新的細胞膜生物染色劑至關重要。TPE-MEM具有兩親性和帶正荷的特性,因此將其可以作為極佳的生物染色劑,用於特異性染色活細胞的細胞膜。兩親性的TPE-MEM自發排列在磷脂雙層,以便使疏水尾部區域在與周圍極性液體相隔離的雙層內以及親水頭部區域被靜電吸引至負電荷的磷酸鹽。如靜電作用力和範德瓦爾斯相互作用力(van der Waals interactions)等導致特異性目標染色。
對於細胞成像染色劑,耐光性是最重要的標準之一。用於特異性細胞染色的一些AIE染色劑都是高耐光性的。螺旋狀分子結構和其聚合形成過程可以阻止氧氣擴散進入AIE微粒內,氧氣進入AIE微粒內會氧化螢光團以及使其PL發光變白。如圖16所示,在活細胞內得到了相似的耐光性結果。根據初始螢光強度標準化螢光強度。如圖16所示,總照射時間5分鐘(30次掃描),TPE-MEM的信號損失少於40%。從0s至325.7s的時間,信號損失和成像亮度發生輕微下降,這是由於染色劑的擴散以及細胞的移動。
如圖16所示,在CLSM時間過程中系列掃描中可以看到氣泡。明顯地,細胞絨毛收縮並消失,然後基於雷射掃描,細胞膨脹並洩露,可見細胞質膜變得不連續且是滲漏的。這種現象強烈表明細胞死亡是由雷射掃描導致的,這就激發了人們後續研究的原因。在π-共軛體系中具有正電荷的吩噻嗪(phenothiazinium)基分子廣泛用於活性氧(ROS)生成和光線療法。與吩噻嗪相比,TPE-MEM在π-共軛體系中也具有正電荷,這有可能會使得光誘導ROS生成,導致細胞死亡。
為了證實上述假設,使用商用ROS螢光探針H2DCFDA進行ROS檢測。當通過已存在的ROS氧化H2DCFDA時,可以檢測到在535nm(λex=488nm)發射強螢光。出人意外地,正常的白色房間燈光(LED燈泡,3W)照射到TPE-MEM溶液時足夠產生ROS。含有H2DCFDA的PBS溶液、含有TPE-MEM的PBS溶液以及同時含有H2DCFDA和TPE-MEM的PBS溶液的PL光譜都是在相同的房間燈光照射得到的。記錄樣品不同照射時間的PL光譜(圖17A,λex=488nm)以及535nm的峰值強度與照射時間之間的相關曲線(圖17B)。在圖17A中,當溶液中同時存在H2DCFDA和TPE-MEM時,被氧化的H2DCFDA在535nm的特徵峰出現並隨著光照射增強。測定結果顯示即使房間燈光照射時間超過120分鐘,PL強度仍然持續增強,而紫外光照射僅幾分鐘之內就使螢光變白(未顯示數據)。單獨的H2DCFDA溶液和單獨的TPE-MEM溶液由房間燈光照射後的PL強度變化輕微。觀察結果表明實際上是光線照射在TPE-MEM的時候產生的ROS,導致細胞受損和死亡。
然而,細胞死亡的病理學仍然無法解釋。細胞膜的完整性是最重要形態學特徵之一,用於區分細胞凋亡和細胞壞死。在細胞壞死的過程中,細胞膨脹,細胞膜變得有漏洞並分裂,最終細胞與周圍環境交換物質。碘化丙啶(propidium iodide,PI)是不能滲透通過細胞膜的,通常排除在活細胞 之外。當細胞膜有漏洞時,PI常用於對死亡細胞的胞核染色。因此,PI開放用於在大量細胞中識別死亡細胞並在多色螢光技術中作為復染色劑。在本實例中,如圖18所示,TPE-MEM加入至具有活細胞的培養基內進行標記,然後將PI引入至觀察基內。如圖18中的A-D所示,在光照射以前僅可以檢測到來自於細胞膜上的TPE-MEM(channel I)的黃光。當照射細胞約5分鐘(30scans)的時候,再照射另一個5分鐘用於攝取PI,如圖18中的E-H所示,在細胞內部的細胞質和細胞核內可以觀察到細胞形態的變化以及來自於PI(channel II)所發的紅光。在細胞核內來自於PI所發的紅光是由於PI插入結合至DNA導致PI發紅光,而細胞質內的紅色信號有可能是細胞核裂解進入至細胞質內造成的。在沒有TPE-MEM的控制實驗中,在照射前(未顯示數據)和照射後(圖18中的I-L)都沒有檢測到紅色信號(channel II)。所有觀察結果顯示細胞膜變得有漏洞,表明在存在有TPE-MEM的情況下進行光線照射會引起細胞壞死。
所有結果表明TPE-MEM在房間燈光照射下促使產生ROS。TPE-MEM除了具有細胞膜選擇性和極好的耐光性,TPE-MEM可潛在用作治療癌症的光線療法藥物。為了評估利用正常房間燈光照射TPE-MEM的光線療法對HeLa癌細胞增殖的影響,如圖19所示,通過MTT法,對於房間燈光照射2小時和未照射2小時兩種情況分別測定含有不同濃度的TPE-MEM的細胞存活率。通過測定的MTT值與不含有TPE-MEM且未光照的樣品測得的MTT值之間的關係製備標準曲線進而計算細胞存活率。
圖19的結果顯示未經照射的細胞是有存活率且從0μM-10μM的細胞存活率約為90%,不含有TPE-MEM的樣品經房間燈光照射後未顯示毒性。然而,經房間燈光照射的TPE-MEM產生ROS,在含有10μM的TPE-MEM的細胞存活率降至47%。在含有TPE-MEM的情況下,經房間燈光照射的樣品與未經房間燈光照射的樣品之間得到比較大的細胞存活率差異。白色房間燈光照射是溫和的,容易獲得且便宜,結合產生ROS的高產率,使得光線療法無危害性、耐光、暗毒性低。所有的優點使得TPE-MEM是一種較好的光敏劑(也可以稱為感光劑)。
即使很難鑑定ROS物質以及說明ROS產生的機制,但卻可以觀察到ROS的產生。ROS已經顯示出可以增強癌細胞的增殖,但過量的ROS水平會導致癌細胞凋亡和壞死。在本實例中,細胞膜生物染色劑(TPE-MEM)通過房間燈光照射產生過量的ROS,可以實時地可視化原位癌細胞壞死的過程。
總之,合成的具有強AIE特性的非對稱的兩親性的四苯乙烯基吡啶鹽(tetraphenylethene-based pyridinium salt,TPE-MEM)可用於細胞膜染色。由於陽離子和兩親性,TPE-MEM對細胞膜具有高特異性以及在活細胞內具有極佳的耐光性。令人意外的是,僅通過普通房間燈光照射下TPE-MEM就可以有效誘導產生ROS,導致細胞壞死。這些獨特特徵使得可以實時觀察在原位的細胞壞死的過程和光線療法的過程。因此,產生ROS和可光線療法的結果使得本實施例的發光物可用於製備治療癌症的新的AIE光線療法藥物。
實施例3:合成陰離子的兩親性發光物TPE-2Gd並對其進行應用方面的實驗研究
(1)合成TPE-2+
如圖3所示,在氮氣環境下,1-(3-三甲基胺基丙烷基)-4-甲基吡啶二溴化物(1-(3-trimethylammoniopropyl)-4-methylpyridinium dibromide)(0.5g,1.4mmol)和4-(1,2,2-三苯基乙烯基)苯甲醛(4-(1,2,2-triphenylvinyl)benzaldehyde)(1.01g,2.8mmol)的溶液在無水甲醇中回流反應,加入三滴哌啶進行催化,冷卻至室溫後,在減壓條件下蒸發溶劑,通過矽膠柱色譜法對殘留物進行純化,使用二氯甲烷和甲醇(2:1v/v)的混合溶劑作為洗脫劑,得到黃色產物TPE-2+(0.56g,57%)。1H NMR(400MHz,甲醇-d4,δ):8.913(d,2H,J=6.8Hz),8.177(d,2H,J=6.8Hz),7.875(d,1H,J=16.0Hz),7.501(d,2H,J=8.4Hz),7.352(d,1H,J=16.4Hz),7.120-6.985(m,17H),4.678(t,2H,J=12.4Hz),3.611(t,2H,J=16.8Hz),3.224(s,9H),2.600(m,2H);13C NMR(100MHz,甲醇-d4,δ):153.985,146.064,143.359,142.763,142.666,142.535,141.710,141.079,139.581,132.603,131.121,130.342,130.261,126.910,126.741,125.901,125.794,123.366,121.556,61.776,55.939,52.015,24.136;HRMS(MALDI-TOF)m/z:計算值,535.3102[M-HBr-Br-]+;測定值,537.3263[M-HBr-Br-]+。
(2)合成第五化合物5,並通過第五化合物5合成TPE-2Gd
如圖3所示,將第三化合物3(163.3mg,0.2mmol)、第四化合物4(214.4mg,0.6mmol)、DCC(136.2mg,0.66mmol)和DMAP(80.6mg,0.66mmol)完全溶解於30mL的DMF中,加入3mL的三乙胺後,室溫條件下,在氮氣環境下對上述混合物攪拌48小時,攪拌後的混合物中加入10mL的三氟乙酸酸化30分鐘,然後過濾,在己烷中沉澱3次,得到相應的需要的第五化合物5,產率92%。1H NMR(400MHz,DMSO-d6,δ):8.45(m,2H,H of triazole苯三唑),8.05(m,2H,H of amide醯胺),7.60(m,4H;H-Ar-triazole苯 三唑),7.12-7.01(m,14H;H-Ar),4.53(s,4H;CH2-triazole苯三唑),3.83(m,4H;CH2C-triazole苯三唑),3.57-3.13(m,20H;OCH2),3.02(s,20H;CH2C=O),2.90(s,20H;NCH2);13C NMR(100MHz,DMSO-d6,δ):172.6,169.2,145.9,143.0,142.6,140.4,131.3,130.7,129.0,127.9,126.7,124.6,121.8,69.6,68.6,64.9,55.1,51.7,49.6;IR(KBr):ν=3437.2,2954.9,1726.3,1635.6,1460.1,1396.4,1226.7,1089.8,974.1,908.5,700.2cm-1;HRMS(MALDI-TOF)m/z:計算值,1670.5896[M-4H+3Na+K];測定值,1669.1871[M-5H+3Na+K]+;計算值,1698.5795[M-6H+6Na];測定值,1697.1949[M-7H+6Na]+;計算值,1724.8194;[M-5H+2Na+3K];測定值,1724.2223[M-6H+2Na+3K]+。
如圖3所示,然後將第五化合物5(235.0mg,0.15mmol)、GdAc3(107.0mg,0.32mmol)和NaAc(131.2mg,1.6mmol)溶解於20mL的DMF中,在70℃條件下攪拌過夜後,對得到的混合物過濾,在己烷中沉澱三次,得到相應的所需化合物TPE-2Gd,產率95%。IR(KBr):ν=3439.1,1595.1,1409.9,1330.9,1273.0,1220.6,1095.6,933.5,707.9,653.9cm-1;HRMS(MALDI-TOF)m/z:計算值,1984.5525[M+6H2O];測定值,1984.4323[M+6H2O]。
(3)應用研究
為了達到雙重功能,本實施例中合成了含有GD-二乙三胺五乙酸(Gd-diethylenetriamine pentaacetic acid,DTPA)螯合物的TPE衍生物(TPE-2Gd),然後對其進行光物理性質的檢測。紫外可見光譜顯示TPE-2Gd的最大吸收波長在330nm,與親代螢光素-TPE的最大吸收波長相似(未顯示數據)。如圖20A-20C所示,在330nm激發時,當THF/水溶液中含水量(fw)少於50%時,TPE-2Gd的螢光發光較弱。隨著fw的增加,溶液的螢光逐漸變強,在純水溶液中變成高強度發光,顯示出明顯的AIE效應。圖20A的照片清楚地顯示了,隨著fw在THF/水溶液中逐漸增加,TPE-2Gd的螢光加強。
從圖20C可以注意到,當染色劑濃度從1μM增加到100μM時,TPE-2Gd在純水中的螢光強度增加了一倍。推測兩親性TPE-2Gd分子高濃度時可以形成膠束。由於AIE性質,TPE-2Gd的臨界膠團濃度(CMC)可以利用熒 光強度進行估測。當濃度低於CMC時,染色劑分子可以較好地溶解於溶液中,因此不發冷光。當染色劑濃度高於10μM,溶液發光。如圖21A-21C所示,螢光強度與染色劑濃度之間的相關曲線形成兩條,兩條線的交叉點給出CMC為70μM,該值比十二烷基硫酸鈉的值(CMC=8.2mM)要低得多,主要是由於TPE配基的強疏水性導致的。這樣低的CMC即使是在血流稀釋下也可以確保在體內形成納米聚合物。如圖22A和22B所示,通過透射電子顯微鏡和電動電勢粒度分析儀證實了在高染色劑濃度下形成納米聚合物。含水膠束的有效直徑為164.9nm,脫水後縮減為70nm。納米聚合物的粒徑適合於體外細胞攝取和體內循環以及生物分布。
由FDA批准的一種商用的Gd-基MR(Gd-based MR)造影劑 是一種典型的細胞外液試劑,在細胞外區或組織間隙可快速循環。另一方面,TPE-2Gd能夠以納米聚合物的形式進入腫瘤細胞內,已通過活細胞成像進行證明。HeLa細胞由30μM的TPE-2Gd培養4小時,TPE-2Gd進入至該細胞內,通過藍色螢光照亮細胞質區。為了進一步證實TPE-2Gd的染色區,使用PI作為復染色劑。PI是可染色固定細胞的細胞核的細胞核染色劑。如圖23A-23D所示,在細胞核周圍的藍色螢光清楚地表明TPE-2Gd選擇性僅對細胞質區染色。TPE-2Gd的納米聚合物通過內吞作用的途徑被內在化進入活細胞,使得TPE-2Gd可以在細胞水平上追蹤腫瘤,彌補了在組織水平上追蹤腫瘤的缺陷。
利用MTT法測定了TPE-2Gd在HeLa細胞內的毒性。將細胞暴露於不同濃度的TPE-2Gd(0、15μM、30μM、45μM和60μM)4小時,然後在新鮮的培養基內培養24小時,用於評估納米聚合物對細胞增殖的內在化影響。如圖24所示,當TPE-2Gd的濃度低於30μM時,通常是沒有毒性的,在用染色劑處理後,約98.8%的細胞都是活的。即使濃度增加至60μM,比細胞成像實驗的工作濃度高出2倍,細胞存活率仍然約有87.8%。這個結果表明TPE-2Gd是生物可相容的用於細胞成像,並有望進一步進行體內研究。
在另一方面,為了檢測TPE-2Gd是否為有效的MRI造影劑,使用3.0T核磁共振成像(MRI)儀器在室溫下根據Gd3+濃度測定水溶液中TPE-2Gd 的縱向弛豫時間或自旋晶格(T1)。如圖25所示,隨著緩衝溶液中TPE-2Gd濃度的增加,混合物的信號強度(亮度)變強,與相同Gd3+濃度的相似。如圖26所示,測定TPE-2Gd的弛豫效能是3.36±0.10mM-1·s-1, 的弛豫效能是3.70±0.02mM-1·s-1,弛豫效能是指每單位濃度的造影劑中自旋晶格的順磁性成分。與相比,TPE-2Gd具有高弛豫速率,表明TPE-2Gd可以加強其鄰近的水質子的弛豫速率,進而導致信號強度增強。如圖27、圖28A、圖28B和圖29所示,TPE-2GD作為納米粒子,在血液中的半衰期較長,可以用於延長肝臟和心臟MRI成像的時間窗。
應當理解的是,對本領域普通技術人員來說,可以根據上述說明加以改進或變換,所有這些改進或變換都應屬於本發明所附權利要求的保護範圍之內。
