針對組織因子的人抗體的製作方法
2023-06-09 05:16:37 3
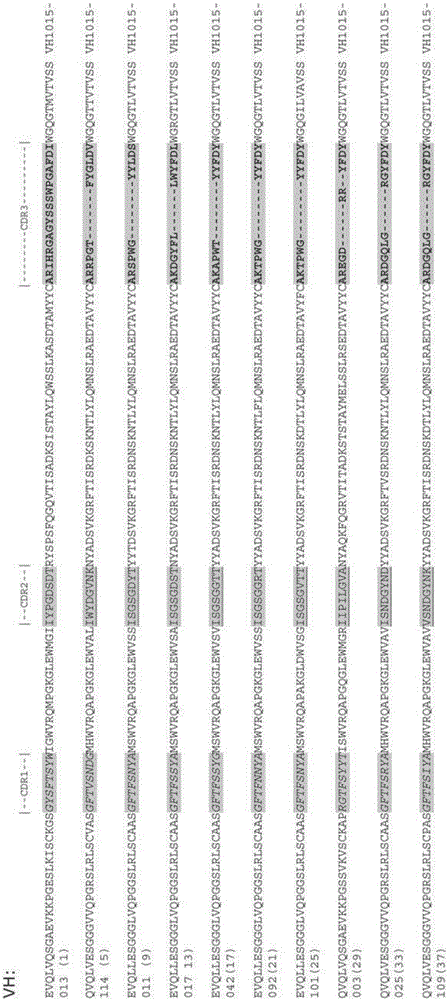
發明領域本發明涉及針對組織因子,特別是人組織因子的抗體,和這類抗體的用途,特別是它們在治療癌症、炎症和血管疾病中的用途。發明背景組織因子(TF),也稱作促凝血酶原激酶(thromboplastin)、因子III或CD142,是一種存在於內皮下組織、血小板和白細胞中的蛋白質,是引發從酶原凝血酶原(prothrombin)形成凝血酶所必需的。凝血酶形成最終導致血液凝固。組織因子使細胞能夠觸發凝血級聯,並且發揮凝血因子VII高親和力受體的功能。所得到的複合體提供一種催化事件,該事件負責通過特異的限制性蛋白水解(limitedproteolysis)引發凝血蛋白酶級聯。與這些蛋白酶級聯中其它作為無功能前體形式進行循環的輔助因子不同,這種因子是一種強力的引發劑(initiator),其表達在細胞表面上時即具有完全的功能。組織因子是絲氨酸蛋白酶因子VIIa(FVIIa)的細胞表面受體。FVIIa與組織因子的結合已經被發現可以在細胞內開始信號傳遞過程,所述信號傳遞功能在血管發生中發揮作用。儘管血管發生在生長和發育以及傷口癒合中是一種正常的過程,但是它也是腫瘤從休眠狀態轉變成惡性狀態過程中的一個基本步驟:當癌細胞獲得可以產生參與血管發生的蛋白質,即所謂的血管發生生長因子,的能力時,這些蛋白質被腫瘤釋放到附近組織內,並刺激現有的健康血管朝著腫瘤萌生出(sprout)新血管並進入腫瘤內部。一旦新血管進入腫瘤內,它就能夠快速增大其尺寸,並侵襲局部的組織和器官。通過這些新血管,癌細胞可以進一步逃逸進入循環中,並棲息於其它器官內形成新的腫瘤(轉移)。此外,TF在炎症中發揮作用。TF的作用被認為是通過血液凝固介導的(A.J.Chu:「Tissuefactormediatesinflammation」inArchivesofbiochemistryandbiophysics,2005,vol.440,No.2,pp.123-132)。因此,通過例如單克隆抗-TF抗體抑制TF,在幹擾凝固-炎症循環中具有重要意義,不僅有助於抗炎而且有助於抗血管疾病。TF表達在許多類型的癌症中均被觀察到,並且與侵襲性較高的疾病有關。而且,人TF還以一種可變剪接形式存在,即asHTF。最近發現,asHTF促進腫瘤生長(Hobbsetal.2007ThrombosisRes.120(2)S13-S21)。在先前技術中已經公開了與TF結合的抗體:WO98/40408公開了能夠結合天然(native)人TF的抗體,單獨存在或者存在於TF:VIIa複合體中,可有效阻止因子X結合到TF或該複合體,藉此降低凝血。該文獻公開了該抗體可用於減輕侵入性醫療程序(invasivemedicalprocedure),例如動脈或心臟手術,後的血栓形成,或者消除由於使用醫療措施(medicalimplementation)引發的凝血。其他抗體被公開用於體內診斷方法,包括天然人TF的體內診斷成像。WO04/094475提供了能夠與人組織因子結合的抗體,其與正常血漿對照相比,不抑制因子介導的凝血。沒有描述人抗體。據稱,該抗體可用於治療癌症。WO03/093422涉及與TF:VIIa複合體的結合親和力大於與TF本身的結合親和力的抗體。並提出了這些抗體作為抗凝劑在某些疾病治療中的用途,例如敗血症、彌散性血管內凝血、缺血性腦卒中、血栓形成、急性冠狀動脈綜合症和晚期癌症中的凝血病。WO01/27079公開了組合物和方法,用於抑制異常細胞增殖,特別是內皮細胞增殖,例如癌症,胚胎異常發育,免疫應答機能失常,以及與新生血管化和腫瘤生長有關的血管發生。提供了許多活性物質,包括抗體,但沒有公開具體的抗體。WO03/037361涉及TF激動劑或拮抗劑用於細胞凋亡相關的治療的用途。WO03/029295涉及分離的人抗體,其與人TF免疫反應,抑制凝血因子VIIa的結合。然而,該申請沒有公開具有這些性質的抗體的任何實例。已經有若干單克隆抗體療法被批准用於治療不同類型的腫瘤,包括例如貝伐單抗(bevacizumab)西妥昔單抗(cetuximab)帕尼單抗(panitumumab)(VectibixTM)和曲妥單抗(trastuzumab)發明概要儘管已經取得了很多進展,但是仍然需要有基於治療性抗體的改進方法用於治療嚴重的疾病,例如改進的癌症治療。本發明的一個目的是提供用於醫療用途的新的高特異性、有效的人抗-TF抗體。本發明抗體顯示與本領域中已有描述的抗體不同的TF結合特性。在優選實施方案中,本發明的抗體對人組織因子具有高親和力,介導抗體依賴的細胞毒性(ADCC),抑制FVIIa結合TF,抑制FVIIa誘導的ERK磷酸化和IL-8釋放,不抑制或者較弱地抑制凝血。本發明包括以下項:1.一種結合人組織因子的人抗體。2.項1的抗體,其中當用實施例13中所述的測定方法進行測定時,該抗體以3nM或更低,例如0.50nM或更低,例如0.35nM或更低,例如0.20nM或更低,例如0.1nM或更低的表觀親和力(EC50)與組織因子的胞外域結合。3.前述項中任一項的抗體,其中該抗體結合表達組織因子的哺乳動物細胞,例如用編碼組織因子的構建體轉染的A431細胞,優選地,當用實施例14中所述的測定方法進行測定時,其表觀親和力(EC50)為10nM或更低,例如8nM或更低,例如5nM或更低,例如2nM或更低,例如1nM或更低,例如0.5nM或更低,例如0.3nM或更低。4.前述項中任一項的抗體,其中該抗體能夠在A431細胞中誘發抗體依賴的細胞細胞毒性,優選地,當用實施例20中所述的測定方法進行測定時,其EC50值為2nM或更低,例如1nM或更低,例如0.7nM或更低,或者0.3nM或更低,例如0.20nM或更低,或者0.1nM或更低,或者0.05nM或更低。5.前述項中任一項的抗體,其中當用實施例24中所述的方法進行測定時,該抗體可有效抑制已建立的MDA-MB-231腫瘤的生長,和/或當用實施例26中所述的方法進行測定時,可有效抑制已建立的BxPC3腫瘤的生長。6.前述項中任一項的抗體,其中該抗體抑制組織因子誘導的凝血,優選地,當用實施例19中所述的測定方法進行測定時,其中值抑制濃度小於10nM,例如小於5nM,例如小於2nM,例如小於1nM。7.前述項中任一項的抗體,其中該抗體抑制FVIIa與組織因子結合,優選地,當用實施例15中所述的測定方法進行測定時,其抑制的最大抑制值大於80%,例如大於90%。8.前述項中任一項的抗體,其中該抗體抑制FVIIa誘導的MDA-MB-231細胞的IL-8釋放,優選地,當用實施例17中所述的測定方法進行測定時,抑制的最大抑制值大於40%,例如大於50%,例如大於60%。9.前述項中任一項中的抗體,其中該抗體抑制FX被TF/FVIIa複合體轉變成FXa,優選地,當用實施例18中所述的測定方法進行測定時,抑制小於50%,例如小於40%,例如在1-30%的範圍內。10.前述項中任一項的抗體,其中所述抗體與包括包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區的抗體競爭組織因子結合。11.前述項中任一項的抗體,其中與組織因子的結合不涉及組織因子的下述任一胺基酸:45位的W,46位的K或94位的Y。12.前述項中任一項的抗體,其中所述抗體與包括包含序列SEQIDNO:37的VH區及包含序列SEQIDNO:93的VL區的抗體競爭組織因子結合。13.前述項中任一項的抗體,其中所述抗體抑制FVIIa誘導的ERK磷酸化,優選地,當用實施例16中所述的測定方法進行測定時,其中值抑制濃度小於10nM,例如小於5nM,例如小於2nM。14.項1-7和9-13中任一項的抗體,其中該抗體抑制ERK磷酸化,優選地,當用實施例16中所述的測定方法進行測定時,其中值抑制濃度小於10nM,例如小於5nM,例如小於2nM,並且如實施例17中的測定方法所述的對FVII誘導的IL-8釋放的抑制不超過最大10%。15.前述項中任一項的抗體,其中抗體能夠誘導C3c和C4c沉積,優選地,如實施例21中所述進行測定,該抗體能夠誘導C3c和C4c沉積。16.前述項中任一項的抗體,其中如實施例28所述,抗體Fab片段與組織因子胞外域結合,用ELISA測得的EC50值低於0.1μg/mL,例如低於0.05μg/mL,例如低於0.04μg/mL。17.項1-15中任一項的抗體,其中如實施例28所述,抗體Fab片段與組織因子胞外域結合,按照ELISA測得的EC50值高於1.0μg/mL。18.項1-15中任一項的抗體,其中如實施例28所述,抗體Fab片段與組織因子胞外域結合,EC50值低於10μg/mL,例如低於1μg/mL,例如低於0.5μg/mL,或者低於0.2μg/mL。19.上述任一項的抗體,其中該抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與人TF的結合,其與改組構建體42-84mm顯示降低的結合,該改組構建體包含人的TF序列,只是胺基酸42-84被小鼠序列代替,如實施例27所述。20.項1-18的抗體,其中該抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與人TF的結合,其與改組構建體85-122mm顯示降低的結合,該改組構建體包含人的TF序列,只是胺基酸85-122被小鼠序列代替,如實施例27所述。21.項1-18的抗體,其中該抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與人TF的結合,其與改組構建體123-137mm顯示降低的結合,該改組構建體包含人的TF序列,只是胺基酸123-137被小鼠序列代替,如實施例27所述。22.項1-18的抗體,其中該抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與人TF的結合,其與改組構建體185-225mm顯示降低的結合,該改組構建體包含人的TF序列,只是胺基酸185-225被小鼠序列代替,如實施例27所述。23.項1-18的抗體,其中該抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與人TF的結合,其與改組構建體226-250mm顯示降低的結合,該改組構建體包含人的TF序列,只是胺基酸226-250被小鼠序列代替,如實施例27所述。24.根據項19-23中任一項的抗體,其中相比於與人TF的結合,其與超過1種改組構建體顯示降低的結合,例如與下列改組構建體的降低的結合:如項19中所定義的改組構建體42-84mm和如項20中所定義的改組構建體85-122mm,或如項21中所定義的改組構建體123-137mm,和如項22中所定義的改組構建體185-225mm,和如項23中所定義的改組構建體226-250mm。25.前述項中任一項中的抗體,其中所述抗體-與包括包含序列SEQIDNO:9的VH區及包含序列SEQIDNO:65的VL區的抗體競爭組織因子結合,並且-不與包括包含序列SEQIDNO:37的VH區及包含序列SEQIDNO:93的VL區的抗體競爭組織因子結合。26.項25的抗體,其中所述抗體包括這樣的VHCDR3區,其具有a)如下所示的序列-SEQIDNo:12,-SEQIDNo:16,-SEQIDNo:20,-SEQIDNo:24,-SEQIDNo:28,或者b)所述任一序列的變體,例如具有最多1、2、3、4、或5個胺基酸修飾,優選替換例如保守替換的變體。27.項26的抗體,其中該抗體包括具有如SEQIDNO:12所示的序列或其變體的VHCDR3區,其中該變體在位置2、3、6、9和11中一個或多個位置處包含修飾,優選地,其中該修飾是替換,更優選地,其中該替換選自下組:a)位置2處的R被K替換,b)位置3處的S被A或T替換,c)位置6處的G被T替換,d)位置9處的L被F替換,和e)位置11處的S被Y替換。28.項1或26的抗體,其中該抗體包括:a)包含CDR1,2和3序列SEQIDNO:10,11和12的VH區,和包含CDR1,2和3序列SEQIDNO:66,67和68的VL區,b)包含CDR1,2和3序列SEQIDNO:14,15和16的VH區,和包含CDR1,2和3序列SEQIDNO:70,71和72的VL區,c)包含CDR1,2和3序列SEQIDNO:18,19和20的VH區,和包含CDR1,2和3序列SEQIDNO:74,75和76的VL區,d)包含CDR1,2和3序列SEQIDNO:22,23和24的VH區,和包含CDR1,2和3序列SEQIDNO:78,79和80的VL區,e)包含CDR1,2和3序列SEQIDNO:26,27和28的VH區,和包含CDR1,2和3序列SEQIDNO:82,83和84的VL區,或f)所述任一抗體的變體,其中所述變體優選地在所述序列中具有最多1、2或3個胺基酸修飾,更優選地是胺基酸替換,例如保守胺基酸替換。29.項26的抗體,包含這樣的VH,其a)與選自SEQIDNO:9,13,17,21和25的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:9,13,17,21,21和25的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。30.項26的抗體,包含這樣的VL,其a)與選自SEQIDNO:65,69,73,77和81的VL區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:65,69,73,77和81的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。31.項26的抗體,包括:a)包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區,b)包含序列SEQIDNO:13的VH區和包含序列SEQIDNO:69的VL區,c)包含序列SEQIDNO:17的VH區和包含序列SEQIDNO:73的VL區,d)包含序列SEQIDNO:21的VH區和包含序列SEQIDNO:77的VL區,e)包含序列SEQIDNO:25的VH區和包含序列SEQIDNO:81的VL區,或f)所述任一抗體的變體,其中所述變體在所述序列中優選地具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。32.項1-24中任一項的抗體,其中所述抗體-與包括包含序列SEQIDNO:9的VH區及包含序列SEQIDNO:65的VL區的抗體競爭組織因子結合,並且-與包括包含序列SEQIDNO:37的VH區及包含序列SEQIDNO:93的VL區的抗體競爭組織因子結合。33.項32的抗體,其中所述抗體包括這樣的VHCDR3區,其具有a)如下所示的序列-SEQIDNo:8,-SEQIDNo:52,或者b)所述任一序列的變體,例如具有最多1、2或3個胺基酸修飾,優選替換例如保守替換的變體。34.項1或32的抗體,其中該抗體包括:a)包含CDR1,2和3序列SEQIDNO:6,7和8的VH區,和包含CDR1,2和3序列SEQIDNO:62,63和64的VL區,b)包含CDR1,2和3序列SEQIDNO:50,51和52的VH區,和包含CDR1,2和3序列SEQIDNO:106,107和108的VL區,或c)所述任一抗體的變體,其中所述變體優選地在所述序列中具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。35.項32的抗體,包括這樣的VH,其a)與選自SEQIDNO:5和49的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:5和49的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。36.項32的抗體,其包括這樣的VL,所述VLa)與選自SEQIDNO:61和105的VL區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:61和105的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。37.項32的抗體,其包括:a)包含序列SEQIDNO:5的VH區和包含序列SEQIDNO:61的VL區,b)包含序列SEQIDNO:49的VH區和包含序列SEQIDNO:105的VL區,或c)所述任一抗體的變體,其中所述變體在所述序列中優選地具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。38.項1-24中任一項的抗體,其中所述抗體-不與包括包含序列SEQIDNO:9的VH區及包含序列SEQIDNO:65的VL區的抗體競爭組織因子結合,並且-與包括包含序列SEQIDNO:37的VH區及包含序列SEQIDNO:93的VL區的抗體競爭組織因子結合。39.項38的抗體,其中所述抗體包括這樣的VHCDR3區,其具有a)如下所示的序列-SEQIDNo:32,-SEQIDNo:36,-SEQIDNo:40,-SEQIDNo:56,或者b)所述任一序列的變體,例如具有最多1、2或3個胺基酸修飾,優選替換,例如保守替換的變體。40.項1或38的抗體,其中該抗體包括:a)包含CDR1,2和3序列SEQIDNO:30,31和32的VH區,和包含CDR1,2和3序列SEQIDNO:86,87和88的VL區,b)包含CDR1,2和3序列SEQIDNO:34,35和36的VH區,和包含CDR1,2和3序列SEQIDNO:90,91和92的VL區,c)包含CDR1,2和3序列SEQIDNO:38,39和40的VH區,和包含CDR1,2和3序列SEQIDNO:94,95和96的VL區,d)包含CDR1,2和3序列SEQIDNO:54,55和56的VH區,和包含CDR1,2和3序列SEQIDNO:110,11和112的VL區,或e)所述任一抗體的變體,其中所述變體優選地在所述序列中具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。41.項38的抗體,其包含這樣的VH,所述VHa)與選自SEQIDNO:29,33,37和53的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:29,33,37和53的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。42.項38的抗體,其包含這樣的VL,所述VLa)與選自SEQIDNO:85,89,93和109的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:85,89,93和109的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。43.項38的抗體,其包括:a)包含序列SEQIDNO:29的VH區和包含序列SEQIDNO:85的VL區,b)包含序列SEQIDNO:33的VH區和包含序列SEQIDNO:89的VL區,c)包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區,d)包含序列SEQIDNO:53的VH區和包含序列SEQIDNO:109的VL區,或e)所述任一抗體的變體,其中所述變體在所述序列中優選地具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。44.前述項1-24中任一項的抗體,其中所述抗體與包括包含序列SEQIDNO:41的VH區和包含序列SEQIDNO:97的VL區的抗體競爭組織因子結合。45.項44的抗體,其中所述抗體包括這樣的VHCDR3區,其具有a)如下所示的序列-SEQIDNo:4,-SEQIDNo:44,-SEQIDNo:48,或者b)所述任一序列的變體,例如具有最多1、2或3個胺基酸修飾,優選替換例如保守替換的變體。46.項1或44的抗體,其中該抗體包括:a)包含CDR1,2和3序列SEQIDNO:2,3和4的VH區,和包含CDR1,2和3序列SEQIDNO:58,59和60的VL區,b)包含CDR1,2和3序列SEQIDNO:42,43和44的VH區,和包含CDR1,2和3序列SEQIDNO:98,99和100的VL區,c)包含CDR1,2和3序列SEQIDNO:46,47和48的VH區,和包含CDR1,2和3序列SEQIDNO:102,103和104的VL區,或者d)所述任一抗體的變體,其中所述變體優選地在所述序列中具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。47.項44的抗體,其包括這樣的VH,所述VHa)與選自SEQIDNO:1,41和45的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:1,41和45的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。48.項44的抗體,其包括這樣的VL,所述VLa)與選自SEQIDNO:57,97和101的VL區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:57,97和101的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。49.項44的抗體,包括:a)包含序列SEQIDNO:1的VH區和包含序列SEQIDNO:57的VL區,b)包含序列SEQIDNO:41的VH區和包含序列SEQIDNO:97的VL區,c)包含序列SEQIDNO:45的VH區和包含序列SEQIDNO:101的VL區,或者d)所述任一抗體的變體,其中所述變體在所述序列中優選地具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。50.項1-5中任一項的抗體,其中當用本文實施例22中所述的方法進行測定時,該抗體對組織因子的親和力小於5nM,例如小於3.5nM,例如小於2nM。51.項1-5中任一項的抗體,其中當用本文實施例22中所述的方法進行測定時,該抗體的kd大於10-3sec-1,和/或當用本文實施例22中所述的方法進行測定時,該抗體的ka大於5x104mol-1sec-1。52.項1-5中任一項的抗體,其中當用本文實施例22中所述的親和力方法進行測定時,該抗體的kd大於10-3sec-1,並且當用本文實施例22中所述的親合力方法進行測定時,該抗體的親合力小於5nM,例如小於1nM,例如小於0.2nM。53.項1-5或51或52中任一項的抗體,其中該抗體與健康組織不顯示結合,特別是與人腎小球不顯示結合,例如用實施例23中所述的測定方法測得;但是與胰腺腫瘤顯示結合,例如用本文實施例23中所述的測定方法測得。54.項1-5或51-53中任一項的抗體,其中當用本文實施例26中所述的方法進行測定時,該抗體可有效抑制已建立的BX-PC3腫瘤的生長。55.前述項中任一項的抗體,其中該抗體進一步具有一種或多種如下性質:抑制增殖、抑制腫瘤血管發生、誘導腫瘤細胞凋亡、與可變剪接的組織因子結合。56.項1-5中任一項的抗體,其與包含下列的抗體競爭組織因子結合:a)包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區,b)包含序列SEQIDNO:1的VH區和包含序列SEQIDNO:57的VL區,c)包含序列SEQIDNO:5的VH區和包含序列SEQIDNO:61的VL區,d)包含序列SEQIDNO:13的VH區和包含序列SEQIDNO:69的VL區,e)包含序列SEQIDNO:17的VH區和包含序列SEQIDNO:73的VL區,f)包含序列SEQIDNO:21的VH區和包含序列SEQIDNO:77的VL區,g)包含序列SEQIDNO:25的VH區和包含序列SEQIDNO:81的VL區,h)包含序列SEQIDNO:29的VH區和包含序列SEQIDNO:85的VL區,i)包含序列SEQIDNO:33的VH區和包含序列SEQIDNO:89的VL區,j)包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區,k)包含序列SEQIDNO:41的VH區和包含序列SEQIDNO:97的VL區,l)包含序列SEQIDNO:45的VH區和包含序列SEQIDNO:101的VL區,m)包含序列SEQIDNO:49的VH區和包含序列SEQIDNO:105的VL區,或者n)包含序列SEQIDNO:53的VH區和包含序列SEQIDNO:109的VL區。57.項1-5中任一項的抗體,其與具有下述的抗體結合組織因子上的相同表位:a)包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區,b)包含序列SEQIDNO:1的VH區和包含序列SEQIDNO:57的VL區,c)包含序列SEQIDNO:5的VH區和包含序列SEQIDNO:61的VL區,d)包含序列SEQIDNO:13的VH區和包含序列SEQIDNO:69的VL區,e)包含序列SEQIDNO:17的VH區和包含序列SEQIDNO:73的VL區,f)包含序列SEQIDNO:21的VH區和包含序列SEQIDNO:77的VL區,g)包含序列SEQIDNO:25的VH區和包含序列SEQIDNO:81的VL區,h)包含序列SEQIDNO:29的VH區和包含序列SEQIDNO:85的VL區,i)包含序列SEQIDNO:33的VH區和包含序列SEQIDNO:89的VL區,j)包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區,k)包含序列SEQIDNO:41的VH區和包含序列SEQIDNO:97的VL區,l)包含序列SEQIDNO:45的VH區和包含序列SEQIDNO:101的VL區,m)包含序列SEQIDNO:49的VH區和包含序列SEQIDNO:105的VL區,或者n)包含序列SEQIDNO:53的VH區和包含序列SEQIDNO:109的VL區。58.前述項中任一項的抗體,其中該抗體包括:-源自選自下組的人種系VH序列的重鏈可變區:IGHV1-18*01,IGHV3-23*01,IGHV3-30*01,IGHV3-33*01,IGHV3-33*03,IGHV1-69*02,IGHV1-69*04和IGHV5-51*01,和/或-源自選自下組的人種系Vκ序列的輕鏈可變區:IGKV3-20*01,IGKV1-13*02,IGKV3-11*01和IGKV1D-16*01。59.前述項中任一項的抗體,其中該抗體是全長抗體,優選IgG1抗體,特別是IgG1,κ抗體。60.前述項中任一項的抗體,其中該抗體偶聯於另一部分,例如細胞毒部分、放射性同位素或藥物。61.項1-3或15-49中任一項的抗體,其中該抗體是效應物功能缺陷抗體。62.項61的抗體,其中該效應物功能缺陷抗組織因子抗體是穩定化的人IgG4抗體,例如其中人IgG4重鏈恆定區409位精氨酸被替換為賴氨酸、蘇氨酸、甲硫氨酸或亮氨酸,優選賴氨酸,和/或其中鉸鏈區包括Cys-Pro-Pro-Cys序列的抗體。63.項1-3或15-49中任一項的抗體,其中該抗體是單價抗體。64.項63的抗體,其中所述單價抗體用如下方法構建,其包括:i)提供編碼所述單價抗體輕鏈的核酸構建體,所述構建體包含編碼選定的抗原特異性抗體之VL區的核苷酸序列和編碼Ig之恆定CL區的核苷酸序列,其中所述編碼選定的抗原特異性抗體之VL區的核苷酸序列和所述編碼Ig之CL區的核苷酸序列可操作地連接在一起,並且其中,在IgG1亞型的情況下,編碼所述CL區的核苷酸序列經過修飾,使得所述CL區不含有任何如下所述的胺基酸:在存在多複製人IgG的條件下或者當施用於動物或人類時,所述胺基酸能夠與其它包含與該CL區相同的胺基酸序列的肽形成二硫鍵或共價鍵;ii)提供編碼所述單價抗體重鏈的核酸構建體,所述構建體包含編碼選定的抗原特異性抗體之VH區的核苷酸序列和編碼人Ig之恆定CH區的核苷酸序列,其中編碼CH區的核苷酸序列經過修飾,使得相應於鉸鏈區的區域,以及如Ig亞型所要求的CH區的其它區域,如CH3區,不含有任何如下所述的胺基酸殘基:在存在多複製人IgG的條件下或者當施用於動物或人類時,所述胺基酸殘基參與同其它包含與人Ig之CH區相同的胺基酸序列的肽形成二硫鍵或者共價或穩定非共價的重鏈間鍵,其中該編碼選定的抗原特異性抗體之VH區的核苷酸序列和該編碼所述Ig之CH區的核苷酸序列可操作地連接在一起;iii)提供用於產生所述單價抗體的細胞表達系統;iv)通過在(iii)的細胞表達系統的細胞中共表達(i)和(ii)的核酸構建體產生所述單價抗體。65.項63的抗體,其中該單價抗體包括(i)項1-26的抗體的可變區或所述區的抗原結合部分,和(ii)免疫球蛋白CH區或其包括CH2和CH3區的片段,其中該CH區或其片段已被修飾,從而使相當於鉸鏈區的區域,以及,如果免疫球蛋白不是IgG4亞型,CH區的其它區域,例如CH3區,不含有任何在多複製人IgG存在下能夠與相同的CH區形成二硫鍵或者與相同的CH區形成其它共價或穩定非共價重鏈間鍵的胺基酸殘基。66.項63-65中任一項的抗體,其中該重鏈已被修飾,使得整個鉸鏈已被刪除。67.一種雙特異性分子,包括項1-62中任一項的抗體以及第二結合特異性,例如對人效應物細胞、人Fc受體或T細胞受體的結合特異性。68.一種表達載體,包括編碼選自SEQIDNO:1-SEQIDNO:112的一個或多個胺基酸序列的核苷酸序列。69.根據項68的表達載體,進一步包括編碼人抗體的輕鏈恆定區、重鏈恆定區、或輕鏈和重鏈二者的恆定區的核苷酸序列。70.一種重組真核或原核宿主細胞,其產生如項1-59或61-66中任一項所限定的抗體。71.一種藥物組合物,其包含如項1-54中任一項限定的抗體,或者如項67所限定的雙特異性分子,以及藥學可接受的載體。72.如項1-66中任一項限定的抗體或如項67中所限定的雙特異性分子,其用於作為藥物的用途。73.項72的抗體或雙特異性分子,其中該用途是用於治療癌症。74.項73的抗體或雙特異性分子,其中該癌症選自下組:中樞神經系統腫瘤、頭頸癌、肺癌、乳腺癌、食道癌、胃癌、肝和膽癌、胰腺癌、結腸直腸癌、膀胱癌、腎癌、前列腺癌、子宮內膜癌、卵巢癌、惡性黑素瘤、肉瘤、原始起源不明的腫瘤、骨髓癌、急性淋巴細胞白血病、慢性淋巴細胞白血病和非霍奇金淋巴瘤、皮膚癌、神經膠質瘤、腦的癌症、子宮的癌症和直腸的癌症。75.項72的抗體或雙特異性分子,其中該用途是用於治療胰腺癌。76.項72的抗體或雙特異性分子,其中該用途是用於治療結腸直腸癌。77.項72的抗體或雙特異性分子,其中該用途是用於治療卵巢癌。78.項72的抗體或雙特異性分子,其中該用途是用於治療乳腺癌。79.項72的抗體或雙特異性分子,其中該用途是用於治療前列腺癌。80.項72的抗體或雙特異性分子,其中該用途是用於治療膀胱癌。81.項72的抗體或雙特異性分子,其中該藥物用於與一種或多種其它治療劑如化療劑組合治療癌症。82.項1-66中任一項的抗體或項697的雙特異性分子在製造用於治療癌症的藥物中的用途。83.項82的用途,其包含項中74-81任一項的附加特徵。84.一種用於抑制表達組織因子的腫瘤細胞的生長和/或增殖的方法,包括向有需要的個體施用項1-66中任一項的抗體或如項67所限定的雙特異性分子。85.一種用於產生項1-59或61-66中任一項的抗體的方法,所述方法包括如下步驟:a)培養項70的宿主細胞,和b)從培養基中純化抗體。86.一種診斷用組合物,包含如項1-67中任一項限定的抗體。87.一種用於檢測樣品中組織因子之存在的方法,包括:-使樣品與項1-66任一項的抗體或項67的雙特異性分子在允許所述抗體或雙特異性分子同組織因子之間形成複合體的條件下接觸;和-分析是否形成了複合體。88.一種用於檢測樣品中組織因子之存在的試劑盒,包括-項1-66中任一項的抗體或項67的雙特異性分子;和-使用該試劑盒的說明。附圖簡述圖1:本發明抗體的序列比對。SEQIDNO在序列右邊的括號中給出。根據IMGT的CDR1、CDR2和CDR3被高亮顯示:斜體的序列代表CDR1區,加下劃線的序列代表CDR2區,粗體的序列代表CDR3區。圖2:IgG4序列(SEQIDNO:113-114)SEQIDNO:113:野生型人IgG4CH區的胺基酸序列。斜體的序列代表CH1區,高亮的序列代表鉸鏈區,規則序列代表CH2區,加下劃線的序列代表CH3區。SEQIDNO:114:人IgG4的無鉸鏈CH區的胺基酸序列。圖3:抗-TF人單抗與TF胞外域的結合。通過ELISA確定了抗TF人單抗在ELISA結合中對TF的胞外域的結合。圖4:抗-TF人單抗與膜結合的TF的結合。抗TF人單抗對MDA-MD-231上的膜結合TF的結合。結合通過FACS分析來確定。圖5:抑制FVIIa與TF結合。FVIIa對TF的結合的抑制。通過ELISA測定FVIIa結合及TF特異性人單抗對該結合的抑制。圖6:抑制FVIIa誘發的ERK磷酸化。FVIIIa誘導的ERK磷酸化的抑制,使用Western印記分析。圖7:抑制FVIIa誘發的IL-8釋放。對FVIIa誘導的IL-8釋放的抑制。MDA-MB-231在無血清培養基中培養,添加TF特異性抗體和FVIIa。通過ELISA來測量FVIIa誘導的IL-8。圖8:抑制FXa產生。FXa生成的抑制。測試TF特異性人單抗抑制FXa生成的能力,在測定系統中利用比色FXa特異性底物來測量TF/FVIIa作用下FX到FXa的轉化。圖9:抑制血液凝固。凝血抑制。用測定TF誘導的凝血時間的測定系統來測量TF-人單抗對凝血作用的抑制。圖10:TF-人單抗通過ADCC誘導Bx-PC3細胞溶解。TF-人單抗誘導的ADCC對Bx-PC3細胞的裂解。圖11:補體組分C3c和C4c沉積在靶細胞上。圖12:TF人單抗與腎小球結合的免疫組化分析。TF-人單抗對正常人腎的結合的免疫組織化學分析。圖13:TF-人單抗與胰腺腫瘤結合的免疫組化分析。TF-人單抗對胰腺腫瘤的結合的免疫組織化學分析。圖14:TF-人單抗在已建立的MDA-MB-231腫瘤異種移植物中的體內效力。TF-人單抗在SCID小鼠的乳腺脂肪墊中建立的MDA-MB-231腫瘤異種移植物中的體內效力。圖15:食蟹猴(cynomolgusmonkeys)中通過靜脈內注射TF特異性人單抗011在後確定的出血時間。抗體在第1(0mg/kg),8(1mg/kg),15(10mg/kg)和22(100mg/kg)天施用。出血時間(分鐘),在給藥後1、24和120小時測定功能性出血時間和失血。圖16:TF-人單抗在預防性的已建立的BX-PC3腫瘤異種移植物中的體內效力。在第0天用400μg/小鼠處理,雙因素重組測量方差分析,隨後進行Bonferroni事後檢驗:111對KLH:從第28天往後:P<0.05,從第32天往後:P<0.01(上圖)。在第8天用300μg/小鼠處理,然後每周用150μg/小鼠處理。雙因素重組測量方差分析,隨後進行Bonferroni事後檢驗:111對KLH:從第35天往後:P<0.05(下圖)。圖17:改組改組構建體和TF域。TFmm改組構建體,含TFmm域(上圖)。TFmm改組構建體,含TFhs域(下圖)。圖18:抗-TF抗體與TF改組改組構建體的結合。抗TF人單抗對HEK293F細胞上表達的TF改組構建體的結合。所示為抗TF人單抗HEK293F細胞上表達的不同TF改組構建體的結合情況,通過FACS測定。每個組顯示來自一個主要克隆的數據。x軸示出了不同的構建體,模擬,TFhs,TFmm,TFhsmm,TFmmhs,TFhs1-41mm,TFhs42-84mm,TFhs85-122mm,TFhs123-137mm,TFhs138-159mm,TFhs160-184mm,TFhs185-225mm,TFhs226-250mm,TFmm1-47hs,TFmm48-90hs,TFmm91-122hs,TFmm123-137hs,TFmm138-159hs,TFmm160-184hs,TFmm185-225hs,TFmm226-250hs。圖19:人單抗-TFFab片段與TF胞外域的結合,ELISA。人單抗-TFFab片段對TF的胞外域的結合,通過ELISA測定。圖20:人單抗-TFFab片段與TF胞外域的結合,FACS。人單抗-TFFab片段對細胞TF的結合,通過對BxPC3細胞的FACS測定。圖21:依賴於所表達的TF分子的數目的抗-TF人單抗的結合譜。抗TF人Mab的結合曲線依賴於表達的TF分子數。通過FACS測定了抗TF人單抗對表達不同水平的TF的細胞系的結合。發明詳細說明定義術語「組織因子」、「TF」、「CD142」、「組織因子抗原」、「TF抗原」和「CD142抗原」在這裡可互換使用,並且除非明確指出,包括由細胞天然表達的或在用組織因子基因轉染的細胞上表達的人組織因子的任何變體、同種型和物種同源物。術語「免疫球蛋白」是指一類結構上相關的糖蛋白,由兩對多肽鏈構成,一對輕(L)低分子量鏈和一對重(H)鏈,所有四條鏈可以通過二硫鍵內部連接。免疫球蛋白的結構已經得到充分表徵。見例如FundamentalImmunology第7章(Paul,W.,ed.,2nded.RavenPress,N.Y.(1989))。簡而言之,每條重鏈典型地由重鏈可變區(這裡縮寫為VH或VH)和重鏈恆定區構成。重鏈恆定區典型地由三個結構域構成:CH1,CH2和CH3。每條輕鏈典型地由輕鏈可變區(這裡縮寫為VL或VL)和輕鏈恆定區構成。輕鏈恆定區典型地由一個結構域構成:CL。VH和VL區可以進一步再分成超可變性區(或超變區,其在結構限定環的序列和/或形式方面可有極高的可變性),也稱作補體決定區(CDRs),它們之間間散布著更保守的、稱作框架區(FR)的區域。每個VH和VL典型地由三個CDR和4個FR構成,從氨基端向羧基端按照如下的次序排列:FR1,CDR1,FR2,CDR2,FR3,CDR3,FR4(另見ChothiaandLeskJ.Mol.Biol.196,901-917(1987))。典型地,該區域中胺基酸殘基的編號是根據IMGT.,SequencesofProteinsofImmunologicalInterest,第五版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD.(1991)(「與如Kabat中相同或者根據Kabat的編號的可變區殘基」等短語,在本文中對於重鏈可變區或輕鏈可變區而言,是參考這種編號系統的)。使用這種編號系統,肽的實際線性胺基酸序列可能含有更少或更多的胺基酸,相應於可變區FR或CDR的縮短或插入。例如,重鏈可變區可能在VHCDR2殘基52後面包含一個單胺基酸插入(根據Kabat,殘基52a),和在重鏈FR殘基82後面包含多個插入殘基(例如根據Kabat,殘基82a,82b和82c等)。給定抗體的殘基的Kabat編號可以通過在該抗體序列的同源區與「標準」Kabat編號序列進行比對加以確定。在本發明的上下文中,術語「抗體」(Ab)是指免疫球蛋白分子,免疫球蛋白分子的片段,或其衍生物,其在典型的生理條件下具有與抗原特異性結合的能力,具有相當時間的半壽期,例如至少大約30分鐘,至少大約45分鐘,至少大約1小時,至少大約2小時,至少大約4小時,至少大約8小時,至少大約12小時,大約24小時或者更長,大約48小時或者更長,大約3、4、5、6、7或更多天等,或者任何其它相關的功能上限定的期間(例如足夠誘發、促進、提高和/或調節與抗體與抗原的結合關聯的生理應答的時間,和/或足以供抗體募集效應物活性的時間)。免疫球蛋白分子的重鏈和輕鏈的可變區含有與抗原互作的結合域。抗體(Abs)的恆定區可以介導免疫球蛋白與宿主組織或因子的結合,包括免疫系統的各種細胞(例如效應物細胞)和補體系統的組分,例如C1q,補體活化經典途徑中的第一組分。抗-TF抗體還可以是雙特異性抗體、雙抗體(diabody)或類似分子(雙抗體的描述見例如PNASUSA90(14),6444-8(1993))。確實,本發明提供的雙特異性抗體、雙抗體等除了結合組織因子的一部分或組織因子FVIIa複合體之外,還可以結合任何合適的靶標。如前所述,除非在上下文中另外指出或明顯有矛盾,在這裡,術語「抗體」包括抗體保持與抗原特異性結合能力的片段。已經顯示,抗體的抗原結合功能可以由全長抗體的片段執行。涵蓋在術語「抗體」中的結合片段的實例包括(i)Fab』或Fab片段,一種由VL,VH,CL和CH1域構成的單價片段,或者如WO2007059782(Genmab)中描述的單價抗體;(ii)F(ab')2片段、包含兩個通過在鉸鏈區中的二硫橋連接的Fab片段的雙價片段;(iii)基本上由VH和CH1域組成的Fd片段;(iv)基本上由VL和VH域組成的Fv片段;(v)dAb片段(Wardetal.,Nature341,544-546(1989)),其基本上由VH域構成,也稱作結構域抗體(Holtetal;TrendsBiotechnol.2003Nov;21(11):484-90);(vi)駱駝抗體(camelid)或納米抗體(nanobodies)(Revetsetal;ExpertOpinBiolTher.2005Jan;5(1):111-24),和(vii)分離的補體決定區(CDR)。而且,儘管Fv片段的兩個域,VL和VH,是由不同的基因編碼的,但是它們可以通過合成的接頭用重組方法連接起來,該合成的接頭能夠使它們作為單個蛋白鏈製造出來,其中VL和VH區配對形成單價分子(稱作單鏈抗體或單鏈Fv(scFv),見例如Birdetal.,Science242,423-426(1988)和Hustonetal.,PNASUSA85,5879-5883(1988))。除非另外指出或上下文中明確指明,這些單鏈抗體包含在術語「抗體」的範圍內。儘管這些片段一般包含在抗體的意思之內,它們總體上並且各自獨立地構成本發明的獨特特徵,顯示不同的生物學性質和效用。在本發明的上下文中,進一步討論了這些和其它有用的抗體片段。還應當理解,除非另外指出,否則術語「抗體」還包括用任何已知的技術提供多克隆抗體、單克隆抗體(單抗)、抗體樣多肽,例如嵌合抗體和人源化抗體,以及抗體的保留與抗原特異性結合能力的片段(抗原結合片段),所述已知技術例如酶法切割(enzymaticcleavage)、肽合成和重組技術。所產生的抗體可以具有任何同種型。「抗-TF抗體」是如上所述的抗體,其與抗原組織因子特異結合。如這裡所使用的,術語「人抗體」意圖包括具有來自人種系免疫球蛋白序列的可變區和恆定區的抗體。本發明的人抗體可以包括不是由人種系免疫球蛋白序列編碼的胺基酸殘基(例如通過體外隨機或定點誘變,或在基因改組期間或通過體內體細胞突變引入的突變)。然而,如這裡所使用的,術語「人抗體」不意圖包括如下的抗體,其中來自另一種哺乳動物物種(,例如小鼠)種系的CDR序列被嫁接到人框架序列上。在一個優選實施方案中,本發明的抗體是分離的。如這裡所使用的,「分離的抗體」意圖指示如下的抗體,其基本上不含其它具有不同抗原特異性的抗體(例如,特異結合組織因子的分離抗體基本上不含特異結合除組織因子之外的抗原的抗體)。然而,特異結合人組織因子的表位、同種型或變體的分離抗體可以同其它相關抗原,例如來自其它物種的抗原(例如組織因子種間同源物)具有交叉反應性。而且,分離的抗體可以基本上不含其它細胞材料和/或化學劑。在本發明的一個實施方案中,兩種或多種具有不同抗原結合特異性的「分離」單克隆抗體被組合在良好限定的組合物中。當在本文上下文中使用兩種或多種抗體時,術語「與…競爭」或「與…交叉競爭」是指,兩個或多個抗體競爭結合TF,例如在本文實施例6中所述的測定中競爭結合TF。對於一些抗體對,實施例6中測定方法中的競爭只有在將一種抗體包被在平板上,而用另一種進行競爭時才能觀察到,但反之則不行。當在本文中使用時,術語「與…競爭」還意圖涵蓋這些組合抗體。如這裡所使用的,術語「單克隆抗體」或「單克隆抗體組合物」是指具有單一分子組成的抗體分子的製備物。單克隆抗體組合物顯示對特定表位的單一的結合特異性和親和力。因此,術語「人單克隆抗體」是指顯示單一結合特異性的抗體,其具有來自人種系免疫球蛋白序列的可變區和恆定區。人單克隆抗體可以通過雜交瘤產生,雜交瘤包含與永生化細胞融合的、從轉基因或轉染色體非人類動物(例如轉基因小鼠)獲得的B細胞,該動物具有包含人重鏈轉基因和輕鏈轉基因的基因組。如這裡所使用的,在抗體與預定抗原的結合的語境中,術語「結合」典型地是其以相當於KD大約10-7M或者更小,例如大約10-8M或者更小,例如大約10-9M或者更小,大約10-10M或者更小,或者大約10-11M或者更小的親和力結合(例如當在BIAcore3000設備中用抗原作為配體、以抗體作為分析物通過表面等離子體共振(SPR)技術進行測定時),並且與預定抗原的結合親和力與除預定抗體或密切相關的抗原之外的非特異性抗原(例如BSA或酪蛋白)的結合親和力相比,與預定抗原的KD比與非特異抗原的KD低至少10倍,例如至少低100倍,例如至少低1,000倍,例如至少低10,000倍,例如至少低100,000倍。親和力低出的量取決於抗體的KD,因此當抗體的KD非常低時(即抗體高度特異),對抗原的親和力低於對非特異性抗原的親和力的量可以是至少10,000倍。如這裡所使用的,術語「kd」(sec-1)是指特定抗體-抗原互作的解離速率常數。所述值也稱作koff值。如這裡所使用的,術語「ka」(M-1xsec-1)是指特定抗體-抗原互作的結合速率常數。如這裡所使用的,術語「KD」(M)是指特定抗體-抗原互作的解離平衡常數。如這裡所使用的,術語「KA」(M-1)是指特定抗體-抗原互作的結合平衡常數,並且通過ka除以kd獲得。本發明還提供了包括實施例抗體的VL區、VH區、或一個或多個CDR的功能變體的抗體。在抗-TF抗體的語境中使用的VL、VH或CDR的功能變體仍然允許該抗體保留本發明抗體的親和力/親合力和/或特異性/選擇性的至少相當部分(至少大約50%,60%,70%,80%,90%,95%或更多),並且在一些情況下,這種抗-TF抗體可以有比親本抗體更大的親和力、選擇性和/或特異性。這些功能變體典型地保留與親本抗體的顯著序列同一性。兩條序列之間的百分比同一性是序列所分享的相同位置的數目的函數(即,%同源性=相同位置數/總位置數x100),同時考慮缺口的數目和每個缺口的長度,缺口的引入是為了在兩條序列間進行最佳比對的需要。兩條序列之間的序列比對和百分比同一性的確定可以用數學算法實現,如下面非限制性實例中所述。兩條核苷酸序列之間的百分比同一性可以用GCG軟體包(可在http://www.gcg.com獲得)中的GAP程序加以確定,使用NWSgapdna.CMP矩陣,缺口權重為40、50、60、70或80,和長度權重1、2、3、4、5或6。兩條核苷酸或胺基酸序列之間的百分比同一性還可以用E.MeyersandW.Miller,Comput.Appl.Biosci4,11-17(1988))的算法加以確定,其已經被引入到ALIGN程序(2.0版)中,使用PAM120加權殘基表,缺口長度罰分為12,缺口罰分為4。此外,兩條胺基酸序列之間的百分比同一性可以用NeedlemanandWunsch,J.Mol.Biol.48,444-453(1970))算法加以確定,其被引入到GCG軟體包(可以從http://www.gcg.com獲得)的GAP程序中,使用Blossum62矩陣或PAM250矩陣,缺口權重為16、14、12、10、8、6、或4,長度權重為1、2、3、4、5、或6。CDR變體的序列可以通過主要是保守的替換而與親本抗體序列的CDR序列不同,例如變體的替換中有至少大約35%、大約50%或更多、大約60%或更多、大約70%或更多、大約75%或更多、大約80%或更多、大約85%或更多、大約90%或更多、大約95%或更多(例如大約65-99%,例如大約96%,97%或98%)是保守的胺基酸殘基替換。CDR變體的序列可以通過主要是保守的替換而與親本抗體序列的CDR序列不同,例如變體中的至少10個替換,例如至少9、8、7、6、5、4、3、2或1個替換是保守的胺基酸殘基替換。在本發明的上下文中,保守替換可以用下列三個表格中的一個或多個中反映的胺基酸分類中的替換加以定義。用於保守替換的胺基酸殘基分類其他保守胺基酸殘基替換分類1AST2DE3NQ4RK5ILM6FYW胺基酸殘基的其他物理和功能分類含醇基殘基S和T脂肪族殘基I,L,V,和M環烯烴相關殘基F,H,W,和Y疏水性殘基A,C,F,G,H,I,L,M,R,T,V,W,和Y帶負電殘基D和E極性殘基C,D,E,H,K,N,Q,R,S,和T帶正電殘基H,K,和R小殘基A,C,D,G,N,P,S,T,和V極小殘基A,G,和S參與轉角形成的殘基A,C,D,E,G,H,K,N,Q,R,S,P,和T柔性殘基Q,T,K,S,G,P,D,E,和R更多的保守替換分組包括:纈氨酸-亮氨酸-異亮氨酸、苯丙氨酸-酪氨酸、賴氨酸-精氨酸、丙氨酸-纈氨酸、和天冬氨酸-穀氨酸。也可以用例如下列文獻中介紹的原則制定其他胺基酸分組:Creighton(1984)Proteins:StructureandMolecularProperties(2dEd.1993),W.H.FreemanandCompany。在本發明的一個實施方案中,與實施例的抗體的CDR相比,變體CDR中也基本上保持在親水(hydropathic)/親水(hydrophilic)性質和殘基重量/大小方面的保守性(例如,序列的重量分類(weightclass)、親水得分或兩者被保留至少大約50%、至少大約60%、至少大約70%、至少大約75%、至少大約80%、至少大約85%、至少大約90%、至少大約95%、或者更多(例如大約65-99%))。例如,保守的殘基替換還可以是,或者作為備選可以是是,基於強或弱或者基於重量的保守基團(strongorweakbasedweightbasedconservationgroups)的替換,這是現有技術已知的。保留相似的殘基還可以或者作為備選可以通過使用BLAST程序確定的相似得分進行測量(例如可以通過NCBI訪問的BLAST2.2.8,使用標準設定BLOSUM62,開放缺口=11和延長缺口=1)。合適的變體與親本肽相比,顯示至少大約45%,例如至少大約55%,至少大約65%,至少大約75%,至少大約85%,至少大約90%,至少大約95%,或更多(例如大約70-99%)的相似性。如這裡所使用的,「同種型」是指由重鏈恆定區基因編碼的免疫球蛋白家族(例如IgG1,IgG2,IgG3,IgG4,IgD,IgA,IgE,或IgM)。術語「表位」是指能夠特異結合抗體的蛋白決定簇。表位通常由分子的表面基團構成,例如胺基酸或糖側鏈,並且通常具有特定的三維結構特徵,以及特定的帶電特徵。構象表位和非構象表位的區別在於,在變性劑存在下,與前者的結合消失,而與後者的結合不消失。表位可以包括直接參與結合的胺基酸殘基(也稱作表位的免疫優勢組分(immunodominantcomponent)),和其它不直接參與結合的胺基酸殘基,例如可以被特異抗原結合肽有效阻斷的胺基酸殘基(換言之,這些胺基酸殘基位於特異抗原結合肽的足跡(footprint)內)。如這裡所使用的,如果抗體是從使用人免疫球蛋白序列的系統獲得的(例如通過免疫攜帶有人免疫球蛋白基因的轉基因小鼠或者通過篩選人免疫球蛋白基因庫),並且其中所選人抗體V域序列在胺基酸V域序列上與由該種系免疫球蛋白基因編碼的胺基酸序列具有至少90%,例如至少95%,例如至少96%,例如至少97%,例如至少98%,或者例如至少99%的相似性,則稱該人抗體「源自」特定的種系序列,。典型地,除了重鏈CDR3,來自特定人種系序列的人抗體與由該種系免疫球蛋白基因編碼的胺基酸序列相比,顯示不超過20個胺基酸的差異,例如不超過10個胺基酸的差異,例如不超過9、8、7、6或5個,例如不超過4、3、2或1個胺基酸的差異。如這裡所使用的,術語「抑制生長」(例如針對細胞,如腫瘤細胞)意圖包括在與抗-TF抗體接觸時,和不與抗-TF抗體接觸的相同的細胞的生長相比,細胞生長的任何可測量的降低,例如,抑制細胞培養物生長至少大約10%,20%,30%,40%,50%,60%,70%,80%,90%,99%,或100%。這種細胞生長降低可以通過多種機制發生,例如效應物細胞吞噬、ADCC、CDC和/或細胞凋亡。術語「雙特異性分子」意圖包括任何具有兩種不同結合特異性的試劑,例如蛋白質、肽、或蛋白或肽複合體。例如,分子可以結合(a)細胞表面抗原和(b)效應物表面上的Fc受體或與(a)細胞表面抗原和(b)效應物表面上的Fc受體互作。術語「雙特異性抗體」意圖包括任何抗-TF抗體,其是雙特異性分子。術語「雙特異性抗體」還包括雙抗體。雙抗體是二價、雙特異性的抗體,其中VH和VL域表達在單個多肽鏈上,但是用一個短到不能令相同鏈上的兩個結構域配對的接頭連接,藉此迫使這些域與另一條鏈上的互補域配對,並產生兩個抗原結合位點(見例如Holliger,P.etal.,PNASUSA90,6444-6448(1993),Poljak,R.J.etal.,Structure2,1121-1123(1994))。「效應物功能有缺陷的抗體」或「效應物功能缺陷抗體」是指如下的抗體,其激活一種或多種效應物機制(例如補體活化或Fc受體結合)的能力顯著降低或者缺無。因此,效應物功能缺陷抗體的介導抗體依賴的細胞介導的細胞毒作用(ADCC)和/或補體依賴的細胞毒作用(CDC)的能力顯著降低或缺無。這種抗體的一個實例是IgG4。術語「單價抗體」在本發明的上下文中意思是抗體分子能夠結合單個抗原分子,因此無抗原交聯能力。術語「穩定化的IgG4抗體」是指被修飾減少了半分子交換的IgG4抗體(見vanderNeutKolfschotenMetal.(2007)Science14;317(5844)和其中的參考文獻,另見Labrijnetal.(2009)NatureBiotechnology,27,767-771)。如這裡所使用的,術語「效應物細胞」是指參與免疫應答的效應階段(與免疫應答的識別階段和活化階段相對)的免疫細胞。免疫細胞實例包括骨髓或淋巴來源的細胞,例如淋巴細胞(例如B細胞和T細胞,包括溶細胞性T細胞(cytolyticTcell)(CTL)、殺傷細胞、天然殺傷細胞、巨噬細胞、單核細胞、嗜酸性粒細胞、多形核細胞,例如中性粒細胞、粒細胞、肥大細胞和嗜鹼性細胞。一些效應物細胞表達特定的Fc受體,並執行特定的免疫功能。在一些實施方案中,效應物細胞能夠誘導抗體依賴的細胞細胞毒性(ADCC),例如天然殺傷細胞,能夠誘導ADCC。例如,表達FcR的單核細胞和巨噬細胞參與特異性殺傷靶細胞並向免疫系統的其它組分呈遞抗原,或者與呈遞抗原的細胞結合。在一個實施方案中,效應物細胞可以吞噬靶抗原或者靶細胞。特定的FcR在效應物細胞上的表達可以被體液因子,例如細胞因子,所調節。例如,已經發現,FcγRI的表達被幹擾素γ(IFN-γ)和/或G-CSF上調。這種被提高的表達可增加攜帶FcγRI的細胞對靶標的細胞毒性。效應物細胞能夠吞噬或裂解靶抗原或靶細胞。如這裡所使用的,術語「載體」意圖指示能夠轉運另一個與之連接的核酸的核酸分子。一種類型的載體是「質粒」,其是指環形雙鏈DNA環,其中可以連接額外的DNA節段。另一種類型的載體是病毒載體,其中額外的DNA節段可以被連接到病毒基因組內。某些載體能夠在引入它們的宿主細胞內自主複製(例如具有細菌複製起點的細菌載體和附加體型哺乳動物載體)。其它的載體(例如非附加體型哺乳動物載體)在引入到宿主細胞中後可以整合到宿主細胞的基因組內,藉此與宿主基因組一起複製。而且,某些載體能夠指導與之可操作連接的基因的表達。這些載體在本文中稱作「重組表達載體」(或者簡稱為「表達載體」)。一般地,重組DNA技術中有用的表達載體經常是質粒的形式。在本說明書中,「質粒」和「載體」可以互換使用,因為質粒是最經常使用的載體形式。然而,本發明意圖包括這些其它形式的表達載體,例如病毒載體(複製缺陷型逆轉錄病毒、腺病毒、腺伴隨病毒),它們發揮等價的功能。如這裡所使用的,術語「重組宿主細胞」(或簡稱為「宿主細胞」)意圖指示其中引入了表達載體的細胞。應當理解,這些術語意圖不僅指示特定的對象細胞,還指示這些細胞的後代。因為可能由於突變或環境影響在後繼世代中發生某些修飾,所以這些後代可能實際上不會與親本細胞完全相同,但仍然包含在這裡所用的術語「宿主細胞」的範圍內。重組宿主細胞包括例如轉染瘤(transfectomas),例如CHO細胞、HEK293細胞、NS/0細胞和淋巴細胞。如這裡所使用的,術語「轉染瘤」包括表達抗體的重組真核宿主細胞,例如CHO細胞、NS/0細胞、HEK293細胞、植物細胞或真菌,包括酵母細胞。術語「轉基因非人類動物」是指如下的非人類動物,其基因組包括一個或多個人重鏈和/或輕鏈轉基因或轉染色體(整合或者不整合到動物的天然基因組DNA中),並且能夠表達完全的人抗體。例如,轉基因小鼠可具有人輕鏈轉基因,以及人重鏈轉基因或人重鏈轉染色體,從而當用TF抗原和/或表達TF的細胞進行免疫時,小鼠可以產生人抗-TF抗體。人重鏈轉基因可以整合到小鼠的染色體DNA中,如同在轉基因小鼠(如人單抗小鼠例如HCo7或HCo12小鼠)中那樣,或者人重鏈轉基因可以保持在染色體外部,如在WO02/43478中記載的轉染色體KM小鼠中那樣。這些轉基因和轉染色體小鼠(這裡統稱作「轉基因小鼠」)能夠通過V-D-J重組和同種型轉換針對給定抗原產生多種同種型(例如IgG,IgA,IgM,IgD和/或IgE)的人單克隆抗體。還可以通過導入編碼這樣的特異抗體的基因利用轉基因非人動物於產生針對特定抗原的抗體,例如通過將基因與在動物乳汁中表達的基因可操作連接。「治療」是指施加有效量的本發明治療活性化合物,用於緩解、減輕、遏制或根除(治癒)病症或疾病狀態。「有效量」是指在必要的劑量和時程下,可有效獲得期望治療結果的量。治療有效量的抗-TF抗體可以隨著多種因素而改變,例如個體的疾病狀態、年齡、性別和體重,以及抗-TF抗體在個體內引發期望的應答的能力。治療有效量還是這樣的量,其中抗體或抗體部分的在治療上益處超過其任何毒性或有害作用。「抗-獨特型(anti-idiotypic)」(Id)抗體是指如下的抗體,其識別一般與抗體的抗原結合位點相關聯的獨特決定簇。發明進一步的方面和實施方案如上所述,在第一個方面中,本發明涉及一種人抗體,其與人組織因子結合。在一個實施方案中,當用實施例13中所述的測定方法進行測定時,抗體與組織因子胞外域結合的表觀親和力(EC50)為3nM或更低,例如0.50nM或更低,例如0.35nM或更低,例如0.20nM或更低,例如0.1nM或更低。在另一個實施方案中,抗體與表達組織因子的哺乳動物細胞(例如被編碼組織因子的構建體轉染的A431細胞)結合,優選地,當用實施例14中所述的測定方法進行測定時,其表觀親和力(EC50)優選地為10nM或更低,例如8nM或更低,例如5nM或更低,例如2nM或更低,例如1nM或更低,例如0.5nM或更低,例如0.3nM或更低。在另一個實施方案中,所述抗體能夠在A431細胞內誘發抗體依賴的細胞毒性,優選地,當用實施例20中所述的測定方法進行測定時,EC50值為2nM或更低,例如1nM或更低,例如0.7nM或更低,或者0.3nM或更低,例如0.20nM或更低,或者0.1nM或更低,或者0.05nM或更低。在另一個實施方案中,當用實施例24中所述的方法進行測定時,該抗體可有效抑制已建立的MDA-MB-231腫瘤的生長,和/或當用實施例26中所述的方法進行測定時,可抑制已建立的BxPC3腫瘤的生長。在另一個實施方案中,所述抗體可抑制組織因子誘導的凝血,優選地,當用實施例19中所述的測定方法進行測定時,中值抑制濃度小於10nM,例如小於5nM,例如小於2nM,例如小於1nM。在另一個實施方案中,抗體不抑制凝血。在一個實施方案中,與天然水平相比,凝血被抑制最多30%,例如25%、例如20%、例如15%、例如10%或例如5%。在進一步的實施方案中,抗體可抑制FVIIa與組織因子結合,優選地,當用實施例15中所述的測定方法進行測定時,其最大抑制值為大於80%,例如大於90%的抑制。在進一步的實施方案中,抗體可抑制FVIIa誘導的MDA-MB-231細胞IL-8釋放,優選地,當用實施例17中所述的測定方法進行測定時,最大抑制值為大於40%,例如大於50%,例如大於60%的抑制。在進一步的實施方案中,抗體可抑制TF/FVIIa複合體將FX轉變成Fxa,優選地,當用實施例18中所述的測定方法進行測定時,抑制小於50%,例如小於40%,例如在1-30%的範圍內。在進一步的實施方案中,抗體與如下的抗體競爭結合組織因子,該抗體包括包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區。在進一步的實施方案中,本發明抗體與組織因子的結合不涉及如下的三個殘基的全部:組織因子45位的W,46位的K或94位的Y。在更進一步的實施方案中,該結合不涉及下列任一殘基:45位的W,46位的K或94位的Y(這些編碼參考成熟TF,在Genbank條目NP_001984中等價的位置是77,78和126)。在本發明抗體的另一個實施方案中,抗體與如下的抗體競爭結合組織因子,該抗體包括包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區。在進一步的實施方案中,抗體可抑制FVIIa誘導的ERK磷酸化,優選地,當用實施例16中所述的測定方法進行測定時,其中值抑制濃度小於10nM,例如小於5nM,例如小於2nM。在進一步的實施方案中,抗體可抑制ERK磷酸化,優選地,當用實施例16中所述的測定方法進行測定時,其中值抑制濃度小於10nM,例如小於5nM,例如小於2nM,並且當用實施例17中所述的測定方法進行測定時,對FVII誘導的IL-8釋放的抑制最大不超過10%。在進一步的實施方案中,抗體能夠誘導C3c和C4c沉積,優選地,其中按照實施例21中所述地進行測定,該抗體能夠誘導C3c和C4c沉積。在進一步的實施方案中,當用ELISA進行測量時,抗體Fab片段與如實施例28中所述的組織因子胞外域結合的EC50值低於0.1μg/mL,例如低於0.05μg/mL,例如低於0.04μg/mL。在進一步的實施方案中,當用ELISA進行測量時,抗體Fab片段與如實施例28中所述的組織因子胞外域結合的EC50值高於1.0μg/mL。在進一步的實施方案中,抗體Fab片段與如實施例28中所述的組織因子胞外域結合的EC50值低於10μg/mL,例如低於1μg/mL,例如低於0.5μg/mL,或者低於0.2μg/mL。在進一步的實施方案中,抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與人TF的結合,與改組構建體42-84mm的結合降低,該改組構建體包含除胺基酸42-84之外的人TF序列,而胺基酸42-84被小鼠序列代替,如實施例27所述。在進一步的實施方案中,抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與相比於與人TF的結合,與改組構建體85-122mm的結合降低,該改組構建體包含除胺基酸85-122之外的人TF序列,而胺基酸85-122被小鼠序列代替,如實施例27所述。在進一步的實施方案中,抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與相比於與人TF的結合,與改組構建體123-137mm的結合降低,該改組構建體包含除胺基酸123-137之外的人TF序列,而胺基酸123-137被小鼠序列代替,如實施例27所述。在進一步的實施方案中,抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與相比於與人TF的結合,與改組構建體185-225mm的結合降低,該改組構建體包含除胺基酸185-225之外的人TF序列,而胺基酸185-225被小鼠序列代替,如實施例27所述。在進一步的實施方案中,抗體與人組織因子結合但不與鼠組織因子結合,並且相比於與相比於與人TF的結合,與改組構建體226-250mm的結合降低,該改組構建體包含除胺基酸226-250外的人TF序列,而胺基酸226-250被小鼠序列代替,如實施例27所述。在進一步的實施方案中,相比於與人TF的結合,抗體顯示與超過1種改組構建體的結合降低。在一個實施方案中,抗體顯示與構建體42-84mm和85-122mm的結合降低。在一個實施方案中,抗體顯示與構建體123-137mm和185-225mm的結合降低。在一個實施方案中,抗體顯示與構建體123-137mm和185-225mm以及構建體226-250mm的結合降低。在進一步的實施方案中,抗體能夠誘導C3c和C4c沉積,優選地,當按照實施例21中所述地進行測定時,該抗體能夠誘導C3c和C4c沉積。在本發明抗體的一個實施方案中,所述抗體-與包括包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區的抗體競爭結合組織因子,並且-不與包括包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區的抗體競爭結合組織因子。在進一步的實施方案中,抗體包括VHCDR3區,其具有a)如下所示的序列-SEQIDNo:12,-SEQIDNo:16,-SEQIDNo:20,-SEQIDNo:24,-SEQIDNo:28,或者b)所述任一序列的變體,例如具有最多1、2、3、4、或5個胺基酸修飾,優選替換,例如保守替換,的變體。在進一步的實施方案中,抗體包括具有如SEQIDNO:12所示的序列或其變體的VHCDR3區,其中該變體包括在位置2、3、6、9和11中一個或多個位置處的修飾,優選地,其中該修飾是替換,更優選地,其中該替換從下列組中選出:a)位置2處的R被K替換,b)位置3處的S被A或T替換,c)位置6處的G被T替換,d)位置9處的L被F替換,和e)位置11處的S被Y替換。在另一個實施方案中,抗體包括:a)包含CDR1、2和3序列SEQIDNO:10、11和12的VH區,和包含CDR1,2和3序列SEQIDNO:66、67和68的VL區,b)包含CDR1,2和3序列SEQIDNO:14,15和16的VH區,和包含CDR1,2和3序列SEQIDNO:70,71和72的VL區,c)包含CDR1,2和3序列SEQIDNO:18,19和20的VH區,和包含CDR1,2和3序列SEQIDNO:74,75和76的VL區,d)包含CDR1,2和3序列SEQIDNO:22,23和24的VH區,和包含CDR1,2和3序列SEQIDNO:78,79和80的VL區,e)包含CDR1,2和3序列SEQIDNO:26,27和28的VH區,和包含CDR1,2和3序列SEQIDNO:82,83和84的VL區,或f)所述任一抗體的變體,其中所述變體優選地在所述序列中具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包含VH,其a)與選自SEQIDNO:9,13,17,21和25的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:9,13,17,21,21和25的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包含VL,其a)與選自SEQIDNO:65,69,73,77和81的VL區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:65,69,73,77和81的VL區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括:a)包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區,b)包含序列SEQIDNO:13的VH區和包含序列SEQIDNO:69的VL區,c)包含序列SEQIDNO:17的VH區和包含序列SEQIDNO:73的VL區,d)包含序列SEQIDNO:21的VH區和包含序列SEQIDNO:77的VL區,e)包含序列SEQIDNO:25的VH區和包含序列SEQIDNO:81的VL區,或f)所述任一抗體的變體,其中所述變體在所述序列中優選地具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體-與包括包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區的抗體競爭結合組織因子,並且-與包括包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區的抗體競爭結合組織因子。在進一步的實施方案中,抗體包括VHCDR3區,其具有a)如下所示的序列-SEQIDNo:8,-SEQIDNo:52,或者b)所述任一序列的變體,例如具有最多1、2或3個胺基酸修飾,優選替換,例如保守替換,的變體。在進一步的實施方案中,抗體包括:a)包含CDR1、2和3序列SEQIDNO:6、7和8的VH區,和包含CDR1、2和3序列SEQIDNO:62、63和64的VL區,b)包含CDR1、2和3序列SEQIDNO:50、51和52的的VH區,和包含CDR1、2和3序列SEQIDNO:106、107和108的VL區,或c)所述任一抗體的變體,其中所述變體優選地在所述序列中具有1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括VH,其a)與選自SEQIDNO:5和49的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:5和49的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括VL,其a)與選自SEQIDNO:61和105的VL區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:61和105的VL區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括:a)包含序列SEQIDNO:5的VH區和包含序列SEQIDNO:61的VL區,b)包含序列SEQIDNO:49的VH區和包含序列SEQIDNO:105的VL區,或c)所述任一抗體的變體,其中所述變體在所述序列中優選地具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體-不與包括包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區的抗體競爭結合組織因子,並且-與包括包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區的抗體競爭結合組織因子。在進一步的實施方案中,抗體包括VHCDR3區,其具有a)如下所示的序列-SEQIDNo:32,-SEQIDNo:36,-SEQIDNo:40,-SEQIDNo:56,或者b)所述任一序列的變體,例如具有最多1、2或3個胺基酸修飾,優選替換,例如保守替換,的變體。在進一步的實施方案中,抗體包括:a)包含CDR1,2和3序列SEQIDNO:30,31和32的VH區,和包含CDR1,2和3序列SEQIDNO:86,87和88的VL區,b)包含CDR1,2和3序列SEQIDNO:34,35和36的VH區,和包含CDR1,2和3序列SEQIDNO:90,91和92的VL區,c)包含CDR1,2和3序列SEQIDNO:38,39和40的VH區,和包含CDR1,2和3序列SEQIDNO:94,95和96的VL區,d)包含CDR1,2和3序列SEQIDNO:54,55和56的VH區,和包含CDR1,2和3序列SEQIDNO:110,111和112的VL區,或e)所述任一抗體的變體,其中所述變體優選地在所述序列中具有1、2或3個胺基酸修飾,更優選地,胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括VH,其a)與選自SEQIDNO:29,33,37和53的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:29,33,37和53的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括VL,其a)與選自SEQIDNO:85,89,93和109的VL區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:85,89,93和109的VL區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括:a)包含序列SEQIDNO:29的VH區和包含序列SEQIDNO:85的VL區,b)包含序列SEQIDNO:33的VH區和包含序列SEQIDNO:89的VL區,c)包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區,d)包含序列SEQIDNO:53的VH區和包含序列SEQIDNO:109的VL區,或e)所述任一抗體的變體,其中所述變體在所述序列中優選地具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體與包括包含序列SEQIDNO:41的VH區和包含序列SEQIDNO:97的VL區的抗體競爭結合組織因子。在進一步的實施方案中,抗體包括VHCDR3區,其具有a)如下所示的序列-SEQIDNo:4,-SEQIDNo:44,-SEQIDNo:48,或者b)所述任一序列的變體,例如具有最多1、2或3個胺基酸修飾,優選替換,例如保守替換,的變體。在進一步的實施方案中,抗體包括:a)包含CDR1、2和3序列SEQIDNO:2、3和4的VH區,和包含CDR1、2和3序列SEQIDNO:58、59和60的VL區,b)包含CDR1、2和3序列SEQIDNO:42、43和44的VH區,和包含CDR1、2和3序列SEQIDNO:98、99和100的VL區,c)包含CDR1、2和3序列SEQIDNO:46、47和48的VH區,和包含CDR1、2和3序列SEQIDNO:102、103和104的VL區,或者d)所述任一抗體的變體,其中所述變體優選地在所述序列中具有1、2或3個胺基酸修飾,更優選地,胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括VH,其a)與選自SEQIDNO:1,41和45的VH區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:1,41和45的VH區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括VL,其a)與選自SEQIDNO:57,97和101的VL區序列具有至少80%同一性,例如至少90%,至少95%,或者至少98%或100%同一性,或者b)與選自SEQIDNO:57,97和101的VL區序列相比具有最多20個,例如15個,或者10個,或者5、4、3、2或1個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在進一步的實施方案中,抗體包括:a)包含序列SEQIDNO:1的VH區和包含序列SEQIDNO:57的VL區,b)包含序列SEQIDNO:41的VH區和包含序列SEQIDNO:97的VL區,c)包含序列SEQIDNO:45的VH區和包含序列SEQIDNO:101的VL區,或者d)所述任一抗體的變體,其中所述變體在所述序列中優選地具有最多1、2或3個胺基酸修飾,更優選胺基酸替換,例如保守胺基酸替換。在更進一步的實施方案中,當用本文實施例22中所述的方法進行測定時,本發明抗體與組織因子的親和力小於5nM,例如小於3.5nM,例如小於2nM。一組特別有趣的本發明抗體的與組織因子結合的特徵是正常或高親合力和高解離速率(kd)。如本文中證明的,這類抗體可顯示腫瘤特異性結合,體現在它們結合癌組織,但不結合或者較少結合健康組織。不受限於任何具體的理論,我們假設這組抗體僅能夠與表達高水平TF的細胞良好結合,因為只有當它是雙價時結合才有效率。這些抗體的實例包括如本文所述的抗體044、098和111。因此,在一個實施方案中,當用本文實施例22中所述的親和力方法進行測定時,本發明抗體的kd大於10-3sec-1,並且當用本文實施例22中所述的親合力方法進行測定時,親合力小於5nM,例如小於1nM,例如小於0.2nM。在另一個實施方案中,當用本文實施例22中所述的親和力方法進行測定時,本發明抗體的kd大於10-3sec-1,和/或當用本文實施例22中所述的親和力方法進行測定時,ka大於5x104mol-1sec-1。在進一步的實施方案中,當用實施例23中所述的測定方法進行測定時,該抗體與健康組織不顯示結合,特別是與人腎小球沒有結合,但是當用本文實施例23中所述的測定方法進行測定時,與胰腺腫瘤顯示結合。在更進一步的實施方案中,當用本文實施例26中所述的方法進行測定時,該抗體可有效抑制已建立的BX-PC3腫瘤的生長。在另一個實施方案中,本發明抗體進具有一種或多種如下性質:抑制增殖、抑制腫瘤血管發生、誘導腫瘤細胞凋亡、與可變剪接的組織因子結合。在進一步的實施方案中,本發明的抗體與包括下列的抗體競爭結合組織因子:a)包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區,b)包含序列SEQIDNO:1的VH區和包含序列SEQIDNO:57的VL區,c)包含序列SEQIDNO:5的VH區和包含序列SEQIDNO:61的VL區,d)包含序列SEQIDNO:13的VH區和包含序列SEQIDNO:69的VL區,e)包含序列SEQIDNO:17的VH區和包含序列SEQIDNO:73的VL區,f)包含序列SEQIDNO:21的VH區和包含序列SEQIDNO:77的VL區,g)包含序列SEQIDNO:25的VH區和包含序列SEQIDNO:81的VL區,h)包含序列SEQIDNO:29的VH區和包含序列SEQIDNO:85的VL區,i)包含序列SEQIDNO:33的VH區和包含序列SEQIDNO:89的VL區,j)包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區,k)包含序列SEQIDNO:41的VH區和包含序列SEQIDNO:97的VL區,l)包含序列SEQIDNO:45的VH區和包含序列SEQIDNO:101的VL區,m)包含序列SEQIDNO:49的VH區和包含序列SEQIDNO:105的VL區,或者n)包含序列SEQIDNO:53的VH區和包含序列SEQIDNO:109的VL區。在進一步的實施方案中,本發明的抗體與具有下述的抗體結合組織因子上的相同表位:a)包含序列SEQIDNO:9的VH區和包含序列SEQIDNO:65的VL區,b)包含序列SEQIDNO:1的VH區和包含序列SEQIDNO:57的VL區,c)包含序列SEQIDNO:5的VH區和包含序列SEQIDNO:61的VL區,d)包含序列SEQIDNO:13的VH區和包含序列SEQIDNO:69的VL區,e)包含序列SEQIDNO:17的VH區和包含序列SEQIDNO:73的VL區,f)包含序列SEQIDNO:21的VH區和包含序列SEQIDNO:77的VL區,g)包含序列SEQIDNO:25的VH區和包含序列SEQIDNO:81的VL區,h)包含序列SEQIDNO:29的VH區和包含序列SEQIDNO:85的VL區,i)包含序列SEQIDNO:33的VH區和包含序列SEQIDNO:89的VL區,j)包含序列SEQIDNO:37的VH區和包含序列SEQIDNO:93的VL區,k)包含序列SEQIDNO:41的VH區和包含序列SEQIDNO:97的VL區,l)包含序列SEQIDNO:45的VH區和包含序列SEQIDNO:101的VL區,m)包含序列SEQIDNO:49的VH區和包含序列SEQIDNO:105的VL區,或者n)包含序列SEQIDNO:53的VH區和包含序列SEQIDNO:109的VL區。在進一步的實施方案中,本發明的抗體包括:-源自選自下組的人種系VH序列的重鏈可變區:IGHV1-18*01,IGHV3-23*01,IGHV3-30*01,IGHV3-33*01,IGHV3-33*03,IGHV1-69*02,IGHV1-69*04和IGHV5-51*01,和/或-源自選自下組的人種系Vκ序列的輕鏈可變區:IGKV3-20*01,IGKV1-13*02,IGKV3-11*01和IGKV1D-16*01。在進一步的方面中,本發明涉及一種單克隆抗-TF抗體,其包含具有如SEQIDNO:9,1,5,13,17,21,25,29,33,37,41,45,49或53所示的序列或所述任一序列的變體的VH區,所述變體具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換。如SEQIDNO:9,1,5,13,17,21,25,29,33,37,41,45,49或53所示的序列的變體與所述任一序列可以具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在本發明的一個方面中,分離的單克隆抗-TF抗體包括具有如SEQIDNO:65,57,61,69,73,77,81,85,89,93,97,101或105所示的序列或所述任一序列的變體的VL序列,所述變體具有例如最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換。如SEQIDNO:65,57,61,69,73,77,81,85,89,93,97,101或105所示的序列的變體與所述任一序列可以具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個實施方案中,抗體包括:a),具有從下組中選出的序列的VL區:SEQIDNo:65,57,61,69,73,77,81,85,89,93,97,101或105,和具有從下組中選出的序列的VH區:SEQIDNo:9,1,5,13,17,21,25,29,33,37,41,45,49或53,b)上述任意一個的變體,其中所述變體優選地僅具有所述序列中的保守替換。在一個優選實施方案中,抗體包括具有如SEQIDNo:65所示的序列的VL區和具有如SEQIDNo:9所示的序列的VH區,或者這兩條序列中任一個的變體,該變體a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:9或SEQIDNO:65分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:57所示的序列的VL區和具有如SEQIDNo:1所示的序列的VH區,或者兩條序列中任一個的變體,該變體a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:1或SEQIDNO:57分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:61所示的序列的VL區和具有如SEQIDNo:5所示的序列的VH區,或者兩條序列中任一個的變體,該變體a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:5或SEQIDNO:61分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:69所示的序列的VL區和具有如SEQIDNo:13所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:13或SEQIDNO:69分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:73所示的序列的VL區和具有如SEQIDNo:17所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:17或SEQIDNO:73分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:77所示的序列的VL區和具有如SEQIDNo:21所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:21或SEQIDNO:77分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括一個具有在SEQIDNo:81所示的序列的VL區和一個具有在SEQIDNo:25所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:25或SEQIDNO:81分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:85所示的序列的VL區和具有如SEQIDNo:29所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:29或SEQIDNO:85分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:89所示的序列的VL區和具有如SEQIDNo:33所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:33或SEQIDNO:89分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:93所示的序列的VL區和具有如SEQIDNo:37所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:37或SEQIDNO:93分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:97所示的序列的VL區和具有如SEQIDNo:41所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:41或SEQIDNO:97分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:101所示的序列的VL區和具有如SEQIDNo:45所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:45或SEQIDNO:101分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:105所示的序列的VL區和具有如SEQIDNo:49所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:49或SEQIDNO:105分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在另一個優選實施方案中,抗體包括具有如SEQIDNo:109所示的序列的VL區和具有如SEQIDNo:53所示的序列的VH區,或者兩條序列中任一個的變體,該變體:a)具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者b)與SEQIDNO:53或SEQIDNO:109分別具有至少80%同一性,例如至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。本發明的單克隆抗體可以例如通過雜交瘤方法產生,其首先在Kohleretal.,Nature256,495(1975)中;或者可以通過重組DNA方法加以產生。單克隆抗體還可以用例如下列文獻中記載的技術從噬菌體抗體庫分離:Clacksonetal.,Nature352,624-628(1991)和Marksetal.,J.Mol.Biol.222,581-597(1991)。單克隆抗體可以從任何合適的來源獲得。因此,例如,單克隆抗體可以從雜交瘤獲得,其中雜交瘤可以從用目的抗原免疫的小鼠獲得的鼠脾B細胞製備。目的抗原的形式可以是例如在表面上表達抗原的細胞,或者是編碼目的抗原的核酸。單克隆抗體還可以從源自被免疫的人或非人哺乳動物(例如大鼠、家兔、狗、靈長動物等)的抗體表達細胞的雜交瘤獲得。在一個實施方案中,本發明的抗體是人抗體。針對組織因子的人單克隆抗體可以用攜帶部分人免疫系統而非小鼠系統的轉基因或轉染色體小鼠產生。這種轉基因或轉染色體小鼠包括如下的小鼠,在這裡分別被稱作人單抗小鼠(HuMAb)和KM小鼠,並在本文統稱為「轉基因小鼠」。人單抗小鼠含有編碼未經重排的人重鏈可變和恆定鏈(μ和γ)和輕鏈可變和恆定鏈(κ)免疫球蛋白序列的人免疫球蛋白基因迷你座位(miniloci),並且還具有靶定的突變,使內源μ和κ鏈座位失活(Lonberg,N.etal.,Nature368,856-859(1994))。因此,小鼠在對免疫進行應答時顯示降低的小鼠IgM或κ表達,並且,被引入的人重鏈和輕鏈轉基因經過類型轉換(classswitching)和體細胞突變(somaticmutation)從而產生高親和力的人IgG,κ單克隆抗體(Lonberg,N.etal.(1994),上文;綜述見Lonberg,N.HandbookofExperimentalPharmacology113,49-101(1994),Lonberg,N.andHuszar,D.,Intern.Rev.Immunol.Vol.1365-93(1995)和Harding,F.andLonberg,N.Ann.N.Y.Acad.Sci764536-546(1995))。人單抗小鼠的製備在下列文獻中有詳細記載:Taylor,L.etal.,NucleicAcidsResearch20,6287-6295(1992),Chen,J.etal.,InternationalImmunology5,647-656(1993),Tuaillonetal.,J.Immunol.152,2912-2920(1994),Taylor,L.etal.,InternationalImmunology6,579-591(1994),Fishwild,D.etal.,NatureBiotechnology14,845-851(1996)。另見US5,545,806,US5,569,825,US5,625,126,US5,633,425,US5,789,650,US5,877,397,US5,661,016,US5,814,318,US5,874,299,US5,770,429,US5,545,807,WO98/24884,WO94/25585,WO93/1227,WO92/22645,WO92/03918和WO01/09187。HCo7小鼠在其內源輕鏈(kappa)基因中具有一個JKD中斷(JKDdisruption)(如Chenetal.,EMBOJ.12,821-830(1993)所述),在其內源重鏈基因中具有一個CMD中斷(如WO01/14424的實施例1所述),並具有一個KCo5人kappa輕鏈轉基因(如Fishwildetal.,NatureBiotechnology14,845-851(1996)所述)和一個HCo7人重鏈轉基因(如US5,770,429所述)。HCo12小鼠在其內源輕鏈(kappa)基因中具有一個JKD中斷(如Chenetal.,EMBOJ.12,821-830(1993)所述),在其內源重鏈基因中具有一個CMD中斷(如WO01/14424的實施例1所述),並具有一個KCo5人kappa輕鏈轉基因(如Fishwildetal.,NatureBiotechnology14,845-851(1996)所述)和一個HCo12人重鏈轉基因(如WO01/14424的實施例2所述)。在KM小鼠株系中,內源小鼠kappa輕鏈基因被如Chenetal.,EMBOJ.12,811-820(1993)所述地那樣純合地中斷,並且內源小鼠重鏈基因被如WO01/09187的實施例1所述的那樣純合地中斷。該小鼠株系攜帶一個人kappa輕鏈轉基因KCo5,如Fishwildetal.,NatureBiotechnology14,845-851(1996)所述。該小鼠種系還攜帶一個由染色體14節段hCF(SC20)構成的人重鏈轉染色體,如WO02/43478所述。這些轉基因小鼠的脾細胞可以用於根據眾所周知的技術產生分泌人單克隆抗體的雜交瘤。本發明的人單克隆或多克隆抗體,或者來源於其它物種的本發明抗體還可以通過轉基因方式,通過產生用目標免疫球蛋白重鏈和輕鏈序列轉基因的另一種非人類動物或植物,並以可回收的形式產生抗體來產生。關於哺乳動物體內的轉基因生產,抗體可以在山羊、牛和其它哺乳動物的乳汁中產生並自其回收。見例如US5,827,690,US5,756,687,US5,750,172和US5,741,957。進一步,本發明的人抗體或來自其它物種的本發明抗體可以使用本領域眾所周知的技術通過展示型技術(包括但不限於,噬菌體展示、逆轉錄病毒展示、核糖體展示和其它技術)加以產生,並且可以進一步對所得分子進行額外的成熟過程,例如親和成熟,這些技術是本領域眾所周知的(見例如Hoogenboometal.,J.Mol.Biol.227,381(1991)(噬菌體展示),Vaughanetal.,NatureBiotech14,309(1996)(噬菌體展示),HanesandPlucthau,PNASUSA94,4937-4942(1997)(核糖體展示),ParmleyandSmith,Gene73,305-318(1988)(噬菌體展示),ScottTIBS17,241-245(1992),Cwirlaetal.,PNASUSA87,6378-6382(1990),Russeletal.,Nucl.AcidsResearch21,1081-1085(1993),Hogenboometal.,Immunol.Reviews130,43-68(1992),ChiswellandMcCaffertyTIBTECH10,80-84(1992),和US5,733,743)。如果使用展示技術產生非人源的抗體,則這些抗體可以被人源化。本發明抗體可以是任何同種型。同種型的選擇典型地遵從期望的效應物功能,例如ADCC誘導。同種型的實例有IgG1,IgG2,IgG3,和IgG4。可以使用人輕鏈恆定區,κ或λ,的任一個。如果期望,本發明抗-TF抗體的類型可以通過已知方法加以轉換。例如,原本為IgM的本發明抗體可以被類型轉換成本發明的IgG抗體。進一步,類型轉換技術可以用於將一個IgG亞類轉變成另一個IgG亞類,例如從IgG1轉變成IgG2。因此,本發明抗體的效應物功能可以通過同種型轉換而改變成例如IgG1,IgG2,IgG3,IgG4,IgD,IgA,IgE,或IgM抗體,以用於不同的治療用途。在一個實施方案中,本發明抗體是IgG1抗體,例如IgG1,κ。在一個實施方案中,本發明的抗體是全長抗體,優選地IgG1抗體,特別是IgG1,κ抗體。在另一個實施方案中,本發明抗體是抗體片段或者單鏈抗體。抗體片段可以例如用常規技術通過片段化(fragmentation)獲得,並且以本文就完整抗體所述的相同的方式基於用途篩選得到的片段。例如,F(ab')2片段可以通過用胃蛋白酶(pepsin)處理抗體產生。所得的F(ab')2片段可以加以處理以還原二硫橋,產生Fab'片段。Fab片段可以通過用木瓜蛋白酶處理IgG抗體來獲得;Fab'片段可以用胃蛋白酶消化IgG抗體來獲得。F(ab')片段還可以通過硫醚鍵或二硫鍵結合下述的Fab'來產生。Fab'片段是通過切斷F(ab')2鉸鏈區中的一個二硫鍵而獲得的抗體片段。Fab'片段片段可以通過用還原劑,例如二硫蘇糖醇,處理F(ab')2片段來獲得。抗體片段還可以通過在重組細胞中表達編碼這些片段的核酸來產生(見例如Evansetal.,J.Immunol.Meth.184,123-38(1995))。例如,編碼F(ab')2片段一部分的嵌合基因可以包括:編碼H鏈CH1域和鉸鏈區的DNA序列,隨後是翻譯終止密碼子以產生這種截短的抗體片段分子。在一個實施方案中,抗-TF抗體是單價抗體,優選是如WO2007059782(Genmab)(本文通過提述併入)所述的單價抗體,其在鉸鏈區具有刪除。因此,在一個實施方案中,抗體是單價抗體,其中這樣的抗-TF抗體通過包括如下的方法構建:i)提供編碼所述單價抗體輕鏈的核酸構建體,所述構建體包含編碼選定的抗原特異性抗TF抗體之VL區的核苷酸序列和編碼Ig之恆定CL區的核苷酸序列,其中所述編碼選定的抗原特異性抗體之VL區的核苷酸序列和所述編碼Ig之CL區的核苷酸序列可操作地連接在一起,並且其中,在IgG1亞型的情況下,編碼CL區的核苷酸序列經過修飾,使得CL區不含有任何如下所述的胺基酸:在存在多複製人IgG的條件下或者當施用於動物或人類時,所述胺基酸能夠與其它包含與該CL區相同的胺基酸序列的肽形成二硫鍵或共價鍵;ii)提供編碼所述單價抗體重鏈的核酸構建體,所述構建體包含編碼選定的抗原特異性抗體之VH區的核苷酸序列和編碼人Ig之恆定CH區的核苷酸序列,其中編碼CH區的核苷酸序列經過修飾,使得相應於鉸鏈區的區域,以及如Ig亞型所要求的,CH區的其它區域,如CH3區,不含有任何如下所述的胺基酸殘基:在存在多複製人IgG的條件下或者當施用於動物或人類時,所述胺基酸殘基參與同其它包含與人IgCH區相同的胺基酸序列的肽形成二硫鍵或者共價或穩定非共價的重鏈間鍵,其中該編碼選定的抗原特異性抗體之VH區的核苷酸序列和該編碼所述Ig之CH區的核苷酸序列可操作地連接在一起;iii)提供用於產生所述單價抗體的細胞表達系統;iv)通過在(iii)的細胞表達系統的細胞中共表達(i)和(ii)的核酸構建體產生所述單價抗體。類似地,在一個實施方案中,抗-TF抗體是單價抗體,其包括:(i)如本文所述的本發明抗體的可變區或所述區的抗原結合部分,和(ii)免疫球蛋白CH區或其包括CH2和CH3區的片段,其中該CH區或其片段被修飾,從而使相當於鉸鏈區的區域,以及,如果免疫球蛋白不是IgG4亞型,CH區的其它區域,例如CH3區,不含有任何在多複製人IgG存在下能夠與相同的CH區形成二硫鍵或者其它共價或穩定非共價重鏈間鍵的胺基酸。在進一步的實施方案中,單價抗-TF抗體的重鏈被修飾,使得整個鉸鏈被刪除。在進一步的實施方案中,所述抗體是IgG4亞型(見SEQIDNO:114,SEQIDNO:113的無鉸鏈變體),但是CH3區被修飾,從而製造了一個或多個如下的胺基酸替換:234位的Thr(T)被Ala(A)替換;236位的Leu(L)被Ala(A)替換;236位的Leu(L)被Val(V)替換;273位的Phe(F)被Ala(A)替換;273位的Phe(F)被Leu(L)替換;275位的Tyr(Y)被Ala(A)替換。在另一個進一步的實施方案中,所述單價抗體的序列被修飾,從而其不包含任何N-連接糖基化的接受位點。本發明抗-TF抗體還包括單鏈抗體。單鏈抗體是如下的肽,其中重鏈和輕鏈Fv被連接起來。在一個實施方案中,本發明提供了一個單鏈Fv(scFv),其中在單肽鏈中,本發明抗-TF抗體Fv中的重鏈和輕鏈用柔性的肽接頭(典型地約10、12、15或更多個胺基酸殘基)在單一肽鏈中連接起來。產生這類抗體的方法見例如下列文獻所述:US4,946,778,PluckthuninThePharmacologyofMonoclonalAntibodies,vol.113,RosenburgandMooreeds.Springer-Verlag,NewYork,pp.269-315(1994),Birdetal.,Science242,423-426(1988),Hustonetal.,PNASUSA85,5879-5883(1988)andMcCaffertyetal.,Nature348,552-554(1990)。單鏈抗體可以是單價的,如果僅使用單個VH和VL的話,可以是雙價的,如果使用兩個VH和VL的話,或者是多價的,如果使用超過兩個VH和VL的話。在一個實施方案中,本發明抗-TF抗體是效應物功能缺陷抗體。當抗體用於通過阻斷TF的抑制作用而刺激免疫系統時,這類抗體是特別有用的。對於這類應用,抗體沒有效應物功能(例如ADCC)可能是有利的,因為此類功能可能會導致不期望的細胞毒性。在一個實施方案中,效應物功能缺陷抗TF抗體是一種穩定化的IgG4抗體。合適的穩定化IgG4抗體的實例是如下的抗體,其中人IgG4重鏈恆定區409位(用EU索引指示,見Kabatetal)的精氨酸被賴氨酸、蘇氨酸、甲硫氨酸或亮氨酸替換,優選地被賴氨酸替換(如WO2006033386(Kirin)中所述)和/或其中鉸鏈區包含Cys-Pro-Pro-Cys序列。在進一步的實施方案中,穩定化的IgG4抗TF抗體是包括重鏈和輕鏈的IgG4抗體,其中所述重鏈包括人IgG4恆定區,其在相應於409的位置處具有選自Lys,Ala,Thr,Met和Leu的殘基,和/或在相應於405的位置處具有選自Ala,Val,Gly,Ile和Leu的殘基,並且其中所述抗體任選地包括一個或多個其他替換、刪除和/或插入,但不是在鉸鏈區不包含Cys-Pro-Pro-Cys序列。優選地,所述抗體在相應於409的位置處包含Lys或Ala殘基,或者所述抗體的CH3區被人IgG1、人IgG2或人IgG3的CH3區替換。在更進一步的實施方案中,穩定化的IgG4抗TF抗體是包括重鏈和輕鏈的IgG4抗體,其中所述重鏈包括人IgG4恆定區,其在相應於409的位置處具有選自Lys,Ala,Thr,Met和Leu的殘基,和/或在相應於405的位置處具有選自Ala,Val,Gly,Ile和Leu的殘基,並且其中所述抗體任選地包括一個或多個其他替換、刪除和/或插入,並且其中所述抗體在鉸鏈區包括Cys-Pro-Pro-Cys序列。優選地,所述抗體在相應於409的位置處包括Lys或Ala殘基,或者抗體的CH3區被人IgG1、人IgG2或人IgG3的CH3區替換。在進一步的實施方案中,效應物功能缺陷抗-TF抗體是非IgG4型的抗體,例如IgG1,IgG2或IgG3,其經過突變,從而介導效應物功能(例如ADCC)的能力被降低或者甚至消除。這些突變已經在例如Dall'AcquaWFetal.,JImmunol.177(2):1129-1138(2006)和HezarehM,JVirol.;75(24):12161-12168(2001)中有記載。在進一步的實施方案中,本發明的抗體與另一個部分偶聯,例如細胞毒性部分、放射性同位素或藥物。這種抗體可以通過通過將另一個部分與抗-TF抗體或其片段(例如抗-TF抗體H鏈、L鏈或其抗-TF特異/選擇性片段)的N端或C端化學偶聯加以產生(見例如OsamuKanemitsu編輯的AntibodyEngineeringHandbook,由ChijinShokan出版(1994))。這種偶聯抗體衍生物還可以通過在合適的內部殘基或糖基處偶聯加以產生)。一般地,這裡所述的抗-TF抗體可以通過包含任何合適數目的這類修飾胺基酸和/或與這類偶聯取代物相關聯加以修飾。在這種語境下的適合性,一般而言取決於至少大體上保留未衍生化的親本抗-TF抗體的相關TF選擇性和/或特異性的能力。例如,在下述方面,包含一個或多個修飾胺基酸可能是有利的:增加多肽血清半衰期,降低多肽抗原性,或者增加多肽儲存穩定性。例如,在重組產生過程中對胺基酸進行共翻譯修飾或者翻譯後修飾(例如在哺乳動物細胞中表達期間在N-X-S/T基序處的N連接糖基化),或者通過合成方法修飾。經修飾胺基酸的非限制性實例包括糖基化胺基酸、硫酸化胺基酸、異戊二烯化(例如法尼基化、牻牛兒基化(geranylgeranylated))胺基酸、乙醯化胺基酸、醯基化胺基酸、PEG化胺基酸、生物素化胺基酸、羧基化胺基酸、磷酸化胺基酸等。足以指導胺基酸修飾領域技術人員的參考文獻在整個文獻域中大量存在。規程實例可以在Walker(1998)ProteinProtocolsOnCd-Rom,HumanaPress,Towata,NJ中找到。經修飾的胺基酸可以例如從下列胺基酸中選出:糖基化胺基酸、PEG化胺基酸、法尼基化胺基酸、乙醯化胺基酸、生物素化胺基酸、與脂質基團偶聯的胺基酸或與有機衍生化劑偶聯的胺基酸。抗-TF抗體還可以通過與聚合物共價偶聯進行化學修飾,以便例如增加其循環半衰期。聚合物和將它們附著於肽上的方法的實例在例如下列文獻中有例證:US4,766,106,US4,179,337,US4,495,285和US4,609,546。其他的聚合物實例包括聚氧乙烯化多元醇和聚乙二醇(PEG)(例如分子量為大約1,000-大約40,000的PEG,例如大約2,000-大約20,000,例如大約3,000-12,000g/mol)。在一個實施方案中,本發明提供了抗-TF抗體,其與從下面選出的第二分子偶聯:放射性核素、酶、酶底物、輔因子、螢光標誌物、化學發光標誌物、肽標籤或磁性顆粒。在一個實施方案中,抗-TF抗體可以和一個或多個抗體片段、核酸(寡核苷酸)、核酸酶、激素、免疫調節劑、螯合劑、硼化合物、光活性劑(photoactiveagent)、染料等偶聯。這些和其它的試劑可以直接或間接與本發明抗-TF抗體偶聯。直接偶合第二試劑的一個實例是通過間隔物部分來加以偶聯。這些間隔物可以是不溶或可溶的(見例如Dieneretal.,Science231,148(1986)),而且可以選擇間隔物使藥物能夠在靶位點和/或在特定條件下從抗-TF抗體釋放。可以和抗-TF抗體偶聯的其它試劑實例包括凝集素和螢光肽。在一個實施方案中,提供了包括一個或多個放射性標記胺基酸的抗TF抗體。放射性標記的抗TF抗體可以用於診斷和治療目的(與放射性標記的分子偶聯是另一可能特徵)。用於多肽的非限制性標記物的實例包括,但不僅限於,3H,14C,15N,35S,90Y,99Tc,和125I,131I,和186Re。用於製備放射性標記胺基酸和相關肽衍生物的方法是本領域已知的(見例如Junghansetal.,inCancerChemotherapyandBiotherapy655-686(2dedition,ChafnerandLongo,eds.,LippincottRaven(1996))和US4,681,581,US4,735,210,US5,101,827,US5,102,990(USRE35,500),US5,648,471和US5,697,902。例如,放射性同位素可以通過氯胺T法加以偶聯。在一個實施方案中,本發明的抗-TF抗體包括偶聯的核酸或核酸相關分子。在本發明的這一方面中,偶聯的核酸是細胞毒性核糖核酸酶。在一個實施方案中,偶聯的核酸是反義核酸(例如S100A10靶定反義分子,其也可以是本發明的聯合組合物或聯合用藥方法中的一種獨立組分,見例如Zhangetal.,JBiolChem.279(3),2053-62(2004))。在一個實施方案中,偶聯的核酸是抑制性RNA分子(例如siRNA分子)。在一個實施方案中,偶聯的核酸是免疫刺激性核酸(例如含有免疫刺激性CpG基序的DNA分子)。在一個實施方案中,偶聯的核酸是編碼表達腫瘤抑制基因、抗癌疫苗、抗癌細胞因子或細胞凋亡劑的表達盒。這些衍生物還可以包括偶聯編碼表達一種或多種細胞毒蛋白(例如植物或細菌毒素)的核酸。在一個實施方案中,抗TF抗體與功能核酸分子偶聯。功能核酸分子包括反義分子、幹擾核酸分子(例如siRNA分子)、適體(aptamer)、核酶、三鏈體形成分子(triplexformingmolecule)和外部引導序列(externalguidesequence)。功能核酸分子可以發揮具有靶分子的特異活性的效應物、抑制劑、調節劑和刺激物的功能,或者功能核酸分子可以具有獨立於任何其它分子的新活性。在另一個實施方案中,本發明的抗TF抗體與適體偶聯。在另一個實施方案中,本發明提供了一種抗TF抗體,其與核酶偶聯。任何本領域已知的用於將抗-TF抗體與偶聯分子相偶聯的方法,例如如上文所述的,均可以使用,包括在下列文獻中記載的方法:Hunteretal.,Nature144,945(1962),Davidetal.,Biochemistry13,1014(1974),Painetal.,J.Immunol.Meth.40,219(1981)和Nygren,J.Histochem.andCytochem.30,407(1982)。許多類型的細胞毒性化合物可以通過使用細胞毒性化合物上的反應活性基團或者通過使用交聯劑與蛋白質連接。可以和氨基在體內形成穩定共價鍵的一種通用反應活性基團是異硫氰酸鹽(Meansetal.,Chemicalmodificationsofproteins(Holden-Day,SanFrancisco1971)pp.105-110)。該基團優先與賴氨酸的ε-氨基反應。馬來醯亞胺是一種通用的反應基團,用於與半胱氨酸上的巰基形成穩定的體內共價鍵(Ji.,MethodsEnzymol91,580-609(1983))。單克隆抗體通常不能與放射性金屬離子形成共價鍵,但是它們可以通過利用共價連接於抗體的螯合劑而間接地附著在抗體上。螯合劑可以通過胺基酸殘基的胺基(Mearesetal.,Anal.Biochem.142,68-78(1984))和巰基(Koyama,Chem.Abstr.120,217262t(1994))連接,還可以通過糖基團(Rodwelletal.,PNASUSA83,2632-2636(1986),Quadrietal.,Nucl.Med.Biol.20,559-570(1993))連接。由於這些螯合劑含有兩種類型的功能基團,一種結合金屬離子,另一種將螯合劑與抗體連接,所以它們通常被稱為雙功能螯合劑(Sundbergetal.,Nature250,587-588(1974))。在一個實施方案中,本發明提供了一種抗-TF抗體,例如人抗-TF抗體,其與治療部分,例如細胞毒素、化療藥物、免疫抑制劑或放射性同位素,偶聯。這種偶聯物在這裡稱作「免疫偶聯物」。包括一個或多個細胞毒素的免疫偶聯物稱作「免疫毒素」(immunotoxins)。細胞毒素或細胞毒劑包括任何對細胞有害(例如殺傷細胞)的試劑。對於這些本領域眾所周知的類型的藥物及其作用機制的記載見Goodmanetal.,GoodmanandGilman'sThePharmacologicalBasisOfTherapeutics,第8版,MacmillanPublishingCo.,1990。在例如Vitetta,Immunol.Today14,252(1993)和US5,194,594中提供了與抗體免疫毒素製備相關的額外技術。用於形成本發明免疫偶聯劑的合適治療劑包括紫杉醇(taxol)、松胞菌素B(cytochalasinB)、短桿菌肽D(gramicidinD)、溴化乙錠(ethidiumbromide)、依米丁(emetine)、絲裂黴素(mitomycin)、依託泊苷(etoposide)、鬼臼噻吩苷(tenoposide)、長春新鹼(vincristine)、長春鹼(vinblastine)、秋水仙鹼(colchicin)、多柔比星(doxorubicin)、柔紅黴素(daunorubicin)、二羥炭疽菌素二酮(dihydroxyanthracindione)、米託蒽醌(mitoxantrone)、普卡黴素(mithramycin)、放線菌素D(actinomycinD)、1-去氫睪酮(1dehydrotestosterone)、糖皮質激素(glucocorticoids)、普魯卡因(procaine)、丁卡因(tetracaine)、利多卡因(lidocaine)、普萘洛爾(propranolol)和嘌呤黴素(puromycin),抗代謝物(例如氨甲蝶呤、6-巰基嘌呤、6-硫鳥嘌呤、阿糖胞苷、氟達拉賓、5-氟脲嘧啶、氨烯咪胺(decarbazine)、羥基脲、天冬醯胺酶、吉西他濱、克拉屈濱),烷化劑(例如鹽酸氮芥、thioepa、苯丁酸氮芥、美法侖、卡氮芥(BSNU)、洛莫司汀(CCNU)、環磷醯胺、白消安、二溴甘露醇、鏈脲佐菌素、達卡巴嗪(DTIC)、丙卡巴肼、絲裂黴素C、順鉑和其它鉑衍生物,例如卡鉑),抗生素(例如放線菌素D(先前稱作放線菌素)、博來黴素、柔紅黴素(先前稱作道諾黴素)、阿黴素、伊達比星、米拉黴素、絲裂黴素、米託蒽醌、普卡黴素、安麴黴素(AMC))、白喉毒素和相關分子(例如白喉A鏈及其活性片段和雜交分子)、蓖麻毒蛋白毒素(例如蓖麻毒蛋白毒素A或脫糖基化蓖麻毒蛋白A鏈毒素)、霍亂毒素、志賀樣毒素(SLT-I,SLT-II,SLT-IIV)、LT毒素、C3毒素、志賀毒素、百日咳毒素、破傷風毒素、大豆Bowman-Birk蛋白酶抑制劑、假單胞菌外毒素、alorin、皂苷、蒴蓮根毒素、明膠、相思豆毒蛋白A鏈、蒴蓮根毒素A鏈、α-帚麴黴素、油桐(Aleuritesfordii)蛋白、石竹素(dianthin)、美洲商陸(PhytolaccaAmericana)蛋白(PAPI,PAPII和PAP-S)、苦瓜抑制物、麻風樹毒蛋白、巴豆毒蛋白、肥皂草(sapaonariaofficinalis)抑制物、白樹毒素(gelonin)、mitogellin、局限麴黴素(restrictocin)、酚黴素和依諾黴素毒素。其它合適的偶聯分子包括核糖核酸酶(RNase)、脫氧核糖核酸酶(DNase)I、葡萄球菌內毒素-A、美洲商陸抗病毒蛋白、白喉毒素和假單胞菌內毒素。見例如Pastanetal.,Cell47,641(1986)和Goldenberg,Calif.ACancerJournalforClinicians44,43(1994)。治療劑,其可以與如本文其它部分所述的本發明的抗-TF抗體組合施用,還可以是可用於與本發明抗-TF抗體偶聯的治療部分的候選物。在一個實施方案中,本發明的抗-TF抗體與螯合劑接頭(例如tiuxetan)偶聯,後者允許將抗體偶聯於放射性同位素。在進一步的方面中,本發明涉及一種雙特異性分子,其包括如本文上文所述的本發明抗-TF抗體和第二結合特異性,例如對人效應物細胞、人Fc受體或T細胞受體的結合特異性,或者對TF的另一表位的結合特異性。除了抗-TF結合特異性和對人效應物細胞、人Fc受體或T細胞受體的結合特異性之外,本發明的雙特異性分子可以進一步包括第三結合特異性。本發明的示例性雙特異性抗體分子包括(i)兩個抗體,一個具有對TF的特異性,另一個具有對第二靶標的特異性,兩者偶聯在一起,(ii)單獨一個抗體,其具有一條特異針對TF的鏈和一條特異針對第二分子的第二鏈,和(iii)具有針對TF和第二分子的特異性的單鏈抗體。典型地,第二靶標/第二分子是除TF之外的分子。在一個實施方案中,第二分子是癌症抗原/腫瘤相關抗原,例如癌胚抗原(CEA)、前列腺特異抗原(PSA)、RAGE(腎抗原)、甲胎蛋白、CAMEL(黑色素瘤上的CTL-識別抗原)、CT抗原(例如MAGE-B5,-B6,-C2,-C3,和D;Mage-12;CT10;NY-ESO-1,SSX-2,GAGE,BAGE,MAGE,和SAGE)、粘蛋白抗原(例如MUC1,粘蛋白-CA125等)、神經節苷脂抗原、酪氨酸酶、gp75、C-myc、Mart1、MelanA、MUM-1、MUM-2、MUM-3、HLA-B7和Ep-CAM。在一個實施方案中,第二分子是癌症相關整聯蛋白,例如α5β3整聯蛋白。在一個實施方案中,第二分子是血管發生因子或其他癌症相關生長因子,例如血管內皮生長因子(VEGF)、成纖維細胞生長因子(FGF)、表皮生長因子(EGF)、表皮生長因子受體(EGFR)、血管生成素及其受體,特別地,與癌症進展相關的受體(例如HER1-HER4受體之一、c-met或RON)。本文中討論的其它癌症進展相關蛋白也可以是合適的第二分子。在一個實施方案中,本發明的雙特異性抗體是雙抗體。雙特異性抗體還包括交聯的或「異源偶聯物」抗體。例如,異源偶聯物中的一個抗體可以和親和素偶聯,另一個與生物素偶聯。這類抗體已經被提議,例如,將免疫系統細胞靶定於不想要的細胞(見例如US4,676,980)。異源偶聯物抗體可以用任何方便的交聯方法製備。在進一步的方面中,本發明涉及編碼本發明抗體的表達載體。在一個實施方案中,本發明的表達載體包括編碼選自下組的一個或多個胺基酸序列的核苷酸序列:SEQIDNO:1-112。在另一個具體的實施方案中,本發明的表達載體包括編碼一個或多個選自下組的VH胺基酸序列的核苷酸序列:SEQIDNO:9,1,5,13,17,21,25,29,33,37,41,45,49和53。在一個具體的實施方案中,本發明的表達載體包括編碼選自下組的一個或多個選自的VHCDR3胺基酸序列的核苷酸序列:SEQIDNO4,8,12,16,20,24,28,32,36,40,44,48,52和56。在另一個具體的實施方案中,本發明的表達載體包括編碼選自下組一個或多個VL胺基酸序列的核苷酸序列:SEQIDNO:65,57,61,69,73,77,81,85,89,93,97,101和105。在另一個具體的實施方案中,本發明的表達載體包括編碼選自下組的一個或多個VLCDR3胺基酸序列的核苷酸序列:SEQIDNO:60,64,68,72,76,80,84,88,92,96,100,104和108。在一個具體的實施方案中,本發明的表達載體包括編碼一個或多個上述胺基酸序列的變體的核苷酸分子,所述變體具有最多25個胺基酸修飾,例如20個,例如最多15、14、13、12或11個胺基酸修飾,例如10、9、8、7、6、5、4、3、2或1個胺基酸修飾,例如刪除或插入,優選替換,例如保守替換,或者與所述任一序列具有至少80%同一性,例如與前述任一胺基酸序列具有至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。在一個進一步的實施方案中,表達載體進一步包括編碼抗體,例如人抗體的輕鏈恆定區、重鏈恆定區、或輕鏈和重鏈恆定區二者的核苷酸序列。這類表達載體可用於重組產生本發明的抗體。本發明上下文中的表達載體可以是任何合適的載體,包括染色體、非染色體、合成核酸載體(包含一組合適的表達控制元件的核酸序列)。這類載體的實例包括如下載體的衍生物:SV40、細菌質粒、噬菌體DNA、杆狀病毒、酵母質粒、源自質粒和噬菌體DNA組合的載體、和病毒核酸(RNA或DNA)載體。在一個實施方案中,編碼抗-TF抗體的核酸被包含在裸DNA或RNA載體內,包括例如線性表達元件(例如在SykesandJohnston,NatBiotech17,355-59(1997)中記載的),緊湊的核酸載體(例如在US6,077,835和/或WO00/70087中記載的),質粒載體例如pBR322,pUC19/18或pUC118/119,「侏儒(midge)」尺寸最小化核酸載體(例如在Schakowskietal.,MolTher3,793-800(2001)中記載的),或者作為被沉澱的(precipitated)核酸載體構建體,例如CaP04-沉澱構建體(例如在WO00/46147,BenvenistyandReshef,PNASUSA83,9551-55(1986),Wigleretal.,Cell14,725(1978),和CoraroandPearson,SomaticCellGenetics7,603(1981)中記載的)。這類核酸載體及其使用是本領域眾所周知的(見例如US5,589,466和US5,973,972)。在一個實施方案中,載體適合於在細菌細胞中表達抗-TF抗體。這類載體的實例包括表達載體,例如BlueScript(Stratagene),pIN載體(VanHeeke&Schuster,JBiolChem264,5503-5509(1989),pET載體(Novagen,MadisonWI)等)。表達載體還可以是,或者可選擇地是適合於在酵母系統中表達的載體。任何適合於在酵母系統中表達的載體均可使用。合適的載體包括,例如,含有組成性或可誘導性啟動子,例如alpha因子、乙醇氧化酶和PGH(綜述見:F.Ausubeletal.,ed.CurrentProtocolsinMolecularBiology,GreenePublishingandWileyInterScienceNewYork(1987),和Grantetal.,MethodsinEnzymol153,516-544(1987))的載體。核酸和/或載體還可以包括編碼分泌/定位序列的核酸序列,分泌/定位序列能夠將多肽,例如未成熟的多肽鏈,靶定到周質空間(periplasmicspace)或者細胞培養基內。這些序列是本領域已知的,並且包括分泌前導序列或信號肽,細胞器靶定序列(例如核定位序列、ER保留信號、線粒體轉運序列(transitsequence)、葉綠體轉運序列),膜定位/錨定序列(例如終止轉移序列、GPI錨定序列)等。在本發明的表達載體中,編碼抗-TF抗體的核酸可以包括合適的啟動子、增強子和其它便於表達的元件或者與合適的啟動子、增強子和其它便於表達的元件相關聯。這些元件的實例包括強表達啟動子(例如人CMVIE啟動子/增強子以及RSV,SV40,SL3-3,MMTV,和HIVLTR啟動子),有效的聚(A)終止序列,大腸桿菌質粒產物的複製起點,作為選擇標籤的抗生素耐受基因,和/或便利的克隆位點(例如多接頭)。核酸還可以包括可誘導的啟動子(與組成型啟動子相對),例如CMVIE(技術人員會認識到,這些術語實際上是描述基因在某些條件下的表達水平的)。在一個實施方案中,編碼抗-TF抗體的表達載體可以被置於或者通過病毒載體輸送到宿主細胞或宿主動物中。在一個更進一步的方面中,本發明涉及重組真核或原核宿主細胞,例如轉染瘤,其產生如這裡所定義的本發明抗體或如這裡所定義的本發明雙特異性分子。宿主細胞的實例包括酵母、細菌和哺乳動物細胞,例如CHO或HEK細胞。例如,在一個實施方案中,本發明提供了一種包含這樣的核酸的細胞,該核酸穩定整合到所述細胞基因組內,並且包含用於表達本發明抗-TF抗體的編碼序列。在另一個實施方案中,本發明提供了這樣的細胞,其包含非整合的核酸,例如質粒、粘粒、噬菌粒或線性表達元件,所述非整合的核酸包含用於表達本發明抗-TF抗體的編碼序列。在進一步的方面中,本發明涉及可產生如這裡所定義的本發明抗體的雜交瘤。在更進一步的方面中,本發明涉及轉基因非人類動物,其包括編碼人重鏈和人輕鏈的核酸,其中該動物或植物可產生本發明的抗體。這種雜交瘤和轉基因動物的產生在上文已有記載。在進一步的方面中,本發明涉及一種用於產生本發明抗-TF抗體的方法,所述方法包括如下步驟:a)培養如本文上文所述的本發明雜交瘤或宿主細胞,和b)從培養基純化本發明抗體。在進一步的主要方面中,本發明涉及用作藥物的如本文所定義的抗-TF抗體或如本文所定義的雙特異性分子。在更進一步的方面中,本發明涉及一種藥物組合物,其包括:-如本文所定義的抗-TF抗體或如本文所定義的雙特異性分子,和-藥學可接受的載體。藥物組合物可以用藥學可接受的載體或稀釋劑以及任何其它已知的佐劑和賦形劑根據常規技術加以配製,例如在Remington:TheScienceandPracticeofPharmacy,19thEdition,Gennaro,Ed.,MackPublishingCo.,Easton,PA,1995中公開的技術。藥學可接受的載體或稀釋劑以及任何其它已知的佐劑和賦形劑應當適合於本發明所選擇的化合物以及所選擇的給藥模式。用於藥物組合物的載體和其它組分的適用性以如下的因素為基礎來確定,即對所選的本發明化合物或藥物組合物的期望的生物學性質沒有顯著的不利影響(例如對抗原結合沒有實質性影響(例如10%或更低的相對抑制,5%或更低的相對抑制等))。本發明的藥物組合物還可以包括稀釋劑、填充劑、鹽、緩衝劑、去汙劑(例如非離子去汙劑,例如吐溫20或吐溫80)、穩定化劑(例如糖或無蛋白胺基酸)、防腐劑、組織固定劑、增溶劑、和/或其它適合於包含在藥物組合物中的材料。已有報導,在癌細胞中,例如人結腸直腸癌細胞中,TF的表達受到2個驅動疾病進程的主要轉化事件(K-ras癌基因活化和p53腫瘤抑制子失活)的控制,其方式依賴於MEK/有絲分裂原活化蛋白激酶(MAPK)和磷脂醯肌醇3』-激酶(PI3K)(Yuetal.(2005)Blood105:1734)。過表達TF的癌細胞可能是本發明抗-TF抗體的特別好的靶標,因為每個細胞可以結合更多的抗體。因此,在一個實施方案中,待用本發明抗-TF抗體治療的癌症患者是如下的患者,例如胰腺癌、肺癌或結腸直腸癌患者,其已經被診斷在其腫瘤細胞的K-Ras中具有一個或多個突變和/或p53中存在一個或多個突變。在一個備選的實施方案中,待用本發明抗-TF抗體治療的癌症患者是患者,例如胰腺癌、肺癌或結腸直腸癌患者,其在K-Ras中沒有突變。不受限於任何具體的理論,一些具有K-Ras激活的腫瘤細胞有可能對抗-TF抗體治療的易感性較弱,因為在K-Ras被激活的細胞中抗-TF抗體影響細胞內信號傳導機制的效力可能較低。本發明藥物組合物中活性成分的實際劑量水平可以加以變化,以獲得可以為特殊患者、組合物或給藥模式有效地實現期望治療應答的活性成分的量,而對患者沒有毒性。所選的劑量水平依賴於多種藥物動力學因素,包括所採用的本發明特定組合物或其醯胺的活性,給藥途徑,給藥時間,所採用特殊化合物的排洩速度,治療的持續時間,與所採用的特定組合物聯合使用的其它藥物、化合物和/或材料,受治療的患者的年齡、性別、體重、狀況、一般健康狀況和先前用藥歷史,以及醫學領域眾所周知的類似因素。藥物組合物可以通過任何合適的途徑和模式施用。在體內和體外施用本發明化合物的合適途徑是本領域眾所周知的,並可以由本領域技術人員加以選擇。在一個實施方案中,本發明的藥物組合物是腸胃外施用的。如這裡所使用的,術語「腸胃外施用」和「腸胃外地施用」是指除腸內和局部給藥之外的給藥模式,通常是通過注射,並且包括上皮、靜脈內、肌內、動脈內、鞘內、囊內、眶內、心臟內、皮內、腹膜內、腱內、經氣管、皮下、表皮下(subticular)、關節內、囊下、蛛網膜下、椎管內、顱內、胸內、硬腦膜外和胸骨內注射和輸注。在一個實施方案中,藥物組合物是通過靜脈內或皮下注射或輸注給藥的。藥學可接受的載體包括任何和全部合適的溶劑、分散介質、包衣劑、殺菌和殺真菌劑、等滲劑、抗氧化劑和延遲吸收劑,和類似的與本發明化合物生理相容的試劑。本發明藥物組合物可以採用的合適的水性和非水性載體實例包括水、鹽水、磷酸鹽緩衝鹽水、乙醇、右旋糖、多元醇(例如甘油、丙二醇、聚乙二醇等),及其合適的混合物,植物油,例如橄欖油、玉米油、花生油、棉籽油、和芝麻油,羧甲基纖維素膠體溶液、黃蓍膠和可注射的有機酯,例如油酸乙酯,和/或各種緩衝液。其它的載體是藥物領域眾所周知的。藥學可接受的載體包括無菌水溶液或分散體和無菌粉末,用於即時製備無菌可注射溶液或分散體。這些介質和試劑在藥物活性物質上的使用是本領域已知的。除非任何常規介質或試劑與活性化合物不相容,本文構想了它們在本發明藥物組合物中的使用。通過使用包衣材料,例如卵磷脂,在分散體情況下通過保持所需的顆粒大小,和通過使用表面活性劑,可以保持合適的流動性。本發明的藥物組合物還可以包括藥學可接受的抗氧化劑,例如(1)水溶性抗氧化劑,例如抗壞血酸、半胱氨酸鹽酸鹽、硫酸氫鈉、焦亞硫酸鈉、亞硫酸鈉和類似物;(2)油溶性抗氧化劑,例如抗壞血酸棕櫚酸酯、丁基羥基茴香醚(BHA)、丁羥甲苯(BHT)、卵磷脂、沒食子酸丙酯、α-生育酚、等等;和(3)金屬螯合劑,例如檸檬酸、乙二胺四乙酸(EDTA)、山梨醇、酒石酸、磷酸等等。本發明的藥物組合物還可以在組合物中包括等滲劑,例如組合物中的糖、多元醇,例如甘露醇、山梨醇、甘油或氯化鈉。本發明的藥物組合物還可以含有一種或多種適合於所選給藥途徑的佐劑,例如防腐劑、潤溼劑、乳化劑、分散劑、防腐劑或緩衝劑,其可以提高藥物組合物的保存壽命或有效性。本發明的化合物可以用保護化合物免於快速釋放的載體製備,這樣的載體例如緩釋劑型,包括植入體、經皮貼片和微膠囊化地輸送系統。這樣的載體可以包括明膠、單硬脂酸甘油酯、二硬脂酸甘油酯、生物可降解的、生物相容性聚合物,例如乙烯乙烯乙酸共聚物、聚酸酐、聚乙醇酸、膠原、聚原酸酯和聚乳酸,單獨地或者與蠟一起,或者其它本領域眾所周知的材料。用於製備這類製劑的方法是本領域技術人員一般知道的。見例如SustainedandControlledReleaseDrugDeliverySystems,J.R.Robinson編輯,MarcelDekker,Inc.,NewYork,1978。在一個實施方案中,可以被配製本發明的化合物以確保在體內適當的分布。用於胃腸外給藥的藥學可接受載體包括無菌含水溶液或分散體用於即時製備無菌可注射溶液或分散體的無菌粉末。這些介質和試劑用於藥物活性物質的使用是本領域已知的。任何常規介質或試劑,只要其不與活性化合物不相容,本文考慮了它們在本發明藥物組合物中的使用。組合物中還可以納入補充活性化合物。用於注射的藥物組合物典型地必須是無菌的,並且在製造和儲存條件下穩定。組合物可以配製成溶液、微乳劑、脂質體或其它適合於高藥物濃度的有序結構。載體可以是水性或非水性溶劑或分散介質,含有例如水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等),及其合適的混合物,植物油,例如橄欖油,和可注射的有機酯,例如油酸乙酯。,可以例如通過下述手段來保持合適的流動性:通過使用包衣,例如卵磷脂;在分散體的情況下通過保持所需的顆粒大小;以及通過使用表面活性劑。在許多情況下,優選地在組合物中含有等滲劑,例如糖、多元醇如甘油、甘露醇、山梨醇、或氯化鈉。可注射組合物的延長吸收可以通過在組合物中包含可延遲吸收的試劑,例如單硬脂酸鹽和明膠,而實現。可以這樣製備無菌可注射溶液:將所需量的活性化合物納入根據需要含有一種成分或多種成分的組合(例如上面所列舉的,)的合適溶劑中,隨後通過無菌微量過濾。一般地,分散體是通過將活性化合物納入含有基礎分散介質和所需的其它成分(例如來自上面列舉的)的無菌媒介中而製備的。在用於製備無菌可注射溶液的無菌粉末的情況下,製備方法的實例是真空乾燥和冷凍乾燥(凍幹),這些過程可以從先經過了無菌過濾的溶液產生活性成分加上任何額外的的粉末。無菌可注射溶液的製備可以通過按照需要,將所需量的活性化合物加入到具有一種或多種上文所列舉成分的組合的合適溶劑中,隨後進行無菌微過濾。一般地,分散體的製備是通過將活性化合物加入到含有基礎分散介質和必需的其它來自上面列舉的成分的無菌介質內。在用於製備無菌可注射溶液的無菌粉末的情況下,製備方法的實例是真空乾燥和冷凍乾燥(凍幹),這些過程從先前經過無菌過濾的溶液產生活性成分加上任何額外的期望成分的粉末。本發明的藥物組合物可以含有一種本發明的化合物或者多種本發明化合物的組合。如上文所述,在另一個方面中,本發明涉及用作藥物的如本文所定義的本發明抗體或者如這裡所本文的本發明雙特異性分子。本發明的抗-TF抗體可以用於多種目的。特別地,本發明的抗體可用於治療多種形式的癌症。在一個方面中,本發明的抗-TF單克隆抗體用於治療各種實體癌症類型,例如中樞神經系統的腫瘤、頭頸癌、肺癌(例如非小細胞肺癌)、乳腺癌、食道癌、胃癌、肝和膽癌(liverandbiliarycancer)、胰腺癌、結腸直腸癌、膀胱癌、腎癌、前列腺癌、子宮內膜癌、卵巢癌、惡性黑色素瘤、肉瘤(軟組織,例如骨和肌肉)、原發來源不明的腫瘤(也就是未知來源)、白血病、骨髓癌症(例如多發性骨髓瘤)、急性淋巴細胞白血病、慢性淋巴細胞白血病和非霍奇金淋巴瘤、皮膚癌、神經膠質瘤、腦、子宮和直腸的癌症。進一步,自身免疫性炎症,例如肌病或多發性硬化,可以作為本發明的抗-TF單克隆抗體的靶標。本發明的抗-TF單克隆抗體還可以用於止血(haemostatis)的治療。癌症相關的止血病症也可以作為本發明的介入的目標。進一步,具有炎症的疾病,例如肌病、類風溼性關節炎、骨關節炎、強直性脊柱炎、痛風、脊柱關節病(spondylarthropathris)、強直性脊柱炎、萊特爾綜合症、銀屑病性關節病、腸病性關節炎(enterapathricspondylitis)、青少年關節病(juvenilearthropathy)、反應性關節病、感染性或感染後關節炎、結核性關節炎、病毒性關節炎、真菌性關節炎、梅毒性關節炎、腎小球腎炎、末期腎病、系統性紅斑狼瘡、mb.Crohn、潰瘍性結腸炎、炎性腸病、囊性纖維化、慢性阻塞性肺病(COPD)、哮喘、過敏性哮喘、支氣管炎、急性支氣管炎、慢性支氣管炎、特發性肺纖維化、或者多發性硬化,可以作為本發明的抗-TF單克隆抗體的靶標。本發明的抗-TF單克隆抗體還可以用於止血症(haemostatis)的治療。癌症相關的止血病症也可以作為本發明的介入的靶標。另外,血管疾病,例如血管再狹窄、心肌血管疾病、腦血管疾病、視網膜病(retinopathia)和黃斑變性,包括但不僅限於,溼性AMD,可以用抗-TF單克隆抗體治療。本發明的抗-TF單克隆抗體還可以用於治療具有心血管危險的患者,例如動脈粥樣硬化、高血壓、糖尿病、血脂障礙、和急性冠狀動脈綜合症,包括但不僅限於,急性心肌梗死、中風。本發明的抗-TF單克隆抗體還可以用於抑制血栓形成,例如DVT、腎栓塞、肺栓塞、動脈血栓形成,或者用於治療在動脈手術、外周血管旁路移植或冠狀動脈旁路移植、動靜脈分流、移除設置物例如支架或導管後的血栓形成。本發明的抗-TF單克隆抗體還可以用於抑制腎缺血再灌注損傷。本發明的抗-TF單克隆抗體還可以用於治療高脂蛋白血症(hyperlipoproteineimia)、甲狀旁腺功能亢進(hyperparathyroidism)。本發明的抗-TF單克隆抗體還可以用於治療血管炎、ANCA陽性血管炎、Behcet病。本發明的抗-TF單克隆抗體還可以用於阻斷外傷誘導的呼吸衰竭,例如急性呼吸窘迫綜合症、急性肺損傷。本發明的抗-TF單克隆抗體還可以用於阻斷感染誘導的器官功能障礙,例如腎衰竭、急性呼吸窘迫綜合症、急性肺損傷。本發明的抗-TF單克隆抗體還可以用於治療各種血栓栓塞疾病,例如由血管成形術、心肌梗死、不穩定型心絞痛和冠狀動脈狹窄引起的血栓栓塞疾病。本發明的抗-TF單克隆抗體還可以用於預防場合,用於治療系統性感染的TF介導的併發症,例如敗血症或肺炎。本發明的抗-TF單克隆抗體還可以用於對具有動脈粥樣硬化的血管而有血栓形成危險的患者的預防性處理。本發明的抗-TF單克隆抗體還可以用於治療移植物抗宿主疾病。本發明的抗-TF單克隆抗體還可以用於在胰島移植中增加β細胞移植物植入,預防心臟同種異體移植物血管病(CAV),預防急性移植物排斥。本發明的抗-TF單克隆抗體還可以用於治療存在暴露於循環組織因子的微粒(circulatingtissue-factorexposingmicroparticles)的疾病,例如但不僅限於血管血栓形成、II型糖尿病、AMI、肺動脈高血壓。類似地,本發明涉及用於抑制表達TF的腫瘤細胞的生長和/或增殖的方法,包括向需要的個體施用本發明的抗體或雙特異性分子。在一個實施方案中,所述腫瘤細胞涉及癌症,例如前列腺癌、肺癌(例如非小細胞肺癌)、乳腺癌、結腸直腸癌(例如轉移性結腸直腸癌)、胰腺癌、子宮內膜癌、卵巢癌、皮膚黑色素瘤(cutaneousmelanoma)、白血病骨髓癌症(例如多發性骨髓瘤)、急性淋巴細胞白血病、慢性淋巴細胞白血病和非霍奇金淋巴瘤、皮膚癌、前列腺癌、神經膠質瘤、腦、腎、子宮、膀胱和直腸的癌症。另外,本發明涉及使用可結合人TF的單克隆抗體在製備用於治療癌症(例如上文所述具體癌症適應證中之一)的藥物中的用途。在一個實施方案中,要用抗-TF抗體治療的患者的選擇是基於其尿液和/或血液中組織因子(TF)的水平。在一個具體的實施方案中,要治療的患者在尿液和/或血液中具有相對高水平的TF。例如,要治療的患者尿液中的TF水平可超過20ng/ml,例如超過40ng/ml,例如超過100ng/ml,例如超過200ng/ml。作為另一選擇,或者除此之外,患者血清中的TF水平可以超過100pg/ml,例如超過200pg/ml。這可以用例如ELISA加以確定。在本發明的治療方法的一個進一步的實施方案中,在治療期間對治療的效力進行監視,例如在預定的時間點。在一個實施方案中,可以通過測量尿液或血液中的TF水平,例如通過ELISA,來監視效力。在另一個實施方案中,可以通過對疾病區域進行可視化來確定效力,可視化例如通過進行一次或多次PET-CT掃描,例如使用標記的抗-TF抗體,如本發明的標記抗-TF抗體進行掃描。而且,標記的抗-TF抗體,如本發明的標記抗-TF抗體,可以用於檢測產生TF的腫瘤,例如使用PET-CT掃描來檢測。對上述治療方法和應用中的劑量方案進行調節,以提供最佳的理想應答(例如治療性應答)。例如,可以給予單次推注(bolus),經過一段時間內給予數個分割的劑量,或者可以根據治療情形的迫切需要而按比例減少或增加劑量。胃腸外組合物可以被配製成單位劑量形式,以便於給藥和保持劑量均勻。如這裡所用的單位劑量形式,是指適合於作為用於待治療的受試者的單位劑量(unitarydosage)的、物理上離散的單位;每個單位含有預定量活性化合物和必需的藥物載體,所述活性化合物的預定量經過計算可產生期望的治療效果。本發明的單位劑量形式的規格由如下因素支配和直接決定:(a)活性化合物的獨特特徵和待實現的具體治療效果,和(b)現有技術中內在的對配伍這種用於治療個體敏感性的活性化合物的限制。抗-TF抗體的有效劑量和劑量域取決於待治療的疾病或病症,並可以由本領域技術人員確定。本發明化合物的治療有效量的一個示例的非限制性範圍是大約0.1-100mg/kg,例如大約0.1-50mg/kg,例如大約0.1-20mg/kg,例如0.1-10mg/kg,例如大約0.5,例如大約0.3,例如大約1,或大約3mg/kg。本領域具有普通技術的醫師或獸醫師可以容易地確定和處方所需的藥物組合物的有效量。例如,對於藥物組合物中所含的抗-TF抗體,醫師或獸醫師可以從低於實現期望治療效果所需量的劑量水平開始,並逐漸增加劑量,直到實現期望的效果。一般地,本發明組合物的合適的每日劑量是這樣的化合物量,它是可以有效產生治療效果的最低劑量。這種有效劑量一般地取決於上述因素。給藥可以是例如靜脈內、肌肉內、腹膜內或皮下,例如施加在靶位點附近。如果期望,可以將藥物組合物的有效每日劑量作為2、3、4、5、6或更多個亞劑量在每天內以合適的間隔分開給藥,任選地採取單位劑量形式。儘管本發明的化合物有可能單獨施用,但是優選地以上述的藥物組合物的形式施用化合物。在一個實施方案中,抗-TF抗體可以以每周10-500mg/m2,例如200-400mg/m2的劑量輸注給藥。這種給藥可以重複進行,例如1-8次,例如3-5次。給藥可以通過歷時2-24小時,例如2-12小時的連續輸注來進行。在一個實施方案中,抗-TF抗體可以通過在一個較長時間內,例如超過24小時,緩慢連續輸注來進行,以降低毒副作用。在一個實施方案中,抗-TF抗體可以用每周250mg-2000mg,例如300mg,500mg,700mg,1000mg,1500mg或2000mg的劑量給藥,最多給8次,例如4-6次。給藥可以通過在2-24小時的時間內,例如2-12小時的時間內連續輸注來進行。這種給藥方案可以按照需要重複1次或多次,例如在6個月或12個月後重複1次或多次。劑量可以通過測量給藥後血液中本發明化合物的量來確定或調整,例如以下述方式:取出生物樣品並使用靶定本發明抗-TF抗體抗原結合區的抗獨特型(anti-idiotypic)抗體。在一個實施方案中,抗-TF抗體可以通過維持療法進行給藥,例如在6個月或更長的時期內每周1次。在一個實施方案中,抗-TF抗體可以通過如下的方案給藥,包括一次輸注本發明的抗-TF抗體,隨後輸注與放射性同位素偶聯的本發明抗-TF抗體。該方案可以在例如7-9天後重複進行。作為非限制性實例,根據本發明的治療可以作為本發明化合物的每日劑量提供,其量為大約每天0.1-100mg/kg,例如每天0.5,0.9,1.0,1.1,1.5,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,40,45,50,60,70,80,90或100mg/kg,在治療開始後第1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,或40天中至少之一,或者第1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20周中的至少之一進行,或者其任何組合,使用單次劑量或者每24、12、8、6、4或2小時分次的劑量,或其任意組合。用於腫瘤治療的「有效量」還可以以其穩定疾病進程的能力來衡量。化合物抑制癌症的能力可以在可預測在人腫瘤中的效力的動物模型體系中進行評估。或者,組合物的這種性質可以通過技術人員已知的體外測定方法檢查化合物抑制細胞生長或者誘導細胞凋亡的能力進行評估。治療有效量的治療化合物可以減少腫瘤大小,或者以其他方式減輕受試者的症狀。本領域的普通技術人員能夠根據如下的因素確定這些量,即受試者的體格、受試者症狀的嚴重程度、和所選的具體組合物或給藥途徑。抗-TF抗體還可以預防性地給藥,以降低發生癌症的危險、延遲癌症進程中事件發生的開始、和/或在癌症減輕過程中降低復發的危險。對於通過其它生物學因素已知其體內存在腫瘤但難以定位腫瘤的患者是特別有用的。抗-TF抗體還可以在組合療法中施用,即與其它與待治療疾病或病症相關的治療劑組合。因此,在一個實施方案中,含有抗體的藥物用於和一種或多種其他的治療劑組合,例如細胞毒劑、化療劑或抗血管發生劑。這種組合施用可以同時、分別或順次進行。對於同時施用,試劑可以合適地作為一個組合物或者作為各別的組合物施用。本發明因此還提供了用於治療涉及如上所述的表達TF細胞的疾病的方法,該方法包括施用與一種或多種如下所述的其他治療劑組合的本發明抗-TF抗體。在一個實施方案中,本發明提供了一種用於治療受試者體內涉及表達TF的細胞的疾病的方法,該方法包括向需要的受試者施用治療有效量的本發明抗-TF抗體和至少一種化療劑。在一個實施方案中,本發明提供了用於治療或預防癌症的方法,該方法包括向需要的對象施加治療有效量的本發明抗-TF抗體和至少一種化療劑。在一個實施方案中,本發明提供了本發明的抗-TF抗體在製備用於同至少一種癌症的化療劑一起施用來治療癌症的藥物組合物中的用途。在一個實施方案中,這種化療劑可以選自抗代謝物,例如氨甲蝶呤、6-巰基嘌呤、6-硫鳥嘌呤、阿糖胞苷、氟達拉濱、5-氟尿嘧啶、氨烯咪胺、羥基脲、天冬醯胺酶、吉西他濱、克拉屈濱和類似的試劑。在一個實施方案中,這種化療劑可以選自烷基化試劑,例如氮芥、塞替派(thioepa)、苯丁酸氮芥、美法侖、卡氯芥(BSNU)、環己亞硝脲(CCNU)、環磷醯胺、白消安、二溴甘露醇、鏈唑黴素、達卡巴嗪(DTIC)、丙卡巴肼、絲裂黴素C、順鉑和其它鉑衍生物,例如卡鉑,和類似藥物。在一個實施方案中,這種化療劑可以選自抗有絲分裂劑,例如紫杉烷類(taxanes),如多西紫杉醇(docetaxel)和紫杉醇,和長春花生物鹼,例如長春地辛、長春新鹼、長春鹼和長春瑞濱。在一個實施方案中,這種化療劑可以選自拓撲異構酶抑制劑,例如託泊替康或依立替康。在一個實施方案中,這種化療劑可以選自抑制細胞生長藥物,例如依託泊苷和替尼泊苷。在一個實施方案中,這種化療劑可以選自生長因子抑制劑,例如ErbB1(EGFR)抑制劑(例如易瑞沙、愛必妥(西妥昔單抗)、特羅凱和類似藥物),ErbB2(Her2/neu)抑制劑(例如赫賽汀和類似藥物)和類似藥物。在一個實施方案中,這種化療劑可以選自酪氨酸激酶抑制劑,例如伊馬替尼(Glivec,GleevecSTI571)、拉帕替尼、PTK787/ZK222584和類似藥物。在一個實施方案中,本發明提供了一種用於治療涉及受試者體內表達TF的細胞的疾病的方法,該方法包括向需要的受試者施用治療有效量的本發明抗-TF抗體和至少一種血管新生、新血管化和/或其它血管化抑制劑。這種血管發生抑制劑的實例是尿激酶抑制劑、基質金屬蛋白酶抑制劑(例如馬立馬司他、新伐司他、BAY12-9566、AG3340、BMS-275291和類似藥物)、內皮細胞遷移和增殖抑制劑(例如TNP-470、角鯊胺、2-甲氧雌二醇、考布他汀類(combretastatins)、內皮他丁、血管他丁、青黴胺、SCH66336(Schering-PloughCorp,Madison,NJ)、R115777(JanssenPharmaceutica,Inc,Titusville,NJ)和類似藥物)、血管新生生長因子拮抗劑(例如ZD6474、SU6668、針對血管發生劑和/或其受體(例如VEGF,bFGF,和血管形成素-1)的抗體、沙利度胺、沙利度胺類似物(例如CC-5013)、Sugen5416、SU5402、抗血管發生核酶(例如angiozyme)、幹擾素α(例如幹擾素α2a)、蘇拉明和類似藥物)、VEGF-R激酶抑制劑和其它抗血管發生酪氨酸激酶抑制劑(例如SU011248)、內皮特異性整聯蛋白/生存信號傳導抑制劑(例如vitaxin和類似藥物)、銅拮抗劑/螯合劑(例如四硫鉬酸鹽、卡託普利和類似藥物)、羧胺三唑(carboxyamido-triazole,CAI)、ABT-627、CM101、白介素-12(IL-12)、IM862、PNU145156E以及抑制血管發生的核苷酸分子(例如反義-VEGF-cDNA、編碼血管他丁的cDNA、編碼p53的cDNA和編碼缺陷型VEGF受體-2的cDNA)和類似藥物。這些血管發生、新血管化和/或其它血管化抑制劑的其它實例是抗血管發生肝素衍生物和相關分子(例如肝素酶III(heperinaseIII))、替莫唑胺、NK4、巨噬細胞遷移抑制因子(MIF)、環氧合酶-2抑制劑、缺氧誘導因子1、抗血管發生大豆異黃酮、奧替普拉、煙麴黴素及其類似物、生長抑素類似物、戊聚糖多硫酸酯、替可加蘭鈉、達肝素、腫瘤抑素(tumstatin)、血小板反應蛋白(thrombospondin)、NM-3、combrestatin、canstatin、阿伐他汀(avastatin)、針對其它相關靶標的抗體(例如抗-α-v/beta-3整聯蛋白和抗-kininostatin單抗)和類似藥物。在一個實施方案中,用於和用於治療如上所述疾病的抗-TF抗體聯合使用的治療劑可以是抗癌免疫原,例如癌抗原/腫瘤相關抗原(例如上皮細胞粘附分子(EpCAM/TACSTD1)、粘蛋白1(MUC1)、癌胚抗原(CEA)、腫瘤相關糖蛋白72(TAG-72)、gp100、Melan-A、MART-1、KDR、RCAS1、MDA7、癌症相關病毒疫苗(例如人乳頭瘤病毒疫苗)、腫瘤來源的熱激蛋白和類似藥物。在本文他處記載的許多其它合適的癌抗原/腫瘤相關抗原和本領域已知的類似分子也可以進一步或者作為另一選擇用在這種實施方案中。抗癌免疫原性肽還包括抗獨特型「疫苗」,例如BEC2抗獨特型抗體、米妥莫單抗、CeaVac和相關抗獨特型抗體、針對MG7抗體的抗獨特型抗體,和其它抗癌抗獨特型抗體(見例如Birebentetal.,Vaccine.21(15),1601-12(2003),Lietal.,ChinMedJ(Engl).114(9),962-6(2001),Schmittetal.,Hybridoma.13(5),389-96(1994),Maloneyetal.,Hybridoma.4(3),191-209(1985),Raychardhurietal.,JImmunol.137(5),1743-9(1986),Pohletal.,IntJCancer.50(6),958-67(1992),Bohlenetal.,CytokinesMolTher.2(4),231-8(1996)和Maruyama,JImmunolMethods.264(1-2),121-33(2002))。這種抗獨特型抗體還以任選地與載體偶聯,該載體可以是合成的(通常是惰性的)分子載體、蛋白質(例如匙孔血藍蛋白(KLH)(見例如Ochietal.,EurJImmunol.17(11),1645-8(1987))或細胞(例如紅細胞-見例如Wietal.,JImmunolMethods.122(2),227-34(1989))。在一個實施方案中,供與用於治療如上所述病症的抗-TF抗體聯合使用的治療劑可以是抗癌細胞因子、趨化因子或其組合。合適的細胞因子和生長因子的實例包括IFNγ、IL-2、IL-4、IL-6、IL-7、IL-10、IL-12、IL-13、IL-15、IL-18、IL-23、IL-24、IL-27、IL-28a、IL-28b、IL-29、KGF、IFNα(例如INFα2b)、IFNβ、GM-CSF、CD40L、Flt3配體、幹細胞因子、安西司亭和TNFα。合適的趨化因子包括Glu-Leu-Arg(ELR)-陰性趨化因子,例如來自人CXC和C-C趨化因子家族的IP-10,MCP-3,MIG,和SDF-1α。合適的細胞因子包括細胞因子衍生物、細胞因子變體、細胞因子片段和細胞因子融合蛋白。並且/或者,這些和本文中其它涉及天然發生的編碼肽的核酸的方法或用途可以通過「基因激活」和同源重組基因上調技術來進行,如下列文獻所述:US5,968,502,US6,063,630和US6,187,305和EP0505500。在一個實施方案中,用於與治療如上所述病症的抗-TF抗體聯合使用的治療劑可以是細胞周期控制/細胞凋亡調節子(或「調節劑」)。細胞周期控制/細胞凋亡調節子可包括靶向並調節細胞周期控制/凋亡調節子的分子,例如(i)cdc-25(例如NSC663284),(ii)過度刺激細胞周期的細胞周期蛋白依賴的激酶(例如夫拉平度(flavopiridol)(L868275,HMR1275),7-羥基星孢素(7-hydroxy-staurosporine)(UCN-01,KW-2401),和roscovitine(R-roscovitine,CYC202)),和(iii)端粒酶調節劑(例如BIBR1532,SOT-095,GRN163和在例如US6,440,735和US6,713,055中記載的組合物)。可幹擾細胞凋亡途徑的分子的非限制性實例包括TNF相關的細胞凋亡誘導配體(TRAIL)/凋亡-2配體(Apo-2L),激活TRAIL受體的抗體、IFN和反義Bcl-2。在一個實施方案中,用於與治療上述疾病的抗-TF抗體聯合使用的治療劑可以是激素調節劑,例如用於抗雄激素和抗雌激素療法的藥物。這些激素調節劑的實例有他莫昔芬、碘昔芬、氟維司群、屈洛昔芬、託瑞米芬、雷洛昔芬、己烯雌酚、乙炔雌二醇/炔雌醇、抗雄激素(antiandrogene)(例如氟他米特(flutaminde)/氟他胺(eulexin))、孕酮(例如己酸羥孕酮、甲羥孕酮/普維拉、甲地孕酮醋酸酯/梅格施)、腎上腺皮質類固醇(例如氫化可的松、潑尼松)、黃體化激素釋放激素(和其類似物或其它LHRH激動劑,例如布舍瑞林和戈舍瑞林)、芳香酶抑制劑(例如阿那曲唑/瑞寧得、氨魯米特/cytraden、依西美坦)、激素抑制劑(例如奧曲肽/善得定)和類似藥物。在一個實施方案中,用於同治療上述疾病的抗-TF抗體聯合使用的治療劑可以是抗變應性缺乏(anti-anergic)藥物(例如小分子化合物、蛋白質、糖蛋白、或阻斷對腫瘤和癌抗原耐受性的抗體)。這些化合物的實例是可阻斷CTLA-4活性的分子,例如MDX-010(易普利姆瑪(ipilimumab))(Phanetal.,PNASUSA100,8372(2003))。在一個實施方案中,用於同治療上述疾病的抗-TF抗體聯合使用的治療劑可以是含腫瘤抑制基因的核酸或載體,例如編碼人重組野生型p53/SCH58500的複製缺陷型腺病毒等;靶定癌基因、突變或不受調節基因的反義核酸;或靶定突變或不受調節基因的siRNA。腫瘤抑制靶標的實例包括例如BRCA1,RB1,BRCA2,DPC4(Smad4),MSH2,MLH1,和DCC。在一個實施方案中,用於同治療上述疾病的抗-TF抗體聯合使用的治療劑可以是抗癌核酸,例如genasense(augmerosen/G3139)、LY900003(ISIS3521)、ISIS2503、OGX-011(ISIS112989)、LE-AON/LEraf-AON(脂質體包裹的c-raf反義寡核苷酸/ISIS-5132)、MG98、和其它靶定PKCα、叢生蛋白(clusterin)、IGFBP、蛋白激酶A、細胞周期蛋白D1、或Bcl-2h的反義核酸。在一個實施方案中,用於同治療上述疾病的抗-TF抗體聯合使用的治療劑可以是抗癌抑制性RNA分子(見例如Linetal.,CurrCancerDrugTargets.1(3),241-7(2001),Erratumin:CurrCancerDrugTargets.3(3),237(2003),Limaetal.,CancerGeneTher.11(5),309-16(2004),Grzmiletal.,IntJOncol.4(1),97-105(2004),Collisetal.,IntJRadiatOncolBiolPhys.57(2Suppl),S144(2003),Yangetal.,Oncogene.22(36),5694-701(2003)和Zhangetal.,BiochemBiophysResCommun.303(4),1169-78(2003))。本發明的組合物和聯合給藥方法還包括施用核酸疫苗,例如編碼這些癌抗原/腫瘤相關抗原的裸露DNA疫苗(見例如US5,589,466,US5,593,972,US5,703,057,US5,879,687,US6,235,523,和US6,387,888)。在一個實施方案中,聯合給藥方法和/或聯合組合物包括自體疫苗組合物。在一個實施方案中,聯合組合物和/或聯合給藥方法包括全細胞疫苗或細胞因子表達細胞(例如表達重組IL-2的成纖維細胞、表達重組細胞因子的樹突細胞等)(見例如Kowalczyketal.,ActaBiochimPol.50(3),613-24(2003),Reillyetal.,MethodsMolMed.69,233-57(2002)和Tirapuetal.,CurrGeneTher.2(1),79-89(2002))。這種可用於本發明的組合方法的自體細胞方法的另一個實例是個體化免疫治療方法(先前稱作GTOP-99)(Genitope公司-Redwood市,CA,USA)。在一個實施方案中,本發明提供了聯合組合物和聯合施用方法,其中抗-TF抗體與病毒、病毒蛋白等組合或者共同施用。例如,複製缺陷病毒,其一般能夠在體內進行1輪或者少數幾輪複製,並且靶定腫瘤細胞,可以用作這種組合物和方法的組分。這類病毒試劑可以包含編碼免疫刺激物(例如GM-CSF和/或IL-2)的核酸,或者與其相伴隨。天然的溶瘤病毒和這些重組溶瘤病毒(例如HSV-1病毒、呼腸孤病毒、複製缺陷和複製敏感型腺病毒等)可以用作這些方法和組合物的組分。因此,在一個實施方案中,本發明提供了聯合組合物和聯合給藥方法,其中抗-TF抗體與溶瘤病毒組合或共同施用。這些病毒的實例包括溶瘤腺病毒和皰疹病毒,其可以是或者不是修飾病毒(見例如Shahetal.,JNeurooncol.65(3),203-26(2003),Stilesetal.,Surgery.134(2),357-64(2003),Sunarmuraetal.,Pancreas.28(3),326-9(2004),Teshigaharaetal.,JSurgOncol.85(1),42-7(2004),Vargheseetal.,CancerGeneTher.9(12),967-78(2002),Wildneretal.,CancerRes.59(2),410-3(1999),Yamanaka,IntJOncol.24(4),919-23(2004)和Zwiebeletal.,SeminOncol.28(4),336-43(2001))。本發明的聯合組合物和聯合給藥方法還可以涉及「全細胞」和「過繼性」免疫治療方法。例如這些方法可以包括輸注或再輸注免疫系統細胞(例如腫瘤浸潤淋巴細胞(TIL),如CD4+和/或CD8+T細胞(例如用腫瘤特異抗原和/或遺傳增強子擴增的T細胞),表達抗體的B細胞或其它抗體產生/呈遞細胞,樹突細胞(例如表達抗細胞因子的重組樹突細胞、用DC擴增劑如GM-CSF和/或Flt3-L培養的樹突細胞,和/或負載腫瘤相關抗原的樹突細胞),抗腫瘤NK細胞,所謂的雜交細胞,或其組合。細胞裂解物也可用於這些方法和組合物。可用於這些方面的正在臨床試驗中的細胞「疫苗」包括CanvaxinTM,APC-8015(Dendreon),HSPPC-96(Antigenics),和細胞裂解物。從癌細胞脫落(shedfrom)的抗原和其混合物(見例如Bystrynetal.,ClinicalCancerResearchVol.7,1882-1887,July2001),任選地與佐劑例如明礬混合,也可以作為這些方法和聯合組合物中的組分。在一個實施方案中,抗-TF抗體可以和體內接種法(internalvaccinationmethod)組合輸送給患者。體內接種是指患者體內的誘導的腫瘤或癌細胞死亡,例如藥物誘導或放射誘導的腫瘤細胞的細胞死亡,其典型地導致針對(i)腫瘤細胞整體或(ii)腫瘤細胞的部分,包括(a)分泌蛋白、糖蛋白或其它產物,(b)膜相關蛋白或糖蛋白或其它與膜關聯或插入在膜內的組分,和/或(c)細胞內蛋白或其它細胞內組分的免疫應答的引發。體內接種誘導的免疫應答可以是體液型(即抗體-補體介導的)或細胞介導型(例如可識別體內被殺死的腫瘤細胞或其部分的內源細胞毒性T淋巴細胞的發生和/或增加)。除了放射療法之外,可用於誘導所述腫瘤細胞死亡和體內接種的藥物和試劑的非限制實例是常規的化療劑、細胞周期抑制劑、抗血管發生藥物、單克隆抗體、細胞凋亡誘導劑和信號傳導抑制劑。其它可能作為治療劑與抗-TF抗體聯用來治療上述疾病的抗癌劑的實例是分化誘導劑、視黃酸類似物(例如全反式視黃酸、13-順視黃酸和類似藥物)、維生素D類似物(例如西奧骨化醇和類似藥物)、如下物質的抑制劑:ErbB3、ErbB4、IGF-IR、胰島素受體、PDGFRa、PDGFRbeta、Flk2、Flt4、FGFR1、FGFR2、FGFR3、FGFR4、TRKA、TRKC、c-met、Ron、Sea、Tie、Tie2、Eph、Ret、Ros、Alk、LTK、PTK7,和類似藥物。其它可能作為治療劑與抗-TF抗體聯用來治療上述疾病的抗癌劑的實例是組織蛋白酶B、組織蛋白酶D脫氫酶活性的調節劑、穀胱甘肽-S-轉移酶(例如穀氨醯半胱氨酸合成酶(glutacylcysteinesynthetase)和乳酸脫氫酶),和類似藥物。其它可能作為治療劑與抗-TF抗體聯用來治療上述疾病的抗癌劑實例是雌莫司汀和表柔比星。其它可能作為治療劑與抗-TF抗體聯用來治療上述疾病的抗癌劑實例是HSP90抑制劑,例如17-烯丙基氨基格爾德黴素,針對腫瘤抗原如PSA,CA125,KSA等的抗體,整聯蛋白如整聯蛋白β1,VCAM抑制劑和類似藥物。其它可能作為治療劑與抗-TF抗體聯用來治療上述疾病的抗癌劑實例是鈣調磷酸酶(calcineurin)抑制劑(例如伐司樸達、PSC833和其它MDR-1或p-糖蛋白抑制劑)、TOR抑制劑(例如西羅莫司、依維莫司和雷帕黴素),和「淋巴細胞歸巢」機制抑制劑(例如FTY720),和對細胞信號傳導具有影響的試劑,例如粘附分子抑制劑(例如抗-LFA等)。在一個實施方案中,本發明的抗-TF抗體用於和一種或多種其它的治療抗體聯合使用,例如貝伐單抗zalutumumab,西妥昔單抗帕尼單抗(VectibixTM),ofatumumab,zanolimumab,daratumumab,蘭尼單抗賽尼哌,Simulect,Remicade,Humira,Tysabri,Xolair,raptiva,nimotuzumab,美羅華和/或曲妥單抗其它可用於和本發明抗體聯合使用的治療抗體在下列文獻中有公開:WO98/40408(能夠結合天然人TF的抗體),WO04/094475(能夠結合人組織因子的抗體,與正常血漿對照相比,其不抑制因子介導的凝血),WO03/093422(與TF:VIIa複合體的結合親和力大於與單獨的TF的親和力),或WO03/037361(用於細胞凋亡相關治療的TF激動劑或拮抗劑)。在另一個實施方案中,兩種或多種如這裡所述的本發明不同抗體聯合使用來治療疾病。特別感興趣的組合包括兩種或多種非競爭的抗體。因此,在一個實施方案中,用這裡所定義的交叉阻斷(cross-block)組I中的抗體和如這裡定義的組II或III中的抗體組合治療患者。在另一個實施方案中,用如下面定義的組II中的抗體與組III中的抗體組合治療患者。這些組合療法可以導致每個細胞結合更多數目的抗體分子,從而可提供更高的效力,例如通過激活補體介導的溶解。在一個實施方案中,抗-TF抗體的施用可以與一種或多種如下所述的作用劑的遞送相結合,所述作用劑可促進抗-TF抗體或聯合組合物到達腫瘤內部。這種方法可以例如與鬆弛素的遞送相結合,其中鬆弛素能夠鬆弛腫瘤(見例如US6,719,977)。在一個實施方案中,本發明的抗-TF抗體可以和細胞滲透肽(CPP)鍵合。細胞滲透肽和相關肽(例如工程化的細胞滲透性抗體)在例如下列文獻中有記載:Zhaoetal.,JImmunolMethods.254(1-2),137-45(2001),Hongetal.,CancerRes.60(23),6551-6(2000).Lindgrenetal.,BiochemJ.377(Pt1),69-76(2004),Buergeretal.,JCancerResClinOncol.129(12),669-75(2003),Poogaetal.,FASEBJ.12(1),67-77(1998)和Tsengetal.,MolPharmacol.62(4),864-72(2002)。在一個實施方案中,本發明涉及一種用於治療受試者體內涉及表達TF的細胞的疾病的方法,該方法包括向需要的受試者施用治療有效量的抗-TF抗體和至少一種抗炎劑。在一個實施方案中,這種抗炎劑可以從下選出:阿司匹林和其它水楊酸鹽、Cox-2抑制劑(例如羅非昔布和塞來昔布)、NSAID(例如布洛芬、非諾洛芬、萘普生、舒林酸、雙氯芬酸、吡羅昔康、酮洛芬、雙氟尼酸、萘丁美酮、依託度酸、奧沙普秦和吲哚美辛)、抗-IL6R抗體、抗-IL8抗體(例如WO2004058797中記載的抗體,例如10F8)、抗-IL15抗體(例如WO03017935和WO2004076620中記載的抗體)、抗-IL15R抗體、抗-CD4抗體(例如zanolimumab)、抗-CD11a抗體(例如efalizumab)、抗-α-4/β-1整聯蛋白(VLA4)抗體(例如那他珠單抗)、用於治療炎症疾病的CTLA4-Ig、潑尼松龍、潑尼松、緩解疾病的抗風溼藥物(DMARDs)如氨甲蝶呤、羥基氯喹、柳氮磺吡啶、嘧啶合成抑制劑(例如來氟米特)、IL-1受體阻斷劑(例如阿那白滯素)、TNF-α阻斷劑(例如依那西普、英夫利昔單抗和阿達木單抗)和類似藥物。在一個實施方案中,這樣的免疫抑制和/或免疫調節劑可以從下選出:環孢菌素、硫唑嘌呤、黴酚酸、黴酚酸酯、皮質激素類如潑尼松、氨甲蝶呤、金鹽、柳氮磺吡啶、抗瘧藥、布喹那、來氟米特、咪唑立賓、15-脫氧精胍菌素(15-deoxyspergualine)、6-巰基嘌呤、環磷醯胺、雷帕黴素、他克莫司(FK-506)、OKT3、抗-胸腺細胞球蛋白、胸腺噴丁、胸腺素-α和類似藥物。在一個實施方案中,這種免疫抑制和/或免疫調節劑可以從免疫抑制抗體中選出,例如與IL-2受體的p75結合的抗體,針對CD25的抗體(例如在WO2004045512中所述,如AB1,AB7,AB11和AB12),或與例如MHC,CD2,CD3,CD4,CD7,CD28,B7,CD40,CD45,IFNγ,TNF-α,IL-4,IL-5,IL-6R,IL-7,IL-8,IL-10,CD11a或CD58結合的抗體,或與它們的配體結合的抗體。在一個實施方案中,這種免疫抑制和/或免疫調節劑可以從下選出:可溶的IL-15R,IL-10,B7分子(B7-1,B7-2,其變體和其片段),ICOS和OX40,陰性T細胞調節子抑制劑(例如針對CTLA4的抗體)和類似藥物。在一個實施方案中,本發明提供了一種用於治療受試者體內涉及表達TF的細胞的疾病的方法,該方法包括向需要的受試者施用治療有效量的抗-TF抗體和抗-C3b(i)抗體。在一個實施方案中,用於同治療如上所述疾病的抗-TF抗體聯合使用的治療劑可以從下選出:組蛋白脫乙醯酶抑制劑(例如苯基丁酸鹽)和/或DNA修復劑(例如DNA修復酶和相關組合物,例如dimericine。對於本發明的包括施用治療有效量的抗-TF抗體用於治療如上所述疾病的方法,還可以包括抗癌指向的光動力學療法(例如抗癌雷射療法-其任選地可以使用光敏劑來實施,見例如Zhangetal.,JControlRelease.93(2),141-50(2003)),抗癌聲波和震動波療法(見例如Kambeetal.,HumCell.10(1),87-94(1997)),和/或抗癌營養藥療法(見例如Roudebushetal.,VetClinNorthAmSmallAnimPract.34(1),249-69,viii(2004)和Rafi,Nutrition.20(1),78-82(2004))。類似地,抗-TF抗體可用於製備與抗癌指向的光動力學療法(例如抗癌雷射療法-其任選地可以使用光敏劑)、抗癌聲波和震動波療法、和/或抗癌營養療法一起施用以治療如上所述疾病的藥物組合物。在一個實施方案中,本發明提供了一種用於治療受試者體內涉及TF表達細胞的疾病的方法,該方法包括向需要的受試者施用治療有效量的抗-TF抗體,例如本發明的抗-TF抗體,和放射療法。在一個實施方案中,本發明提供了一種用於治療或預防癌症的方法,該方法包括向需要的受試者施用治療有效量的抗-TF抗體,例如本發明的抗-TF抗體,和放射療法。在一個實施方案中,本發明提供了抗-TF抗體,例如本發明的抗-TF抗體在製備用於和放射療法組合施用的治療癌症的藥物組合物。放射療法可以包括放射或者相關的向患者施用放療藥物。放射源可以在待治療患者的體外或者體內(放射治療可以例如處於外部射束放射療法(EBRT)或近程放射治療(BT)的形式)。可用於實施這些方法的放射活性元素包括例如鐳、銫-137、銥-192、鋂-241、金-198、鈷-57、銅-67、鎝-99、碘-123、碘-131和銦-111。在進一步的實施方案中,本發明提供了一種用於治療或預防癌症的方法,該方法包括與外科手術組合向需要的受試者施用治療有效量的抗-TF抗體,例如本發明的抗-TF抗體。如上所述,本發明的藥物組合物可以在組合療法中施用,即與一種或多種與待治療的病症相關的藥劑組合,或者作為各別的藥物組合物,或者將本發明化合物與一種或多種如上所述的額外治療劑共同配製。這些組合療法需要的本發明化合物和/或共施用藥劑的劑量可以更低,從而避免與各種單一療法相關的可能毒性或者併發症。除上以外,其它感興趣的組合療法包括如下:●對於胰腺癌治療,抗-TF抗體與抗代謝物(例如5-氟尿嘧啶和/或吉西他濱)組合,可能與一個或多個從下組選出的化合物組合:90Y-hPAM4、ARC-100、ARQ-197、AZD-6244、bardoxolonemethyl、cixutumumab、(IMC-A12)、folitixorincalcium、GVAX、易普利姆瑪、KRX-0601、美巴龍、MGCD-0103、MORAb-009、PX-12、Rh-Apo2L、TLN-4601、trabedersen、volociximab(M200)、WX-671、培美曲塞,盧比替康,伊沙匹隆、OCX-0191Vion、216586-46-8、拉帕替尼、馬妥珠單抗(matuzumab)、伊馬替尼、索拉菲尼(sorafinib)、曲妥單抗、exabepilone、埃羅替尼(erlotinib)、阿伐斯汀和西妥昔單抗。●對於結腸直腸癌治療,抗-TF抗體與一個或多個從下選出的化合物組合:吉西他濱、貝伐單抗、FOLFOX、FOLFIRI、XELOX、IFL、奧沙利鉑、伊立替康、5-FU/LV、卡培他濱、UFT、EGFR靶定劑、例如西妥昔單抗、帕尼單抗、扎魯木單抗(zalutumumab)、尼妥珠單抗(nimotuzumab);VEGF抑制劑、或酪氨酸激酶抑制劑如舒尼替尼。●對於乳腺癌治療,抗-TF抗體與一個或多個從下選出的化合物組合:抗代謝物、蒽環類抗生素、紫杉烷類、烷基化劑、埃博黴素抗激素(來曲唑(femar)、他莫昔芬等)、ErbB2(Her2/neu)抑制劑(例如赫賽汀和類似藥物)、CAF/FAC(環磷醯胺(cyclofosfamide)、多柔比星、5FU)AC(cyclo、doxo)、CMF(cyclo、氨甲蝶呤、5FU)、多西紫杉醇+卡培他濱、GT(紫杉醇、吉西他濱)FEC(cyclo、epi、5FU)與赫賽汀組合、紫杉醇+/-卡鉑、長春瑞濱、多西紫杉醇、CT與拉帕替尼組合;卡培他濱。●對於膀胱癌治療,抗-TF抗體與一個或多個從下選出的化合物組合:抗代謝物(吉西他濱、力比泰(alimta)、氨甲蝶呤)、鉑類似物(順鉑、卡鉑)、EGFr抑制劑(例如西妥昔單抗或扎魯木單抗)、VEGF抑制劑(例如阿伐斯汀)、多柔比星、酪氨酸激酶抑制劑例如吉非替尼、曲妥單抗、抗有絲分裂劑如紫杉烷類,例如紫杉醇,和長春鹼類例如長春花鹼。●對於前列腺癌治療,抗-TF抗體與一個或多個從下選出的化合物組合:激素/抗激素療法;例如抗雄激素、黃體生成素釋放激素(LHRH)激動劑,和化療劑例如紫杉烷類、米託蒽醌、雌莫司汀、5FU、長春花鹼、伊沙匹隆。●對於卵巢癌治療,抗-TF抗體與一個或多個從下選出的化合物組合:抗有絲分裂劑,例如紫杉烷類,和長春花生物鹼類、楷萊(caelyx)、託泊替康。診斷用途本發明的抗-TF抗體還可以用於診斷目的。因此,在進一步的方面中,本發明涉及包含如本文中定義的抗-TF抗體的診斷組合物。在一個實施方案中,本發明的抗-TF抗體可以用於通過檢測TF的水平或在其膜表面上含有TF的細胞的水平而在體內或體外診斷激活的TF表達細胞在其發病中發揮積極作用的疾病。這可以通過例如在允許抗體和TF之間形成複合體的條件下使待測樣品,任選地與對照樣品一起,與抗-TF抗體接觸而實現。然後檢測複合體的形成(例如使用ELISA)。當與測試樣品一道使用對照樣品時,對兩個樣品均檢測複合體,並且樣品間複合體形成的任何統計學顯著的差異指示測試樣品中TF的存在。因此,在進一步的方面中,本發明涉及一種用於檢測樣品中TF抗原或表達TF的細胞的存在的方法,包括:-在允許抗體與TF間形成複合體的條件下,使樣品與本發明的抗-TF抗體或本發明的雙特異性分子接觸;和-分析是否形成了複合體。在一個實施方案中,該方法在體外實施。更具體地,本發明提供了用於鑑定、診斷侵襲性細胞和組織,以及其它被本發明的抗-TF抗體靶定的細胞的方法,和用於監視治療性處理的進展、治療後狀態、發生癌症的危險、癌症進程等的方法。在這種診斷測定法的一個實例中,本發明提供了診斷組織中侵襲性細胞水平的方法,包括在抗-TF抗體和潛在的含TF組織之間形成免疫複合體,和檢測免疫複合體的形成,其中免疫複合體的形成與組織中侵襲細胞的存在相關。接觸可以使用被標記的分離抗體和標準成像技術在體內實施,或者可以在體外在組織樣品上實施。抗-TF抗體可用於通過任何合適的技術檢測任何合適的生物樣品中含TF的肽和肽片段。本發明提供的常規免疫測定法的實例包括,但不限於,ELISA、RIA、FACS測定、等離子共振測定、色譜測定、組織免疫組化、western印跡、和/或使用抗-TF抗體的免疫沉澱。本發明的抗-TF抗體可用於檢測來自人的TF和TF片段。用於在這些技術中使用的抗-TF抗體和/或第二抗體的合適標記物包括,但不限於,各種酶、輔基、螢光物質、發光物質和放射活性物質。合適的酶的實例包括辣根過氧化物酶、鹼性磷酸酶、β-半乳糖苷酶、或乙醯膽鹼酯酶;合適輔基複合體的實例包括鏈親和素/生物素和親和素/生物素;合適螢光物質的實例包括傘形酮、螢光素、螢光素異硫氰酸鹽、若丹明、二氯三嗪基胺螢光素(dichlorotriazinylaminefluorescein)/丹磺醯氯或藻紅蛋白;發光物質的實例包括魯米諾;而合適的放射活性物質的實例包括125I,131I,35S,和3H。抗-TF抗體還可以在生物樣品中通過競爭免疫測定方法利用標記有可檢測底物的TF肽標準和未標記的抗-TF抗體進行測定。在這種測定中,將生物樣品、經標記的TF肽標準和抗-TF抗體混合,並檢測與未標記的抗-TF抗體結合的經標記的TF標準肽的量。生物樣品中TF抗體的量與和抗-TF抗體結合的經標記TF標準的量成反比。抗-TF抗體在腫瘤的體內成像方面特別有用。與TF相關的腫瘤體內成像可以通過任何合適的技術實施。例如,可使用99Tc-標記法或者使用另一种放射γ射線的同位素的標記法,來標記腫瘤中的抗-TF抗體或者來自腫瘤的第二標記(例如FITC標記)的抗-TF抗體:TF複合體,並用γ閃爍照相機(例如ElscintApex409ECT器件)成像,典型地使用低能量、高解析度準直儀或低能量全能準直儀。然後,可以對被染色的組織進行放射活性計數評估,作為腫瘤內TF-相關肽的量的指示。通過使用這些技術獲得的圖像可用於評估患者、哺乳動物或組織內TF的生物分布(例如當使用TF或TF片段作為侵襲性癌細胞的存在的生物標誌時)。這種技術的變化形式包括使用磁共振成像(MRI)以提供優於γ照相機技術的成像。類似的免疫閃爍掃描方法和原理在例如下列文獻中有記載:Srivastava(編輯),RadiolabeledMonoclonalAntibodiesForImagingAndTherapy(Plenum出版社1988),Chase,"MedicalApplicationsofRadioisotopes,"inRemington'sPharmaceuticalSciences,第18版,Gennaroetal.,(編輯),第624-652頁(MackPublishingCo.,1990),和Brown,"ClinicalUseofMonoclonalAntibodies,"inBiotechnologyAndPharmacy227-49,Pezzutoetal.,(編輯)(Chapman&Hall1993)。這些圖像還可以用於其它的抗癌劑的靶向遞送,其它抗癌劑的實例在這裡已有記載(例如細胞凋亡劑、毒素或CHOP化療組合物)。並且/或者這些圖像還可以作為除去腫瘤的外科手術技術的基礎。而且,這種體內成像技術可允許在患者被鑑定患有腫瘤(由於其它的生物標誌、轉移等的存在),但是腫瘤無法用常規的分析技術加以鑑定的情況下鑑定和定位腫瘤。所有這些方法都是本發明的特徵。本發明提供的體內成像和其它診斷方法特別有用於檢測人患者(例如先前沒有被診斷患有癌症的患者或者處於癌症恢復/緩解期的患者)體內的微轉移。例如,佔全部癌細胞高達90%的癌瘤(Carcinoma)癌細胞已經被證明可用抗-TF抗體偶聯組合物良好染色。用這裡所述的單克隆抗-TF抗體檢出可以指示攻擊性/侵襲性上皮腫瘤的存在,或者/並且提供針對這些微轉移使用相關單克隆抗-TF抗體的可行性的指示。在一個實施方案中,本發明提供了體內成像方法,其中將本發明的抗-TF抗體與檢測-促進不透射線試劑(detection-promotingradio-opaqueagent)偶聯,將偶聯抗體施用給宿主(例如通過注射到血流中),並測定宿主中標記抗體的存在和定位。通過這種技術和這裡提供的任何其它診斷方法,本發明提供了用於篩選人患者體內或從人患者獲取的生物樣品中疾病相關細胞的存在的方法。為了診斷成像,放射性同位素可以直接或者通過使用中間功能基團間接地與抗-TF抗體連接。有用的中間功能基團包括螯合劑,例如乙二胺四乙酸和二乙三胺五乙酸(見例如US5,057,313)。除了放射性同位素和不透射線試劑之外,診斷方法可以用與染料(例如與生物素-鏈親和素複合體偶聯)、造影劑、螢光化合物或分子和用於磁共振成像(MRI)的增強劑(例如順磁離子)(見例如USPat.No.6,331,175,其記載了MRI技術和與MRI增強劑偶聯的抗體的製備)偶聯的抗-TF抗體實施。這種診斷/檢測試劑可以從用於磁共振成像的試劑和螢光化合物中選擇。為了使抗-TF抗體負載放射活性金屬或順磁離子,可能需要使它與具有長尾部的試劑反應,該尾部上搭接有多個用於與離子結合的螯合基團。這種尾部可以是聚合物,例如多聚賴氨酸、多糖或其它具有可以與螯合基團結合的懸吊基團的衍生化或可衍生化鏈,所述的螯合基團例如卟啉、多胺、冠醚、雙縮氨硫脲(bisthiosemicarbazone)、聚肟,和已知可用於此目的的類似基團。螯合劑可以用標準化學法與抗-TF抗體偶聯。因此,本發明提供了診斷性抗-TF抗體偶聯物,其中抗-TF抗體與造影劑(例如用於磁共振成像、計算機斷層掃描或超聲對比增強劑)或放射性核素偶聯,放射性核素可以是例如發射γ、β、α,俄歇電子、或正電子的同位素。在進一步的方面中,本發明涉及用於檢測樣品中TF抗原或表達TF的細胞的存在的試劑盒,包括-本發明的抗-TF抗體或本發明的雙特異性分子;和-試劑盒的使用說明書。在一個實施方案中,本發明提供了用於診斷癌症的試劑盒,包括含有抗-TF抗體的容器,和一種或多種用於檢測抗-TF抗體與TF肽結合的試劑。試劑可以包括例如螢光標籤、酶標籤、或其它可檢測標籤。試劑還可以包括用於酶反應的第二或第三抗體或試劑,其中酶反應產生能被可視化的產物。在一個實施方案中,本發明提供了一種診斷試劑盒,其包括置於合適的容器中的處於被標記或未標記的形式的一種或多種本發明的抗-TF抗體、用於在間接測定中用於溫育的試劑、和用於在這種測定中進行檢測的底物或衍生化試劑,這些試劑取決於標記物的性質。還可以包括對照試劑和使用說明書。還可以提供診斷試劑盒來利用抗-TF抗體,例如偶聯/標記的抗-TF抗體,檢測組織樣品或宿主內細胞活性或檢測TF肽的存在。在這種診斷試劑盒,以及在本文它處記載的用於治療應用的試劑盒中,抗-TF抗體典型地以凍幹形式置於容器內,單獨提供或者與額外的特異針對靶細胞或肽的抗體一起提供。典型地,還包括藥學可接受的載體(例如惰性稀釋劑)和/或其組分例如Tris、磷酸鹽或碳酸鹽緩衝劑、穩定劑、防腐劑、殺生物劑、殺生物劑、惰性蛋白質如血清白蛋白、等等(典型地置於另外的容器中供混合),和額外的試劑(典型地也置於另外的容器內)。在某些試劑盒中,還包括能夠與抗-TF抗體結合的第二抗體,其通常置於另外的容器內。第二抗體通常與標記物偶聯,並且以類似於本發明抗-TF抗體的方式配製。使用上述的和本文它處記載的方法,可以利用抗-TF抗體來限定癌/腫瘤細胞的亞類,和表徵這些細胞和相關組織/生長物。通過從患者取出組織樣本,並向這種樣本提供本發明的標記的抗-TF抗體的組合,可以實現原位檢測。本發明抗-TF抗體的提供可以通過向生物樣品施加(apply)或者覆蓋(overlay)本發明的標記抗-TF抗體來實現。通過使用這種程序,不僅有可能確定TF或TF片段的存在,還可能確定這些肽在所檢測組織中的分布(例如在評估癌細胞的擴散時)。利用本發明,普通技術人員能夠容易地意識到,可對大量組織學方法中的任何一種(例如染色程序)加以修改以實現這種原位檢測。在進一步的方面中,本發明涉及一種抗獨特型抗體,其與如本文所述的本發明抗-TF抗體結合。抗-獨特型(Id)抗體是如下的抗體,其識別一般與抗體的抗原結合位點關聯的獨特決定簇。Id抗體可以通過用要製備抗Id的抗TF單抗免疫動物來製備,其中所述動物的物種和遺傳類型與該抗TF單抗所來源的物種和遺傳類型相同。被免疫的動物通常能夠識別用來免疫的抗體的獨特型決定簇,並通過產生針對這些獨特型決定簇的抗體(抗-Id抗體)來對其做出應答。這種抗體在例如US4,699,880中有記載。這種抗體是本發明的進一步特徵。抗-Id抗體還可用作「免疫原」在另一個動物內誘導免疫應答,產生所謂的抗-抗-Id抗體。抗-抗-Id抗體可能和誘導抗-Id抗體的最初單抗在表位上相同。因此,通過使用針對某種單抗的獨特型決定子的抗體,有可能鑑定出其它表達具有相同特異性的抗體的克隆。抗-Id抗體可以通過任何合適的技術進行改變(藉此產生抗-Id抗體變體)和/或衍生化,例如在本文它處關於本發明抗-TF抗體所描述的技術。例如,抗-Id單抗可以和載體如鑰孔血藍蛋白(KLH)偶聯,並用於免疫BALB/c小鼠。來自這些小鼠的血清通常含有抗-抗-Id抗體,其具有和原始/親本TF抗體相似(即使不相同)的結合性質。本發明進一步通過如下的實施例進行舉例說明,但它們不應視為進一步的限制。實施例實施例1組織因子(TF)的表達構建體產生了用於在HEK、NS0或CHO細胞中表達TF或其胞外域的完全密碼子優化構建體。由這些構建體編碼的蛋白質與TF的Genbank登錄號NP_001984相同。該構建體含有合適的用於克隆的限制位點和最優的Kozak序列(Kozak,1987)。將該構建體克隆在哺乳動物表達載體pEE13.4(LonzaBiologics)中(Bebbington,Renneretal.1992),獲得pEE13.4TF。使用PCR從該合成構建體擴增編碼TF胞外域(ECD)(胺基酸1-251)的部分,同時添加一個含有6個組氨酸殘基的C端His標籤(TFECDHis)。將該構建體克隆到pEE13.4中,並進行完全測序以確認構建體的正確性。實施例2在HEK-293F細胞中瞬時表達FreestyleTM293-F(一種適應懸浮生長和化學限定Freestyle培養基的HEK-293亞克隆,(HEK-293F))細胞從Invitrogen獲得,並用293fectin(Invitrogen)根據製造商的使用說明用合適的質粒DNA進行轉染。在抗體表達的情況下,共表達如實施例10中所述的合適重鏈和輕鏈載體。實施例3在NS0細胞中半穩定表達將pEE13.4TF穩定轉染到NS0細胞中,並在不含穀氨醯胺和存在7.5μM甲基亞碸亞胺(MSX)的條件下生長選擇穩定的克隆。讓克隆池(poolofclones)在懸浮培養基中生長,同時保持選擇壓力。池的TF表達通過FACS分析進行檢驗,並保全備用。實施例4在CHO細胞中穩定表達將pEE13.4TF穩定轉染到CHO-K1SV(LonzaBiologics)細胞中,並在不含穀氨醯胺和存在50μMMSX的條件下生長選擇穩定的克隆。挑取單克隆、擴增並通過如下所述的FACS分析進行TF表達檢驗。選擇高表達克隆並保全備用。實施例5帶His標籤TF的純化TFECDhis在IHEK-293F細胞中表達。TFECDHis中的his標籤使得用固定的金屬親和色譜進行純化成為可能。在該過程中,使固定在色譜樹脂上的螯合劑帶上Co2+陽離子。將含有TFECDHis的上清液與樹脂以分批模式(即溶液)溫育。帶His-標籤的蛋白質與樹脂珠子強力結合,而存在於培養上清液中的其它蛋白質則不會強力結合。溫育之後,從上清液中回收珠子,並填充進柱子中。清洗柱子以除去弱結合的蛋白質。然後用含有咪唑的緩衝液洗脫強結合的TFECDHis蛋白,其中咪唑與His競爭結合Co2+。通過在脫鹽柱上進行緩衝液交換從蛋白質中除去洗脫液。實施例6轉基因小鼠免疫程序人單抗小鼠每14天交替用5x106半穩定轉染的NS0-TF細胞或用20μgTFECDHis蛋白質進行免疫。總共實施8次免疫,4次腹腔內(IP)免疫和4次尾根皮下(SC)免疫。使用細胞的第一次免疫在完全弗氏佐劑(CFA;DifcoLaboratories,Detroit,MI,USA)中完成。對於全部其它免疫,細胞在PBS中IP注射,而TFECDHis用不完全弗氏佐劑(IFA;DifcoLaboratories,Detroit,MI,USA)SC注射。當血清滴度充分時(在如實施例7中所述的抗原特異性篩選測定方法中在至少2次連續的雙周篩選事件中發現1/50或更低稀釋的血清呈陽性),用溶於100μlPBS中的10μgTFECDHis蛋白在融合前4和3天進行額外的兩次靜脈內(IV)加強免疫(boosted)。使用細胞的第一次免疫在CFA中進行,對於所有其它各個(7個)免疫,細胞在PBS中IP注射。當發現血清滴度充分時,在融合前4和3天,小鼠用溶於100μlPBS中的1x106個瞬時半穩定轉染NS0-TF細胞IV額外加強免疫2次。實施例7同源抗原特異性篩選測定經免疫小鼠的血清或人單抗(人單克隆抗體)雜交瘤或轉染瘤培養物上清中抗-TF抗體的存在通過同源抗原特異性篩選測定(四分式)使用FluorometricMicrovolumeAssayTechnology(FMAT;AppliedBiosystems,FosterCity,CA,USA)加以確定。為此,組合使用3個基於細胞的測定系統和1個基於珠子的測定系統。在基於細胞的測定中,確定與TH1015-TF(瞬時表達TF的HEK-293F細胞;如上所述地產生)和A431(其在細胞表面上表達TF)以及HEK293野生型細胞(不表達TF,陰性對照)的結合。在基於珠子的測定中,測定對偶聯於鏈親和素珠子的生物素化的TF(SB1015-TF)的結合。將樣品添加到細胞/珠子以進行TF結合。隨後,用螢光偶聯物(山羊抗-人IgG-Cy5;JacksonImmunoResearch)檢測與人單抗的結合。小鼠抗-人TF抗體(ERL;在Genmab公司與Alexa-647偶聯)用作陽性對照,人單抗-小鼠合併血清(pooledserum)和小鼠-chrompure-Alexa647抗體用作陰性對照。樣品用AppliedBiosystems8200細胞檢測系統(8200CDS)進行掃描,並用「計數x螢光」作為讀出。實施例8人單抗雜交瘤生成對具有充分抗原特異性滴度發生(如上定義)的人單抗小鼠處以安樂死,收集脾臟和腹主動脈和腔靜脈兩側的淋巴結。通過電融合用CEEF50電融合系統(CytoPulseSciences,GlenBurnie,MD,USA)基本上按照製造商的使用說明進行脾細胞和淋巴結細胞與小鼠骨髓瘤細胞系的融合。所得的人單抗雜交瘤的選擇和培養根據標準方法進行(例如在下列文獻中所述:ColiganJ.E.,Bierer,B.E.,Margulies,D.H.,Shevach,E.M.andStrober,W.,eds.CurrentProtocolsinImmunology,JohnWiley&Sons,Inc.,2006)。實施例9純化的抗體的質譜將來自6孔或Hyperflask平臺的小份含有抗體的上清液(每份0.8ml)用含有蛋白G樹脂的PhyTip柱(PhyNexusInc.,SanJose,USA)在ScicloneALH3000工作站(CaliperLifesciences,Hopkinton,USA)上進行純化。PhyTtip柱的使用根據製造商的使用說明書,但是緩衝液用結合緩衝液PBS(B.Braun,MedicalB.V.,Oss,Netherlands)和洗脫緩衝液0.1M甘氨酸-HClpH2.7(FlukaRiedel-deBuchs,Germany)代替。純化後,樣品用2MTris-HClpH9.0(Sigma-Aldrich,Zwijndrecht,Netherlands)中和。或者,在一些情況下,用蛋白A親和柱色譜來純化較大體積的培養上清。純化後,將樣品置於384-孔板(Waters,100ul方孔板,部件號186002631)中。樣品用N-糖基化酶F(Roche批號11365177001在37℃過夜去糖基。添加DTT(15mg/ml)(1μl/孔)並在37℃溫育1h。樣品(5或6ul)在AcquityUPLCTM(Waters,Milford,USA)上用BEH300C18,1.7μm,2.1x50mm柱在60℃進行脫鹽。使用MQ水和LC-MS級乙腈(Biosolve,批號01204101,Valkenswaard,TheNetherlands),兩者均含0.1%甲酸(Fluka,批號56302,Buchs,Germany)分別作為洗脫液A和B。在以陽離子模式操作的micrOTOFTM質譜儀(Bruker,Bremen,Germany)上在線記錄飛行時間電噴霧離子化質譜。在分析之前,用ES調節預混劑(EStuningmix)(AgilentTechnologies,SantaClara,USA)校準900-3000m/z刻度。質譜用DataAnalysisTM軟體v.3.4(Bruker)進行去卷積,使用最大熵值算法(MaximalEntropyalgorithm)尋找5-80kDa之間的分子量。去卷積之後,對所得的全部樣品的重鏈和輕鏈質量進行比較,以發現重複的抗體。在重鏈的比較中,將C-端賴氨酸變體的可能存在納入考慮。結果得到了一系列獨特的抗體,其中「獨特」的定義是重鏈和輕鏈的獨特組合。在發現重複抗體的情況下,使用來自其它測試的結果決定哪個是繼續進行實驗的最佳材料。對118個TF特異雜交瘤的重鏈和輕鏈分子量進行MS分析,獲得了70個獨特的抗體(獨特的重鏈/輕鏈組合)。在若干功能測試中對它們進行了表徵,鑑定了14個前導候選物,TF特異抗體。實施例10抗-TF人單抗可變域的序列分析和到表達載體中的克隆從5x106個雜交瘤細胞製備抗-TF人單抗的總RNA,並從100ng總RNA使用SMARTRACEcDNA擴增試劑盒(Clontech)根據製造商的使用說明書製備5』-RACE-互補DNA(cDNA)。通過PCR擴增VH(重鏈可變區)和VL(輕鏈可變區)編碼區,並用ZeroBluntPCR克隆試劑盒(Invitrogen)克隆到pCR-BluntII-TOPO載體(Invitrogen)中。對於每個人單抗,對16個VL克隆和8個VH克隆進行測序。序列在本文的序列表和圖1中給出。表1A和表1B(下面)給出了抗體序列信息和最同源的種系序列的概況。表1A重鏈同源物表1B輕鏈同源物序列表參考:實施例11抗體純化將培養上清液通過0.2μm盲端過濾器(dead-endfilter)過濾,並裝載到5ml蛋白A柱(rProteinAFF,AmershamBioscience)上,用0.1M檸檬酸-NaOH,pH3洗脫。洗脫物立即用2MTris-HCl,pH9中和,並過夜透析到12.6mMNaH2PO4,140mMNaCl,pH7.4(B.Braun)中。透析後,樣品通過0.2μm盲端過濾器無菌過濾。通過SDS-PAGE確定純度,並通過比濁法和280nm吸光度測量濃度。將純化的抗體分成等分,並保存在-80℃。一旦融化,將純化的抗體等分保存於4℃。實施質譜來鑑定由如實施例9所述雜交瘤表達的抗體重鏈和輕鏈的分子量。實施例12用夾心-ELISA進行抗體交叉競爭研究用稀釋於PBS中的每種抗-TF人單抗(0.5或2μg/ml100μL/孔)在+4℃過夜包被ELISA平板孔。用PBS清洗ELISA孔,用溶於PBS的2%(v/v)雞血清(Gibco,Paisley,Scotland)在室溫下封閉1小時,並用PBS再次清洗。隨後,添加50μL抗-TF人單抗(10μg/mL),然後添加50μLTFECDHis(0.5或1μg/ml)(在Genmab產生;實施例5),並在RT溫育1小時(同時震蕩)。平板用PBST(PBS+0.05%吐溫)清洗3次,並用1:2000稀釋的抗-his生物素BAM050在RT溫育1小時(同時震蕩)。清洗平板,並與鏈親和素-聚HRP(Sanquin,Amsterdam,TheNetherlands)在RT溫育20分鐘,再次清洗。在黑暗中在RT下用ABTS(RocheDiagnostics)對反應物進一步顯色,15分鐘後通過添加2%(w/v)草酸終止反應,並測量405nm吸光度。表2顯示,可以鑑別出3個交叉阻斷組(cross-blockgroup)(彼此競爭結合TFECDHis的抗體組),其中抗體013,044和087-Lg63屬於一個交叉阻斷組(組I),抗體011,017-D12,42,092-A09和101屬於另一個交叉阻斷組(組II),抗體003,025,109和111屬於第三個交叉阻斷組(組III)。抗體114被發現能與來自交叉阻斷組II和III的抗體競爭結合TFECDHis。抗體098與TFECDHis的結合能夠被來自交叉阻斷組II和III的抗體競爭。表2–抗-TF抗體競爭對TFECDHis的結合.白框表示沒有競爭對TFECDHis的結合,淺灰色框表示部分競爭對TFECDHis的結合,深灰色框表示競爭對TFECDHis的結合。實施例13ELISA中抗-TF人單抗與TF胞外域的結合用ELISA評估所得抗-TF人單抗的特異性。ELISA板(Microlon;GreinerBio-One)用溶於PBS,pH7.的0.5μg/mLTFECDHis在+4℃過夜包被。清空已包被的ELISA平板,並用溶於PBS中的2%(v/v)雞血清(Gibco,Paisley,Scotland)室溫封閉1小時,並用含有0.05%吐溫20的PBS(PBST)清洗。隨後,將在PBSTC(補充有2%(v/v)雞血清和0.05%(v/v)吐溫-20的PBS)中系列稀釋的人單抗在震蕩狀態(300rpm)下RT溫育1小時。用1:5,000稀釋於PBSTC中的HRP-偶聯的山羊-抗-人IgG抗體(JacksonImmunoResearch)在震蕩狀態(300rpm)下RT溫育1小時,以檢測結合的人單抗。在黑暗中RT下用ABTS(RocheDiagnostics)對反應物進一步顯色,並在15-30分鐘後通過添加2%(w/v)草酸終止反應,然後測量405nm吸光度。用人單抗-KLH(針對KLH(鑰孔血藍蛋白)的人單克隆抗體)作為陰性對照。小鼠抗-人TF(ERL)用作陽性對照(HRP標記的抗-小鼠IgG作為偶聯物)。使用GraphPadPrismV4.03軟體用非線性回歸(可變斜率的S型劑量-應答)分析結合曲線。如圖3所見,所有抗-TF均結合TFECDHis。對人單抗的EC50值是3次實驗的平均值,為0.09-0.46nM不等(表3,見下面)。表3:實施例14抗-TF人單抗與膜結合TF的結合抗-TF人單抗與膜結合TF的結合通過FACS分析進行測定,使用TF轉染的CHO細胞或表達TF的腫瘤細胞系MDA-MB-231,(螢光素轉染)A431和Bx-PC3。將細胞懸浮在PBS中(2x106細胞/ml),置於96孔V-底平板(50μl/孔)中。向細胞添加50μl系列稀釋於FACS緩衝液(添加0.1%BSA和0.02%疊氮化鈉的PBS)中的人單抗,並在冰上溫育30分鐘。用FACS緩衝液清洗3次後,添加50μl藻紅蛋白(PE)偶聯的山羊-抗人IgGFc(JacksonImmunoResearch)(以1:100稀釋於FACS緩衝液中)。在冰上放置30分鐘後(黑暗中),清洗細胞3次,並在FACSCalibur(BDBiosciences)上通過流式細胞術檢測人單抗的特異結合。人單抗-KLH用作陰性對照。用小鼠抗-TF和隨後的PE-偶聯的抗小鼠IgGFc作為陽性對照。使用GraphPadPrismV4.03軟體(GraphPadSoftware,SanDiego,CA,USA)用非線性回歸(可變斜率的S型劑量-應答)分析結合曲線。圖4顯示了一個TF-特異人單抗與MDA-MB-231細胞的結合曲線的實例。表4給出了TF-特異人單抗與TF轉染的CHO細胞(S1015-TF),MDA-MB-231,A431和Bx-PC3細胞的結合EC50值的概覽。表4–通過FACS分析確定的TF-特異性人單抗與不同細胞類型的結合的EC50和最大平均螢光指數(最大MFI)值的概覽。EC50值以nM計。對MDA-MB-231,BxPC3和A431細胞的最大MFI為30μg/mL抗體,對於S1015-TF為7.5μg/mL抗體。實施例15抑制FVIIa與TF結合通過ELISA測量了TF-人單抗對FVIIa與TFECDHis結合的抑制。用TFECDHis(0.5μg/mL,100Μl/孔)過夜包被ELISA平板。倒空平板,用含有2%(v/v)雞血清的PBS封閉(1小時,RT),再次倒空。向孔添加4-倍系列稀釋的TF-人單抗或人單抗-KLH(陰性對照),隨後添加EC50濃度(100nM)的FVIIa,將平板在RT溫育1小時(同時震蕩,300rpm)。清洗平板,並用如上的兔-抗-FVIIa(2.5μg/mL;Abcam)溫育。清洗平板,並用豬-抗-兔IgG-HRP抗體(1:2,500;DAKO)溫育。清洗後,用ABTS作為底物顯現免疫複合體。通過添加2%v/v草酸終止反應,隨後用ELISA閱讀器測量405nm的光密度。用GraphPadprism(非線性回歸分析)計算獲得50%抑制(IC50)所需的抗體濃度。圖5顯示,來自交叉阻斷組II和III的抗體有效率地抑制了FVIIa與TF的結合,而來自交叉阻斷I組的抗體不能抑制FVIIa結合(或者抑制程度低很多)。表5顯示了FT特異人單抗對FVIIa與TF結合的抑制的IC50和最大抑制值(百分比)。表5–TF-特異性人單抗對FVIIa與TF結合的抑制的IC50值和最大抑制值(百分比)實施例16FVIIa誘導的ERK磷酸化的抑制在凝血因子VIIa(FVIIa)與TF結合時,觸發有絲分裂原活化激酶(p42和p44MAPK或ERK1和ERK2)的磷酸化。扁平上皮癌細胞系A431表達高水平的TF,並且根據AlphaScreenSurefireERK測定系統(PerkinElmer)測量,在用FVIIa刺激後,在10分鐘內誘導了最佳(3-5倍)的ERK磷酸化(ERK-P)。將A431細胞(30,000個細胞/孔)接種於96孔TC板內,並在無血清培養基(含有20%HAS和青黴素/鏈黴素的RPMI)中培養過夜(37℃,5%CO2,85%溼度)。然後用DMEM(無添加劑)替換培養基,並將細胞溫育1.5小時。添加3倍系列稀釋的TF-人單抗或人單抗-KLH,並將細胞溫育0.5小時。然後,用FVIIa以EC80濃度刺激細胞(50nM;10分鐘;37℃,5%CO2,85%溼度)。用PBS清洗一次細胞,並用25μL裂解緩衝液(PerkinElmer,Surefire試劑盒)裂解。對裂解物進行離心(3分鐘,330xg,RT)。將4μL上清轉移到384孔Proxiplate中(PerkinElmer)。添加7μL含有AlphaScreen珠子(PerkinElmer,Surefire試劑盒)的反應緩衝液/活化緩衝液預混物,在黑暗下在RT溫育平板2小時。用EnVisiontechnology的「SurefirePlus」規程讀取平板。圖6顯示,用AlphaScreenSurefireERK測定系統測量,抗體013不抑制FVIIa誘導的ERK磷酸化,044和111中等抑制ERK磷酸化,並且全部其它抗體可高效地阻斷ERK磷酸化。表6顯示了TF-特異人單抗對FVIIa誘導的ERK磷酸化的IC50值和最大抑制值(百分比),使用AlphaScreenSurefireERK測定系統測得。表6-TF-特異性人單抗對FVIIa誘導的ERK磷酸化(用AlphaScreenSurefireERK測定系統測量)的IC50值和最大抑制值(百分比)在AlphaScreenSurefireERK測定中所得的結果通過Western印跡分析加以確認,使用HaCaT和BxPC3細胞系。將30,000細胞/孔接種在含有最小濃度血清的DMEM(飢餓培養基)中,並過夜培養。細胞在無血清的DMEM中進一步培養2小時,在培養的最後30分鐘內添加抗-TF抗體。細胞用0,10或50nMFVIIa刺激10分鐘(37℃),隨後在細胞裂解液中裂解(每孔50μL裂解緩衝液,在震蕩條件下裂解30-60分鐘,RT)。向每個樣品添加含有25μLSDS的樣品緩衝液。將樣品加載到SDS-PAGE凝膠上,運行,並用標準western印跡程序進行印跡。印跡用含有5%無關蛋白(ELK)的TBST1x在RT下封閉1小時。用兔抗-ERK-P抗體溫育印跡(O/N,4℃)。用TBST1x清洗印跡,並用抗-兔IgGHRP溫育(1小時,RT),清洗,用HRP底物顯影,用OptigoUltima成像系統(IsogenLifeSciences)成像。圖6顯示了BxPC3細胞中抗體的一個亞組(sub-panel)的結果。10nMFVIIa誘導的ERK磷酸化沒有被抗體013抑制,但是被抗體111、044和025有效抑制(後者是這裡所描述的所有其他TF-特異性人單抗的一個實例)。更強烈誘導的ERK磷酸化(50nMFVIIa)不被抗體013、111和044抑制,但是被抗體025抑制。實施例17對FVIIa誘導的IL-8釋放的抑制用MDA-MB-231細胞測試TF特異性人單抗抑制FVIIa誘導的IL-8釋放的能力。將細胞接種於96孔板(60,000細胞/孔),並在含有CS、丙酮酸鈉、l-穀氨醯胺、MEMNEAA和青黴素/鏈黴素的DMEM中培養(O/N,37℃,5%CO2)。除去組織培養基,在無血清、高鈣培養基(含有青黴素/鏈黴素的DMEM)中清洗2次,在這種培養基中再培養105分鐘。添加系列稀釋的抗體並將細胞培養15分鐘。添加FVIIa(NovoNordisk;終濃度10nM),將細胞培養5小時。移出上清液並離心(300xg,RT)。用IL-8ELISA試劑盒根據製造商的方案(Sanquin)測量上清液中IL-8的濃度。圖7顯示,來自交叉阻斷組II和III的抗體高效抑制FVIIa誘導的MDA-MB-231細胞的IL-8釋放,但來自相互作用組III的抗體111除外。來自交叉阻斷組I的抗體(013,044和87-Lg6)全部不能抑制FVIIa誘導的IL-8釋放。表7顯示了TF-特異性人單抗抑制FVIIa誘導的IL-8釋放的IC50值和最大抑制值(百分比)。表7-TF-特異性人單抗抑制FVIIa誘導的IL-8釋放的IC50值和最大抑制值(百分比)。實施例18抑制FXa生成在如下的測定系統中測試TF特異性人單抗抑制FXa生成的能力,其中用比色FXa特異性底物測量TF/FVIIa複合體作用下FX向FXa的轉變。向平底96孔板添加TF(Innovin)以及系列稀釋的TF特異性人單抗、陽性對照(小鼠抗-TF)和陰性對照(人單抗-KLH)(全部均稀釋在含有3mMCaCl2的Hepes緩衝液中)。平板在RT下溫育30分鐘,並添加FVIIa(終濃度1nM)和FX(ERL;終濃度200nM)。平板在37℃溫育30分鐘。從每孔取50μl轉移到含有終止緩衝液(溶於100mlHepes緩衝液中的5mMEDTA)(預熱的,37℃)的96孔板中。添加FXa特異性底物Chromogenix-2765(InstrumationLaboratoryCompany),將平板在37℃溫育60分鐘,並測量37℃的OD405nm。圖8顯示,抗體017-D12強烈抑制FXa生成,013顯示中等抑制,其它抗體對FXa生成顯示較低的抑制或者沒有抑制。表8顯示了TF-特異性人單抗抑制FXa生成的IC50值和最大抑制值(百分比)。分組人單抗TFIC50nM%最大抑制I130.0531I44NA3I87-Lg6ntntII110.0526II017-D120.2884II42ntntII092-A090.3021II101ntntII/III980.4314II/III1140.2421III30.0721III250.3019III1090.0918III1110.077表8-TF-特異人單抗抑制FXa生成的IC50值和最大抑制值(百分比)。實施例19抑制凝血用確定TF誘導的凝血時間的測定系統測量TF-人單抗對凝血的抑制。在96孔板中製備如下的混合物:17μl100mMCaCl2(終濃度17mM),10μl1:100innovin(終濃度1:1000),23μl1xHEPES緩衝液和50μl系列稀釋的抗體。向Immulon2B平板(ThermoElectron)的孔中添加50μl合併的人血漿。向Immulon2b平板添加50μl製備好的抗體混合物,用動力學讀板器每15秒測量405nm的凝血發展(coagulationdevelopment),共25分鐘。將光密度的增加相對時間作圖,並計算凝血時間(t1/2)。將凝血時間相對抗體濃度作圖。使用GraphPadPrism通過非線性回歸分析從該結果計算抗體誘導的抑制凝血的IC50。圖9顯示,抗體044、087和111不抑制TF誘導的凝血,而所有其它抗體則抑制。表9顯示了TF-特異性人單抗抑制凝血的IC50值。表9-TF-特異性人單抗抑制凝血的IC50值.實施例20抗體依賴的細胞介導的細胞毒性靶細胞的製備收集表達TF的靶細胞(5x106個Bx-PC3細胞,MDA-MB-231細胞或A431細胞),清洗(在PBS中清洗2次,1500rpm,5min),並收集在1mlRPMI1640培養基中,該培養基中補充了加強型小牛血清(cosmiccalfserum)、丙酮酸鈉、L-穀氨酸、MEMNEAA和青黴素/鏈黴素,並添加100μCi51Cr(鉻-51;AmershamBiosciencesEuropeGmbH,Roosendaal,TheNetherlands)。將混合物在震蕩水浴中37℃溫育1小時。清洗細胞(PBS中清洗2次,1500rpm,5min)後,將細胞重懸浮在培養基中,並通過臺盼藍排斥計數活細胞。將活細胞濃度調節為1x105細胞/ml。效應物細胞的製備:用標準Ficoll密度離心根據製造商的使用說明(淋巴細胞分離介質;Lonza,Verviers,France)從新鮮棕黃層(buffycoat)(Sanquin,Amsterdam,TheNetherlands)分離外周血單個核細胞(PBMCs)。將細胞重懸浮在培養基中後,通過臺盼藍排斥計數細胞,並將濃度調節到1x107細胞/ml。ADCC設置:將50μl51Cr-標記的靶細胞轉移到微滴定孔中,並添加50μl系列稀釋(稀釋於培養基中)的抗體。溫育細胞(RT,15min),並添加50μl效應物細胞,得到的效應物與靶標的比例為100:1。為了確定最大裂解水平,添加100μl5%Triton-X100代替效應物細胞;為了確定自發裂解水平,添加100μl培養基;為了確定不依賴抗體的裂解水平,添加50μl效應物細胞和50μl培養基。隨後,在37℃,5%CO2溫育細胞過夜。將細胞離心沉降後(1200rpm,3min),將75μl上清轉移到MICRONIC管中。在γ讀數器中計數釋放出的51Cr,如按照下式計算抗體介導的裂解百分比:((cpm樣品–cpm不依賴抗體的裂解)/(cpm最大裂解-cpm自發裂解))x100%其中cpm是每分鐘計數(countsperminute)。圖10顯示,全部測試的TF-人單抗均誘導了ADCC對Bx-PC3細胞的裂解,儘管效力不同(EC50)。表10顯示了TF-特異性人單抗對不同細胞系ADCC的EC50值(nM)。表10-TF-特異性人單抗對不同細胞系ADCC的EC50值(nM)。實施例21補體沉積通過FACS分析測量補體片段C3c和C4c在與TF-人單抗溫育過的靶細胞上的沉積。將表達TF的靶細胞(Bx-PC3或MDA-MB-231細胞)於含有1%BSA的RPMI中播種於96孔圓底平板(1x10e5個細胞/孔)中。添加抗體(30μg/mL),在RT下溫育細胞15分鐘。添加25μL合併人血清作為補體源,使用熱滅活的人血清確定自發補體結合。細胞在37℃溫育45分鐘。清洗細胞1次,並在FACS緩衝液中與抗人C3cFITC或抗人C4cFITC(DAKO)溫育,並在冰上溫育30分鐘。用FACSCanto分析樣品。圖11顯示,來自交叉阻斷組I的抗體不能誘導C3c或C4c在BxPC3或MDA-MB-231細胞上的沉積。測試的所有來自交叉阻斷組II的抗體均誘導C3c和C4c沉積,來自交叉阻斷組III的抗體也一樣,但抗體003除外。實施例22:親合力/親和力研究親和力確定在BIAcore3000(GEHealthcare)中通過表面等離子體共振分析抗體與TF的結合。使用TFECDHis進行分析。根據製造商推薦的實驗方案將人單抗抗體(500個共振單位)固定在CM-5傳感器晶片上。簡而言之,在用EDC和NHS表面活化後,將人單抗抗體注射到活化的CM-5表面上,其中抗體置於10mMpH4.0-5.5的醋酸鈉中,速度為5μl/min,隨後用1M乙醇胺去活化。將溶於HBS-EP緩衝液中的系列濃度的TFECDHis注射到固定的抗體上,流速為30μl/min,持續180秒。通過注射10mM甘氨酸-HClpH2.0或10mM醋酸鈉pH3.0進行人單抗表面再生。用雙參比差減法(doublereferencesubtraction)和模型1:1(朗格繆爾)結合分析進行動力學分析。表11顯示,對於大多數人單抗,所測得的親和力處於(亞)納摩爾範圍。但不是從全部抗體均能夠測定動力學參數。044確實具有高的解離速率(kd)變差,並具有高殘差(residual),這意味著曲線擬合不好。098、111和087-Lg6的解離速率太高,以至Biacore3000不能測量。n.a.不可評估=>10-3sec-1表11.TF-人單抗對TFECDHis的反應性的動力學常數—親和力測量親合力測定TF(TFECDHis)與TF-特異人單抗結合的測定基本上如上所述,其中將TFECDHis固定在CM-5傳感器晶片上(300個共振單位),使用系列濃度的人單抗抗體進行動力學分析。動力學分析使用雙參比差減(doublereferencesubtraction)和模型1:1(朗格繆爾)結合分析來進行。表12顯示了抗體11,98,109和111的親合力測量結果。儘管98和111的親和力測量結果顯示高解離速率(超過Biacore的測定極限(i.e.>10-3)),親合力測定則顯示出納摩爾範圍內的互作。分組人單抗TF親合力nMII110.47II/III984.85III1090.01III1110.11表12.TFECDHIS對TF-人單抗–親合力測量反應的動力學常數實施例23:與正常人組織和胰腺腫瘤結合的免疫組織化學分析TF-人單抗與各種已知表達TF的人組織(結腸、心臟、腎臟、皮膚、肺和腦)的結合通過免疫組織化學(IHC)進行測定。對冷凍組織的IHC切割冷凍組織切片(4-6μm厚),並固定在丙酮中。封閉內源組織過氧化物酶(PO),並且用正常的人血清預溫育組織切片,以除去後面施用的抗體對內源Fc受體的非特異結合。將針對人TF的小鼠抗體(和陰性對照小鼠抗體)以最佳稀釋度施用在組織上,隨後用Powervision-PO(山羊抗-小鼠/-兔IgG)-PO進行檢測。將TF特異性的人單抗與Fab'山羊抗-人IgG(Fc)-FITC偶聯,之後以3個稀釋度施用於冷凍的組織切片,包括一個預先確定的最佳稀釋度。隨後,通過兔抗-FITC和Powervision-PO檢測人單抗-Fab-FITC複合體。用AEC作為底物使PO活性可視化,細胞核用蘇木精可視化。染色通過亮場顯微鏡分析。在福馬林固定和石蠟包埋(FFPE)的組織上使用小鼠抗體的IHCFFPE組織活檢以4μm切片,脫蠟,封閉內源組織過氧化物酶,並進行抗原恢復(retrieval)(pH6,檸檬酸緩衝液)。用小鼠抗體溫育前,將組織切片在正常人血清中預溫育,以防止與內源Fc受體的非特異結合。將針對人TF的小鼠抗體(和陰性對照小鼠抗體)以最佳稀釋度施用於組織切片,隨後用Powervision-PO(山羊抗-小鼠/-兔IgG)-PO進行檢測。PO活性用AEC作為底物可視化,細胞核用蘇木精可視化。染色通過亮場顯微鏡分析。圖12顯示了抗體013(陽性染色)、011(陽性染色)、114(陽性染色)和111(中間染色)與腎小球的結合實例。抗體098和044沒有結合腎小球。表13給出了全部TF-人單抗在人腎臟所有被檢測組織中的染色結果的概覽。表13.人腎小球的IHC染色表14給出了所選TF-特異性人單抗在人腎臟、結腸、心臟、大腦和皮膚以及人胰腺腫瘤中的染色結果Ab人腎人結腸人心臟人大腦人皮膚胰腺腫瘤13腎小體+基底膜++-+表皮++++114腎小體++基底膜++-++表皮++++++11腎小體+基底膜++-++n.a.(+)+++44-基底膜+-+/-n.a.++98-基底膜+-+/-n.a.(+)+++111腎小體+/-基底膜+-+n.a.+++表14.正常人組織和胰腺腫瘤的IHC染色TF-人單抗與人胰腺腫瘤結合的IHC分析顯示所有TF-人單抗均有陽性染色(圖13舉例說明)。實施例24:對SCID小鼠乳腺脂肪墊中已建立的MDA-MB-231腫瘤異種移植物的治療在SCID小鼠體內已建立的原位MDA-MB-231異種移植物腫瘤中確定TF-人單抗的體內效力。將2x106個置於PBS中的腫瘤細胞皮下注射在雌性SCID小鼠第二乳腺脂肪墊內,隨後當腫瘤尺寸變得可以測量時開始用TF-人單抗或對照單抗(人單抗-KLH)進行治療。抗體在第21天(260μg/小鼠),28天(130μg/小鼠)和42天(130μg/小鼠)注射。腫瘤體積至少每周測量2次。由卡尺(PLEXX)測量結果計算體積(mm3):0.52x(長度)x(寬度)2。圖14顯示,抗體114、111、013、098、011和044全部能夠有效抑制已經建立的原位MDA-MB-231腫瘤生長。實施例25:TF-特異性人單抗在食蟹猴中的試驗性重複給藥(Pilotrepeatdosing)為了獲得關於TF-特異性人單抗毒理學的初步信息,包括評估抗體幹擾凝血級聯並因此潛在地增加暴露動物的出血風險的能力,在食蟹猴中進行了試驗性重複劑量給藥研究。兩隻雄性和兩隻雌性食蟹猴(Macacafascicularis),年齡為大約2年,接受靜脈內注射抗體011:-研究第1天:0mg/kg(僅溶媒(vehicle))-第8天:1mg/kg;1mL/分鐘-第15天:10mg/kg;1mL/分鐘-第22天:100mg/kg;1mL/分鐘跟蹤動物達27天,在該時間點使動物安樂死,進行屍體解剖和器官組織學評估。主要的研究終點為:-臨床觀察:每天確定從牙齦、眼出血的跡象。-功能性出血時間和失血:在第1、8、15和22天(給藥後1、24和120h)和在2個試驗前時間點進行測定。-血液/血液痕跡/血塊:全部組織進行HE染色(在最終處死時獲得的組織上確定)-尿液、糞便、嘔吐物中的血液:每天/每周確定。重複或增加劑量給藥的抗體011沒有觀察到表觀毒性。動物沒有顯示臨床徵候,沒有細胞因子釋放的徵象。此外,沒有表明凝血系統受損或系統性出血的表觀臨床跡象。在給藥後1小時的時間點,第22天的平均出血時間顯著長於在第1天觀察到的結果(p=0.012)。第8、15和22天與第1天相比,沒有其它統計學上顯著的差異。而且,發現對主要器官沒有表觀毒性並且沒有不利的血液學影響。從該研究中得到的關於組織的組織學評估的初步結論是,在4隻被處理的動物中沒有可以歸因為測試物處理的組織學發現。圖15顯示了每隻動物的各個數據點(二個重複樣品),作為時間的函數。在第1、8、15和22天(1、24和120h)以及兩個試驗前(pre-trial)時間點測定4隻動物的出血時間。實施例26在SCID小鼠中預防和治療性處理BxPC3腫瘤異種移植物確定了TF-人單抗在預防和治療性處理SCID小鼠中BxPC3細胞異種移植物的體內效力。將10x106個置於PBS中的BxPC3腫瘤細胞皮下注射在雌性SCID小鼠體內,隨後用TF-人單抗或對照單抗(人單抗-KLH)進行治療。對於預防性治療,在腫瘤誘導1小時後腹腔注射抗體(400μg/小鼠)。對於治療性處理,在腫瘤誘導8天後開始注射抗體(300μg/小鼠),隨後每周進行抗體注射(150μg/小鼠)。腫瘤體積每周至少測定2次。體積(mm3)由卡尺(PLEXX)測量結果計算:0.52x(長度)x(寬度)2。圖16顯示,TF特異的性人單抗能夠預防性以及治療性處理BxPC3異種移植腫瘤。實施例27鼠和人TF之間的DNA改組,以確定對結合抗-TF人單抗重要的域為了確定對抗-TF人單抗與人TF的結合重要的域,在人和小鼠TF之間進行DNA改組。通過用鼠的域替換人的域從編碼人TF的DNA製備改組構建體,並通過用人域替換鼠域從編碼鼠TF的DNA製備改組構建體。如果人TF中的某個域對抗-TF人單抗的結合重要,那麼當用鼠域替換時,結合將喪失。人和鼠TF在蛋白質水平具有57%同源性。圖17A和17B顯示了含有鼠TF域的人TF構建體(TFhs,含有TFmm域),和含有人TF域的鼠TF構建體。用構建體或者單獨的載體(pcDNA3.3SP;模擬)瞬時轉染HEK293F細胞。基本上如上所述進行FACS分析,使用30μg/mL純化的親本材料。人單抗-KLH用作對照抗體。圖17顯示,除一個之外,全部的抗-TF人單抗都僅與人TF結合,而不與鼠TF結合。人單抗-TF-003顯示與鼠TF的一些結合。圖18A-O顯示了不同抗-TF人單抗與在HEK293F細胞上表達的構建體的結合結果。這些結果在表15中概括。在該表中,根據人TF上對這些人單抗的結合重要的域將這些抗-TF人單抗分組。表15實施例28抗-TF人單抗的Fab片段與TF胞外域的結合(通過ELISA測定)和與BxPC3細胞上的細胞TF的結合(通過FACS測定)通過ELISA(包被TF的胞外域)和FACS(BxPC3細胞上的TF)測量抗-TF人單抗的Fab片段與TF的結合。ELISA基本上如前文所述進行。結合的Fab片段用HRP偶聯的驢-抗人H+L進行檢測。FACS分析基本上如前文所述進行。使用FITC偶聯的山羊抗-人IgG(H+L)(Jackson)檢測結合的前導候選物。螢光在FACSCantoII上測量。結合曲線的分析用GraphPadPrism5軟體如前文所述地進行。圖19顯示,與人單抗-TF-011Fab片段相比,人單抗-TF-098和-111Fab片段顯示與TF胞外域的結合較少(通過ELISA測量)。圖20顯示,與人單抗-TF-011Fab片段相比,人單抗-TF-098和-111Fab片段顯示與細胞TF的結合較少(通過對BxPC3細胞的FACS測量)。表16顯示人單抗-TFFab片段與TF胞外域的結合EC50值(通過ELISA確定)和與細胞TF的結合EC50值(通過BxPC3細胞的FACS測量)。表16-人單抗-TFFab片段與TF胞外域的結合EC50值(通過ELISA測定)和與BxPC3細胞上細胞TF的結合的EC50值(通過FACS測定)的概覽。EC50值以μg/mL計。Na-不能計算。實施例29抗-TF單抗與表達不同水平TF的細胞系的結合通過FACS分析測定抗-TF人單抗與表達不同水平TF的細胞系上的膜結合TF的結合,基本上如前文所述。陽性對照使用小鼠抗-TF抗體後續PE-偶聯的抗-小鼠IgGFc。螢光在FACSCantoII上測量。結合曲線的分析用GraphPadPrism5軟體基本上如前文所述地進行。細胞系上TF分子的量通過Qifi試劑盒(Dako,Glostrup,Denmark)按照製造商的使用說明書加以確定。測得SW480細胞每個細胞表達~20,000個TF分子,SK-OV-3細胞每個細胞表達~60,000個分子,AsPC-1細胞每個細胞表達~175,000個分子,而MDA-MB-231細胞每個細胞表達~900,000個分子。圖21在高表達TF的細胞系MDA-MD-231中,人單抗-TF-98和-111顯示與人單抗-TF-11,-13和109相似的結合特性。在每個細胞TF分子數較低的細胞系,例如SK-OV-3和SW480細胞系中,人單抗-TF-98和111顯示與其它人單抗-TF抗體不同的結合特性。當前第1頁1 2 3 
