過表達N‑糖基化途徑調節基因以調節重組蛋白的糖基化的製作方法
2023-05-27 22:17:01 2
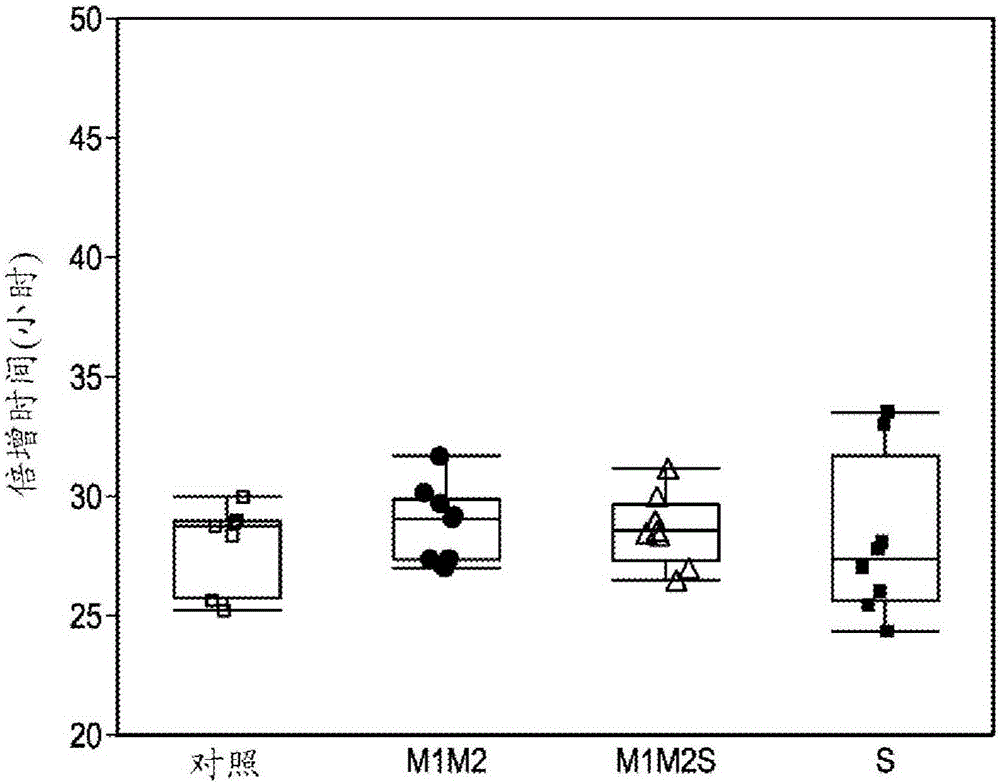
本發明總體上涉及用於調節由細胞培養物(包括哺乳動物細胞細胞培養物,諸如CHO細胞培養物)產生的重組蛋白的一個或多個特性的方法。相關申請的交叉引用本申請要求2014年1月29日提交的美國臨時申請號61/933,192的權益,所述申請以引用的方式併入本文。發明背景糖基化是哺乳動物細胞中常見的翻譯後修飾;正常人免疫球蛋白和中國倉鼠卵巢(CHO)細胞中產生的治療性單克隆抗體(mAb)都是糖蛋白。治療性mAb的藥代動力學特性和效應功能都可受糖基化影響。末端糖諸如巖藻糖和半乳糖可影響抗體依賴性細胞毒性(ADCC)和補體依賴性細胞毒性(CDC;Wright,A.和S.L.Morrison,TrendsBiotechnol(1997)15:26-32)。高甘露聚糖可增加某些mAb的血清清除率,因此潛在地影響了功效(Goetze等,(2011)Glycobiology21:949-59)。另選地,高甘露糖糖型可增加FcγIII受體的抗體親和性,因此增加了某些抗體的ADCC活性(Yu等(2012)MAb4:475-87)。因此,對於每個重組mAb,需維持某些最好地支持mAb治療潛力的糖基化特性。用於在細胞培養中操控蛋白質的高甘露糖糖型含量的方法包括改變培養基組成、重量摩爾滲透壓濃度、pH、溫度等(Yu等,同上,Pacis等,同上,CheeFurngWong等(2005)BiotechnolBioeng89:164-177;Ahn等(2008)BiotechnolBioeng101:1234-44)。這些方法的有效性對於細胞系、分子類型和培養基環境是特異的,並且通常通過試錯法來獲得。另選地,這些方法可能也會改變抗體生產率、細胞培養物行為和其他抗體質量屬性。仍存在鑑定可在沒有降低CHO生產培養物性能和抗體產率的情況下調控mAb上的高甘露糖糖型(特別是甘露糖5)的機制的需要。這種方法將有益於治療性蛋白質的工藝過程開發。本發明提供一種通過操控涉及N-糖基化途徑的蛋白質的表達水平來調控高甘露糖糖型含量的方法。發明概述本發明提供一種用於在哺乳動物細胞培養過程期間調控重組蛋白的高甘露糖糖型含量的方法,其包括轉化宿主細胞以過表達涉及N-糖基化途徑的蛋白質。本發明還提供一種用於在哺乳動物細胞培養過程期間減少重組蛋白的高甘露糖糖型含量的方法。在一個實施方案中,蛋白質是N-乙醯基-葡萄糖胺轉移酶-1(由Mgat1編碼);在本發明的另一個實施方案中,蛋白質是N-乙醯基-葡萄糖胺轉移酶-2(由Mgat2編碼)。在本發明的再一個實施方案中,蛋白質是UDP-半乳糖轉運蛋白(由Slc35a2編碼)。本發明的附加實施方案包括轉化宿主細胞以過表達兩種或更多種涉及N-糖基化途徑的蛋白質,包括上述蛋白質的組合。在一個實施方案中,用Mgat1和Mgat2轉化宿主細胞;在其他實施方案中,用Mgat1和Slc35a2、用Mgat2和Slc35a2或者用Mgat1、Mgat2和Slc35a2轉化宿主細胞。本發明還提供先前已經過轉染以表達重組蛋白的宿主細胞系的轉染。在一個實施方案中,重組蛋白是包含抗體Fc區的蛋白質。再一個實施方案包括表達選自由Fc融合蛋白、抗體、免疫球蛋白和肽體組成的組的重組蛋白的宿主細胞。在再一個實施方案中,首先轉染宿主細胞以過表達Mgat1、Mgat2和Slc35a2中的一種或多種,然後進行轉染以表達重組蛋白。在一個實施方案中,重組蛋白是包含抗體Fc區的蛋白質。再一個實施方案包括選自由Fc融合蛋白、抗體、免疫球蛋白和肽體組成的組的重組蛋白的表達。任選地,本發明還包括收穫由細胞培養物產生的重組蛋白的步驟。在再一個實施方案中,將宿主細胞產生的重組蛋白純化並配製成藥學上可接受的製劑。在再一個實施方案中,重組蛋白的高甘露糖糖型含量與由細胞未通過轉染以過表達涉及N-連接糖基化的蛋白質來進行操控的培養物產生的重組蛋白相比是減少的。在一個實施方案中,高甘露聚糖物質為甘露糖5(Man5)。在另一個實施方案中,高甘露聚糖物質為甘露糖6(Man6)、甘露糖7(Man7)、甘露糖8(包括甘露糖8a和8b;Man8a和8b或甘露糖9(Man9)。在再一個實施方案中,高甘露聚糖物質包括Man5、Man6、Man7、Man8a、Man8b和/或Man9的混合物。本發明提供重組蛋白高甘露糖糖型含量減少的再一個實施方案。在再一個實施方案中,重組蛋白的高甘露糖糖型含量小於或等於5%。在另一個實施方案中,重組蛋白的高甘露糖糖型含量小於或等於10%。在再一個實施方案中,由本發明的細胞培養物產生的重組蛋白的高甘露糖糖型含量小於6%、7%、8%、9%或10%。在又一個實施方案中,由本發明的細胞培養物產生的重組蛋白的高甘露糖糖型含量小於0.5%、1%、2%、3%、4%或5%。再一個實施方案包括小於12%、小於15%、小於20%或小於30%、40%或50%的高甘露糖糖型含量。附加的實施方案包括使用分批或補料分批培養物和使用灌流培養物。在一個實施方案中,使用交替式切向流(ATF)灌流所述培養物。與本文描述的本發明的任何實施方案相結合,根據需要還可向培養容器中添加消泡劑。可選地或此外,使用1M碳酸鈉或另一種適合的鹼來使pH維持在所需設定值。如本文所述,在本發明的一個方面,可通過灌流維持細胞培養物。在一個實施方案中,灌流開始於細胞培養的第1天或大約第1天至第9天或大約第9天。在一個相關實施方案中,灌流開始於細胞培養的第3天或大約第3天至第7天或大約第7天。在一個實施方案中,灌流在細胞已達到生產期時開始。在本發明的再一個實施方案中,灌流通過交替式切向流來完成。在一個相關實施方案中,通過交替式切向流使用超濾器或微濾器來完成灌流。在本發明的再一個實施方案中提供了連續灌流;在又一個實施方案中,灌流速率是恆定的。在本發明的一個實施方案中提供了以每天小於或等於1.0個工作容積的速率進行的灌流。在一個相關實施方案中,在細胞培養期間以在生產期期間從每天0.25個工作容積增加至每天1.0個工作容積的速率進行灌流。在另一個相關實施方案中,在細胞培養的第9天至第11天以達到每天1.0個工作容積的速率進行灌流。在另一個相關實施方案中,在細胞培養的第10天以達到每天1.0個工作容積的速率進行灌流。在一個實施方案中,細胞培養物在培養的第3天-第7天之前接受灌注細胞培養基補料。在本發明的又一方面,通過分批補料來維持細胞培養物。在補料分批培養的一個實施方案中,所述培養物在生產期間補料三次。在再一個實施方案中,所述培養物在第二天與第四天之間的一天、在第5天與第7天之間的一天以及在第8天與第10天之間的一天補料。另一個實施方案提供了所述培養物在生產期間補料四次的補料分批法。在又一個實施方案中,所述培養物在第二天與第四天之間的一天、在第5天與第6天之間的一天、在第7天與第8天之間的一天以及在第8天與第10天或更遲之間的一天補料。根據本發明的一個實施方案,哺乳動物細胞培養物通過用無血清培養基中的至少0.5x106個細胞/mL至3.0x106個細胞/mL接種生物反應器來建立。在一個可選或再一個實施方案中,哺乳動物細胞培養物通過用無血清培養基中的至少0.5x106個細胞/mL至1.5x106個細胞/mL接種生物反應器來建立。本發明還可包括培養期間的溫度變化。在一個實施方案中,溫度變化為36℃至31℃。在一個實施方案中,本發明還包括36℃至33℃的溫度變化。在一個相關實施方案中,溫度變化發生在生長期與生產期之間的過渡處。在一個相關實施方案中,溫度變化在生產期期間發生。在另一個實施方案中,本發明還包括通過L-天冬醯胺飢餓隨後用具有5mM或更少的L-天冬醯胺濃度的無血清灌流培養基灌流來誘導細胞生長停滯。在另一個實施方案中,本發明還包括通過用具有5mM或更少的L-天冬醯胺濃度的無血清灌流培養基灌流來誘導細胞生長停滯。在一個相關實施方案中,無血清灌流培養基中L-天冬醯胺的濃度小於或等於5mM。在一個相關實施方案中,無血清灌流培養基中L-天冬醯胺的濃度小於或等於4.0mM。在一個相關實施方案中,無血清灌流培養基中L-天冬醯胺的濃度小於或等於3.0mM。在一個相關實施方案中,無血清灌流培養基中L-天冬醯胺的濃度小於或等於2.0mM。在一個相關實施方案中,無血清灌流培養基中L-天冬醯胺的濃度小於或等於1.0mM。在一個相關實施方案中,無血清灌流培養基中L-天冬醯胺的濃度為0mM。在一個相關實施方案中,在L-天冬醯胺飢餓之前或期間監控細胞培養基的L-天冬醯胺濃度。在又一個實施方案中,本發明包括在生產期期間細胞壓積小於或等於35%。在一個相關實施方案中,所述細胞壓積小於或等於35%。在一個相關實施方案中,所述細胞壓積小於或等於30%。在一個相關實施方案中,在小於或等於35%的細胞壓積時的哺乳動物細胞培養物的活細胞密度為10x106個活細胞/ml至80x106個活細胞/ml。在另一個實施方案中,所述哺乳動物細胞培養物的活細胞密度為20x106個活細胞/ml至30x106個活細胞/ml。在又一個實施方案中,生物反應器的容量為至少500L。在又一個實施方案中,生物反應器的容量為至少500L至2000L。在又一個實施方案中,生物反應器的容量為至少1000L至2000L。在又一個實施方案中,所述哺乳動物細胞是中國倉鼠卵巢(CHO)細胞。在又一個實施方案中,重組蛋白選自由人抗體、人源化抗體、嵌合抗體、重組融合蛋白或細胞因子組成的組。附圖簡述圖1展示在用於實施例2中第一組補料分批培養物的細胞系的傳代期間倍增時間的克隆可變性。在這個實施例中,使來自表達MAbB的細胞系的細胞轉化以過表達Mgat1、Mgat2和/或Slc35A2。M1M2表示過表達Mgat1和Mgat2(由實心圓代表的個別克隆)的細胞系;M1M2S表示過表達Mgat1、Mgat2和Slc35a2(由空心三角形代表的個別克隆)的細胞系;並且S表示過表達Slc35A2(由實心正方形代表的個別克隆)的細胞系。用空載體轉化對照細胞(由空心正方形代表的個別克隆)。中央方框涵蓋第一四分位數(Q1)至第三四分位數(Q3),並且方框的高度為四分位數間距(IQR),方框內的條帶是中值,如果沒有值大於Q3+1.5IQR,則上線(topwhisker)從Q3延伸至低於Q3+1.5IQR的最大值或極大值。如果沒有值小於Q1-1.5IQR,則下線(bottomwhisker)從Q1延伸至高於Q1-1.5IQR的最小值或極小值。圖2展示在用於實施例2中第二組補料分批細胞的細胞系的傳代期間倍增時間的克隆可變性。在這個實施例中,使來自表達MAbB的細胞系的細胞轉化以過表達Mgat1、Mgat2和/或Slc35A2。M1M2表示過表達Mgat1和Mgat2的細胞系;M1M2S表示過表達Mgat1、Mgat2和Slc35a2的細胞系;並且S表示過表達Slc35A2的細胞系。用空載體轉化對照細胞。如對圖1所描述的,表示個別克隆;各方框的參數如對圖1所描述的一樣。圖3呈現與實施例2描述的第二補料分批實驗第10天的對照相比,就活細胞密度而言顯示的生長對於所有過表達的細胞系(M1M2、M1M2S和S)是相似的。各方框中的個別值再次說明了觀察到的克隆可變性。如對圖1所描述的,表示個別克隆;各方框的參數如對圖1所描述的一樣。圖4呈現在實施例2描述的第二補料分批實驗期間產生的抗體的效價的克隆可變性比較。如對圖1所描述的,表示個別克隆;各方框的參數如對圖1所描述的一樣。圖5呈現在實施例2描述的第二補料分批實驗期間產生的抗體的比產率的克隆可變性。如對圖1所描述的,表示個別克隆;各方框的參數如對圖1所描述的一樣。圖6提供在實施例2描述的第二補料分批實驗期間產生的抗體的HM百分比的克隆可變性指示。如對圖1所描述的,表示個別克隆;各方框的參數如對圖1所描述的一樣。發明詳述雖然在本申請中使用的術語在本領域中是標準的,但是本文提供了某些術語的定義以確保權利要求意思的清楚和明確。單位、前綴和符號可以他們的SI(國際單位制)接受的形式來表示。本文列舉的數值範圍包括界定了範圍的數字,並且包括並支持所界定的範圍內的每個整數。除非另外指示,否則本文描述的方法和技術一般根據本領域中所熟知且如在整篇本說明書中所引用並論述的各種一般參考文獻和更特定參考文獻中所述的常規方法來進行。參見,例如,Sambrook等MolecularCloning:ALaboratoryManual,第3版,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,N.Y.(2001)和Ausubel等,CurrentProtocolsinMolecularBiology,GreenePublishingAssociates(1992)以及Harlow和LaneAntibodies:ALaboratoryManualColdSpringHarborLaboratoryPress,ColdSpringHarbor,N.Y.(1990)。公開的方法適用於在攪拌釜反應器(包括傳統分批細胞培養物和補料分批細胞培養物,其可能但不必包括自旋濾器)、灌流系統(包括交替式切向流(「ATF」)培養物、聲學(acoustic)灌流系統、深度濾器灌流系統及其他系統)、中空纖維生物反應器(HFB,其在一些情況下可用於灌流工藝)以及各種其他細胞培養方法中生長的貼壁培養物或懸浮培養物(參見,例如,以引用的方式整體併入本文的Tao等,(2003)Biotechnol.Bioeng.82:751-65;Kuystermans和Al-Rubeai,(2011)「BioreactorSystemsforProducingAntibodyfromMammalianCells」inAntibodyExpressionandProduction,CellEngineering7:25-52,Al-Rubeai(ed)Springer;Catapano等,(2009)「BioreactorDesignandScale-Up」inCellandTissueReactionEngineering:PrinciplesandPractice,Eibl等(編)Springer-Verlag)。本申請中引用的所有文件或文件的部分,包括但不限於專利、專利申請、文章、書籍和論文,均特此明確地以引用的方式併入。本發明的一個實施方案中描述的可與本發明的其他實施方案組合。定義如本文所使用,術語「一個(a)」和「一種(an)」意指一個(種)或多個(種),除非另外確切地指出。此外,除非另外為上下文所需,否則單數術語將包括複數,並且複數術語將包括單數。通常,與本文所述的細胞和組織培養、分子生物學、免疫學、微生物學、遺傳學和蛋白質及核酸化學以及雜交關聯使用的命名以及細胞和組織培養、分子生物學、免疫學、微生物學、遺傳學和蛋白質及核酸化學以及雜交的技術是本領域中熟知和常用的那些命名和技術。本公開提供調節表達「目標蛋白」的細胞培養物的特性的方法;「目標蛋白」包括天然存在的蛋白質、重組蛋白和改造的蛋白質(例如,不存在於自然中且已由人類設計和/或創造的蛋白質)。目標蛋白可為但不必為已知或疑似是治療學上相關的蛋白質。目標蛋白的具體實例包括抗原結合蛋白(如本文所描述或定義的)、肽體(即,包含直接或間接與其他分子諸如抗體的Fc結構域融合的肽,其中肽部分特異性地與所需靶標結合;例如,如以引用的方式整體併入本文的美國專利申請公布號US2006/0140934所述的,所述肽可與Fc區融合或者嵌入Fc-環或修飾的Fc分子中)、融合蛋白(例如,Fc融合蛋白,其中Fc片段與蛋白質或肽(包括肽體)融合)、細胞因子、生長因子、激素和其他天然存在的分泌蛋白以及天然存在的蛋白質的突變形式。術語「抗原結合蛋白」被以其廣義使用並且意指包含與抗原或靶標結合的一部分並且任選地包含允許抗原結合部分採用促進抗原結合蛋白與抗原結合的構型的構架或框架部分的蛋白質。抗原結合蛋白的實例包括人抗體、人源化抗體;嵌合抗體;重組抗體;單鏈抗體;雙功能抗體;三功能抗體;四功能抗體;Fab片段;F(ab』)2片段;IgD抗體;IgE抗體;IgM抗體;IgG1抗體;IgG2抗體;IgG3抗體;或IgG4抗體以及其片段。抗原結合蛋白可以包括,例如具有移植的CDR或CDR衍生物的替代蛋白構架或人工構架。此類構架包括,但不限於:抗體來源的構架,其包含被引入以便例如使抗原結合蛋白的三維結構穩定的突變;以及完全合成的構架,其包含例如生物相容性聚合物。參見,例如,Korndorfer等,2003,Proteins:Structure,Function,andBioinformatics,53(1):121-129(2003);Roque等,Biotechnol.Prog.20:639-654(2004)。此外,可使用肽抗體模擬物(「PAM」),也可使用基於抗體模擬物的構架,所述抗體模擬物利用纖連蛋白組分作為構架。抗原結合蛋白可以具有例如天然存在的免疫球蛋白的結構。「免疫球蛋白」是四聚體分子。在天然存在的免疫球蛋白中,每個四聚體主要由兩個相同的多肽鏈對組成,每對具有一個「輕」鏈(約25kDa)和一個「重」鏈(約50kDa-70kDa)。每條鏈的氨基端部分包括主要負責抗原識別的具有約100至110個或更多個胺基酸的可變區。每條鏈的羧基端部分限定了主要負責效應功能的恆定區。人輕鏈被分類為κ輕鏈和λ輕鏈。重鏈被分類為μ、δ、γ、α或ε,並且將抗體的同種型分別定義為IgM、IgD、IgG、IgA以及IgE。天然存在的免疫球蛋白鏈展現出由三個高變區連接的相對保守的框架區(FR)的相同通用結構,所述高變區又稱為互補決定區或CDR。從N端至C端,輕鏈和重鏈均包含結構域FR1、CDR1、FR2、CDR2、FR3、CDR3以及FR4。可根據Kabat等inSequencesofProteinsofImmunologicalInterest,第5版,USDept.ofHealthandHumanServices,PHS,NIH,NIH出版號91-3242,(1991)的定義來進行每個結構域的胺基酸分配。按照要求,也可根據另選命名方案諸如Chothia的命名方案(參見,Chothia和Lesk,(1987)J.Mol.Biol.196:901-917;Chothia等,(1989)Nature342:878-883或者Honegger和Pluckthun,(2001)J.Mol.Biol.309:657-670)重新定義CDR。在本公開的上下文中,當離解數(KD)≤10-8M時,稱抗原結合蛋白「特異性地結合」或「選擇性地結合」其靶標抗原。當KD≤5x10-9M時,抗體以「高親和性」特異性地結合抗原,並且當KD≤5x10-10M時,抗體以「極高親和性」特異性地結合抗原。除非另外說明,否則術語「抗體」包括對任何同種型或亞類的糖基化的和非糖基化的免疫球蛋白或與完整抗體競爭以特異性結合的其抗原結合區的提及。此外,除非另外說明,否則術語「抗體」是指完整免疫球蛋白或與完整抗體競爭以特異性結合的其抗原結合部分。抗原結合部分可以通過重組DNA技術或通過完整抗體的酶促裂解或化學裂解來產生,並且可形成目標蛋白的元件。抗原結合部分尤其包括Fab、Fab』、F(ab』)2、Fv、結構域抗體(dAb)、包括互補決定區(CDR)的片段、單鏈抗體(scFv)、嵌合抗體、雙功能抗體、三功能抗體、四功能抗體以及含有足以賦予與多肽的特異性抗原結合的至少一部分免疫球蛋白的多肽。Fab片段是具有VL、VH、CL和CH1結構域的單價片段;F(ab』)2是具有兩個由鉸鏈區二硫鍵連接的Fab片段的二價片段;Fd片段具有VH和CH1結構域;Fv片段具有抗體的單臂的VL和VH結構域;並且dAb片段具有VH結構域、VL結構域或者VH或VL結構域的抗原結合片段(美國專利號6,846,634、6,696,245、美國申請公布號05/0202512、04/0202995、04/0038291、04/0009507、03/0039958,Ward等,(1989)Nature341:544-546)。單鏈抗體(scFv)是VL區和VH區通過接頭(例如,具有胺基酸殘基的合成序列)連接以形成連續的蛋白質鏈的抗體,其中接頭足夠長以允許蛋白質鏈在其自身上向後摺疊並形成單價抗原結合位點(參見,例如,Bird等,Science242:423-26(1988)以及Huston等,(1988)Proc.Natl.Acad.Sci.USA85:5879-83)。雙功能抗體是包含兩個多肽鏈的二價抗體,其中每個多肽鏈包含通過接頭連接的VH結構域和VL結構域,所述接頭太短以致不能允許同一鏈上的兩個結構域之間成對,由此允許每個結構域與另一個多肽鏈上的互補結構域成對(參見,例如,Holliger等,(1993)Proc.Natl.Acad.Sci.USA90:6444-48;以及Poljak等,(1994)Structure2:1121-23)。如果雙功能抗體的兩個多肽鏈是相同的,那麼由它們成對而產生的雙功能抗體將具有兩個相同的抗原結合位點。具有不同序列的多肽鏈可以周來製造具有兩個不同抗原結合位點的雙功能抗體。類似地,三功能抗體和四功能抗體是分別包含三個和四個多肽鏈並且分別形成三個和四個抗原結合位點的抗體,所述抗原結合位點可以是相同的或不同的。可將一個或多個CDR共價地或非共價地併入到分子中以使所述分子成為抗原結合蛋白。抗原結合蛋白可以併入一個或多個CDR作為更大的多肽鏈的部分,可以使一個或多個CDR與另一個多肽鏈共價地連接,或可以非共價地併入一個或多個CDR。CDR容許抗原結合蛋白特異性地與特定的目標抗原結合。抗原結合蛋白可以具有一個或多個結合位點。如果存在多於一個結合位點,則結合位點可以彼此相同或可以不同。例如,天然存在的人免疫球蛋白通常具有兩個相同的結合位點,而「雙特異性」或「雙功能性」抗體具有兩個不同的結合位點。為了清楚的目的,並且如本文所述,應當指出抗原結合蛋白可但不必為人源的(例如,人抗體),並且在一些情況下將包括非人蛋白例如大鼠蛋白或小鼠蛋白,並且在其他情況下,抗原結合蛋白可包括人蛋白和非人蛋白的雜交種(例如,人源化抗體)。目標蛋白可包括人抗體。術語「人抗體」包括具有一個或多個源自人免疫球蛋白序列的可變區和恆定區的所有抗體。在一個實施方案中,所有的可變結構域和恆定結構域均源自人免疫球蛋白序列(完全人抗體)。此類抗體可以各種方式(包括通過與小鼠的目標抗原的免疫作用)來製備,所述小鼠,諸如源自UltiMabTM或系統的小鼠,被遺傳修飾以表達源自人重鏈編碼基因和/或輕鏈編碼基因的抗體。還可採用基於噬菌體的方法。另選地,目標蛋白可包括人源化抗體。「人源化抗體」具有因一個或多個胺基酸置換、缺失和/或添加而與源自非人物種的抗體的序列不同的序列,這樣使得與非人物種抗體相比,當向人類受試者施用時人源化抗體不太可能誘導免疫應答和/或誘導不太嚴重的免疫應答。在一個實施方案中,非人物種抗體的重鏈和/或輕鏈的框架結構域和恆定結構域中的某些胺基酸被突變以產生人源化抗體。在另一個實施方案中,使來自人抗體的一個或多個恆定結構域與非人物種的一個或多個可變結構域融合。如何製得人源化抗體的實例可見於美國專利號6,054,297、5,886,152和5,877,293中。如本文所用,「Fc」區包含兩個重鏈片段,所述重鏈片段包含抗體的CH2和CH3結構域。兩個重鏈片段通過兩個或更多個二硫鍵且通過CH3結構域的疏水性相互作用結合在一起。包含Fc區的目標蛋白(包括抗原結合蛋白和Fc融合蛋白)形成了本公開的另一個方面。「半抗體(hemibody)」是包含完整重鏈、完整輕鏈以及與完整重鏈的Fc區成對的第二重鏈Fc區的免疫功能性免疫球蛋白構建體。可但不必採用接頭來連接重鏈Fc區和第二重鏈Fc區。在具體實施方案中,半抗體為本文所公開的抗原結合蛋白的單價形式。在其他實施方案中,可採用帶電的殘基對來使一個Fc區與第二Fc區締合。在本公開的上下文中,半抗體可為目標蛋白。術語「宿主細胞」意指已用或能夠用核酸序列轉化並且因此表達目標基因的細胞。所述術語包括親本細胞的子代,無論子代在形態或基因組成方面是否與原始親本細胞相同,只要存在目標基因即可。細胞培養物可包含一個或多個宿主細胞。術語「雜交瘤」意指由永生化細胞與抗體產生細胞的融合而產生的細胞或細胞的子代。產生的雜交瘤是產生抗體的永生化細胞。用來創建雜交瘤的單個細胞可來自任何哺乳動物源,包括但不限於倉鼠、大鼠、豬、兔、綿羊、山羊和人。所述術語還包括當異雜交骨髓瘤融合時產生的三源雜交瘤細胞系,三源雜交瘤細胞系是人細胞和小鼠骨髓瘤細胞系之間的融合的產物,隨後與漿細胞融合。所述術語旨在包括產生抗體的任何永生化雜交細胞系,例如像四源雜交瘤(參見,例如,Milstein等,(1983)Nature,537:3053)。術語「培養物」和「細胞培養物」可互換使用,並且是指在培養基中在適於細胞群的存活和/或生長的條件下維持的細胞群。本領域技術人員將清楚,這些術語是指包含細胞群和所述群所懸浮於的培養基的組合。術語「多肽」和「蛋白質」(例如,如在目標蛋白或目標多肽的上下文中所用)在本文可互換使用以指胺基酸殘基的聚合物。所述術語還適用於一個或多個胺基酸殘基是相應天然存在的胺基酸的類似物或模擬物的胺基酸聚合物以及適用於天然存在的胺基酸聚合物。所述術語還可包括已被修飾(例如,通過添加碳水化合物殘基以形成糖蛋白)或被磷酸化的胺基酸聚合物。多肽和蛋白質可由天然存在的和非重組的細胞產生,或者多肽和蛋白質可由基因工程改造的或重組的細胞產生。多肽和蛋白質可包含具有天然蛋白質的胺基酸序列的分子,或者具有缺失、添加和/或置換的一個或多個胺基酸的天然序列的分子。術語「多肽」和「蛋白質」包括只包含天然存在的胺基酸的分子,以及包含非天然存在的胺基酸的分子。非天然存在的胺基酸的實例(按照要求,其可置換存在於本文公開的任何序列中的任何天然存在的胺基酸)包括:4-羥脯氨酸、γ-羧基穀氨酸、ε-N,N,N-三甲基賴氨酸、ε-N-乙醯賴氨酸、O-磷酸絲氨酸、N-乙醯絲氨酸、N-甲醯甲硫氨酸、3-甲基組氨酸、5-羥賴氨酸、σ-N-甲基精氨酸及其他類似的胺基酸和亞胺基酸(例如,4-羥脯氨酸)。根據標準用法和慣例,在本文所用的多肽符號中,左手方向是氨基末端方向且右手方向是羧基末端方向。可被插入蛋白質或多肽序列或者置換蛋白質或多肽序列中的野生型殘基的非天然存在的胺基酸的實例的非限制性列表包括β-胺基酸、高胺基酸、環狀胺基酸以及具有衍生側鏈的胺基酸。實例包括(呈L-型或D-型;如括號中縮寫的):瓜氨酸(Cit)、高瓜氨酸(hCit)、Nα-甲基瓜氨酸(NMeCit)、Nα-甲基高瓜氨酸(Nα-MeHoCit)、鳥氨酸(Orn)、Nα-甲基鳥氨酸(Nα-MeOrn或NMeOrn)、肌氨酸(Sar)、高賴氨酸(hLys或hK)、高精氨酸(hArg或hR)、高穀氨醯胺(hQ)、Nα-甲基精氨酸(NMeR)、Nα-甲基亮氨酸(Na-MeL或NMeL)、N-甲基高賴氨酸(NMeHoK)、Nα-甲基穀氨醯胺(NMeQ)、正亮氨酸(Nle)、正纈氨酸(Nva)、1,2,3,4-四氫異喹啉(Tic)、八氫吲哚-2-羧酸(Oic)、3-(1-萘基)丙氨酸(1-Nal)、3-(2-萘基)丙氨酸(2-Nal)、1,2,3,4-四氫異喹啉(Tic)、2-茚滿基甘氨酸(IgI)、對-吲哚苯丙氨酸(pI-Phe)、對-氨基苯丙氨酸(4AmP或4-氨基-Phe)、4-胍基苯丙氨酸(Guf)、甘氨醯賴氨酸(縮寫「K(Nε-甘氨醯)」或「K(甘氨醯)」或「K(gly)」)、硝基苯丙氨酸(硝基phe)、氨基苯丙氨酸(氨基phe或氨基-Phe)、苄基苯丙氨酸(苄基phe)、γ-羧基穀氨酸(γ-羧基glu)、羧脯氨酸(羥基pro)、對羧基-苯丙氨酸(Cpa)、α-氨基己二酸(Aad)、Nα-甲基纈氨酸(NMeVal)、N-α-甲基亮氨酸(NMeLeu)、Nα-甲基正亮氨酸(NMeNle)、環戊基甘氨酸(Cpg)、環己基甘氨酸(Chg)、乙醯精氨酸(乙醯arg)、α,β-二氨基丙酸(Dpr)、α,γ-二氨基丁酸(Dab)、二氨基丙酸(Dap)、環己基丙氨酸(Cha)、4-甲基-苯丙氨酸(MePhe)、β,β-二苯基-丙氨酸(BiPhA)、氨基丁酸(Abu)、4-苯基-苯丙氨酸(或二苯基丙氨酸;4Bip)、α-氨基-異丁酸(Aib)、β-丙氨酸、β-氨基丙酸、哌啶酸、氨基己酸、氨基庚酸、氨基庚二酸、鎖鏈素、二氨基庚二酸、N-乙基甘氨酸、N-乙基天冬醯胺、羥賴氨酸、別-羥賴氨酸、異鎖鏈素、別-異亮氨酸、N-甲基甘氨酸、N-甲基異亮氨酸、N-甲基纈氨酸、4-羥脯氨酸(Hyp)、γ-羧基穀氨酸、ε-N,N,N-三甲基賴氨酸、ε-N-乙醯賴氨酸、O-磷酸絲氨酸、N-乙醯絲氨酸、N-甲醯甲硫氨酸、3-甲基組氨酸、5-羥賴氨酸、ω-甲基精氨酸、4-氨基-O-鄰苯二甲酸(4APA)以及其他類似胺基酸和明確列出的那些胺基酸中的任一種的衍生形式。「細胞培養」或「培養」指的是多細胞生物或組織外的細胞的生長和增殖。用於哺乳動物細胞的適合的培養條件是本領域已知的。參見,例如,Animalcellculture:APracticalApproach,D.Rickwood,編,OxfordUniversityPress,NewYork(1992)。哺乳動物細胞可在懸浮液中或當附著到固體基質上時培養。可使用具有或沒有微載體的流化床生物反應器、中空纖維生物反應器、轉瓶、搖瓶或攪拌釜生物反應器。在一個實施方案中,使用500L至2000L生物反應器。在一個實施方案中,使用1000L至2000L生物反應器。術語「細胞培養基」(也稱為「培養基」、「細胞培養基(cellculturemedia)」、「組織培養基」)是指用於使細胞例如動物或哺乳動物細胞生長的任何營養液,並且其通常提供來自以下的至少一種或多種組分:能量來源(通常呈碳水化合物的形式,諸如葡萄糖);所有必需胺基酸中的一種或多種,並且通常為20種基本胺基酸,外加半胱氨酸;通常以低濃度需要的維生素和/或其他有機化合物;脂質或游離脂肪酸;以及微量元素,例如通常以極低的濃度(常在微摩爾濃度範圍內)需要的無機化合物或天然存在的元素。取決於要培養的細胞的需要和/或所需的細胞培養參數,所述營養液可任選地增補有附加的任選組分以使細胞生長優化,諸如激素和其他生長因子例如胰島素、轉鐵蛋白、表皮生長因子、血清等;鹽類,例如鈣、鎂和磷酸鹽以及緩衝液,例如HEPES;核苷和鹼基,例如腺苷、胸苷、次黃嘌呤;以及蛋白質和組織水解產物,例如水解的動物蛋白或植物蛋白(蛋白腖或蛋白腖混合物,其可獲得自動物副產品、精製明膠或植物物質);抗生素,例如慶大黴素;細胞保護劑或表面活性劑,諸如F68(還被稱為F68和P188;非離子三嵌段共聚物,其由側接聚氧化乙烯(聚環氧乙烷)的兩個親水鏈的聚氧化丙烯(聚環氧丙烷)的中央疏水鏈構成);聚胺,例如腐胺、亞精胺和精胺(參見,例如,WIPO公布號WO2008/154014)以及丙酮酸鹽(參見,例如,美國專利號8053238)。細胞培養基包括通常在任何細胞培養方法中採用的和/或已知用於任何細胞培養方法的那些,諸如但不限於細胞的分批培養、延長分批培養、補料分批培養和/或灌流培養或連續培養。「基礎」(或分批)細胞培養基是指通常用來啟動細胞培養,並且足夠完全支持細胞培養的細胞培養基。「生長」細胞培養基是指通常用於指數生長時期(生長期)期間的細胞培養中並且足夠完全支持此階段期間的細胞培養的細胞培養基。生長細胞培養基還可含有賦予對併入宿主細胞系內的選擇標記的抗性或存活性的選擇劑。此類選擇劑包括但不限於遺傳黴素(G4118)、新黴素、潮黴素B、嘌呤黴素、博萊黴素、蛋氨酸亞碸亞胺、氨甲蝶呤、無穀氨醯胺細胞培養基、缺乏甘氨酸、次黃嘌呤和胸苷或單獨缺乏胸苷的細胞培養基。「生產」細胞培養基是指通常在指數生長將要結束且蛋白生產接管「過渡」期和/或「產物」期時用於過渡期間的細胞培養中並且足夠完全維持此階段期間所需的細胞密度、細胞活力和/或產物效價的細胞培養基。「灌流」細胞培養基是指通常用於通過灌流培養或連續培養方法維持的細胞培養中,並且足夠完全支持此過程期間的細胞培養的細胞培養基。灌流細胞培養基製劑可更為富集或比基礎細胞培養基製劑更為濃縮以適應用來移除廢培養基的方法。灌流細胞培養基可在生長期和生產期期間使用。濃縮細胞培養基可含有一些或所有維持細胞培養所需的營養物;特別是可含有鑑定為或已知是在細胞培養的生產期過程期間消耗的營養物的濃縮培養基。濃縮培養基可基於幾乎任何細胞培養基製劑。此類濃縮補料培養基可含有例如約2X、3X、4X、5X、6X、7X、8X、9X、10X、12X、14X、16X、20X、30X、50X、100x、200X、400X、600X、800X乃至1000X它們的正常量的細胞培養基的一些或所有組分。用來製備細胞培養基的組分可完全地碾磨成粉末培養基製劑;部分地與液體增補物一起碾磨,按需添加到細胞培養基中;或以完全液體形式向細胞培養物中添加。細胞培養物還可增補有可能難以製備或在細胞培養中快速耗乏的特定營養物的獨立濃縮補料。此類營養物可為胺基酸,諸如酪氨酸、半胱氨酸和/或胱氨酸(參見,例如,WIPO公布號2012/145682)。在一個實施方案中,獨立地向在含有酪氨酸的細胞培養基中生長的細胞培養物中補料濃縮的酪氨酸溶液,以使酪氨酸在細胞培養物中的濃度不超過8mM。在另一個實施方案中,獨立地向在缺乏酪氨酸、胱氨酸或半胱氨酸的細胞培養基中生長的細胞培養物中補料酪氨酸和胱氨酸的濃縮溶液。所述獨立補料可在生產期之前或生產期開始時開始。所述獨立補料可在與濃縮補料培養基相同或不同的日子通過細胞培養基的分批補料來實現。所述獨立補料還可在與灌流培養基相同或不同的日子進行灌流。「無血清」應用於不含動物血清諸如胎牛血清的細胞培養基中。在其他情況中,各種組織培養基(包括確定的培養基)是可商購獲得的,例如,可使用下列細胞培養基中的任何一種或組合:RPMI-1640培養基、RPMI-1641培養基、Dulbecco氏改良的Eagle氏培養基(DMEM)、最低必需Eagle培養基、F-12K培養基、Ham氏F12培養基、Iscove氏改良的Dulbecco氏培養基、McCoy氏5A培養基、Leibovitz氏L-15培養基以及無血清培養基,諸如EX-CELLTM300系列(JRHBiosciences,Lenexa,Kansas)。此類培養基的無血清版也是可獲得的。取決於要培養的細胞的需要和/或所需的細胞培養參數,細胞培養基可增補有附加的或增加濃度的組分,諸如胺基酸、鹽類、糖類、維生素、激素、生長因子、緩衝液、抗生素、脂類、微量元素等。術語「生物反應器」意指用於細胞培養物的生長的任何容器。本公開的細胞培養物可在生物反應器中生長,可基於由生長於所述生物反應器中的細胞產生的目標蛋白的應用而選擇所述生物反應器。生物反應器可為任何尺寸,只要它對細胞培養有用;通常,生物反應器的尺寸適於在其之內生長的細胞培養物的容積。通常,生物反應器會是至少1升,並且可為2、5、10、50、100、200、250、500、1,000、1500、2000、2,500、5,000、8,000、10,000、12,000升或更多或在中間的任何容積。可在培養期期間控制生物反應器的內部條件,包括但不限於pH和溫度。本領域技術人員將知道並且將能夠基於相關考慮而選擇用於實踐本發明的適合的生物反應器。「細胞密度」是指給定容積的培養基中的細胞數量。「活細胞密度」是指如通過標準活力測定(諸如臺盼藍染料排斥方法)所確定的給定容積的培養基中的活細胞數量。術語「細胞活力」意指培養中的細胞在給定組的培養條件或實驗變量下生存的能力。所述術語還指在當時的培養中在特定時間相對於總數的細胞(活的和死的)活著的細胞的部分。「細胞壓積」(PCV),也稱為「細胞壓積百分比」(%PCV),是細胞所佔容積與細胞培養物的總容積的比率,表示為百分比(參見,Stettler等,(2006)BiotechnolBioeng.Dec20:95(6):1228-33)。細胞壓積是細胞密度和細胞直徑的函數;細胞壓積的增加可由細胞密度或細胞直徑或兩者的增加而引起。細胞壓積是細胞培養物中固體含量的量度。在收穫和下遊純化期間去除固體。更多的固體意味著在收穫和下遊純化步驟期間從所需產物中分離所述固體物料的更多的努力。另外,在收穫過程期間所需產物可困於所述固體中並損失,導致產物收率減少。因為宿主細胞大小不同並且細胞培養物還可含有死的和垂死的細胞以及其他細胞碎片,所以細胞壓積比起細胞密度或活細胞密度是描述細胞培養物內固體含量的更加精確的方式。例如,取決於細胞大小,具有50x106個細胞/ml的細胞密度的2000L培養物將具有迥然不同的細胞壓積。此外,一些細胞當處於生長停滯狀態時將在大小方面增加,因此由於細胞大小增加而導致生物量增加,使得在生長停滯和後生長停滯之前的細胞壓積很可能會不同。「生長停滯」,其還被稱為「細胞生長停滯」,是細胞在數量上停止增加或當細胞周期不再進行時的時刻。可通過測定細胞培養物的活細胞密度來監控生長停滯。處於生長停滯狀態的一些細胞可在大小而非數量方面增加,因此生長停滯的培養物的細胞壓積可能增加。如果細胞不處於健康下降中,那麼可通過反轉導致生長停滯的條件來在某種程度上反轉生長停滯。術語「效價」意指由給定量的培養基體積中的細胞培養物產生的目標多肽或目標蛋白(其可為天然存在的或重組的目標蛋白)的總量。效價可以每毫升(或其他體積的量度)培養基毫克或微克多肽或蛋白質的單位表示。「累積效價」是由細胞在培養過程期間產生的效價,並且可例如通過測量每日效價並利用這些值來計算累積效價而確定。術語「補料分批培養」是指懸浮培養的形式,並且意指繼培養過程開始之後一次或多次向培養物中提供附加組分的培養細胞的方法。提供的組分通常包含已在培養過程期間耗乏的用於細胞的營養補充劑。此外或可選地,附加組分可包括補充性組分(例如,細胞周期抑制性化合物)。通常在某點處停止補料分批培養,並且將培養基中的細胞和/或組分收穫並任選地純化。術語「綜合活細胞密度」或「IVCD」可互換使用,並且意指培養過程中的平均活細胞密度乘以培養已運行的時間量。通過兩個時間點之間的平均活細胞密度(VCD)乘以這兩個時間點之間的持續時間來計算「累積活細胞密度」(CVCD)。CVCD是由VCD對時間繪圖形成的曲線下的面積。細胞培養過程的描述在重組蛋白產生期間,期望具有使細胞生長至所需密度的可控系統,然後使細胞的生理狀態轉換至細胞利用能量和底物來產生目標重組蛋白而不是形成更多細胞的生長停滯的高生產率狀態。用於到達這個目標的各種方法存在並且包括溫度變化和胺基酸飢餓以及使用細胞周期抑制劑或可停滯細胞生長而不引起細胞死亡的其他分子。重組蛋白的生產開始於在培養皿、培養瓶、培養試管、生物反應器或其他適合的容器中建立表達蛋白質的哺乳動物細胞生產型細胞培養物。通常使用較小的生產型生物反應器,在一個實施方案中,所述生物反應器為500L至2000L。在另一個實施方案中,使用1000L-2000L生物反應器。用來接種生物反應器的種子細胞密度可對產生的重組蛋白水平具有積極影響。在一個實施方案中,用無血清培養基中的至少0.5x106個活細胞/mL至和超過3.0x106個活細胞/mL接種生物反應器。在另一個實施方案中,接種為1.0x106個活細胞/mL。哺乳動物細胞然後經受指數生長期。可在沒有補充性補料的情況下維持細胞培養物直至達到所需細胞密度。在一個實施方案中,在有或沒有補充性補料的情況下維持細胞培養物持續多達三天。在另一個實施方案中,可按照所需細胞密度接種培養物以開始生產期,而沒有簡短的生長期。在本文的任何實施方案中,還可通過任何前述的方法來啟動生長期至生產期的轉換。在生長期與生產期之間的過渡處以及在生產期期間,細胞壓積百分比(%PCV)等於或小於35%。生產期期間維持的所需細胞壓積等於或小於35%。在一個實施方案中,所述細胞壓積等於或小於30%。在另一個實施方案中,所述細胞壓積等於或小於20%。在又一個實施方案中,所述細胞壓積等於或小於15%。在再一個實施方案中,所述細胞壓積等於或小於10%。在生長期與生產期之間的過渡處的和在生產期期間維持的所需活細胞密度可根據項目而不同。它可基於來自歷史數據的當量細胞壓積來確定。在一個實施方案中,所述活細胞密度為至少約10x106個活細胞/mL至80x106個活細胞/mL。在一個實施方案中,所述活細胞密度為至少約10x106個活細胞/mL至70x106個活細胞/mL。在一個實施方案中,所述活細胞密度為至少約10x106個活細胞/mL至60x106個活細胞/mL。在一個實施方案中,所述活細胞密度為至少約10x106個活細胞/mL至50x106個活細胞/mL。在一個實施方案中,所述活細胞密度為至少約10x106個活細胞/mL至40x106個活細胞/mL。在另一個實施方案中,所述活細胞密度為至少約10x106個活細胞/mL至30x106個活細胞/mL。在另一個實施方案中,所述活細胞密度為至少約10x106個活細胞/mL至20x106個活細胞/mL。在另一個實施方案中,所述活細胞密度為至少約20x106個活細胞/mL至30x106個活細胞/mL。在另一個實施方案中,所述活細胞密度為至少約20x106個活細胞/mL至至少約25x106個活細胞/mL,或者至少約20x106個活細胞/mL。生產期期間較低的細胞壓積有助於緩解可阻礙更高細胞密度灌流培養的溶解氧鼓泡問題。較低的細胞壓積還允許較小的培養基體積,所述較小的培養基體積允許使用較小的培養基儲存容器並且可與較小流速組合。與較高的細胞生物量培養物相比,較小的細胞壓積還對收穫和下遊處理具有較小影響。所有這些都降低了與生產重組蛋白治療劑相關的成本。通常在用於通過哺乳動物細胞培養來生產重組蛋白的商業過程中使用三種方法:分批培養、補料分批培養和灌流培養。分批培養是使細胞在固定體積的培養基中生長持續較短時間段隨後全部收穫的不連續的方法。利用分批法生長的培養物經歷細胞密度的增加直至達到最大細胞密度,隨後隨著培養基組分消耗和代謝副產物(諸如乳酸鹽和氨)的水平積累,活細胞密度下降。通常收穫發生在當達到最大細胞密度(取決於培養基製劑、細胞系等,通常為5x106個細胞/mL-10x106個細胞/mL)時的時刻。分批法是最簡單的培養方法,然而活細胞密度受養分有效性的限制,並且一旦細胞處於最大密度,培養物就衰退且生產就減少。不存在延長生產期的能力,因為廢物積累和營養耗乏快速地導致了培養物衰退,(通常大約3天至7天)。補料分批培養通過提供灌注或連續培養基補料以補充已消耗的那些培養基組分來改進分批法。因為補料分批培養物在整個操作過程中始終接受附加的營養物,所以當與分批法相比時它們具有達到較高的細胞密度(取決於培養基製劑、細胞系等,>10x106個細胞/ml至30x106個細胞/ml))和增加的產物效價的潛力。不同於分批法,雙相培養可通過操控補料策略和培養基製劑來建立和維持,以區分達成所需細胞密度(生長期)的細胞增殖時期與暫停的或緩慢的細胞生長時期(生產期)。如此,與分批培養相比,補料分批培養具有達到較高產物效價的潛力。通常,在生長期使用分批法並且在生產期使用補料分批法,但是可在整個過程中使用補料分批補料策略。然而,不同於分批法,生物反應器容積是限制補料量的限制因素。另外,如同分批法一樣,代謝副產物積累會導致培養物衰退,這限制了生產期的持續時間,約1.5周至3周。補料分批培養是不連續的,並且收穫通常在代謝副產物水平或培養物活力達到預定水平時發生。當與沒有補料發生的分批培養相比時,補料分批培養可產生更大量的重組蛋白。參見,例如,美國專利號5,672,502。灌流法通過添加新鮮培養基並同時移除廢培養基而提供了優於分批法和補料分批法的潛在改進。典型的大規模商業細胞培養策略努力達到幾乎三分之一至超過二分之一的反應器容積為生物量的高細胞密度,60x106個細胞/mL-90(+)x106個細胞/mL。用灌流培養已達到了>1x108個細胞/mL的極限細胞密度,並且甚至預測了更高的密度。典型的灌流培養開始於持續一天或兩天的分批培養啟動,隨後在培養的整個生長期和生產期中向培養物中連續、逐步和/或間歇添加新鮮補料培養基並同時移除廢培養基並保留細胞和另外的高分子量化合物諸如蛋白質(基於濾器分子量截斷值)。諸如沉降、離心或過濾的各種方法可用來移除廢培養基,同時維持細胞密度。已報告了每天一部分工作容積至每天許多多個工作容積的灌流流速。灌流法的優勢為比起分批培養方法或補料分批培養方法,生產培養可維持較長期間。然而,需要增加的培養基製備、使用、存儲和處理以支持長期灌流培養,特別是具有高細胞密度的那些灌流培養,其還需要甚至更多的營養物,並且與分批法或補料分批法相比,這一切驅使生產成本甚至更高。此外,更高的細胞密度可引起生產期間的問題,諸如維持溶解氧水平和具有增加的放氣的問題,其包括提供更多氧氣並去除更多二氧化碳,這將導致更多發泡和對消泡劑策略的改變的需要;以及收穫和下遊處理期間的問題,其中去除過多的細胞材料所需的努力可導致產物損失,由於增加的細胞團塊而否定了增加的效價的效益。還提供組合了生長期期間的補料分批補料隨後是生產期期間的連續灌流的大規模細胞培養策略。所述方法把以小於或等於35%細胞壓積維持細胞培養的生產期作為目標。在一個實施方案中,在生長期期間使用具有灌注補料的補料分批培養來維持細胞培養。然後可在生產期期間使用灌流補料。在一個實施方案中,灌流在細胞已達到生產期時開始。在另一個實施方案中,灌流開始於細胞培養的第3天或大約第3天至第9天或大約第9天。在另一個實施方案中,灌流開始於細胞培養的第5天或大約第5天至第7天或大約第7天。生長期期間使用灌注補料允許細胞過渡至生產期中,引起了作為啟動並控制生產期的手段的對溫度變化更少的依賴性,然而36℃至31℃的溫度變化可在生長期與生產期之間發生。在一個實施方案中,變化為36℃至33℃。在另一個實施方案中,可通過使補料分批培養物暴露於細胞周期抑制劑中來啟動細胞生長停滯在補料分批培養中的啟動。在另一個實施方案中,可通過用包含細胞周期抑制劑的無血清灌流培養基灌流來實現細胞生長停滯在補料分批培養中的啟動。如本文所述,可用至少0.5x106個活細胞/mL至和超過3.0x106個活細胞/mL在無血清培養基中接種生物反應器,例如1.0x106個活細胞/mL。灌流培養是細胞培養物接受新鮮灌流補料培養基並同時移除廢培養基的一種培養。灌流可為連續的、逐步的、間歇的或者這些中的任何的任一種或全部的組合。灌流速率可為每天小於一個工作容積至每天許多個工作容積。細胞在培養物中保留並且移除的廢培養基基本不含細胞或比所述培養物具有顯著較少的細胞。由細胞培養物表達的重組蛋白也可在培養物中保留。灌流可通過包括離心、沉降或過濾的若干手段來實現,參見,例如,Voisard等,(2003),BiotechnologyandBioengineering82:751-65。過濾法的一個實例為交替式切向流過濾。交替式切向流通過將培養基泵送通過中空纖維濾器組件來維持。參見,例如,美國專利號6,544,424;Furey(2002)Gen.Eng.News.22(7),62-63。「灌流流速」是在給定時間內從生物反應器穿過(添加和移除)的培養基的量,通常表現為一部分或多倍的工作容積。「工作容積」是指用於細胞培養的生物反應器容積的量。在一個實施方案中,所述灌流流速為每天一個工作容積或更少。可配製灌流補料培養基以使灌流營養濃度最大化,使灌流速率最小化。可用含有在細胞培養的生產期過程期間消耗的組分諸如營養物和胺基酸的濃縮補料培養基增補細胞培養物。濃縮補料培養基可基於幾乎任何細胞培養基製劑。這種濃縮補料培養基可含有例如約5X、6X、7X、8X、9X、10X、12X、14X、16X、20X、30X、50X、100x、200X、400X、600X、800X乃至1000X它們的正常量的細胞培養基的大部分組分。濃縮補料培養基經常用於補料分批培養過程中。根據本發明的方法可用來在多階段培養過程中改進重組蛋白的生產。在多階段過程中,以兩個或更多個不同階段培養細胞。例如,細胞可首先以一個或多個生長期在使細胞增殖和活力最大化的環境條件下培養,然後在使蛋白質生產最大化的條件下轉移至生產期。在用於通過哺乳動物細胞生產蛋白質的商業過程中,在最終生產培養之前,通常有存在於不同培養容器中的多個(例如,至少約2、3、4、5、6、7、8、9或10個)生長期。一個或多個過渡期可先於或隔開生長期和生產期。在多階段過程中,可至少在商業細胞培養最終生產期的生長期和生產期期間採用根據本發明的方法,然而它還可在前生長期中採用。可以大規模進行生產期。可以至少約100、500、1000、2000、3000、5000、7000、8000、10,000、15,000、20,000升的容積進行大規模過程。在一個實施方案中,生產在500L、1000L和/或2000L生物反應器中進行。生長期可在比生產期更高的溫度下存在。例如,生長期可在約35℃至約38℃的第一溫度下存在,並且生產期可在約29℃至37℃,任選地約30℃至約36℃或約30℃至約34℃的第二溫度下存在。此外,可在溫度變化的同時、之前和/或之後添加蛋白生產的化學誘導物,例如像咖啡因、丁酸鹽和六亞甲基二乙醯胺(HMBA)。如果在溫度變化後添加誘導物,它們可在溫度變化後一小時至五天,任選地在溫度變化後一至兩天添加。當細胞產生所需蛋白質時,細胞培養物可維持數天乃至數周。可使用本領域已知的任何分析技術監控並評估來自細胞培養物的樣品。可在培養期間監控包括重組蛋白和培養基質量和特徵的多種參數。可以合意的頻率間歇地獲取並監控樣品,包括實時或近實時的連續監控。通常,最終生產培養物(N-xtoN-1)之前的細胞培養物用來產生將用來接種生產型生物反應器(N-1培養物)的種子細胞。種子細胞密度可對產生的重組蛋白水平具有積極影響。產物水平傾向於隨著增加種子密度而升高。效價的改善不但受制於更高的種子密度,而且很可能受制於生產中的細胞的代謝狀態和細胞周期狀態的影響。可通過任何培養方法來生產種子細胞。一個這樣的方法是使用交替式切向流過濾的灌流培養。可使用交替式切向流過濾操作N-1生物反應器以提供高密度的細胞來接種生產型生物反應器。N-1階段可用來使細胞生長至>90x106個細胞/mL的密度。N-1生物反應器可用來產生灌注種子培養物或可用作滾種儲備培養物(rollingseedstockculture),可維持所述滾種儲備培養物來以高種子細胞密度接種多生產型生物反應器。生產的生長階段持續時間的範圍可為7至14天,並且可被設計以便在接種生產型生物反應器之前使細胞維持指數生長。優化灌流速率、培養基製劑和定時以使細胞生長並將他們以最有益於優化他們的生產的狀態遞送至生產型生物反應器。對於接種生產型生物反應器,可達到>15x106個細胞/mL的種子細胞密度。接種時更高的種子細胞密度可減少乃至消除達到所需生產密度所需的時間。本發明發現了在調控重組蛋白糖基化的存在和/或量方面的特定效用。本發明所用的細胞系(也稱為「宿主細胞」)經過基因工程改造以表達具有商業或科學價值的多肽。細胞系通常從起源於原代培養物的譜系得到,所述原代培養物可在培養中維持無限時間。基因工程改造的細胞系涉及用重組多核苷酸分子轉染、轉化或轉導所述細胞和/或另外的改變(例如,通過同源重組和基因活化或重組細胞與非重組細胞的融合),以便引起宿主細胞表達所需重組多肽。用於基因工程改造細胞和/或細胞系以表達目標多肽的方法和載體為本領域技術人員所熟知;例如,CurrentProtocolsinMolecularBiology,Ausubel等,編.(Wiley和Sons,NewYork,1988,和季刊更新);Sambrook等,MolecularCloning:ALaboratoryManual(ColdSpringLaboratoryPress,1989);Kaufman,R.J.,LargeScaleMammalianCellCulture,1990,pp.15-69闡明了各種技術。動物細胞系來源於祖細胞是來源於多細胞動物的細胞。一種動物細胞係為哺乳動物細胞系。適於在培養中生長的多種多樣的哺乳動物細胞系購自美國種質保存中心(Manassas,Va.)和商業供應商。工業中常用的細胞系的實例包括VERO、BHK、HeLa、CV1(包括Cos)、MDCK、293、3T3、骨髓瘤細胞系(例如,NSO、NS1)、PC12、WI38細胞和中國倉鼠卵巢(CHO)細胞。CHO細胞廣泛用於生產複合重組蛋白,例如,細胞因子、凝血因子和抗體(Brasel等(1996),Blood88:2004-2012;Kaufman等(1988),J.BiolChem263:6352-6362;McKinnon等(1991),JMolEndocrinol6:231-239;Wood等(1990),J.Immunol.145:3011-3016)。二氫葉酸還原酶(DHFR)缺陷型突變細胞系(Urlaub等(1980),ProcNatlAcadSciUSA77:4216-4220)、DXB11和DG-44是合意的CHO宿主細胞系,因為有效的DHFR可選擇和可擴增基因表達系統允許這些細胞中的高水平重組蛋白表達(KaufmanR.J.(1990),MethEnzymol185:537-566)。此外,這些細胞易於操控作為貼壁培養物或懸浮培養物並且顯示出相對良好的遺傳穩定性。CHO細胞和在它們中重組表達的蛋白已被廣泛表徵並且已被監管機構批准用於臨床商業生產中。在另一方面,本發明提供已引入重組表達載體的宿主細胞。宿主細胞可為任何原核細胞(例如大腸桿菌(E.coli))或真核細胞(例如酵母、昆蟲或哺乳動物細胞(例加,CHO細胞))。可通過常規轉化或轉柒技術將載體DNA引入原核或真核細胞中。很多轉染方法是本領域已知的,並且包括了使用脂質(例如,)、磷酸鈣、陽離子聚合物、DEAE-葡聚糖、活化的樹狀聚合物和磁珠。另外的轉染方法利用基於儀器的技術。實例包括電穿孔、生物射彈技術、顯微注射和雷射轉染/光注射,所述雷射轉染/光注射使用光(例如,雷射)以將核酸引入宿主細胞中。對於哺乳動物細胞的穩定轉染,眾所周知,根據使用的表達載體和轉染技術,僅一小部分細胞可將外源DNA整合至它們的基因組中。為了鑑定和選擇這些整合體,通常將編碼選擇標記(例加,對於對抗生素的抗性)的基因連同目標基因一起引入宿主細胞中。優選的選擇標記包括賦予對藥物諸如G418、潮黴素和氨甲蝶呤的抗性的那些選擇標記。在其他方法中,可通過藥物選擇鑑定穩定轉染了引入的核酸的細胞(例加,已併入選擇標記基因的細胞將存活,而其它細胞死亡)。目標蛋白本發明的方法可用來培養表達目標重組蛋白的細胞。表達的重組蛋白可分泌至培養基中,可從所述培養基中回收和/或收集它們。此外,可利用已知的方法和從商業供應商獲得的產品來純化或部分地純化來自此類培養物或組分(例如,來自培養基)的蛋白質。然後可將純化的蛋白質「配製」(意指緩衝液交換)、滅菌、成批包裝和/或包裝以用於最終用戶。用於藥物組合物的適合製劑包括在Remington′sPharmaceuticalSciences,第18版.1995,MackPublishingCompany,Easton,PA中描述的那些製劑。可用本發明方法來生產的多肽的實例包括了包含與以下蛋白質之一的全部或部分相同或基本相似的胺基酸序列的蛋白質:腫瘤壞死因子(TNF)、flt3配體(WO94/28391)、促紅細胞生成素(erythropoeitin)、促血小板生成素(thrombopoeitin)、降鈣素、IL-2、血管生成素-2(Maisonpierre等(1997),Science277(5322):55-60)、NF-κB的受體激活物的配體(RANKL,WO01/36637)、腫瘤壞死因子(TNF)相關的凋亡誘導配體(TRAIL,WO97/01633)、胸腺基質淋巴細胞生成素、粒細胞集落刺激因子、粒細胞-巨噬細胞集落刺激因子(GM-CSF,澳大利亞專利號588819)、肥大細胞生長因子、幹細胞生長因子(美國專利號6,204,363)、表皮生長因子、角質化細胞生長因子、巨核細胞(megakaryote)生長和發育因子、RANTES、人纖維蛋白原樣2蛋白(FGL2;NCBI登錄號NM_00682;Rüegg和Pytela(1995),Gene160:257-62)、生長激素、胰島素、促胰島素、胰島素樣生長因子、甲狀旁腺素、包括α-幹擾素、γ-幹擾素和共有序列幹擾素(consensusinterferon)的幹擾素(美國專利號4,695,623和4,897471)、神經生長因子、腦源性神經營養因子、突觸結合蛋白樣蛋白(SLP1-5)、神經營養因子-3、胰高血糖素、白細胞介素、集落刺激因子、淋巴毒素-B、白血病抑制因子和制瘤素-M。對可根據本發明方法生產的蛋白質的描述可見於例如HumanCytokines:HandbookforBasicandClinicalResearch,全冊(Aggarwal和Gutterman,編BlackwellSciences,Cambridge,MA,1998);GrowthFactors:APracticalApproach(McKay和Leigh,編,OxfordUniversityPressInc.,NewYork,1993);以及TheCytokineHandbook,第1冊和第2冊(Thompson和Lotze編,AcademicPress,SanDiego,CA,2003)中。此外,本發明的方法將用來生產包含任何上述蛋白質的受體的全部或部分胺基酸序列的蛋白質、此類受體或任何上述蛋白質的拮抗劑和/或基本類似於此類受體或拮抗劑的蛋白質。這些受體和拮抗劑包括:兩種形式的腫瘤壞死因子受體(TNFR,也稱為p55和p75,美國專利號5,395,760和美國專利號5,610,279)、白細胞介素-1(IL-1)受體(I型和II型;歐洲專利號0460846、美國專利號4,968,607和美國專利號5,767,064,)、IL-1受體拮抗劑(美國專利號6,337,072)、IL-1拮抗劑或抑制劑(美國專利號5,981,713、6,096,728和5,075,222)、IL-2受體、IL-4受體(歐洲專利號0367566和美國專利號5,856,296)、IL-15受體、IL-17受體、IL-18受體、Fc受體、粒細胞-巨噬細胞集落刺激因子受體、粒細胞集落刺激因子受體、制瘤素-M的受體和白血病抑制因子的受體、NF-κB的受體激活物(RANK,WO01/36637和美國專利號6,271,349)、骨保護素(美國專利號6,015,938)、TRAIL的受體(包括TRAIL受體1、2、3和4)以及包含死亡結構域的受體,諸如Fas或凋亡誘導受體(AIR)。可利用本發明來生產的其他蛋白質包括包含分化抗原(也稱為CD蛋白)或它們的配體或基本類似於這兩者之一的蛋白質的全部或部分胺基酸序列的蛋白質。在LeukocyteTypingVI(ProceedingsoftheVIthInternationalWorkshopandConference,Kishimoto,Kikutani等人,編,Kobe,Japan,1996)中公開了此類抗原。在後續的研討會中公開了類似的CD蛋白。此類抗原的實例包括CD22、CD27、CD30、CD39、CD40和另外配體(CD27配體、CD30配體等)。若干CD抗原是TNF受體家族的成員,所述TNF家族還包括41BB和OX40。配體通常是TNF家族的成員,41BB配體和OX40配體也是。也可利用本發明生產酶促活性蛋白或它們的配體。實例包括包含以下蛋白質或它們的配體或基本類似於這兩者之一的蛋白質中的一個的全部或部分的蛋白質:包括TNF-α轉化酶的解聯蛋白和金屬蛋白酶結構域家族成員、各種激酶、葡糖腦苷脂酶、超氧化物歧化酶、組織纖溶酶原激活物、因子VIII、因子IX、載脂蛋白E、載脂蛋白A-I、珠蛋白、IL-2拮抗劑、α-1抗胰蛋白酶、任何上述酶類的配體和為數眾多的其他酶類和它們的配體。可生產的抗體的實例包括但不限於識別包括但不限於上述蛋白質和/或以下抗原的蛋白質中的任何一種或組合的那些抗體:CD2、CD3、CD4、CD8、CD11a、CD14、CD18、CD20、CD22、CD23、CD25、CD33、CD40、CD44、CD52、CD80(B7.1)、CD86(B7.2)、CD147、IL-1α、IL-1β、IL-2、IL-3、IL-7、IL-4、IL-5、IL-8、IL-10、IL-1受體、IL-2受體、IL-4受體、IL-6受體、IL-13受體、IL-18受體亞基、FGL2、PDGF-β及其類似物(參見,美國專利號5,272,064和5,149,792)、VEGF、TGF、TGF-β2、TGF-β1、EGF受體(參見,美國專利號6,235,883)、VEGF受體、肝細胞生長因子、骨保護素配體、幹擾素γ、B淋巴細胞刺激物(BlyS,也稱為BAFF、THANK、TALL-1和zTNF4;參見,Do和Chen-Kiang(2002),CytokineGrowthFactorRev.13(1):19-25)、C5補體、IgE、腫瘤抗原CA125、腫瘤抗原MUC1、PEM抗原、LCG(其是表達的與肺癌相關的基因產物)、HER-2、HER-3、腫瘤相關糖蛋白TAG-72、SK-1抗原、在結腸癌和/或胰腺癌患者血清中以升高的水平存在的腫瘤相關表位、在乳腺、結腸、鱗狀細胞、前列腺、胰腺、肺和/或腎癌細胞和/或黑色素瘤、膠質瘤或成神經細胞瘤細胞上表達的癌症相關表位或蛋白、腫瘤壞死中心、整聯蛋白α4β7、整聯蛋白VLA-4、整聯蛋白(包括包含了α4β7的整聯蛋白)、TRAIL受體1、2、3和4、RANK、RANK配體、TNF-α、黏附分子VAP-1、上皮細胞黏附分子(EpCAM)、細胞間黏附分子-3(ICAM-3)、白細胞整聯蛋白粘附素、血小板糖蛋白gpIIb/IIIa、心肌肌球蛋白重鏈、甲狀旁腺素、rNAPc2(其是因子VIIa組織因子的抑制劑)、MHCI、癌胚抗原(CEA)、甲胎蛋白(AFP)、腫瘤壞死因子(TNF)、CTLA-4(其是細胞毒性T淋巴細胞相關抗原)、Fc-γ-1受體、HLA-DR10β、HLA-DR抗原、硬化蛋白、L-選擇素、呼吸融合病毒、人類免疫缺陷病毒(HIV)、B型肝炎病毒(HBV)、變異鏈球菌(Streptococcusmutans)和金黃色葡萄球菌(Staphlycoccusaureus)。可利用本發明方法來生產的已知抗體的具體實例包括但不限於阿達木單抗、貝伐單抗、英夫利昔單抗、阿昔單抗、阿侖單抗、巴匹珠單抗、巴利昔單抗、貝利木單抗、布雷奴單抗、布羅達單抗(brodalumab)、康納單抗、培舍珠單抗、西妥昔單抗、可那木單抗(conatumumab)、地諾單抗(denosumab)、依庫珠單抗、etrolizumab、evolocumab、吉妥珠單抗奧唑米星、戈利木單抗(golimumab)、替伊莫單抗、拉貝珠單抗、馬帕木單抗、馬妥珠單抗、美泊利單抗、莫他珠單抗、莫羅單抗-CD3、那他珠單抗、帕利珠單抗、奧法木單抗、奧馬珠單抗、奧戈伏單抗(oregovomab)、帕利珠單抗、帕尼單抗、pemtumomab、培妥珠單抗、蘭尼單抗、利妥昔單抗、羅維珠單抗、塔西單抗、託西莫單抗、曲妥珠單抗、優特克單抗、維多珠單抗(vedolizomab)、扎蘆木單抗和扎木單抗。本發明還可用來生產包含例如任何上述蛋白質的重組融合蛋白。例如,可利用本發明的方法來生產包含上述蛋白質之一加上多聚化結構域諸如亮氨酸拉鏈、捲曲螺旋、免疫球蛋白或基本類似的蛋白質的Fc部分的重組融合蛋白。參見,例如,WO94/10308;Lovejoy等(1993),Science259:1288-1293;Harbury等(1993),Science262:1401-05;Harbury等(1994),Nature371:80-83;等(1999),Structure7:255-64。明確地包括在此類重組融合蛋白中的是受體的部分融合到抗體諸如依那西普(p75TNFR:Fc)、阿巴西普和貝拉西普(CTLA4:Fc)的Fc部分的蛋白質。本發明的範圍不受本文所述的具體實施方案限制,所述具體實施方案意欲作為本發明的個別方面的說明,並且功能上等同的方法和組分構成本發明的方面。確實,除了本文示出和描述的那些之外,根據以上描述和所附附圖,本發明的各種修改將對於本領域技術人員而言變得顯而易見。此類修改旨在處於所附權利要求書的範圍內。實施例實施例1將表達以往顯示出低水平高甘露糖(HM)表達的重組人抗體(MAbA)的產生單克隆抗體的中國倉鼠卵巢(CHO)細胞系用於siRNA實驗。使用基於DHFR的選擇克隆獲得所述細胞系;對於常規培養,將細胞懸浮培養於含有氨甲蝶呤(MTX)的選擇培養基中。在36℃、5%CO2和85%相對溼度下,將培養物維持在放空的125mL或250mL錐形搖瓶(CorningLifeSciences,Lowell,MA)或50mL放空的自旋試管(TPP,Trasadingen,Switzerland)中。將錐形瓶以120rpm用25mm軌道直徑在大容量自動CO2培養箱(ThermoFisherScientific,Waltham,MA)中振蕩,並且將自旋試管以225rpm、50mm軌道直徑在大容量ISF4-X培養箱(KuhnerAG,Basel,Switzerland)中振蕩。檢測八種不同的19聚體siRNA的Mgat1、Mgat2和Slc35a2。根據製造商的方案使用RNAiMAX(Invitrogen;LifeTechnologies;一種基於脂質的轉染試劑,其與核酸複合並促進細胞與核酸的轉染)將siRNA瞬時轉染至MAbA細胞系中。簡言之,在轉染日用500微升培養基將細胞以每孔2×105個接種在Corning公司的六孔板上。對於轉染,使10pmolsiRNA在100微升Opti-MemI培養基中與1.5微升LipofectamineRNAiMAX複合,並在室溫下孵育10分鐘。將RNAi-LipofectamineRNAiMax試劑複合物添加至各孔中。將板在36℃下於CO2培養箱中孵育3天。使用1X裂解緩衝液(AffymetrixInc.,SanataClara,CA)在50℃下將細胞裂解1小時。通過多路復用測定使用FLEXMAP系統(Luminex,AustinTX;蛋白質和基因組多路復用珠陣列測定)來將裂解物用於mRNA表達分析。對於mRNA表達分析,利用QuantiGenePlex2.0試劑系統(AffymetrixInc.,SantaClara,CA)。簡言之,使用增補有蛋白激酶K(儲備濃度50mg/mL)的1X裂解緩衝液(QS0100)(AffymetrixInc.,SantaClara,CA)將來自5x105個活細胞的細胞團裂解並在50℃下孵育1小時。將細胞裂解物在-80℃下儲存直至準備使用。使用靶向Mgat1、Mgat2和Slc35a3以及歸一化基因的定製的基因特異性探針組(Affymetrix,Inc.SantaClara,CA)。將冷凍的裂解物解凍並使用Affymetrix公司的標準方案處理而用於mRNA表達水平分析。將來源於測量來自每基因每孔100珠的中值報告基因螢光的數據測定並表示為中值螢光強度(MFI)。將本底信號在缺乏來自空白樣品的靶mRNA的情況下測定並從在靶mRNA存在下獲得的信號中減去。針對兩種持家基因:GusB和TBP將目標基因的螢光強度歸一化。將各靶RNA的測定強度通過測定檢測極限(LOD)來評估,定義為信號是三個高於本底的標準差的靶濃度。變異係數(CV)測量試驗精密度,並且是標準差與平均數的比率。將所有樣品重複操作三次,並且將裂解緩衝液用作空白。使用Luminex公司的Bio-Plex3D酶標儀分析樣品,並且使用Bio-Plex數據管理器5.0(Bio-RadLaboratories,Hercules,CA)獲得數據。對於各基因,選擇達到>85%敲除而沒有任何顯著脫靶效應的兩種siRNA。然後將所選的siRNA轉染至MAbA細胞系中,並且進行10天的補料分批抗體生產操作。在補料分批生產研究中,將細胞以3.5x105個細胞/mL接種至生產培養基中。將3mL工作容積用於24深孔板(AxygenScientific,UnionCity,CA)中,或者將25mL工作容積用於125mL放空的搖瓶中。在第3天、第6天和第8天將培養物補料7%的最初培養容積的快速灌注補料。在第3天、第6天和第8天將葡萄糖補料至10g/L的目標。在生產操作的第10天收穫離心的條件培養基。還在第3天、第6天、第8天和第10天獲取樣品的生長、活力和代謝數據,並且在第6天、第8天和第10天獲取樣品的效價和HM分析。在第3天、第6天、第8天和第10天將細胞團樣品從培養物中取出以用於mRNA表達分析;下表1示出了結果。表1:通過siRNA處理的Mgat1、Mgat2和Slc35a2的水平的減少mRNA表達分析顯示在10天培養操作中Mgat1和Mgat2轉錄物水平減少>50%。Slc35a2的表達水平從第3天至第6天減少>50%,而到第8天和第10天只看到7%-14%的減少。在補料分批的第十天測定抗體效價和%HM。由親和蛋白APOROSPAID傳感器盒通過使用WatersUPLC來測量效價。使用CaliperGXIIHM試驗(CaliperLifeSciencesInc.,PerkinElmer公司)或使用UPLCHILIC(親水相互作用色譜)(裝備有與AcquityUPLCBEHGlycanColumn一起使用的UPLCFluorescence(FLR)檢測器的WatersAcquityUPLC)來測量高甘露糖含量。下表2示出了結果(結果表示為平均值加/減標準差)。表2:用siRNA處理的細胞系的效價和%HM樣品效價(g/L)%HM無siRNA0.75±0.090.81±0.07siRNAMGAT10.73±0.0572.42±3.28siRNAMGAT20.87±0.271.98±0.31siRNASlc35A20.57±0.361.56±0.29這些結果的分析表明在用MgatlsiRNA處理的細胞中,HM的水平降低70%,然而Mgat2或Slc35a2的敲除不顯著影響HM。然而到第10天,Slc35a2的水平已恢復至對照值的90%,因此對於此實驗,不可能排除這種基因在調節HM中的作用。用siRNA處理未觀察到產生的抗體的效價的顯著變化。此外,siRNA處理似乎不影響生產率或細胞活力,表明了在減少的Mgat1mRNA表達的情況下觀察到的升高的HM水平很可能直接與減少的Mgat1活性有關。實施例2將表達以往顯示出高水平(即,>10%)高甘露糖型聚糖的重組人抗體(MAbB)的產生單克隆抗體的中國倉鼠卵巢(CHO)細胞系用於轉柒實驗。使用基於DHFR的選擇克隆獲得所述細胞系;對於常規培養,將細胞懸浮培養於含有MTX的選擇培養基中。基本如先前所述,將培養物維持在放空的125mL或250mL錐形搖瓶(CorningLifeSciences,Lowell,MA)或50mL放空的自旋試管(TPP,Trasadingen,Switzerland)中。將MAbB細胞用任一以下載體來轉染:零表達載體對照、含有用弗林蛋白酶pep2A連接的Mgat1和Mgat2的雙順反子表達載體(M1M2)、含有Slc35a2的載體(S)或共轉染的Mgat1、Mgat2和Slc35a2載體(M1M2S)。這些細胞在選擇培養基中恢復至大於80%活力後,使用流式細胞術將它們單細胞克隆。對於來源於單細胞的那些細胞系,分析目標基因的表達水平。對於四種不同載體中的每個,分析大於40個克隆的構型的目標基因的表達並且基於此分析而選擇二十種過表達細胞系和十種對照細胞系以用於基本如先前所述進行的兩個獨立10天補料分批生產操作中的進一步表徵。在第一補料分批生產開始時,平均來說,過表達細胞系的倍增時間較高(>25小時),並且與具有較高PDL的對照(<25小時)相比,PDL較低(圖1)。因此,為全部顯示出相似倍增時間的較小克隆亞組進行第二10天補料分批實驗(圖2)。來自第二補料分批實驗的所選克隆中的mRNA表達的統計分析確認了與對照相比過表達的倍數變化較為顯著。與Mgat1基因相比,Mgat2基因具有較大的表達增加倍數。下表3示出了結果。表3:三組過表達克隆的Mgat1、Mgat2和Slc35a2轉錄物水平的平均增加倍數。樣品Mgat1Mgat2Slc35A2M1M26.2426.290.99M1M2S1.457.7637.28S0.830.9927.1為了進一步研究誘導的過表達水平,使用液相色譜串聯質譜法(LC-MS/MS)量化Mgat1和Mgat2的蛋白質水平。分析用空載體(EV)轉染的對照細胞系以及過表達Mgat1和Mgat2的兩種系(B1和B2)。下表4示出了結果。以百萬分率(ppm)測量相對蛋白質表達。表4:第10天對照細胞系和過表達Mgat1和Mgat2的兩種細胞系中的歸一化mRNA和蛋白質水平如表4所示,EV展現出Mgat1和Mgat2的基礎表達水平,然而在B1和B2細胞系中這些蛋白質的表達水平顯著升高。此外,在B1和B2細胞系中,與Mgat1相比,Mgat2顯示了升高的表達水平。這些數據與對於第10天Mgat1和Mgat2的mRNA表達水平所觀察到的那些數據密切相關。相比之下,在第8天和第10天(分析蛋白質表達的兩天)對於這三種細胞系,持家對照蛋白的表達水平(GAPDH;數據未示出)保持恆定。圖3、4和5示出了生長和比生產率在所述組之間相似;然而,與另外兩組相比,對於過表達Mgat1和2的克隆,效價顯著增加。與對照細胞(分別為70%和29%)相比,過表達Mgat1和Mgat2的細胞系(M1M2)以及過表達全部三種基因的那些克隆(M1M2S)顯示了高甘露糖水平的減少(圖6)。然而,當與對照相比時過表達Slc35a2的細胞系(S)沒有顯示出統計學上顯著的變化(圖6)。因為UDP-半乳糖轉運蛋白(由Slc35A2編碼的蛋白質)的作用是將核苷酸糖底物(包括UDP-GlcNAc)轉運至高爾基體腔中,所以如果UDP-GlcNAc水平是限制性的,則升高的Slc35a2水平將不會影響隨後的聚糖加工。為每種過表達的細胞系(M1M2、M1M2S和S)評估分泌的重組MAbB的糖型特性。與對照細胞系相比,M1M2細胞系顯示了所有HM類諸如M5、M6、M7和M8b的顯著減少。結果展示於下表5中。表5:在補料分批的第10天過表達Mgat1、Mgat2和/或Slc35a2的細胞系中產生的抗體的糖基化特性在對照空載體細胞系中,A2G0F是評估的八種複合聚糖種類之中的優勢種類(49.17%),其次是A2G1F(16.46%)和其他複合糖型。對於M1M2和M1M2S,看到相對於不同種類百分比的相似趨勢。然而,在M1M2細胞系的情況下,與對照相比,A2G0F糖型的量顯著增加27%(顯著性值p=0.0076)。這暗示隨著Mgat2的表達存在著雜合聚糖(A1G0M5)至A2G0的有效轉化,並且因此與對照細胞系相比,更多底物可用於巖藻糖基轉移酶8(Fut8)以製造更多A2G0F產物。雖然在此實驗中Slc35a2的過表達似乎不引起複合聚糖水平的顯著升高,但是這些結果表明Mgat1和Mgat2的過表達可增加HM聚糖至複合糖型的轉化,因此降低HM水平。實施例3將CHO宿主細胞系單獨用Mgat1或Mgat2轉柒,或用Mgat1和Mgat2表達載體共轉染。這些細胞在選擇培養基中恢復至大於80%活力後,使用流式細胞術將它們單細胞克隆。分析總計291個克隆的Mgat1和Mgat2基因的表達。其中,基於良好生長和活力而選擇表達了高於重組CHO細胞系中檢測的水平的Mgat1和Mgat2水平的48個克隆,所述重組CHO細胞系表達具有以往低水平(即,<5%)高甘露糖類型聚糖的人單克隆抗體(MAbA)。使全部48個克隆生長至少60個PDL(群體倍增水平),並且在此時間過程期間在三個不同時間點處分析Mgat1和Mgat2的mRNA表達水平。基於各自mRNA的穩定表達水平而選擇十六個克隆。基本如Remy和Michnick(1999),Proc.Natl.Acad.Sci.,96:5394-5399所述,為了進一步評估這些克隆的轉柒能力,將全部48個克隆用含有綠色螢光蛋白(GFP)的載體在蛋白質片斷互補測定中進行瞬時轉染。選擇展現出最高轉染率的七個克隆以用於進一步分析。表6示出前七個克隆相對於對照CHO的Mgat1和Mgat2mRNA倍數變化。表6:Mgat1和Mgat2的轉錄物水平的平均增加倍數將以往展示出高水平(即,>15%)高甘露糖類型聚糖的單克隆抗體(MAbC)用於過表達Mgat1和/或Mgat2的改造的宿主細胞或者對照非改造的CHO宿主細胞中的轉柒。如先前所述,創建穩定細胞群並選擇以用於10天補料分批生產操作中的進一步表徵。為每種過表達的細胞系評估分泌的重組MAbC的糖型特性和效價。與對照宿主相比,對於MAbC,在宿主38C2中檢測到顯著較低水平的高甘露聚糖,而沒有影響生產率(即,效價)。表7示出了結果;數值反映出從補料分批生產試驗獲得的第10天效價和聚糖水平。表7:表達MAbC的非擴增克隆的效價和糖基化特性類似地,使150nM和300nM擴增群形成並在10天補料分批生產試驗中分析。在150nM群的情況下,與對照宿主細胞相比,所有過表達的宿主細胞展示出顯著降低的高甘露糖%,而沒有影響效價。表8和9示出了結果。表8:表達MAbC的150nM擴增克隆的效價和糖基化特性表8續*表示P值顯著如表9所示,隨著300nM擴增,對於五種群(61A9、45F2、63C5、38C2和2B8)檢測到顯著減小水平的高甘露聚糖水平。表9:300nM擴增MAbC的效價和糖基化特性表9續*表示P值顯著這些結果表明了經過轉化以過表達Mgat1和/或Mgat2的宿主細胞可用來製備HM聚糖至複合糖型的轉化增加的重組蛋白,並且因此降低HM水平。當前第1頁1 2 3 
