一種具有逆轉腫瘤多藥耐藥性功能的兩親性綴合物抗腫瘤納米藥及其製備方法和應用與流程
2023-12-02 18:54:16 1
本發明屬於抗腫瘤藥物技術領域,特別涉及一種具有逆轉腫瘤多藥耐藥性功能的兩親性綴合物抗腫瘤納米藥及其製備方法和應用。
背景技術:
多藥耐藥性(MDR)是導致臨床上腫瘤化療失敗的主要原因,而三磷酸腺苷(ATP)結合盒(ABC)膜轉運蛋白調控的藥物外排是MDR機制中最普遍的一種。P-gp糖蛋白是膜轉運蛋白中最重要的成員之一,P-gp蛋白能從ATP水解中獲得能量,從而將阿黴素、紫杉醇等小分子藥物排除到腫瘤細胞外,導致腫瘤細胞中小分子藥物富集濃度大大降低,導致腫瘤化療失敗(Nano Today 2011,6,176-185;Curr.Opin.Struct.Biol.2000,10,649-655)。為解決上述問題,前人將P-gp蛋白抑制劑(如異搏定、奎寧、環孢黴素A等)和小分子抗腫瘤藥物混合使用,以逆轉腫瘤的多藥耐藥性(Biochem.Pharmacol.1989,38,1727-1736)。然而,由於小分子P-gp抑制劑和抗腫瘤藥物普遍存在著生物相容性差、體內停留時間短和對正常組織的毒副作用等缺點,同時由於小分子P-gp抑制劑和抗腫瘤藥物之間物理化學性質不同,導致兩者的藥代動力學存在很大差異,使P-gp抑制劑和抗腫瘤藥物不能同時到達腫瘤部位,難以達到協同治療多藥耐藥性腫瘤的目的。
隨著納米技術的快速發展,在癌症的化療中,納米尺度物質常常被用作藥物載體,將藥物有效地輸送到腫瘤部位。若將小分子抗腫瘤藥物和P-gp蛋白抑制劑負載在同一納米載體內,同時輸送到腫瘤細胞,是一種有效克服腫瘤多藥耐藥性的方法,這些納米載體包括納米粒子(J.Control.Release 2009,136,21-29;Biomaterials 2010,31,358-365)、脂質體(Drug Deliv.2009,16,261-267;Front Pharmacol.2014,5,1-22)和聚合物膠束(Science 1998,281,1312-1316;Biomaterials 2011,32,1738-1747)。使用納米載體共輸送小分子抗腫瘤藥物和P-gp蛋白抑制劑,不僅能夠提高藥物在腫瘤部位的富集濃度(Eur.J.Pharm.Biopharm.2010,75,341-353),同時也可抑制P-gp蛋白的活性(Cancer Treat Rev.2008,34,592-602;Int.J.Nanomedicine 2012,7,187-197)。與小分子抗腫瘤藥物和P-gp蛋白抑制劑簡單物理混合使用相比,納米載體輸送方法的治療效果有了較大提高。但仍存在如下諸多問題,(1)在到達腫瘤部位之前,小分子抗腫瘤藥物和蛋白抑制劑可能會發生洩露(Eur.J.Biochem.1995,228,1020-1029),難以確保兩者同時富集到腫瘤部位;(2)大部分載體的載藥量非常低;(3)小分子抗腫瘤藥物和蛋白抑制劑由於物理化學性質的不同,兩者的藥代動力學存在很大的差異;(4)納米載體本身沒有治療作用,且在代謝過程中可能會引起器官毒性和炎症。因此,通過連接劑將小分子抗腫瘤藥物和P-gp蛋白抑制劑連接起來構築抗腫瘤納米藥物能夠有效地逆轉腫瘤的多藥耐藥性。
在CN201210475046「一種具有P糖蛋白抑制功能的抗腫瘤前藥」公開了由抗腫瘤藥物與具有P糖蛋白抑制功能的聚乙二醇琥珀酸酯通過連接器共價連接構成的兩親性物質,也同樣通過連接劑將小分子抗腫瘤藥物和P-gp蛋白抑制劑連接起來構築抗耐藥腫瘤納米藥物;然而聚乙二醇琥珀酸酯是一種大分子聚合物,僅具有P-gp蛋白抑制功能,且作用機制並不明確,同時需要藉助載體(如:聚乙二醇)才可得到穩定且分散均勻的納米顆粒。
技術實現要素:
本發明的第一目的是提供一種具有逆轉腫瘤多藥耐藥性功能的兩親性綴合物抗腫瘤納米藥,以解決大多數抗腫瘤小分子藥物普遍存在的多藥耐藥性問題,同時解決現有技術中逆轉腫瘤多藥耐藥性都需採用納米尺寸物質作為載體,而這些納米載體將藥物送到腫瘤細胞內後,其自身需要通過腎臟等器官排出體外,有可能引起腎臟等器官發生炎症或引起一些其它病症等技術性問題。
本發明的第二目的是提供一種具有逆轉腫瘤多藥耐藥性功能的兩親性綴合物抗腫瘤納米藥的製備方法,以解決大多數抗腫瘤小分子藥物普遍存在的多藥耐藥性問題,同時解決現有技術中逆轉腫瘤多藥耐藥性都需採用納米尺寸物質作為載體,而這些納米載體將藥物送到腫瘤細胞內後,其自身需要通過腎臟等器官排出體外,有可能引起腎臟等器官發生炎症或引起一些其它病症等技術性問題。
本發明的第三目的是上述的兩親性綴合物抗腫瘤納米藥應用於腫瘤和耐藥性腫瘤的治療,以解決大多數抗腫瘤小分子藥物普遍存在的多藥耐藥性問題,同時解決現有技術中逆轉腫瘤多藥耐藥性都需採用納米尺寸物質作為載體,而這些納米載體再將藥物送到癌細胞內後,其自身需要通過腎臟等器官排出體外,有可能引起腎臟等器官發生炎症或引起一些其它病症等技術性問題。
本發明的技術方案如下:
一種具有逆轉腫瘤多藥耐藥性功能的兩親性綴合物抗腫瘤納米藥,包括由抗腫瘤藥物與P-gp蛋白抑制劑奎寧通過連接劑共價連接而成的兩親性綴合物,所述兩親性綴合物在水中自組裝得到所述兩親性綴合物抗腫瘤納米藥;所述的抗腫瘤藥物為伊立替康、拓撲替康、阿糖胞苷、吉西他濱、艾沙託立賓、曲沙他濱、匹杉瓊、喜樹鹼、10-羥基喜樹鹼、7-乙基-10-羥基喜樹鹼、紫杉醇、多西紫杉醇或阿黴素中的一種。
優選為,所述的連接劑含有敏感鍵且至少含有兩個分別用於共價連接所述抗腫瘤藥物和所述P-gp蛋白抑制劑奎寧的反應官能團,所述的敏感鍵是在腫瘤細胞內環境下易斷裂的化學鍵。
優選為,所述的敏感鍵為二硫鍵、二硒鍵、酯鍵或醯腙鍵其中的一種。
優選為,所述的連接劑為3,3′-二硫代二丙酸,4,4′-二硫代二丁酸、3,3′-二硒代二丙酸,丁二酸酐、馬來酸酐、二乙醇酸酐或2,2′-二硫二乙醇其中的一種。
優選為,所述的兩親性綴合物抗腫瘤納米藥的粒徑為小於200nm。
本發明還公開了上述的具有逆轉腫瘤多藥耐藥性功能的兩親性綴合物抗腫瘤納米藥的製備方法,其特徵在於,包括以下步驟:
(1)所述的P-gp蛋白抑制劑奎寧與所述的連接劑反應,得到一中間體;
(2)將所述的中間體與所述的抗腫瘤藥物反應,得到所述的兩親性綴合物;
(3)將所述的兩親性綴合物溶解在與水互溶的有機溶劑中,然後滴入緩慢攪拌的水中,最後除去有機溶劑,即得到所述的兩親性綴合物抗腫瘤納米藥水溶液。
優選為,所述的有機溶劑為N,,N′-二甲基甲醯胺、二甲基亞碸、四氫呋喃或乙腈其中的一種。
在本發明的一具體實施方式中,由喜樹鹼、10-羥基喜樹鹼、7-乙基-10-羥基喜樹鹼、紫杉醇、多西紫杉醇或阿黴素製備兩親性綴合物抗腫瘤納米藥的過程中,步驟(2)還包括所述的中間體與所述的抗腫瘤藥物反應後,加入質子化試劑,得到所述的兩親性綴合物。
優選為,所述的質子化試劑為鹽酸或硫酸。
本發明的P-gp蛋白抑制劑奎寧為含羥基的疏水性蛋白抑制劑,同時將抗腫瘤藥物分為四類:含羥基的親水性抗腫瘤藥,如伊立替康、拓撲替康、阿糖胞苷、吉西他濱、艾沙託立賓、曲沙他濱;含氨基的親水性抗腫瘤藥,如匹杉瓊;含羥基的疏水性抗腫瘤藥,如喜樹鹼、10-羥基喜樹鹼、7-乙基-10-羥基喜樹鹼、紫杉醇、多西紫杉醇;含氨基的疏水性抗腫瘤藥,如阿黴素。本發明在製備方法上存在多種選擇,具體為:中間體的製備有以下三種方法,一、在室溫下,將奎寧加入於溶有4,4′-二硫代二丁酸、縮合劑和催化劑的有機溶劑中攪拌反應,得到一端為羧基的中間體;二、在75℃下,將奎寧加入於溶有丁二酸酐、馬來酸酐或二乙醇酸酐、催化劑的有機溶劑中攪拌反應,得到一端為羧基的中間體;三、在室溫下,將奎寧加入於溶有三光氣、縛酸劑的有機溶劑中攪拌反應,然後在室溫下,再加入2,2′-二硫二乙醇反應,得到一端為羥基的中間體。步驟(2)兩親性/非兩親性綴合物的製備有以下幾種:一、在室溫下,將末端為羧基的中間體與含羥基的親/疏水抗癌藥加入到有機溶劑中,再加入縮合劑和催化劑,攪拌反應,得到兩親性綴合物/非兩親性綴合物;二、在室溫下,將末端為羥基的中間體加入到溶有三光氣、縛酸劑和催化劑的有機溶劑中反應,然後在室溫下,加入含羥基的親/疏水性的抗癌藥反應,得到兩親性綴合物//非兩親性綴合物;三、在室溫下,將末端含羥基的中間體加入到溶有對硝基苯基氯甲酸酯、三乙胺的有機溶劑中反應,然後加入含氨基親/疏水性抗癌藥得到兩親性綴合物/非兩親性綴合物。
所述的縮合劑為N,N′-二環己基碳二亞胺(DCC)、1-乙基-(3-二甲基氨基丙基)碳二亞胺鹽酸鹽(EDC)的中的一種;所述的催化劑為4-二甲氨基吡啶(DMAP);所述的縛酸劑選自4-二甲氨基吡啶(DMAP)、三乙胺、N,N-二異丙基乙胺中的一種。
本發明還公開了上述的具有逆轉腫瘤多藥耐藥性功能的兩親性綴合物抗腫瘤納米藥在治療腫瘤和耐藥性腫瘤上的應用。
與現有技術相比,本發明的有益效果如下:
本發明的兩親性綴合物在水中可以自組裝形成納米顆粒,無需任何藥物輸送載體,就能共輸送蛋白抑制劑和抗腫瘤藥物,通過腫瘤組織的通透性增強與滯留效應,該綴合物抗腫瘤納米藥可以更有效地進入腫瘤多藥耐藥性細胞,減少對正常細胞的毒副作用;當兩親性綴合物抗腫瘤納米藥進入腫瘤多藥耐藥性細胞後,在腫瘤微環境條件(酸性或還原性條件)下連接基團發生斷裂,同時釋放出蛋白抑制劑和抗腫瘤藥物,蛋白抑制劑抑制P-gp蛋白的表達,防止抗腫瘤藥物被泵出到細胞外,從而提高腫瘤多藥耐藥性細胞內藥物濃度,達到逆轉腫瘤多藥耐藥性的目的。
與CN201210475046「一種具有P糖蛋白抑制功能的抗腫瘤前藥」相比,本發明的P-gp蛋白抑制劑奎寧是小分子蛋白抑制劑,作用機制明確;且本發明的抗腫瘤藥物既包括親水性的抗癌藥又包括疏水性的抗癌藥,而現有技術的聚乙二醇琥珀酸酯是親水性的,所以要做成兩親性的物質,只能跟疏水性的抗腫瘤藥物連接在一起,因此,本發明抗腫瘤藥物選擇範圍較廣,可根據病人病理情況進行選擇;和本發明的抗腫瘤納米藥不需要藉助於載體(例如:聚乙二醇)就可得到穩定且分散均勻的納米顆粒,而現有技術要藉助聚乙二醇高分子聚合物作為藥物載體才能在緩衝液中形成均勻分散的體系,得到納米藥物。
附圖說明
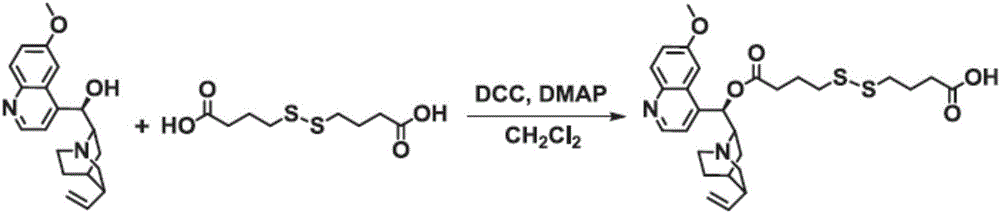
圖1為本發明實施例1的中間體Qu-ss-COOH的反應路線圖;
圖2為本發明實施例1的兩親性藥-藥綴合物Ir-ss-Qu的反應路線圖;
圖3為本發明實施例1的中間體Qu-ss-COOH的1H NMR譜圖;
圖4為本發明實施例1的中間體Qu-ss-COOH的13C NMR譜圖;
圖5為本發明實施例1的兩親性藥-藥綴合物Ir-ss-Qu的1H NMR譜圖;
圖6為本發明實施例1的兩親性綴合物Ir-ss-Qu納米藥的動態光散射粒徑分布圖;
圖7為本發明實施例1的兩親性綴合物Ir-ss-Qu納米藥的透射電子顯微鏡圖;
圖8為本發明實施例1的兩親性綴合物Ir-ss-Qu納米藥的體外藥物釋放曲線圖;
圖9為本發明實施例1的兩親性綴合物Ir-ss-Qu納米藥對多藥耐藥性腫瘤細胞的體外生長抑制作用的效果示意圖;
圖10為本發明實施例1的兩親性綴合物Ir-ss-Qu納米藥對P-gp蛋白抑制的效果示意圖;
圖11為本發明實施例1的兩親性藥-藥綴合物CPT-ss-Qu的合成路線圖。
具體實施方式
下面結合具體實施例,進一步闡述本發明。應該理解,這些實施例僅用於說明本發明,而不用於限定本發明的保護範圍。在實際應用中本領域技術人員根據本發明做出的改進和調整,仍屬於本發明的保護範圍。
實施例1:本發明的一種由奎寧Qu(式1)和伊立替康Ir(式2)製備的兩親性綴合物Ir-ss-Qu抗腫瘤納米藥
一、兩親性綴合物Ir-ss-Qu抗腫瘤納米藥的製備方法,具體包括以下步驟:
(1)中間體Qu-ss-COOH的合成
如圖1所示,在室溫下,分別向250mL乾燥潔淨的圓底燒瓶中,加入4,4′-二硫代二丁酸(4.77g,20mmol)、二環己基碳二亞胺(2.27g,11mmol)、4-甲氨基吡啶(1.22g,10mmol)和100mL無水四氫呋喃,攪拌反應30min後,然後將溶有奎寧(Qu,3.24g,10mmol)的50mL四氫呋喃溶液逐滴加入到上述反應體系中,繼續反應24h,反應結束後,旋蒸除去有機溶劑,得到粗產物,然後經矽膠柱純化(CH2Cl2∶CH3OH=20∶1,v/v),收集完畢後,旋蒸除去溶劑,即得到白色固體Qu-ss-COOH(3.12g,產率:65.8%),如式3所示。
如圖3所示,中間體Qu-ss-COOH的1H NMR(400MHz,CDCl3)δ(ppm):10.62(s,1H),8.70(d,J=4Hz,1H),8.01(d,J=8Hz,1H),7.46(d,J=2Hz,1H),7.38(dd,J=2Hz,J=2Hz,1H),7.25(s,1H),6.81(s,1H),5.65(m,1H),4.99(t,J=28Hz,2H),4.00(s,3H),3.48(s,1H),3.39(s,1H),3.23(t,J=24Hz,1H),2.91(t,J=24Hz,1H),21.70(m,1H),2.55(m,1H),2.46(s,1H),2.36(t,J=16Hz,2H),2.08(m,2H),1.94(m,4H),1.82(m,1H),1.72(m,1H),1.62(m,1H)。
如圖4所示,中間體Qu-ss-COOH的13C NMR(100MHz,CDCl3)δ(ppm):177.55,171.57,158.89,147.04,144.48,142.59,139.67,131.64,126.44,122.89,117.94,116.16,101.17,72.18,58.01,56.44,55.27,42.86,38.41,37.74,34.01,32.48,27.53,26.37,25.12,23.76,22.01。
ESI-MS m/z(M+H+)calcd 545.2148,found 545.2158(M+H+)。
(2)兩親性藥-藥綴合物Ir-ss-Qu的合成
如圖2所示,在室溫下,向250mL乾燥潔淨的圓底燒瓶中,分別加入中間體Qu-ss-COOH(2.32g,4.26mmol)、伊立替康(Ir,2.26g,3.85mmol),二環己基碳二亞胺(0.79g,3.85mmol)、4-甲氨基吡啶(0.43g,3.5mmol)和100mL無水CH2Cl2,攪拌反應24h後,過濾除去反應體系中的不溶物,濃縮除去有機溶劑後,再將粗產物過矽膠柱進行純化(CH2Cl2∶CH3OH=20∶1,v/v),收集完畢後,旋蒸除去有機溶劑,即得到淡黃色固體Ir-ss-Qu(3.8g,產率:69.7%),如式4所示。
如圖5所示,兩親性藥-藥綴合物Ir-ss-Qu的1H NMR(400MHz,CDCl3)δ(ppm):8.71(d,J=4Hz,1H),8.19(d,J=12Hz,1H),7.99(d,J=8Hz,1H),7.83(d,J=4Hz,1H),7.58(dd,J=4Hz,J=4Hz,1H),7.42(d,J=4Hz,1H),7.35(d,J=4Hz,J=4Hz,1H),7.32(d,J=4Hz,1H),7.15(s,1H),6.48(d,J=4Hz,1H),5.82(m,1H),5.67(d,J=16Hz,1H),5.40(d,J=16Hz,1H),5.23(d,J=4Hz,2H),5.01(m,2H),4.40(dd,J=16Hz,J=12Hz,2H),3.94(s,3H),3.34(m,1H),3.09(m,6H),2.90(t,J=24Hz,1H),2.62(m,12H),2.50(m,2H),2.25(m,2H),2.13(m,2H),1.99(m,6H),1.87(m,3H),1.69(m,7H),1.49(m,4H),1.38(t,J=16Hz,3H),0.96(t,J=16Hz,3H)。
兩親性藥-藥綴合物Ir-ss-Qu的13C NMR(100MHz,CDCl3)δ(ppm):172.24,172.11,167.76,158.12,157.54,153.28,151.62,150.64,147.63,147.29,147.07,146.09,145.56,144.91,143.79,141.84,131.96,131.74,127.75,127.29,127.17,126.18,122.07,120.07,119.09,114.79,101.57,95.96,76.17,73.99,67.31,62.58,59.31,56.73,55.92,50.47,49.50,44.58,44.25,42.68,39.82,37.54,37.27,32.77,32.32,31.99,28.40,27.91,27.70,26.24,24.72,24.58,24.13,23.38,14.23,7.81。
ESI-MS m/z(M+H+)calcd1113.4849,found 1113.4860(M+H+)。
(3)兩親性綴合物Ir-ss-Qu抗腫瘤納米藥的製備
取5mg兩親性藥-藥綴合物Ir-ss-Qu溶解在1mL DMSO中,室溫攪拌溶解5min後,將上述溶液緩慢滴加到3mL劇烈攪拌的超純水中,滴加完後,繼續攪拌30min,然後將納米藥物溶液轉移到透析袋(MWCO=1,000g mol-1)中,並用去離子水透析24h,每3h換一次去離子水,將DMSO透析完後,得到兩親性綴合物Ir-ss-Qu納米藥。用動態光散射粒徑分布儀和透射電子顯微鏡對其粒徑及形貌進行了表徵,結果如圖6和圖7所示,可以看到兩親性綴合物組裝成粒徑在110nm左右的球形納米藥。
二、兩親性綴合物Ir-ss-Qu抗腫瘤納米藥的性能測試
(1)兩親性綴合物Ir-ss-Qu抗腫瘤納米藥的體外釋放行為
將2mL 0.5mg mL-1的兩親性綴合物Ir-ss-Qu抗腫瘤納米藥物溶液裝入透析袋(MWCO=3,500)中,然後將透析袋置於50mL含不同濃度穀胱甘肽(GSH)(0.0mM、1.0mM or 5.0mM)的磷酸緩衝液中,以1.0mM or 5.0mM穀胱甘肽的磷酸緩衝液為實驗組,和以0.0mM穀胱甘肽的磷酸緩衝液為對照組。在恆溫37℃,每隔一定時間間隔,取出3mL磷酸緩衝液,同時分別補充加入3mL新鮮上述三種磷酸緩衝液到透析液中,最後在365nm激發波長下測定取出樣品的螢光發射強度,根據標準曲線計算出伊立替康(Ir)的濃度,釋放結果如圖8所示,可以看到在還原劑GSH作用下,雙硫鍵斷裂能有效的釋放出Ir。
(2)兩親性綴合物Ir-ss-Qu抗腫瘤納米藥逆轉乳腺癌多藥耐藥細胞(MCF-7/ADR)體外生長抑制效果
將MCF-7/ADR細胞以每孔1×104個細胞的密度,接種在96孔板中,每孔200μL,細胞置於5%CO2和37℃培養箱內培養過夜,待細胞完全貼壁後,更換新鮮的DMEM培養基,並加入含有不同系列濃度的Ir、Ir/Qu混合物或兩親性綴合物Ir-ss-Qu抗腫瘤納米藥物溶液,每孔50μL,加完結束後,培養箱中繼續培養72h;然後每孔加入20μL預先配置好的MTT的PBS溶液(5mg mL-1),繼續培養4h後,吸去DMEM培養液,每孔加入200μL DMSO,輕微振蕩10min溶解藍紫色甲瓚,用酶標儀測定490nm處吸光值(A);計算細胞存活率,算出各給藥組對MCF-7/ADR細胞的細胞毒性,算出IC50值,進而算出各給藥組對MCF-7/ADR細胞的耐藥逆轉指數,耐藥逆轉指數(IRDR)=IC50(游離的Ir組)/IC50(各實驗處理組),結果如圖9和表1所示,通過所得的耐藥逆轉指數可以得出,兩親性綴合物Ir-ss-Qu抗腫瘤納米藥有效的逆轉乳腺癌細胞的多藥耐藥性。
表1
(3)兩親性綴合物抗腫瘤納米藥對MCF-7/ADR腫瘤細胞P-gp蛋白的抑制效果
將MCF-7/ADR細胞以5.0×105個/孔的密度接種到6孔板中,每孔2mL,然後在培養箱中培養24h後,去除培養基,然後分別加入濃度20μM游離的Qu,Ir、Ir/Qu混合物或兩親性綴合物Ir-ss-Qu抗腫瘤納米藥物為實驗組,不加任何藥物的為對照組。在37℃孵育24h後,吸去培養液,用預冷的PBS漂洗兩遍,消化細胞,4℃下1000rpm離心10min,預冷的PBS洗2次,將細胞重懸於0.1mL PBS中,分別加入5μL PE-anti-human MDR1後,繼續孵育30min,然後加入0.4mL PBS,再次離心,PBS洗2次後用BD FACSCalibur流式細胞儀FL2通道測試並分析門內1×104個細胞的螢光。螢光的數值就代表細胞膜表面P-gp蛋白的表達量,測試結果如圖10所示,可以看出兩親性綴合物Ir-ss-Qu抗腫瘤納米藥能有效的抑制MCF-7/ADR細胞中P-gp蛋白的表達。
實施例2:本發明的一種由奎寧Qu(式1)和伊立替康Ir(式2)製備的兩親性綴合物抗腫瘤納米藥
一、兩親性綴合物Ir-cc-Qu抗腫瘤納米藥的另一製備方法,具體包括以下步驟:本實施例2除了以下步驟,其他步驟與實施例1相同。
(1)中間體Qu-cc-COOH的合成
取100mL反應瓶,向其分別加入奎寧(324mg,1mmol)、丁二酸酐(500mg,5mmol)、DMAP(122mg,1mmol)和50mL無水CH2Cl2,在氮氣保護下,75℃避光反應48小時,反應結束後,先用旋轉蒸發儀除去溶劑CH2Cl2,再將粗產物過矽膠柱進行純化(CH2Cl2∶CH3OH=20∶1,v/v),收集完畢,旋蒸除去有機溶劑,即得到淡黃色固體Qu-COOH(237mg,yield:51.1%)。
(2)兩親性藥-藥綴合物Ir-cc-Qu的合成
取50mL乾燥潔淨的圓底燒瓶,向其分別加入Qu-COOH(232mg,0.426mmol)、Ir(226mg,0.385mmol),二環己基碳二亞胺(0.079g,0.385mmol)、4-甲氨基吡啶(0.043g,0.35mmol)和10mL無水CH2Cl2,室溫下攪拌反應24h後,過濾除去反應體系中的不溶物,濃縮除去有機溶劑後,將粗產物過矽膠柱進行純化(CH2Cl2∶CH3OH=20∶1,v/v),收集完畢,旋蒸除去有機溶劑,即得到淡黃色固體Ir-cc-Qu(0.35g,產率:67.1%),如式5所示。
實施例3:本發明的一種由奎寧Qu(式1)和伊立替康Ir(式2)製備的兩親性綴合物Ir-ss-Qu抗腫瘤納米藥
一、兩親性綴合物Ir-ss-Qu抗腫瘤納米藥的又一製備方法,具體包括以下步驟:本實施例3除了以下步驟,其他步驟與實施例1相同
(1)中間體Qu-ss-OH的合成
取240mL反應瓶,向其分別加入奎寧(972mg,3mmol)、三光氣(311.6mg,1.05mmol)、DMAP(1.22mg,10mmol)和120mL無水CH2Cl2,在氮氣保護下,室溫避光反應1小時後,加入溶有2,2′-二硫二乙醇(2.26g,3.85mmol)的50mL CH2Cl2溶液,繼續反應24h,反應結束後,用1N HCl洗滌3次,然後用10%的飽和NaHCO3溶液洗滌3次,飽和食鹽水洗滌1次,去離子水洗滌2次,用無水Na2SO4乾燥過夜,過濾收集有機層,旋蒸除去有機溶劑後,將粗產物過矽膠柱進行純化(CH2Cl2∶CH3OH=20∶1,v/v),收集濃縮,即得到淡黃色固體Qu-ss-OH(877mg,yield:58%)。
(2)兩親性藥-藥綴合物Ir-ss-Qu的合成:
取90mL反應瓶,向其分別加入Qu-ss-OH(504mg,1mmol),三光氣(95.6mg,0.4mmol)、DMAP(0.488mg,4mmol)和60mL無水CH2Cl2,在氮氣保護下,室溫避光反應1小時後,加入溶有伊立替康Ir(2.32g,5mmol)的50mL THF溶液,繼續反應24h,反應結束後,用1N HCl洗滌3次,然後用10%的飽和NaHCO3溶液洗滌3次,飽和食鹽水洗滌1次,去離子水洗滌2次,用無水Na2SO4乾燥過夜,過濾收集有機層,旋蒸除去有機溶劑後,將粗產物過矽膠柱進行純化(CH2Cl2∶CH3OH=20∶1,v/v),收集濃縮後,即得到淡黃色固體Qu-ss-Ir(721.6mg,yield:64.6%),如式6所示。
實施例4:本發明的一種由奎寧Qu(式1)和匹杉瓊製備的兩親性綴合物抗腫瘤納米藥
一、兩親性綴合物匹杉瓊-ss-Qu抗腫瘤納米藥的製備方法,具體包括以下步驟:
(1)中間體Qu-ss-NPC的合成
先合成Qu-ss-OH,Qu-ss-OH的合成步驟同實施例3中步驟(1);然後取100mL反應瓶,向其分別加入Qu-ss-OH(504mg,1mmol)、對硝基苯基氯甲酸酯(NPC-Cl,201mg,1mmol)、三乙胺(0.15mL,1.1mmol)和60mL無水CH2Cl2,在氮氣保護下,室溫避光反應24小時後,旋蒸除去有機溶劑,將粗產物過矽膠柱進行純化(乙酸乙酯∶石油醚=1∶5,v/v),收集濃縮後,即得到淡黃色固體(532mg,yield:79.6%)。
(2)兩親性藥-藥綴合物匹杉瓊-ss-Qu的合成
將Qu-ss-NPC(532mg,0.79mmol)、匹杉瓊(440mg,0.79mmol)和三乙胺(0.58mL,4mmol)加入到30mL DMF溶液中,室溫攪拌反應24h後,濃縮除去DMF後,分別使用(CH2Cl2∶CH3OH=10∶1,5∶1,v/v)作為淋洗劑過矽膠柱進行純化,收集濃縮得到藍色固體匹杉瓊-ss-Qu(277.3mg,41%),如式7所示。
實施例5:本發明的一種由奎寧Qu(式1)和喜樹鹼CPT製備的兩親性綴合物抗腫瘤納米藥
先合成Qu-ss-COOH,Qu-ss-COOH的合成步驟同實施例1中步驟(1);如圖11所示,然後取250mL乾燥潔淨的圓底燒瓶,向其分別加入Qu-ss-COOH(1.16g,2.13mmol)、喜樹鹼(CPT,0.69g,2mmol)、二環己基碳二亞胺(0.5g,2.5mmol)、4-甲氨基吡啶(0.24g,2mmol)和100mL無水CH2Cl2,室溫下攪拌反應24h後,過濾除去反應體系中的不溶物,濃縮除去有機溶劑後,將粗產物過矽膠柱進行純化(CH2Cl2∶CH3OH=15∶1,v/v),收集完畢後,旋蒸除去有機溶劑,即得到淺黃色固體CPT-ss-Qu(1.25g,產率:73%)。然後將綴合物CPT-ss-Qu中的Qu進行質子化,得到兩親性綴合物CPT-ss-Qu,如式8所示。
實施例6:本發明的一種由奎寧Qu(式1)和紫杉醇PTX製備的兩親性綴合物抗腫瘤納米藥
先合成Qu-ss-COOH,Qu-ss-COOH的合成步驟同實施例1中步驟(1),然後取250mL乾燥潔淨的圓底燒瓶,向其分別加入Qu-ss-COOH(0.25g,0.45mmol)、紫杉醇(PTX,0.42g,0.5mmol)、二環己基碳二亞胺(103mg,0.5mmol)、4-甲氨基吡啶(48mg,0.4mmol)和100mL無水CH2Cl2,室溫下攪拌反應72h後,過濾除去反應體系中的不溶物,濃縮除去有機溶劑後,將粗產物過矽膠柱進行純化(CH2Cl2∶CH3OH=10∶1,v/v),收集完畢後,旋蒸除去有機溶劑,即得到白色固體粉末PTX-ss-Qu(0.372g,產率:64%)。然後將綴合物PTX-ss-Qu中的Qu進行質子化,即得到兩親性綴合物PTX-ss-Qu,如式9所示。
實施例7:本發明的一種由奎寧Qu(式1)和阿黴素製備的兩親性綴合物抗腫瘤納米藥
先合成Qu-ss-NPC,Qu-ss-NPC的合成步驟同實施例4中步驟(1),然後將Qu-ss-NPC(669mg,1mmol),阿黴素(579mg,1mmol),三乙胺(0.15mL,1mmol)加入到50mL DMF溶液中,室溫攪拌反應24h後,濃縮除去DMF,再分別使用(CH2Cl2∶CH3OH=20∶1,v/v)作為淋洗劑過矽膠柱進行純化,收集濃縮得到紅色固體粉末綴合物(0.84g,78%),然後將綴合物中的Qu進行質子化,即得到兩親性綴合物阿黴素-ss-Qu,如式10所示。
以上公開的本發明優選實施例只是用於幫助闡述本發明。優選實施例並沒有詳盡敘述所有的細節,也不限制該發明僅為所述的具體實施方式。顯然,根據本說明書的內容,可作很多的修改和變化。本說明書選取並具體描述這些實施例,是為了更好地解釋本發明的原理和實際應用,從而使所屬技術領域技術人員能很好地理解和利用本發明。本發明僅受權利要求書及其全部範圍和等效物的限制。
