苯並菲己烷氧基橋連異辛烷氧基苯基卟啉金屬Zn配合物的合成方法與流程
2023-05-22 05:36:21 1
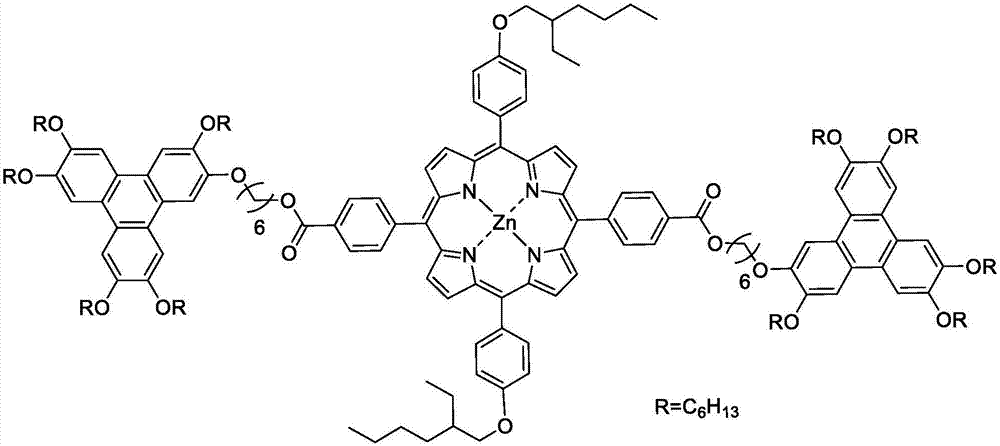
本發明涉及一種苯並菲己烷氧基橋連異辛烷氧基苯基卟啉金屬zn配合物的合成方法。
背景技術:
天然卟啉化合物在自然界中以多種形式廣泛存在於動植物體內,承擔著與生命活動密切相關的工作,人類合成多種卟啉化合物以模擬這些生命活動。1936年,paulrothemund等人以吡咯和醛類化合物作為反應物,吡啶作為反應溶劑,在密封環境中控制溫度在90-95℃之間反應30小時首次合成了卟吩,到了1941年,他又用等摩爾量的苯甲醛和吡咯作為反應物,在吡啶溶劑中密閉加熱合成出四苯基卟啉。此方法開創了卟啉合成的先河。此後,人們在此基礎上開創了多種合成卟啉化合物的方法,主要有adler法、lindsey法、郭燦城法、[2+2]法和微波誘導法等方法。
在研究過程中人們發現部分卟啉化合物是一種盤狀液晶化合物,其母體卟吩是一個共軛平面環,相當於盤狀液晶中的盤狀中心,且卟啉化合物在可見光範圍內存在吸收光譜,具有良好的光和熱穩定性;而苯並菲衍生物是一種擁有平面結構的多環芳烴,是一類非常重要的盤狀液晶材料,也具有良好的光學性質和熱穩定性。在盤狀液晶化合物的研究過程中,有關盤狀液晶低聚物的報導遠少於盤狀液晶小分子和盤狀液晶高聚物,但是相較於盤狀液晶單分子化合物,盤狀液晶低聚物具有更為寬泛的液晶中間相;同時由於盤狀液晶低聚物中的盤狀分子依然能夠通過π-π作用力堆集成柱狀相,所以它又比盤狀液晶高聚物擁有更好的電荷傳輸能力。
本發明利用兩個苯並菲單元和一個卟啉單元通過柔性橋鏈連接形成三聚體化合物-苯並菲癸烷氧基橋連甲氧羰基苯基卟啉金屬zn配合物,其合成方法簡便,在可見光區域具有強吸收。此類化合物未來可以應用在有機太陽能電池、有機光伏材料、液晶材料等分子器件中。
技術實現要素:
本發明的目的是提供一種苯並菲己烷氧基橋連異辛烷氧基苯基卟啉金屬zn配合物的合成方法。
本發明合成路線分為以下三個部分:第一部分先以對甲醯基苯甲酸甲酯和吡咯為原料合成二吡咯,再以對羥基苯甲醛和1-溴代異辛烷為原料合成對異辛烷氧基苯甲醛,然後二吡咯與對異辛烷氧基苯甲醛反應合成卟啉酯,卟啉酯水解、酸化得到卟啉酸;第二部分在三氯化鐵的氧化作用下鄰己烷氧基苯酚和鄰二己烷氧基苯發生偶聯反應生成單羥基五己烷氧基苯並菲,再將單羥基五己烷氧基苯並菲與1,6-二溴己烷為原料合成具有一個ω-溴支鏈的烷氧基苯並菲;第三部分將上述兩部分得到的中間體合成烷氧基橋連苯並菲-卟啉-苯並菲三元化合物後與金屬鹽在n,n-二甲基甲醯胺和三氯甲烷的混合溶劑中進行反應,進而得到金屬配合物。
苯並菲及其衍生物擁有良好的液晶性質,具有一維方向上的電荷傳輸和能量遷移性能,且合成苯並菲類化合物的原料易得,產品易於提純;而卟啉衍生物分子性質和結構穩定,具有良好的螢光性和芳香性,同時也是很好的電子接受體,其合成方法成熟,擁有液晶性質。在本發明中將苯並菲衍生物作為電子給體單元,卟啉衍生物作為電子受體單元,將它們通過柔性橋鏈連接,形成具有光誘導分子內電子轉移的性質的盤狀液晶三元化合物。此類化合物未來可以應用在有機太陽能電池、有機光伏材料、液晶材料等分子器件中。
附圖說明
圖1為本發明苯並菲己烷氧基橋連異辛烷氧基苯基卟啉金屬zn配合物結構式。
圖2為本發明合成路線的化學反應方程式。
圖中:r=c6h13。
具體實施方式
實施例:
實施例中所使用的化學試劑和溶劑均為分析純。
(1)二吡咯(化合物1)的合成:
取0.22毫升三氟乙酸室溫下避光滴加至35毫升含有6克對甲醯基苯甲酸甲酯的吡咯溶液中,氮氣氛圍下滴加30分鐘完畢,接著室溫下避光反應4小時後,加入400毫升二氯甲烷,反應混合物用100毫升0.1mol/l的氫氧化鈉水溶液洗滌三次,再用100毫升雙蒸水洗滌三次,分出有機層,加入無水硫酸鈉乾燥除水後,減壓旋蒸除去溶劑,得到的粗產物用200-300目矽膠柱層析提純(淋洗液:石油醚/二氯甲烷,體積比4:1),得到化合物1,7.20克白色固體,產率70.35%。mp:162.1-162.7℃.ir(kbr)νmax(cm-1):1710,1610,1430,1290,802.1hnmr(500mhz,cdcl3)δ:8.00(d,j=8.2hz,4h),7.36-7.26(m,2h),6.74(s,2h),6.26-6.14(m,2h),5.91(s,2h),5.55(s,1h),3.93(s,3h).
(2)對異辛烷氧基苯甲醛(化合物2)的合成:
取2.44克對羥基苯甲醛、5.20克溴代異辛烷、5.52克無水碳酸鉀和20毫升n,n-二甲基甲醯胺,氮氣氛圍下80℃反應24小時後,加入100毫升水,用60毫升乙酸乙酯萃取三次,分出有機層,再用30毫升飽和食鹽水洗滌有機層三次,分出有機層,加入無水硫酸鈉乾燥除水後,減壓旋蒸除去溶劑,得到的粗產物用200-300目矽膠柱層析提純(淋洗液:石油醚/二氯甲烷,體積比10:1),得到化合物2,4.30克淡黃色液體,產率91.88%。bp:>300℃.ir(kbr)νmax(cm-1):1610,1380,1260,841.1hnmr(300mhz,cdcl3)δ:9.87(s,1h),7.68(t,j=8.4hz,2h),6.89(d,j=8.4hz,2h),3.99(t,j=6.9hz,2h),2.13-1.98(m,1h),1.33-1.25(m,8h),0.96(t,j=6.9hz,6h).
(3)5,15-二-(4-甲氧碳基苯基)-10,20-二-(4-異辛氧基)苯基卟啉(化合物3)的合成:
取0.28克化合物1、0.23克化合物2、0.07克間硝基苯甲酸和3毫升二甲苯,140℃反應1小時後,冷卻至室溫,用200-300目矽膠柱層析提純(淋洗液:石油醚/二氯甲烷,體積比8:1),得到化合物3,0.13克紫色固體,產率26.37%。mp:>200℃.ir(kbr)νmax(cm-1):1720,1280,801.1hnmr(500mhz,cdcl3)δ:8.95(d,j=4.5hz,4h),8.81(d,j=4.5hz,4h),8.47(d,j=8.0hz,4h),8.34(d,j=8.0hz,4h),8.13(d,j=8.0hz,4h),7.32(d,j=8.0hz,4h),4.24-3.90(m,10h),2.13-1.93(m,2h),1.66-1.46(m,16h),1.17-1.06(m,6h),1.15-0.92(m,6h),-2.73(s,2h).
(4)5,15-二-(4-甲酸基苯基)-10,20-二-(4-異辛氧基)苯基卟啉(化合物4)的合成:
取0.1克化合物3加入15毫升四氫呋喃和15毫升甲醇的混合溶液中,再加入4毫升含有0.4克氫氧化鉀的水溶液,80℃冷凝回流反應10小時,冷卻至室溫後,用2mol/l的鹽酸溶液酸化至ph為2~3之間,布氏漏鬥抽濾,得化合物4,0.09克墨綠色固體,產率92.63%。mp:>200℃.ir(kbr)νmax(cm-1):2960,1720,1600,1260,802.
(5)鄰己烷氧基苯酚(化合物5)的合成:
取30克鄰苯二酚、45克1-溴代正己烷、60克無水碳酸鉀、2.28克碘化鉀和300毫升無水乙醇,85℃冷凝回流反應12小時,冷卻至室溫後抽濾,濾液減壓旋蒸除去溶劑,0.5mmhg的減壓蒸餾情況下收集84℃的餾分,得化合物5,15.46克無色油狀液體,產率29.52%。bp:106±3℃.ir(kbr)νmax(cm-1):1260,930.1hnmr(300mhz,cdcl3)δ:6.95-6.82(m,4h),5.68(s,1h),4.02(t,j=6.6hz,2h),1.83-1.76(m,2h),1.48-1.31(m,6h),0.91(t,j=6.9hz,3h).
(6)鄰二己烷氧基苯(化合物6)的合成:
取10克鄰苯二酚、45克1-溴代正己烷、37.26克無水碳酸鉀、3.32克碘化鉀和125毫升無水乙醇,85℃冷凝回流反應60小時,冷卻至室溫後抽濾,濾液減壓旋蒸除去溶劑,0.5mmhg的減壓蒸餾情況下收集142℃的餾分,得化合物6,24.53克無色油狀液體,產率96.96%。bp:255±3℃.ir(kbr)νmax(cm-1):1250,939.1hnmr(300mhz,cdcl3)δ:6.89(s,4h),3.99(t,j=6.9hz,4h),1.83-1.76(m,4h),1.49-1.31(m,12h),0.90(t,j=6.9hz,6h).
(7)單羥基-五己烷氧基苯並菲(化合物7)的合成:
取1.16克化合物5和3.32克化合物6溶於60毫升二氯甲烷中,經恆壓滴液漏鬥滴加至80毫升含有12.96克無水三氯化鐵和8毫升硝基甲烷的二氯甲烷溶液中,滴加30分鐘完畢,控制反應液溫度在0~3℃之間反應4小時後,加入30毫升甲醇和60毫升水終止反應,分出有機層,用30毫升二氯甲烷萃取水層三次,收集所有有機層,再用20毫升飽和食鹽水洗滌有機層,分出有機層,加入無水硫酸鈉乾燥除水後,減壓旋蒸除去溶劑,得到的粗產物用200-300目矽膠柱層析提純(淋洗液:石油醚/乙酸乙酯,體積比50:1),得到化合物7,1.80克白色固體,產率40.45%。mp:47.7-50.1℃.ir(kbr)νmax(cm-1):3040,1240,837.1hnmr(400mhz,cdcl3)δ:7.96(s,1h),7.83(s,3h),7.82(s,1h),7.77(s,1h),5.91(s,1h),4.31-4.19(m,10h),1.98-1.90(m,10h),1.59-1.40(m,30h),0.96-0.92(m,15h)
(8)溴代己氧基-五己氧基苯並菲(化合物8)的合成:
取1.19克化合物7、2.34克1,6-二溴己烷、0.15克四丁基溴化銨、0.36克氫氧化鉀、14毫升水和22毫升二氯甲烷,氮氣氛圍下室溫攪拌反應24小時後,分出有機層,用15毫升二氯甲烷萃取水層三次,收集所有有機層,再用12毫升飽和食鹽水洗滌有機層,分出有機層,加入無水硫酸鈉乾燥除水後,減壓旋蒸除去溶劑,得到的粗產物用200-300目矽膠柱層析提純(淋洗液:石油醚/乙酸乙酯,體積比100:1),得到化合物8,1.01克乳白色固體,產率69.52%。bp:>300℃.ir(kbr)νmax(cm-1):2930,1620,1260,837.1hnmr(400mhz,cdcl3)δ:7.83(s,6h),4.23(t,j=6.8hz,12h),3.38(t,j=6.8hz,2h),1.96-1.92(m,12h),1.60-1.51(m,16h),1.45-1.35(m,20h),0.93(t,j=6.8hz,15h).
(9)苯並菲己烷氧基橋連異辛烷氧基苯基卟啉(化合物9)的合成:
取0.20克化合物4、0.49克化合物8、0.08克碳酸鉀和12毫升n,n-二甲基甲醯胺溶液,氮氣氛圍下80℃回流反應24小時後,加入120毫升水,用60毫升乙酸乙酯萃取三次,分出水層和有機層,用20毫升飽和食鹽水洗滌有機層,分出有機層,加入無水硫酸鈉乾燥除水後,減壓旋蒸除去溶劑,得到的粗產物用200-300目矽膠柱層析提純(淋洗液:石油醚/二氯甲烷,體積比4:1),得到化合物9,0.32克紫色固體,產率58.72%。mp:31.8±3℃.ir(kbr)νmax(cm-1):2930,1720,1260.1hnmr(500mhz,cdcl3)δ:8.93(d,j=4.0hz,4h),8.80(d,j=4.0hz,4h),8.47(d,j=8.0hz,4h),8.32(d,j=8.0hz,4h),8.13(d,j=8.0hz,4h),7.94-7.78(m,12h),7.31(d,j=8.0hz,4h),4.58(t,j=6.5hz,4h),4.34-4.20(m,24h),4.16(d,j=6.0hz,4h),2.10-1.91(m,26h),1.78-1.38(m,88h),1.10(t,j=7.5hz,6h),1.02(t,j=7.5hz,6h),0.98-0.95(m,30h),-2.77(s,2h).elementalanalysiscalcdforc170h226n4o18(2613):c,78.12,h,8.72,n,2.14,found:c,78.08,h,8.74,n,2.19.
(10)苯並菲己烷氧基橋連異辛烷氧基苯基卟啉金屬zn配合物(化合物10)的合成:
取0.11克化合物9加入15毫升n,n-二甲基甲醯胺和10毫升三氯甲烷的混合溶液中,65℃攪拌反應2小時,反應完向反應液中加入200毫升水,分離出有機層,水層用15毫升三氯甲烷分三次萃取,合併有機層,用10毫升飽和食鹽水洗滌有機層。得到的有機液用無水硫酸鈉乾燥,減壓旋蒸後得紫色固體粗產物,將粗產物用矽膠柱進一步提純(淋洗液:石油醚/乙酸乙酯體積比100:1)。得到化合物5紫色固體0.10g,產率85.00%。mp:>300℃.ir(kbr)νmax(cm-1):2930(c-h),2840,2360,1720,1610(c=c),1510,1430,1390,1260(c-o-c),1170.1hnmr(500mhz,cdcl3)δ:9.02(d,j=4.5hz,4h),8.86(d,j=4.5hz,4h),8.41(d,j=8.0hz,4h),8.14(d,j=8.0hz,4h),8.13(d,j=8.0hz,4h),7.89(s,2h),7.84(s,2h),7.81(s,2h),7.69(s,2h),7.64(s,2h),7.55(s,2h),7.31(d,j=8.0hz,4h),4.58(t,j=6.5hz,4h),4.45–4.13(m,24h),4.01–3.93(m,4h),2.11–1.85(m,26h),1.81–1.36(m,88h),1.11(t,j=7.5hz,6h),1.03(t,j=7.5hz,6h),0.99–0.91(m,30h).
