具有DPP‑4抑制活性的中藥活性化合物及其製備方法與用途與流程
2023-05-28 12:53:56 3
本發明屬於中藥化學領域,更具體地說涉及從中藥消渴安膠囊中篩選發現的一種具二肽基肽酶4(DPP-4)抑制活性的活性化合物,該活性化合物及其製劑具有潛在的預防和治療餐後高血糖症、糖尿病綜合症中的高血糖症的作用。
背景技術:
糖尿病、肥胖症和高脂血症在世界範圍人口中的發病頻率很高並且繼續增加。在一般人群中,糖尿病是最慢性的疾病之一,其隨著肥胖和年齡的增多而發生。雖然有用於治療糖尿病綜合症所開發的藥物,但是今天在對糖尿病病人的治療中最具有挑戰的目標仍然是使血糖水平儘可能地接近正常。另外,餐後高血糖症和高胰島素血症是發生糖尿病大血管併發症的獨立危險因素。糖尿病是一種慢性代謝紊亂性疾病,其主要的幹預方法是控制飲食、減少攝入性碳水化合物的含量、藥物治療等。人體攝入的碳水化合物經過小腸上皮細胞的酶(如澱粉酶和α-葡萄糖苷酶)的水解作用生成葡萄糖之後,才被吸收進入血液循環。而DPP-4作為一種絲氨酸蛋白酶,在腸道中高表達,它能夠分解腸道細胞分泌的腸促胰島素(GLP-1)。通過抑制DPP-4活性,而阻斷其分解GLP-1,使GLP-1能夠持續發揮刺激胰島素分泌、抑制升糖素、抑制胃排空和讓胰島細胞重生等作用,從而降低血糖。目前,西格列汀、阿格列汀等DPP-4抑制劑可以抑制DPP-4活性,成為一類臨床常用的糖尿病治療藥物。但現有的DPP-4抑制劑大多為化學合成小分子,源於中藥的DPP-4抑制劑還少見報導。
消渴安膠囊是能清熱生津、益氣養陰、活血化瘀的治療2型糖尿病的臨床經驗方,具有一定的降血糖作用。其處方包括地黃、知母、黃連、人參、丹參、地骨皮、玉竹和枸杞八味藥材。
本發明涉及從消渴安膠囊中篩選具有顯著DPP-4抑制作用的化合物及其製劑,其可用於製備治療糖尿病藥物。消渴安膠囊的藥品文號為:國藥準字Z19991067,處方為:地黃 知母 黃連 地骨皮 枸杞子 玉竹 人參 丹參。
技術實現要素:
本發明的目的是提供具有DPP-4抑制活性的中藥活性化合物及其製備方法與用途,發現的新物質人參皂苷Ro,在製備治療糖尿病藥物中的應用。
具有DPP-4抑制活性的中藥活性化合物,其特徵是:該活性化合物為人參皂苷Ro。
具有DPP-4抑制活性的中藥活性化合物在製備治療糖尿病藥物中的應用。
治療糖尿病的藥物,其特徵在於由上述中藥活性化合物(人參皂苷Ro)加入藥劑學上可接受的輔料,按照藥劑學上記載的製劑製備方法製成。
治療糖尿病的藥物,其特徵在於所述的製劑包括液體製劑或固體製劑,但不限於此,包括其它常規劑型,不一一羅列。
具有DPP-4抑制活性的中藥活性化合物,其特徵在於人參皂苷Ro從消渴安膠囊中提取。但不限於此,也可以是其它藥材中提取。
具有DPP-4抑制活性的中藥活性化合物,其特徵在於人參皂苷Ro濃度為35-50 μmol/L。
具有DPP-4抑制活性的中藥活性化合物,其特徵在於人參皂苷Ro濃度為50 μmol/L。
消渴安膠囊為臨床驗證安全有效的抗糖尿病藥物,從中發現活性化合物用於製備治療糖尿病藥物,在有效性、安全性上能夠得到保障。採用製備液相色譜從消渴安膠囊中獲得人參皂苷Ro,簡單易得。
人參皂苷Ro製備方法步驟如下:
(1)原料:消渴安膠囊內容物。
(2) 取消渴安膠囊內容物120 g,加入10倍量甲醇超聲提取1h。過濾,50℃下旋蒸至浸膏狀,用100mL超純水復溶。復溶液用大孔樹脂進行分離,依次用水、40%乙醇和95%乙醇洗脫,分別得到B01、B02和B03組分。B03組分進一步用製備液相進行分離,流動相:水(A)-乙腈(B);流速:10 mL • min-1;柱溫:30℃;洗脫梯度:0 ~ 60 min(30% ~ 75% B),60 ~ 63 min(75% ~ 85% B),63 ~ 65 min(80% ~ 100% B),65 ~ 75 min(100% ~ 100% B)。取保留時間為37分鐘的色譜峰,即得。
本發明的有益效果為:
1、本發明提供的中藥有效組分化學成分簡單明確,在藥理研究上更易於闡明其作用機制。
2、本發明提供的方法首次從消渴安膠囊中得到具有DPP-4抑制活性的人參皂苷Ro,為糖尿病的防治提供新的藥物選擇。
3、消渴安膠囊為臨床驗證安全有效的抗糖尿病藥物,從中發現活性化合物用於製備治療糖尿病藥物,在有效性、安全性上能夠得到保障。
附圖說明
圖1為人參皂苷Ro對DPP-4的抑制作用。
圖2為人參皂苷Ro抑制DPP-4量效關係。
圖3為人參皂苷Ro對3T3-L1前脂肪細胞誘導分化的影響。
圖4為人參皂苷Ro對3T3-L1脂肪細胞總膽固醇含量的影響。
圖5為人參皂苷Ro對3T3-L1脂肪細胞甘油三酯含量的影響。
圖6為人參皂苷Ro對胰島素抵抗的BNL CL.2細胞葡萄糖消耗作用的影響。
具體實施方式
本發明結合實施例進一步詳細說明本發明的實質內容,該實施例僅用於說明本發明而並非對本發明的限制。
實施例一DPP-4抑制活性的測定
採用課題組建立的DPP-4抑制劑篩選方法,將人參皂苷Ro製成1 mmol/L濃度的溶液;將陽性藥抑二肽素A製成1 mmol/L濃度的溶液。取96孔板,加50 μmol/L 底物20µL,人參皂苷Ro溶液5 µL,0.1 U/mL DPP-4酶溶液5 µL,混勻後37℃下孵育30min,在激發波長320 nm,發射波長450 nm處測定其螢光強度值。計算人參皂苷Ro對DPP-4活性的抑制率。其中酶溶液,樣品溶液,反應底物溶液均以0.5 mmol/L,pH 7.0 HEPES緩衝液配製。
I給藥組:含底物和酶,並且加入待測樣品反應後的螢光強度值;
I給藥空白組:含底物和待測樣品,不加酶的螢光強度值;
I對照組:含底物和酶,但不加入待測樣品反應後的螢光強度值;
I空白組:只含有底物,不含酶和待測樣品的螢光強度值。
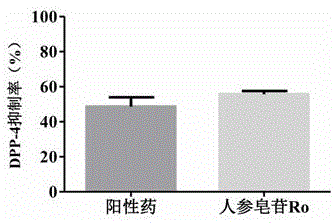
人參皂苷Ro在50 μmol/L濃度下抑制率為55.73%。相同條件下,陽性藥物抑二肽素A在5 μmol/L濃度下抑制率為48.60%。見圖1。
實施例二中藥活性化合物製劑
取實施例一的中藥活性化合物0.5g與10.5g聚乙二醇-6000混合均勻,加熱熔融,化料後移至滴丸滴灌中,藥液滴至6~8℃液體石蠟中,除油,製得滴丸400粒。
實施例三中藥活性化合物製劑
取實施例以的中藥活性化合物0.5g、葡萄糖4.5g、硫代硫酸鈉0.9g和蒸餾水1L,上述組分混合均勻後,冷凍乾燥,分裝500支,即得。
實施例四人參皂苷Ro對DPP-4抑制活性的量效考察
取96孔板,加50 μmol/L 底物20µL,0.1 U/mL DPP-4酶溶液5 µL以及一定體積濃度為1 mmol/L人參皂苷Ro溶液,使得人參皂苷Ro終濃度分別為5、10、25、35、50 μmol/L,反應總體積為100 µL。混勻後37℃下孵育30min,在激發波長320 nm,發射波長450 nm處測定其螢光強度值。計算人參皂苷Ro各濃度對DPP-4活性的抑制率。其中酶溶液,樣品溶液,反應底物溶液均以0.5 mmol/L,pH 7.0 HEPES緩衝液配製。
人參皂苷Ro在5、10、25、35、50 μmol/L濃度下抑制率分別為5.49%、13.48%、32.55%、46.65%、56.76%。見圖2。
實施例五對3T3-L1前脂肪細胞誘導分化的影響
3T3-L1前脂肪細胞以2×104個/孔接種於24孔板,置於37℃、含5% CO2細胞培養箱內進行孵育。當細胞匯合度達到80%左右時,將培養液換成3T3-L1前脂肪細胞成脂誘導液1培養48 h;隨後,換成3T3-L1前脂肪細胞成脂誘導液2繼續培養48 h;之後將培養液換成3T3-L1前脂肪細胞成脂誘導液3,每48 h換液一次,直至模型組約有75%的細胞分化為成熟脂肪細胞,共誘導分化10-12天。在更換誘導液的同時加入一定體積含人參皂苷Ro的培養液,使得人參皂苷Ro濃度為25 μmol·L-1。實驗另設對照組(不進行誘導分化)、模型組和陽性藥組(含有300 μmol·L-1西他列汀)。
誘導分化為成熟脂肪細胞後,棄去舊培養液,PBS漂洗1次,4%多聚甲醛固定1 h,之後PBS漂洗1次,油紅O染色0.5-1 h後,70%乙醇水溶液清洗2次,吸盡液體後,於顯微鏡下拍攝圖片。
人參皂苷Ro在25 μmol/L濃度下能抑制3T3-L1前脂肪細胞的誘導分化。見圖3。
實施例六對3T3-L1脂肪細胞總膽固醇和甘油三酯含量的影響
誘導分化為成熟脂肪細胞後,吸去原培養液,PBS漂洗1次,每孔加入250 μL細胞裂解液(所有操作於冰上完成)。反覆吹打細胞,使得細胞裂解完全,然後吸出每孔液體,4℃、12000 rpm離心10 min,取上清用於細胞蛋白定量及甘油三酯、總膽固醇含量的測定。
甘油三酯和總膽固醇含量測定:取100 μL細胞蛋白於96孔板中,加入100 μL甘油三酯(或總膽固醇)含量測定工作液,37℃振搖5 min,於550 nm處測定吸光度。
最後結果以甘油三酯(或總膽固醇)含量除以細胞蛋白含量表示。
25 μmol/L人參皂苷Ro能顯著降低脂肪細胞中總膽固醇和甘油三酯含量,使得3T3-L1脂肪細胞中總膽固醇和甘油三酯含量分別為0.63mmol/g蛋白和0.66mmol/g蛋白,與模型組相比有顯著性差異(P<0.01)。見圖4、5。
實施例七對胰島素抵抗的BNL CL.2細胞葡萄糖消耗作用的影響
取對數生長期的BNL CL.2細胞消化計數,2×104個/孔接種於96孔板,置於細胞培養箱中孵育,使細胞貼壁。24 h後,棄去舊培養液,PBS漂洗1次,之後加入一定體積的含胰島素和各藥物的DMEM,總體積為100 μL,使得胰島素濃度為1 μmol·L-1、人參皂苷Ro濃度為25μmol·L-1。實驗另設無細胞空白組(不含細胞)、溶劑對照組(含0.1% DMSO)、模型組(含1μmol·L-1胰島素)和陽性對照組(含300μmol·L-1西他列汀和1μmol·L-1胰島素)。細胞培養箱中孵育24 h後,取各孔10 μL上清於新的96孔板中,用於測定葡萄糖含量。之後將原96孔板中的培養基吸盡,避光加入100 μL含0.5 mg · mL-1 MTT的培養液,繼續於細胞培養箱內培養。4 h後,吸去含MTT的培養液,每孔加入100 μL DMSO,37℃震搖10 min後,酶標儀580 nm處測定各孔吸光度。本部分實驗使用的DMEM均為不含血清的低糖無酚紅DMEM。
葡萄糖含量測定:將葡萄糖測定試劑盒中的R1工作液和R2工作液等體積混合後,取200 μL混合液加入含有10 μL上清的96孔板中,37℃孵育30 min後,酶標儀492 nm處測定各孔吸光度。以無細胞空白組的葡萄糖含量減去其他各組葡萄糖含量即為各組細胞的葡萄糖消耗量,最後除以各組細胞MTT實驗的吸光度進行細胞數量的校正。
25 μmol/L人參皂苷Ro作用於胰島素抵抗的BNL CL.2細胞後,葡萄糖消耗量增加,且與模型組相比有顯著性差異(P<0.01)。見圖6。
