一種京尼平交聯脫細胞神經支架及其製備方法與應用與流程
2023-07-03 17:24:21 5
本發明涉及神經支架材料技術領域,具體涉及一種京尼平交聯脫細胞神經支架及其製備方法與應用。
背景技術:
周圍神經損傷是臨床常見的疾病,其對應的肢體運動,感覺功能完全喪失,肌肉萎縮給患者帶來極大痛苦並造成社會負擔。目前周圍神經損傷的修複方法大多採用顯微外科技術,即神經縫合術、自體神經移植術、神經植入術等。但是神經縫合及植入往往引起神經黏連和瘢痕形成,並且植入成功修復神經損傷的成功率較低,是神經外科學亟待解決的難題。
大量研究發現,在神經損傷修復中,在吻合處使用生物膜包繞,阻隔外部環境的影響,減少炎性細胞浸潤可有效防止黏連和瘢痕形成,並充分發揮遠端神經的趨化作用(mackinnon,s.e.anda.r.hudson,clinicalapplicationofperipheralnervetransplantation.plastreconstrsurg,1992.90(4):p.695-9.)。而與使用其他可降解生物材料相比,去細胞神經支架材料在修復神經缺損時表現出更好的生物相容性和生物力學性能,並且更易引導神經再生。
由於自身神經來源受限且異體異種神經具有免疫原性,因此,神經支架材料應去除神經細胞成分並最大程度保留細胞外基質成分(wang,q.,etal.,thepreparationandcomparisonofdecellularizednervescaffoldoftissueengineering.jbiomedmaterresa,2014.102(12):p.4301-8.)。目前證明對異種動物組織採用去細胞技術處理可獲得無免疫原性神經支架。現在常用的神經去細胞方法包括化學法和物理法。但是物理法去細胞不徹底,化學法所用化學物質難以完全去除,殘留對神經細胞附著再生有影響,因此,急需尋找新的方法改進神經支架的去細胞效果。
本申請人課題組在前期研究中利用一種新型的深海細菌酶——myroilysin處理wistar大鼠坐骨神經,獲得了脫細胞神經支架。myroilysin酶具有特異性,除溶解彈力蛋白和膨脹膠原外,不會破壞神經組織中的其他結構與成分,與天然神經細胞外基質非常相似。組織學觀察發現,myroilysin脫細胞神經支架具有徹底的脫細胞效果,所保留的神經基底膜結構均勻一致。但在後續的研究中發現,myroilysin酶對其儲存的條件要高,而且在儲存過程中酶的生物效價會發生變化,導致在製備脫細胞神經支架時需要對酶的加入量和處理時間等製備條件進行重新摸索。若製備條件選擇不當,則會導致製備的脫細胞神經支架的強度降低,進而影響脫細胞神經支架材料的機械性能,使其難以滿足植入部位的力學要求。
技術實現要素:
針對上述現有技術,本發明的目的是提供一種京尼平交聯脫細胞神經支架及其製備方法。
本發明的另一目的是提供上述京尼平交聯脫細胞神經支架在作為周圍神經損傷修復材料中的用途。
為實現上述目的,本發明採用如下技術方案:
本發明的第一方面,提供一種京尼平交聯脫細胞神經支架的製備方法,步驟如下:
將離體動物神經組織用tris-hcl溶液衝洗;將衝洗後的離體動物神經組織浸入myroilysin溶液進行孵育;孵育後加入含有京尼平的tris-hcl溶液進行交聯;交聯後再用tris-hcl溶液衝洗,即製備得到京尼平交聯脫細胞神經支架。
上述製備方法中,衝洗用的tris-hcl溶液的濃度為50mm,ph9.0。
上述製備方法中,所述myroilysin溶液的濃度為0.2-0.8mg/ml;優選為0.4mg/ml。
上述製備方法中,孵育的溫度為37℃,孵育的時間為12-48h;優選的,孵育的時間為24h。
上述製備方法中,含有京尼平的tris-hcl溶液中京尼平的濃度為0.2-0.3mg/ml;優選為0.25mg/ml。
上述製備方法中,含有京尼平的tris-hcl溶液中,tris-hcl溶液的濃度為50mm,ph7.2。
上述製備方法中,交聯的溫度為37℃,交聯的時間為12h。
本發明的第二方面,提供上述製備方法製備得到的京尼平交聯脫細胞神經支架。
本發明製備的京尼平交聯脫細胞神經支架具有極低的免疫原性和良好的生物學特性,可有效降低周圍神經黏連和瘢痕形成。而且,經京尼平交聯後的脫細胞神經支架與原有的myroilysin脫細胞神經支架相比,受儲存過程中myroilysin酶生物效價變化的影響較小,可以固定在優化後的製備條件下進行脫細胞神經支架的製備,無需反覆的進行製備條件的摸索。
本發明的第三方面,提供上述的京尼平交聯脫細胞神經支架在作為周圍神經損傷修復材料中的應用。
體外實驗表明,人牙髓幹細胞在本發明的京尼平交聯脫細胞神經支架上的生長、粘附、增殖狀況良好。
將附著神經幹細胞的京尼平交聯脫細胞神經支架材料在坐骨神經橫斷動物模型中進行功能驗證,觀察移植後神經修復、黏連與瘢痕形成情況。結果表明,含神經幹細胞的神經支架材料可以有效促進神經修復,緩解神經黏連。
上述技術方案具有如下有益效果:
(1)本發明通過京尼平對myroilysin脫細胞神經支架進行交聯,交聯的後脫細胞神經支架克服了myroilysin酶的生物效價變化對神經支架製備條件的影響,經京尼平交聯後的脫細胞神經支架的力學性能明顯提高;而且交聯後對脫細胞神經支架的生物相容性無顯著影響。
(2)本發明製備的京尼平交聯脫細胞神經支架的生物學特性良好、免疫原性低、能有效促進神經修復、減少神經黏連,為周圍神經損傷的臨床治療提供了新的手段。
附圖說明
構成本申請的一部分的說明書附圖用來提供對本申請的進一步理解,本申請的示意性實施例及其說明用於解釋本申請,並不構成對本申請的不當限定。
圖1:去神經wistar大鼠坐骨神經及其結構;圖中,a,b,c:周圍神經組織支架製備;a取材,b為sondell化學法(左為天然神經,右為脫細胞神經),c為京尼平交聯myroilysin法(左為天然神經,右為脫細胞神經);
d,e,f:周圍神經組織he染色;d為天然神經,e為化學法處理的神經,f為京尼平交聯myroilysin法處理的神經(放大倍數為200×);
g,h,i:周圍神經組織masson染色;g為天然神經,h為化學法處理的神經,i為京尼平交聯myroilysin法處理的神經(放大倍數為200×);
j,k,l:神經組織掃描電鏡觀察;j為天然神經,k為化學法處理的神經,l為京尼平交聯myroilysin法處理的神經。
圖2:體外細胞相容性試驗結果。
圖3:體內植入試驗結果。
圖4:牙髓前體細胞在脫細胞神經支架的生長情況;圖中,a為京尼平交聯myroilysin組,b為sondell化學組,c為明膠海綿組;(放大倍數為200×)。
圖5:支架浸提液對牙髓前體細胞表達神經營養因子的影響試驗的試驗結果。
圖6:坐骨神經橫斷兔移植含神經幹細胞的神經支架後修復情況。
具體實施方式
應該指出,以下詳細說明都是示例性的,旨在對本發明提供進一步的說明。除非另有指明,本文使用的所有技術和科學術語具有與本發明所屬技術領域的普通技術人員通常理解的相同含義。
需要注意的是,這裡所使用的術語僅是為了描述具體實施方式,而非意圖限制根據本發明的示例性實施方式。如在這裡所使用的,除非上下文另外明確指出,否則單數形式也意圖包括複數形式,此外,還應當理解的是,當在本說明書中使用術語「包含」和/或「包括」時,其指明存在特徵、步驟、操作和/或它們的組合。
正如背景技術所介紹的,myroilysin酶對其儲存的條件要高,而且在儲存過程中酶的生物效價會發生變化,導致在製備脫細胞神經支架時需要對酶的加入量和處理時間等製備條件進行重新摸索。基於此,本發明提出了一種京尼平交聯脫細胞神經支架及其製備方法與應用。
在本申請的一種實施方案中,提供了一種京尼平交聯脫細胞神經支架的製備方法,步驟如下:
先將動物神經使用50mmtris-hcl(ph9.0)將神經組織衝洗三遍;再0.4mg/mlmyroilysin溶液在37℃分別勻速震蕩孵育24h;使用京尼平0.25mg/ml的tris-hcl(50mm,ph7.2)37℃交聯12小時,50mmtris-hcl衝洗後儲存於4℃。
需要說明的是,為優化人工神經的理化特性及生物性能,目前已有涉及神經支架材料的重組或改性的報導,可根據不同需要進行一定的化學或生物修飾,如添加交聯劑、細胞活性成分等,然而這一材料性能的優化過程中不可避免的增加了材料降解產物生物相容性不佳的可能性。生物降解材料植入體內有可能會釋放出大量對人體系統有影響的物質。因此,盲目的對支架材料進行性能優化會提高支架降解後生物相容性不良的風險,這也是目前制約生物支架材料應用的難點所在。
京尼平是傳統中藥杜仲的活性成分之一,是從京尼平苷中分離、提純而獲得。京尼平含有羥基、羧基等多個活性官能團,可以用於天然生物材料的交聯。但是京尼平的交聯效果受交聯劑的濃度、ph值、溫度、交聯時間等多種因素的影響;而且,針對不同材料的氨基含量不同,需要對京尼平的交聯濃度進行篩選,通過溫度、ph值、交聯時間、交聯濃度等進行精確控制,避免過度交聯造成材料力學性能和抗酶解性能的極端化。
本發明在試驗過程中對京尼平的交聯條件進行了優化,結果發現,使用京尼平0.25mg/ml的tris-hcl(50mm,ph7.2)37℃交聯12小時,其交聯效果最佳。
為了使得本領域技術人員能夠更加清楚地了解本發明的技術方案,以下將結合具體的實施例詳細說明本發明的技術方案。
實施例1:京尼平交聯脫細胞神經支架的製備。
(1)坐骨神經的獲取
將成年wistar大鼠用3%戊巴比妥鈉按1ml/kg耳緣靜脈注射麻醉。將實驗動物側臥於手術臺上固定,術區備皮、消毒、鋪巾。在胭窩上方與臀大肌之間沿後肢外側正中線剪開皮膚後,在該處肌間隙處分離,尋找並暴露坐骨神經上下端,前行分離坐骨神經體視顯微鏡下去除神經外膜上附著的結締組織,修剪為長約2cm的坐骨神經節段。
(2)京尼平交聯脫細胞神經支架的製備
將獲得的成年wistar大鼠坐骨神經節段用含100u/ml青鏈黴素的50mmtris-hcl(ph9.0)緩衝液衝洗3次,將神經節段浸入0.4mg/ml的myriolysin(ph9.0,50mmtris-hcl緩衝液)中處理(37℃),脫色搖床震蕩(150轉/分)24小時,tris-hcl緩衝液衝洗3次。使用京尼平0.25mg/ml的tris-hcl(50mm,ph7.2)37℃交聯12小時,50mmtris-hcl衝洗後儲存於4℃中備用。
對比例1:
將成年wistar大鼠坐骨神經節段(坐骨神經節段的製備方法同實施例1)置於滅菌蒸餾水中低滲處理7h;3%tritonx-100浸泡12h;4%脫氧膽酸鈉中震蕩(150轉/分)24小時;重複上述步驟。滅菌pbs衝洗3次。所有步驟均在室溫下完成。置於pbs(4℃,10mm,ph7.2)中備用。
對比例2:
將成年wistar大鼠坐骨神經節段(坐骨神經節段的製備方法同實施例1)不做任何處理,獲取後立即進行固定。
試驗例1:脫細胞神經支架的生物學特性研究
1.去神經鼠坐骨神經及其結構
1.1he染色
取實施例1、對比例1和對比例2處理的坐骨神經節段,10%甲醛固定12小時,梯度酒精脫水,二甲苯透明2小時,浸蠟2小時,石蠟包埋,切片(片厚5μm),展片,烤片。
切片用二甲苯脫蠟,梯度酒精水化,蒸餾水浸洗3分鐘,蘇木素染色10分鐘,自來水衝洗,1%鹽酸酒精分化30秒,自來水衝洗20分鐘,伊紅染色2分鐘,梯度酒精脫水,二甲苯透明,中性樹膠封片,顯微鏡下觀察。結果如圖1所示。
1.2masson染色
(1)取實施例1、對比例1和對比例2處理的坐骨神經節段,10%甲醛固定12小時,梯度酒精脫水,二甲苯透明2小時,浸蠟2小時,石蠟包埋,切片(片厚5μm),展片,烤片。
(2)脫蠟:石蠟切片在二甲苯中脫蠟2次,每次10-15分鐘。
(3)梯度入水:95%,70%,30%乙醇各2分鐘,蒸餾水2分鐘。
(4)溫熱水漂洗:30-40℃溫熱水漂洗,每次45秒,共2次。分兩缸溫熱水進行漂洗,直至玻片上除樣本以外,其餘部分均沒有顆粒狀小水珠為止。
(5)染色:
染色前先用蒸餾水潤溼玻片1分鐘;
核染液染色60秒左右,倒丟,衝洗液衝洗1分鐘左右;
漿染液染色45秒左右,倒丟,衝洗液衝洗1分鐘左右;
分色液分色8分鐘;
復染液染色5分鐘左右,倒丟,用無水乙醇衝洗乾淨;
(5)封片、鏡檢。
結果如圖1所示。
1.3掃描電鏡觀察
將各組神經階段用2.5%戊二醛固定2小時,用pbs漂洗2次,每次20分鐘;1%鋨酸固定2小時,pbs漂洗2次,每次20分鐘;放入凍幹機中進行升華乾燥6小時後,將樣本放入樣品室,按照掃描電鏡操作的流程說明,進行鏡下觀察。
結果如圖1所示。
2.細胞毒性
2.1體外細胞相容性試驗
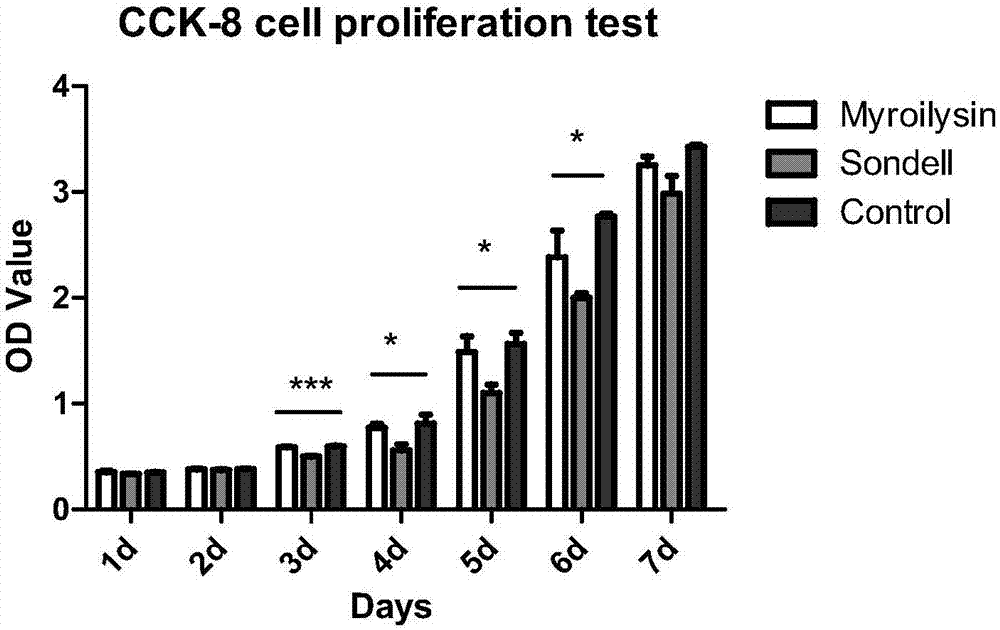
將實施例1(京尼平交聯myroilysin組)和對比例1(sondell組)製備的脫細胞神經按0.1g/ml比例分別置於α-mem培養液中,於37℃靜置72小時製備浸提液。將製備好的牙髓前體細胞的細胞懸液接種於96孔板內,待細胞貼壁後加入每組浸提液,於37℃、5%co2孵箱中分別培養1,2,3,4,5,6,7天,然後向每孔加入10μlcck-8溶液,注意不要生成氣包,以免氣泡折光影響od值。將培養板在培養箱內孵育2小時。對照組(control組):與實驗組同步,細胞貼壁後加入含20%胎牛血清的α-mem。最後將96孔板周圍每孔各加入500μlpbs以免靠近周邊的孔蒸發較快影響實驗結果。
檢測:用酶聯免疫檢測儀450nm波長測定3組的吸光度。結果見圖2。
由圖2可以看出,牙髓前體細胞接種3天開始,京尼平交聯myroilysin組增殖活性高於sondell組(p<0.05),差異具有統計學意義(p<0.0001);接種7天後,3組細胞增殖活性一致(p<0.05)。
2.2體內植入試驗
實驗動物選用成年紐西蘭大白兔6隻,雌雄不限,適應飼養1周後,進行神經支架材料的植入手術。於兔脊柱兩側3×8cm區域備皮。脊柱中線兩側各取1點作為皮下植入點,兩點均距中線約1.5cm,左側植入點近頭側,右側植入點近尾側。1%戊巴比妥鈉腹腔注射(40mg/kg),常規無菌條件下依次切開皮膚、筋膜、製備皮下囊,左側植入長1cm,直徑約1mm脫細胞神經支架材料(實施例1製備,作為京尼平交聯myroilysin組),右側植入約2mm×2mm×2mm明膠海綿(作為明膠海綿組)。縫合後,送回原籠繼續餵養,每天觀察皮膚手術切口及動物反應變化。於手術後1周、4周時各取3隻紐西蘭大白兔大鼠處死,切開皮膚仔細檢查兩側樣品及周圍組織的情況,進一步製作組織切片,進行he染色,光學顯微鏡下觀察。結果見圖3。
圖3中a和c分別為京尼平交聯myroilysin組術後1周和術後4周的he染色圖,由a可以看出:術後1周發現脫細胞神經支架結構仍然清晰完整,支架材料中有少量炎細胞浸潤;神經支架與周圍結締組織交界處可見大量炎細胞浸潤,以中性粒細胞為主;可見功能活躍的成纖維細胞及其周圍粉染的新生膠原;血管內皮細胞生長,血管內皮細胞形成連續的富含紅細胞的血管。
由c可以看出:術後4周可見脫細胞神經支架與周圍組織界限不明顯,炎性細胞已明顯減少;成纖維細胞減少,周圍可見大量膠原;支架材料中可見沿其排列一致的纖維細胞。
圖3中b和d分別為明膠海綿組術後1周和術後4周的he染色圖,由b可以看出:術後1周,明膠海綿及其周圍結締組織有大量炎細胞浸潤。
由d可以看出,術後4周,明膠海綿已降解,炎性細胞明顯減少,結締組織中可見較多纖維細胞。
2.3牙髓前體細胞在脫細胞神經支架的生長
2.3.1接種及培養
取一皿生長良好的第三代牙髓前體細胞,棄去細胞培養皿中舊培養液,吸取2-3mlpbs洗滌2次,加0.25%胰酶消化牙髓前體細胞製成單細胞懸液,並調整細胞濃度至106個/ml,用移液器將細胞分別均勻接種於實施例1和對比例1製備的脫細胞神經支架和明膠海綿上(96孔板),37℃、5%co2孵箱中靜置1小時,在含20%胎牛血清的α-mem培養液培養4天。
2.3.2edu標記
(1)用α-mem細胞培養液稀釋edu溶液(1000:1),配製成50μmedu培養液。
(2)向各培養孔中加入100μl50μmedu培養液,孵育2小時,棄培養液。
(3)pbs清洗細胞1-2次,每次5分鐘。
2.3.3細胞固定
(1)4%多聚甲醛室溫固定30分鐘,棄固定液。
(2)加入50μl2mg/ml甘氨酸,脫色搖床孵育5分鐘,棄甘氨酸溶液。
(3)加入100μlpbs,脫色搖床清洗5分鐘,棄pbs。
(4)加入100μl0.5%tritonx-100,脫色搖床孵育10分鐘;pbs清洗1次,5分鐘。
2.3.4apollo染色
(1)加入100μl的apollo染色反應液,脫色搖床孵育(避光、室溫)30分鐘,棄染色反應液。
(2)加入100μl0.5%tritonx-100,脫色搖床清洗2-3次,每次10分鐘,棄滲透劑。
(3)每孔每次加入100μl甲醇,清洗1-2次,每次5分鐘;pbs清洗1次,每次5分鐘。
2.3.5dna染色
(1)配製hoechst33342反應液,避光保存。
(2)加入100μlhoechst33342反應液,脫色搖床孵育(避光、室溫)30分鐘,棄反應液。
(3)每孔每次加入100μlpbs清洗1-3次。
(4)4℃、避光保存,待檢測(不應超過3天)。
2.3.6雷射掃描共聚焦顯微鏡下觀察,採集並分析圖像。
牙髓前體細胞在脫細胞神經支架的生長情況如圖4所示。
2.4支架浸提液對牙髓前體細胞表達神經營養因子的影響
2.4.1接種及培養
分別將實施例1(京尼平交聯myroilysin組)和對比例1(sondell組)製備的脫細胞神經按0.1g/ml比例置於α-mem培養液中,於37℃靜置72h製備浸提液。將製備好的牙髓幹細胞的細胞懸液(104/ml)接種於96孔板內,待細胞貼壁後加入每組浸提液,於37℃、5%co2孵箱中培養4天。對照組僅接種細胞,不添加神經移植物浸提液。
2.4.2totalrna提取
(1)pbs洗滌細胞後,向細胞培養瓶中加入2.5ml的rnaisoplus,水平放置片刻,吹打細胞。將上述混有細胞的裂解液轉移至離心管,反覆吹吸直至其無明顯沉澱。
(2)向上述離心管中加入0.5ml氯仿,劇烈震蕩15秒,待溶液無分相現象後,室溫靜置5分鐘。
(3)4℃下12000g離心15分鐘。
(4)從離心機中小心取出離心管,吸取上清液轉移至另一新的離心管中,加入等體積異丙醇,充分混勻,靜置10分鐘。
(5)4℃下12000g離心10分鐘,試管底部出現沉澱,棄上清,倒置ep管控幹水分。
(6)加入75%的乙醇1ml,輕輕上下顛倒洗滌離心管管壁,4℃下12000g離心5分鐘。
(7)棄去上清,控幹乙醇,加入20μldepc水,輕輕吹打沉澱,待沉澱溶解置於-80℃保存,作為totalrna待用。
(8)rna定量:吸取lμlrna樣品,加depc水至100μl,depc水為空白對照。紫外分光光度計測定總rna的濃度和od260/od280。od比值在1.8-2.2間的總rna可用於後期rt-pcr。
2.4.3反轉錄反應
(1)基因組dna的除去反應
反應體系:5×gdnaeraserbuffer2.0μl,gdnaeraser1.0μl,totalrna(不超過1μg),加rnasefreedh2o至10μl。
按上述反應體系配液後42℃孵育2分鐘或者室溫5分鐘。
(2)反轉錄反應
反應體系:向上述反應液中加入rnasefreedh2o4.0μl和5×primescriptbuffer24.0μl,混合後再添加rtprimermix和primescriptrtenzymemixⅰ,輕輕混勻。
反轉錄程序設置為37℃,15分鐘;85℃,5秒;4℃,5分鐘。反轉錄所獲得的cdna需長時間保存時,可保存於-20℃。
(3)rt-pcr反應
(1)pcr反應液配製(冰上操作):extaqtm10.0μl,pcrforwardprimer(10μm)0.4μl,pcrreverseprimer(10μm)0.4μl,dna模板2.0μl,滅菌蒸餾水7.2μl。
(2)rt-pcr反應
預變性:95℃,30秒,20℃/秒,1cycle;
pcr反應:95℃,5秒,20℃/秒;60℃,20秒,20℃/秒,40cycles;
融解曲線分析:95℃,0秒,20℃/秒;65℃,15秒,20℃/秒;95℃,0秒,0.1℃/秒。
支架浸提液對牙髓前體細胞表達神經營養因子的影響試驗的試驗結果見圖5。
由圖5可以看出:京尼平交聯myroilysin組gdnf表達明顯低於sondell組和空白對照組(p<0.001),sondell組gdnf表達明顯低於空白對照組(p<0.01);myroilysin組bdnf和ngf表達明顯低於空白對照組(p<0.001),sondell組與空白對照組bdnf和ngf表達無統計學差異。
實施例2:含神經幹細胞神經支架修復周圍神經損傷的動物實驗
(1)模型建立
實驗動物選用3月齡紐西蘭大白兔12隻,雌雄不限,適應飼養1周後,進行神經支架複合物的植入手術。戊巴比妥鈉麻醉後於紐西蘭大白兔手術區域備皮消毒。常規無菌條件下依次切開皮膚、筋膜,分離肌肉,暴露坐骨神經。
選取一側植入長1cm,直徑約1mm複合dpscs的脫細胞神經支架材料,縫合後,送回原籠繼續餵養,每天觀察皮膚手術切口及動物反應變化。180°自體神經及脫細胞神經支架材料分別作為對照組植入動物體內。於手術後30天、90天時各取3隻紐西蘭大白兔大鼠處死,切開皮膚仔細檢查兩側樣品及周圍組織的情況,進一步製作冰凍組織切片,進行免疫螢光染色,光學顯微鏡下觀察。於90天各取2隻紐西蘭大白兔戊巴比妥鈉麻醉後測量神經傳導速度。
(2)結果
結果如圖6所示,圖中,a,b,c,d分別表示:dpscs複合實施例1製備的脫細胞神經組、單純實施例1製備的脫細胞神經、自體神經移植組和對照組的紐西蘭大白兔小腿複合神經肌肉動作電位;e,f分別表示:dpscs複合實施例1製備的脫細胞神經組,單純實施例1製備的脫細胞神經及自體神經移植組的複合神經肌肉動作電位振幅和傳導速度比較(*p<0.05;**p<0.01;***p<0.001;n=3).
結果表明:將牙髓前體細胞和實施例1製備的脫細胞異種神經支架複合物植入兔坐骨神經後,獲得了良好的神經再生和運動功能,這再次證實了利用京尼平交聯myroilysin去細胞方法,可獲得一種有效改良細胞生長微環境,促進神經幹細胞在體外定向分化,移植後能夠促進受損神經纖維重塑的組織工程支架。
實施例3:京尼平交聯脫細胞神經支架前後的力學性能測試
1.試驗方法:
將交聯前脫細胞神經支架組設為a組(與實施例1的區別在於:不用京尼平進行交聯),交聯後脫細胞神經支架組設為b組(實施例1製備),分別將兩組樣本從冷凍(-80℃)中取出,生理鹽水浸泡40min後,將各組樣本固定於冰凍卡具中部,5min後旋緊卡具以保證固定的神經已被凍硬,不會向各向滑動;而外露的神經仍為常溫,不會影響拉伸實驗過程中的力學測試結果。通過wintest力學測試軟體將兩卡具間的距離固定為8mm,即初始長度為8mm。以1mm/min的速度拉伸神經直至其斷裂,應力、應變、位移、及載荷每秒取樣10次。測試過程中使用生理鹽水保持樣本溼潤。讀出每個點的載荷及相應的位移。按以下公式計算每組神經的生物力學特性:韌度(=載荷/位移(n/mm);斷裂功耗=載荷-位移曲線中極限載荷點左側曲線下的面積;極限應力=極限載荷/面積(mpa);彈性模量=應力/應變(mpa);極限應變=極限載荷對應的位移/樣本的初長度。
2.試驗結果:
兩組神經的生物力學測試結果如表1所示。
表1:兩組神經的生物力學測試(n=10,x±s)
交聯後脫細胞神經支架極限載荷、韌度、彈性模量、極限應力、斷裂功耗增加,僅彈性模量之間的差異有統計學意義(p<0.05)。
上述實施例為本發明較佳的實施方式,但本發明的實施方式並不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護範圍之內。
