FH535誘導的肌肉萎縮模型及其應用的製作方法
2023-05-05 10:28:36 1
本發明涉及生物
技術領域:
,具體涉及FH535誘導的肌肉萎縮模型及其應用。
背景技術:
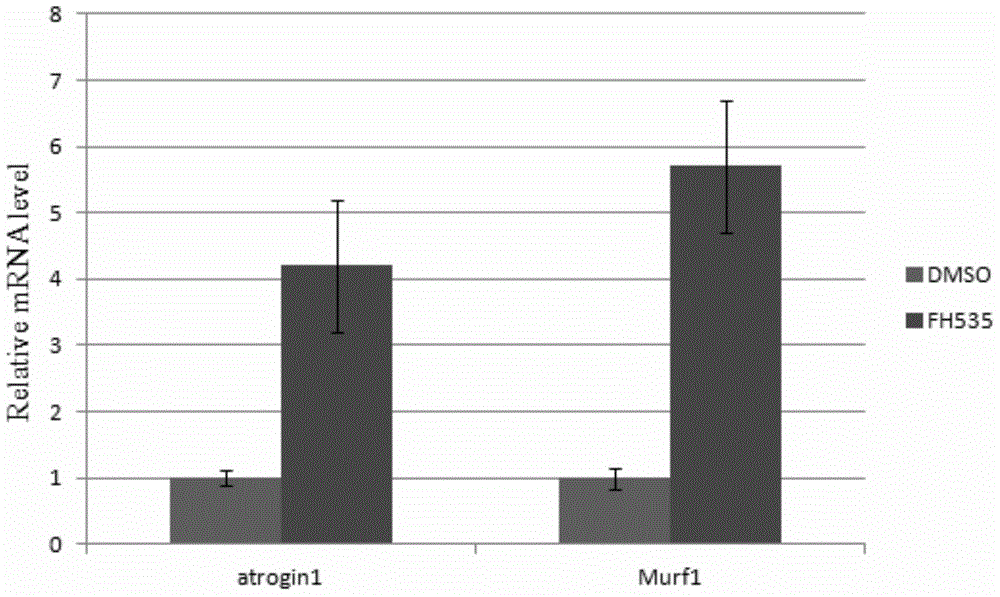
:目前的肌肉萎縮細胞模型主要通過血清飢餓製備,其模擬的是在營養不良情況下的肌肉萎縮,但是在現代社會由於營養不良造成的肌肉萎縮只佔肌肉萎縮症患者中很小的比例,包括衰老相關肌肉萎縮在內的絕大多數肌肉萎縮都不是由營養不良造成的。要製備衰老相關肌肉萎縮的細胞模擬,目前只能從衰老小鼠肌肉中直接分離終末分化的肌纖維。這一方法耗時很長,需將小鼠至少飼養一年。一致性較差,由於小鼠存在個體差異,同樣年齡的小鼠,其肌肉萎縮的程度存在比較大的差異。自體內直接分離的肌纖維只能在體外培養3-5天,再次使用必須另取新的小鼠進行分離。而由於小鼠間的個體差異,很難保證從不同個體中分離到的肌纖維的萎縮程度的一致性,因而妨礙採用此系統的實驗的一致性。目前常用的肌肉萎縮動物模型主要通過限制進食獲得,其模擬的是在營養不良情況下的肌肉萎縮。如上文所述,營養不良造成的肌肉萎縮在現代社會發生率很低,無法模擬衰老相關肌肉萎縮。另一獲得衰老相關肌肉萎縮動物模型的方法是經長期飼養等動物衰老後作為模型使用。這一方法耗時很長,如上文所述,由於個體差異造成一致性很差,從而降低藥物篩選實驗的重複性。現有技術中,尚未未發現小分子FH535與肌肉萎縮之間的關係。技術實現要素:為了克服現有技術中的缺陷,本發明提供了一種FH535的新用途,並將FH535用於誘導肌肉細胞發生萎縮,成功構建了肌肉萎縮細胞模型和肌肉萎縮動物模型。本發明的肌肉萎縮細胞模型和動物模型具有肌肉萎縮的典型特徵,可極好地模擬體內肌肉萎縮的發生發展,是肌肉萎縮基礎和臨床應用研究的理想細胞模型和動物模型,可良好地應用於篩選治療肌肉萎縮的藥物。本發明是通過以下技術方案實現的:本發明的第一方面,提供了FH535在製備誘導肌肉細胞發生萎縮的藥物或製劑中的用途。優選的,所述肌肉細胞為終末分化的肌肉細胞。優選的,所述藥物或製劑還用於減小肌肉中肌管的直徑或橫切面積。優選的,所述藥物或製劑還用於上調肌肉細胞中Atroign1和Murf1等肌肉萎縮相關基因的表達水平。本發明的第二方面,提供了FH535在構建肌肉萎縮細胞模型或肌肉萎縮動物模型中的用途。本發明的第三方面,提供了一種構建肌肉萎縮細胞模型的方法,所述方法包括以下步驟:向肌肉細胞施用有效劑量的FH535;獲得肌肉萎縮細胞模型。優選的,所述肌肉細胞為終末分化的肌肉細胞。優選的,所述終末分化的肌肉細胞選自以下任一:(1)由肌肉前體細胞、原代肌肉祖細胞或幹細胞分化而成;(2)由體內肌肉直接分離得到終末分化的肌管細胞。在本發明的優選實例中,所述終末分化的肌肉細胞由肌肉前體細胞分化而成。所述肌肉前體細胞選自肌肉前體細胞系,如C2C12細胞。更優選的,所述終末分化的肌肉細胞是將肌肉前體細胞採用分化培養基培養2~4天,誘導分化而成。最優培養時間為3天。優選的,所述施用有效劑量的FH535的方法為:採用新鮮的含有效劑量的FH535的分化培養基,培養終末分化的肌肉細胞。在本發明的優選實例中,所述有效劑量的FH535是指FH535在分化培養基中的終濃度為2~30μM;培養時間為24~48小時。更優選的,FH535在分化培養基中的終濃度為5~10μM;培養時間為24~48小時。最優選FH535的終濃度為10μM;培養時間為24小時。本發明的第四方面,提供了由前述方法構建的肌肉萎縮細胞模型在篩選藥物中的用途。本發明的第五方面,提供了一種篩選治療肌肉萎縮的候選藥物的方法,所述方法包括以下步驟:將測試候選藥物施用於由前述方法構建獲得的肌肉萎縮細胞模型,並與未施用測試候選藥物的肌肉萎縮細胞模型進行比較,其中施用後導致肌肉萎縮症狀改善或治癒的測試化合物就是治療肌肉萎縮的候選藥物。上述篩選出的候選藥物可構成一個篩選庫,可對這些物質進行進一步的細胞實驗、動物實驗、和/或臨床試驗,以進一步確證所述潛在物質的治療肌肉萎縮作用。由於本發明採用FH535進行誘導,所構建的模型更類似於人類的發病過程,一致性高,因而在藥物的篩選上比以往的模型更為精準,效率更高。本發明的第六方面,提供了一種構建肌肉萎縮動物模型的方法,所述方法包括以下步驟:給哺乳動物施用有效劑量的FH535;獲得肌肉萎縮動物模型。優選的,所述的哺乳動物是鼠。更優選小鼠。優選的,所述施用的方法為局部肌肉注射。優選的,具體方法為:連續數天,給哺乳動物通過脛骨前肌局部注射的方式,施用有效劑量的FH535後,飼養數天。在本發明的優選實例中,具體方法為:通過脛骨前肌局部注射的方式,對小鼠施用0.045~0.18mg/kg體重的FH535,每兩天注射一次,共注射5~8次後,進行飼養7~12天。更優選的,具體方法為:通過脛骨前肌局部注射的方式,對小鼠施用0.09mg/kg體重的FH535,每兩天注射一次,共注射7次後,進行飼養10天。本發明的第七方面,提供了由前述方法構建的肌肉萎縮動物模型在篩選藥物中的用途。本發明的第八方面,提供了一種篩選治療肌肉萎縮的候選藥物的方法,所述方法包括以下步驟:將測試候選藥物施用於由前述方法構建的肌肉萎縮動物模型,並與未施用測試候選藥物的肌肉萎縮動物模型進行比較,其中施用後導致肌肉萎縮症狀改善或治癒的測試化合物就是治療肌肉萎縮的候選藥物。上述篩選出的候選藥物可構成一個篩選庫,可對這些物質進行進一步的細胞實驗、動物實驗、和/或臨床試驗,以進一步確證所述潛在物質的治療肌肉萎縮作用。由於本發明採用FH535進行誘導,所構建的模型更類似於人類的發病過程,一致性高,因而在藥物的篩選上比以往的模型更為精準,效率更高。本發明的有益效果在於:(1)本發明首次揭示了FH535能夠誘導肌肉細胞發生萎縮,更類似於人類的發病過程,模型的一致性高。(2)本發明的肌肉萎縮細胞模型和動物模型具有肌肉萎縮的典型特徵,可極好地模擬體內肌肉萎縮的發生發展,是肌肉萎縮基礎和臨床應用研究的理想細胞模型和動物模型,可良好地應用於篩選治療肌肉萎縮的藥物。附圖說明圖1:FH535加入myotube造成肌肉萎縮:A:與空白對照組相比,加入FH535後myotube的直徑顯著減小;B:統計學分析顯示,加入FH535後myotube的直徑顯著減小至約為空白對照組的三分之一。圖2:FH535誘導肌肉萎縮,在加入FH535後,肌肉萎縮特異性基因Atrogin1,Murf1表達均上調。圖3:不同劑量FH535對於終末分化肌肉細胞直徑的影響。圖4:不同誘導分化天數對於終末分化肌肉細胞直徑的影響。圖5:FH535誘導肌肉萎縮的小鼠模型:A:HE染色表明注射FH535後肌肉直徑顯著變小;B:統計學分析顯示,注射FH535後肌肉直徑明顯變小。圖6A:FH535誘導的肌肉萎縮在加入Wnt3a後被逆轉。圖6B:Myotube直徑統計分析顯示,FH535誘導的肌肉萎縮在加入Wnt3a後被逆轉。圖7A:雖然能夠逆轉FH535誘導的肌肉萎縮,Wnt3a無法逆轉由於飢餓造成的肌肉萎縮。圖7B:Myotube直徑統計,Wnt3a無法逆轉由於飢餓造成的肌肉萎縮。具體實施方式本發明經過廣泛而深入的研究,對多種小分子化合物及其使用方法進行測試,發現小分子FH535能夠用於成功建立肌肉萎縮細胞模型和肌肉萎縮動物模型。所述肌肉萎縮細胞模型和肌肉萎縮動物模型具有肌肉萎縮的典型特徵,可作為模型,良好地模擬肌肉萎縮的發生發展。同時,所述細胞模型和動物模型還可應用於篩選治療肌肉萎縮的候選藥物。在此基礎上完成了本發明。所述的肌肉萎縮是一種哺乳動物的疾病,其主要表現為以下的部分或全部特徵:Myotube(肌管)直徑或橫截面積明顯變小,肌肉萎縮特異標記基因Atroign1和Murf1的mRNA表達水平上調。具體而言,本發明人使用小分子FH535建立肌肉萎縮細胞和動物模型,對細胞模型和動物模型進行相關生物學測試,最終篩選到一種Myotube直徑明顯變小,Atroign1和Murf1的mRNA表達水平上調的肌肉萎縮細胞模型和動物模型。所述肌肉萎縮細胞模型穩定,並且在顯微鏡下的形態特徵與肌肉萎縮組織一致。顯微鏡下的測量顯示,具有Myotube直徑明顯變小的特徵。免疫組化分析顯示,Atroign1和Murf1的mRNA高表達。動物學實驗表明,其組織病理形態與肌肉萎縮組織一致。FH535小分子FH535,分子量361.2,分子式C13H10Cl2N2O4S,CAS號108409-83-2。FH535的新用途本發明提供了FH535在製備誘導肌肉細胞發生萎縮的藥物或製劑中的用途。所述肌肉細胞為終末分化的肌肉細胞。此外,所述藥物或製劑還用於減小肌肉細胞中肌管的直徑或橫切面積。此外,所述藥物或製劑還用於上調肌肉細胞中Atroign1和Murf1的表達水平。肌肉萎縮細胞模型的構建及其用途。本發明還提供了FH535在構建肌肉萎縮細胞模型或肌肉萎縮動物模型中的用途。本發明的肌肉萎縮細胞模型構建方法,包括以下步驟:向肌肉細胞施用有效劑量的FH535;獲得肌肉萎縮細胞模型。所述肌肉細胞為終末分化的肌肉細胞。所述終末分化的肌肉細胞選自以下任一:(1)由肌肉前體細胞、原代肌肉祖細胞或幹細胞分化而成;(2)由體內肌肉分離得到終末分化的肌管細胞。在本發明的優選實例中,所述終末分化的肌肉細胞由肌肉前體細胞分化而成,所述肌肉前體細胞選自肌肉前體細胞系,如C2C12細胞。更優選的,所述終末分化的肌肉細胞是將肌肉前體細胞採用分化培養基培養2~4天,誘導分化而成。最優培養時間為3天。優選的,所述施用有效劑量的FH535的方法為:採用新鮮的含有效劑量的FH535的分化培養基,培養終末分化的肌肉細胞。在本發明的優選實例中,所述有效劑量的FH535是指FH535在分化培養基中的終濃度為2~30μM;培養時間為24~48小時。更優選的,FH535在分化培養基中的終濃度為5~10μM;培養時間為24~48小時。最優選FH535的終濃度為10μM;培養時間為24小時。在利用FH535誘導後,本發明人利用肌肉萎縮疾病相關的指標來驗證建立模型成功與否。驗證發現,採用FH535誘導後,Myotube直徑明顯變小,Atroign1和Murf1的mRNA表達水平上調。綜合這些指標可知,本發明人利用FH535誘導成功構建了肌肉萎縮細胞模 型。本發明利用FH535誘導成功構建了肌肉萎縮細胞模型,所述模型具有多方面的應用。例如,可以用於研究和闡述肌肉萎縮的細胞乃至分子水平上的發病機制。還可應用於治療肌肉萎縮的藥物的篩選。篩選新藥因此,本發明提供了一種篩選治療肌肉萎縮的候選藥物的方法,所述方法包括以下步驟:將測試候選藥物施用於上述肌肉萎縮細胞模型,並與未施用測試候選藥物的肌肉萎縮細胞模型進行比較,其中施用後導致肌肉萎縮症狀改善或治癒的測試化合物就是治療肌肉萎縮的候選藥物。上述篩選出的候選藥物可構成一個篩選庫,可對這些物質進行進一步的細胞實驗、動物實驗、和/或臨床試驗,以進一步確證所述潛在物質的治療肌肉萎縮作用。由於本發明採用FH535進行誘導,所構建的模型更類似於人類的發病過程,一致性高,因而在藥物的篩選上比以往的模型更為精準,效率更高。肌肉萎縮動物模型的構建及其用途本發明的肌肉萎縮動物模型構建方法,包括以下步驟:給哺乳動物施用有效劑量的FH535;獲得肌肉萎縮動物模型。本發明中,所述的哺乳動物包括但不限於:小鼠、大鼠、兔、狗、猿猴。所述的哺乳動物在基因的組成、器官解剖、個體的發育、代謝方式、疾病發病機制等方面和人類接近,可良好地應用於人類疾病發病機制、藥物藥理學研究等方面。優選的,所述的哺乳動物是鼠(如小鼠)。優選的,所述施用的方法,包括(但不限制於):肌肉注射,靜脈注射,腹腔注射等。優選的,具體方法為:連續數天,給哺乳動物通過脛骨前肌局部注射的方式,施用有效劑量的FH535後,飼養數天。在本發明的優選實例中,具體方法為:通過脛骨前肌局部注射的方式,對小鼠施用0.045~0.18mg/kg體重的FH535,每兩天注射一次,共注射5~8次後,進行飼養7~12天。更優選的,具體方法為:通過脛骨前肌局部注射的方式,對小鼠施用0.09mg/kg體重的FH535,每兩天注射一次,共注射7次後,進行飼養10天。在利用FH535誘導後,本發明人利用肌肉萎縮疾病相關的指標來驗證建立模型成功與否。驗證發現,採用FH535誘導後,Myotube直徑明顯變小或者橫切面增大,Atroign1和Murf1的mRNA表達水平上調。綜合這些指標可知,本發明人利用FH535誘導成功構建了 肌肉萎縮動物模型。本發明的肌肉萎縮動物模型,所述模型具有多方面的應用。例如,可以用於研究和闡述肌肉萎縮的細胞乃至分子水平上的發病機制。還可應用於治療肌肉萎縮的藥物的篩選。篩選新藥本發明利用FH535誘導成功構建了肌肉萎縮模型,所述模型可應用於治療肌肉萎縮的藥物的篩選。因此,本發明提供了一種篩選治療肌肉萎縮的候選藥物的方法,所述方法包括以下步驟:將測試候選藥物施用於上述肌肉萎縮動物模型,並與未施用測試候選藥物的肌肉萎縮動物模型進行比較,其中施用後導致肌肉萎縮症狀改善或治癒的測試化合物就是治療肌肉萎縮的候選藥物。上述篩選出的候選藥物可構成一個篩選庫,可對這些物質進行進一步的細胞實驗、動物實驗、和/或臨床試驗,以進一步確證所述潛在物質的治療肌肉萎縮作用。由於本發明採用FH535進行誘導,所構建的模型更類似於人類的發病過程,一致性高,因而在藥物的篩選上比以往的模型更為精準,效率更高。本發明的有益效果在於:(1)本發明首次揭示FH535能夠誘導肌肉細胞發生萎縮,更類似於人類的發病過程,模型一致性高。(2)本發明的肌肉萎縮細胞模型和動物模型具有肌肉萎縮的典型特徵,可極好地模擬體內肌肉萎縮的發生發展,是肌肉萎縮基礎和臨床應用研究的理想細胞模型和動物模型,從而可良好地應用於篩選治療肌肉萎縮的藥物。以下通過特定的具體實例說明本發明的實施方式,本領域技術人員可由本說明書所揭露的內容輕易地了解本發明的其它優點與功效。本發明還可以通過另外不同的具體實施方式加以實施或應用,本說明書中的各項細節也可以基於不同觀點與應用,在沒有背離本發明的精神下進行各種修飾或改變。在進一步描述本發明具體實施方式之前,應理解,本發明的保護範圍不局限於下述特定的具體實施方案;還應當理解,本發明實施例中使用的術語是為了描述特定的具體實施方案,而不是為了限制本發明的保護範圍;在本發明說明書和權利要求書中,除非文中另外明確指出,單數形式「一個」、「一」和「這個」包括複數形式。當實施例給出數值範圍時,應理解,除非本發明另有說明,每個數值範圍的兩個端點 以及兩個端點之間任何一個數值均可選用。除非另外定義,本發明中使用的所有技術和科學術語與本
技術領域:
技術人員通常理解的意義相同。除實施例中使用的具體方法、設備、材料外,根據本
技術領域:
的技術人員對現有技術的掌握及本發明的記載,還可以使用與本發明實施例中所述的方法、設備、材料相似或等同的現有技術的任何方法、設備和材料來實現本發明。除非另外說明,本發明中所公開的實驗方法、檢測方法、製備方法均採用本
技術領域:
常規的分子生物學、生物化學、染色質結構和分析、分析化學、細胞培養、重組DNA技術及相關領域的常規技術。這些技術在現有文獻中已有完善說明,具體可參見Sambrook等MOLECULARCLONING:ALABORATORYMANUAL,Secondedition,ColdSpringHarborLaboratoryPress,1989andThirdedition,2001;Ausubel等,CURRENTPROTOCOLSINMOLECULARBIOLOGY,JohnWiley&Sons,NewYork,1987andperiodicupdates;theseriesMETHODSINENZYMOLOGY,AcademicPress,SanDiego;Wolffe,CHROMATINSTRUCTUREANDFUNCTION,Thirdedition,AcademicPress,SanDiego,1998;METHODSINENZYMOLOGY,Vol.304,Chromatin(P.M.WassarmanandA.P.Wolffe,eds.),AcademicPress,SanDiego,1999;和METHODSINMOLECULARBIOLOGY,Vol.119,ChromatinProtocols(P.B.Becker,ed.)HumanaPress,Totowa,1999等。實施例1FH535誘導的肌肉萎縮細胞模型的建立本實施例的主要內容為對肌肉前體細胞系C2C12進行培養、分化並構建肌肉萎縮細胞模型:(1)配置生長培養基:DMEM高糖培養基加入10%胎牛血清後混勻備用。(2)配置分化培養基:DMEM高糖培養基中加入2%馬血清後混勻備用。(3)溶解小分子化合物:用DMSO溶解FH535,配成濃度為10mM的儲存濃度。(4)配置誘導肌肉萎縮的條件培養基:臨用前向分化培養基中加入FH535溶液,使其在分化培養基中的終濃度為10μM;(5)細胞系培養:C2C12細胞從液氮中取出後迅速置於37℃水浴鍋中,融化加入到9ml生長培養基中,1500rpm/min室溫離心5分鐘後,棄上清,加入1ml生長培養基重懸後轉入10cm培養皿中,補加9ml生長培養基,在37℃,5%二氧化碳條件下培養。C2C12細胞系分化為myotube:待C2C12細胞長至完全鋪滿整個培養皿之後,用PBS洗3次,加入10ml分化培養基, 在37℃,5%二氧化碳條件下誘導分化3天。(6)小分子誘導由C2C12分化而來的myotube發生肌肉萎縮:更換新鮮10ml分化培養基,在對照組中加入10μlDMSO,在實驗組中加入終濃度為10μM的FH535,37℃,5%二氧化碳條件下培養24小時。通過免疫螢光染色檢測myosin重鏈(MYHC)的表達水平,測量由MYHC標記的myotube的直徑,比較FH535實驗組與DMSO空白對照組的差異。取實驗組和空白對照組各一盤細胞,PBS洗3次,用4%甲醛室溫固定15分鐘。用PBS洗3次,加入1%Tween20,室溫孵育10分鐘。用PBS洗3次,加入在含有1%BSA的PBS中1:500稀釋的MYHC抗體,4℃孵育過夜。用PBS洗三次,每次5分鐘。加入在含有1%BSA的PBS溶液中1:1000稀釋的螢光標記的驢抗鼠二抗,室溫孵育1小時。用PBS洗一次,加入20μMDAPI,室溫5分鐘,用PBS洗三次,每次5分鐘。加入抗猝滅劑後封片。在Zeiss螢光顯微鏡下觀察拍照,並測量myotube的直徑,結果如圖1所示,通過螢光顯微鏡觀察,與空白對照組相比,加入FH535後myotube的直徑顯著減小;且通過統計學分析顯示,加入FH535後myotube的直徑顯著減小至約為空白對照組的三分之一。(7)取實驗組和空白對照組各一盤細胞,加入1mlTrizol後提取總RNA,各取1μg總RNA加入1μl(200units)NEB公司MuLV反轉錄酶及其1x反應緩衝液,0.5mMdNTP混合物,4μMOligodT,1μlRNaseinhibitor42℃孵育1小時,反轉錄為cDNA。將cDNA在90℃滅活10分鐘,作為PCR模板。使用上面列出的正向和反向引物,進行實時螢光定量PCR檢測目的基因的表達量。PCR條件為95℃10分鐘,95℃30秒,60℃60秒,第二和第三步反覆循環40次。採用GAPDH作為內參,所用引物序列為:GAPDHforward:ACCCAGAAGACTGTGGATGG(SEQIDNO.1)GAPDHreverse:ACACATTGGGGGTAGGAACA(SEQIDNO.2)同時檢測肌肉中肌肉萎縮特異性基因Atrogin1(NM_026346.3)和Murf1(NM_001039048.2)的表達作為肌肉萎縮的標記。所用引物的核苷酸序列為:Atrogin-1forward:AGAGAGGCAGATTCGCAAGCGT(SEQIDNO.3)Atrogin-1reverse:TGCAAAGCTGCAGGGTGACCC(SEQIDNO.4)Murf-1forward:acctgctggtggaaaacatc(SEQIDNO.5)Murf-1reverse:cttcgtgttccttgcacatc(SEQIDNO.6)採用NEB的MuLv反轉錄酶反轉錄為cDNA,通過實時螢光定量PCR檢測肌肉萎縮標記物Atroign1和Murf1的mRNA表達水平。結果如圖2所示,小分子FH535能上調Atrogin1、Murf1的表達水平,造成肌肉萎縮。此外,還進行了如下優化考察實驗:(a)固定分化誘導的天數為3天,作用時間24小時,對FH535的有效劑量進行了考察,亦即,上述步驟(4)中,加入不同濃度的小分子FH535,使其在分化培養基中的終濃度分別為0、5、10、15、20μM,觀察終末分化肌肉細胞直徑的變化情況,結果如表1和圖3所示:表1.不同劑量FH535對於終末分化肌肉細胞直徑的影響FH535(μM)平均終末分化肌肉細胞直徑(μm)014.7±1.5658.23±1.16103.9±0.43154.05±0.65超過80%的細胞死亡204.14±0.47超過90%的細胞死亡由上述結果可知,當FH535在分化培養基中終濃度為5~10uM時,均可使得終末分化肌肉細胞直徑明顯減小。下述實驗優選採用FH535在分化培養基中終濃度為10uM。(b)固定分化培養基中的FH535終濃度為10uM,作用時間24小時,對誘導分化天數進行了考察,亦即,上述步驟(5)中,誘導分化2~4天,觀察終末分化肌肉細胞直徑的變化情況,結果如表2和圖4所示:表2.不同分化時間的C2C12細胞分化效率分化時間(天)分化效率(%)0013220390490由上述結果可知,當FH535誘導分化的時間為2~4天時,均可使得終末分化肌肉細胞直徑明顯減小,但是當誘導分化3天時,已經能夠達到較好的效果。因此,優選採用FH535的誘導分化時間為3天。(C)固定分化培養基中的FH535終濃度為10uM,誘導分化時間3天,對作用時間進行了考察,亦即,上述步驟(6)中,培養12~60小時,觀察終末分化肌肉細胞直徑的變化情 況,結果如表3所示:表3.不同FH535作用時間對於終末分化肌肉細胞直徑的影響作用時間(小時)平均肌肉細胞直徑(μm)細胞死亡率(%)014.7±1.5601212.54±1.751243.9±0.4312364.18±0.4370484.06±0.648060NA98由上述結果可知,當FH535誘導分化的時間為24~48小時,均可使得終末分化肌肉細胞直徑明顯減小,但是當誘導分化24小時,已經能夠達到較好的效果,並且細胞死亡率較低。因此,優選採用作用時間為24小時。實施例2FH535誘導的肌肉萎縮動物模型的建立使用濃度:FH535儲存液用PBS稀釋至100μM。方法:取成年小鼠(6-8周),將0.0361mg/mlFH535注射進小鼠左腿脛骨前肌中,每次注射100μMFH53550μl,右側腿脛骨前肌注射50μlPBS為對照,每兩天注射一次,持續14天(亦即注射7次)注射完畢後飼養10天。取小鼠脛骨前肌,包埋於包埋劑OCT中,製成冰凍切片。通過蘇木精-伊紅染色(HE染色)顯示肌纖維輪廓,比較肌纖維直徑。染色方法如下:將冰凍切片用PBS洗兩次,5分鐘/次;蘇木精染色1分鐘,自來水衝洗20分鐘;在30%乙醇中孵育5分鐘;在50%乙醇中孵育5分鐘;在70%乙醇中孵育5min;在95%乙醇中孵育5min;在伊紅染料中染色10秒;在95%乙醇中孵育5分鐘;在100%乙醇中孵育5分鐘;在100%乙醇中孵育5分鐘;二甲苯:乙醇=1:1溶液中孵育10分鐘;在二甲苯中孵育10分鐘;晾乾後用樹脂膠封片。顯微鏡下拍照,並統計肌纖維的直徑,結果如圖6所示,A:HE染色表明注射FH535後肌肉直徑顯著變小;B:統計學分析顯示,注射FH535後肌肉直徑明顯變小。此外,還進行了如下優化考察實驗:(a)考察了不同FH535注射濃度對小鼠肌肉直徑的影響,結果如表4所示:表4.不同FH535濃度在小鼠中對肌肉直徑的影響FH535濃度(mg/kg體重)平均肌纖維直徑(μm)0167±140.045125±90.0996±80.1891±11由上述結果可知,當FH535注射濃度為0.045~0.18mg/kg體重時,均能夠使得小鼠肌肉細胞直徑明顯減小。(b)考察了不同FH535注射次數對小鼠肌肉直徑的影響,結果如表5所示:表5.不同FH535持續注射次數在小鼠中對於肌肉直徑的影響注射持續次數(次)平均肌纖維直徑(μm)0167±145124±175.5119±126128±136.5122±16796±87.594±15897±14由上述結果可知,當FH535連續注射次數為5~8次時,均能夠使得小鼠肌肉細胞直徑明顯減小。但是,當注射天數為7次時,已經取得很好的效果。(c)考察了不同FH535飼養時間對小鼠肌肉直徑的影響,結果如表6所示:表6.不同飼養時間在小鼠中對於肌肉直徑的影響飼養時間(天)平均肌纖維直徑(μm)0151±187137±168127±149128±161096±81191±121297±15由上述結果可知,當飼養時間為7~12天時,均能夠使得小鼠肌肉細胞直徑明顯減小。當飼養天數為10天時,已經能夠取得很好的效果。實施例3營養不良誘導的肌肉萎縮模型與FH535誘導的肌肉萎縮模型比較肌肉前體細胞系C2C12的培養、分化及構建肌肉萎縮細胞模型:配置生長培養基:DMEM高糖培養基加入10%胎牛血清後混勻備用。配置分化培養基:DMEM高糖培養基中加入2%馬血清後混勻備用。溶解小分子化合物:用DMSO溶解FH535,配成濃度為10mM的儲存濃度。配置誘導肌肉萎縮的條件培養基:臨用前向分化培養基中加入小分子FH535,致終濃度為10uM。細胞系培養:C2C12細胞從液氮中取出後迅速置於37℃水浴鍋中,融化後加入到9ml生長培養基中,1500rpm/min室溫離心5分鐘後,棄掉上清,加入1ml生長培養基重懸後轉入10cm培養皿中,補加9ml生長培養基,在37℃,5%二氧化碳條件下培養。C2C12細胞系分化為myotube:待C2C12細胞長至完全鋪滿整個培養皿之後,用PBS洗3次,加入10ml分化培養基,在37℃,5%二氧化碳條件下誘導分化3天。飢餓誘導肌肉萎縮:將終末分化的myotube置於Hanks』緩衝液(0.137MNaCl,5.4mMKCl,0.25mMNa2HPO4,0.44mMKH2PO4,1.3mMCaCl2,1.0mMMgSO4,4.2mMNaHCO3)中培養24小時,保持滲透壓平衡,但是不提供任何血清等營養物質。在顯微鏡下拍照,測量myotube的直徑。小分子FH535誘導由C2C12分化而來的myotube發生肌肉萎縮:更換新鮮10ml分化培養基,在對照組中加入10μlDMSO,在實驗組中加入終濃度為10μM的FH535,37℃,5%二氧化碳條件下培養24小時。顯微鏡下觀察拍照,並測量myotube的直徑。向飢餓誘導的肌肉萎縮和FH535誘導的肌肉萎縮myotube中分別加入Wnt信號通路激動劑10ng/μlWnt3a,37℃,5%二氧化碳條件下培養24小時。顯微鏡下拍照,並測量myotube直徑。結果顯示,加入Wnt信號通路激動劑能夠逆轉FH535造成的肌肉萎縮,但是無法逆轉營養不良造成的肌肉萎縮。綜上所述,FH535所誘導引起的肌肉萎縮與飢餓引起的肌肉萎縮不同:加入Wnt信號通路激動劑能夠逆轉由FH535誘導的肌肉萎縮(如圖4所示)。但是由飢餓造成的肌肉萎縮不受Wnt信號通路激動劑的影響(如圖7所示),提示FH535誘導的肌肉萎縮與傳統的營養不良導致的肌肉萎縮模型不同。當今世界由於營養不良造成的肌肉萎縮越來越少見,而由衰老等原因所導致的肌肉萎縮患者日益增多。目前還沒有快速、穩定地製備模擬衰老所導致的肌肉萎縮模型的方法,因而難以為進一步肌肉萎縮防治藥物的篩選提供穩定的良好平臺,並研究相關的分子機制。而本發明的FH535誘導的肌肉萎縮模型,為進一步肌肉萎縮防治藥物的篩選或研究相關的分子機制提供穩定而良好的平臺。實施例4藥物篩選以實施例1製備的肌肉萎縮細胞模型或實施例2製備的肌肉萎縮動物模型為受試對象,檢測候選藥物施用前後,Myotube直徑的變化,從而判斷候選藥物是否對於治療肌肉萎縮是有效的。測試組:給予候選藥物的模型;對照組:不給予候選藥物的模型。如果與對照組相比,測試組中的Myotube直徑變大,Atroign1和Murf1的mRNA表達水平下降,則說明該候選藥物可治療肌肉萎縮。如果測試組中的Myotube直徑保持不變,Atroign1和Murf1的mRNA表達水平不繼續上升,則說明該藥物可以阻滯肌肉萎縮的進一步發生。可利用患肌肉萎縮的動物,對上述經篩選能夠治療肌肉萎縮的候選藥物,進行進一步的動物試驗,進一步驗證治療效果。以上的實施例是為了說明本發明公開的實施方案,並不能理解為對本發明的限制。此外,本文所列出的各種修改以及發明中方法、組合物的變化,在不脫離本發明的範圍和精神的前提下對本領域內的技術人員來說是顯而易見的。雖然已結合本發明的多種具體優選實施例對本發明進行了具體的描述,但應當理解,本發明不應僅限於這些具體實施例。事實上,各種如上所述的對本領域內的技術人員來說顯而易見的修改來獲取發明都應包括在本發明的範圍內。當前第1頁1 2 3 
