一種無標記神經降壓素受體(NTSR)配體篩選模型的製作方法
2023-05-13 05:09:36 2
本發明涉及無標記GPCR配體篩選模型的建立,具體地說是一種無標記神經降壓素受體(NTSR)配體篩選模型。所述GPCR為NTSR;所述方法為無標記細胞整合藥理學技術;所述應用為NTSR配體的篩選,以及與NTSR相關的心血管疾病、高血壓、肺癌、前列腺癌、乳腺癌、結腸癌以及胰腺癌等疾病的預防和治療。
背景技術:
神經降壓素受體(neurotensin receptor,NTSR)是神經降壓素(neurotensin,NTS)的特異性受體,是G蛋白偶聯受體(G protein-coupled receptors,GPCRs)家族成員中的一種,在中樞神經系統主要分布在大腦內側隔核、斜角帶布神經元、前腦基底核、腦黑質、海馬和下丘腦核等區域,在外周組織主要分布在胃腸道等組織。NT與NTSR具有使血管擴張、降血壓、調節多巴胺神經傳導、減弱腦部神經活動、調節情緒、刺激垂體腺分泌激素、刺激膽囊分泌膽汁、抑制小腸和胃的蠕動、刺激胰腺分泌胰液、刺激結腸運動、以及對胃腸道等許多組織的營養與修復作用的生理功能。NTS及NTSR能刺激多種正常的組織及細胞生長、增殖。但是研究發現在胰腺癌、乳腺癌、前列腺癌、肺癌以及胃癌等癌細胞中發現了NTSR高表達。因此尋找發現針對NTSR的高活性特異性激動劑和拮抗劑是非常必要的(Carraway R,Leeman S E.Isolation of a New Hypotensive Peptide,Neurotensin,from Bovine Hypothalami.Journal of Biological Chemistry,1973,248(19):6854-6861;Vincent J P,Mazella J,Kitabgi P.Neurotensin and neurotensin receptors.Trends in pharmacological sciences,1999,20(7):302-309;Popp E,Schneider A,Vogel P,et al.Time course of the hypothermic response to continuously administered neurotensin.Neuropeptides,2007,41(5):349-354;St-Gelais F,Jomphe C,Trudeau L E.The role of neurotensin in central nervous system pathophysiology:What is the evidence?J PsychiatrNeurosci,2006,31(4):229-245;Mustain W C,Rychahou P G,Evers B M.The role of neurotensin in physiologic and pathologic processes.CurrOpinEndocrinol,2011,18(1):75-82)。
目前NTSR配體的篩選主要是採用螢光標記、酶聯免疫法、螢光標記和螢光成像讀板儀等法(Fluorescence Image Plate Reader,FLIPR)等傳統方法。但是這些方法都有缺點或自身局限性,例如反射自顯影技術有操作複雜、通量低等缺點;螢光標記方法有需要特定的螢光、操作繁瑣、靈敏度低以及無法實現高通量等缺點;酶聯免疫法有操作繁瑣、實驗周期長、靈敏度低及低通量等特點;FLIPR是唯一一個能實現高通量、快速篩選配體的檢測技術,但是其具有只能針對鈣流及 膜電位檢測的局限性,無法直接針對受體,也不能進行通路研究。而本模型採用的方法為最新的無標記細胞整合藥理學(cellular label-free integrative pharmacology,CLIP)技術是採用光學感應技術對細胞內質量發生重置的過程通過光波長的位移來反應細胞內受體信號傳導的技術,具有無傷害、高靈敏度、高通量、能多靶點多通路研究、實驗周期短以及操作簡單等特點。因此,採用CLIP技術建立NTSR無標記配體篩選模型可以大大提高NTSR配體篩選的效率,對於闡述NTS和NTSR的藥理學和生理學功能具有重要意義,為與NTSR相關的疾病的靶向治療提供指導(Botto J M,Guillemare E,Vincent J P,et al.Effects of SR 48692 on neurotensin-induced calcium-activated chloride currents in the Xenopus oocyte expression system:Agonist-like activity on the levocabastine-sensitive neurotensin receptor and absence of antagonist effect on the levocabastine insensitive neurotensin receptor.Neurosci Lett,1997,223(3):193-196;Martin S,Navarro V,Vincent J P,et al.Neurotensin receptor-1and-3complex modulates the cellular signaling of neurotensin in the HT29 cell line.Gastroenterology,2002,123(4):1135-1143;
Sehgal I,Powers S,Huntley B,et al.Neurotensin Is an Autocrine Trophic Factor-Stimulated by Androgen Withdrawal in Human Prostate-Cancer.P NatlAcadSci USA,1994,91(11):4673-4677;Seethalakshmi L,Mitra S P,Dobner P R,et al.Neurotensin receptor expression in prostate cancer cell line and growth effect of NT at physiological concentrations.Prostate,1997,31(3):183-192;Fang Y.Non-invasive optical biosensor for probing cell signaling.Sensors-Basel,2007,7(10):2316-2329;Fang Y,Frutos A G,Verklereen R.Label-free cell-based assays for GPCR screening.Comb Chem High T Scr,2008,11(5):357-369;Fang Y,Ferrie A M,Fontaine N H,et al.Characteristics of dynamic mass redistribution of epidermal growth factor receptor signaling in living cells measured with label-free optical biosensors.Analytical chemistry,2005,77(17):5720-5725)。
目前關於採用無標記細胞整合藥理學技術的NTSR配體篩選模型的內容尚未報導。
技術實現要素:
本發明涉及GPCR中的NTSR無標記配體篩選模型的建立及其應用,目的之一是採用無標記細胞整合藥理學技術建立NTSR無標記配體篩選模型;目的之二是NTSR配體篩選模型的建立可為與這些疾病相關的靶點提供高活性的配體,為其他受體的配體的篩選提供參照,為與NTSR相關的疾病的靶向治療提供指導。
本發明的技術方案為:
在接種了HT29細胞的細胞培養板中陸續加入待測樣品和神經降壓素(NTS),若在HT29細胞上NTS產生的DMR譜的強度隨待測樣品濃 度的增加而減少,則表明樣品可使NTS脫敏,可判斷樣品具有NTSR的激動或者拮抗活性。
所述細胞培養板為Epic光學生物傳感器微孔板。
所述細胞培養板中HT29細胞的接種密度為1.5~4.0×104個/孔,細胞培養液體積為10~60μL/孔。
模型的具體步驟為:
A)NTS以終濃度0.004~32nM加入到接種HT29細胞的細胞培養板,立即檢測其DMR信號;
B)將待測樣品加入到接種了HT29細胞的細胞培養板,待測樣品終濃度為0.01nM~100μM,立即測其DMR譜,若其DMR譜與步驟A)所得的DMR譜具有輪廓相似性;
C)將不同濃度的NTSR拮抗劑SR48692或SR142948A以終濃度為4nM~40μM加入到接種HT29細胞的細胞培養板,室溫處理HT29細胞30~60min,加入與步驟B)相同濃度的待測樣品立即檢測其DMR信號,若其DMR信號小於步驟B)中的DMR信號,則表明樣品具有NTSR的激動活性。
模型的具體步驟為:
A)將待測樣品和NTS分別加入接種了HT29細胞的細胞培養板,待測樣品終濃度為0.01nM~100μM,NTS終濃度0.004~32nM,立即測HT29細胞DMR譜,檢測時間40min-120min;
B)若步驟A)中待測樣品不產生DMR譜,再向步驟A)中加入了待測樣品的細胞培養板中繼續加入與步驟A)濃度相同的NTS立即檢測DMR譜40min-120min,若所得NTS的DMR信號比步驟A)中的NTS的DMR信號小,則表明樣品具有NTSR的拮抗活性。
通路抑制劑U 73122、C1530、枸櫞酸託法替尼(tofacitinib citrate)、Y27632、LY294002、H89、GF109203X或厄洛替尼(erlotinib)分別加入接種了HT29細胞的細胞培養板中,加入通路抑制劑的最終濃度為2nM~20μM,室溫孵育30~60min,然後加入具有激動活性的待測樣品(EC80或EC100)檢測,所得細胞測DMR譜,根據其DMR譜是否被上述通路抑制劑所抑制,可判斷樣品是否具有通路偏向性。
所述GPCR無標記配體篩選模型為NTSR的無標記配體篩選模型。
所述GPCR無標記配體篩選模型採用的方法技術方法為無標記細胞整合藥理學技術方法。
所述GPCR無標記配體篩選模型所採用的細胞培養板為Epic光學生物傳感器微孔板。
所述GPCR無標記配體篩選模型中Epic光學生物傳感器微型細胞培養板中HT29細胞的接種密度為3×104個/孔,細胞培養液體積40μL。
所述GPCR無標記配體篩選模型中NTSR的內源性激動劑NTS在 HT29細胞上的DMR信號,NTS的濃度梯度為32nM、16nM、8nM、4nM、2nM、1nM、0.5nM、0.25nM、0.125nM、0.0625nM、0.03125nM、0.015625nM、0.0078125nM、0.00390625nM。
所述GPCR無標記配體篩選模型採用NTSR特異性拮抗劑SR48692和SR142948A在HT29細胞上對NTSR的激動劑NTS的DMR信號進行了分析。
所述GPCR無標記配體篩選模型採用無標記細胞整合藥理學技術結合信號傳導通路抑制劑和激酶抑制劑對NTSR的信號傳導通路偏向性進行了研究。
體外細胞實驗表明,本發明中GPCR無標記配體篩選模型中的GPCR為NTSR,NTSR與肺癌、前列腺癌、乳腺癌、結腸癌以及胰腺癌等疾病相關,根據靶點與疾病的相關性,可以拓寬此模型在臨床應用的範圍。
附圖說明
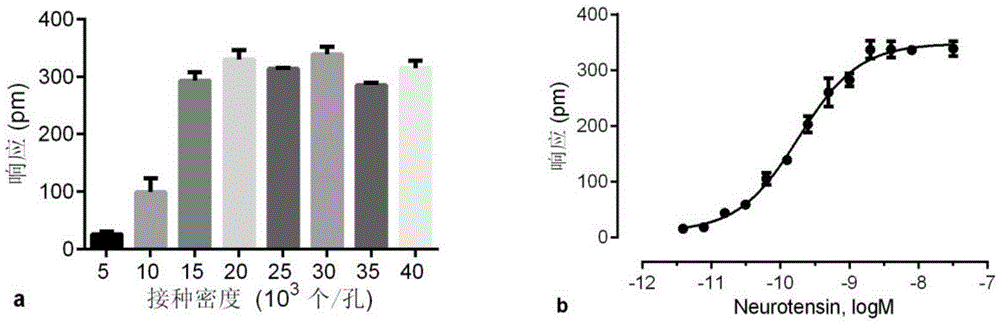
圖1(a)神經降壓素在不同接種密度的HT29細胞上的DMR最大響應值;(b)神經降壓素在最佳接種密度的HT29細胞上的DMR劑量效應曲線。
圖2(a)SR48692對神經降壓素在HT29細胞上所產生的DMR響應的劑量效應曲線;(b)SR142948A對神經降壓素在HT29細胞上所產生的DMR響應的劑量效應曲線。
圖3(a)U73122對神經降壓素在HT29細胞上的DMR劑量效應曲線;(b)C1530對神經降壓素在HT29細胞上的DMR劑量效應曲線;(c)Tofacitinib citrate預處理後神經降壓素在HT29細胞上的DMR劑量效應曲線;(d)不同劑量的Y27632預處理HT29細胞之後不同時間神經降壓素的DMR響應信號;(e)不同劑量的LY294002預處理之後HT29細胞之後神經降壓素的DMR劑量效應曲線;(f)不同劑量的H-89預處理之後HT29細胞之後神經降壓素的DMR劑量效應曲線;(g)不同劑量的GF109203X預處理之後HT29細胞之後神經降壓素的DMR劑量效應曲線;(h)不同劑量的erlotinib預處理之後HT29細胞之後神經降壓素的DMR劑量效應曲線。
圖4(a)PD149163在的HT29細胞上的DMR劑量效應曲線;(b)SR48692和SR142948A對PD149163在HT29細胞上所產生的DMR響應的劑量效應曲線;(c)U73122、C1530和Y27632預處理後PD149163在HT29細胞上的DMR劑量效應曲線;
具體實施方式
現結合實例對本發明做進一步說明,實例僅限於說明本發明,而非對本發明的限定。
實施例1:HT29細胞在Epic384光學生物傳感器細胞培養板中的接種密度的優化
HT-29細胞購於中國科學院上海細胞庫;神經降壓素(neurotensin,NTS)、PD149163、SR48692、SR142948A、U73122、Erlotinib、C1530、Y27632、AG490、Tofacitinib citrate、H-89、LY294002購自Sigma公司;GF109203X購於Tocris公司。細胞培養板為Epic384孔光學生物傳感器板。檢測平臺為康寧第三代成像儀,檢測的信號為細胞動態質量重置(DMR)引起的波長位移。
將處於對數生長期的HT29細胞接種0.5、1、1.5、2、2.5、3、3.5、4×104個/孔8種不同密度,所用培養液為McCoy’s 5A(Sigma,批號:SLBG2279V),每孔培養液用量為40μL,在37℃條件下,培養24h,測DMR譜,通過NTS的DMR響應來確定一個最佳的接種密度,結果如圖1a所示。結果表明NTS在3×104個/孔接種密度的HT29細胞上產生一個最大的DMR響應(圖1b),且logEC50為-9.735±0.031(n=4)。因此確定HT29細胞的接種密度為3×104個/孔。
實施例2:採用CLIP技術研究NTSR特異性拮抗劑對NTS在HT29細胞上信號的影響
將處於對數生長期的HT29細胞以3×104個/孔的密度接種到Epic384孔光學生物傳感器細胞培養板中,加入培養液,所用培養液為McCoy’s 5A(Sigma,批號:SLBG2279V),每孔培養液用量為40μL,在37℃條件下,培養24h之後,用不同劑量的NTSR特異性拮抗劑SR48692(圖2a)和SR142948A(圖2b)分別處理HT29細胞1h之後(每種拮抗劑從2.5nM、5nM、10nM、20nM、40nM、78nM、156nM、312nM、625nM、1.25μM、2.5μM、5μM、10μM、20μM共14個孔,平行4次),每孔加入4nM的NTS,然後置於儀器上實時監測記錄DMR信號,根據監測到的DMR信號做劑量效應曲線如圖2所示。結果表明SR142948A和SR48692都能以一個劑量依賴性的方式抑制NTS在HT29細胞上的DMR信號,且SR142948A的作用強於SR48692。SR142948A對NTS的logIC50為-6.521±0.019(n=4),SR48692對NTS的logIC50為-5.329±0.040(n=4)。
實施例3:採用CLIP技術結合細胞信號轉導通路抑制劑及其激酶抑制劑研究NTSR信號轉導通路
將處於對數生長期的HT29細胞以3×104個/孔的密度接種到Epic384孔光學生物傳感器細胞培養板中,加入培養液,所用培養液為McCoy’s 5A(Sigma,批號:SLBG2279V),每孔培養液用量為40μL,在37℃條件下,培養24h之後用不同劑量的細胞信號轉導通路抑制劑及其激酶抑制劑(Gq阻斷劑U73122(圖3a)、鈣泵阻斷劑C1530(圖3b)、Janus activated kinase(JAK3)抑制劑Tofacitinib citrate(圖3c)、 ROCK抑制劑Y27632(圖3d)、PI3K抑制劑LY294002(圖3e)、PKA抑制劑H-89(圖3f)、PKC抑制劑GF109203X(圖3g)、酪氨酸蛋白激酶抑制劑Erlotinib(圖3h))分別預處理HT29細胞1h後(每種拮抗劑從2.5nM、5nM、10nM、20nM、40nM、78nM、156nM、312nM、625nM、1.25μM、2.5μM、5μM、10μM、20μM共14個孔,平行4次),每孔加入4nM的NTS,然後置於儀器上實時監測記錄DMR信號,根據監測到的DMR信號做劑量效應曲線如圖3。結果表明這些通路抑制劑及激酶抑制劑都能以一個劑量依賴性的方式不同程度的抑制NTS的DMR信號,這也說明NTSR信號通路與以上通路和激酶密切相關。U73122對NTS的logIC50值為-5.470±0.119(n=4);C1530對NTS的logIC50值分別為-5.682±0.026(n=4);Tofacitinib citrate對NTS的logIC50值為-5.082±0.195(n=4);Y27632對NTS的logIC50值為-4.704±0.085(n=4);LY294002對NTS的logIC50值為-4.749±0.273(n=4);H-89對NTS的logIC50值為-4.313±0.187(n=4);Erlotinib對NTS的logIC50值為-5.128±0.125(n=4)。
實施例4:採用CLIP技術研究NTSR激動劑PD149163在HT29細胞上信號的影響及其激活NTSR後的信號轉導通路
首先,將處於對數生長期的HT29細胞接種3×104個/孔,所用培養液為McCoy’s 5A(Sigma,批號:SLBG2279V),每孔培養液用量為40μL,在37℃條件下,培養24h時間,測DMR譜,結果表明PD149163在3×104個/孔接種密度的HT29細胞上產生一個較強的正向的DMR響應信號,其logEC50分別為-5.824±0.038(n=4)(圖4a)。
第二,將處於對數生長期的HT29細胞以3×104個/孔的密度接種到Epic384孔光學生物傳感器細胞培養板中,加入培養液,所用培養液為McCoy’s 5A(Sigma,批號:SLBG2279V),每孔培養液用量為40μL,在37℃條件下,培養24h之後,用不同劑量的NTSR特異性拮抗劑SR48692和SR142948A分別處理HT29細胞1h之後(每種拮抗劑從2.5nM、5nM、10nM、20nM、40nM、78nM、156nM、312nM、625nM、1.25μM、2.5μM、5μM、10μM、20μM共14個孔,平行4次),每孔加入20μM的PD149163,然後置於儀器上實時監測記錄DMR信號,根據監測到的DMR信號做劑量效應曲線如圖4b所示。結果表明SR142948A和SR48692都能以一個劑量依賴性的方式抑制PD149163在HT29細胞上的DMR信號,且SR142948A的作用強於SR48692。SR142948A對PD149163的logIC50為-6.762±0.040(n=4),SR48692對PD149163的logIC50為-5.656±0.032(n=4)。
第三,將處於對數生長期的HT29細胞以3×104個/孔的密度接種到Epic384孔光學生物傳感器細胞培養板中,加入培養液,所用培養液為McCoy’s 5A(Sigma,批號:SLBG2279V),每孔培養液用量為40μL, 在37℃條件下,培養24h之後用不同劑量的細胞信號轉導通路抑制劑及其激酶抑制劑(Gq阻斷劑U73122、鈣泵阻斷劑C1530、ROCK抑制劑Y27632)分別預處理HT29細胞1h後(每種拮抗劑從2.5nM、5nM、10nM、20nM、40nM、78nM、156nM、312nM、625nM、1.25μM、2.5μM、5μM、10μM、20μM共14個孔,平行4次),每孔加入4nM的PD149163,然後置於儀器上實時監測記錄DMR信號,根據監測到的DMR信號做劑量效應曲線如圖4c。結果表明這些通路抑制劑及激酶抑制劑都能以一個劑量依賴性的方式不同程度的抑制PD149163的DMR信號,這也說明NTSR信號通路與以上通路和激酶密切相關。U73122對PD149163的logIC50值為-5.257±0.270(n=4);C1530對PD149163的logIC50值為-5.557±0.030(n=4);Y27632對PD149163的logIC50值為-4.597±0.070(n=4)。
本發明採用無標記細胞整合藥理學技術建立了NTSR無標記配體篩選模型。目前研究表明NTSR與心血管疾病、高血壓、肺癌、前列腺癌、乳腺癌、結腸癌以及胰腺癌等疾病相關,根據靶點與疾病的相關性,可以拓寬此模型在臨床應用的範圍,採用該模型可以大大提高NTSR配體篩選的效率,對於闡述NTS和NTSR的藥理學和生理學功能具有重要意義,為與NTSR相關的疾病的靶向治療提供指導。
