功能靶向性載體材料二硬脂醯基磷脂醯乙醇胺-聚乙二醇-苯基葡萄糖苷及其製備方法與應用與流程
2023-04-24 07:26:11 2
本發明屬於藥物領域,涉及一種功能靶向性載體材料二硬脂醯基磷脂醯乙醇胺-聚乙二醇-苯基葡萄糖苷及其製備方法與應用。
背景技術:
4-氨基苯基-β-D-葡萄糖苷(4-Aminophenylβ-D-glucopyranoside,GLU),又稱對氨基苯基葡萄糖苷,是一種葡萄糖衍生物。葡萄糖是生命活動中必不可少的物質之一,能夠直接參與細胞的代謝活動,並提供細胞生長所需的能量。血腦屏障內皮細胞上具有大量表達的葡糖糖轉運體(GLUTs),用以將腦部所必需的營養物質葡萄糖從血液中主動攝取入腦。與此同時,腫瘤細胞中通常存在有一種特殊的糖代謝機制——它們比正常的組織需要更多的葡萄糖用於糖酵解,因此也相應地高度表達協助葡萄糖轉運進入細胞的葡萄糖轉運體。腦膠質瘤細胞中有顯著過度表達的GLUT 1葡萄糖轉運體。最新實驗研究發現,另一種葡萄糖轉運體GLUT 3可作為腦膠質瘤幹細胞的生物標記物,其在腦膠質瘤幹細胞中特異性的高表達能夠幫助腦膠質瘤幹細胞競爭葡萄糖,以適應腦腫瘤區域葡萄糖缺乏的惡劣環境。
二硬脂醯基磷脂醯乙醇胺-聚乙二醇(DSPE-PEG2000)是一種用於長循環脂質體製備的材料。1992年Maruyama等就報導了將DSPE-PEG2000材料用於大單層脂質體的製備,可以顯著增加藥物在血液系統中循環時間的實驗結果。由於長鏈PEG的存在,修飾有二硬脂醯基磷脂醯乙醇胺-聚乙二醇材料的脂質體可以有效避免人體內網狀內皮系統(RES)對脂質體的清除,從而提高載藥系統在血液循環系統中的穩定性,使其具有生物學穩定的性質,延長脂質體在體內的循環時間。並且,該種具有適當粒徑的長循環脂質體可以在腫瘤組織的非正常血管區域表現出滲透與滯留增強效應(enhanced permeability and retention effect,EPR effect),可以實現腫瘤部位的被動靶向,從而增加藥物在腫瘤部位的聚集。
技術實現要素:
本發明的目的是提供一種功能靶向性載體材料二硬脂醯基磷脂醯乙醇胺-聚乙二醇-苯基葡萄糖苷及其製備方法與應用。
本發明提供的式I所示化合物,也即DSPE-PEG2000-GLU,其結構式如式I所示,
本發明提供的製備式I所示化合物的方法,包括如下步驟:
將式II所示化合物(也即4-氨基苯基-β-D-葡萄糖苷(4-Aminophenylβ-D-glucopyranoside,GLU))和式III所示化合物(也即二硬脂醯磷脂醯乙醇-聚乙二醇-N-琥珀醯亞胺(DSPE-PEG2000-NHS))於溶劑中進行取代反應,反應完畢得到所述式I所示化合物;
上述方法中,所述溶劑選自DMF、DMSO和氯仿中的至少一種;
所述式II所示化合物和式III所示化合物的投料摩爾比為1:5-15,優選為1:10,質量比為1:1;
所述式II所示化合物與所述溶劑的用量比為3mg:0.1-2mL,優選為3mg:0.5mL;
所述取代反應步驟中,溫度通常為室溫,時間通常為24h-48h,優選為48h;該取代反應是由GLU分子上的氨基親核取代DSPE-PEG2000-NHS上的NHS基團形成醯胺鍵而得式I;
所述取代反應可在惰性氣氛中進行;所述惰性氣氛具體為氬氣氣氛
所述方法還包括如下步驟:在所述反應完畢後,將所得反應體系置於截留分子量為2500Da左右的透析袋中用水進行透析;
所述透析步驟中,時間通常為36h-72h,優選為48h。
所述方法還包括如下步驟:在所述用水進行透析步驟之後,將透析所得液體進行凍幹的步驟。經過該凍幹步驟,可得到乾燥的呈現白色粉末狀的式I所示化合物。
另外,上述本發明提供的式I所示化合物在製備靶向性產品中的應用,也屬於本發明的保護範圍。其中,所述靶向性產品為靶向性藥物製劑,具體為靶向性脂質體,更具體為靶向性柔紅黴素脂質體、靶向性香豆素脂質體或靶向性DiR脂質體。
本發明還提供了一種製備GLU修飾的靶向性空白脂質體的方法,為以卵磷脂、膽固醇、式I所示化合物和DSPE-PEG2000為原料製得;
該方法具體包括如下步驟:
1)將卵磷脂、膽固醇、式I所示化合物和DSPE-PEG2000於有機溶劑中溶解後,旋轉蒸發減壓乾燥除去所述有機溶劑,得到脂膜;
所述DSPE-PEG2000的結構式如式IV所示:
2)向步驟1)所得脂膜中加入硫酸銨水溶液,進行水浴超聲5min後,再在超聲波細胞粉碎機進行超聲,將超聲所得含有粗脂質體的液體通過孔徑為400nm的聚碳酸酯膜3次後,再通過孔徑為200nm的聚碳酸酯膜3次後,於透析袋中透析,得到所述GLU修飾的靶向性空白脂質體。
上述方法的步驟1)中,所述有機溶劑為氯仿、二氯甲烷或二氯甲烷與甲醇的混合溶劑;
所述卵磷脂、膽固醇、式I所示化合物和DSPE-PEG2000的投料摩爾比為60-65:30-35:0.5-5:0.5-5,具體為63:32.5:0.5:4;
所述步驟2)中,硫酸銨水溶液的濃度為200-300mM mM,具體為250mM;
所述水浴超聲步驟中,超聲的能量為100-200W;溫度為20-30℃;
所述在超聲波細胞粉碎機進行超聲的步驟中,超聲的能量為100-300W,具體為200W;溫度為20-40℃,具體為35℃;超聲工作時間為10s,間歇時間為10s,全程時間為10min;
所述透析步驟中,透析袋的截留分子量為10,000-12,000Da;透析的時間為12-48小時,具體為24小時;
透析所用試劑為HBS緩衝溶液;
所述HBS緩衝液的成分如下:151mMNaCl、25.2mMHepes,PBS pH值為7.4。
另外,按照上述方法得到的GLU修飾的靶向性空白脂質體,也屬於本發明的保護範圍。
本發明還提供了一種GLU修飾的靶向性柔紅黴素脂質體,為以前述本發明提供的GLU修飾的靶向性空白脂質體和柔紅黴素為原料製得。
上述GLU修飾的靶向性柔紅黴素脂質體中,所述GLU修飾的靶向性柔紅黴素脂質體的包封率大於90%。
本發明提供的製備所述GLU修飾的靶向性柔紅黴素脂質體或靶向性香豆素脂質體的方法,為以所述GLU修飾的靶向性空白脂質體和鹽酸柔紅黴素的水溶液為原料製得;
該方法具體包括如下步驟:將所述GLU修飾的靶向性空白脂質體和鹽酸柔紅黴素的水溶液於水浴中振蕩,得到所述GLU修飾的靶向性柔紅黴素脂質體。
上述方法中,所述鹽酸柔紅黴素和所述GLU修飾的靶向性空白脂質體脂材的質量比為1:10-100,具體為1:20;
所述振蕩步驟中,溫度為35-70℃,具體為60℃;
時間為10-45min,具體為20min。
上述本發明提供的GLU修飾的靶向性柔紅黴素脂質體在製備真核生物腫瘤細胞增殖的抑制劑、製備真核生物腫瘤細胞凋亡誘導劑、製備真核生物腫瘤細胞內caspase8和/或caspase 3活化誘導劑和提升真核生物腫瘤細胞的攝取中任意一種的應用及所述GLU修飾的靶向性柔紅黴素脂質體或靶向性香豆素脂質體在製備預防和/或治療腫瘤的藥物中的應用,也屬於本發明的保護範圍;
其中,所述真核生物具體為哺乳動物;所述腫瘤細胞具體為癌細胞;所述癌細胞具體為腦膠質瘤細胞,更具體為鼠源C6細胞或腦膠質瘤幹細胞;
所述腫瘤具體為腦膠質瘤,更具體為腦膠質瘤幹細胞。
本發明還提供了製備PEI和GLU共同修飾的功能靶向性空白脂質體的方法,該方法為以卵磷脂、膽固醇、DSPE-PEG2000-PEI600化合物和所述式I所示化合物為原料製得;
所述DSPE-PEG2000-PEI600化合物為由重複結構單元a、重複結構單元b及端基-NH2構成的聚合物;
其中,所述重複結構單元a為-NHCH2CH2-,總個數為x,x為0-15;
重複結構單元b為-N(CH2CH2NH2)CH2CH2-,總個數為y,y為1-10。
該方法具體包括如下步驟:
1)將卵磷脂、膽固醇、DSPE-PEG2000-PEI600化合物和所述式I所示化合物於有機溶劑中溶解後,旋轉蒸發減壓乾燥除去所述有機溶劑,得到脂膜;
2)向步驟1)所得脂膜中加入硫酸銨水溶液,進行水浴超聲5min後,再在超聲波細胞粉碎機進行超聲,將超聲所得含有粗脂質體的液體通過孔徑為400nm的聚碳酸酯膜3次後,再通過孔徑為200nm的聚碳酸酯膜3次後,於透析袋中透析,得到所述PEI和GLU共同修飾的功能靶向性空白脂質體。
上述方法的步驟1)中,所述有機溶劑為氯仿、二氯甲烷或二氯甲烷與甲醇的混合溶劑;
所述卵磷脂、膽固醇、式I1所示化合物和所述式I所示化合物的投料摩爾比為60-65:30-35:0.5-5:0.5-5,具體為63:32.5:0.5:4;
所述步驟2)中,硫酸銨水溶液的濃度為200-300mM,具體為250mM;
所述水浴超聲步驟中,超聲的能量為100-200W;溫度為20-30℃;
所述在超聲波細胞粉碎機進行超聲的步驟中,超聲的能量為100-300W,具體為200W;溫度為20-40℃,具體為35℃;超聲工作時間為10s,間歇時間為10s,全程時間為10min;
所述透析步驟中,透析袋的截留分子量為10,000-12,000Da;透析的時間為12-48小時,具體為24小時;
透析所用試劑為HBS緩衝溶液;
所述HBS緩衝液的成分如下:151mMNaCl、25.2mMHepes(羥乙基哌嗪乙硫磺酸),PBS pH值為7.4。
按照上述方法製備得到的PEI和GLU共同修飾的功能靶向性空白脂質體,也屬於本發明的保護範圍。
另外,上述本發明提供的PEI和GLU共同修飾的功能靶向性空白脂質體在製備真核生物腫瘤細胞增殖的抑制劑、製備真核生物腫瘤細胞凋亡誘導劑、製備真核生物腫瘤細胞內caspase 8和/或caspase 3活化誘導劑和提升真核生物腫瘤細胞的攝取中任意一種的應用及所述PEI和GLU共同修飾的功能靶向性空白脂質體在製備預防和/或治療腫瘤的藥物中的應用,也屬於本發明的保護範圍;
其中,所述真核生物具體為哺乳動物;所述腫瘤細胞具體為癌細胞;所述癌細胞具體為腦膠質瘤細胞,更具體為鼠源C6細胞或腦膠質瘤幹細胞;
所述腫瘤具體為腦膠質瘤,更具體為腦膠質瘤幹細胞。
本發明提供的PEI和GLU雙重修飾的靶向性柔紅黴素脂質體,為以所述PEI和GLU雙重修飾的靶向性空白脂質體和柔紅黴素為原料製得。
上述PEI和GLU雙重修飾的靶向性柔紅黴素脂質體中,所述PEI和GLU雙重修飾的靶向性柔紅黴素脂質體的包封率大於90%。
本發明提供的製備所述PEI和GLU雙重修飾的靶向性柔紅黴素脂質體的方法,該方法為以所述PEI和GLU雙重修飾的靶向性柔紅黴素脂質體和鹽酸柔紅黴素的水溶液為原料製得;
該方法具體包括如下步驟:將所述PEI和GLU雙重修飾的靶向性柔紅黴素脂質體和鹽酸柔紅黴素的水溶液於水浴中振蕩,得到所述PEI和GLU雙重修飾的靶向性柔紅黴素脂質體。
上述方法中,所述鹽酸柔紅黴素和所述PEI和GLU雙重修飾的靶向性空白脂質體的質量比為1:10-100,具體為1:20;
所述振蕩步驟中,溫度為35-70℃,具體為60℃;
時間為10-45min,具體為20min。
另外,上述本發明提供的PEI和GLU雙重修飾的靶向性柔紅黴素脂質體或靶向性香豆素脂質體在製備真核生物腫瘤細胞增殖的抑制劑、製備真核生物腫瘤細胞凋亡誘導劑、製備真核生物腫瘤細胞內caspase 8和/或caspase 3活化誘導劑和提升真核生物腫瘤細胞的攝取中任意一種的應用及所述PEI和GLU雙重修飾的靶向性柔紅黴素脂質體在製備預防和/或治療腫瘤的藥物中的應用,也屬於本發明的保護範圍;
其中,所述真核生物具體為哺乳動物;所述腫瘤細胞具體為癌細胞;所述癌細胞具體為腦膠質瘤細胞,更具體為鼠源C6細胞或腦膠質瘤幹細胞;
所述腫瘤具體為腦膠質瘤,更具體為腦膠質瘤幹細胞。
本發明中製備了一種脂質-葡萄糖衍生物的功能性載體材料DSPE-PEG2000-GLU,並採用該種功能性載體材料修飾載藥脂質體,使其能夠經由葡萄糖轉運體介導的方式跨越血腦屏障並靶向腫瘤細胞。
本發明將DSPE-PEG2000-GLU化合物作為靶向性分子修飾於載藥脂質體表面,能夠使藥物有效通過血腦屏障,選擇性聚集於腫瘤細胞,產生靶向作用。比如,使C6腦膠質瘤細胞及腦膠質瘤幹細胞在低糖環境下對藥物的攝取比率顯著提高,使藥物對腦膠質瘤細胞表現為更強的生長抑制作用,使藥物顯示出更強的跨越血腦屏障、殺傷腦膠質瘤幹細胞的效應,即雙重靶向性作用,可延長藥物在ICR小鼠體內的循環時間和在腫瘤組織中的聚集程度,從而延長生物的生存期。本發明的這些特性使得本發明較現有發明具有優越性。
附圖說明
圖1為本發明DSPE-PEG2000-GLU化合物的合成路線。
圖2為GLU,DSPE-PEG2000-NHS和DSPE-PEG2000-GLU結合物的1H NMR圖譜。
圖3為PEI600、GLU雙重修飾的的柔紅黴素脂質體的粒徑分布。
圖4為柔紅黴素從PEI600、GLU雙重修飾的的柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和柔紅黴素脂質體的體外釋放率結果。
圖5為腦膠質瘤幹細胞在低糖環境下對GLU修飾的靶向性柔紅黴素脂質體的攝取情況。
圖6為PEI600、GLU雙重修飾的的靶向性香豆素脂質體和GLU修飾的靶向性香豆素脂質體與腦膠質瘤幹細胞葡萄糖轉運體GLUT 1的靶向性效應。
圖7為柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的的靶向性柔紅黴素脂質體對腦膠質瘤幹細胞的抑制作用。
圖8(A)為BMVEC/腦膠質瘤幹細胞共培養模型;(B)為柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體在跨越血腦屏障後對腦膠質瘤幹細胞的生長抑制情況。(a)柔紅黴素脂質體;(b)PEI修飾的靶向性柔紅黴素脂質體;(c)GLU修飾的靶向性柔紅黴素脂質體;(d)功能靶向性柔紅黴素脂質體。
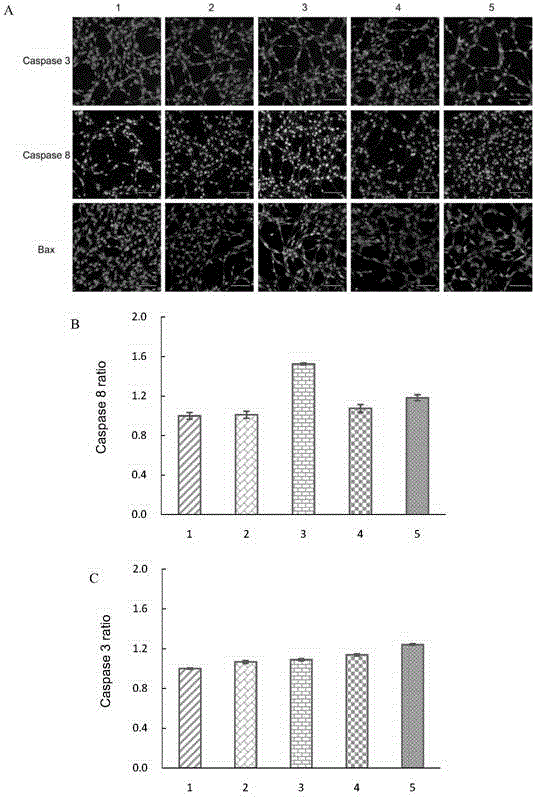
圖9柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的的靶向性柔紅黴素脂質體對細胞內凋亡蛋白Caspase 3、Caspase 8、Bax和Mcl 1的表達情況進行測定的螢光圖譜。(A)腦膠質瘤幹細胞內Caspase 3,Caspase 8和Bax在高內涵系統下的表達情況的螢光圖像。(B)Caspase 3的活性比率;(C)Caspase 8的活性比率;(D)Bax的活性比率;(E)Mcl 1的活性比率.(1)空白培養基;(2)柔紅黴素脂質體;(3)PEI修飾的靶向性柔紅黴素脂質體;(4)GLU修飾的靶向性柔紅黴素脂質體;(5)功能靶向性柔紅黴素脂質體。
圖10(A)為DiR標記的GLU修飾的靶向性脂質體和PEI600、GLU雙重修飾的的靶向性脂質體在腦膠質瘤荷瘤ICR小鼠體內的分布和腫瘤蓄積能力;(B)為尾靜脈注射游離DiR、DiR脂質體、GLU修飾的靶向性DiR脂質體和PEI600、GLU雙重修飾的的靶向性DiR脂質體在ICR小鼠體內48h後,解剖出心、肝、脾、肺、腎和荷瘤腦組織的體外成像結果。(a)DiR脂質體;(b)PEI修飾的靶向性DiR脂質體;(c)GLU修飾的靶向性DiR脂質體;(d)PEI600、GLU雙重修飾的DiR脂質體;(e)游離DiR。
圖11腦膠質瘤荷瘤小鼠在腫瘤接種並接受各個製劑組治療後的卡普蘭-邁耶生存曲線。
具體實施方式
下面結合具體實施例對本發明作進一步闡述,但本發明並不限於以下實施例。所述方法如無特別說明均為常規方法。所述原材料如無特別說明均能從公開商業途徑獲得。
二硬脂醯基磷脂醯乙醇胺-聚乙二醇-N-琥珀醯亞胺(1,2-distearoyl-sn-glycero-3-phosphatidylethanolamine-polyethyleneglycol2000-N-hydroxysuccin-imide,DSPE-PEG2000-NHS),購自日本油脂株式會社(日本NOF公司),產品目錄號為M139522。
4-氨基苯基-β-D-葡萄糖苷(4-Aminophenylβ-D-glucopyranoside,GLU),購自美國Sigma-Aldrich公司,產品目錄號為012M4005V。
二甲基甲醯胺(Dimethylformamide,DMF),購自美國Acros Organics公司,產品目錄號為1339870。
蛋黃卵磷脂(EPC)購自日本油脂株式會社,產品目錄號為108057-3。
膽固醇購自北京市海澱區微生物培養基製品廠,批號20020106。
DSPE-PEG2000購自日本油脂株式會社,產品目錄號M86563。
下述實施例所用DSPE-PEG2000-PEI600化合物中,重複結構單元a和b的連接方式不固定,可為各種連接方式。
具體的,所述DSPE-PEG2000-PEI600化合物,可為依次由重複結構單元a、重複結構單元b及端基-NH2連接而成的聚合物。
該化合物的製備方法包括如下步驟:將20μmolPEI600(x為0-15,y為1-10)和20μmol式III所示化合物DSPE-PEG2000-NHS溶解在4ml無水DMF中,將反應液混合物在室溫、氬氣保護下用磁力攪拌器輕輕攪拌24h進行取代反應,反應完畢得到粗產物,繼而將粗產物轉移到再生纖維素透析袋(截留分子量2500),在去離子水中透析48h,除去未反應的PEI和DMF溶劑。接下來將反應液凍幹,得到乾燥白色粉末,在-20℃條件下保存。
實施例1、式I所示化合物功能靶向性載體材料DSPE-PEG2000-GLU的合成與表徵
將3mg式II所示化合物GLU和3mg式III所示化合物DSPE-PEG2000-NHS溶解在0.5ml無水DMF中,將反應液混合物在室溫、避光、氬氣保護下用磁力攪拌器輕輕攪拌進行取代反應48h,反應完畢得到粗產物,繼而將粗產物轉移到再生纖維素透析袋(截留分子量2000),在去離子水中透析48h,除去未反應的GLU和DMF溶劑。接下來將反應液凍幹,得到乾燥白色粉末式I所示產物,在-20℃條件下保存。
該產物的合成路線如圖1所示。
反應產物採用核磁共振氫譜(1H NMR)進行檢測驗證反應目標產物的存在。1H NMR使用氘代二甲基亞碸(DMSO)為溶劑,使用4-甲基矽烷(TMS,δ=0ppm)進行定標。圖2為GLU、DSPE-PEG2000-NHS和DSPE-PEG2000-GLU分子的1H NMR譜圖。如圖所示,GLU及DSPE-PEG2000-NHS分子的特徵峰都可在反應產物DSPE-PEG2000-GLU的1H NMR譜圖中找到。可見,所得產物結構正確,為目標產物。
實施例2、脂質體的製備與表徵
1)GLU修飾的靶向性空白脂質體的製備
a、精密稱取卵磷脂(EPC)、膽固醇(CHOL)、DSPE-PEG2000-GLU、DSPE-PEG2000按摩爾比63:32.5:4:0.5於茄形瓶中,加入適量氯仿溶解,然後在40℃水浴、40rpm轉速下通過旋轉蒸發減壓乾燥除去有機試劑,在茄形瓶底部及內壁形成一層薄薄的均勻脂膜;
b、向步驟1)所得脂膜中加入適量250mM硫酸銨溶液水化:先在水浴中超聲5min,超聲能量為100W,至形成乳白色均勻的粗脂質體後轉移到JY92-IID型超聲波細胞粉碎機中進一步超聲(設置超聲工作時間為10s,間歇時間為10s,全程時間為10min,保護溫度為35℃,功率為200W)。超聲結束後粗脂質體逐漸形成帶有微弱藍色螢光的半透明液體,然後將其依次擠壓通過孔徑為400nm,200nm的聚碳酸酯膜各3次。擠壓後,將脂質體混懸液裝入透析袋(截留分子量10,000-12,000Da),在HBS緩衝溶液中(151mM NaCl,25.2mM Hepes,PBS pH 7.4)透析24小時,每8小時更換一次透析液,共三次,得到GLU修飾的靶向性空白脂質體。
2)GLU修飾的靶向性柔紅黴素脂質體的製備
採用硫酸銨梯度法,將柔紅黴素包載入功能靶向性空白脂質體的內水相中製得柔紅黴素脂質體。具體步驟包括:
將鹽酸柔紅黴素以一定的濃度溶解在蒸餾水中,將該鹽酸柔紅黴素的水溶液與步驟1)所得GLU修飾的的靶向性空白脂質體分別在60℃水浴中預熱,然後按照藥脂比(也即鹽酸柔紅黴素和GLU修飾的靶向性空白脂質體的質量比)1:20,將該鹽酸柔紅黴素的水溶液加入到步驟1)所得GLU修飾的靶向性空白脂質體的水溶液中,在60℃空氣浴恆溫培養振蕩器裡振搖20min,得到本發明提供的GLU修飾的靶向性柔紅黴素脂質體。
3)PEI600、GLU雙重修飾的靶向性空白脂質體的製備
a、精密稱取卵磷脂(EPC)、膽固醇(CHOL)、實施例1所得化合物DSPE-PEG2000-GLU、式I1所示化合物DSPE-PEG2000-PEI600按摩爾比63:32.5:4:0.5於茄形瓶中,加入適量氯仿溶解,然後在40℃水浴、40rpm轉速下通過旋轉蒸發減壓乾燥除去有機試劑,在茄形瓶底部及內壁形成一層薄薄的均勻脂膜;
b、向步驟1)所得脂膜中加入適量250mM硫酸銨溶液水化:先在水浴中超聲5min,至形成乳白色均勻的粗脂質體後轉移到JY92-IID型超聲波細胞粉碎機中進一步超聲(設置超聲工作時間為10s,間歇時間為10s,全程時間為10min,保護溫度為35℃,功率為200W)。超聲結束後粗脂質體逐漸形成帶有微弱藍色螢光的半透明液體,然後將其通過孔徑為400nm的聚碳酸酯膜3次後,再通過孔徑為200nm的聚碳酸酯膜3次後,
將脂質體混懸液裝入透析袋(截留分子量10,000-12,000Da),在HBS緩衝溶液中(151mM NaCl,25.2mM Hepes,PBS pH 7.4)透析24小時,每8小時更換一次透析液,共三次,得到PEI600、GLU雙重修飾的靶向性空白脂質體。
4)PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體的製備
採用硫酸銨梯度法,將柔紅黴素包載入PEI600、GLU雙重修飾的靶向性空白脂質體的內水相中製得柔紅黴素脂質體。具體步驟包括:
將鹽酸柔紅黴素以一定的濃度溶解在蒸餾水中,將該鹽酸柔紅黴素的水溶液與步驟3)所得PEI600、GLU雙重修飾的靶向性空白脂質體分別在60℃水浴中預熱,然後按照藥脂比(也即鹽酸柔紅黴素和步驟3)所得PEI600、GLU雙重修飾的靶向性空白脂質體的質量比)1:20,將該鹽酸柔紅黴素的水溶液加入到步驟3)所得PEI600、GLU雙重修飾的靶向性空白脂質體的水溶液中,在60℃空氣浴恆溫培養振蕩器裡振搖20min,得到本發明提供的PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體。
5)脂質體的表徵
取步驟3)所得PEI600、GLU雙重修飾的靶向性空白脂質體500μl通過SephadexG-50葡聚糖凝膠柱,以HBS緩衝溶液(151mM NaCl,25.2mM Hepes,PBS pH 7.4)為流動相預飽和葡聚糖凝膠柱。
之後取載藥脂質體(柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體)500μl通過Sephadex G-50葡聚糖凝膠柱,以HBS緩衝溶液為流動相分離未包進脂質體的游離柔紅黴素,收集分離後的脂質體,加入九倍體積甲醇破壞,並用流動相稀釋後,用上述高效液相色譜法(HPLC)進行測定。
取未過凝膠柱的載藥脂質體(柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體)原液,加入九倍體積甲醇破壞,並用流動相稀釋相同倍數後,用上述高效液相色譜法進行測定。採用下面的公式對柔紅黴素的包封率進行計算:包封率(%)=過凝膠柱分離後脂質體中的藥物含量/未過凝膠柱脂質體中的藥物含量×100%。藥物濃度用對照品法(比較一點法)計算,即得。
分別取新製得的脂質體加入PBS稀釋載藥脂質體至1ml,混合均勻後,使用Nano Series Zen 4003ZetaSizer(Malvern instruments,Ltd,UK)測定脂質體的粒徑、多分散度和Zeta電位。
將柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體在含血清蛋白的釋放介質(含10%胎牛血清的PBS緩衝液)中進行體外釋放實驗。取2ml脂質體,加入2ml釋放介質混勻後放入透析袋(分子截留量為10,000-12,000Da)內,兩端紮緊後將透析袋置於10.0ml釋放介質中,在37℃、100rpm的條件下在搖床上振蕩。分別於0,0.25,0.5,1,2,4,6和24h時取出0.2ml釋放介質,並每次取樣後立即補入同等體積的新釋放介質。取出的各份樣品用九倍體積甲醇進行破壞稀釋,使蛋白溶解,高速離心,再用濾膜過膜,除去大分子蛋白,用HPLC進行檢測,測定各樣品中各樣品的峰面積,用其線性回歸曲線換算得到相應濃度。然後計算出各個樣品在不同時刻的釋放量,進而得到其在某一時刻的累積釋放量。
各種脂質體的體外釋放率分別用下列公式計算:體外釋放率(%)=第i時間點釋放液中藥物的量/與透析體積相同的透析前脂質體溶液中藥物的量×100%。
6)脂質體的表徵結果
柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體的藥物包封率、粒徑、多分散係數和Zeta電位的表徵結果如表1所示。
表1脂質體的包封率、粒徑及Zeta電位表徵
數據為平均值±標準差的形式(n=3)。
結果顯示,上述脂質體的平均粒徑在100nm左右,分布均一。柔紅黴素在三種脂質體中的包封率均大於94%。三種脂質體的Zeta電位均呈負電性。
圖3為PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體的粒徑分布情況,可見該脂質體粒徑100nm左右,粒徑均一,分散度良好。
圖4為柔紅黴素從PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和柔紅黴素脂質體的體外釋放率結果。選擇含10%胎牛血清的PBS緩衝液作為釋放介質是為了模擬動物體內的血液環境,更加客觀地模擬載藥脂質體經靜脈注射後在血液循環過程中的釋放。實驗結果表明,柔紅黴素從各種脂質體中的釋放率,在最初的2h內,釋放率均低於5%,在第24h,PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和柔紅黴素脂質體的體外累積釋放率分別為9.98±3.37%、6.49±0.73%及9.87±3.04%。
實施例3、脂質體的體內外藥效實驗
(1)細胞攝取情況
圖5腦膠質瘤幹細胞在低糖環境下對GLU修飾的靶向性柔紅黴素脂質體的攝取情況。流式細胞儀測定結果以柱狀圖表示,相對於在低葡萄糖濃度(1g/L)的環境下,腦膠質瘤幹細胞在低糖環境及正常葡萄糖濃度(4.5g/L)環境下對GLU修飾的靶向性柔紅黴素脂質體的攝取率分別為1.00±0.01和1.27±0.02,即在低糖環境下,腦膠質瘤幹細胞對GLU修飾的靶向性柔紅黴素脂質體的攝取量顯著高於正常葡萄糖濃度環境。
(2)葡萄糖轉運體GLUT 1靶向性效應
圖6為各製劑組在腦膠質瘤幹細胞中的亞細胞共定位雷射共聚焦顯微圖象。如圖所示,在共聚焦顯微鏡下,各含香豆素螢光探針的製劑組呈綠色螢光,由抗體染色後的葡萄糖轉運體GLUT 1呈紅色螢光,細胞核呈藍色螢光。在螢光疊加的圖中,黃色螢光為綠色和紅色螢光的組合,表示製劑與葡萄糖轉運體GLUT 1的共定位。結果顯示,在GLU修飾的靶向性香豆素脂質體組和PEI600、GLU雙重修飾的靶向性香豆素脂質體組中,可以觀察到最明顯的黃色螢光,而香豆素脂質體組中則沒有顯示黃色螢光。
(3)對腦膠質瘤幹細胞的抑制效應
圖7所示為柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體對腦膠質瘤幹細胞的抑制作用。PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體和GLU修飾的靶向性柔紅黴素脂質體與柔紅黴素脂質體相比,均對腦膠質瘤幹細胞表現為更強的生長抑制作用。
(4)體外跨越血腦屏障後對腦膠質瘤幹細胞的殺傷效應
建立BMVEC/腦膠質瘤幹細胞共培養模型,如圖8A所示,並用於GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體的體外跨越血腦屏障後對腦膠質瘤幹細胞的殺傷效應(雙重靶向性效應)評價。柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體在跨越血腦屏障後對腦膠質瘤幹細胞的生長抑制情況見圖8B。結果顯示,腦膠質瘤幹細胞的存活率分別為:PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體(45.85±0.51%),GLU修飾的柔紅黴素脂質體(67.04±1.72%),以及柔紅黴素脂質體(72.96±2.78%)。PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體和GLU修飾的靶向性柔紅黴素脂質體,與柔紅黴素脂質體製劑組相比,顯示出更強的跨越血腦屏障、殺傷腦膠質瘤幹細胞的效應,即雙重靶向性作用。
(5)對腦膠質瘤幹細胞的誘導凋亡效應與機制
圖9A所示為腦膠質瘤幹細胞在給以柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體6小時後,採用高內涵篩選系統對細胞內凋亡蛋白Caspase 3、Caspase 8和Bax的表達情況進行測定的螢光圖譜。圖中綠色螢光的強度代表細胞內凋亡蛋白表達的量,結果顯示,凋亡蛋白酶Caspase 3、Caspase 8和促凋亡蛋白Bax均在給藥孵育後而呈現表達量提高的趨勢,其中GLU修飾的靶向性柔紅黴素脂質體製劑組和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體製劑組較柔紅黴素脂質體呈現更高的表達量。
腦膠質瘤幹細胞在給以柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體6小時後,採用高內涵篩選系統對細胞內凋亡相關信號通路的蛋白Caspase 3、Caspase 8、Bax和Mcl 1的表達情況進行測定,相應的蛋白活性比率的數值以柱形圖的形式體現。如圖9B、C、D&E所示,空白培養基、柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體給藥後,腦膠質瘤幹細胞中凋亡蛋白酶Caspase 8的活性比率分別為1.00±0.03,1.01±0.04,1.08±0.04,1.18±0.03(圖9B);凋亡蛋白酶Caspase 3的活性比率分別為1.00±0.01,1.07±0.01,1.14±0.01,1.24±0.01(圖9C);促凋亡蛋白Bax的活性比率分別為1.00±0.01,1.01±0.02,1.02±0.04,1.09±0.03(圖9D);抗凋亡蛋白Mcl 1的活性比率分別為1.00±0.01,0.97±0.01,0.94±0.02,0.92±0.02(圖9E)。
(6)在荷瘤小鼠體內的分布情況
DiR標記的GLU修飾的靶向性脂質體和DiR標記的PEI600、GLU雙重修飾的靶向性脂質體在腦膠質瘤荷瘤ICR小鼠體內的分布和腫瘤蓄積能力如圖10所示。圖10(A)為尾靜脈注射游離DiR、DiR脂質體、GLU修飾的靶向性DiR脂質體和PEI600、GLU雙重修飾的靶向性DiR脂質體後各個時間點下ICR小鼠體內的螢光分布;圖10(B)為尾靜脈注射游離DiR、DiR脂質體、GLU修飾的靶向性DiR脂質體和PEI600、GLU雙重修飾的靶向性DiR脂質體在ICR小鼠體內48h後,解剖出心、肝、脾、肺、腎和荷瘤腦組織的體外成像結果。
從圖10(A)中可以看出,尾靜脈注射GLU修飾的靶向性DiR脂質體和PEI600、GLU雙重修飾的靶向性DiR脂質體後1h時,可以在ICR小鼠體內觀察到強烈的DiR螢光信號,而且在腫瘤組織48h仍可觀察到強烈的螢光信號。相反,尾靜脈注射游離DiR螢光染料後,在ICR小鼠體內觀察到的DiR螢光信號較弱且持續時間較短,腦組織沒有觀察到明顯的螢光信號,且螢光信號主要蓄積於肝臟和腎臟內。離體組織研究結果圖10(B)表明,兩種靶向性脂質體均在腦腫瘤組織部位有明顯的聚集。結果表明,尾靜脈注射GLU修飾的靶向性DiR脂質體和PEI600、GLU雙重修飾的靶向性DiR脂質體可延長藥物在ICR小鼠體內的循環時間和在腫瘤組織中的聚集程度,可在腫瘤組織觀察到最強的螢光信號。
(7)在荷瘤小鼠體內的分布情況
圖11為腦膠質瘤荷瘤小鼠在腫瘤接種並接受各個製劑組治療後的卡普蘭-邁耶生存曲線。從腫瘤接種後第14天開始給藥,柔紅黴素按4.5mg/kg體重給藥量,每3-4天給藥1次,連續給藥四次,每組7隻考察生存曲線。觀察腦膠質瘤荷瘤小鼠模型的行為狀態,記錄小鼠活動狀況、症狀、死亡日期,繪製卡普蘭-邁耶生存曲線。結果如圖所示,腦膠質瘤荷瘤小鼠在接受生理鹽水、柔紅黴素脂質體、GLU修飾的靶向性柔紅黴素脂質體、PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體和柔紅黴素游離藥的治療後,中位生存期分別為29、32、36、56和27天。結果表明,與對照製劑相比,GLU修飾的靶向性柔紅黴素脂質體和PEI600、GLU雙重修飾的靶向性柔紅黴素脂質體能夠顯著性提高對腦膠質瘤荷瘤小鼠腦腫瘤的治療作用。
