持續多代芽變選種及其與雜交育種聯合對蘋果紅色性狀持續改良的方法與流程
2023-05-15 18:09:33
本發明涉及一種持續多代芽變選種及其與雜交育種聯合對蘋果紅色性狀持續改良的方法。
背景技術:
「醫食同源」是發展方向,「吃營養,吃健康」已成為人們的共識。蘋果果實含有較多的人體容易吸收的游離多酚或類黃酮,在抗氧化、預防心腦血管疾病及抗腫瘤等方面均具有較好的作用,「一天一蘋果,醫生遠離我」,世界上相當多的國家都將蘋果作為主要消費果品而大力推薦。蘋果果實的紅皮和紅肉性狀主要由花青苷發育而來,是類黃酮的主要組分。為此,進一步選育花青苷(或類黃酮)含量高、外觀品質好、保健價值大的蘋果新品種,對推動蘋果產業發展、改進人類健康具有重要意義。
果肉紅色、類黃酮含量高的功能型蘋果育種是多個品質性狀(基因)的有效集成與平衡,為完善新品種選育方案,提高育種效率,課題組採取了三項措施:一是在新疆紅肉蘋果與蘋果品種雜種一代果實總酚含量等性狀遺傳變異研究的基礎上,提出並實施了「三選兩早一促」的蘋果育種法(專利號ZL 2013 1 0205419.6),育種效率顯著提高;二是利用遺傳背景複雜的『嘎啦』、『美國八號』、『寒富』及『富士』等蘋果品種與新疆紅肉蘋果(M.sieversii f.niedzwetzkyana)進行多親本雜交與反覆回交,旨在進行品質育種,目前已構建回交一、二代分離群體40個,定植雜種實生苗4萬株,並申報了「果樹多種源品質育種法(專利申請號2015 10428448.8)」及「易著色蘋果品種培育法(專利申請號201510890141.X)」2個育種技術發明專利;三是及時地以性狀基本穩定的後代株係為試材,進行品質性狀評價及發育機理的研究,並已取得了諸多重要進展。目前,已創建了常規雜交與生物技術有機結合的蘋果高效育種技術體系,創製了一批新品種及優異種質,研發了蘋果新品種配套高效栽培技術體系。授權和申報發明專利10餘項,育成新品種(系)16個;發表相關研究論文120篇,其中SCI論文20餘篇,這些研究成果總體處在國際同類研究的領先水平。
技術實現要素:
本發明的目的是提供一種持續多代芽變選種及其與雜交育種聯合對蘋果紅色性狀持續改良的方法。
本發明首先保護一種蘋果育種方法(方法甲),包括如下步驟:將蘋果品種C0進行持續多代的芽變選種,第一代芽變選種將蘋果品種CO作為出發品種,以後的每代芽變選種均將上一代芽變選種得到的品種作為出發品種,每代芽變選種從全滿足如下三個性狀的芽發育出的枝條或植株中選擇目標品種:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為出發品種的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為出發品種的二分之一以下;
所述特異DNA分子為如下(Ⅰ)或(Ⅱ)或(Ⅲ):
(Ⅰ)序列表的序列1所示的DNA分子;
(Ⅱ)將序列表的序列1所示的DNA分子進行一個或幾個核苷酸的插入和/或缺失和/或替換得到的DNA分子;
(Ⅲ)與序列表的序列1所示的DNA分子具有90%以上同源性的DNA分子。
所述多代為2代以上,可為2代、3代、4代、5代、6代等。
所述育種方法得到的蘋果品種滿足如下指標(d1)和/或(d2):(d1)著色速度大於蘋果品種C0;(d2)著色指數大於蘋果品種C0。
所述育種方法得到的蘋果品種滿足如下指標(d3)和/或(d4):(d3)著色速度為「除袋之後5天以內著色」;(d4)著色指數為80%以上。
所述育種方法得到的蘋果品種滿足如下指標(d5)和/或(d6):(d5)著色速度為「除袋之後4天以內著色」;(d6)成熟果實表皮80%以上為寶石紅色。
所述育種方法得到的蘋果品種滿足如下指標(d7)和/或(d8):(d7)著色速度為「除袋之後5天以內著色」;(d8)著色指數為90%以上。
所述育種方法得到的蘋果品種滿足如下指標(d9)和/或(d10):(d9)著色速度為「除袋之後4天以內著色」;(d20)成熟果實表皮90%以上為寶石紅色。
所述蘋果品種C0具體可為『紅富士』蘋果或『嘎啦』蘋果。
本發明還保護一種蘋果育種方法(方法乙),包括如下步驟:將蘋果品種C0進行持續多代的芽變選種,第一代芽變選種將蘋果品種CO作為出發品種,以後的每代芽變選種均將上一代芽變選種得到的品種作為出發品種,每代芽變選種從全滿足如下四個性狀的芽發育出的枝條或植株中選擇目標品種:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為出發品種的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為出發品種的二分之一以下;(d)芽發育成的枝條或植株上生長枝條的節間長度為2cm以下;
所述特異DNA分子為如下(Ⅰ)或(Ⅱ)或(Ⅲ):
(Ⅰ)序列表的序列1所示的DNA分子;
(Ⅱ)將序列表的序列1所示的DNA分子進行一個或幾個核苷酸的插入和/或缺失和/或替換得到的DNA分子;
(Ⅲ)與序列表的序列1所示的DNA分子具有90%以上同源性的DNA分子。
所述多代為2代以上,可為2代、3代、4代、5代、6代等。
所述育種方法得到的蘋果品種滿足如下指標(e1)和/或(e2)和/或(e3):(e1)著色速度大於蘋果品種C0;(e2)著色指數大於蘋果品種C0;(e3)枝條的節間長度為2cm以下。
所述育種方法得到的蘋果品種滿足如下指標(e4)和/或(e5)和/或(e6):(e4)著色速度為「除袋之後5天以內著色」;(e5)著色指數為80%以上;(e6)枝條的節間長度為2cm以下。
所述育種方法得到的蘋果品種滿足如下指標(e7)和/或(e8)和/或(e9):(e7)著色速度為「除袋之後5天以內著色」;(e8)成熟果實表皮80%以上為濃紅色;(e9)枝條的節間長度為2cm以下。
所述育種方法得到的蘋果品種滿足如下指標(e10)和/或(e11)和/或(e12):(e10)著色速度為「除袋之後5天以內著色」;(e11)著色指數為90%以上;(e12)枝條的節間長度為2cm以下。
所述育種方法得到的蘋果品種滿足如下指標(e13)和/或(e14)和/或(e15):(e13)著色速度為「除袋之後5天以內著色」;(e14)成熟果實表皮90%以上為濃紅色;(e15)枝條的節間長度為2cm以下。
所述蘋果品種C0具體可為『紅富士』蘋果或『嘎啦』蘋果。
本發明還保護一種蘋果育種方法(方法丙),包括如下步驟:
(1)將蘋果品種A和蘋果品種B進行雜交,獲得雜交種子;所述蘋果品種A為蘋果(Malus domestica)CSR6R6-666;所述蘋果品種B為以上任一所述方法得到的蘋果品種;
(2)將步驟(1)得到的雜交種子播種並育苗,得到實生苗;
(3)將步驟(2)得到的實生苗移栽至大田,待其長出果實後不對果實進行套袋,篩選得到目的植株。
所述將蘋果品種A和蘋果品種B進行雜交的方法如下:取蘋果品種A的花粉,對去雄後的蘋果品種B進行授粉。
所述步驟(2)中,進行所述播種前,先將所述雜交種子進行1-3℃層積處理以打破休眠。所述層積處理的時間具體可為60天。
所述步驟(2)中,進行所述育苗的條件為:25℃、每天光照12小時、光照強度3000lx,從種子萌發開始每7-10天澆一次營養液。
所述步驟(2)中,進行所述育苗的條件具體為:將所述雜交種子播種於裝有育苗基質的營養缽(每個營養缽播種3-5粒種子)培養至實生苗高度為8-15cm且根頸處木質化(通常為播種2-3個月),然後將實生苗移栽至新的裝有育苗基質的營養缽(每個營養缽移栽1株)進行培養;所述培養的條件為:25℃、每天光照12小時(光照強度3000lx),從種子萌發開始每7-10天澆一次營養液(將MS基本培養基的大量元素母液用水稀釋至10倍體積即為營養液)、每次每個營養缽澆40-50ml。
所述步驟(3)中,在所述大田中進行栽培管理的方法如下:在擬定植實生苗的大田中每畝施入有機肥6000kg並澆水沉實,定植實生苗後在大田中每畝再施入有機肥6000kg並及時澆水。所述有機肥具體可為充分腐熟的奶牛糞。
所述方法中,移栽第4年,在離地面20cm處對實生苗的主幹進行環剝,環剝寬度為0.5-1.0cm,深達木質部。
所述方法中,移栽第5年,在實生苗的盛花期進行如下操作:每個花序的5朵花僅保留中心花,其他全部疏除。
所述方法中,移栽第5年得到所述目的植株。
所述目的植株為果肉全紅的植株。
所述目的植株為滿足如下(f1)和/或(f2)和/或(f3)和/或(f4)的蘋果植株:(f1)果肉全紅;(f2)果肉高類黃酮含量;(f3)果肉高花青苷含量;(f4)果肉高抗氧化能力。所述果肉高類黃酮含量指的是每千克鮮重的果肉中的類黃酮的含量為5000mg以上。所述果肉高花青苷含量指的是每千克鮮重的果肉中的花青苷含量為200mg以上。果肉高抗氧化能力指的是每千克鮮重的果肉中的抗氧化能力(又稱抗氧化物含量)為3μmol以上。
本發明還保護蘋果(Malus domestica)CSR6R6-666在蘋果育種中的應用。所述應用中,蘋果CSR6R6-666作為親本之一。所述應用中,蘋果CSR6R6-666作為父本。所述育種的目的為獲得果肉全紅的植株。
『CSR6R6-666』,又稱蘋果(Malus domestica)CSR6R6-666,已於2017年2月17日保藏於中國微生物菌種保藏管理委員會普通微生物中心(簡稱CGMCC,地址為:北京市朝陽區北辰西路1號院3號,中國科學院微生物研究所),保藏登記號為CGMCC NO.13783。
本發明加強芽變選種工作,建立雜交育種與芽變選種優勢互補、常規技術與生物技術有機結合的高效育種技術體系,對蘋果紅色性狀的持續改良具有重要意義。
附圖說明
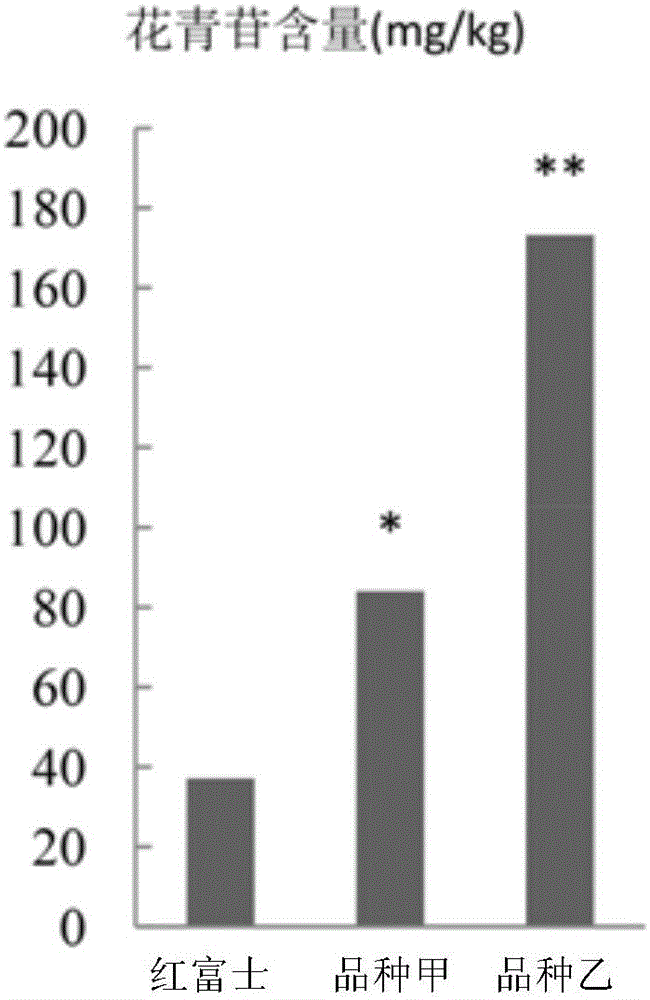
圖1為紅富士、品種甲和品種乙的果皮中的花青苷檢測結果。
圖2為紅富士、品種甲和品種乙的果皮中的特異DNA分子甲基化水平檢測結果。
圖3為品種甲的照片。
圖4為品種乙的照片
圖5為品種丁的照片,
圖6為嘎啦的照片。
圖7為品種己的照片。
圖8為蘋果新品系『功能1號』的照片。
圖9為蘋果新品系『功能2號』的照片。
具體實施方式
以下的實施例便於更好地理解本發明,但並不限定本發明。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的試驗材料,如無特殊說明,均為自常規生化試劑商店購買得到的。以下實施例中的定量試驗,均設置三次重複實驗,結果取平均值。
著色指數指的是:成熟蘋果果實表皮,紅色區域面積佔表皮總面積的比例。
蘆丁的結構式如下:
Trolox的結構式如下:
80%丙酮溶液:將4體積份丙酮與1體積份水混合。
1%鹽酸甲醇溶液:97.2ml甲醇與2.8ml濃鹽酸混合。濃鹽酸即市售12mol/L鹽酸。
0.5%鹽酸甲醇溶液的製備方法:將0.5體積份35%濃鹽酸與99.5體積份甲醇混合。
提及『紅富士』蘋果和『嘎啦』蘋果的參考文獻:陳學森,辛培剛等,元帥和金帥在蘋果新品種選育中的作用,山東農業大學學報,1994,25(2):236—248。
實施例1、通過持續多代芽變選種對蘋果紅皮性狀進行持續改良的方法的建立
一、蘋果紅色芽變的特點
調研發現,蘋果的紅色芽變具有如下三個特點:
(1)蘋果紅色芽變的重演性
調研發現,蘋果的紅色芽變可在國內外不同地區及不同年份重複發生,表現出芽變的重演性。這為有效利用芽變選種技術對蘋果紅皮性狀持續改良提供了科學依據。
(2)蘋果紅色芽變的多效性
對多個蘋果紅色芽變品種進行調研發現,儘管均是紅色芽變,但不同芽變品種(系)在著色類型(條紅或片紅)、著色速度以及對光的敏感程度等存在明顯差異。這為有效利用芽變選種技術選育特色多樣化品種、滿足消費者和栽培者的多樣化需求提供了科學依據;
(3)蘋果紅色芽變的穩定性
對多個蘋果紅色芽變品種嫁接繁殖後的穩定性進行了調研,結果表明,蘋果紅色芽變具有很好的遺傳穩定性和一致性。這為蘋果紅色芽變品種的大面積推廣應用提供了科學依據。
二、芽變的機理
經過發明人的大量研究,蘋果的紅色芽變是特異DNA分子甲基化水平差異引起的表觀遺傳。特異DNA分子如序列表的序列1所示。
經檢測,『紅富士』蘋果和『嘎啦』蘋果的基因組中均具有序列表的序列1所示的特異DNA分子。
三、通過持續多代芽變選種對蘋果紅皮性狀進行持續改良的方法的建立
建立如下方法:將蘋果品種C0進行持續多代的芽變選種,第一代芽變選種將蘋果品種CO作為出發品種,以後的每代芽變選種均將上一代芽變選種得到的品種作為出發品種,每代芽變選種從全滿足如下三個性狀的芽發育出的枝條或植株中選擇目標品種:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為出發品種的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為出發品種的二分之一以下。上述果皮均指的是成熟蘋果的果皮。
檢測果皮的花青苷含量的方法如下:
①取0.5g果皮,液氮研磨,加入5ml 4℃預冷的1%鹽酸甲醇溶液,4℃避光靜置,提取24h。
②完成步驟①後,取提取液,分為兩份,每份1ml,一份加入4ml KCl緩衝液,另一份加入4ml NaAC緩衝液,混勻後4℃避光靜置提取15min,然後8000r/min離心10min,收集上清液。
KCl緩衝液(pH=1、0.025M):1.86g KCl用980ml蒸餾水溶解,用濃鹽酸調pH為1.0,轉移到1L容量瓶中,用蒸餾水定容。
NaAC緩衝液(pH=4.5、0.4M):54.43g NaAC用960ml蒸餾水溶解,用濃鹽酸調pH為4.5,轉移到1L容量瓶中,用蒸餾水定容。
③取步驟②得到的上清液,分別測定510nm和700nm下的吸光值。
花青苷含量(mg/g)=△A*5*0.005*1000*449.2/(26900*0.5);
△A=(A510nm-A700nm)pH1.0條件下-(A510nm-A700nm)pH4.5條件下。
「mg/g」中,mg指的是花青苷的質量,g指的是果皮鮮重。
檢測果皮的特異DNA分子的甲基化水平的方法如下:
①利用QIAGEN植物基因組DNA抽提試劑盒提取果皮的基因組DNA。
②取步驟①得到基因組DNA,採用EZ DNA Methylation-Gold試劑盒進行亞硫酸鹽轉化,得到亞硫酸鹽處理的DNA。
③取步驟②得到的亞硫酸鹽處理的DNA,作為模板,分兩個體系進行PCR擴增。
PCR擴增體系Ⅰ:10×Ex Taq Buffer 2.5μl,dNTP Mixture 2μl,引物F1 2μl、引物R1 2μl,TaKaRa Ex Taq HS 0.5μl,模板4μl,ddH2O 12μl。
PCR擴增體系Ⅰ的反應程序:94℃預變性5分鐘;94℃變性30秒、51℃退火30秒、72℃延伸1分鐘,共進行40個循環;72℃延伸10分鐘。
PCR擴增體系Ⅱ:10×Ex Taq Buffer 2.5μl,dNTP Mixture 2μl,引物F2 2μl、引物R2 2μl,TaKaRa Ex Taq HS 0.5μl,模板4μl,ddH2O 12μl。
PCR擴增體系Ⅱ的反應程序:94℃預變性5分鐘;94℃變性30秒、54℃退火30秒、72℃延伸1分鐘,共進行40個循環;72℃延伸10分鐘。
引物F1:5』-TAGGTTTGAAGAATTAATTAGGGAT-3』;
引物R1:GGGAAATTTTGGTTTTTATATGGTTTAG-3』。
引物F2:TTTTATTTTTTATATATATTATGTTATT-3』;
引物R2:GGATTATGTTATTAGATGGT-3』。
④分別將步驟③的兩個體系的擴增產物進行測序,利用CyMATE軟體(Hetzl et al.,2007)輸出甲基化水平數據。
特異DNA分子的甲基化水平=(體系Ⅰ的甲基化水平數據+體系Ⅱ的甲基化水平數據)÷2。
實施例2、應用實施例1建立的方法通過持續多代芽變選種對蘋果紅皮性狀進行持續改良
本實施例中檢測果皮的花青苷含量的方法和檢測果皮的特異DNA分子的甲基化水平的方法同實施例1。
一、紅富士蘋果紅色芽變新品種選育
1、第一代芽變選種:
將紅富士作為出發品種,將滿足如下三個性狀的芽發育出的枝條或植株作為初選對象:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為紅富士的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為紅富士的二分之一以下。上述果皮均指的是成熟蘋果的果皮。
將初選對象進行複選和決選後,得到的某一個品種作為品種甲。
2、第二代芽變選種:
將品種甲作為出發品種,將滿足如下三個性狀的芽發育出的枝條或植株作為初選對象:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為品種甲的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為品種甲的二分之一以下。上述果皮均指的是成熟蘋果的果皮。
將初選對象進行複選和決選後,得到的某一個品種作為品種乙。
紅富士、品種甲和品種乙的果皮中的花青苷檢測結果見圖1。品種甲的果皮的花青苷含量為紅富士的2倍以上,品種乙的果皮的花青苷含量為品種甲的2倍以上。
紅富士、品種甲和品種乙的果皮中的特異DNA分子甲基化水平檢測結果見圖2。品種甲的果皮的特異DNA分子的甲基化水平是紅富士的二分之一以下,品種乙的果皮的特異DNA分子的甲基化水平是品種甲的二分之一以下。
紅富士的果皮顏色性狀:著色速度較慢(除袋之後10-15天著色),著色指數為25%-35%(成熟果實表皮,25%-35%顯示為淺紅色、剩餘部分顯示為黃色或綠色)。紅富士的果肉顏色性狀:乳白色果肉。
品種甲的果皮顏色性狀:著色速度較快(除袋之後6-9天著色),著色指數為75%-85%(成熟果實表皮,75%-85%顯示為鮮紅色)。品種甲的照片見圖3。品種甲的果肉顏色性狀:乳白色果肉。
品種乙的果皮顏色性狀:著色速度快(除袋之後3-4天著色),著色指數為90%以上(成熟果實表皮,90%以上為寶石紅色)。品種乙的照片見圖4。品種乙的果肉顏色性狀:乳白色果肉。
二、紅富士蘋果紅色、短枝雙芽變優質短枝型新品種選育
1、第一代芽變選種:
將紅富士作為出發品種,將滿足如下四個性狀的芽發育出的枝條或植株作為初選對象:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為紅富士的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為紅富士的二分之一以下;(d)芽發育成的枝條或植株上生長的枝條的節間長度為2cm以下。上述果皮均指的是成熟蘋果的果皮。
將初選對象進行複選和決選後,得到的某一個品種作為品種丙。
2、第二代芽變選種:
將品種丙作為出發品種,將滿足如下四個性狀的芽發育出的枝條或植株作為初選對象:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為品種丙的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為品種丙的二分之一以下;(d)芽發育成的枝條或植株上生長的枝條的節間長度為2cm以下。上述果皮均指的是成熟蘋果的果皮。
將初選對象進行複選和決選後,得到的某一個品種作為品種丁。
紅富士的果皮顏色性狀:著色速度較慢(除袋之後10-15天著色),著色指數為25%-35%(成熟果實表皮,25%-35%顯示為淺紅色、剩餘部分顯示為黃色或綠色)。紅富士的果肉顏色性狀:乳白色果肉。
品種丙的果皮顏色性狀:著色速度較快(除袋之後7-10天著色),著色指數為75%-85%(成熟果實表皮,75%-85%顯示為鮮紅色)。品種丙的果肉顏色性狀:乳白色果肉。品種丙的短枝性狀:節間長度為2cm以下。
品種丁的果皮顏色性狀:著色速度快(除袋之後3-5天著色),著色指數為90%以上(成熟果實表皮,90%以上為濃紅色)。品種丁的照片見圖5。品種丁的果肉顏色性狀:乳白色果肉。品種丁的短枝性狀:節間長度為2cm以下。
三、嘎啦蘋果紅色芽變新品種選育
1、第一代芽變選種:
將嘎啦作為出發品種,將滿足如下三個性狀的芽發育出的枝條或植株作為初選對象:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為嘎啦的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為嘎啦的二分之一以下。上述果皮均指的是成熟蘋果的果皮。
將初選對象進行複選和決選後,得到的某一個品種作為品種戊。
2、第二代芽變選種:
將品種戊作為出發品種,將滿足如下三個性狀的芽發育出的枝條或植株作為初選對象:(a)發生紅色芽變;(b)芽發育成的枝條或植株上生長的蘋果的果皮的花青苷含量為品種戊的2倍以上;(c)芽發育成的枝條或植株上生長的蘋果的果皮的特異DNA分子的甲基化水平為品種戊的二分之一以下。上述果皮均指的是成熟蘋果的果皮。
將初選對象進行複選和決選後,得到的某一個品種作為品種己。
嘎啦的果皮顏色性狀:著色速度較慢(除袋之後8-12天著色),著色指數為25%-35%(成熟果實表皮,25%-35%顯示為淺紅色、剩餘部分顯示為黃色或綠色)。嘎啦的果肉顏色性狀:乳白色果肉。嘎啦的照片見圖6。
品種戊的果皮顏色性狀:著色速度較快(除袋之後5-8天著色),著色指數為75%-85%(成熟果實表皮,75%-85%顯示為鮮紅色)。品種戊的果肉顏色性狀:乳白色果肉。
品種己的果皮顏色性狀:著色速度快(除袋之後3-5天著色),著色指數為90%以上(成熟果實表皮,90%以上為濃紅色)。品種己的照片見圖7。品種己的果肉顏色性狀:乳白色果肉。
實施例3、蘋果優異種質『CSR6R6-666』的獲得和鑑定
鑑定蘋果植株為R1R1基因型、R6R6基因型還是R6R1基因型的方法如下:從待測蘋果植株上取蘋果,提取蘋果果肉的基因組DNA,以基因組DNA為模板,採用F3和R3組成的引物對進行PCR擴增,然後按如下標準判讀基因型:如果PCR擴增產物為一條帶且為497bp,待測蘋果植株為R6R6基因型;如果PCR擴增產物為一條帶且為386bp,待測蘋果植株為R1R1基因型;如果PCR擴增產物為兩條帶且分別為497bp和386bp,待測蘋果植株為R6R1基因型。
F3:5』-GGTGGTCAAAGATGTGTGTTGT-3』;
R3:5』-TTTGCCTGCTACCCACTTCA-3』。
經檢測,『紅富士』蘋果和『嘎啦』蘋果均為R1R1基因型。
一、『CSR6R6-666』的獲得
新疆紅肉蘋果作為親本,與『紅富士』等白肉栽培蘋果品種雜交。按照孟德爾遺傳定律,新疆紅肉蘋果(R6R1基因型)與『紅富士』(R1R1基因型)等白肉栽培蘋果品種雜交,其後代群體應為紅肉表型(R6R1基因型):白肉表型(R1R1基因型)=1:1。但是,在雜交F1代群體中發現了R6R6基因型的單株。
將一株R6R6基因型的單株命名為『CSR6R6-666』。
『CSR6R6-666』具有如下表型:莖、葉、花、果皮和果肉等各部分及各個發育階段均為紫紅色。
二、『CSR6R6-666』的保藏
『CSR6R6-666』,又稱蘋果(Malus domestica)CSR6R6-666,已於2017年2月17日保藏於中國微生物菌種保藏管理委員會普通微生物中心(簡稱CGMCC,地址為:北京市朝陽區北辰西路1號院3號,中國科學院微生物研究所),保藏登記號為CGMCC NO.13783。
三、『CSR6R6-777』的保藏
『CSR6R6-777』是發明人所在的實驗室前期選育出來的另一株R6R6基因型的單株。
『CSR6R6-777』,又稱蘋果(Malus domestica)CSR6R6-777,已於2016年12月08日保藏於中國微生物菌種保藏管理委員會普通微生物中心(簡稱CGMCC,地址為:北京市朝陽區北辰西路1號院3號,中國科學院微生物研究所),保藏登記號為CGMCC NO.12468。
四、類黃酮組分含量分析
分別將『CSR6R6-666』和『CSR6R6-777』作為待測植株。
1、取待測植株上的蘋果,取蘋果果肉。
2、取步驟1得到的果肉,在液氮中研磨得到粉末。
3、稱取2g步驟2得到的粉末,加入5mL 0.5%鹽酸甲醇溶液,4℃靜置提取2h,然後8000rpm離心20min,分別收集上清液和殘渣。
4、取步驟3得到的殘渣,加入5mL 0.5%鹽酸甲醇溶液,4℃靜置提取1h,然後8000rpm離心20min,收集上清液。
5、將步驟3得到的上清液和步驟4得到的上清液混合,得到混合液。
6、取步驟5得到的混合液,37℃旋蒸除去甲醇,殘留物用2-3ml甲醇溶解,然後8000rpm離心20min,收集上清液。
7、取步驟6得到的上清液,用甲醇定容至5ml,然後用0.45μm濾膜過濾,收集濾液。
8、將步驟7得到的濾液進行HPLC-MS分析。
液相色譜條件:
採用WATERS ACQUITY UPLC色譜儀,色譜柱為BEH C18柱(100mm×2.1mm),填料粒徑1.7μm;柱溫45℃;進樣體積1μL;
流動相為A液和B液的混合液,流速為0.3mL/min;A液為乙腈,B液為含0.2%(體積分數)甲酸的水溶液;0-0.1min,A液佔流動相的體積分數為5%;0.1-20min,A液佔流動相的體積分數由5%線性上升至20%;20-22min,A液佔流動相的體積分數由20%線性上升至80%;22-22.1min,A液佔流動相的體積分數由80%線性下降至5%;22.1-25min,A液佔流動相的體積分數為5%。
質譜條件:
質譜儀為WATERS MALDI SYNAPT Q-TOF MS,ESI電離源,電噴霧離子化正離子採集模式(ESI+);掃描範圍100-1500m/z;毛細管電壓3.5kV,錐孔電壓30V;源溫度100℃,脫溶溫度300℃;脫溶劑氣流量500L/h。
9種特定黃酮醇物質的含量見表1。表1中的9種特有物質的檢測方法均屬於類黃酮組分及含量檢測方法,參考文獻(陳學森,張晶,劉大亮,等.新疆紅肉蘋果雜種一代的遺傳變異及功能型蘋果優株評價[J].中國農業科學,2014,47(11):2193-2204.。
表1
以上結果表明,『CSR6R6-666』和『CSR6R6-777』均具有很強的類黃酮合成能力,果肉富含類黃酮,並且含有特殊的黃酮醇類組分,是培育功能型蘋果品種的優異種質。『CSR6R6-666』優於『CSR6R6-777』。
實施例4、芽變選種和雜交育種有機結合培育『功能1號』功能型蘋果新品系
一、功能型蘋果新品系
1、回交(在山東煙臺市牟平區進行)
2011年4月,取『CSR6R6-666』的花粉,對去雄後的品種乙進行授粉,收穫BC1雜交種子,將BC1雜交種子洗淨後放到1-3℃冰箱保鮮室層積處理60d左右(目的是通過滿足需冷量來解除種子休眠)。
2、溫室育苗(在山東泰安進行)
2011年12月,將步驟1得到的BC1雜交種子播種於裝有育苗基質的營養缽(每個營養缽播種3-5粒種子)培養至實生苗高度為8-15cm且根頸處木質化(通常為播種2-3個月),然後將實生苗移栽至新的裝有育苗基質的營養缽(每個營養缽移栽1株)進行培養;本步驟中的培養條件為:25℃、每天光照12小時(光照強度3000lx),從種子萌發開始每7-10天澆一次營養液(將MS基本培養基的大量元素母液用水稀釋至10倍體積即為營養液)、每次每個營養缽澆40-50ml。
3、雜種實生苗定植(在山東冠縣進行)
2012年2月,在擬定植實生苗的選種圃(大田)中每畝施入有機肥(本實施例中採用的為充分腐熟的奶牛糞)6000kg並澆水沉實;2012年4月,將3600株步驟2得到的實生苗定植於選種圃,2012年4月在定植有實生苗的選種圃中每畝再施入有機肥(本實施例中採用充分腐熟的奶牛糞)6000kg並及時澆水。
4、雜種實生苗環剝處理
2015年5月,在離地面20cm處對各實生苗的主幹進行環剝,環剝寬度為0.5-1.0cm,深達木質部。此操作的目的是促進營養物質的積累及花芽分化,以縮短童期、提早結果。
5、花果管理
2016年4-5月,在各實生苗的盛花期進行疏花(每個花序的5朵花僅保留中心花,其他全部疏除)。幼果不套袋,常規管理。
6、功能型蘋果新品系『功能1號』的獲得
2016年9月,從回交後代群體中選育出功能型蘋果新品系『功能1號』(照片見圖8)。『功能1號』的果肉全紅、果皮全紅。
二、類黃酮含量、花青苷含量及抗氧化能力分析
待測材料:『功能1號』上生長的蘋果、『CSR6R6-666』上生長的蘋果和『CSR6R6-777』上生長的蘋果。
1、果肉的類黃酮含量測定
(1)取1g果肉,液氮研磨,然後加入10ml 4℃預冷的65%(體積百分含量)乙醇水溶液並混勻,4℃避光靜置提取4h,然後12000g離心20min,收集上清液。
(2)取試管,加入0.5ml步驟(1)得到的上清液,然後依次加入1mL 5g/100ml NaNO2水溶液、1ml 10g/100ml AL(NO3)3水溶液、4mL 2M NaOH水溶液,混勻後靜置15min,8000rpm離心10min,取上清,然後在510nm下測定吸光值。
以蘆丁(rutin,Sigma chemical,ST,Loiuis,USA)為標樣做標準曲線。
2、果肉的花青苷含量測定
(1)取0.5g果肉,液氮研磨,加入5ml 4℃預冷的1%鹽酸甲醇溶液,4℃避光靜置提取24h。
(2)取步驟(1)得到的提取液,分成2份,每份1ml,第一份加入4ml KCl緩衝液,第二份加入4ml NaAC緩衝液,混勻後4℃避光靜置提取15min,然後8000r/min離心10min,收集上清液。
KCl緩衝液(pH=1、0.025M):1.86g KCl用980ml蒸餾水溶解,用濃鹽酸調pH為1.0,轉移到1L容量瓶中,用蒸餾水定容。
NaAC緩衝液(pH=4.5、0.4M):54.43g NaAC用960ml蒸餾水溶解,用濃鹽酸調pH為4.5,轉移到1L容量瓶中,用蒸餾水定容。
(3)取步驟(2)得到的上清液,分別測定510nm和700nm下的吸光值。
花青苷含量(mg/g)=△A*5*0.005*1000*449.2/(26900*0.5);
△A=(A510nm-A700nm)pH1.0條件下-(A510nm-A700nm)pH4.5條件下。
「mg/g」中,mg指的是花青苷的質量,g指的是果肉鮮重。
3、果肉的抗氧化能力測定
(1)取果肉,液氮研磨,得到粉末。
(2)稱取10g步驟(1)得到的粉末,加入50mL 80%丙酮溶液,4℃靜置提取2h,8000rpm離心10min,收集上清。
(3)取完成步驟(2)的殘渣,加入50mL 80%丙酮溶液,4℃靜置提取1h,8000rpm離心10min,收集上清。
(4)將步驟(2)得到的上清和步驟(3)得到的上清合併,得到混合液。
(5)取步驟(4)得到的混合液,40℃旋蒸除去丙酮,殘留部分5000rpm離心,取上清液,用去離子水定容至20mL,得到待測樣品。
(6)10體積份乙酸緩衝液、1體積份20mM FeCl3·6H2O水溶液和1體積份TPTZ溶液混合,37℃水浴5min。
乙酸緩衝液(pH3.6、300mM):16.8克冰醋酸和0.8克氫氧化鈉與水配製成1升溶液。
TPTZ溶液:含10mM 2,4,6–三吡啶基三嗪和40mM鹽酸的水溶液。
(7)完成步驟(6)後,取4mL溶液,與30μL待測樣品混合,37℃靜置反應120min,然後593nm測其吸光度。以Trolox為標樣做標準曲線。
結果見表2。
實施例5、芽變選種和雜交育種有機結合培育『功能2號』功能型蘋果新品系用品種己代替品種乙,按照實施例4的步驟進行操作。
2016年7月,從回交後代群體中選育出功能型蘋果新品系『功能2號』(照片見圖9)。『功能2號』的果肉全紅、果皮全紅。
結果見表2。
表2
SEQUENCE LISTING
山東農業大學
持續多代芽變選種及其與雜交育種聯合對蘋果紅色性狀持續改良的方法
GNCYX170348
1
PatentIn version 3.5
1
841
DNA
蘋果
1
taggcttgaa gaatcaatta gggatttaca aaatgattaa agggattttg ggtgtttgct 60
gttgccattt ttgaacacaa catcagttcc actactcttt cattttccct caatttctga 120
gcaaccaaac aagtagcatt attgacaaca tactgagctc ctcgtgtcaa ccattcttga 180
aagaatccta ataaagattt ataggcaaat tatgccctag aaaaaattta ataaaaagga 240
ccctgaacac gtaggaaccg gcccgtttgt aacagactga gataggtccg gttctatttc 300
ttaaaaaccc aacacccgct acgttccatt tataaacggg tcggtctggt ccctccaact 360
ttgagcccgg ctcgacttgt gcccactcct aaactaaacc atataaaaac caagatttcc 420
ctttcatctt tcacacatat cacgttactt tccaacaaca attcaacaat cacaacaaat 480
aatcaaccat caagatcata tatcacgtca ctaataaaga caaccttcat aagggttgcc 540
gtagttctct acttgaaatc caattgtcta gcattgtaac cctaagttac agacacaaac 600
ataaacttga gcaacttcta tgcataagaa tctagggttt tggactaact caacagaacc 660
taacaagaaa taatattctg gaccgcttaa cggaatccaa cgaagacaag gtttcggacc 720
actcaacgga acaaataagg aagggatata aaccattcaa cgaaatccat ctttagaata 780
cgcatagtcc cccaatacgg attaaccaag tgagaacata cgccatctga tagcgtggtc 840
c 841
