一種快速提取革蘭氏陽性菌基因組DNA的方法和試劑盒與流程
2023-08-08 00:36:21 2
本發明涉及生物
技術領域:
,具體地,涉及一種快速提取革蘭氏陽性菌基因組DNA的方法和一種快速提取革蘭氏陽性菌基因組DNA的試劑盒。
背景技術:
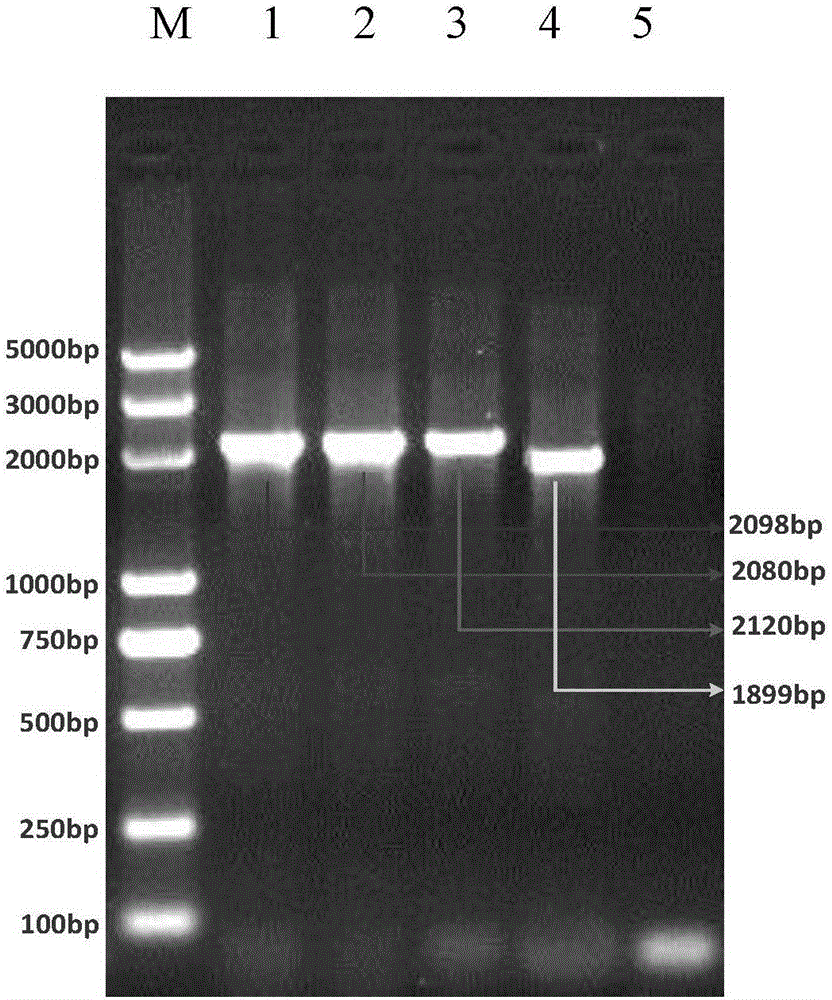
:由於革蘭氏陽性菌的細胞壁相對較厚,與革蘭氏陰性菌的細胞壁成分不同,給食源性致病菌檢測領域帶來比較大的困難,嚴重影響了檢測效率。傳統提取革蘭氏陽性菌基因組的方法中,酶解法是最常用的方法。酶解法需要用酶來消化革蘭氏陽性菌的細胞壁肽聚糖成分,然後用溶劑抽提,如酚/氯仿。吸附DNA材料主要採用矽質材料、陰離子交換樹脂及磁珠等。該方法試劑耗材價格昂貴,成本較高。且步驟多、費時,操作過程中易產生蛋白酶殘留,導致PCR反應受到抑制;酚、氯仿等有機溶劑易造成環境汙染,有損實驗操作者的健康。當僅有少量材料時,傳統的DNA製備方法格外不適用。其他方法,如超聲波法、研磨法、凍融法都能夠幫助破除革蘭氏陽性菌的細胞壁,但是由於操作複雜度、特殊儀器等方面的限制原因,沒能夠在食源性致病菌檢測領域擴大使用,長期以來,革蘭氏陽性菌樣本中DNA的提取和純化一直是耗時、繁瑣的過程,嚴重減慢了檢測速度,低通量的提取方法已經無法滿足大量樣本製備基因組DNA的需求。技術實現要素:本發明的目的是克服目前的DNA提取方法在用於革蘭氏陽性細菌基因組DNA提取時所存在的效率較低的缺陷,提供一種以較高提取效率分離純化出高收率和高純度的革蘭氏陽性細菌基因組DNA的試劑盒和方法。為了實現上述目的,本發明首先提供一種提取革蘭氏陽性菌基因組DNA的試劑盒,其中,所述試劑盒包括:粒徑為78μm-106μm的第一玻璃珠和粒徑為425-600μm的第二玻璃珠,且所述第一玻璃珠與所述第二玻璃珠在使用時的重量比為1:(0.6-1.3)。優選的,所述第一玻璃珠與所述第二玻璃珠在使用時的重量比為1:(0.8-1.2)。本發明還提供了一種革蘭氏陽性菌基因組DNA提取方法,其中,該方法包括以下步驟:(1)將菌體與DNA純化緩衝液、粒徑為78μm-106μm的第一玻璃珠和粒徑為425-600μm的第二玻璃珠混合得到裂解混合物;其中,所述第一玻璃珠與所述第二玻璃珠的重量比為1:(0.6-1.3);(2)對所述裂解混合物進行脈衝震蕩裂解,脈衝震蕩裂解的條件為在5000-7000rpm下進行3-5次脈衝震蕩,每次脈衝震蕩2-4s,每次間歇1-3s獲得裂解產物;(3)將所述裂解產物在80-100℃下孵育2-10min後冷卻至15-25℃,離心後得到上清液。本發明還提供了所述試劑盒或提取方法在革蘭氏陽性菌檢測中的用途。通過上述技術方案,本發明能夠實現革蘭氏陽性菌基因組快速提取,克服了傳統基因組提取方法上的不足之處,具備如下有益效果:(1)簡便快速易操作:提取方法操作步驟少,操作簡單,整個過程僅需要10分鐘就可以完成。(2)提取通量高,樣品需求少:可以一次性提取100個樣本,檢測樣本可以是培養皿上的單菌落菌體或增菌液。(3)適用菌體範圍廣泛:採用不同粒徑的玻璃珠進行組合,可以適用不同直徑大小的食源性革蘭氏陽性菌,提取效果可靠、高效。(4)成本低、安全可靠:不需要特殊儀器、昂貴試劑、無有毒有害物質,安全性高。本發明的其他特徵和優點將在隨後的具體實施方式部分予以詳細說明。附圖說明附圖是用來提供對本發明的進一步理解,並且構成說明書的一部分,與下面的具體實施方式一起用於解釋本發明,但並不構成對本發明的限制。在附圖中:圖1是四種革蘭氏陽性菌基因組DNA瓊脂糖凝膠電泳結果。其中,泳道1:金黃色葡萄球菌;泳道2:蠟樣芽孢桿菌;泳道3:單增李斯特菌;泳道4:鏈球菌;泳道5:空白對照;M:5KMarker;圖2是金黃色葡萄球菌基因組DNA的螢光定量結果;其中,A為商品化試劑盒(天根生物,DP302)提取的基因組DNA的螢光定量結果;B為用本發明試劑盒提取的基因組DNA的螢光定量結果;具體實施方式以下結合附圖對本發明的具體實施方式進行詳細說明。應當理解的是,此處所描述的具體實施方式僅用於說明和解釋本發明,並不用於限制本發明。本發明提供了一種提取革蘭氏陽性菌基因組DNA的試劑盒,其中,所述試劑盒包括:粒徑為78μm-106μm的第一玻璃珠和粒徑為425-600μm的第二玻璃珠,且所述第一玻璃珠與所述第二玻璃珠在使用時的重量比為1:(0.6-1.3)。其中,本發明採用的粒徑為78μm-106μm的第一玻璃珠和粒徑為425-600μm的第二玻璃珠混合,二者直徑大小差異大,可以破碎較小(0.2μm)和較大(3μm)的細菌菌體,將二者混合使用效果明顯優於單一粒徑玻璃珠的破壁效果,特別適用於革蘭氏陽性菌的破壁;不僅避免了由於破壁不完全造成的漏提漏檢,而且顯著節省了實驗操作時間。其中,根據本發明一種優選的實施方式,所述第一玻璃珠與所述第二玻璃珠在使用時的重量比為1:(0.8-1.2)。在該優選實施方式中,本發明能夠進一步提高樣本中基因組DNA的收率和純度。其中,所述試劑盒還含有DNA純化緩衝液,所述DNA純化緩衝液含有11-13%(m/v)的Chelex-100和5-15mMTris,且pH值為8.8-9.2。玻璃珠振蕩破壁後細胞內容物釋放到液體環境中,由於細胞內容物含有大量蛋白、糖類、以及鹽離子等,這些因素會影響提取的基因組DNA的質量並進而影響下遊應用的效果,例如,能夠抑制PCR反應。為了能夠快速的純化DNA以滿足下遊應用特別是PCR反應的質量要求,本發明的技術方案採用Chelex-100和Tris的鹼性溶液來純化DNA。本發明所提供的試劑盒中,DNA純化緩衝液在一定條件下可以導致細胞膜破裂和DNA變性,使DNA釋放出來,通過高選擇性地結合多價陽離子,可阻止金屬離子對DNA降解的催化作用,並能去除肽類等可與DNA結合的大分子物質。進而可以快速有效的去除大多數的陽性離子,沉降大部分的蛋白,有效保護DNA。以免影響下一步的應用。所述DNA純化緩衝液可以通過以下方法配置:用電子天平稱取Chelex-100,將Chelex-100顆粒加入到無菌水中;加入1MTris(pH值為9),定容至100ml;本發明還提供了一種革蘭氏陽性菌基因組DNA提取方法,其中,該方法包括以下步驟:(1)將菌體與DNA純化緩衝液、粒徑為78μm-106μm的第一玻璃珠和粒徑為425-600μm的第二玻璃珠混合得到裂解混合物;其中,所述第一玻璃珠與所述第二玻璃珠的重量比為1:(0.6-1.3);(2)對所述裂解混合物進行脈衝震蕩裂解,脈衝震蕩裂解的條件為在5000-7000rpm下進行3-5次脈衝震蕩,每次脈衝震蕩2-4s,每次間歇1-3s獲得裂解產物;(3)將所述裂解產物在80-100℃下孵育2-10min後冷卻至15-25℃,離心後得到上清液。其中,所述DNA純化緩衝液含有11-13%(m/v)的Chelex-100和5-15mMTris,且pH值為8.8-9.2。在本發明的一種實施方式中,所述菌體從菌液中分離得到,可以先將含有菌體的菌液離心分離得到菌體,再按照本發明所提供的方法進行基因組DNA提取。其中,在步驟(1)中可以將菌體與DNA純化緩衝液充分混合後再加入所述第一玻璃珠和第二玻璃珠。其中,根據本發明一種優選的實施方式,所述第一玻璃珠與所述第二玻璃珠在使用時的重量比為1:(0.8-1.2)。在該優選實施方式中,本發明能夠進一步提高樣本中基因組DNA的收率和純度。其中,所述脈衝震蕩可以在高頻旋渦振蕩器上進行。玻璃珠頻繁碰撞擠壓產生細胞剪切作用。在本發明所提供的震蕩條件下可以避免基因組DNA碎片的產生,獲得高完整度的基因組DNA。在本發明的一種優選的實施方式中,在步驟(1)中,DNA裂解緩衝液的用量為0.2-1ml;第一玻璃珠和第二玻璃珠的總用量為0.15-0.25g。優選的,在步驟(3)中,離心的條件為在8000-14000g下離心1-10min。本發明還提供了所述試劑盒或提取方法在革蘭氏陽性菌檢測中的用途,所述用途包括提取革蘭氏陽性菌的基因組DNA後進行PCR檢測、基因測序檢測或分子雜交檢測等。以下,通過實施例進一步詳細說明本發明。下述實施例中所使用的材料、試劑等,如無特殊說明,均可從商業途徑得到。例如,粒徑為78μm-106μm的第一玻璃珠購自Sigma公司,貨號為G8893;粒徑為425-600μm的第二玻璃珠購自Sigma公司,貨號為G8772;Chelex-100購自Sigma公司,貨號為C7901。實施例11)按照以下配方製作用於DNA純化的材料:取4種革蘭氏陽性菌:金黃色葡萄球菌、蠟樣芽孢桿菌、單核細胞增生李斯特氏菌、鏈球菌,分別挑取單菌落,分別接種於5mLLB液體培養基的試管中培養,37℃,200rpm搖菌8h至菌體濁度為1OD。2)按照以下配方製作用於破碎細胞壁的材料:①DNA純化緩衝液:用電子天平稱取12gChelex-100,將Chelex-100顆粒加入到80ml無菌水中;②加入1MTris(pH值為9)1ml,定容至100ml;③玻璃珠A:≤106μm玻璃珠:0.1g;④玻璃珠B:425μm-600μm玻璃珠:0.1g。3)操作步驟:(1)取1.0ml菌液於EP管中,10000g離心2min;(2)去掉上清,用300μL的DNA純化緩衝液懸浮菌體,加入0.1g玻璃珠A和0.1g玻璃珠B;(3)在渦旋振蕩器上,6000rpm振蕩3s,間歇2s,振蕩3-5次;(4)沸水浴5min;(5)取出並放至25℃後,10000g離心1min;(6)小心吸取上清液50μL轉移到新的EP管中保存,該上清含有基因組DNA。Nanodrop檢測基因組DNA的濃度如下表1所示。表1菌名濃度260/280金黃色葡萄球菌82ng/μL1.94蠟樣芽孢桿菌98ng/μL1.81單增李斯特菌110ng/μL1.79鏈球菌88ng/μL2.24)PCR反應體系的配製取200μL的PCR管配置25μL的反應體系,其配置如下:2×PCRBuffer12.5μL;25xDNA聚合酶1μL;10×引物混合液2.5μL,模板2μL,去離子水7μL。5)PCR反應將PCR管放入Bio-RadC1000型PCR儀中,開啟熱蓋後,按照如下程序進行PCR反應:95℃5min;95℃30s,60℃30s,72℃90s,30個循環;72℃5min。6)瓊脂糖凝膠電泳分析PCR產物取5μL的PCR產物與1μL的6X上樣緩衝液混勻,加入到瓊脂糖凝膠的加樣孔中。採用2%的瓊脂糖凝膠,5V/cm電泳40min,使用凝膠成像儀顯示擴增目標條帶的大小。瓊脂糖凝膠電泳結果如圖1所示,由圖1可知:本發明的試劑盒可以提取不同的革蘭氏陽性菌,提取得到的基因組DNA純度高,回收得到的基因組DNA量大,無需進一步純化完全可以滿足下遊的分子檢測實驗。對比例1不同震蕩模式對提取DNA效果影響對比試驗按照實施例1的方法進行金黃色葡萄球菌基因組DNA的提取,區別僅在於,震蕩模式分別為:(1):持續振蕩模式6000rpm,持續振蕩1min;(2):脈衝振蕩模式6000rpm,振蕩3s,間隔2s,重複20次;Nanodrop檢測基因組DNA的濃度,用瓊脂糖凝膠電泳分析PCR產物,用螢光定量法評估基因組DNA的提取效果,結果顯示相對於實施例1的方法,持續震蕩模式與多次脈衝震蕩模式下提取的DNA完整性不高,不利於下遊的分子檢測。對比例2不同純化試劑純化DNA效果對比實驗按照實施例1的方法進行金黃色葡萄球菌基因組DNA的提取,區別僅在於,DNA純化緩衝液為:(1):無菌水;(2):有12%(m/v)的Chelex-100和10mMTris,且pH值為8.5;(3):有12%(m/v)的Chelex-100和10mMTris,且pH值為9.5;Nanodrop檢測基因組DNA的濃度,用瓊脂糖凝膠電泳分析PCR產物,用螢光定量法評估基因組DNA的提取效果,結果顯示:上述方法提取的DNA中純度較低,含有蛋白質等抑制物,不利於下遊的分子檢測。對比例3玻璃珠比例對提取DNA效果影響對比試驗按照實施例1的方法進行金黃色葡萄球菌基因組DNA的提取,玻璃珠共添加0.2g,區別僅在於,用量比例分別為:(1)玻璃珠A:B1:9;(2)玻璃珠A:B2:8;(3)玻璃珠A:B3:7;(4)玻璃珠A:B5:6;(5)玻璃珠A:B5:5;(6)玻璃珠A:B5:3;(7)玻璃珠A:B7:3;(8)玻璃珠A:B8:2;(9)玻璃珠A:B9:1;Nanodrop檢測基因組DNA的濃度,用瓊脂糖凝膠電泳分析PCR產物,用螢光定量法評估基因組DNA的提取效果,結果顯示:玻璃珠A與B比例為5:6、5:5和5:3時DNA的提取效果較好,當為5:5時,效果最優,其他提取的DNA完整性不高,不利於下遊的分子檢測。實施例2本發明的試劑盒與市場上的商品化試劑盒(天根生物,DP302)提取效果對比試驗金黃色葡萄球菌接種於5mLLB液體培養基的試管中培養,調整菌液濁度至108CFU/ml,梯度稀釋至103CFU/ml。分別按照實施例1的方法和對照試劑盒(天根生物,DP302)說明書給出的方法進行金黃色葡萄球菌基因組DNA的提取。Nanodrop檢測108CFU/ml菌液提取的基因組DNA的濃度,用螢光定量法評估基因組DNA的提取效果。表2紫外分光光度法測的濃度試劑盒108CFU/ml濃度260/280本發明試劑盒89ng/μL1.94對照試劑盒21ng/μL1.81表3螢光定量PCR法測定提取基因組各稀釋度的CT值如表2可知,本發明所提取得到的基因組濃度是對照試劑盒提取得到的4.2倍。如表3可知,根據CT大小判斷,本發明提取的金黃色葡萄球菌基因組DNA濃度要明顯高於對照試劑盒提取的基因組DNA濃度,與紫外分光光度法測的濃度結果相一致。且僅需10min即可完成提取,是對照試劑盒所需時間的1/6。如圖2可知,本發明所提取的基因組DNA純度和濃度完全滿足螢光定量PCR的要求。本發明可以提取非常少量的樣品,提取的DNA質量完全滿足螢光定量PCR實驗所需,本發明所能提取少量樣品的效果是市面上絕大多數基因組提取試劑盒所達不到的。以上結合附圖詳細描述了本發明的優選實施方式,但是,本發明並不限於上述實施方式中的具體細節,在本發明的技術構思範圍內,可以對本發明的技術方案進行多種簡單變型,這些簡單變型均屬於本發明的保護範圍。另外需要說明的是,在上述具體實施方式中所描述的各個具體技術特徵,在不矛盾的情況下,可以通過任何合適的方式進行組合,。為了避免不必要的重複,本發明對各種可能的組合方式不再另行說明。此外,本發明的各種不同的實施方式之間也可以進行任意組合,只要其不違背本發明的思想,其同樣應當視為本發明所公開的內容。當前第1頁1 2 3 
