一種製備手性炔丙基芳基醚類化合物的方法與流程
2023-07-18 21:59:56
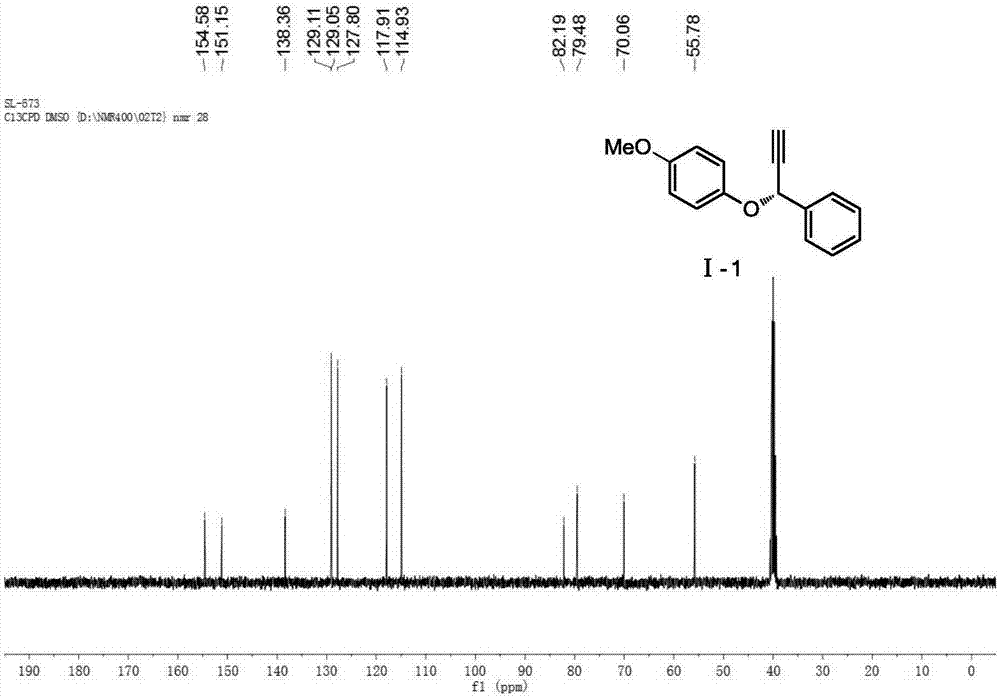
本發明屬於有機合成領域,具體涉及一種由Cu/P,N,N-配體構成的催化劑體系催化苯酚類化合物與芳香族炔丙醇酯類化合物的不對稱炔丙基取代反應來製備手性炔丙基芳基醚類化合物的方法。
背景技術:
:由於端基炔鍵可以通過簡單反應而轉變為各種官能團,炔丙基骨架已經成為有機轉化過程中很常用的一種反應中間體[(a)Kolb,H.C.;Sharpless,K.B.DrugDiscoveryToday2003,8,1128.(b)Meldal,M.;C.W.Chem.Rev.2008,108,2952.(c)Hawker,C.J.;Wooley,K.L.Science2005,309,1200.(d)Moses,J.E.;Moorhouse,A.D.Chem.Soc.Rev.2007,36,1249.(e)Lallana,E.;Riguera,R.;Fernandez-Megia,E.Angew.Chem.,Int.Ed.2011,50,8794.]。自從2003年首次報導了釕催化的炔丙醇與丙酮的不對稱炔丙基烷基化反應,炔丙基醇及其衍生物與含碳或氮親核試劑的不對稱炔丙基取代反應相繼被報導[(a)Nishibayashi,Y.;Onodera,G.;Inada,Y.;Hidai,M.;Uemura,S.Organometallics2003,22,873.(b)Fukamizu,K.;Miyake,Y.;Nishibayashi,Y.J.Am.Chem.Soc.2008,130,10498.(c)Ikeda,M.;Miyake,Y.;Nishibayashi,Y.Angew.Chem.,Int.Ed.2010,49,7289.(d)Sinisi,R.;Vita,M.V.;Gualandi,A.;Emer,E.;Cozzi,P.G.Chem.Eur.J.2011,17,7404.(e)Wang,B.;Liu,C.;Guo,H.RSCAdv.2014,4,53216]。然而,過渡金屬催化的炔丙醇衍生物的不對稱醚化反應卻很少報導。2015年,YoshiakiNishibayashi課題組首次報導了脂肪族炔丙醇酯與醇的不對稱炔丙基醚化反應,該反應的對映選擇性達到99%,但是產率不高,反應需要72h,且其反應體系對芳香族炔丙醇酯的不對稱醚化反應無效[Nakajima,K.;Shibata,M.;Nishibayashi,Y.J.Am.Chem.Soc.2015,137,2472.]。本發明利用自主發展的金屬銅/P,N,N-配體構成的催化劑實現了苯酚類化合物與芳香族炔丙醇酯類化合物的不對稱炔丙基取代反應,能高效、高對映選擇性地合成手性炔丙基芳基醚類化合物。技術實現要素:本發明的目的是提供一種銅催化的苯酚類化合物與炔丙基類化合物通過不對稱炔丙基取代反應來合成手性炔丙基芳基醚類化合物的方法。本發明具有原料易得,操作簡單,對映選擇性高等特點。本發明提供了一種製備手性炔丙基芳基醚類化合物的方法,在鹼添加劑存在下,手性銅催化劑在反應介質中催化苯酚類化合物與炔丙基類化合物通過不對稱炔丙基取代反應合成,具體步驟為:(1)手性銅催化劑的製備:氮氣保護下,將銅鹽與P,N,N-配體按摩爾比1:0.1-10在反應介質中攪拌0.5-2小時製得手性銅催化劑;(2)手性炔丙基芳基醚類化合物的製備:將苯酚類化合物、炔丙基類化合物和鹼添加劑溶於反應介質中,然後將該溶液在氮氣保護下加入到上述攪拌好的手性銅催化劑的溶液中,-20℃攪拌反應1-12小時;反應完畢,減壓旋蒸,柱分離,得到手性炔丙基芳基醚類化合物;所述手性銅催化劑與炔丙基類化合物的摩爾比為0.001-1:1;所述鹼添加劑與炔丙基類化合物的摩爾比為0.5-10:1;所述苯酚類化合物與炔丙基類化合物的摩爾比為1-2:1。所述反應介質為甲醇、乙醇、甲苯、二甲苯、二氯甲烷、二氯乙烷、乙醚、四氫呋喃、乙酸乙酯中的至少一種,。所述手性3-苯氧基-3-苯基-1-丙炔類化合物具有以下結構之一:I和II互為對映異構體,式中:R1,R2為C1-C40的烷基、C3-C12的環烷基或帶有取代基的C3-C12環烷基、苯基及取代苯基、苄基及取代苄基、含一個或二個以上氧、硫、氮原子的五元或六元雜環芳香基團或酯基;C3-C12環烷基的取代基、苯基上取代基、或苄基的取代基分別為C1-C40烷基、C1-C40的烷氧基、滷素、硝基、酯基或氰基。所述苯酚類化合物具有以下結構:式中:R1為與上述結構式I、II中R1相同基團。所述炔丙基類化合物具有以下結構:式中:R2為與結構式上述I、II中R2相同基團;X為氟、氯、溴、碘、烷基羧酸酯、烷基碳酸酯、烷基磺酸酯、烷基磷酸酯,苯基及取代苯基羧酸酯、苯基及取代苯基碳酸酯、苯基及取代苯基磺酸酯或苯基及取代苯基磷酸酯。所述銅鹽為水合醋酸銅、水合硫酸銅、無水醋酸銅、無水硫酸銅、三氟甲磺酸酮、氯化銅、醋酸亞銅、氯化亞銅、碘化亞銅、高氯酸亞銅、三氟甲磺酸亞酮、Cu(CH3CN)4BF4、Cu(CH3CN)4ClO4中的至少一種。優選水合醋酸銅、三氟甲磺酸酮、Cu(CH3CN)4BF4、Cu(CH3CN)4ClO4中的至少一種。所述手性P,N,N-配體結構式為:式中:R3,R4為H、C1~C10內的烷基、C3~C8內的環烷基、苯基及取代苯基或苄基及取代苄基;R5,R6為H、滷素、烷基和環烷基、苯基及取代苯基、烷氧基、苯氧基,醯基或硝基;R7為烷基、環烷基、苯基及取代苯基、萘基及取代萘基或含一個或以上氧、硫、氮原子的五元或六元雜環芳香基團。所述鹼添加劑為各種無機鹼或有機鹼,優選N,N-二異丙基乙胺、三乙胺、DBU、K3PO4、K2CO3、Cs2CO3、Na2CO3或NaHCO3。所述步驟(2)催化反應條件優選為:溫度為-20℃;反應介質為甲醇;壓力為常壓;時間為12小時。所述手性銅催化劑與炔丙基類化合物的摩爾比優選為0.01-0.1:1;所述鹼添加劑與炔丙基類化合物的摩爾比優選為1.2:1;所述苯酚類化合物與炔丙基類化合物的摩爾比優選為1.2:1。本發明的反應方程式為:本發明具有以下優點:1、起始原料廉價易得。2、手性配體合成簡便,催化劑廉價易得,用量少。3、反應活性好、立體選擇性高。4、與傳統方法相比較,該方法可以更方便地合成各種取代的手性炔丙基芳基醚類化合物。附圖說明圖1為實施例1製備的(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1的核磁共振氫譜;圖2為實施例1製備的(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1的核磁共振碳譜;圖3為實施例8製備的(R)-3-苯氧基-3-苯基-1-丙炔Ⅰ-2的核磁共振氫譜;圖4為實施例8製備的(R)-3-苯氧基-3-苯基-1-丙炔Ⅰ-2的核磁共振碳譜;圖5為實施例9製備的(R)-3-對氯苯氧基-3-苯基-1-丙炔Ⅰ-3的核磁共振氫譜;圖6為實施例9製備的(R)-3-對氯苯氧基-3-苯基-1-丙炔Ⅰ-3的核磁共振碳譜;圖7為實施例10製備的(R)-3-對甲基苯氧基-3-苯基-1-丙炔Ⅰ-4的核磁共振氫譜;圖8為實施例10製備的(R)-3-對甲基苯氧基-3-苯基-1-丙炔Ⅰ-4的核磁共振碳譜;圖9為實施例11製備的產物(R)-3-對叔丁基苯氧基-3-苯基-1-丙炔Ⅰ-5的核磁共振氫譜;圖10為實施例11製備的產物(R)-3-對叔丁基苯氧基-3-苯基-1-丙炔Ⅰ-5的核磁共振碳譜;圖11為實施例12製備的(R)-3-鄰甲氧基苯氧基-3-苯基-1-丙炔Ⅰ-6的核磁共振氫譜;圖12為實施例12製備的(R)-3-鄰甲氧基苯氧基-3-苯基-1-丙炔Ⅰ-6的核磁共振碳譜;圖13為實施例13製備的(R)-3-對三氟甲基苯氧基-3-苯基-1-丙炔Ⅰ-7的核磁共振氫譜;圖14為實施例13製備的(R)-3-對三氟甲基苯氧基-3-苯基-1-丙炔Ⅰ-7的核磁共振碳譜;圖15為實施例14製備的產物(R)-3-對氟苯氧基-3-苯基-1-丙炔Ⅰ-8的核磁共振氫譜;圖16為實施例14製備的產物(R)-3-對氟苯氧基-3-苯基-1-丙炔Ⅰ-8的核磁共振碳譜;具體實施方式下面的實施例將對本發明予以進一步的說明,但並不因此而限制本發明。核磁共振是通過Bruker400M核磁共振儀測定,高效液相色譜(HPLC)是通過Agilent1100系列高效液相色譜測定。實施例1Cu(OAc)2·H2O和L-2-1作為催化劑催化反應,生成產物(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1。在反應瓶中加入Cu(OAc)2·H2O(0.015mmol,5mol%)及手性配體L-2-1(0.0165mmol,5.5mol%),氮氣保護下加入1.0毫升無水甲醇,室溫攪拌1小時。將炔丙醇酯Ⅳ-1(0.3mmol,1equiv),對甲氧基苯酚Ⅲ-1(0.36mmol,1.2equiv)和N,N-二異丙基乙胺(0.36mmol,1.2equiv)溶於2.0毫升無水甲醇,然後將該溶液在氮氣保護下加入到上述攪拌好的催化劑的溶液中,-20℃攪拌反應24h。反應完畢,減壓旋蒸至0.5毫升,矽膠柱分離(石油醚/乙酸乙酯=100:1),減壓濃縮,真空乾燥,得到化合物Ⅰ-1,淺黃色油狀物,77%收率,78%ee.(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1的核磁共振氫譜和核磁共振碳譜分別如圖1、圖2所示:1HNMR(400MHz,DMSO):δ7.59(d,J=7.3Hz,2H),7.45-7.38(m,3H),7.04(d,J=9.0Hz,2H),6.88(d,J=9.1Hz,2H),6.07(d,J=2.0Hz,1H),3.76(d,J=2.1Hz,1H),3.70(s,3H).13CNMR(101MHz,DMSO):δ154.6,151.2,138.4,129.1,129.0,127.8,117.9,114.9,82.2,79.5,70.1,55.8.HPLC(ChiralcelOD-H,n-hexane/i-PrOH=95/5,0.8ml/min,230nm,40℃):tR(major)=10.3min,tR(minor)=11.2min。Ⅲ-1,Ⅳ-1,Ⅰ-1,L-2-1的結構式如下:實施例2Cs2CO3作為鹼製備(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1。將實施例1中的鹼N,N-二異丙基乙胺用Cs2CO3代替,其餘同實施例1。反應得到化合物Ⅰ-1,87%收率,95%ee。實施例3K3PO4作為鹼製備(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1。將實施例1中的鹼N,N-二異丙基乙胺用K3PO4代替,其餘同實施例1。反應得到化合物Ⅰ-1,84%收率,88%ee。實施例4L-2-2作為配體製備(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1。將實施例2中的配體L-2-1用配體L-2-2代替,其餘同實施例2。反應得到化合物Ⅰ-1,85%收率,84%ee。L-2-2的結構式如下:實施例5L-2-3作為配體製備(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1。將實施例2中的配體L-2-1用配體L-2-3代替,其餘同實施例2。反應得到化合物Ⅰ-1,84%收率,88%ee。L-2-3的結構式如下:實施例6Cu(CF3SO3)2和L-2-1作為催化劑催化反應生成產物(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1。將實施例2中的Cu(OAc)2·H2O替換為Cu(CF3SO3)2。其餘同實施例2,得到化合物Ⅰ-1,80%收率,92%ee。實施例7Cu(CF3SO3)·1/2C6H6和L-2-1作為催化劑催化反應生成產物(R)-3-(4-甲氧基苯氧基)-3-苯基-1-丙炔Ⅰ-1。將實施例2中的Cu(OAc)2·H2O替換為Cu(CF3SO3)·1/2C6H6。其餘同實施例2,得到化合物Ⅰ-1,90%收率,95%ee。實施例8苯酚Ⅲ-2作為底物反應生成產物(R)-3-苯氧基-3-苯基-1-丙炔Ⅰ-2。將實施例7中的對甲氧基苯酚Ⅲ-1替換為苯酚Ⅲ-2,其餘同實施例7,得到化合物(R)-3-苯氧基-3-苯基-1-丙炔Ⅰ-2,88%收率,91%ee。(R)-3-苯氧基-3-苯基-1-丙炔Ⅰ-2的核磁共振氫譜和核磁共振碳譜分別如圖3、圖4所示:1HNMR(400MHz,CDCl3):δ7.60(d,J=7.4Hz,2H),7.42–7.35(m,3H),7.29(t,J=7.6Hz,2H),7.08(d,J=8.0Hz,2H),6.99(s,1H),5.82(s,1H),2.67(s,1H).13CNMR(101MHz,CDCl3):δ157.4,137.5,129.5,128.9,128.8,127.4,121.9,116.2,81.1,76.7,69.9.HPLC(ChiralcelOD-H,n-hexane/i-PrOH=98/2,0.8ml/min,230nm,40℃):tR(major)=12.1min,tR(minor)=14.2min.Ⅲ-2,Ⅰ-2的結構式如下:實施例9對氯苯酚Ⅲ-3作為底物反應生成產物(R)-3-對氯苯氧基-3-苯基-1-丙炔Ⅰ-3。將實施例7中的對甲氧基苯酚Ⅲ-1替換為對氯苯酚Ⅲ-3,其餘同實施例7,得到化合物(R)-3-對氯苯氧基-3-苯基-1-丙炔Ⅰ-3,84%收率,85%ee。產物(R)-3-對氯苯氧基-3-苯基-1-丙炔Ⅰ-3的核磁共振氫譜和核磁共振碳 譜分別如圖5、圖6所示:1HNMR(400MHz,CDCl3):δ7.58(d,J=6.7Hz,2H),7.40–7.38(m,3H),7.24(d,J=8.8Hz,2H),7.00(d,J=8.9Hz,2H),5.76(d,J=1.8Hz,1H),2.69(d,J=1.9Hz,1H).13CNMR(101MHz,CDCl3):δ155.9,137.0,129.4,129.1,128.8,127.3,126.9,117.7,80.6,77.1,70.3.HPLC(ChiralcelAS-H,n-hexane/i-PrOH=98/2,0.8ml/min,230nm,40℃):tR(minor)=11.1min,tR(major)=12.6min.Ⅲ-3,Ⅰ-3的結構式如下:實施例10對甲基苯酚Ⅲ-4作為底物反應生成產物(R)-3-對甲基苯氧基-3-苯基-1-丙炔Ⅰ-4。將實施例7中的對甲氧基苯酚Ⅲ-1替換為對甲基苯酚Ⅲ-4,其餘同實施例7,得到化合物(R)-3-對甲基苯氧基-3-苯基-1-丙炔Ⅰ-4,88%收率,94%ee。(R)-3-對甲基苯氧基-3-苯基-1-丙炔Ⅰ-4的核磁共振氫譜和核磁共振碳譜分別如圖7、圖8所示:1HNMR(400MHz,CDCl3):δ7.50(d,J=7.3Hz,2H),7.31-7.25(m,3H),6.99(d,J=8.0Hz,2H),6.89–6.87(m,2H),5.68(s,1H),2.56(s,1H),2.19(s,3H).13CNMR(101MHz,CDCl3):δ155.3,137.7,131.3,123.0,128.9,128.8,127.4,116.8,81.3,76.6,70.2,20.6.HPLC(ChiralcelOD-H,n-hexane/i-PrOH=98/2,0.8ml/min,230nm,40℃):tR(major)=7.2min,tR(minor)=8.0min.Ⅲ-4,Ⅰ-4的結構式如下:實施例11對叔丁基基苯酚Ⅲ-5作為底物反應生成產物(R)-3-對叔丁基苯氧基-3-苯基-1-丙炔Ⅰ-5。將實施例7中的對甲氧基苯酚Ⅲ-1替換為對叔丁基苯酚Ⅲ-4,其餘同實施例7,得到化合物(R)-3-對叔丁基苯氧基-3-苯基-1-丙炔Ⅰ-5,87%收率,93%ee。產物(R)-3-對叔丁基苯氧基-3-苯基-1-丙炔Ⅰ-5的核磁共振氫譜和核磁共振碳譜分別如圖9、圖10所示:1HNMR(400MHz,CDCl3):δ7.52(d,J=7.0Hz,2H),7.31–7.22(m, 5H),6.94(d,J=8.8Hz,2H),5.70(d,J=1.8Hz,1H),2.58(d,J=2.1Hz,1H),1.21(s,9H).13CNMR(101MHz,CDCl3):δ155.3,144.5,137.7,128.8,128.8,127.3,126.3,115.6,81.3,76.6,69.9,34.2,31.6.HPLC(ChiralcelOD-H,n-hexane/i-PrOH=99.55/0.5,0.8ml/min,230nm,40℃):tR(major)=29.3min,tR(minor)=34.4min.Ⅲ-5,Ⅰ-5的結構式如下:實施例12鄰甲氧基苯酚Ⅲ-6作為底物反應生成產物(R)-3-鄰甲氧基苯氧基-3-苯基-1-丙炔Ⅰ-6。將實施例7中的對甲氧基苯酚Ⅲ-1替換為鄰甲氧基苯酚Ⅲ-6,其餘同實施例7,得到化合物(R)-3-鄰甲氧基苯氧基-3-苯基-1-丙炔Ⅰ-6,83%收率,94%ee。(R)-3-鄰甲氧基苯氧基-3-苯基-1-丙炔Ⅰ-6的核磁共振氫譜和核磁共振碳譜為分別如圖11、圖12所示:1HNMR(400MHz,CDCl3):δ7.67–7.65(m,2H),7.41–7.34(m,3H),7.13–7.11(m,1H),7.02(t,J=7.8Hz,1H),6.92–6.86(m,2H),5.89(s,1H),3.84(s,3H),2.66(s,1H).13CNMR(101MHz,CDCl3):δ151.10,146.4,137.7,128.8,128.6,127.5,123.5,120.7,119.2,112.3,81.2,76.7,71.6,55.9.HPLC(ChiralcelOJ-H,n-hexane/i-PrOH=95/5,0.8ml/min,230nm,40℃):tR(major)=11.6min,tR(minor)=15.1min.Ⅲ-6,Ⅰ-6的結構式如下:實施例13對三氟甲基苯酚Ⅲ-7作為底物反應生成產物(R)-3-對三氟甲基苯氧基-3-苯基-1-丙炔Ⅰ-7。將實施例7中的對甲氧基苯酚Ⅲ-1替換為對三氟甲基苯酚Ⅲ-7,其餘同實施例7,得到化合物(R)-3-對三氟甲基苯氧基-3-苯基-1-丙炔Ⅰ-7,85%收率,83%ee。(R)-3-對三氟甲基苯氧基-3-苯基-1-丙炔Ⅰ-7的核磁共振氫譜和核磁共振碳譜為分別如圖13、圖14所示:1HNMR(400MHz,CDCl3):δ7.59(d,J=6.8Hz,2H),7.43–7.37(m,3H),7.15(d,J=8.8Hz,2H),7.07(d,J=9.1Hz,2H),5.78(d,J= 1.7Hz,1H),2.70(d,J=2.1Hz,1H).13CNMR(101MHz,CDCl3):δ155.8,143.6(d,J=1.9Hz),137.0,129.1,128.8,127.3,122.4,120.6(d,J=256.4Hz),117.1,80.5,77.1,70.4.HPLC(ChiralcelAS-H,n-hexane/i-PrOH=99/1,0.8ml/min,230nm,40℃):tR(major)=6.5min,tR(minor)=7.7min.Ⅲ-7,Ⅰ-7的結構式如下:實施例14對氟苯酚Ⅲ-8作為底物反應生成產物(R)-3-對氟苯氧基-3-苯基-1-丙炔Ⅰ-8。將實施例7中的對甲氧基苯酚Ⅲ-1替換為對氟苯酚Ⅲ-8,其餘同實施例7,得到化合物(R)-3-對氟苯氧基-3-苯基-1-丙炔Ⅰ-8,87%收率,88%ee。產物(R)-3-對氟苯氧基-3-苯基-1-丙炔Ⅰ-8的核磁共振氫譜和核磁共振碳譜為分別如圖15、圖16所示:1HNMR(400MHz,CDCl3):δ7.51(d,J=6.9Hz,2H),7.32–7.30(m,3H),6.9–6.89(m,4H),5.66(d,J=1.8Hz,1H),2.60(d,J=2.1Hz,1H).13CNMR(101MHz,CDCl3):δ159.0,156.8,153.4(d,J=2.2Hz),137.2,127.4,127.4,117.8(d,J=8.0Hz),115.9(d,J=23.1Hz),80.87,76.9,70.9.HPLC(ChiralcelAS-H,n-hexane/i-PrOH=99/1,0.6ml/min,230nm,40℃):tR(major)=13.0min,tR(minor)=14.3min.Ⅲ-8,Ⅰ-8的結構式如下:實施例15-25反應底物適用性本發明具有廣泛的底物適用性,按照實施例2中的反應條件,許多底物都能參與該反應,高收率、高立體選擇性地獲得手性3-苯氧基-3-苯基-1-丙炔類化合物,其反應式為:實施例裡15~25中,當R1和R2分別被替換,其產率和對映體過量值如表1所示。表1實施例R1R2產率(%)對映體過量(%)7p-MeOPhH909515p-BrPhH859016p-CNPhH899117p-OHPhH849318m-MeOPhH879519p-MeOPhp-Br828920p-MeOPhp-Cl878821p-MeOPhp-F899022p-MeOPhp-CF3888923p-MeOPhp-OCH3899524p-MeOPhp-CH3929325p-MeOPh2-naphthyl8891本發明可以方便地合成各種帶取代基團的手性炔丙基芳基醚類化合物,其對映體過量百分數高達95%。本發明具有操作簡單、原料易得、底物適用範圍廣、對映選擇性高等特點。當前第1頁1 2 3 
