用於鑑定克羅諾桿菌屬各個「種」的引物對組、探針、試劑盒及方法與流程
2024-03-30 15:41:05 1
本發明涉及食品微生物檢測技術領域,特別是一種涉及用於鑑定克羅諾桿菌屬各個「種」的引物對組、探針、試劑盒及方法。
背景技術:
克羅諾桿菌(cronobacterspp.)原名為阪崎腸桿菌,可以通過汙染嬰幼兒奶粉而引起新生兒腦膜炎、壞死性小腸結腸炎和敗血症等,嚴重可導致死亡或預後留有神經系統後遺症、發育障礙。雖然早在1958年就有感染病例,但一直被誤認為是陰溝腸桿菌,直到1980年才被正式命名為阪崎腸桿菌。2008年,艾弗森(iversen)等人將原來的阪崎腸桿菌,大腸桿菌科裡的一個「種」,重新劃分為一個「屬」,並命名為克羅諾桿菌屬。到目前為止,研究報導「屬」內一共分有7個「種」,分別為阪崎克羅諾桿菌(c.sakazakii)、丙二酸鹽陽性克羅諾桿菌(c.malonaticus)、穆汀斯克羅諾桿菌(c.muytjensii)、都柏林克羅諾桿菌(c.dublinensis)、蘇黎世克羅諾桿菌(c.turicensis)、尤尼沃斯克羅諾桿菌(c.universalis)和康帝蒙提克羅諾桿菌(c.condimenti),其中,常見的為前五種。
2011年克魯茲(cruz)等人將不同「種」克羅諾桿菌的菌株進行了細胞粘附和侵襲實驗,發現不同「種」克羅諾桿菌的菌株表現的細胞毒性有差異;再者,分子流行病學研究結果也表明不同「種」克羅諾桿菌的不同基因型(sequencetypes,sts)的菌株可能具有不同的致病力,例如st4的阪崎克羅諾桿菌(c.sakazakii)是引起新生兒腦膜腦炎主要型別。因此,在「屬」水平對各個「種」進行區分並鑑定在目前克羅諾桿菌研究中尤為重要。
傳統的分種方法依賴於生理生化和形態學特點,但是這種方法操作繁瑣、耗時長、不易分辨結果,而且存在一定假陽性情況,所以逐漸被淘汰。隨著分子生物學技術的成熟發展,分子檢測的方法被廣泛應用。
2009年stoop等利用普通pcr方法進行了克羅諾桿菌屬內各個「種」的鑑定,該方法選用rpob基因作為目標檢測基因,然而由於阪崎克羅諾桿菌(c.sakazakii)和丙二酸鹽陽性克羅諾桿菌(c.malonaticus)的rpob基因具有高同源性,因此還需要再設計一對引物才能將兩者區別。huangch等利用dna促旋酶b亞基基因設計引物,建立了一種只能用於區別阪崎克羅諾桿菌(c.sakazakii)和都柏林克羅諾桿菌(c.dublinensis)的普通pcr檢測方法。caixianquan等利用外膜蛋白基因ompa基因建立了針對克羅諾桿菌屬的螢光定量pcr方法,在螢光定量pcr反應結束後對pcr產物進行高解析度溶解曲線的生成,根據溶解曲線的差異從而將克羅諾桿菌屬內不同「種」的菌株區別。stephan等利用基質輔助雷射解吸電離飛行時間質譜(maldi-tof)質譜鑑定方法將克羅諾桿菌屬菌株鑑定到「種」的水平,還有多位點序列分型(mlst)通過測序並將將序列進行分析後,也可以鑑定各個「種」。
但是上述方法或流程比較多,成本比較高,或者缺乏直觀判定性,或鑑定周期長,因此均未能得到廣泛的應用。
技術實現要素:
基於此,有必要針對鑑定成本高、流程繁瑣、無法直觀判定克羅諾桿菌屬各個「種」的方法,提供一種用於鑑定克羅諾桿菌屬各個「種」的引物對組、探針、試劑盒及方法。
本發明提供的一種用於鑑定克羅諾桿菌屬各個「種」的引物對組,所述克羅諾桿菌屬各個「種」包括阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌以及蘇黎世克羅諾桿菌中的任意一種,其中,所述用於鑑定克羅諾桿菌屬各個「種」的引物對組包括第一引物對、第二引物對以及第三引物對;
所述第一引物對的序列分別如seqidno.s1和2所示;
所述第二引物對的序列分別如seqidno.s3和4所示;
所述第三引物對的序列分別如seqidno.s5和6所示。
本發明提供的一種用於鑑定克羅諾桿菌屬各個「種」的探針,所述克羅諾桿菌屬各個「種」包括阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌以及蘇黎世克羅諾桿菌中的任意一種,其中,所述用於鑑定克羅諾桿菌屬各個「種」的探針包括第一探針、第二探針以及第三探針;
所述第一探針的序列如seqidno.s7所示;
所述第二探針的序列如seqidno.s8所示;
所述第三探針的序列如seqidno.s9所示。
本發明提供的一種用於鑑定克羅諾桿菌屬各個「種」的試劑盒,所述克羅諾桿菌屬各個「種」包括阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌以及蘇黎世克羅諾桿菌中的任意一種,其中,所述用於鑑定克羅諾桿菌屬各個「種」的試劑盒包括用於鑑定克羅諾桿菌屬各個「種」的引物對組以及用於鑑定克羅諾桿菌屬各個「種」的探針;
所述用於鑑定克羅諾桿菌屬各個「種」的引物對組包括第一引物對、第二引物對以及第三引物對;
所述第一引物對的序列分別如seqidno.s1和2所示;
所述第二引物對的序列分別如seqidno.s3和4所示;
所述第三引物對的序列分別如seqidno.s5和6所示;
所述用於鑑定克羅諾桿菌屬各個「種」的探針包括第一探針、第二探針以及第三探針;
所述第一探針的序列如seqidno.s7所示;
所述第二探針的序列如seqidno.s8所示;
所述第三探針的序列如seqidno.s9所示。
在其中一個實施例中,所述第一引物對、所述第二引物對、所述第三引物對在工作液中的濃度分別為10±1μmol/l,所述第一探針、所述第二探針、所述第三探針的工作液探針濃度分別為10±1μmol/l。
在其中一個實施例中,還包括10×premixextaq緩衝液以及roxii矯正染料。
在其中一個實施例中,還包括分別由所述第一引物對、所述第二引物對以及所述第三引物對擴增片段並放入載體質粒得到的第一標準品、第二標準品、第三標準品。
本發明提供的一種用於鑑定克羅諾桿菌屬各個「種」的方法,所述克羅諾桿菌屬各個「種」包括阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌以及蘇黎世克羅諾桿菌中的任意一種,其中,包括以下步驟:
(1)提取待測樣品的基因組dna;
(2)以步驟(1)的基因組dna為反應體系的模板,以序列如seqidno.s1和2所示的第一引物對、以序列如seqidno.s3和4所示的第二引物對、以序列如seqidno.s5和6所示的第三引物對為反應體系的引物,以序列如seqidno.s7所示的第一探針、以序列如seqidno.s8所示的第二探針、以序列如seqidno.s9所示的第三探針為反應體系的探針進行擴增反應;
(3)結合待測樣品擴增曲線判定鑑定結果。
在其中一個實施例中,還包括以下步驟:
(1』)分別配製梯度濃度的第一標準品溶液、第二標準品溶液、第三標準品溶液,其中,所述第一標準品、所述第二標準品、所述第三標準品分別由所述第一引物對、所述第二引物對以及所述第三引物對擴增片段並放入載體質粒得到的;
(2』)分別以梯度濃度的所述第一標準品溶液、所述第二標準品溶液、所述第三標準品溶液為反應體系的模板,以序列如seqidno.s1和2所示的第一引物對、以序列如seqidno.s3和4所示的第二引物對、以序列如seqidno.s5和6所示的第三引物對為反應體系的引物,以序列如seqidno.s7所示的第一探針、以序列如seqidno.s8所示的第二探針、以序列如seqidno.s9所示的第三探針為反應體系的探針進行擴增反應;
(3』)結合所述第一標準品、所述第二標準品、所述第三標準品標準品的擴增曲線分別繪製第一標準品曲線、第二標準品曲線以及第三標準品曲線;
(4)根據待測樣品擴增曲線、第一標準品曲線、第二標準品曲線以及第三標準品曲線對待測樣品進行定量分析。
在其中一個實施例中,所述擴增反應的程序包括:
在95℃下2min,1個循環;
在95℃下15s,40個循環;
在60℃下30s,40個循環。
在其中一個實施例中,所述反應體系總體積為20μl,所述反應體系包括:
10×premixextaq緩衝液10μl;
roxii矯正染料0.4μl;
模板2μl;
所述序列如seqidno.s1所示的引物0.3μl至1μl;
所述序列如seqidno.s2所示的引物0.3μl至1μl;
所述序列如seqidno.s3所示的引物0.3μl至1μl;
所述序列如seqidno.s4所示的引物0.3μl至1μl;
所述序列如seqidno.s5所示的引物0.3μl至1μl;
所述序列如seqidno.s6所示的引物0.3μl至1μl;
所述序列如seqidno.s7所示的探針0.3μl至1μl;
所述序列如seqidno.s8所示的探針0.3μl至1μl;
所述序列如seqidno.s9所示的探針0.3μl至1μl;
水餘量。
上述用於鑑定克羅諾桿菌屬各個「種」的引物對組和探針,針對克羅諾桿菌屬各個「種」中的阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌以及蘇黎世克羅諾桿菌基因序列特徵進行特異性設計,能夠一次性區分鑑定出阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌以及蘇黎世克羅諾桿菌中的任意一種,檢測靈敏度高,可確保結果的準確性,鑑定快速、成本低,能夠進行廣泛的應用。
上述用於鑑定克羅諾桿菌屬各個「種」的試劑盒,利用上述用於鑑定克羅諾桿菌屬各個「種」的引物對和探針,能夠一次性區分鑑定出阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌以及蘇黎世克羅諾桿菌中的任意一種,檢測靈敏度高,可確保結果的準確性,鑑定快速、成本低,能夠進行廣泛的應用。
上述用於鑑定克羅諾桿菌屬各個「種」的方法,利用上述用於鑑定克羅諾桿菌屬各個「種」的引物對和探針,能夠一次性區分鑑定出阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌以及蘇黎世克羅諾桿菌中的任意一種,檢測靈敏度高,可確保結果的準確性,鑑定快速、成本低,能夠進行廣泛的應用。
附圖說明
為了更清楚地說明本申請實施例或現有技術中的技術方案,下面將對實施例中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖僅僅是本發明中記載的一些實施例,對於本領域普通技術人員來講,還可以根據這些附圖獲得其他的附圖。
圖1為本發明實施例1待測樣品的擴增曲線圖;
圖2為本發明實施例1待測樣品基於第一探針的擴增曲線圖;
圖3為本發明實施例1待測樣品基於第二探針的擴增曲線圖;
圖4為本發明實施例1待測樣品基於第三探針的擴增曲線圖;
圖5為本發明實施例6待測樣品基於第一探針的擴增曲線圖;
圖6為本發明實施例6待測樣品基於第二探針的擴增曲線圖;
圖7為本發明實施例6待測樣品基於第三探針的擴增曲線圖;
圖8為本發明第一標準曲線圖;
圖9為本發明第二標準曲線圖;
圖10為本發明第三標準曲線圖。
具體實施方式
為了使本發明的目的、技術方案及優點更加清楚明白,以下通過實施例,並結合附圖,對本發明的用於鑑定克羅諾桿菌屬各個「種」的引物對組、探針、試劑盒及方法進行進一步詳細說明。應當理解,此處所描述的具體實施例僅用以解釋本發明,並不用於限定本發明。
本發明提供了用於鑑定克羅諾桿菌屬各個「種」的引物對組和探針,利用該引物對組和探針能夠一次性鑑定克羅諾桿菌屬中包括阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌和蘇黎世克羅諾桿菌在內的五個具體的菌種。
上述引物對組包括第一引物對、第二引物對和第三引物對,上述探針包括第一探針、第二探針和第三探針。
參考美國國家生物技術信息中心dna序列資料庫克羅諾桿菌16srrna基因序列,將阪崎克羅諾桿菌和丙二酸鹽陽性克羅諾桿菌與其他「種」相比,找到核苷酸序列鹼基缺失的目標位點,設計第一探針和第一引物對,其中將第一探針5』端用hex螢光標記,名稱記為csm-ctd-p,第一引物對的上下遊引物名稱分別記為csm-ctd-f和csm-ctd-r。
參考美國國家生物技術信息中心dna序列資料庫克羅諾桿菌fusa基因序列,找到阪崎克羅諾桿菌與丙二酸鹽陽性克羅諾桿菌鹼基不同的位點,設計第二探針和第二引物對,其中,將第二探針5』端用fam螢光標記,名稱記為cs-cma-p,第一引物對的上下遊引物名稱分別記為cs-cma-f和cs-cma-r。
同樣參考美國國家生物技術信息中心dna序列資料庫克羅諾桿菌fusa基因序列,找到穆汀斯克羅諾桿菌和都柏林克羅諾桿菌鹼基不同的位點,設計第三探針和第三引物對,其中,將第三探針5』端用cy5螢光標記,名稱記為cmu-cd-p,第三引物對的上下遊引物名稱分別記為cmu-cd-f和cmu-cd-r。
具體地,第一引物對、第一探針,第二引物對、第二探針,第三引物對、第三探針的序列如表1所示。
表1引物對及探針序列
其中,產物長度指的是有分別由第一引物對、第二引物對、第三引物對擴增後的產物長度。
本發明提供了一種用於鑑定克羅諾桿菌屬各個「種」的試劑盒,能夠一次性鑑定克羅諾桿菌屬中包括阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌和蘇黎世克羅諾桿菌在內的5個具體的菌種。
作為一種可選實施方式,該用於鑑定克羅諾桿菌屬各個「種」的試劑盒包括用於鑑定克羅諾桿菌屬各個「種」的引物對組和用於鑑定克羅諾桿菌屬各個「種」的探針。其中,用於鑑定克羅諾桿菌屬各個「種」的引物對組包括上述第一引物對、第二引物對和第三引物對,用於鑑定克羅諾桿菌屬各個「種」的探針包括上述第一探針、第二探針和第三探針。
可選地,上述第一引物對、第二引物對、第三引物對工作液中引物濃度分別為10±1μmol/l。即csm-ctd-f工作液中csm-ctd-f的濃度為10±1μmol/l,csm-ctd-r工作液中csm-ctd-r的濃度為10±1μmol/l,cs-cma-f工作液中cs-cma-f的濃度為10±1μmol/l,cs-cma-r工作液中cs-cma-r的濃度為10±1μmol/l,cmu-cd-f工作液中cmu-cd-f的濃度為10±1μmol/l,cmu-cd-r工作液中cmu-cd-r的濃度為10±1μmol/l。
可選地,上述第一探針、第二探針、第三探針工作液中探針濃度分別為10±1μmol/l。即csm-ctd-p工作液中csm-ctd-p的濃度為10±1μmol/l,cs-cma-p工作液中cs-cma-p的濃度為10±1μmol/l,cmu-cd-p工作液中cmu-cd-p的濃度為10±1μmol/l。
作為一種可選實施方式,上述用於鑑定克羅諾桿菌屬各個「種」的試劑盒還包括10×premixextaq緩衝液以及roxii矯正染料。
作為一種可選實施方式,上述用於鑑定克羅諾桿菌屬各個「種」的試劑盒還包括分別由第一引物對、第二引物對以及第三引物對擴增得到的第一標準品、第二標準品以及第三標準品。
可選地,上述第一標準品、第二標準品以及第三標準品的製備方法如下:
第一步,普通pcr分別對引物對擴增得到目的基因,其中引物對指上述第一引物對、第二引物對以及第三引物對中的任意一種。
第二步,跑電泳回收上述目標基因(qiagen膠回收試劑盒)。
第三步,將目的基因連接到載體上,pmd19-tvector2ul,insertdna8ul,總量為10μl。加入10μl(等量)的solutioni(冰中溶解),16℃反應2h,製得重組質粒。
第四步,將第三步中的重組質粒導入感受態細胞(-80℃)。takarae.colijm109competentcells使用前在冰上融化。輕微混合,將100μl細胞移入1.5ml離心管。第三步中全量(20μl)加入至100μljm109感受態細胞中,冰中放置30分鐘,42℃放置90秒,冰中放置1-2分鐘,添加soc培養基(預先在37℃保溫)至終體積1ml,37℃振蕩培養1小時(160-225rpm)。取適量培養液塗於藍白篩選培養基(平板使用前需在37℃預熱30分鐘,翻轉避光培養)。
第五步,37℃過夜培養,藍白色菌落篩選(添加x-gal,iptg,amp),製得克隆目的片段。進一步地,普通pcr方法驗證克隆目的片段的大小,當測序結果與目的基因序列比對一致後,確認製得對應的模板標準品。本發明提供了一種用於鑑定克羅諾桿菌屬各個「種」的方法,能夠一次性鑑定克羅諾桿菌屬中包括阪崎克羅諾桿菌、丙二酸鹽陽性克羅諾桿菌、穆汀斯克羅諾桿菌、都柏林克羅諾桿菌和蘇黎世克羅諾桿菌在內的五個具體的菌種。
具體地,上述用於鑑定克羅諾桿菌屬各個「種」的方法包括以下步驟:
(1)提取待測樣品的基因組dna;
(2)以步驟(1)的基因組dna為反應體系的模板,以上述第一引物對、第二引物對、第三引物對為反應體系的引物,以上述第一探針、第二探針、第三探針為反應體系的探針進行擴增反應;
(3)結合待測樣品擴增曲線圖判定鑑定結果。
進一步地,擴增反應為聚合酶鏈式反應(pcr)。
可選地,步驟(3)中結合待測樣品擴增曲線圖判定鑑定結果的方法如下:
將待測樣品基於不同探針的測定ct值與預設ct值進行比較,當測定ct值>預設測定ct值時判定為陰性,當測定ct值≤預設ct值時判定為陽性。可選的,預設ct值為35。
將判定結果與表2比對,從而可以鑑定待測樣品中的克羅諾桿菌屬的具體的「種」。
表2克羅諾桿菌屬各個「種」對探針的反應結果
其中,「+」代表陽性,即測定ct值≤預設測定ct值,「-」代表陰性,即測定ct值>預設測定ct值。
該方法能夠直觀地鑑定待測樣品中克羅諾桿菌屬內具體的種,檢測快速、準確、直觀、廉價。
作為一種可選實施方式,上述用於鑑定克羅諾桿菌屬各個「種」的方法還包括以下步驟:
(1』)分別配製梯度濃度的第一標準品溶液、第二標準品溶液、第三標準品溶液;
(2』)分別以梯度濃度的第一標準品溶液、第二標準品溶液、第三標準品溶液為反應體系的模板,以上述第一引物對、第二引物對、第三引物對為反應體系的引物,以上述第一探針、第二探針、第三探針為反應體系的探針進行擴增反應;
(3』)結合第一標準品、第二標準品、第三標準品的擴增曲線分別繪製第一標準曲線、第二標準曲線以及第三標準曲線;
(4)根據待測樣品擴增曲線、第一標準曲線、第二標準曲線以及第三標準曲線對待測樣品進行定量分析。
可選地,根據標準曲線換算成拷貝數,計算測待測樣品濃度其中拷貝數的換算公式如下:
拷貝數(copies/ul)=(6.02x1023)x(g/ulx10-9)/(質粒長度x660)
待測樣品通過螢光定量pcr方法擴增後可獲得ct值,在標準曲線上找到對應的ct值並通過上述換算公式換算為核酸的拷貝數,然後再計算其真實質量。進一步地,通過引入第一標準品、第二標準品、第三標準品並繪製標準曲線,能夠對待測樣品中克羅諾桿菌屬各個「種」進行定量分析,提高該方法的應用價值。
作為一種可選實施方式,上述擴增反應程序包括:
在95℃下2min,1個循環;
在95℃下15s,40個循環;
在60℃下30s,40個循環。
作為一種可選實施方式,所述反應體系總體積為20μl,反應體系包括:
實施例1
敏感性檢測試驗,待測樣品為阪崎克羅諾桿菌(atcc29544)純菌。
(1)提取待測樣品的基因組dna。
將阪崎克羅諾桿菌純菌在lb液體培養基中過夜培養,調菌液od值至1.0,10倍梯度稀釋製備101-107cfu/ml的菌液各1ml,用核酸提取試劑盒提取基因組dna,製得梯度濃度的待測樣品基因組dna。
(2)取10×premixextaq緩衝液10μl,取csm-ctd-f工作液、csm-ctd-r工作液、cs-cma-f工作液、cs-cma-r工作液、cmu-cd-f工作液、cmu-cd-r工作液、csm-ctd-p工作液、cs-cma-p工作液、cmu-cd-p工作液各0.5μl,roxii矯正染料0.4μl,分別取101-107cfu/ml的菌液提取的基因組dna2μl,純水補充至20μl,製得總體積為20μl的反應體系,利用abi7500-fast螢光定量pcr儀進行擴增。
擴增反應程序如下:
在95℃下2min,1個循環;
在95℃下15s,40個循環;
在60℃下30s,40個循環。
(3)結合擴增曲線圖判定鑑定結果。
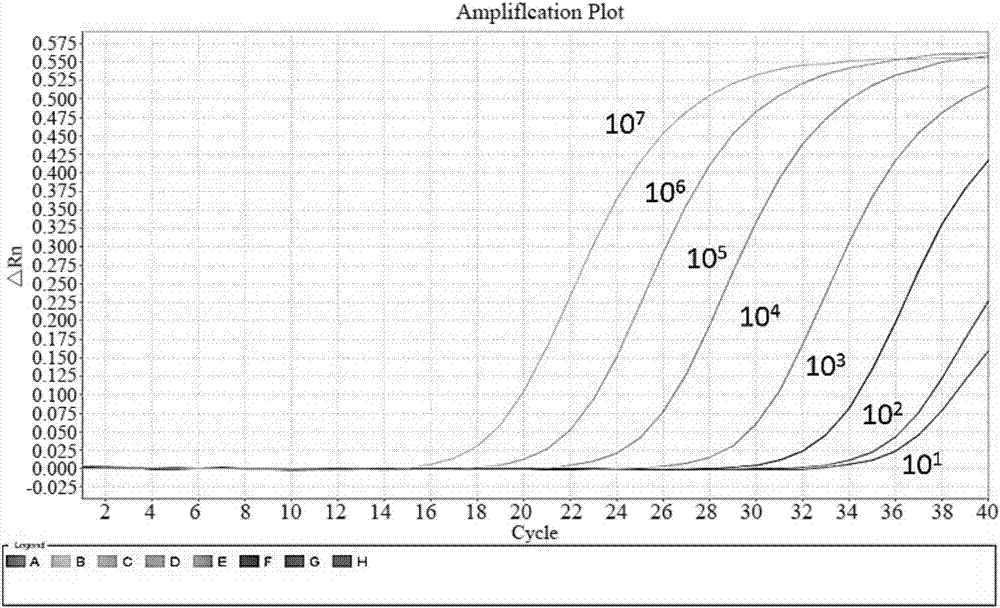
請參閱圖1所示,為實施例1的待測樣品-阪崎克羅諾桿菌純菌的擴增曲線圖,將阪崎克羅諾桿菌純菌基於第一探針、第二探針、第三探針的測定ct值與預設ct值進行比較,當測定ct值≤預設測定ct值時判定為陽性,當測定ct值>預設ct值時判定為陰性。本實施例中,預設ct值為35。
本實施例的待測樣品基於第一探針、第二探針、第三探針的判定結果均為陽性,結合表2可知,鑑定結果確認待測樣品為阪崎克羅諾桿菌。
請參閱圖2至圖4所示,分別為實施例1不同梯度濃度待測樣品-阪崎克羅諾桿菌純菌對第一探針、第二探針、第三探針的擴增曲線圖。
基於圖2至圖4所示的擴增曲線圖,顯示第一探針、第二探針、第三探針對阪崎克羅諾桿菌檢測下限均為102cfu/ml。
實施例2
採用與實施例1相同的方法檢測待測樣品-丙二酸鹽陽性克羅諾桿菌純菌,將丙二酸鹽陽性克羅諾桿菌純菌基於第一探針、第二探針、第三探針的測定ct值與預設ct值比較,判定結果分別為陽性、陰性、陽性,結合表2可知,鑑定結果確認待測樣品為丙二酸鹽陽性克羅諾桿菌。
實施例2不同梯度濃度待測樣品-丙二酸鹽陽性克羅諾桿菌純菌基於第一探針、第二探針、第三探針的擴增曲線圖,顯示第一探針、第二探針、第三探針對丙二酸鹽陽性克羅諾桿菌檢測下限均為102cfu/ml。
實施例3
採用與實施例1相同的方法檢測待測樣品-穆汀斯克羅諾桿菌純菌,將穆汀斯克羅諾桿菌純菌基於第一探針、第二探針、第三探針的測定ct值與預設ct值比較,判定結果分別為陰性、陰性、陽性,結合表2可知,鑑定結果確認待測樣品為穆汀斯克羅諾桿菌。
實施例3不同梯度濃度待測樣品-穆汀斯克羅諾桿菌純菌基於第一探針、第二探針、第三探針的擴增曲線圖,顯示第一探針、第二探針、第三探針對穆汀斯克羅諾桿菌檢測下限均為102cfu/ml。
實施例4
採用與實施例1相同的方法檢測待測樣品-都柏林克羅諾桿菌純菌,將都柏林克羅諾桿菌純菌基於第一探針、第二探針、第三探針的測定ct值與預設ct值比較,判定結果分別為陰性、陰性、陰性,結合表2可知,鑑定結果確認待測樣品為都柏林克羅諾桿菌。
實施例4不同梯度濃度待測樣品-都柏林克羅諾桿菌純菌基於第一探針、第二探針、第三探針的擴增曲線圖,顯示第一探針、第二探針、第三探針對都柏林克羅諾桿菌檢測下限均為102cfu/ml。
實施例5
採用與實施例1相同的方法檢測待測樣品-蘇黎世克羅諾桿菌純菌,將蘇黎世克羅諾桿菌純菌基於第一探針、第二探針、第三探針的測定ct值與預設ct值比較,判定結果分別為陰性、陰性、陰性,結合表2可知,鑑定結果確認待測樣品為蘇黎世克羅諾桿菌。
實施例5不同梯度濃度待測樣品-蘇黎世克羅諾桿菌純菌基於第一探針、第二探針、第三探針的擴增曲線圖,顯示第一探針、第二探針、第三探針對蘇黎世克羅諾桿菌檢測下限均為102cfu/ml。
實施例6
敏感性檢測試驗,待測樣品為阪崎克羅諾桿菌模擬汙染奶粉。
(1)提取待測樣品的基因組dna。
取2g嬰兒配方奶粉溶於18ml滅菌生理鹽水中,配成1:10的稀釋液。分別吸取濃度為101-107cfu/ml的阪崎克羅諾桿菌(atcc29544)純菌菌懸液1ml,加至9ml奶粉溶液中,充分混勻,製成阪崎克羅諾桿菌模擬汙染奶粉溶液。
分別取10ml上述阪崎克羅諾桿菌模擬汙染奶粉溶液以12000rpm離心1min,棄去上清,用1ml無菌水溶解菌體沉澱。此溶解液作為待測樣品的初始液。向溶解液中分別加1ml無水乙醇,1ml氨水,1ml石油醚,混勻。混合物以12000rpm離心10min。棄去上清液,剩餘的沉澱分別用1mlte(ph7.8)溶解,將其轉移到1.5ml離心管,用核酸提取試劑盒提取dna,製得梯度濃度的待測樣品基因組dna。
(2)取10×premixextaq緩衝液10μl,取csm-ctd-f工作液、csm-ctd-r工作液、cs-cma-f工作液、cs-cma-r工作液、cmu-cd-f工作液、cmu-cd-r工作液、csm-ctd-p工作液、cs-cma-p工作液、cmu-cd-p工作液各0.5μl,roxii矯正染料0.4μl,分別取101-107cfu/ml的阪崎克羅諾桿菌模擬汙染奶粉提取的待測樣品基因組dna2μl,純水補充至20μl,製得總體積為20μl的反應體系,利用abi7500-fast螢光定量pcr儀進行擴增。
擴增反應程序如下:
在95℃下2min,1個循環;
在95℃下15s,40個循環;
在60℃下30s,40個循環。
(3)結合擴增曲線圖判定實驗結果。
將阪崎克羅諾桿菌模擬汙染奶粉溶液基於第一探針、第二探針、第三探針的測定ct值與預設ct值進行比較,當測定ct值≤預設測定ct值時判定為陽性,當測定ct值>預設ct值35時判定為陰性。本實施例中,預設ct值為35。
本實施例的阪崎克羅諾桿菌模擬汙染奶粉基於第一探針、第二探針、第三探針的判定結果均為陽性,結合表2可知,鑑定結果確認待測樣品中含有阪崎克羅諾桿菌。
請參閱圖8至圖10所示,分別為實施例6不同梯度濃度阪崎克羅諾桿菌模擬汙染奶粉對第一探針、第二探針、第三探針的擴增曲線圖。
基於圖8至圖10所示的擴增曲線圖,顯示第一探針、第二探針、第三探針對阪崎克羅諾桿菌模擬汙染奶粉檢測下限均為103cfu/ml。
實施例7
採用與實施例6相同的方法檢測待測樣品-丙二酸鹽陽性克羅諾桿菌模擬汙染奶粉,將丙二酸鹽陽性克羅諾桿菌模擬汙染奶粉基於第一探針、第二探針、第三探針的測定ct值與預設ct值比較,判定結果分別為陽性、陰性、陽性,結合表2可知,鑑定結果確認待測樣品含有丙二酸鹽陽性克羅諾桿菌。
實施例7不同梯度濃度待測樣品-丙二酸鹽陽性克羅諾桿菌模擬汙染奶粉基於第一探針、第二探針、第三探針的擴增曲線圖,顯示第一探針、第二探針、第三探針對丙二酸鹽陽性克羅諾桿菌模擬汙染奶粉檢測下限均為103cfu/ml。
實施例8
採用與實施例6相同的方法檢測待測樣品-穆汀斯克羅諾桿菌模擬汙染奶粉,將穆汀斯克羅諾桿菌模擬汙染奶粉基於第一探針、第二探針、第三探針的測定ct值與預設ct值比較,判定結果分別為陰性、陰性、陽性,結合表2可知,鑑定結果確認待測樣品中含有穆汀斯克羅諾桿菌桿菌。
實施例8不同梯度濃度待測樣品-穆汀斯克羅諾桿菌模擬汙染奶粉基於第一探針、第二探針、第三探針的擴增曲線圖,顯示第一探針、第二探針、第三探針對穆汀斯克羅諾桿菌模擬汙染奶粉檢測下限均為103cfu/ml。
實施例9
採用與實施例6相同的方法檢測待測樣品-都柏林克羅諾桿菌模擬汙染奶粉,將都柏林克羅諾桿菌模擬汙染奶粉基於第一探針、第二探針、第三探針的測定ct值與預設ct值比較,判定結果分別為陰性、陰性、陰性,結合表2可知,鑑定結果確認待測樣品中含有都柏林克羅諾桿菌。
實施例9不同梯度濃度待測樣品-都柏林克羅諾桿菌模擬汙染奶粉基於第一探針、第二探針、第三探針的擴增曲線圖,顯示第一探針、第二探針、第三探針對都柏林克羅諾桿菌模擬汙染奶粉檢測下限均為103cfu/ml。
實施例10
採用與實施例6相同的方法檢測待測樣品-蘇黎世克羅諾桿菌模擬汙染奶粉,將蘇黎世克羅諾桿菌模擬汙染奶粉基於第一探針、第二探針、第三探針的測定ct值與預設ct值比較,判定結果分別為陰性、陽性、陽性,結合表2可知,鑑定結果確認待測樣品中含有蘇黎世克羅諾桿菌。
實施例10不同梯度濃度待測樣品-蘇黎世克羅諾桿菌模擬汙染奶粉對第一探針、第二探針、第三探針的擴增曲線圖,顯示第一探針、第二探針、第三探針對蘇黎世克羅諾桿菌模擬汙染奶粉檢測下限均為103cfu/ml。
實施例11
特異性檢測,待測樣品包括311株克羅諾屬的不同「種」的菌株,其中192株為阪崎克羅諾桿菌,64株為丙二酸鹽陽性克羅諾桿菌,14株為穆汀斯克羅諾桿菌,31株為都柏林克羅諾桿菌,10株為蘇黎世克羅諾桿菌,其中均包含國際標準菌株。
採用與實施例1相同的方法測定上述待測樣品,測定結果均與其實際菌種相對應。
實施例12
第一標準品製備:
第一步,普通pcr對第一引物對擴增得到目標基因。
第二步,跑電泳回收上述目標基因(qiagen膠回收試劑盒)。
第三步,將目的基因連接到載體上,pmd19-tvector2ul,insertdna8ul,總量為10μl。加入10μl(等量)的solutioni(冰中溶解),16℃反應2h,製得重組質粒產物。
第四步,將第三步中的重組質粒導入感受態細胞(-80℃)。takarae.colijm109competentcells使用前在冰上融化。輕微混合,將100μl細胞移入1.5ml離心管。第三步中全量(20μl)加入至100μljm109感受態細胞中,冰中放置30分鐘,42℃放置90秒,冰中放置1-2分鐘,添加soc培養基(預先在37℃保溫)至終體積1ml,37℃振蕩培養1小時(160-225rpm)。取適量培養液塗於藍白篩選培養基(平板使用前需在37℃預熱30分鐘,翻轉避光培養)。
第五步,37℃過夜培養,藍白色菌落篩選,(添加x-gal,iptg,amp),製得克隆目的片段。進一步地,普通pcr方法驗證克隆目的片段的大小,當測序結果與目的基因序列比對一致後,確認製得對應的第一標準品。
分別採用上述方法製備第二標準品以及第三標準品。
第一標準曲線製備:
(1』)分別配製梯度濃度的第一標準品溶液。
(2』)取10×premixextaq緩衝液10μl,取csm-ctd-f工作液、csm-ctd-r工作液、cs-cma-f工作液、cs-cma-r工作液、cmu-cd-f工作液、cmu-cd-r工作液、csm-ctd-p工作液、cs-cma-p工作液、cmu-cd-p工作液各0.5μl,roxii矯正染料0.4μl,分別取101-107cfu/ml的第一標準品溶液2μl,純水補充至20μl,製得總體積為20μl的反應體系,利用abi7500-fast螢光定量pcr儀進行擴增。
擴增反應程序如下:
在95℃下2min,1個循環;
在95℃下15s,40個循環;
在60℃下30s,40個循環。
(3』)結合第一標準品擴增曲線圖繪製第一標準曲線,請參閱圖8所示,為採用上述方法製得的第一標準曲線圖。
分別採用上述方法製備第二標準曲線以及第三標準曲線,請參閱圖9至圖10所示,分別為採用上述方法製得的第二標準曲線圖以及第三標準曲線圖。
請參閱圖8至圖10所示,可以看出各梯度之間間隔的ct值相等,各梯度均能在一條直線上,標準曲線的相關係數在0.99以上,提示誤差較小,可信度較高。
(4)根據待測樣品擴增曲線、第一標準曲線、第二標準曲線以及第三標準曲線對待測樣品進行定量分析。
根據標準曲線換算成拷貝數,計算測待測樣品濃度。其中拷貝數的換算方式如下:
拷貝數(copies/ul)=(6.02x1023)x(ng/ulx10-9)/(質粒長度x660)
在本發明描述中,術語「第一」、「第二」僅用於描述目的,而不能理解為指示或暗示相對重要性。
以上所述實施例僅表達了本發明的幾種實施方式,其描述較為具體和詳細,但並不能因此而理解為對本發明專利範圍的限制。應當指出的是,對於本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干變形和改進,這些都屬於本發明的保護範圍。因此,本發明專利的保護範圍應以所附權利要求為準。
序列表
中國疾病預防控制中心傳染病預防控制所
用於鑑定克羅諾桿菌屬各個"種"的引物對、探針、試劑盒及方法
jlp17110108bj
9
patentinversion3.5
1
22
dna
cronobacterspp.
1
gtttatcaccggcagtctcctt22
2
22
dna
cronobacterspp.
2
ctcgtgttgtgaaatgttgggt22
3
18
dna
cronobacterspp.
3
ccgcacgtgarcgtttcg18
4
22
dna
cronobacterspp.
4
gatccgggttacacagrgtgtc22
5
20
dna
cronobacterspp.
5
cgtgagcgtttcggtcgtat20
6
20
dna
cronobacterspp.
6
gtcacgtctttcagaccgat20
7
20
dna
cronobacterspp.
7
ccggccgraccgctggcaac20
8
19
dna
cronobacterspp.
8
caggcgacatcgcggctgc19
9
24
dna
cronobacterspp.
9
atgcacgctaacaagcgtgaagag24
