用於結合有機靶的蜘蛛絲融合蛋白結構的製造方法與工藝
2023-06-14 01:06:22
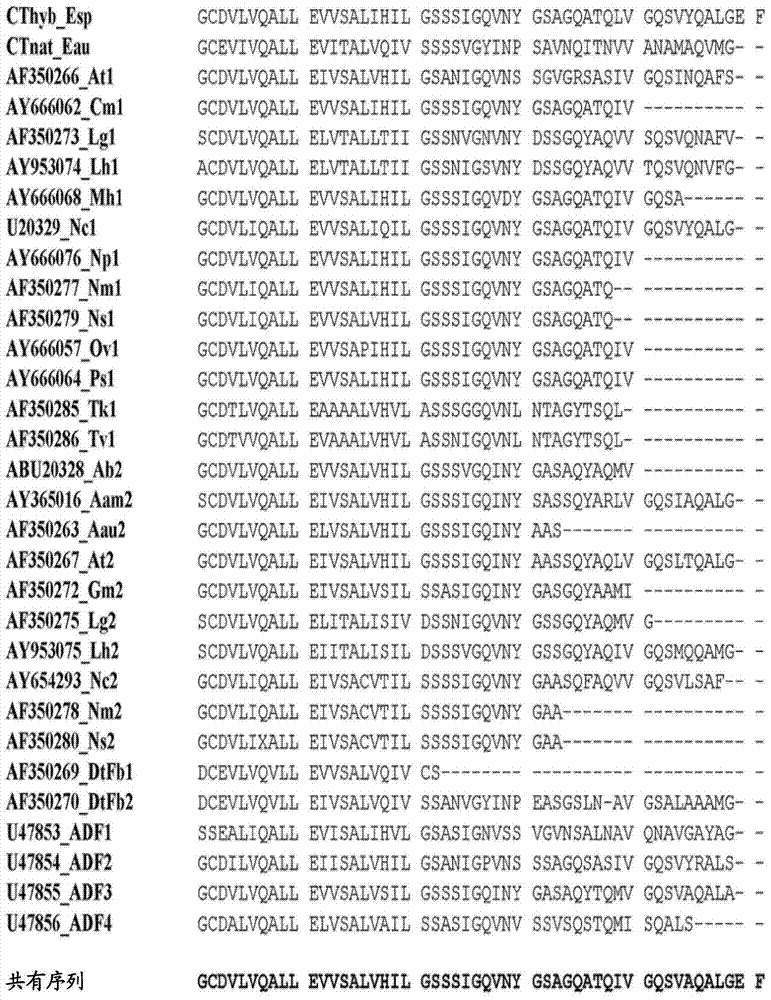
用於結合有機靶的蜘蛛絲融合蛋白結構發明的技術領域本發明涉及重組融合蛋白的領域,更具體地涉及包含衍生自蜘蛛絲蛋白(拖絲蛋白)的部分的融合蛋白。本發明提供用於提供為包含重組融合蛋白的聚合物的蛋白結構的方法,所述重組融合蛋白包含衍生自拖絲蛋白的部分。還提供了用於結合有機靶的新穎蛋白結構。發明背景在應用蛋白化學中,一個常見的問題是如何向相關的活性位點配製或呈現生物活性肽或蛋白,所述活性位點通常是有機靶,諸如核酸、蛋白、蛋白複合體、蛋白和/或脂質和/或碳水化合物和/或核酸的複合體。最簡單的解決方案是僅僅提供生物活性肽或蛋白的水溶液。然而,許多應用的確要求一些進一步的手段來實現期望的目標。例如,可將肽/蛋白締合於脂質混合物或化學地固定於支持結構。用於固定於支持結構的肽/蛋白的應用包括製備和分析性分離程序諸如生物工藝、層析法、細胞捕獲和培養、主動過濾器(activefilters)和診斷學。基於胞外基質蛋白例如膠原的結構公開在EP704532和EP985732中。還已經建議在支持結構中使用蜘蛛絲蛋白。蜘蛛絲是天然的高性能聚合物,由於強度和彈性的組合而獲得了非同尋常的韌性和延伸性。蜘蛛具有多達七個不同的腺,這些腺產生具有不同機械性質和功能的多種絲類型。由大壺狀腺產生的拖絲(draglinesilk)是最堅韌的纖維。它由兩種主要的多肽組成,大多被稱為大壺狀腺拖絲蛋白(spidroin)(MaSp)1和2,但在例如,在十字園蛛(Araneusdiadematus)中被稱為ADF-3和ADF-4。這些蛋白質具有200-720kDa範圍內的分子量。蜘蛛拖絲蛋白質或MaSp具有分成三部分的組成:無重複的N-端結構域、由許多重複的聚Ala/Gly區段構成的中心重複區域和無重複的C-端結構域。通常認為重複區域在絲纖維中形成分子間接觸,但不太清楚末端結構域的準確功能。還認為與纖維形成相聯繫地,重複區域經歷從無規捲曲和α-螺旋構象到β-摺疊結構的結構轉化。拖絲蛋白的C端區域在蜘蛛種類和絲類型之間通常是保守的。WO07/078239和Stark,M.等人,Biomacromolecules8:1695-1701,(2007)公開了由具有高的Ala和Gly含量的重複片段和蛋白質的C端片段組成的微型蜘蛛絲蛋白,以及包含蜘蛛絲蛋白的可溶性融合蛋白。在蜘蛛絲蛋白從其融合配體釋放後,自然地獲得蜘蛛絲蛋白的纖維。Rising,A.等人,CMLS68(2):169-184(2010)綜述了在產生蜘蛛絲蛋白方面的進展。US2009/0263430公開了酶β-半乳糖苷酶與微型蜘蛛絲蛋白的膜的化學偶聯。然而,化學偶聯可能要求對蛋白穩定性和/或功能不利的條件。包含衍生自蜘蛛絲蛋白的重複區的區段的多個重複段的蛋白已經被設計以包括RGD細胞結合區段(Bini,E等人,Biomacromolecules7:3139-3145(2006))和/或R5肽(WongPoFoo,C等人,ProcNatlAcadSci103(25):9428-9433(2006))或參與礦化作用(mineralization)的其他蛋白區段(Huang,J等人,Biomaterials28:2358-2367(2007);WO2006/076711)。在這些現有技術文獻中,通過在變性的有機溶劑六氟異丙醇(HFIP)中增溶融合蛋白和乾燥來形成膜。US2005/261479A1公開了用於純化具有親和性標籤的重組絲蛋白的方法,包括從複雜混合物中磁親和性分離單獨的絲蛋白,而不形成絲蛋白纖維或其他聚合物結構。已知的支持結構和相關的技術在以下方面具有某些缺陷,例如經濟性、效率、穩定性、再生能力、生物活性和生物相容性。發明概述本發明的一個目的是提供能夠與有機靶選擇性相互作用的新穎蛋白結構。本發明的另一個目的是提供能夠與有機靶選擇性相互作用的蛋白結構,其中所述結構的形成不使用可能對蛋白的二級結構或活性具有不可預測的作用和/或保持在蛋白結構中的強溶劑。本發明的一個目的是提供能夠與有機靶選擇性相互作用的穩定蛋白結構,該蛋白結構在使用後可容易地再生,例如通過化學處理。本發明的另一個目的是提供穩定蛋白結構,其是生物相容的,並適於細胞培養和作為植入物。本發明的又另一個目的是提供具有高密度的能夠與有機靶選擇性相互作用的均勻間隔的官能團的蛋白結構。本發明的另一個目的是提供在+4℃或在室溫儲存數月後保持其選擇性結合能力的蛋白結構。本發明的又一個目的是提供可高壓滅菌的蛋白結構,即,在滅菌熱處理後保持其選擇性結合能力。在第一個方面,本發明提供了以下實施方案:A1.一種蛋白結構,所述蛋白結構能夠與選自免疫球蛋白和包含免疫球蛋白或其衍生物的分子組成的組的有機靶選擇性相互作用,其中所述蛋白結構是包含能夠與所述有機靶選擇性相互作用的重組融合蛋白作為重複結構單元的聚合物,所述重組融合蛋白包含部分B、REP和CT,其中:B是多於30個胺基酸殘基的非拖絲蛋白部分,所述B提供與所述有機靶選擇性相互作用的能力,其中所述B部分選自衍生自葡萄球菌蛋白A的Z結構域、葡萄球菌蛋白A、和葡萄球菌蛋白A的E、D、A、B和C結構域;和與這些胺基酸序列的任一種具有至少70%同一性的蛋白片段組成的組;REP是70至300個胺基酸殘基的部分並衍生自蜘蛛絲蛋白的重複片段;和CT是70至120個胺基酸殘基的部分並衍生自蜘蛛絲蛋白的C端片段。A2.根據A1所述的蛋白結構,其中所述B部分可選自衍生自葡萄球菌蛋白A的Z結構域、和與衍生自葡萄球菌蛋白A的Z結構域具有至少70%同一性的蛋白片段組成的組。A3.一種蛋白結構,所述蛋白結構能夠與有機靶選擇性相互作用,其中所述蛋白結構是包含能夠與所述有機靶選擇性相互作用的重組融合蛋白作為重複結構單元的聚合物,所述重組融合蛋白包含部分B、REP和CT、和任選的NT,其中:B是多於30個胺基酸殘基的非拖絲蛋白部分,其提供與所述有機靶選擇性相互作用的能力;REP是70至300個胺基酸殘基的部分並衍生自蜘蛛絲蛋白的重複片段;CT是70至120個胺基酸殘基的部分並衍生自蜘蛛絲蛋白的C端片段;和NT是100至160個胺基酸殘基的部分並衍生自蜘蛛絲蛋白的N端片段。A4.根據A3所述的蛋白結構,其中所述重組融合蛋白可選自由式Bx-REP-By-CT-Bz和Bx-CT-By-REP-Bz定義的蛋白組成的組,其中x、y和z是0至5的整數;且x+y+z≥1。A5.根據A4所述的蛋白結構,其中所述重組融合蛋白可選自由式Bx-REP-CT、BX-CT-REP、REP-CT-BZ和CT-REP-BZ定義的蛋白組成的組;其中x和z是1至5的整數。A6.根據A5所述的蛋白結構,其中所述重組融合蛋白可選自由式B-REP-CT、B-CT-REP、REP-CT-B和CT-REP-B定義的蛋白組成的組。A7.根據A1-A6任一個所述的蛋白結構,其中所述B部分可具有與SEQIDNO:6-10的任一種少於30%的同一性。A8.根據A3-A7任一個所述的蛋白結構,其中所述有機靶可選自免疫球蛋白和包含免疫球蛋白或其衍生物的分子組成的組。A9.根據A8所述的蛋白結構,其中所述免疫球蛋白可選自來自人類的免疫球蛋白亞類IgG1、IgG2、IgG4、IgA和IGM。A10.根據A3-A9任一個所述的蛋白結構,其中所述B部分可選自衍生自葡萄球菌蛋白A的Z結構域、葡萄球菌蛋白A、和葡萄球菌蛋白A的E、D、A、B和C結構域、鏈球菌蛋白G、和鏈球菌蛋白G的C1、C2和C3結構域;和與這些胺基酸序列的任一種具有至少70%同一性的蛋白片段組成的組。A11.根據A10所述的蛋白結構,其中所述B部分可選自衍生自葡萄球菌蛋白A的Z結構域、葡萄球菌蛋白A的B結構域、和鏈球菌蛋白G的C2結構域;和與這些胺基酸序列的任一種具有至少70%同一性的蛋白片段組成的組。A12.根據A11所述的蛋白結構,其中所述B部分可選自衍生自葡萄球菌蛋白A的Z結構域和鏈球菌蛋白G的C2結構域組成的組。A13.根據A3-A7任一個所述的蛋白結構,其中所述有機靶可選自白蛋白和包含白蛋白或其衍生物的分子組成的組。A14.根據A13所述的蛋白結構,其中所述B部分可選自鏈球菌蛋白G、鏈球菌蛋白G的白蛋白結合結構域、來自大芬戈爾德菌(Finegoldiamagna)的GA模塊;和與這些胺基酸序列的任一種具有至少70%同一性的蛋白片段。A15.根據A13-A14任一個所述的蛋白結構,其中所述B部分可包括鏈球菌蛋白G的白蛋白結合結構域、和與其具有至少70%同一性的蛋白片段。A16.根據A15所述的蛋白結構,其中所述B部分可以是鏈球菌蛋白G的白蛋白結合結構域。A17.根據A3-A7任一個所述的蛋白結構,其中所述有機靶可選自生物素和包含生物素或其衍生物或類似物的分子組成的組。A18.根據A17所述的蛋白結構,其中所述B部分可選自鏈黴親和素、單體鏈黴親和素(M4);和與這些胺基酸序列的任一種具有至少70%同一性的蛋白片段組成的組。A19.根據A18所述的蛋白結構,其中所述B部分可以是單體鏈黴親和素(M4)。A20.根據A1-A19任一個所述的蛋白結構,其中所述蛋白結構可在至少兩個維度上具有至少0.1μm的尺寸。A21.根據A1-A20任一個所述的蛋白結構,其中所述蛋白結構可以是以選自由纖維、膜、泡沫、網狀物、網、球和膠囊組成的組的物理形態。A22.根據A1-A21任一個所述的蛋白結構,其中所述REP部分可選自L(AG)nL、L(AG)nAL、L(GA)nL、L(GA)nGL的組,其中n是2至10的整數;每個單獨的A區段是8至18個胺基酸殘基的胺基酸序列,其中所述胺基酸殘基中的0至3個不是Ala,且剩餘的胺基酸殘基是Ala;每個單獨的G區段是12至30個胺基酸殘基的胺基酸序列,其中至少40%的胺基酸殘基是Gly;且每個單獨的L區段是0至20個胺基酸殘基的接頭胺基酸序列。A23.根據A1-A22任一個所述的蛋白結構,其中所述CT部分可具有與SEQIDNO:9的至少50%同一性或與SEQIDNO:7的至少80%同一性。A24.根據A23所述的蛋白結構,其中所述CT部分可具有與SEQIDNO:9的至少50%同一性和與SEQIDNO:7的至少80%同一性。A25.根據A1-A24任一個所述的蛋白結構,其中所述NT部分可具有與SEQIDNO:8的至少50%同一性或與SEQIDNO:6的至少80%同一性。A26.根據A25所述的蛋白結構,其中所述NT部分可具有與SEQIDNO:8的至少50%同一性和與SEQIDNO:6的至少80%同一性。A27.根據A1-A26任一個所述的蛋白結構,其中所述融合蛋白可包括寡肽細胞結合基序。A28.根據A1-A27任一個所述的蛋白結構,其中所述融合蛋白可選自SEQIDNO:14、16、18、22、24和26;和與這些序列的任一種具有至少80%同一性的蛋白組成的組。A29.一種提供根據A1-A28任一個所述的蛋白結構的方法,所述蛋白結構展示對有機靶的結合活性,所述方法包括以下步驟:(a)提供根據A1-A28任一個所述的重組融合蛋白;(b)將所述融合蛋白經受實現包含所述重組融合蛋白的聚合物的形成的條件。A30.一種用於固定有機靶的親和性介質,所述親和性介質包含根據A1-A28任一個所述的融合蛋白,其中所述B部分能夠與所述有機靶選擇性相互作用。A31.根據A30所述的親和性介質,所述親和性介質可包含根據A1-A28任一個所述的蛋白結構,所述蛋白結構是包含所述重組融合蛋白的聚合物。A32.根據A31所述的親和性介質,其中所述蛋白結構可以是根據A8-A19任一個所述的。A33.根據A30-A32任一個所述的親和性介質,所述親和性介質還可包含所述有機靶,其中所述B部分能夠與所述有機靶選擇性相互作用並結合。A34.根據A33所述的親和性介質,其中所述有機靶能夠與第二有機靶選擇性相互作用。A35.根據A31-A34任一個所述的親和性介質,其中所述蛋白結構可以是以膜的物理形態。A36.一種用於培養細胞的細胞支架材料,所述細胞具有存在於所述細胞表面上的有機靶,所述細胞支架材料包含根據A1-A28任一個所述的蛋白結構。A37.根據A36所述的細胞支架材料,其中所述B部分能夠與存在於所述細胞表面上的所述有機靶選擇性相互作用。A38.根據A36所述的細胞支架材料,其中所述細胞支架材料還可包含中間有機靶,其中所述B部分能夠與所述中間有機靶選擇性相互作用並結合,且其中所述中間有機靶能夠與存在於所述細胞表面上的所述有機靶選擇性相互作用。A39.根據A38所述的細胞支架材料,其中所述蛋白結構可以是根據A8-A19任一個所述的。A40.根據A36-A40任一個所述的細胞支架材料,其中所述蛋白結構可以是以膜的物理形態。A41.細胞與根據A36-A40任一個所述的細胞支架材料的組合。A42.根據A1-A28任一個所述的蛋白結構在從樣品分離有機靶中的用途。A43.根據A1-A28任一個所述的蛋白結構在培養細胞中的用途。A44.一種從樣品分離有機靶的方法,所述方法包括以下步驟:提供包含所述有機靶的樣品;提供根據A30-A35任一個所述的親和性介質,其中所述親和性介質能夠與所述有機靶選擇性相互作用;在實現所述親和性介質與所述有機靶之間的結合的適當條件下將所述親和性介質與所述樣品接觸;和除去未結合的樣品。A45.根據A44所述的方法,所述方法還可包括在實現第一有機靶與第二有機靶之間的結合的適當條件下將所述親和性介質和固定的有機靶與第二有機靶接觸的步驟,所述第二有機靶能夠與第一有機靶選擇性相互作用。A46.根據A44-A45任一個所述的方法,其中當將所述親和性介質與所述樣品接觸以實現所述親和性介質與所述有機靶之間的結合時,所述親和性介質中的所述融合蛋白可以以如根據A1-A28任一個所述的蛋白結構存在。A47.根據A44-A45任一個所述的方法,其中當將所述親和性介質與所述樣品接觸以實現所述親和性介質與所述有機靶之間的結合時,所述親和性介質中的所述融合蛋白可在溶液中存在,且其中允許融合蛋白與所述有機靶結合的複合體形成根據A1-A28任一個所述的融合蛋白結構。A48.根據A44-A47任一個所述的方法,所述方法還可包括檢測、和任選地定量所述親和性介質上的固定的靶的存在的步驟。A49.根據A44-A48任一個所述的方法,所述方法還可包括從所述親和性介質釋放和收集所述有機靶的步驟。A50.根據A44-A49任一個所述的方法,所述方法還可包括通過化學處理和/或滅菌熱處理再生所述親和性介質的最後步驟。A51.根據A50所述的方法,其中所述化學處理可包括用NaOH和/或脲處理。A52.一種固定細胞的方法,所述方法包括提供:包含目標細胞的樣品;將所述樣品應用到根據A36-A40任一個所述的細胞支架材料,其中所述細胞支架材料能夠與存在於所述細胞表面上的有機靶選擇性相互作用;和通過所述細胞表面上的所述有機靶與所述細胞支架材料之間的結合,允許所述細胞固定於所述細胞支架材料。A53.一種培養細胞的方法,所述方法包括:根據A52所述的方法固定目標細胞到細胞支架材料;和在適合細胞培養的條件下保持已對其應用細胞的所述細胞支架材料。A54.根據A44-A53任一個所述的方法,其中所述蛋白結構可以是以膜、纖維或泡沫的物理形態。A55.根據A1-A28任一個所述的重組融合蛋白,所述重組融合蛋白能夠與有機靶選擇性相互作用。A56.一種分離的多核酸,所述多核酸編碼根據A55所述的融合蛋白。A57.根據A56所述的分離的多核酸,所述多核酸可選自由編碼根據A28所述的融合蛋白的核酸組成的組和由SEQIDNO:15、17、19、23、25和27組成的組。A58.一種產生融合蛋白的方法,所述方法包括以下步驟:a)在適當的宿主中表達根據A1-A28任一個所述的融合蛋白;和b)獲得包含所述融合蛋白的混合物,和任選地分離所述融合蛋白。A59.根據A1-A28任一個所述的重組融合蛋白用於產生能夠與有機靶選擇性相互作用的蛋白結構的用途,其中所述蛋白結構是包含所述重組融合蛋白的聚合物。在另一個方面,本發明提供了以下實施方案:B1.一種蛋白結構,所述蛋白結構能夠與選自IgG的可結晶片段(Fc)區域和包含IgG或其衍生物的分子組成的組的有機靶選擇性相互作用,其中所述蛋白結構是包含能夠與所述有機靶選擇性相互作用的重組融合蛋白作為重複結構單元的聚合物,所述重組融合蛋白包含部分B、REP和CT,其中所述聚合物包括多於100個融合蛋白結構單元,且其中:B是多於30個胺基酸殘基的非拖絲蛋白部分,所述B提供與所述有機靶選擇性相互作用的能力,其中所述B部分選自葡萄球菌蛋白A的Z結構域、葡萄球菌蛋白A、和葡萄球菌蛋白A的E、D、A、B和C結構域;和與這些胺基酸序列的任一種具有至少70%同一性的蛋白片段組成的組;所述REP部分和CT部分提供形成聚合物的能力;REP是70至300個胺基酸殘基的部分並選自由L(AG)nL、L(AG)nAL、L(GA)nL、L(GA)nGL組成的組,其中n是2至10的整數;每個單獨的A區段是8至18個胺基酸殘基的胺基酸序列,其中所述胺基酸殘基中的0至3個不是Ala,且剩餘的胺基酸殘基是Ala;每個單獨的G區段是12至30個胺基酸殘基的胺基酸序列,其中至少40%的胺基酸殘基是Gly;且每個單獨的L區段是0至20個胺基酸殘基的接頭胺基酸序列;和CT是70至120個胺基酸殘基的部分並具有與SEQIDNO:9的至少50%同一性或與SEQIDNO:7的至少80%同一性。B2.根據B1所述的蛋白結構,其中所述B部分可選自葡萄球菌蛋白A的Z結構域、葡萄球菌蛋白A的B結構域;和與這些胺基酸序列的任一種具有至少70%同一性的蛋白片段組成的組。B3.根據B2所述的蛋白結構,其中所述B部分可選自葡萄球菌蛋白A的Z結構域、和與葡萄球菌蛋白A的Z結構域具有至少70%同一性的蛋白片段組成的組。B4.根據B3所述的蛋白結構,其中所述B部分可以是葡萄球菌蛋白A的Z結構域。B5.根據B4所述的蛋白結構,其中所述重組融合蛋白可選自由式Bx-REP-By-CT-Bz和Bx-CT-By-REP-Bz定義的蛋白組成的組,其中x、y和z是0至5的整數;且x+y+z≥1。B6.根據B5所述的蛋白結構,其中所述重組融合蛋白可選自由式Bx-REP-CT、BX-CT-REP、REP-CT-BZ和CT-REP-BZ定義的蛋白組成的組;其中x和z是1至5的整數。B7.根據B6所述的蛋白結構,其中所述重組融合蛋白可選自由式B-REP-CT、B-CT-REP、REP-CT-B和CT-REP-B定義的蛋白組成的組。B8.根據B1-B7任一個所述的蛋白結構,其中所述B部分可具有與SEQIDNO:6-10的任一種少於30%的同一性。B9.根據B1-B8任一個所述的蛋白結構,其中所述蛋白結構可在至少兩個維度上具有至少0.1μm的尺寸。B10.根據B1-B9任一個所述的蛋白結構,其中所述蛋白結構可以是以選自由纖維、膜、泡沫、網狀物、網、球和膠囊組成的組的物理形態。B11.根據B1-B10任一個所述的蛋白結構,其中所述CT部分可具有與SEQIDNO:9的至少50%同一性和與SEQIDNO:7的至少80%同一性。B12.根據B1-B10任一個所述的蛋白結構,其中所述CT部分可具有與SEQIDNO:7的至少90%同一性。B13.根據B12所述的蛋白結構,其中所述CT部分可以是SEQIDNO:7。B14.根據B1-B13任一個所述的蛋白結構,其中所述重組融合蛋白可選自SEQIDNO:14和與SEQIDNO:14具有至少80%同一性的蛋白組成的組。B15.一種提供根據B1-B14任一個所述的蛋白結構的方法,所述蛋白結構展示對選自由IgG的可結晶片段(Fc)區域和包含IgG或其衍生物的分子組成的組的有機靶的結合活性,所述方法包括以下步驟:(a)提供根據B1-B14任一個所述的重組融合蛋白;(b)將所述重組融合蛋白經受實現包含所述重組融合蛋白的聚合物的形成的條件。B16.一種用於固定選自由IgG的可結晶片段(Fc)區域和包含IgG或其衍生物的分子組成的組的有機靶的親和性介質,所述親和性介質包含根據B1-B14任一個所述的重組融合蛋白,其中所述B部分能夠與所述有機靶選擇性相互作用。B17.根據B16所述的親和性介質,所述親和性介質可包含根據B1-B14任一個所述的蛋白結構,所述蛋白結構是包含所述重組融合蛋白的聚合物。B18.根據B16-B17任一個所述的親和性介質,所述親和性介質還可包含所述有機靶,其中所述B部分能夠與所述有機靶選擇性相互作用並結合。B19.根據B18所述的親和性介質,其中所述有機靶能夠與第二有機靶選擇性相互作用。B20.根據B17-B19任一個所述的親和性介質,其中所述蛋白結構可以是以膜的物理形態。B21.一種用於培養細胞的細胞支架材料,所述細胞具有存在於所述細胞表面上的有機靶,所述細胞支架材料包含根據B1-B14任一個所述的蛋白結構,其中所述細胞支架材料還包含選自由IgG的可結晶片段(Fc)區域和包含IgG或其衍生物的分子組成的組的中間有機靶,其中所述B部分能夠與所述中間有機靶選擇性相互作用並結合,且其中所述中間有機靶能夠與存在於所述細胞表面上的所述有機靶選擇性相互作用。B22.根據B21所述的細胞支架材料,其中所述蛋白結構可以是以膜的物理形態。B23.細胞與根據B21-B22任一個所述的細胞支架材料的組合。B24.根據B1-B14任一個所述的蛋白結構在從樣品分離選自由IgG的可結晶片段(Fc)區域和包含IgG或其衍生物的分子組成的組的有機靶中的用途。B25.根據B1-B14任一個所述的蛋白結構在培養細胞中的用途。B26.一種從樣品分離選自由IgG的可結晶片段(Fc)區域和包含IgG或其衍生物的分子組成的組的有機靶的方法,所述方法包括以下步驟:提供包含所述有機靶的樣品;提供根據B16-B20任一個所述的親和性介質,其中所述親和性介質能夠與所述有機靶選擇性相互作用;在實現所述親和性介質與所述有機靶之間的結合的適當條件下將所述親和性介質與所述樣品接觸,從而提供固定的有機靶;和除去未結合的樣品。B27.根據B26所述的方法,所述方法還可包括將所述親和性介質和所述固定的有機靶與另外的有機靶在實現這兩個有機靶之間的結合的適當條件下接觸的步驟,所述另外的有機靶能夠與所述固定的有機靶選擇性相互作用。B28.根據B26-B27任一個所述的方法,其中當將所述親和性介質與所述樣品接觸以實現所述親和性介質與所述有機靶之間的結合時,所述親和性介質中的所述重組融合蛋白可以以如根據B1-B14任一個所述的蛋白結構存在。B29.根據B26-B27任一個所述的方法,其中當將所述親和性介質與所述樣品接觸以實現所述親和性介質與所述有機靶之間的結合時,所述親和性介質中的所述重組融合蛋白可在溶液中存在,且其中允許融合蛋白與所述有機靶結合的複合體形成根據B1-B14任一個所述的融合蛋白結構。B30.根據B26-B29任一個所述的方法,所述方法還可包括檢測、和任選地定量所述親和性介質上的所述固定的有機靶的存在的步驟。B31.根據B26-B30任一個所述的方法,所述方法還可包括從所述親和性介質釋放和收集所述有機靶的步驟。B32.根據B26-B31任一個所述的方法,所述方法還可包括通過化學處理和/或滅菌熱處理再生所述親和性介質的最後步驟。B33.根據B32所述的方法,其中所述化學處理可包括用NaOH和/或脲處理。B34.一種固定細胞的方法,所述方法包括:提供包含目標細胞的樣品;將所述樣品應用到根據B21-B22任一個所述的細胞支架材料,其中所述細胞支架材料能夠與存在於所述細胞表面上的有機靶選擇性相互作用;和通過所述細胞表面上的所述有機靶與所述細胞支架材料之間的結合,允許所述細胞固定於所述細胞支架材料。B35.一種培養細胞的方法,所述方法包括:根據B34所述的方法固定目標細胞到細胞支架材料;和在適合細胞培養的條件下保持已對其應用細胞的所述細胞支架材料。B36.根據B26-B35任一個所述的方法,其中所述蛋白結構可以是以膜、纖維或泡沫的物理形態。B37.一種重組融合蛋白,所述重組融合蛋白由SEQIDNO:14組成。B38.一種分離的多核酸,所述多核酸選自由編碼根據B37所述的重組融合蛋白的核酸和SEQIDNO:15組成的組。B39.一種產生重組融合蛋白的方法,所述方法包括以下步驟:a)在適當的宿主中表達根據B37所述的重組融合蛋白;和b)獲得包含所述重組融合蛋白的混合物,和任選地分離所述重組融合蛋白。B40.根據B1-B14任一個所述的重組融合蛋白用於產生能夠與選自由IgG的可結晶片段(Fc)區域和包含IgG或其衍生物的分子組成的組的有機靶選擇性相互作用的蛋白結構的用途,其中所述蛋白結構是包含所述重組融合蛋白的聚合物。附圖簡述圖1顯示拖絲蛋白C端結構域的序列比對。圖2顯示拖絲蛋白N端結構域的序列比對。圖3顯示包含Z結構域的融合蛋白的宏觀纖維。圖4顯示來自包含Z結構域的融合蛋白的純化和分析的SDS-PAGE凝膠。圖5顯示由融合蛋白製成的纖維和對照纖維,示出融合蛋白中Z結構域的功能性(functionality)。圖6顯示在組織培養板的底部由融合蛋白製成的成型膜(castedfilm)的部分。圖7-12顯示非還原性SDS-PAGE凝膠,示出融合蛋白結構中Z結構域的功能性。圖13-15顯示非還原性SDS-PAGE凝膠,示出與商業蛋白A基質相比,融合蛋白結構中的Z結構域的IgG-結合能力。圖16-17顯示與商業蛋白A基質相比,融合蛋白結構的就地清洗(cleaning-in-place,CIP)程序的非還原性SDS-PAGE凝膠。圖18顯示來自用生物素化的Atto-565浸泡的蛋白膜的螢光強度。圖19顯示不同濃度的生物素化的Atto-565在結合融合蛋白膜後螢光強度值的圖和線性擬合。圖20顯示向由融合蛋白製成的膜或對照的孔加入生物素化的Atto-565之前(-)和之後(+)的螢光強度值的圖。圖21是顯示由溶液中游離的生物素化的HRP催化所得的反應速率的標準曲線和線性擬合的圖。圖22是顯示與對照相比,由固定於融合蛋白膜的生物素化的HRP催化的反應速率的圖。圖23顯示增溶的融合蛋白結構的還原性SDS-PAGE凝膠。圖24-26顯示示出IgG-HRP與包含Z結構域的融合蛋白膜的結合的圖。圖27顯示示出IgG-AlexaFluor633與包含Z結構域的融合蛋白膜的結合的圖。圖28顯示非還原性SDS-PAGE凝膠,示出高壓滅菌後融合蛋白中Z結構域的功能性。圖29顯示蛋白酶3C處理包含Z結構域的融合蛋白纖維的裂解產物的SDS-PAGE凝膠。圖30顯示非還原性SDS-PAGE凝膠,示出在有機靶(IgG)存在下形成的融合蛋白結構中Z結構域的功能性。圖31-32顯示非還原性SDS-PAGE凝膠,示出融合蛋白結構中Abd結構域的功能性。圖33-34顯示非還原性SDS-PAGE凝膠,示出融合蛋白結構中C2結構域的功能性。所附序列的列表SEQIDNOSEQIDNO14Rep24RepCT3NT4Rep4NT5Rep5NT4RepCTHis6NT7CT8共有NT序列9共有CT序列10來自EuprosthenopsaustralisMaSp1的重複序列11共有G區段序列112共有G區段序列213共有G區段序列314HisZQG4Rep4CT15HisZQG4Rep4CT(DNA)16HisAbdQG4RepCT17HisAbdQG4RepCT(DNA)18HisC2QG4RepCT19HisC2QG4RepCT(DNA)204RepCT2214RepCT2(DNA)22M44RepCT23M44RepCT(DNA)24modM44RepCT25modM44RepCT(DNA)264RepCTM4274RepCTM4(DNA)發明詳述本發明總體是基於如下洞見:能夠與有機靶選擇性相互作用的固態蛋白結構可製備為以重組融合蛋白作為重複結構單元的聚合物形式。融合蛋白包含至少一個能夠與該有機靶選擇性相互作用的多於30個胺基酸殘基的非拖絲蛋白部分、和對應於蜘蛛絲蛋白的至少重複片段和C端片段的部分。意外地,衍生自蜘蛛絲蛋白的部分可被誘導以在結構上重排並因而形成聚合、固態結構,而非拖絲蛋白部分不在結構上重排,但保持其期望的結構和功能,即,與該有機靶選擇性相互作用的能力。可獲得蛋白結構而無化學偶聯步驟或變性方法步驟,這使得程序容易並改進獲得具有保持其部分的功能性的融合蛋白的機會,尤其是當功能依賴於部分的二級結構時。這些融合蛋白聚合物的形成可被緊密地控制,且這一洞見已被開發為進一步的新穎蛋白結構、產生該蛋白結構的方法、和該蛋白結構在多種應用和方法中的用途。因此,根據本發明的融合蛋白具備期望的選擇性相互作用活性和蛋白結構中在生理條件下採用的內部的固態支持活性二者。當拖絲蛋白部分在結構上重排以形成聚合、固態結構時,融合蛋白的結合活性被保持,而非拖絲蛋白部分與拖絲蛋白部分共價連接,一定是被認為令人驚訝的。事實上,提供選擇性相互作用活性的部分當被整合在根據本發明的融合蛋白結構中時,可增加其熱和/或化學穩定性和/或結合活性。該蛋白結構還提供對有機靶的選擇性相互作用活性的高和可預測的密度。具有選擇性相互作用活性的有價值的蛋白部分的丟失被減到最小,因為所有表達的蛋白部分與固體支持物締合。從根據本發明的融合蛋白形成的聚合物是固態結構,由於其物理特徵而是有用的,尤其是高強度、彈性和輕的重量的有用的組合。特別有用的特徵是,融合蛋白的拖絲蛋白衍生部分是生化牢固的,適於用例如酸、鹼或離液劑再生,並適於加熱滅菌,例如在120℃高壓滅菌20min。該聚合物還因為其支持細胞粘附和生長的能力而是有用的。衍生自拖絲的性質在開發為了醫學或技術目的的新材料方面是有吸引力的。尤其是,根據本發明的蛋白結構可用在製備和分析性分離程序中,諸如層析法、細胞捕獲、篩選和培養、主動過濾器(activefilters)和診斷學。根據本發明的蛋白結構還可用在醫療裝置中,諸如植入物和醫學產品,諸如傷口閉合系統、創可貼、縫線、傷口敷料、和用於細胞固定、細胞培養、組織工程和引導細胞再生的支架。本發明提供能夠與有機靶選擇性相互作用的重組融合蛋白,該融合蛋白包含部分B、REP和CT、和任選的NT。本發明還提供能夠與有機靶選擇性相互作用的蛋白結構,其中所述蛋白結構是包含根據本發明的重組融合蛋白、和任選地由根據本發明的重組融合蛋白組成的聚合物,即,包含部分B、REP和CT、和任選的NT,和任選地由部分B、REP和CT、和任選的NT組成。儘管在實施例中融合蛋白的REP和CT部分不得已地涉及具體蛋白,例如衍生自來自Euprosthenopsaustralis的大拖絲蛋白1(MaSp1)的蛋白,為了產生根據本發明的融合蛋白結構的目的,考慮本公開內容可適用於任何結構上相似的部分。而且,儘管在實施例中提供融合蛋白的選擇性相互作用活性的B部分不得已地涉及具體蛋白部分,例如衍生自蛋白A、蛋白G和鏈黴親和素的部分,為了產生根據本發明的融合蛋白結構的目的,考慮本公開內容可適用於能夠與有機靶選擇性相互作用的任何結構上和/或功能上相似的B部分。根據本發明的具體融合蛋白以式Bx-REP-By-CT-Bz和Bx-CT-By-REP-Bz定義,其中x、y和z是0至5的整數;且x+y+z≥1,任選地在融合蛋白的任一端或融合蛋白中任何兩個蛋白部分之間還包含一個NT部分。如果x+y+z>1,即,如果存在兩個或多個B部分,它們可以是相同或不同的。兩個或多個B部分可具有與相同有機靶或與不同有機靶選擇性相互作用的能力。優選地,兩個或多個B部分是大致上相同的,各具有與相同有機靶選擇性相互作用的能力。在根據本發明的優選融合蛋白中,x、y和z是0至2、優選地0至1的整數。在根據本發明的某些優選融合蛋白中,y=0。在根據本發明的更優選的具體融合蛋白中,y=0且x或z是0,即,融合蛋白以式BX-REP-CT、BX-CT-REP、REP-CT-BZ和CT-REP-BZ定義,其中x和z是1至5的整數。在根據本發明的優選融合蛋白中,y=0,x和z是0至1的整數;且x+z=1。如此,根據本發明的某些優選融合蛋白以式B-REP-CT、B-CT-REP、REP-CT-B和CT-REP-B定義。在根據本發明的優選融合蛋白中,任選的NT部分不存在。術語「融合蛋白」此處指通過由重組核酸,即通過組合正常情況下不會一起出現的兩個或更多個核酸序列而人工創造的DNA或RNA表達而製備的蛋白質(遺傳工程)。根據本發明的融合蛋白是重組蛋白,且因此其不同於天然存在的蛋白質。特別地,因為野生型拖絲蛋白不是由以上列出的重組核酸表達的,所以其不是根據本發明的融合蛋白。組合的核酸序列編碼具有特定功能特性的不同蛋白質、部分蛋白質或多肽。所得的融合蛋白或重組融合蛋白是具有衍生自原始蛋白質、部分蛋白質或多肽中的每一種的功能特性的單一蛋白質。而且,根據本發明的融合蛋白和相應的基因是嵌合的,即,該蛋白/基因部分衍生自至少兩種不同的物種。REP和CT部分、以及任選的NT部分,都衍生自蜘蛛絲蛋白。為了避免疑問,根據本發明的B部分是非拖絲蛋白的蛋白或多肽,即,其不是衍生自蜘蛛絲蛋白。具體地,根據本發明的B部分不是衍生自蜘蛛絲蛋白的C端、重複或N端片段。融合蛋白通常由170至2000個胺基酸殘基、諸如170至1000個胺基酸殘基、諸如170至600個胺基酸殘基、優選地170至500個胺基酸殘基、諸如170至400個胺基酸殘基組成。小的尺寸是有利的,因為包含蜘蛛絲蛋白片段的較長蛋白可能形成無定形的聚集物,這需要使用強力的溶劑來增溶和聚合。重組融合蛋白可包含多於2000個殘基,尤其是在蜘蛛絲蛋白包含多於一個B部分和/或當其包含NT部分的情形時。術語"拖絲蛋白(spidroin)"和"蜘蛛絲蛋白(spidersilkprotein)"遍及本說明書可互換地使用,並涵蓋所有已知的蜘蛛絲蛋白,包括大壺狀腺蜘蛛絲蛋白,其通常縮寫為"MaSp",或在十字園蛛的情形縮寫為"ADF"。這些大壺狀腺蜘蛛絲蛋白一般為兩種類型,1和2。這些術語還包括與已知蜘蛛絲蛋白具有高程度的同一性和/或相似性的非天然蛋白。所以,術語"非拖絲蛋白"意指不是衍生自蜘蛛絲蛋白的蛋白,即,與蜘蛛絲蛋白具有低(或無)程度的同一性和/或相似性。根據本發明的蛋白結構能夠與有機靶選擇性相互作用。這一能力存在於根據本發明的融合蛋白中,更具體地存在於融合蛋白的B部分中。REP和CT部分、以及任選的NT部分,與有機分子的任何相互作用不被術語"能夠與有機靶選擇性相互作用"涵蓋。為了避免疑問,術語"能夠與有機靶選擇性相互作用"不涵蓋根據本發明的融合蛋白的依賴於包括REP和CT部分、以及任選的NT部分的相互作用的二聚、寡聚或聚合。術語"有機靶"涵蓋含碳原子的所有化學分子,例外是通常本領域技術人員認為是無機分子的那些,例如碳酸鹽、碳的簡單氧化物、氰化物、金剛石和石墨。為了避免疑問,無機分子、鹽和離子,諸如矽石和氯化鈣,不是有機的。有機靶可以是包含有機分子或由有機分子組成的複合體,例如,細胞表面上的受體複合體。有機靶可以是一種或多種有機分子類型的單體、二聚體、寡聚體或聚合物,可以由共價鍵或其他類型的締合保持在一起。當然,它還可以簡單地是單個有機分子。根據本發明的優選的有機靶包括但不限於,核酸、蛋白和多肽、脂質和碳水化合物、以及其組合。根據本發明的另外的優選的有機靶包括但不限於,免疫球蛋白、包含免疫球蛋白或其衍生物的分子、白蛋白、包含白蛋白或其衍生物的分子、生物素、和包含生物素或其衍生物或類似物的分子。在本發明的上下文中,配體例如根據本發明的融合蛋白的B部分與其靶的"特異"或"選擇性"相互作用是指,該相互作用使得特異性與非特異性、或選擇性或非選擇性的相互作用之間的差別變得有意義。兩種蛋白之間的相互作用有時以解離常數測量。解離常數描述兩種分子之間的結合強度(或親和性)。通常抗體與其抗原之間的解離常數是10-7至10-11M。然而,高特異性不必要求高親和性。對其對應物具有低親和性(在摩爾範圍中)的分子已經顯示為與具有高的多的親和性的分子同樣特異性。在本發明的情形中,特異或選擇性相互作用是指在指定條件下,在天然存在的或經加工的生物或生化流體的樣品中其他蛋白的存在下,特定方法可用於確定特定蛋白、靶蛋白或其片段的存在和/或量的程度。換言之,特異性或選擇性是區分相關蛋白的能力。特異和選擇性在本說明書中有時可互換地使用。根據本發明的融合蛋白還可包含一個或多個接頭肽。接頭肽可布置在融合蛋白的任何部分之間,例如,CT和REP部分之間、兩個B部分之間、B和CT部分之間、和B和REP部分之間,或可布置在融合蛋白的任一末端。如果融合蛋白包含兩個或多個B部分,接頭肽還可布置在兩個B部分之間。接頭可在融合蛋白的功能單元之間提供間隔區,而且還可構成用於鑑定和純化該融合蛋白的工具,例如,His和/或Trx標籤。如果融合蛋白包含用於鑑定和純化融合蛋白的兩個或多個接頭肽,優選它們被間隔序列隔開,例如His6-間隔區-His6-。接頭還可構成將融合蛋白導向膜和/或致使融合蛋白從宿主細胞分泌到周圍介質中的信號肽,例如信號識別顆粒。融合蛋白還可在其胺基酸序列中包括允許裂解並去除接頭和/或其他相關部分,通常是一個或多個B部分的裂解位點。多種裂解位點是本領域技術人員已知的,例如,針對化學劑的裂解位點,例如Met殘基之後的CNBr裂解位點和Asn-Gly殘基之間的羥胺裂解位點,針對蛋白酶例如凝血酶或蛋白酶3C的裂解位點,和自我剪接序列,例如內蛋白(intein)自我剪接序列。REP、CT和B部分彼此直接或間接連接。直接連接指部分之間的直接共價結合而無間插序列例如接頭。間接連接也是指部分通過共價鍵連接,但是存在間插序列,例如接頭和/或一個或多個另外的部分,例如NT部分。一個或多個B部分可布置在融合蛋白的內部或任何一端,即,布置在C端或布置在N端。優選一個或多個B部分布置在融合蛋白的N末端。如果融合蛋白包含用於鑑定和純化融合蛋白的一個或多個接頭肽,例如,His或Trx標籤,優選地其被布置在融合蛋白的N末端。優選的融合蛋白具有布置在N端的B部分通過1-30個胺基酸殘基,經由例如1-10個胺基酸殘基的接頭肽偶聯到布置在C端的REP和CT部分的形式。接頭肽可包含裂解位點。任選地,融合蛋白具有可包含純化標籤例如His標籤和裂解位點的N端或C端接頭肽。另一種優選的融合蛋白具有布置在N端的B部分直接偶聯到布置在C端的REP和CT部分的形式。任選地,融合蛋白具有可包含純化標籤例如His標籤和裂解位點的N端或C端接頭肽。根據本發明的蛋白結構是包含根據本發明的重組融合蛋白作為重複結構單元的聚合物,這是意指,其包含有序的多個根據本發明的融合蛋白,通常遠多於100個融合蛋白單元、例如,1000個融合蛋白單元或更多。任選地,聚合物可包含無B部分的互補蛋白、優選地衍生自蜘蛛絲的蛋白作為另外的重複結構單元。如果融合蛋白的B部分是大和/或龐大的,這可以是有益的。這些互補蛋白通常包括REP部分和CT部分、和任選地NT部分。根據本發明的優選的互補蛋白可具有本文列出的結構的任一種,並缺失B部分。優選地,互補融合蛋白與缺失B部分的融合蛋白基本上相同。然而優選地,根據本發明的蛋白結構是由根據本發明的重組融合蛋白作為重複結構單元組成的聚合物,即,根據本發明的蛋白結構是根據本發明的重組融合蛋白的聚合物。聚合物中融合單元的量值意指該蛋白結構獲得顯著的大小。在優選的實施方案中,蛋白結構在至少兩個維度上具有至少0.1μm的尺寸。如此,本文使用的術語"蛋白結構"涉及具有至少0.1μm的厚度的融合蛋白聚合物,優選地人眼可見的宏觀聚合物,即,具有至少1μm的厚度。術語"蛋白結構"不涵蓋無結構的聚集物或沉澱物。儘管融合蛋白的單體是水溶性的,應理解的是,根據本發明的蛋白結構是固態結構,即,不溶於水。該蛋白結構是包含根據本發明的重組融合蛋白作為重複結構單元單體的聚合物。優選地,根據本發明的蛋白結構是以選自由纖維(fiber)、膜(film)、泡沫(foam)、網狀物(net)、網(mesh)、球(sphere)和膠囊(capsule)組成的組的物理形態。優選地,根據本發明的蛋白結構是厚度為至少0.1μm、優選地至少1μm的纖維或膜。優選地,纖維或膜具有範圍在1-400μm、優選地60-120μm中的厚度。優選地,纖維具有範圍在0.5-300cm、優選地1-100cm中的長度。其他優選的範圍是0.5-30cm和1-20cm。纖維具有在物理操作期間保持完整的能力,即,可用於旋轉、編織、扭轉、鉤編和類似程序。膜是有利的,因為其是一致的並粘附於固體結構,例如,微量滴定板中的塑料製品。膜的這一特徵有助於洗滌和再生程序,對於分離目的是非常有用的。特別有用的蛋白結構是膜或纖維,其中B部分是衍生自葡萄球菌蛋白A的Z結構域或與其具有至少70%同一性的蛋白片段,參見例如,實施例1-6。還優選地,根據本發明的蛋白結構具有高於1MPa、優選地高於2MPa、更優選地10MPa或更高的抗張強度。優選地,根據本發明的蛋白結構具有高於100MPa、更優選地200MPa或更高的抗張強度。REP部分是包含70至300個胺基酸殘基的蛋白片段,並衍生自蜘蛛絲蛋白的重複片段。這意指,REP部分具有在富含丙氨酸的區段和富含甘氨酸的區段之間交替的重複性特徵。如以下將更詳細地解釋的,REP部分通常包含多於70,例如多於140且少於300,優選地少於240,例如少於200個胺基酸殘基,且自身可分成幾個L(接頭)區段、A(富含丙氨酸)區段和G(富含甘氨酸)區段。通常,所述接頭區段是任選的,位於REP部分末端,而剩餘的區段依次是富含丙氨酸和富含甘氨酸的。因此,REP部分通常可具有以下結構中的任何一種,其中n是整數:L(AG)nL,例如LA1G1A2G2A3G3A4G4A5G5L;L(AG)nAL,例如LA1G1A2G2A3G3A4G4A5G5A6L;L(GA)nL,例如LG1A1G2A2G3A3G4A4G5A5L;或L(GA)nGL,例如LG1A1G2A2G3A3G4A4G5A5G6L。其遵循:富含丙氨酸或富含甘氨酸的區段是否與N端或C端接頭區段相鄰不是關鍵的。優選n是2至10,優選地2至8,優選地4至8,更優選地4至6,即n=4、n=5或n=6的整數。在優選的實施方案中,根據本發明的REP部分的丙氨酸含量高於20%,優選地高於25%,更優選地高於30%且低於50%,優選地低於40%,更優選地低於35%。這是有利的,因為設想更高的丙氨酸含量提供更硬和/或更強和/或不太可延伸的結構。在某些實施方案中,REP部分不含脯氨酸殘基,即REP部分中不存在脯氨酸殘基。現在轉向構成根據本發明的REP部分的區段,應強調的是每個區段是單獨的,即,特定REP部分的任何兩個A區段、任何兩個G區段或任何兩個L區段可以是相同的或可以是不相同的。因此,每種類型的區段在特定REP部分內是相同的不是本發明的一般特徵。而是,以下公開內容為技術人員提供了如何設計單獨的區段並將其聚集成REP部分的指南,該REP部分從而被認為是來源於蜘蛛絲蛋白的重複片段,且構成根據本發明的功能性融合蛋白的一部分。每個單獨的A區段是具有8至18個胺基酸殘基的胺基酸序列。優選每個單獨的A區段包含13至15個胺基酸殘基。大多數或多於兩個的A區段包含13至15個胺基酸殘基,且少數例如一或兩個A區段包含8至18個胺基酸殘基例如8-12或16-18個胺基酸殘基也是可能的。這些胺基酸殘基中的絕大多數是丙氨酸殘基。更特別地,這些胺基酸殘基中的0至3個不是丙氨酸殘基,且剩餘的胺基酸殘基是丙氨酸殘基。因此,每個單獨的A區段中的所有胺基酸殘基毫無例外地或除了一、二或三個胺基酸殘基可以是任何胺基酸以外,都是丙氨酸殘基。優選取代丙氨酸的胺基酸是天然胺基酸,優選地單獨選自絲氨酸、穀氨酸、半胱氨酸和甘氨酸的組,更優選地是絲氨酸。當然,A區段中的一個或多個是全丙氨酸區段,而剩餘的A區段包含1-3個非丙氨酸的殘基,例如絲氨酸、穀氨酸、半胱氨酸或甘氨酸是可能的。在優選的實施方案中,每個A區段包含13-15個胺基酸殘基,包括10-15個丙氨酸殘基和0-3個上述非丙氨酸的殘基。在更優選的實施方案中,每個A區段包含13-15個胺基酸殘基,包括12-15個丙氨酸殘基和0-1個上述非丙氨酸的殘基。優選每個單獨的A區段與選自SEQIDNO:10的胺基酸殘基7-19、43-56、71-83、107-120、135-147、171-183、198-211、235-248、266-279、294-306、330-342、357-370、394-406、421-434、458-470、489-502、517-529、553-566、581-594、618-630、648-661、676-688、712-725、740-752、776-789、804-816、840-853、868-880、904-917、932-945、969-981、999-1013、1028-1042和1060-1073的組的胺基酸序列具有至少80%,優選地至少90%,更優選地95%,最優選地100%的同一性。該組的每個序列對應於EuprosthenopsaustralisMaSp1蛋白質的天然存在的序列的區段,該天然存在的序列經過克隆相應的cDNA而推斷得來,參見WO2007/078239。可選擇地,每個單獨的A區段與選自SEQIDNO:3的胺基酸殘基143-152、174-186、204-218、233-247和265-278的組的胺基酸序列具有至少80%,優選地至少90%,更優選地95%,最優選地100%的同一性。該組的每個序列對應於表達的、非天然蜘蛛絲蛋白的區段,這些蛋白具有在合適的條件下形成絲結構的能力。因此,在根據本發明的某些實施方案中,每個單獨的A區段與選自上述胺基酸區段的胺基酸序列相同。不期望被任何具體的理論束縛,設想根據本發明的A區段形成螺旋結構或β摺疊。如下計算遍及本說明書和所附權利要求書使用的術語「%同一性」。使用CLUSTALW算法(Thompson,J.D.,Higgins,D.G.和Gibson,T.J.,NucleicAcidsResearch,22:4673-4680(1994))比對查詢序列與靶序列。在對應所比對的序列中的最短序列的窗口上進行對比。對比每個位置的胺基酸殘基,並將在靶序列中具有相同對應物的查詢序列中的位置的百分比報告為%同一性。如對「%同一性」所描述的計算遍及本說明書和所附權利要求書使用的術語「%相似性」,但以下除外:疏水殘基Ala、Val、Phe、Pro、Leu、Ile、Trp、Met和Cys是相似的;鹼性殘基Lys、Arg和His是相似的;酸性殘基Glu和Asp是相似的;且親水性的、不帶電荷的殘基Gln、Asn、Ser、Thr和Tyr是相似的。在該上下文中剩餘的天然胺基酸Gly不與任何其他胺基酸相似。遍及本說明書,根據本發明的替代實施方案滿足相應百分比的相似性,而不是指定百分比的同一性。其他替代實施方案滿足指定百分比的同一性以及另一個較高百分比的相似性,選自對於每個序列的優選百分比的同一性的組。例如,某序列可以與另一序列70%相似;或其可以與另一序列70%相同;或其可以與另一序列70%相同且90%相似。此外,已從實驗數據推斷出每個單獨的G區段是12至30個胺基酸殘基的胺基酸序列。優選每個單獨的G區段由14至23個胺基酸殘基組成。每個G區段的至少40%的胺基酸殘基是甘氨酸殘基。通常,每個單獨的G區段的甘氨酸含量在40-60%的範圍內。優選每個單獨的G區段與選自SEQIDNO:10的胺基酸殘基20-42、57-70、84-106、121-134、148-170、184-197、212-234、249-265、280-293、307-329、343-356、371-393、407-420、435-457、471-488、503-516、530-552、567-580、595-617、631-647、662-675、689-711、726-739、753-775、790-803、817-839、854-867、881-903、918-931、946-968、982-998、1014-1027、1043-1059和1074-1092的組的胺基酸序列具有至少80%,優選地至少90%,更優選地95%,最優選地100%的同一性。該組的每個序列對應於EuprosthenopsaustralisMaSp1蛋白質的天然存在的序列的區段,該天然存在的序列從克隆相應的cDNA推斷得來,參見WO2007/078239。可選擇地,每個單獨的G區段與選自SEQIDNO:3的胺基酸殘基153-173、187-203、219-232、248-264和279-296的組的胺基酸序列具有至少80%,優選地至少90%,更優選地95%,最優選地100%的同一性。該組的每個序列對應於表達的、非天然蜘蛛絲蛋白的區段,所述蛋白具有在合適的條件下形成絲結構的能力。因此,在根據本發明的某些實施方案中,每個單獨的G區段與選自上述胺基酸區段的胺基酸序列相同。在某些實施方案中,根據本發明的每個G區段的前兩個胺基酸殘基不是-Gln-Gln-。根據本發明的G區段存在三種亞型。該分類基於對EuprosthenopsaustralisMaSp1蛋白質序列的仔細分析(WO2007/078239),並已在構建新穎、非天然蜘蛛絲蛋白中使用並驗證了該信息。根據本發明的G區段的第一種亞型由單字母胺基酸共有序列GQG(G/S)QGG(Q/Y)GG(L/Q)GQGGYGQGAGSS(SEQIDNO:11)代表。該第一種且通常不是最長的G區段亞型通常包含23個胺基酸殘基,但是可包含少至17個胺基酸殘基,且缺少帶電荷的殘基或包含一個帶電荷的殘基。因此,優選該第一種G區段亞型包含17-23個胺基酸殘基,但設想其可包含少至12個或多至30個胺基酸殘基。不期望被任何具體的理論束縛,設想該亞型形成捲曲結構或31-螺旋結構。該第一種亞型的代表性G區段是SEQIDNO:10的胺基酸殘基20-42、84-106、148-170、212-234、307-329、371-393、435-457、530-552、595-617、689-711、753-775、817-839、881-903、946-968、1043-1059和1074-1092。在某些實施方案中,根據本發明的該第一種亞型的每個G區段的前兩個胺基酸殘基不是-Gln-Gln-。根據本發明的G區段的第二種亞型由單字母胺基酸共有序列:GQGGQGQG(G/R)YGQG(A/S)G(S/G)S(SEQIDNO:12)代表。該第二種通常中間尺寸的G區段亞型通常包含17個胺基酸殘基且缺少帶電荷的殘基或包含一個帶電荷的殘基。優選該第二種G區段亞型包含14-20個胺基酸殘基,但設想其可包含少至12個或多至30個胺基酸殘基。不期望被任何具體的理論束縛,設想該亞型形成捲曲結構。該第二種亞型的代表性G區段是SEQIDNO:10的胺基酸殘基249-265、471-488、631-647和982-998;及SEQIDNO:3的胺基酸殘基187-203。根據本發明的G區段的第三種亞型由單字母胺基酸共有序列:G(R/Q)GQG(G/R)YGQG(A/S/V)GGN(SEQIDNO:13)代表。該第三種G區段亞型通常包含14個胺基酸殘基,且通常是根據本發明的G區段亞型中最短的。優選該第三種G區段亞型包含12-17個胺基酸殘基,但設想其可包含多至23個胺基酸殘基。不期望被任何具體的理論束縛,設想該亞型形成轉角結構。該第三種亞型的代表性G區段是SEQIDNO:10的胺基酸殘基57-70、121-134、184-197、280-293、343-356、407-420、503-516、567-580、662-675、726-739、790-803、854-867、918-931、1014-1027;及SEQIDNO:3的胺基酸殘基219-232。因此,在優選的實施方案中,每個單獨的G區段與選自SEQIDNO:11、SEQIDNO:12和SEQIDNO:13的胺基酸序列具有至少80%,優選地90%,更優選95%的同一性。在REP部分的A和G區段的交替序列的優選實施方案中,每隔一個G區段具有第一種亞型,而剩餘的G區段具有第三種亞型,例如...A1G短A2G長A3G短A4G長A5G短...。在REP部分的另一個優選實施方案中,第二種亞型的一個G區段通過插入而中斷G區段的規律性,例如...A1G短A2G長A3G中A4G短A5G長...。每個單獨的L區段代表可包含0至20個胺基酸殘基,例如0至10個胺基酸殘基的任選的接頭胺基酸序列。雖然該區段是任選的且對於蜘蛛絲蛋白不是功能上關鍵的,但是其存在仍允許根據本發明的完全功能性的蜘蛛絲融合蛋白形成蛋白結構。在從Euprosthenopsaustralis的MaSp1蛋白質推斷的胺基酸序列的重複部分(SEQIDNO:10)中也存在接頭胺基酸序列。特別地,接頭區段的胺基酸序列可能與所描述的A或G區段的任何一種相似,但是通常不足以滿足本文對其定義的標準。如WO2007/078239中所示的,設置在REP部分的C端部分的接頭區段可由富含丙氨酸的單字母胺基酸共有序列ASASAAASAASTVANSVS和ASAASAAA代表。實際上,第二序列可被認為是根據本發明的A區段,而第一序列與根據本發明的A區段具有高度的相似性。根據本發明的接頭區段的另一實例具有富含甘氨酸的單字母胺基酸序列GSAMGQGS並與根據本發明的G區段具有高度的相似性。接頭區段的另一實例是SASAG。代表性L區段是SEQIDNO:10的胺基酸殘基1-6和1093-1110;及SEQIDNO:3的胺基酸殘基138-142,但是本領域技術人員將易於認識到存在這些區段的許多合適的替代胺基酸序列。在根據本發明的REP部分的一個實施方案中,L區段中的一個包含0個胺基酸,即缺少L區段中的一個。在根據本發明的REP部分的另一個實施方案中,兩個L區段都包含0個胺基酸,即不含這兩個L區段。因此,根據本發明的REP部分的這些實施方案可示意性地表示如下:(AG)nL、(AG)nAL、(GA)nL、(GA)nGL;L(AG)n、L(AG)nA、L(GA)n、L(GA)nG;和(AG)n、(AG)nA、(GA)n、(GA)nG。這些REP部分中的任何一種適合與以下定義的任何CT部分一起使用。CT部分是包含70至120個胺基酸殘基的蛋白片段,並衍生自蜘蛛絲蛋白的C端片段。表述"衍生自"意指在根據本發明的CT部分的上下文中,它與蜘蛛絲蛋白的C端胺基酸序列具有高度的相似性。如圖1中所示,該胺基酸序列在各個物種和蜘蛛絲蛋白,包括MaSp1和MaSp2之間相當保守。以SEQIDNO:9提供了MaSp1和MaSp2的C端區域的共有序列。在圖1中,比對了以GenBank登記條目(如果可用)表示的下列MaSp蛋白質:表1–拖絲蛋白CT部分哪種特定的CT部分存在於根據本發明的蜘蛛絲蛋白中不是關鍵的,只要該CT部分沒有完全缺失。因此,根據本發明的CT部分可選自圖1和表1中示出的胺基酸序列或具有高度相似性的序列中的任何一種。多種多樣的C端序列可用在根據本發明的蜘蛛絲蛋白中。根據本發明的CT部分的序列與基於圖1的胺基酸序列的共有胺基酸序列SEQIDNO:9具有至少50%的同一性,優選地至少60%,更優選地至少65%的同一性,或甚至至少70%的同一性。根據本發明的代表性的CT部分是Euprosthenopsaustralis序列SEQIDNO:7。因此,根據本發明的一個優選方面,CT部分與SEQIDNO:7或圖1和表1中的任何單獨的胺基酸序列具有至少80%、優選地至少90%、例如至少95%的同一性。在本發明的優選方面中,CT部分與SEQIDNO:7或圖1和表1中的任何單獨的胺基酸序列相同。CT部分通常由70至120個胺基酸殘基組成。優選CT部分包含至少70、或多於80、優選地多於90個胺基酸殘基。還優選CT部分包含至多120、或少於110個胺基酸殘基。典型的CT部分包含約100個胺基酸殘基。任選的NT部分是包含100至160個胺基酸殘基的蛋白片段,並衍生自蜘蛛絲蛋白的N端片段。表述"衍生自"意指在根據本發明的NT部分的上下文中,它與蜘蛛絲蛋白的N端胺基酸序列具有高度的相似性。如圖2中所示,該胺基酸序列在各個物種和蜘蛛絲蛋白,包括MaSp1和MaSp2之間相當保守。在圖2中,比對了以GenBank登記條目(如果可用)表示的以下拖絲蛋白NT部分:表2-拖絲蛋白NT部分對每個序列顯示僅對應N端部分的部分,省略了信號肽。Ncflag和NImflag根據RisingA.等人.Biomacromolecules7,3120-3124(2006)翻譯和編輯。哪種特定的NT部分存在於根據本發明的蜘蛛絲蛋白中不是關鍵的。因此,根據本發明的NT部分可選自圖2中示出的胺基酸序列或具有高度相似性的序列中的任何一種。多種多樣的N端序列可用在根據本發明的蜘蛛絲蛋白中。基於圖2的同源序列,以下序列構成共有NT胺基酸序列:QANTPWSSPNLADAFINSF(M/L)SA(A/I)SSSGAFSADQLDDMSTIG(D/N/Q)TLMSAMD(N/S/K)MGRSG(K/R)STKSKLQALNMAFASSMAEIAAAESGG(G/Q)SVGVKTNAISDALSSAFYQTTGSVNPQFV(N/S)EIRSLI(G/N)M(F/L)(A/S)QASANEV(SEQIDNO:8).根據本發明的NT部分的序列與共有胺基酸序列SEQIDNO:8(其基於圖2的胺基酸序列)具有至少50%的同一性、優選至少60%的同一性。在優選的實施方案中,根據本發明的NT部分的序列與共有胺基酸序列SEQIDNO:8具有至少65%的同一性、優選至少70%的同一性。在優選的實施方案中,根據本發明的NT部分進一步地與共有胺基酸序列SEQIDNO:8具有70%、優選80%的相似性。根據本發明的代表性NT部分是Euprosthenopsaustralis序列SEQIDNO:6。根據本發明的優選實施方案,NT部分與SEQIDNO:6或圖1中的任何單獨的胺基酸序列具有至少80%同一性。在本發明的優選實施方案中,NT部分與SEQIDNO:6或圖2中的任何單獨的胺基酸序列具有至少90%、諸如至少95%的同一性。在本發明的優選實施方案中,NT部分與與SEQIDNO:6或圖1中的任何單獨的胺基酸序列、尤其是與EaMaSp1相同。NT部分包含100至160個胺基酸殘基。優選NT部分包含至少100、或多於110、優選地多於120個胺基酸殘基。還優選NT部分包含至多160、或少於140個胺基酸殘基。典型的NT部分包含大約130-140個胺基酸殘基。B部分是包含多於30個胺基酸殘基的蛋白或多肽片段。B部分優選地包含多於40個胺基酸殘基,諸如多於50個胺基酸殘基。B部分優選地包含少於500個胺基酸殘基,諸如少於200個胺基酸殘基、更優選地少於100個胺基酸殘基,諸如少於100個胺基酸殘基。其能夠與有機靶選擇性相互作用,且融合蛋白中是B部分提供與有機靶選擇性相互作用的能力。B部分是非拖絲蛋白部分。這是意指,其不是衍生自蜘蛛絲蛋白,即,其與蜘蛛絲蛋白具有低(或無)程度的同一性和/或相似性。根據本發明的B部分的序列優選地與本文公開的拖絲蛋白胺基酸序列的任一種、具體地與SEQIDNO:6-10的任一種具有少於30%同一性、諸如少於20%同一性、優選地少於10%同一性。選擇B部分被認為是在本領域普通技術人員能力範圍內的。然而,以下為了示例起見,提供了可證明用作B部分的親和配體的實例、以及用於檢測和/或定量的形式和條件的實例。選擇親和配體所需的生物分子多樣性可通過組合改造多個可能的支架分子之一來產生,然後利用適當的選擇平臺選擇特異性和/或選擇性親和配體。可用於針對有機靶產生親和配體的此類結構的非限制性實例是葡萄球菌蛋白A和其結構域、和這些結構域的衍生物,諸如Z結構域(NordK等人.(1997)Nat.Biotechnol.15:772-777);脂籠蛋白(BesteG等人.(1999)Proc.Natl.Acad.Sci.U.S.A.96:1898-1903);錨蛋白重複結構域(BinzHK等人.(2003)J.Mol.Biol.332:489-503);纖維素結合結構域(CBD)(SmithGP等人.(1998)J.Mol.Biol.277:317-332;LehtioJ等人.(2000)Proteins41:316-322);γ晶體蛋白(crystallines)(FiedlerU和RudolphR,WO01/04144);綠色螢光蛋白(GFP)(PeelleB等人.(2001)Chem.Biol.8:521-534);人類細胞毒性T淋巴細胞相關抗原4(CTLA-4)(HuftonSE等人.(2000)FEBSLett.475:225-231;IrvingRA等人.(2001)J.Immunol.Meth.248:31-45);蛋白酶抑制劑,諸如Knottin蛋白(WentzelA等人.(2001)J.Bacteriol.183:7273-7284;BaggioR等人.(2002)J.Mol.Recognit.15:126-134)和Kunitz結構域(RobertsBL等人.(1992)Gene121:9-15;DennisMS和LazarusRA(1994)J.Biol.Chem.269:22137-22144);PDZ結構域(SchneiderS等人.(1999)Nat.Biotechnol.17:170-175);肽適體,諸如硫氧還蛋白(LuZ等人.(1995)Biotechnology13:366-372;KlevenzB等人.(2002)Cell.Mol.LifeSci.59:1993-1998);葡萄球菌核酸酶(NormanTC等人.(1999)Science285:591-595);澱粉酶抑肽(McConellSJ和HoessRH(1995)J.Mol.Biol.250:460-479;LiR等人.(2003)ProteinEng.16:65-72);基於纖連蛋白III型結構域的trinectins(KoideA等人.(1998)J.Mol.Biol.284:1141-1151;XuL等人.(2002)Chem.Biol.9:933-942);和鋅指(BianchiE等人.(1995)J.Mol.Biol.247:154-160;KlugA(1999)J.Mol.Biol.293:215-218;SegalDJ等人.(2003)Biochemistry42:2137-2148)。上述實例包括展現用於產生新的結合特異性的單個隨機化環的支架蛋白,具有其中從蛋白表面突出的側鏈被隨機化以產生新的結合特異性的剛性二級結構的蛋白支架,和展現用於產生新的結合特異性的非連續高變性環區的支架。寡核苷酸也可用作親和配體。稱為適體或誘餌(decoy)的單鏈核酸,摺疊為充分確定的三維結構並以高的親和性和特異性結合其靶。(EllingtonAD和SzostakJW(1990)Nature346:818-822;BrodyEN和GoldL(2000)J.Biotechnol.74:5-13;MayerG和JenneA(2004)BioDrugs18:351-359)。寡核苷酸配體可以是RNA或DNA,並可結合寬範圍的靶分子種類。對於從上述支架結構的任一種的變體池選擇期望的親和配體,大量選擇平臺可用於分離針對所選靶蛋白的特定新配體。篩選平臺包括但不限於,噬菌體展示(SmithGP(1985)Science228:1315-1317)、核糖體展示(HanesJ和PltickthunA(1997)Proc.Natl.Acad.Sci.U.S.A.94:4937-4942)、酵母雙雜交系統(FieldsS和Song0(1989)Nature340:245-246)、酵母展示(GaiSA和WittrupKD(2007)CurrOpinStructBiol17:467-473)、mRNA展示(RobertsRW和SzostakJW(1997)Proc.Natl.Acad.Sci.U.S.A.94:12297-12302)、細菌展示(DaughertyPS(2007)CurrOpinStructBiol17:474-480,KronqvistN等人.(2008)ProteinEngDesSel1-9,HarveyBR等人.(2004)PNAS101(25):913-9198)、微珠展示(NordO等人.(2003)JBiotechnol106:1-13,WO01/05808)、SELEX(配體指數富集的系統進化(SystemEvolutionofLigandsbyExponentialEnrichment))(TuerkC和GoldL(1990)Science249:505-510)和蛋白片段互補檢驗(PCA)(RemyI和MichnickSW(1999)Proc.Natl.Acad.Sci.U.S.A.96:5394-5399)。對免疫球蛋白、白蛋白或其他有機靶具有親和性的B部分的優選的組是細菌receptin結構域或其衍生物。優選的B部分的組能夠與免疫球蛋白和包含免疫球蛋白或其衍生物的分子選擇性相互作用。免疫球蛋白亞類的優選的組是被衍生自葡萄球菌蛋白A的Z結構域識別的亞類,即,來自人類的IgG1、IgG2、IgG4、IgA和IgM、來自兔和牛的所有Ig亞類、來自豚鼠的IgG1和IgG2、和來自小鼠的IgG1、IgG2a、IgG2b、IgG3和IgM(參見Hober,S.等人,J.ChromatogrB.848:40-47(2007))、更優選地來自人類的免疫球蛋白亞類IgG1、IgG2、IgG4、IgA和IgM。免疫球蛋白亞類的另一優選的組是被C2結構域鏈球菌蛋白G識別的亞類;即,IgG的所有人類亞類,包括IgG3、和來自多種動物,包括小鼠、兔和綿羊的IgG。優選的B部分的一個組選自以下組成的組:衍生自葡萄球菌蛋白A的Z結構域、葡萄球菌蛋白A和其結構域,優選地E、D、A、B或C結構域、鏈球菌蛋白G和其結構域,優選地C1、C2和C3結構域;和與這些胺基酸序列的任一種具有至少70%同一性、諸如至少80%同一性、或至少90%同一性的蛋白片段。優選地,B部分選自以下組成的組:衍生自葡萄球菌蛋白A的Z結構域、葡萄球菌蛋白A的B結構域、和鏈球菌蛋白G的C2結構域;和與這些胺基酸序列的任一種具有至少70%同一性、諸如至少80%同一性、或至少90%同一性的蛋白片段。優選地,B部分選自以下組成的組:衍生自葡萄球菌蛋白A的Z結構域、和與這一胺基酸序列具有至少70%同一性、諸如至少80%同一性、或至少90%同一性的蛋白片段。優選地,B部分選自以下組成的組:衍生自葡萄球菌蛋白A的Z結構域和鏈球菌蛋白G的C2結構域,參見例如,實施例1-6和8。對免疫球蛋白具有親和性的B部分的優選的組是細菌receptin結構域或其衍生物。優選的B部分的另一組能夠與白蛋白和包含白蛋白或其衍生物的分子選擇性相互作用。對白蛋白具有親和性的B部分的優選的組是細菌receptin結構域或其衍生物。優選的B部分選自鏈球菌蛋白G、鏈球菌蛋白G的白蛋白結合結構域、來自大芬戈爾德菌(Finegoldiamagna)的GA模塊;和與這些胺基酸序列的任一種具有至少70%同一性、諸如至少80%同一性、或至少90%同一性的蛋白片段。優選地,B部分選自鏈球菌蛋白G的白蛋白結合結構域、和與其具有至少70%同一性、諸如至少80%同一性、或至少90%同一性的蛋白片段。優選地,B部分是鏈球菌蛋白G的白蛋白結合結構域,參見例如,實施例7。優選的B部分的另一組能夠與生物素和包含生物素或其衍生物或類似物的分子選擇性相互作用。優選的B部分選自以下組成的組:鏈黴親和素、單體鏈黴親和素(M4);和與這些胺基酸序列的任一種具有至少70%同一性、諸如至少80%同一性、或至少90%同一性的蛋白片段。優選地,B部分是單體鏈黴親和素(M4),參見例如,實施例10-12。根據本發明的具體融合蛋白和蛋白結構在實施例中提供。這些優選的融合蛋白形成由SEQIDNO14、16、18、22、24和26組成的組。另外優選的融合蛋白與這些序列的任一種具有至少80%、優選地至少90%、更優選地至少95%的同一性。本發明還提供編碼根據本發明的融合蛋白的分離的多核酸。具體地,具體的多核酸在實施例和所附的序列表中提供,例如,SEQIDNO15、17、19、23、25和27。另外優選的多核酸編碼與SEQIDNO14、16、18、22、24和26的任一種具有至少80%、優選地至少90%、更優選地至少95%的同一性的融合蛋白。根據本發明的多核酸可用於產生根據本發明的融合蛋白。本發明提供了製備融合蛋白的方法。第一步驟包括在合適的宿主中表達根據本發明的融合蛋白。合適的宿主是本領域技術人員熟知的且包括,例如細菌和真核細胞,例如酵母、昆蟲細胞系和哺乳動物細胞系。通常,該步驟包括在大腸桿菌中表達編碼該融合蛋白的多核酸分子。方法的第二步驟包括獲得包含該融合蛋白的混合物。混合物可例如通過裂解或機械破壞宿主細胞獲得。如果宿主細胞分泌融合蛋白,還可通過收集細胞培養基獲得混合物。可使用標準方法分離由此獲得的蛋白質。如需要的話,該混合物可進行離心,並收集合適的部分(沉澱或上清液)。包含融合蛋白的混合物還可進行凝膠過濾、層析例如陰離子交換層析、透析、相分離或過濾以導致分離。任選地,脂多糖和其他熱原在該階段被有效地去除。如需要的話,可在該步驟中通過裂解去除接頭肽。根據本發明的蛋白結構在適當的條件下從根據本發明的融合蛋白自發地組裝,並且組裝為聚合物由剪切力和/或兩個不同相之間的界面的存在而促進,所述界面例如,固相與液相之間、氣相與液相之間、或在疏水/親水界面,例如,礦物油-水界面。所得的界面的存在刺激在界面或在界面周圍區域中聚合,該區域延伸進入液體介質,從而所述聚合在所述界面或在所述界面區域中開始。通過修改組裝期間的條件,可產生多種蛋白結構。例如,如果允許組裝在從一側向一側輕微擺動的容器中發生,則在空氣-水界面形成纖維。如果允許混合物靜置,則在空氣-水界面形成膜。如果蒸發混合物,則在容器底部形成膜。如果向含水混合物的頂部加入油,則在油-水界面形成膜,無論允許靜置或擺動。如果混合物起泡沫,例如,通過鼓入空氣或甩動,如果允許乾燥,則泡沫是穩定的並固化如此,本發明提供用於提供展示對有機靶的結合活性的蛋白結構的方法。在第一方法步驟中,提供了根據本發明的重組融合蛋白。融合蛋白可例如,通過在適當的宿主中從根據本發明的多核酸表達來提供。在第二方法步驟中,對融合蛋白進行實現形成包含重組融合蛋白的聚合物的條件。注意,儘管自發地組裝的蛋白結構可在六氟異丙醇中溶解,溶解的融合蛋白隨後不能夠自發地再次組裝為例如,纖維。蛋白結構可用作固定有機靶的親和性介質的部分,其中B部分能夠與該有機靶選擇性相互作用。樣品,例如,生物樣品可施加到能夠結合該生物樣品中存在的有機靶的根據本發明的融合蛋白或蛋白結構,然後融合蛋白或蛋白結構可用於從樣品分離有機靶。可對已經從受治療者取出的生物樣品,諸如血液、血清或血漿進行有機靶的檢測、分離和/或定量。如此,本發明提供從樣品分離有機靶的方法。提供了包含有機靶的樣品,例如,生物樣品,諸如血液、血清或血漿。生物樣品可以是較早獲得的樣品。如果在方法中使用較早獲得的樣品,方法的步驟都不是對人類或動物體進行的。提供了根據本發明的親和性介質,其包含根據本發明的融合蛋白或蛋白結構。在某些實施方案中,親和性介質由根據本發明的融合蛋白或蛋白結構組成。親和性介質能夠藉助根據本發明的融合蛋白中的B部分與有機靶選擇性相互作用。在實現親和性介質與有機靶之間結合的適當條件下將親和性介質與樣品接觸。在保持親和性介質與有機靶之間選擇性結合的適當條件下除去未結合的樣品。這一方法導致有機靶被固定於根據本發明的親和性介質,具體地被固定於融合蛋白。在根據本發明的優選的方法中,當親和性介質與樣品接觸以實現親和性介質與有機靶之間的結合時,親和性介質中的融合蛋白作為根據本發明的蛋白結構存在。在這一方面,特別有用的蛋白結構是膜或纖維,其中B部分是衍生自葡萄球菌蛋白A的Z結構域或與其具有至少70%同一性,諸如至少80%同一性、或至少90%同一性的蛋白片段,參見例如,實施例1-6。膜是有利的,因為其粘附於固體結構,例如,微量滴定板中的塑料製品。膜的這一特徵有助於洗滌和再生程序,對於分離目的是非常有用的。已經令人驚訝地觀察到,當作為根據本發明的蛋白結構中的根據本發明的融合蛋白的部分時,Z結構域的鹼穩定性可甚至被增強。這一特徵對於洗滌和再生目的可以是非常有用的,例如,允許高濃度的NaOH,諸如0.1M、0.5M、1M或甚至高於1M,例如,2M,和/或允許高濃度的脲,例如,6-8M。化學穩定性還可用於允許為了親和純化反覆周期地使用Z結構域。這一鹼穩定性可通過利用Z結構域的穩定的突變體來進一步增加。另外,已經有利地顯示,包括Z結構域的根據本發明的融合蛋白是熱穩定的。這允許加熱滅菌並保持結合能力。具有Z結構域的傳統親和性基質的一個已知問題是Z結構域從親和性基質的洩漏。由於Z結構域被肽鍵穩定地摻入本發明的融合蛋白中,預計Z結構域從根據本發明的蛋白結構的不期望的洩露是低的或不存在。根據本發明的融合蛋白的另一優點是,所得的蛋白結構具有高密度的Z結構域(或其他B部分)。預計這一高密度提供高結合能力。總之,融合蛋白的這些特徵對於多種B部分是非常有吸引力的,尤其是對於以良好的生產經濟使用蛋白Z的親和純化。這些特徵在以傳統凝膠珠親和柱以外的形式也是有用的,例如,以濾器樣的形式。固定的有機靶能夠與第二有機靶選擇性相互作用。然後該方法還包括在實現第一和第二有機靶之間的結合的適當條件下,將所述親和性介質和固定的有機靶與第二有機靶接觸的步驟,第二有機靶能夠與第一有機靶選擇性相互作用。固定的有機靶是可檢測和/或可定量的。有機靶的檢測和/或定量可以以本領域技術人員已知用於檢測和/或定量結合試劑的任何方式、以基於多種生物或非生物相互作用的檢驗實現。有機靶本身可以用多種標誌物標記,或可轉而由第二、標記的親和配體檢測以允許檢測、可視化和/或定量。這可使用許多標記的任何一種或多種實現,所述標記可與有機靶或任何第二親和配體軛合,使用本領域技術人員已知的許多技術的任何一種或多種實現,如此不牽涉任何過度的實驗。可與有機靶和/或第二親和配體軛合的標記的非限制性實例包括,螢光染料或金屬(例如,螢光素、羅丹明、藻紅蛋白、螢光胺)、發色染料(例如,視紫質)、化學發光化合物(例如,魯米那、咪唑)和生物發光蛋白(例如,螢光素、螢光素酶)、半抗原(例如,生物素)。多種其他可用的螢光劑和發色團描述在StryerL(1968)Science162:526-533,BrandL和GohlkeJR(1972)Annu.Rev.Biochem.41:843-868。有機靶和/或第二親和配體還可用酶(例如,辣根過氧化物酶、鹼性磷酸酶、β-內醯胺酶)、放射性同位素(例如,3H、14C、32P、35S或125I)和顆粒(例如,金)標記。在本公開內容的上下文中,"顆粒"是指適於標記分子的顆粒,諸如金屬顆粒。另外,親和配體還可用螢光半導體納米晶體(量子點)標記。量子點具有極佳的量子產量,比有機螢光團更耐光,因此更容易檢測(Chan等人.(2002)CurrOpiBiotech.13:40-46)。不同類型的標記可使用多種化學反應軛合於有機靶或第二親和配體,例如,胺反應或硫醇反應。然而,可使用胺和硫醇以外的其他反應基團,例如,醛、羧酸和穀氨醯胺。如果檢測和/或定量包括暴露於第二有機靶或第二親和配體,再次用緩衝液洗滌親和性介質以除去未結合的第二親和配體。舉例來說,第二親和配體可以是抗體或其片段或衍生物。之後,可以用常規方法檢測和/或定量有機靶。對第二親和配體的結合特徵可以變化,但本領域技術人員將能夠通過常規實驗確定對每種確定有效和最佳的檢驗條件。標記的分子的檢測、定位和/或定量可包括可視化技術,諸如光顯微術或免疫螢光顯微術。其他方法可包括經由流式細胞術或發光測定法檢測。標記可視化的方法可包括但不限於,螢光測定、發光測定和/或酶促技術。螢光通過如下檢測和/或定量:將螢光標記暴露於特定波長的光,之後檢測和/或定量特定波長區域中的發射光。發光標記的分子的存在可由在化學反應期間發生的發光檢測和/或定量。酶反應的檢測是由於化學反應導致的樣品的色移。本領域技術人員知曉,為了適當的檢測和/或定量,可修改多種不同的實驗方案。用於檢測和/或定量有機靶的一種可得的方法是通過將其或第二親和配體與酶連接,隨後可在酶免疫測定(諸如EIA或ELISA)中檢測和/或定量該酶。此類技術是充分建立的,其實現對本領域技術人員不產生任何過度的困難。在此類方法中,將生物樣品與結合有機靶的根據本發明的蛋白結構接觸,然後用酶促標記的第二親和配體檢測和/或定量。之後,在適當的緩衝液中,將適當的底物與酶促標記反應產生化學部分,例如使用分光光度計、螢光計、光度計或通過可見手段檢測和/或定量。有機靶或第二親和配體可用放射性同位素標記以使得能夠檢測和/或定量。本公開內容中適當的放射性標記的非限制性實例是3H、14C、32P、35S或125I。標記的親和配體的比活性依賴於放射性標記的半衰期、同位素純度,和標記如何被摻入親和配體。親和配體優選地使用公知技術標記(WenselTG和MearesCF(1983)於:RadioimmunoimagingandRadioimmunotherapy(BurchielSW和RhodesBA編著)Elsevier,NewYork,pp185-196中)。如此放射性標記的親和配體可用於通過檢測放射性顯現有機靶。放射性核素掃描可用以下進行,例如,γ射線照相機、磁共振光譜學、發射斷層照相術、γ射線/β射線計數器、閃爍計數器和放射照相術。如此,可向蛋白結構施加樣品以檢測、分離和/或定量有機靶。這一程序使得能夠不僅檢測有機靶,而且另外可顯示其分布和相對水平。任選地,可從親和性介質釋放有機靶並收集。如此,用途可包括在其上已經固定有機靶的親和性介質上親和純化。蛋白結構可例如布置在柱中或多孔板(諸如96孔板)中、或在磁珠、瓊脂糖珠或sepharose珠上。另外,用途可包括蛋白結構在可溶基質上的用途,例如使用葡聚糖基質,或在表面等離子共振儀器諸如BiacoreTM儀器中的用途,其中分析可例如包括監測對固定的有機靶或多種可能的親和配體的親和性。根據本發明的蛋白結構可被洗滌並用多種清潔劑,包括酸、鹼和離液劑再生。尤其有用的清潔劑包括NaOH,諸如0.1、0.5或1MNaOH,和脲,諸如6-8M脲。由於根據本發明的蛋白結構令人驚訝地耐受化學處理和/或滅菌性熱處理,包括使用蛋白結...
