鋰基電池組的電化學電池的製作方法
2023-07-04 12:57:06 3
二次或可再充電的鋰離子電池組通常用於多種固定和可攜式裝置,例如,在消費型電子、汽車和航天工業中遇到的那些裝置。鋰類型的電池組因多種原因得到普及,包括相對高的能量密度、與其它種類的可再充電電池組相比時一般不出現任何記憶效應、相對低的內阻和不使用時的低自放電率。鋰電池組在其它使用壽命期間經歷重複的功率循環的能力使其成為一種引人注目的並可靠的電源。
技術實現要素:
形成電化學電池。電化學電池包括與鋰離子可滲透的負電極集流體接觸設置的非鋰負電極。同樣,電化學電池包括與鋰離子可滲透的正電極集流體接觸設置的正電極。非鋰負電極和正電極是鋰離子可滲透的。電化學電池也具有包括鋰離子的鋰源電極。將相應微孔聚合物隔膜置於鋰源電極與非鋰負電極和正電極中每一者之間;或將第一微孔聚合物隔膜置於鋰源電極與非鋰負電極和正電極中的一者之間,及將第二微孔聚合物隔膜置於非鋰負電極與正電極之間。將電解質引入電化學電池中。將電壓施加於電化學電池上以利用來自鋰源電極的鋰離子預鋰化非鋰負電極和正電極中的任一者。
本文所公開的電化學電池的實例可形成鋰離子電池組或鋰硫電池組。
附圖說明
本發明的實例的特徵通過參考以下詳細說明和圖式而將變得顯而易見,其中同樣的參考數字對應於類似的但可能不相同的部件。為了簡潔起 見,具有前述功能的參考數字或特徵可或不可連同其出現在其中的其它圖式而加以描述。
圖1為本文所公開的電化學電池的一個實例的橫截面圖;
圖2為本文所公開的電化學電池的另一個實例的橫截面圖;
圖3為本文所公開的在電化學電池中包括兩個子電池的電化學電池的實例的橫截面圖;
圖4為本文所公開的在電化學電池中包括兩個子電池的電化學電池的另一個實例的橫截面圖;
圖5為包括鋰化正電極和負電極的電化學測試電池的結構的示意圖;
圖6包括分別說明三對不同電極的電壓隨時間的差異的三個圖;及
圖7包括分別說明圖5的電化學測試電池中一個電極的阻抗相對於圖5的電化學測試電池中另一個電極的阻抗的五個圖。
具體實施方式
鋰基電池組通常通過使鋰離子在負電極(有時稱為陽極)與正電極(有時稱為陰極)之間可逆地傳遞來進行操作。負電極和正電極位於浸泡有適於傳導鋰離子的電解質溶液的微孔聚合物隔膜的相對側上。每個電極也與相應集流體相關聯,所述集流體通過允許電流在負電極與正電極之間傳遞的可中斷的外電路連接。另外,可將參考電極引入鋰基電池組中以監測正電極、負電極或兩種電極的電荷狀態。
在一些情況中,在形成功能性鋰基電池組之前,負電極通過將負電極添加到浸在電解質中的半電池進行預鋰化。將電壓施加到半電池上以完成負電極的預鋰化。當負電極在半電池中預鋰化時,包括額外的製造步驟以形成鋰基電池組。額外步驟包括從半電池移動負電極,及接著清洗、乾燥負電極、並將負電極放在包括上述其它部件的鋰基電池組中。形成全電池的額外步驟可增加生產成本,並也可通過將負電極暴露於空氣中的溼氣或氧氣而減小鋰基電池組的壽命循環。在插入全電化學電池前,負電極也可 能在清洗和乾燥過程期間損壞。
此外,在形成鋰基電池組的額外步驟期間,可能難以將負電極移向電池組。這是部分地在預鋰化期間因負電極活性材料的大體積膨脹導致的負電極的變形所造成的。已發現具有高比容量的負電極活性材料(例如,矽顆粒)在負電極於半電池中的預鋰化(即,初始充電)期間也具有大體積膨脹。在預鋰化期間負電極活性材料所經歷的大體積變化(例如,約300%)引起負電極活性材料膨脹。負電極活性材料的膨脹可引起負電極變形。舉例而言,變形可改變負電極的曲率。負電極的變化曲率可使電極更難以轉移到鋰基電池組中。
為了形成本文中的電化學電池的實例,方法包括形成電化學電池,其可原位預鋰化以形成鋰離子或鋰硫電池組。所述電化學電池包括非鋰負電極和正電極,其為鋰離子可滲透的。在方法開始時(即在預鋰化前),在一些情況中,電極不包括鋰。部分地由於非鋰電極的鋰離子滲透性,可進行原位預鋰化。原位預鋰化消除進行任何額外製造步驟的需求以形成全電化學電池(例如,鋰基電池組)。通過消除任何額外的製造步驟,部分地因為未暴露於空氣中的氧氣或溼氣,所以可延長鋰基電池組的壽命周期。此外,原位預鋰化消除了先前提及的在半電池中的預鋰化後進行的清洗和乾燥過程,因此消除由此導致的變形的可能性。
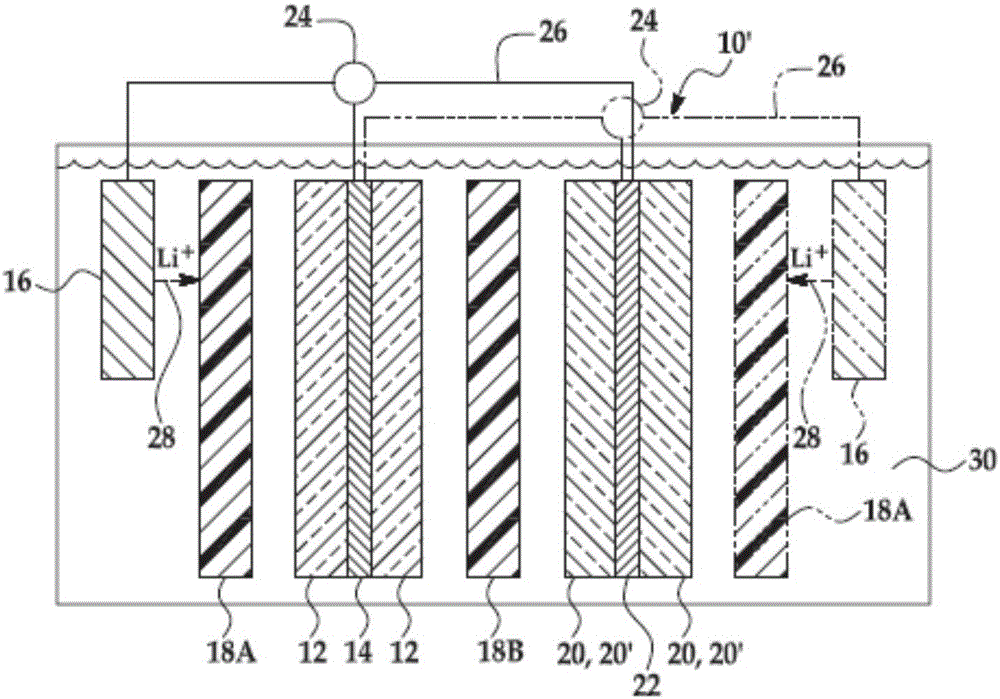
在本文所公開的方法的實例中,可形成電化學電池10。圖1中展示可形成的電化學電池10的實例。在此實例中,電化學電池10包括與鋰離子可滲透的負電極集流體14接觸的非鋰負電極12。電化學電池10也包括與鋰離子可滲透的正電極集流體22接觸的正電極20、20』。電化學電池10進一步包括鋰源電極16,其中第一微孔聚合物隔膜18A和第二微孔聚合物隔膜18B置於鋰源電極16與非鋰負電極12和正電極20、20』中的每一者之間。
在實例中,非鋰負電極12包括含有非鋰的負活性材料。含有非鋰的負活性材料不含鋰。在實例中,負活性材料可選自由以下各者組成的群組:石墨或另一種導電碳、焦炭、軟碳、硬碳、無定形碳、矽、鋁、錫、或Si、Al、和/或Sn的合金、矽-碳複合物、氧化矽(例如,SiOxx<2)、氧化錫和 氧化鈦。導電碳的一些實例包括天然石墨,例如鱗狀石墨、片狀石墨和其它類型的石墨;由例如石油焦炭、煤焦炭、纖維素、多糖和中間相瀝青得到的高溫燒結的碳產品;人造石墨,包括熱解石墨;碳黑,例如乙炔黑、爐黑、科琴碳黑、槽黑、燈黑和熱裂黑;柏油瀝青、煤焦油、活性碳、中間相瀝青和聚乙炔。
應了解,非鋰負電極12為鋰離子可滲透的。此滲透性是部分地由負活性材料所致的,其雖然不是由鋰形成,但為鋰離子可滲透的。此外,非鋰負電極12可為多孔的,且孔可允許鋰離子滲透負電極12。
非鋰負電極12可進一步包括粘合劑和導電性填料。可包括粘合劑以有助於將負活性材料粘附在一起及有助於將非鋰負電極12粘附到鋰離子可滲透的負電極集流體14。粘合劑材料的選擇可以寬泛地變化,只要其對於負電極12中的其它材料是惰性的。用於非鋰負電極12的粘合劑的一些實例可包括聚四氟乙烯、聚偏二氟乙烯(PVdF)、聚環氧乙烷(PEO)、乙烯丙烯二烯單體(EPDM)橡膠、羧甲基纖維素(CMC)、苯乙烯-丁二烯橡膠(SBR)、苯乙烯-丁二烯橡膠羧甲基纖維素(SBR-CMC)、聚丙烯酸(PAA)、交聯的聚丙烯酸-聚乙烯亞胺、聚醯亞胺、丙烯酸酯、甲基丙烯酸酯、二乙烯基醚或技術人員已知的任何其它合適的粘合劑材料。其它合適的粘合劑包括聚乙烯醇(PVA)、海藻酸鈉或其它水溶性粘合劑。
可包括導電性填料以確保鋰離子可滲透的負電極集流體14與負活性材料之間的電子傳導。導電性填料的一些實例可為高表面積碳,例如乙炔黑(即,碳黑)。合適的導電性填料的其它實例包括石墨烯、石墨、碳納米管、活性碳纖維、非活性碳纖維、金屬片、金屬粉末、金屬纖維、碳織物、金屬網和導電聚合物。在又另一個實例中,使用導電性填料(例如碳黑和碳納米纖維)的組合。
不含鋰的負電極12可通過將電極組分的漿料施用於鋰離子可滲透的負電極集流體14,然後乾燥漿料以形成不含鋰的負電極12而形成。在一實例中,將電極組分的漿料施用到鋰離子可滲透的負極集流體14的兩側。在另一個實例中,漿料可施用於一側,並可滲透集流體14的孔以基本上塗覆集流體14的另一側。在任一實施例中,應理解,電極組分的漿料也 可以基本上填充鋰離子可滲透的負電極集流體14的孔並塗覆側面。
在一實例中,鋰離子可滲透的負電極集流體14可以由銅網、鎳網、多孔碳紙(例如,由納米纖維、納米管、纖維和/或石墨烯構成)或任何其它適當的導電材料形成。應了解,負電極集流體14可以呈允許鋰離子通過集流體14的任何形式。例如,鋰離子可滲透的負電極集流體14可以呈以下各種形式:泡沫、網格、網狀物、編織纖維、蜂窩、金屬箔上的圖案化孔、金屬箔上的穿孔、金屬化塑料薄膜、膨脹金屬網格、金屬棉、微型桁架、碳纖維織物、織造碳網、非織造碳網、碳氈或其組合。集流體14可具有範圍為約1nm到約10μm的平均孔徑。集流體14可以通過範圍為約0.1%至約99.9%的平均孔對表面比或孔隙度來表徵。在一實例中,平均孔對表面比或孔隙度為至少10%。所選擇的鋰離子可滲透的負電極集流體14應為鋰離子可滲透的並且能夠將自由電子收集並移動到與之連接的外電路和從與之連接的外電路收集並移動自由電子。
正電極20、20』的實例包括正活性材料、粘結劑和導電填料。正電極20、20』的粘結劑和導電填料可以選自本文所描述的用於非鋰負電極12的粘結劑和導電填料的相同實例。
在一些實施例中,正電極20可以由不含鋰的正活性材料形成,所述正活性材料可以作為鋰離子電池的正電極。一種常見類型的適用於正電極20的已知非鋰正活性材料包括層狀過渡金屬氧化物。正活性材料的一些具體實例包括氧化錳(Mn2O4)、氧化鈷(CoO2)、鎳錳氧化物尖晶石、層狀的鎳錳鈷氧化物或鐵聚陰離子氧化物,例如磷酸鐵(FePO4)或氟磷酸鐵(FePO4F)或氧化釩(V2O5)。當正電極20為待使用本文所公開的實施方法預理化的電極20時,非鋰正電極20可以是合乎需要的。
在一些其它實施例中,鋰離子電池的正活性材料可以是含鋰的活性材料。在這些情況下,正電極未經預鋰化,而是包括一定量的鋰,所述鋰的量少於正電極的總容量(例如,為總容量的約10%到約50%)。鋰基正電極可以幫助補償由於固體電解質相間(SEI)層和/或其它副反應的形成所導致的鋰損失。
用於鋰離子電池正電極的含鋰活性材料的一些實例包括尖晶石鋰錳 氧化物(LiMn2O4)、鋰鈷氧化物(LiCoO2)、鎳錳氧化物尖晶石(Li(Ni0.5Mn1.5)O2)或層狀鎳錳鈷氧化物(通式為Li2MnO3·(1-x)LiMO2或(M是由任意比率的Ni、Mn和/或Co組成的)。層狀鎳錳鈷氧化物的具體實例包括(xLi2MnO3·(1-x)Li(Ni1/3Mn1/3Co1/3)O2).其它合適的鋰活性材料包括Li(Ni1/3Mn1/3Co1/3)O2、Lix+yMn2-yO4(LMO,0<x<1並且0<y<0.1),或鋰鐵聚陰離子氧化物,例如磷酸鋰鐵(LiFePO4)或氟磷酸鋰鐵(Li2FePO4F)還可使用其它的鋰基活性材料,例如LiNixM1-xO2(M是由任何比率的Al、Co和/或Mg組成的,例如,鋰鎳鈷鋁氧化物(LiNi0.8Co0.15Al0.05O2)或NCA)、鋁穩定型鋰錳氧化物尖晶石(例如LixAl0.05Mn0.95O2)、鋰釩氧化物(LiV2O5)、Li2MSiO4(M是由任何比率的Co、Fe和/或Mn組成的)和任何其它高效鋰鎳錳鈷材料(例如,NMC或LiNiMnCoO2)。「任何比率」是指任何元素可以任何量存在。因此,例如,M可以是Al,包括或不包括Co和/或Mg,或所列舉元素中的任何其它組合。
在其它實例中,正電極20』可以由不含鋰的正活性材料形成,所述正活性材料可以作為鋰硫電池的正電極。在此實例中,不含鋰的正活性材料可以是硫基活性材料。在一實例中,硫基活性材料是硫碳複合材料。在一實例中,硫碳複合材料中S和C的重量比在1∶9到9∶1的範圍內。硫基活性材料的一些其它實例包括S8、硫化銅或硫化鐵。
在又一個實例中,正電極20』可以由含鋰的活性材料形成。含鋰的活性材料可以為鋰硫基活性材料,例如鋰硫碳複合材料。在另一個實例中,含鋰的硫基活性材料可以是Li2S8、Li2S6、Li2S4、Li2S2或Li2S。
應了解,正電極20、20』是鋰離子可滲透的。此滲透性部分地是由鋰離子可滲透的正活性材料所致的。另外,正電極20、20』可以是多孔的,並且孔可以允許鋰離子滲透正電極20、20』。
正極20、20』可以通過將組分的漿料施用到鋰離子可滲透的正電極集流體22,及接著乾燥漿料以形成不含鋰的正電極20、20』。在一實例中,電極組分的漿料被施用到鋰離子可滲透的正電極集流體22的兩側。在另一實例中,漿料可以使用到一側,並可穿透集流體14的孔以基本上塗覆集流體14的另一側。在任一實例中,應了解,電極組分的漿液也可以基 本上填充鋰離子可滲透的正電極集流體22的孔並塗覆側面。
在實例中,鋰離子可滲透的正電極集流體22可以由鋁網、鎳網、多孔碳紙(例如,由納米纖維、納米管、纖維和/或石墨烯構成),或任何其它適當的導電材料形成。應了解,鋰離子可滲透的正電極集流體22可以呈允許鋰離子通過集流體22的任何形式。例如,鋰離子可滲透的正電極集流體22可以呈以下各種形式:泡沫、網格、網狀物、編織纖維、蜂窩、金屬箔上的圖案化孔、金屬箔上的穿孔、金屬化塑料膜、膨脹金屬網格、金屬棉、微型桁架、碳纖維織物、織造碳網、非織造碳網、碳氈或其組合。集流體22可具有範圍為約1nm到約10μm的平均孔徑。集流體22可以通過範圍約0.1%至約99.9%的平均孔對表面比或孔隙度來表徵。在一實例中,平均孔對表面比或孔隙度為至少10%。所選擇的鋰離子可滲透的正電極集流體22應為鋰離子可滲透的並能夠將自由電子收集並移動到與之連接的外電路和從與之連接的外電路收集並移動自由電子。
在圖1所示的實例中,電化學電池10具有兩個微孔聚合物隔膜18A、18B。微孔聚合物隔膜18A、18B既作為電絕緣體又作為機械支撐來進行操作。一個微孔聚合物隔膜18A夾在非鋰負電極12和鋰源電極16之間。另一微孔聚合物隔膜18B夾在正極20、20』和鋰源電極16之間。微孔聚合物隔膜18A、18B防止兩個電極12、20、20』中的每一個電極與參考電極16之間的實體接觸和發生短路。除了在電極12、20、20』、16之間提供實體屏障外,微孔聚合物隔膜18A、18B保證鋰離子(由Li+28識別)和相關的陰離子(未示出)通過填充其孔隙的電解質溶液30(在下文更詳細地論述)。這有助於確保電化學電池10的正常操作。
每一微孔聚合物隔膜18A、18B可以是任何合適的材料。在實例中,隔膜18A、18B可以是聚烯烴膜。所述聚烯烴可以是均聚物(衍生自單一單體成分)或雜聚物(衍生自一個以上單體成分),並且可以是直鏈或支鏈的。如果採用衍生自兩種單體成分的雜聚物,那麼聚烯烴可以採用任何共聚物鏈布置,包括嵌段共聚物或無規共聚物的布置。如果聚烯烴是衍生自兩種以上的單體成分的雜聚物,這種情況同樣適用。例如,聚烯烴膜可以由聚乙烯(PE)、聚丙烯(PP)、PE和PP的共混物,或者PE和/或PP 的多層結構的多孔膜形成。
在其它實例中,微孔聚合物隔膜18A、18B可以由選自以下各者的另一種聚合物形成:聚對苯二甲酸乙二酯(PET)、聚偏二氟乙烯(PVdF)、聚醯胺(尼龍)、聚氨酯、聚碳酸酯、聚酯、聚醚醚酮(PEEK)、聚醚碸(PES)、聚醯亞胺(PI)、聚醯胺-醯亞胺、聚醚、聚甲醛(例如、乙縮醛)、聚對苯二甲酸丁二酯、聚乙烯環烷酸、聚丁烯、丙烯腈-丁二烯-苯乙烯共聚物(ABS)、聚苯乙烯共聚物、聚甲基丙烯酸甲酯(PMMA)、聚氯乙烯(PVC)、聚矽氧烷聚合物(例如聚二甲基矽氧烷(PDMS))、聚苯並咪唑(PBI)、聚苯並惡唑(PBO)、聚亞苯基(例如,PARMAXTM(美國密西西比州聖路易海灣密西西比聚合物技術公司))、聚亞芳基醚酮、聚全氟環丁烷、聚四氟乙烯(PTFE)、聚偏二氟乙烯共聚物和三元共聚物、聚偏二氯乙烯、聚氟乙烯、液晶聚合物(例如,VECTRANTM(德國Hoechst公司)、(美國德拉瓦州維明頓杜邦公司)、聚對羥基苯甲酸、聚芳醯胺、聚苯醚和/或其組合。在又一個實例中,微孔聚合物隔膜18可選自聚烯烴(例如PE和/或PP)與上文所列的聚合物中的一或多個聚合物的組合。
微孔聚合物隔膜18A、18B可含有以幹法或溼法工藝製造的單層或多層層壓製品。例如,單層聚烯烴和/或其它所列聚合物可以構成整個微孔聚合物隔膜18A、18B。然而,又例如,相似或不相似的聚烯烴和/或聚合物的多個離散層可組合成微孔聚合物隔膜18A、18B。在一個實例中,一種或多種聚合物的離散層可以塗覆在聚烯烴的離散層上,以形成微孔聚合物隔膜18A、18B。此外,聚烯烴(和/或其它聚合物)層和任何其它任選的聚合物層可作為纖維層進一步包括在微孔聚合物隔膜18A,18B中,以幫助為所述微孔聚合物隔膜18A、18B提供適當的結構和孔隙度特性。其它合適的微孔聚合物隔膜18A、18B包括具有連接在其上的陶瓷層的隔膜,以及在聚合物基質中(即,有機-無機複合物基質)具有陶瓷填料的隔膜。
鋰源電極16可首先用於在非鋰負電極12、正電極20、20』或這兩種電極12、20、20』的單獨預鋰化期間提供鋰離子源28。在一個實例中,非鋰負電極12的預鋰化期間,電壓電勢(其可在電流保持恆定時變化)施加在參考電極16與非鋰負電極12之間。在此實例中,在預鋰化(下文進一 步論述)期間,鋰離子28自源電極16流向非鋰負電極12。鋰離子28流向負電極12會使負電極12變為鋰化的,從而一旦完成鋰化,即為電化學電池10提供一種初始充電狀態。在預鋰化期間,應了解,添加到非鋰負電極12的鋰的量不超過非鋰負電極12的容量的110%。超過負電極12的容量的鋰化是合乎需要的,以補充電池循環期間不可逆的鋰損失。然後可使電化學電池10放電,以使得負電極12中的鋰離子被驅向正電極20、20』,使其變為鋰化的。
當預鋰化非鋰負電極12時(或在最初幾個電池循環期間),可以形成固體電解質界面(SEI)層。SEI層的形成通常會導致來自正電極20、20』的鋰的損失,部分原因是來自此電極20、20』的鋰在SEI形成期間可能被部分地消耗(例如,達到10%的鋰損失)。然而,在本文公開的實例中,鋰源電極16用於補償由SEI形成導致的鋰損失。電解質中的一或多種組分是活性組分且在預鋰化或在最初幾個循環期間容易分解。當在預鋰化過程或前幾個循環期間對電池施加電壓電勢時,電解質中的至少一些組分被分解並與來自鋰源電極16的鋰反應。分解產物在負電極12的(多個)暴露表面上沉積以形成SEI層。分解產物的實例可為LiF、Li2CO3、LiO、LixPFyOz、F-替代乙烯二碳酸鋰(F-LEDC)、不飽和聚烯烴等等。在此實例中,鋰源電極16補償來自正電極20、20』的不可逆的鋰損失。
在另一個實例中,在預鋰化期間,將電壓電勢(其可在電流保持恆定時變化)施加在參考電極16與正電極20、20』之間。在此實例中,在預鋰化(下文進一步論述)期間,鋰離子28自源電極16流向正電極20、20』。鋰離子28流向正電極20、20』會使正電極20、20』變為鋰化的,從而一旦完成鋰化,即為電化學電池10提供一種初始放電狀態。在預鋰化期間,應了解,添加到正電極20、20』的鋰的量不超過正電極20、20』的容量的110%。超過負電極12的容量的鋰化是合乎需要的,以補充電池循環期間不可逆的鋰損失。然後可對電化學電池10進行充電,以使得正電極20、20』中的鋰離子被驅向非鋰負電極12,使其得以鋰化。當正電極20、20』待被預鋰化時,用於正電極20、20』中的活性材料可為非鋰正電極活性材料。
在又一實例中,將電壓電勢(其可在電流保持恆定時變化)施加在參考電極16與非鋰負電極12或正電極20、20』之間以部分地預鋰化電極12或20、20』。當電極12或20、20』中的一個電極被部分地預鋰化後,則將電壓電勢施加於鋰源電極16與另一電極20、20』或12之間以部分地預鋰化另一電極20、20』或12(下文進一步論述)。鋰離子28流向相應電極會分別使各個電極12、20、20』被部分地預鋰化,從而一旦完成部分預鋰化,即為電化學電池10提供一種初始充電/初始放電狀態。當利用兩種電極12及20、20』的部分鋰化時,應了解,兩種電極12、20、20』的鋰化總百分比不超過每一電極12、20、20』的容量的110%。然後,可對電化學電池10進行充電或放電,以使得在電極12、20、20』中的鋰離子移到另一電極20、20』或12,使其被完全鋰化。
在實例中,鋰源電極16可選自由以下各者組成的群組:鋰化碳;鋰-矽合金;鋰-鋁合金;鋰-錫合金;具有通式LiMO2的鋰-金屬氧化物,其中M選自由Co、Ni、Mn及其組合組成的群組;具有通式LiM2O4的鋰-金屬氧化物,其中M選自由Mn、Ti及其組合組成的群組;具有通式LiMxM′2-xO4的鋰-金屬氧化物,其中M和M』獨立地選自由Mn和Ni組成並且0.1<x<0.9的群組;具有通式LiMPO4的鋰-金屬磷酸鹽,其中M選自由Fe、Mn、Co及其組合組成的群組;以及其組合。
雖然圖中未示出,但應了解,鋰源電極16可定位成與合適的集流體(例如銅箔)相接觸。在一些實例中,當鋰源電極16定位在兩個或兩個以上電極或子電池之間時,鋰源電極16的集流體可為如本文前面所公開的可滲透的鋰離子。例如,鋰源電極16可為相似金屬或非金屬(例如石墨烯、碳納米纖維紙、碳布等等)製成的網、布、網狀物。
鋰源電極16就其「投影面積」來說可能相當大,所述投影面積表示在朝向負電極12或正電極20、20』突出時的幾何表面積。鋰源電極16可具有為負電極12或正電極20、20』的面積的至少約10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更大的投影面積。
在一個實例中,控制鋰離子28在鋰源電極16中的質量以提供特定量的鋰離子28。所述質量可基於待鋰化的非鋰負電極12或正電極20、20』 的容量。在另一實例中,可控制鋰離子28在鋰源電極16中的質量以使得鋰離子28的質量可略超過對非鋰負電極12和/或正電極20、20』進行預鋰化所需的鋰離子28。在實例中,鋰離子28可以大於待鋰化的電極12或20、20』且在從約10%至約50%的範圍內的量存在於鋰源電極16中。換句話說,如果非鋰負電極12或正電極20、20』的最大鋰質量容量是X,則鋰離子28在鋰源電極16中的量可在從X+10%X至X+50%X的範圍內。例如,如果非鋰負電極12或正電極20、20』具有2安培-小時(Ah)的容量、即等於最大0.6克鋰,則鋰離子28在鋰源電極16中的質量範圍可以是從約0.66克至約0.9克。
在鋰離子28於鋰源電極16中的質量略過量的情形中,過量的鋰離子28可用於利用鋰離子28將非鋰負電極12或正電極20、20』或者兩種電極12、20、20』再鋰化。在一個實例中,鋰化可在循環電化學電池10通過放電和充電循環之後發生,這會導致鋰離子28部分地由於副反應而發生不可逆的損失。例如,鋰離子28在鋰源電極16中的過大質量會用作鋰儲罐,直到需要將其中電極12、20、20』中的一個電極鋰化來增加電化學電池10的壽命為止。在先前提及的任何實例中,為了進行再鋰化,可跨越被再鋰化的鋰源電極16和電極12、20、20』施加適當的電壓電勢,以將鋰離子28驅向適當的電極12、20、20』。
在又一實例中,鋰源電極16可並不用於預鋰化,而是用於對非鋰負電極12或正電極20、20』進行再鋰化。在這些情形中,正電極20、20』將包括足夠的含鋰的活性材料以使得電池10處於至少部分地放電狀態中。因此,可並不需要對非鋰負電極12和正電極20、20』進行預鋰化。可首先對電化學電池10進行充電(其將有可能形成SEI層)。鋰源電極16可用於在形成SEI層之後或者在任何時間對負電極12或正電極20、20』進行再鋰化,以補償鋰損失並且維持電化學電池10的容量保持。
鋰源電極16也可用作鋰基電池中的參考電極。將鋰源電極16用作參考電極將在下文進行更詳細地論述。
在電化學電池10可使用可接觸非鋰負電極12與正電極20、20』之間的鋰離子的任何適當的電解質30。在一個實例中,電解質30可以是包括 鋰鹽的非水溶性液體電解質溶液。所述非水溶性液體可基於電化學電池10的類型改變。例如,當電池10是鋰離子電池組電池時,非水溶性液體電解質溶液可以是有機溶劑或有機溶劑的混合物。合適的有機溶劑的實例包括環狀碳酸酯(碳酸乙烯酯、碳酸丙烯酯、碳酸丁烯酯、氟代碳酸乙烯酯)、線型碳酸酯(碳酸二甲酯、碳酸二乙酯、碳酸甲乙酯)、脂族羧酸酯(甲酸甲酯、乙酸甲酯、丙酸甲酯)、γ-內酯(γ-丁內酯、γ-戊內酯)、鏈結構醚(1,2-二甲氧基乙烷、1,2-二乙氧基乙烷、乙氧基甲氧基乙烷、四乙二醇二甲醚)、環醚(四氫呋喃、2-甲基四氫呋喃、1,3-二氧戊環)、二氧六環、乙腈、硝基甲烷、乙基單甘醇二甲醚、磷酸三酯、三甲氧基甲烷、二氧戊環衍生物、3-甲基-2-惡唑烷酮、碳酸丙烯酯衍生物、四氫呋喃衍生物、乙基乙醚、1,3-丙烷磺內酯、N-甲基乙醯胺、乙縮醛、縮酮、碸、環丁碸、脂肪醚、環醚、甘醇二甲醚、聚醚、磷酸酯、矽氧烷、二氧戊環、N-烷基吡咯烷酮及其混合物。對於另一實例,當電池10是鋰硫電池組電池時,非水溶性液體電解質溶液可以是醚類溶劑。醚類溶劑的實例包括環醚、例如1,3-二氧戊環、四氫呋喃、2-甲基四氫呋喃以及鏈結構乙醚,例如1,2-二甲氧基乙烷、1-2-二乙氧基乙烷、乙氧基甲氧基乙烷、四乙二醇二甲醚(TEGDME)、聚乙二醇二甲醚(PEGDME)、乙基醚、脂肪醚及其混合物。
不管是否用在鋰離子電池還是鋰硫電池中,電解質30均包括先前提及的鋰鹽。可溶解在有機溶劑或醚中的鋰鹽的實例包括LiSBF6、LiClO4、LiAlCl4、LiI、LiBr、LiCl、LiB(C2O4)2(LiBOB)、LiBF2(C2O4)(LiODFB)、LiSCN、LiBF4、LiB(C6H5)4、LiAsF6、LiCF3SO3、LiN(FSO2)2(LIFSI)、LiN(CF3SO2)2(LITFSI)、LiPF6、LiPF4(C2O4)(LiFOP)、LiNO3及其混合物。
鹽的濃度並不受特別限制,但是在一實例中可在電解質溶液的約0.1mol/L至約5mol/L的範圍內。
電化學電池10還包括外電路26和負載24。將負載24施加於電化學電池10將外電路26閉合併且連接非鋰負電極12和正電極20、20』。閉合的外電路26使得能夠在電流保持恆定時橫貫電化學電池10施加電壓電勢。例如,可通過將電化學電池10連接到外電池充電器來施加電壓電勢。
可以控制電壓電勢以使鋰離子28朝著非鋰負電極12(通過「Li+←」 表示)或者正電極20、20』(未在圖1中示出)移動。應了解,非鋰負電極12或正電極20、20』可以通過在鋰源電極16與將預鋰化的電極12或20、20』之間在恆定電流下施加電壓電勢來預鋰化。在此實例中,由於鋰離子28由電解質30從鋰源電極16穿過多孔隔膜18A朝著非鋰負電極12運送,電子通過外電路26朝著鋰離子可滲透的負電極集流體14流動。所述電子和鋰離子28在非鋰負極12處結合,從而利用用於在第一電池放電循環中消耗的嵌入的、電鍍額、合金化等的鋰來鋰化負活性材料。在一實例中,當施加電壓電勢時,鋰離子28從鋰源電極16溶解(或者退鍍)並插入到電解質30(可以傳導鋰離子)中的負電極活性材料。在實例中,鋰離子28可以與石墨活性材料或者矽基活性材料形成合金。這會在原位鋰化非鋰負電極12以形成鋰化的負電極(未示出)。
在一實例中,為了鋰化非鋰負電極12,可以使用恆定電流並且所述電壓可以變化。例如,如果非鋰負電機12是將被預鋰化的電極,則施加在參考電極16與非鋰負電極12之間的電壓在約0.005V到約2.0V之間的範圍內,並且電流是恆定的。在一實例中,施加在參考電極16與非鋰負電極12之間的電壓為約1.5V。非鋰負電極12可以預鋰化直到鋰的量達到容量或者高達超過容量的10%。還可以進行預鋰化直到達到截止電壓為止。一旦達到所述截止電壓,預鋰化完成並可以除去恆定電流(即,電流流動停止)。在一實例中,非鋰負極12的截止電壓可為相對於Li+/Li略高於0V。應了解,截止電壓根據在非鋰負電極12中使用的材料的類型變化。
在另一個實例中,如果正電極20、20』是將預鋰化的電極,則施加在參考電極16與正電極20、20』之間的電壓在約1.5V到約5.0V的範圍內,並且電流是恆定的。非鋰正電極20、20』可以預鋰化直到鋰的量達到容量或者高達超過容量的10%。還可以進行預鋰化直到達到截止電壓為止。一旦達到所述截止電壓,所述預鋰化完成並可以除去恆定電流(即,電流流動停止)。在一實例中,正電極20、20』的截止電壓為相對於Li+/Li略高於1V。
在施加電壓電勢達預定時間量後,直到達到特定容量,和/或直到達到截止電壓,非鋰負電極12或正電極20、20』變為鋰化的。預鋰化非鋰負電 極12(而不是正電極20、20』)會使電化學電池10處於充電狀態。然後可以閉合外電路26來使電化學電池10放電。在放電期間,電化學電池10的鋰化負電極含有高濃度的插入的(例如嵌入的,合金化的,等)鋰,而正電極20、20』還未鋰化或者包括小於其容量的某形式的鋰活性材料。閉合外電路26的建立導致插入的鋰從鋰化負電極中析出。在負電極-電解質界面處離開宿主(即活性材料)時,析出的鋰原子分離成鋰離子28和電子。
正極20、20』和鋰化負電極之間的化學電勢差(對於鋰化負電極來說在約0.005V到約2.0V的範圍內,對於正電極20、20』來說在約1.5V到約5.0V的範圍內,這取決於電極的確切化學組成驅使由在鋰化負電極處插入的鋰的氧化所產生的電子通過外電路26朝著所述正極20、20′移動。鋰離子28同時被電解質30通過微孔聚合物隔膜18A、18B朝著正電極20、20』運送。流經外電路26電子和穿過電解質30中的微孔聚合物隔膜18A、18B遷移的鋰離子28最終在正電極20、20』處以某種形式併入有鋰,從而鋰化正電極20、20』。
在另一個實例中,通過在鋰源電極16與正電極20、20』(而不是非鋰負電極12)之間施加電壓電勢來預鋰化正電極20、20』使電化學電池10處於放電狀態中。外部電池充電器可以連接到鋰化正電極和非鋰負電極12以驅動電池放電電化學反應的逆反應來對電化學電池10進行充電。在充電期間,電子通過外電路26朝著非鋰負電極12流動,且鋰離子28由電解質30跨過多孔隔膜18A和/或18B朝著非鋰負電極12運送。電子和鋰離子28在非鋰負電極12處結合,最終在非鋰負電極12處以某種形式併入有鋰,從而鋰化非鋰負電極12。
在又一實例中,非鋰負電極12和正電極20、20』可各自部分地預鋰化以使電化學電池10處於部分充電/放電狀態中。為了部分預鋰化,可以在不同時間處在鋰源電極16與非鋰負電極12之間以及在鋰源電極16與正電極12、20、20』之間施加電壓電勢直到電極12或20、20』被部分地預鋰化。例如,可以在非鋰負電極12與鋰源電極16之間施加電壓電勢以部分地預鋰化負電極12。然後,可以在正電極20、20』與鋰源電極16之間施加 電壓電勢以部分地預鋰化正電極20、20』。應了解,添加到兩個電極12、20、20』的鋰的組合量未超過相應電極12、20、20』的容量的110%。然後可如先前所描述對電化學電池10進行放電或充電,以充分鋰化所述部分鋰化的負電極(即,通過對電池10進行充電)或充分鋰化所述部分鋰化的正電極20、20』(即,通過對電池10進行放電)。
轉到圖2,在本文所公開的方法的另一實例中,可以形成電化學電池10』。應了解,與本文所公開的用於圖1中所示的電化學電池10相同的材料可以用於形成電化學電池10』的部件。
在此實例中,電化學電池10』包括與鋰離子可滲透的負電極集流體14接觸的非鋰負電極12。電化學電池10』還包括與鋰離子可滲透的正電極集流體22接觸的正電極20、20』。微孔聚合物隔膜18B之一可以設置在非鋰負電極12與正電極20、20』之間。
電化學電池10』進一步包括鋰源電極16。在此實例電池10』中,鋰源電極16不位於非鋰負電極12與正電極20、20』之間,而是位於電池10的端部處。在此實例中,另一微孔聚合物隔膜18A設置在鋰源電極16與非鋰負電極12之間。應了解,鋰源電極16的置放不限於圖2中所示的配置。在一些情況下,如圖2中的虛線所示,鋰源電極16可以與最外正電極20、20』相鄰,而不是與最外非鋰負電極12相鄰。
電化學電池10』還包括外電路26和負載24,如先前參照圖1所描述。在此電化學電池10』中,非鋰電極12、20、20』可以通過在鋰源電極16與非鋰負電極12或正電極20、20』之間施加電壓電勢來預鋰化。在一個實例中,在鋰源電極16與非鋰負電極12之間施加電壓。在此實例中,所施加的電壓電勢可以引起鋰離子28朝向非鋰負電極12移動(通過「Li+→」示出)。在圖2中所示的配置中,非鋰負電極12的預鋰化以與如圖1中所述的類似的方式進行。然而,與圖1不同的是,鋰離子28通過電極12的相對側而導向非鋰負電極12。由於隔膜18A和集流體14為鋰離子可滲透的,所以非鋰負電極12可以利用鋰源電極16所供應的鋰離子28來預鋰化,所述鋰源電極16可以位於非鋰負電極12的任一側上。
在另一實例中,由於部件18A、14、12和18B為鋰離子可滲透的,所 以正電極20、20』可以原位預鋰化。例如,可以在鋰源電極16與正電極20、20』之間施加電壓電勢(具有恆定電流)。在圖2中所示的配置中,正電極20、20』的預鋰化以與如圖1中所述的類似的方式進行。如果使用在電池10』的最左手側處的鋰源電極16,那麼鋰將通過負電極12和集流體14行進,這是由於在源電極16與正電極20、20』之間施加了電壓。如上文所提及,在一些情況下(圖2中的虛線所示),鋰源電極16可以與最外正電極20、20』相鄰,而不是與最外非鋰負電極12相鄰。在此實例中,隔膜18A可以位於集流體22/正電極20、20』與鋰源電極16之間。在此實例中,可以橫跨鋰源電極16(在電池10』的右手側上)和正電極20、20』施加電勢以預鋰化正電極20、20』。由於隔膜18A和集流體22為鋰離子可滲透的,所以正電極20、20』可以利用鋰源電極16所供應的鋰離子28來預鋰化,所述鋰源電極16(在此實例中)定位為更接近於正電極20、20』。
當在鋰源電極16與非鋰負電極12之間施加電壓電勢時,虛線所示的配置允許鋰離子28鋰化非鋰負電極12。在此實例中,當在電極12與16(位於最右)之間施加電壓電勢時,鋰離子28繼續從鋰源電極16移動通過正電極20、20』到達非鋰負電極12。在這些情況下,所引入的鋰的量可以通過使用在變化電勢下的恆定電流和時間來控制,並且通過非鋰負電極12的容量來確定(如本文中先前參照圖1所描述)。
在另一實例中,在圖2所示的配置中,電極12、20、20』每個均可以被部分地預鋰化,如先前參照圖1所描述。
現在參照圖3,在本文所公開的方法的又一實例中,可以形成電化學電池10」。應了解,與本文中公開的用於圖1中所示的電化學電池10相同的材料可以用於形成電化學電池10」的部件。
在此實例中,電化學電池10」包括兩個子電池32、32』。每個子電池32、32』包括設置成與鋰離子可滲透的負電極集流體14接觸的非鋰負電極12。每個子電池32、32』還包括設置成與鋰離子可滲透的正電極集流體22接觸的正電極20、20』。微孔聚合物隔膜18A可以設置在每個子電池32、32』內的非鋰負電極12與正電極20、20』之間。
圖3中所示的電化學電池10」還包括鋰源電極16,其中微孔聚合物隔 膜18B設置在鋰源電極16與兩個子電池32、32』的每個子電池之間。應了解,額外的子電池32、32』(例如,三個或三個以上的子電池)可以包括在電化學電池10」中。額外的子電池32、32』可以位於與子電池32、子電池32』或子電池32、32』兩者相鄰的電化學電池10」的最外部分處。
應了解,非鋰負電極12與正電極20、20』在子電池32、32』內的置放不限於圖3中所示的實例。例如,子電池32』可以具有定位為與鋰源電極16相鄰的正電極20、20』。在另一實例中,子電池32可以具有定位為與鋰源電極16相鄰的非鋰負電極12。
另外,存在於電池10」中的微孔聚合物隔膜18B的數目取決於包括在電化學電池10」中的子電池32、32』的數目。例如,當電化學電池10」具有多於兩個子電池32、32』時,可以存在位於每個子電池之間以使子電池彼此分離的至少一個微孔聚合物隔膜18B。在實例中,如果電化學電池10」具有在與子電池32』相鄰的電化學電池10」的最外部分處的第三子電池(圖3中未示出),那麼微孔聚合物隔膜18B可以位於子電池32』與第三子電池之間。
電化學電池10」還包括外電路26和負載24,如先前參照圖1所描述。
為了對子電池32中的一個電池進行預鋰化,可以在鋰源電極16與(子電池32的)正電極20、20』或(子電池32的)的非鋰負電極12之間施加電壓電勢(以及恆定電流)(例如,持續足夠量的時間或直到達到截止電壓為止)。在另一實例中,子電池32的每個電極12、20、20』可以分別地被部分地預鋰化。在此實例中,當正電極20、20』與鋰源電極16相鄰時(如圖2中的虛線所示),子電池32的電極20、20』或電極12變為預鋰化的,如參照圖2所描述。
為了對子電池32』中的另一個子電池進行預鋰化,可以在鋰源電極16與(子電池32』的)非鋰負電極12或(子電池32』的)正電極20、20』之間施加電壓電勢(以及恆定電流)(例如,持續足夠量的時間或直到達到截止電壓為止)。在另一實例中,子電池32』的每個電極12、20、20』可以分別被部分地預鋰化(即,一次一個電極12或20、20』)。在此實例中,當非鋰負電極12與鋰源電極16相鄰時,子電池32』的電極12或電極20、20』 變為預鋰化的,如參照圖2所描述。
此外,在又一實例中,可以形成電化學電池10」』。在圖4中示出了電化學電池10」』的示例。應了解,與本文所公開的用於圖1中的電化學電池10相同的材料可以用於形成電化學電池10」』的部件。
在此實例中,電化學電池10」』包括兩個子電池32、32』。每個子電池32、32』包括與如本文中針對圖3所描述的相同的部件。類似於圖3,子電池32、32』被隔膜18B分離。
與圖3中所示的實例不同,圖4中所示的電化學電池10」』的鋰源電極16位於電池10」』的一端處。如圖4中所示,微孔聚合物隔膜18B設置在鋰源電極16與子電池32之間。電化學電池10」』不限於圖4中所示的配置。鋰源電極16可以替代地處於與子電池32』相鄰的電化學電池10」』的最外部分中。此外,應了解,額外的子電池(例如,三個或三個以上的子電池)可以包括在電化學電池10」』中。額外的子電池可以定位為與子電池32、子電池32』或子電池32、32』兩者相鄰。
應了解,非鋰負電極12和正電極20、20』在子電池32、32』內的置放不限於圖4中示出的實例。例如,子電池32』可以具有定位為與使兩個子電池32、32』分離的微孔聚合物隔膜18B相鄰的正電極20、20』。在另一實例中,子電池32可以具有定位為與使兩個子電池32、32』分離的微孔聚合物隔膜18B相鄰的非鋰負電極12。
另外,微孔聚合物隔膜18B的數目取決於電化學電池10」』中的子電池32、32』的數目。例如,當電化學電池10」』具有多於兩個子電池32、32』時,可存在位於每個子電池之間以使額外的子電池彼此分離的至少一個微孔聚合物隔膜18B。在實例中,如果電化學電池10」』具有在與子電池32』相鄰的電化學電池10」』的最外部分中的第三子電池(圖4中未示出),那麼額外的微孔聚合物隔膜18B可以位於子電池32』與第三子電池之間。
電化學電池10」』還包括外電路26和負載24,如先前參照圖1所描述。各個子電池32、32』的電極12、20、20』可以被預鋰化,如先前參照圖2所描述。特別地,可以在鋰源電極16與子電池32、32』內的正被預鋰化的電 極之間(例如,在鋰源電極16與子電池32或32』的非鋰負電極12之間)施加電壓電勢。
在子電池32中,可以使用恆定電流在鋰參考電極16與非鋰負電極12或正電極20、20』之間施加電壓電勢。可以施加電壓電勢達足量的時間以鋰化所期望的電極12、20、20』。子電池32的電極12和20、20』也可以被部分地鋰化,如先前所描述。
在子電池32』中,可以使用恆定電流在鋰參考電極16與子電池32』的非鋰負電極12之間施加電壓電勢。可以施加電壓達足夠長時間以使鋰離子28經由子電池32遷移至子電池32』的非鋰負電極12。一旦鋰離子28到達子電池32』的非鋰負電極12,那么子電池32』的非鋰負電極12變為鋰化的。還可以使用恆定電流在鋰參考電極16與子電池32』的正電極20、20』之間施加電壓電勢以鋰化子電池32』的正電極20、20』。子電池32』的電極12和20、20』也可以被部分地鋰化,如先前所描述。
如果子電池32』的非鋰負電極12被預鋰化,那么子電池32』的正電極20、20』可以在電化學電池10」』的第一放電循環期間變為鋰化的(其中鋰離開負電極12)。如果子電池32』的正電極20、20』被預鋰化,那麼非鋰負電極12可以在電化學電池10」』的第一充電循環期間變為鋰化的(其中鋰離開正電極20、20』)。如果每個電極12、20、20』被部分地預鋰化,那麼可對電化學電池10」』進行充電或放電並且進行循環以完成一個電極12或20、20』的鋰化,如先前參照圖1所描述。
電化學電池10、10』、10」、10」』的電極12、20、20』的預鋰化可以原位發生(即,在接著可以被用作電池的全電池中)。在實例中,所形成的電化學電池10、10』、10」、10」』可以是軟包電池、紐扣電池或具有圓柱狀版式或纏繞的稜柱狀版式的另一全電化學電池。
在稜柱狀形式下,電極和集流體形成堆疊的幾何結構,其可以利用能夠防止電池10、10』、10」、10」』的空氣汙染和水汙染的封裝材料來密封。可以採用三個端子以允許電通入正電極、負電極和鋰源電極16中的每一者的電池端子。在圓柱狀形式下,多層結構可以被纏繞成與膠狀卷(jelly roll)類似的配置。鋰源電極16層可以置放成最外層或另一層。纏繞結構 可以在添加電解質30之後密封在金屬容器中。這種電池也將具有三個引線。
應了解,軟包電池或其它全電化學電池10、10』、10」、10」』在預鋰化之後未打開,而是可以用作鋰離子或鋰硫電池(例如,矽硫電池)。
當電化學電池10、10』、10」、10」』為鋰基電池時,負載裝置24可以為任何數目的已知用電裝置,消耗功率的負載裝置24的一些特定示例包括用於混合動力車輛或全電動車輛的電機、膝上型計算機、蜂窩電話以及無繩電動工具。然而,負載裝置24還可以為電力生成設備,其對鋰基電池進行充電以用於存儲能量的目的。例如,風車和太陽能面板可變和/或間歇生成電力的趨勢通常導致需要存儲過剩的能量以供隨後使用。
鋰基電池還可以包括對於本領域技術人員已知的寬範圍的其它部件。例如,鋰基電池可以包括套管、襯墊、端子、突舌以及可位於負電極與正電極之間或周圍以用於性能相關或其它實用目的的任何其它所期望的部件或材料。此外,鋰基電池的尺寸和形狀以及其主要部件的設計和化學組成可以根據其所針對設計的特定應用而變化。例如,電池供電的汽車和手持式消費型電子裝置是其中鋰基電池將最有可能被設計成不同尺寸、容量和功率輸出規格的兩種情況。如果負載裝置24有如此需要,那麼鋰基電池還可以與其它類似的鋰基電池串聯和/或並聯,以產生較大的電流輸出(如果並聯布置)或電壓輸出(如果串聯布置)。
具體對於鋰離子電池來說,鋰離子電池一般通過在鋰化負電極和鋰化正電極之間可逆地傳遞鋰離子來操作。在完全充電狀態下,電池電壓為最大(通常在1.5V到5.0V的範圍內);而在完全放電狀態下,電池電壓為最小(通常在0V到1.5V的範圍內)。基本上,鋰化的正電極和負電極中的活性材料的費米能級在電池工作期間發生改變,且兩者之間的差別(被稱為電池電壓)也發生改變。隨著費米能級越來越接近彼此,電池電壓在放電期間降低。在充電期間,隨著費米能級被驅使而分開,電池電壓上升,發生逆過程。在電池放電期間,外部負載裝置24使電子電流在外部電路26中於一方向上流動,使得費米能級(且對應地,電池電壓)之間的差別減小。在電池充電期間發生相反的情況:電池充電器迫使電子電流在外部 電路26中於一方向上流動,使得費米能級(且對應地,電池電壓)之間的差別增大。
在放電開始時,在非鋰負電極12已被預鋰化的情形下,鋰離子電池的鋰化負電極包含高濃度插入的鋰,而正電極20則相對缺乏鋰。當鋰化負電極包含相對足夠高量的插入的鋰時,鋰離子電池能通過外電路26閉合以連接鋰化負電極和正電極20時發生的可逆電化學反應而生成有益電流。在這些情況下,閉合的外電路的建立導致插入的鋰從鋰化負電極中析出。在負電極-電解質界面處離開插入宿主時,析出的鋰原子分裂成鋰離子28和電子。
正電極20和鋰化負電極之間的化學電勢差(取決於鋰化電極的確切化學組成,在約1.5V到約5.0V的範圍內)驅使在鋰化負電極處插入的鋰的氧化所產生的電子通過外電路26朝著正電極20移動。鋰離子28同時由電解質30通過微孔聚合物隔膜18朝著正電極20運送。流經外電路26的電子和跨越電解質30中的微孔聚合物隔膜18A和/或18B遷移的鋰離子28最終結合併形成插入的鋰,從而鋰化正電極20。通過外電路26的電流可經由負載裝置24整治並引導直到鋰化負電極中插入的鋰的水平下降到可工作水平以下或不再需要電能。
在其有效容量的局部或完全放電之後,鋰離子電池可再充電。為了對鋰離子電池進行充電,將外部電池充電器連接到鋰化正電極和鋰化負電極,從而驅使電池放電的電化學反應逆轉。在再充電期間,電子通過外電路26朝著鋰化負電極(其鋰濃度已被至少被部分地消耗掉)回流,且鋰離子28由電解質30跨越多孔隔膜18A和/或18B運送回至鋰化負電極。電子和鋰離子28在鋰化負電極處重新結合,從而為其補充插入的鋰以用於下一個電池放電循環期間的消耗。
可用於對鋰離子電池進行充電的外部電池充電器可取決於鋰離子電池的尺寸、構型以及特定的最終用途而改變。一些合適的外部電池充電器包括插入AC壁式插座的電池充電器和機動車交流發電機。
鋰硫電池也可於電池放電期間生成有用的電流。在非鋰負電極已被預鋰化的情形下,於放電期間,鋰硫電池中的化學過程包括鋰(Li+)從鋰化 負電極的表面分解和在正電極20』中將鋰離子28合併入鹼金屬聚硫化物鹽(例如,Li2Sx,如Li2S8、Li2S6、Li2S4、Li2S3、Li2S2和Li2S)。同樣地,當鋰離子28依序鋰化正電極20』而電池正放電時,在正電極20』的表面上形成聚硫化物(硫被還原)。正電極20』和鋰化負電極之間的化學電勢差(取決於電極的確切化學組成,大致1.5V到3.0V的範圍內)驅使由在鋰化負電極處分解鋰所產生的電子通過外電路26朝著所述正電極20』移動。所產生的通過外電路26的電流可通過負載裝置24整治並引導直到鋰化負電極中的鋰被耗盡且鋰硫電池的容量減小,或直到鋰化負電極中鋰的水平下降到可工作水平以下,或直至不再需要電能。
通過施加外部電源至鋰硫電池以逆轉在電池放電期間中發生的電化學反應,可隨時對鋰硫電池進行充電或重新提供動力。在充電期間,發生對鋰化負電極的鍍鋰,並發生在鋰化正電極處形成硫。將外部電源連接到鋰硫電池迫使鋰化正電極處的鋰發生另外的非自發性氧化,從而產生電子和鋰離子28。通過外電路26朝著鋰化負電極回流的電子以及由電解質30跨越多孔高分子隔膜18運送回至鋰化負電極的鋰離子28在所述鋰化負電極處再結合併為其補充鋰以用於下一個電池放電循環期間的消耗。可用於對鋰硫電池進行充電的外部電源可取決於鋰硫電池充電的尺寸、構型以及特定的最終用途而改變。一些合適的外部電源包括插入AC壁式插座的電池充電器和機動車交流發電機。
本文所公開的方法可進一步包括:在鋰源電極16中的鋰離子28質量添加稍過量時(超過適用於預鋰化的量),再鋰化鋰離子或者鋰硫電池。再鋰化可發生於鋰離子或鋰硫電池經過至少一些充電和放電循環之後。再鋰化之前執行的循環的數目可取決於電池的類型和/或尺寸而改變。在循環期間,鋰不可逆轉地損失。為了補償此不可逆損失,可跨越合適的電極(例如,電極16和12、16和20、20』)施加具有控制電流的合適電壓以引發再鋰化。在再鋰化期間,來自鋰源電極16的多餘質量的鋰離子28可再鋰化鋰離子或鋰硫電池的電極。
在本文所公開的實例中,可期望在電池循環之前耗盡電極12或20、20』中的一者。在這些實例中,反電流(與用於預鋰化的電流相反)可與適 當電壓一起用於將鋰從電極12或20、20』驅至鋰源電極16。
在本文所公開的實例中,在鋰源電極16用於預鋰化電極12,20、20』之後,所述鋰源電極16可保持在電池中並於電池工作期間用作參考電極。當浸透於適當電解質30中,圖2的結構(且具體為以虛線示出的實例)使得能夠在鋰源電極16和鋰化正極以及鋰化負電極之間進行直接離子通信而不阻擋電池的電流路徑。在正常電池工作期間,電流在鋰化正電極與鋰化負電極之間流動。在電池工作期間,在鋰化正電極與鋰源電極16之間施加非常小的電流使得能夠對鋰化正電極進行電壓監測。並且於電池工作期間,在鋰化負電極與鋰源電極16之間施加非常小的電流使得能夠對鋰化負電極進行電壓監測。
如本文中所使用,「非常小的電流」是施加於鋰源電極16與鋰化正或負電極之間的參考電流,以便監測單獨的電極電壓和確定電池電壓。在一實例中,所述非常小的電流小於大約10-6amp(即,微安),如約5×10-7amp、10-7amp、5×10-8amp、10-8amp或更低。在一些實例中,所述非常小的或參考電流處於毫微安(nA)範圍內,例如約9×10-9amp、8×10-9amp、7×10-9amp、6×10-9amp、5×10-9amp、4×10-9amp、3×10-9amp、2×10-9amp、10-9amp或小於10-9amp。在一實例中,所述參考電流處於從約0.5hA到約2nA的範圍內,如大約1nA。本文所公開的實例的原理和範圍用於大於10-6amp的參考電流,但這些相對較高的電流(與電池的電流輸出相比)對於準確的電壓讀數並非必需的。
參照圖二,於電池10』的工作期間(即,預鋰化後),集流體14和22之間的電壓是正常的電池電壓。當施加參考電流時,與鋰源電極16相鄰的集流體(未示出)和集流體14之間的電壓是負電極電壓(即,陽極電壓)。當施加參考電流時,與鋰源電極16相鄰的集流體和集流體22之間的電壓是正電極電壓(即,陰極電壓)。
從陽極電壓減去陰極電壓得到監測的電池電壓。由於集流體14和22之間的電路中實際的電池電壓一般是已知的,所以可通過比較實際的電池電壓與所述監測的電池電壓來提供準確性指示。
如果需要,可同時動態監測陰極電壓和陽極電壓。或者,可於某一時 間段監測電極電壓,然後再監測電池中存在的另一電極的電壓。可連續地、周期性地、隨機地或者按照相對於電池工作的預定時間表來監測陰極和/或陽極電壓。陰極電壓和陽極電壓可使用一或多個數字萬用表(或相似裝置)顯示,並記錄在電腦上進行處理。
本文所公開的電池結構可進一步包括在鋰源電極16的集流體和集流體14之間的外部參考電路,其中所述外部參考電路電連接於監視器以顯示或者記錄負電極的電壓。更進一步,所述電池結構可包括在鋰源電極16的集流體和集流體22之間的外部參考電路,其中所述外部參考電路電連接於監視器以顯示或者記錄正電極的電壓。
作為用於監測電池的電極電勢的方法的實例,提供或獲得電池10』、10」』,所述電池10』、10」』包括至少第一電極(例如,鋰化負電極)、第二電極(例如,鋰化正電極)以及鋰源電極16,所述鋰源電極16在空間上並非處於第一電極與第二電極之間。電池在第一和第二電極之間運行以產生或接收電力。為了監測第一電極的電壓,在鋰源電極16與第一電極之間在第一外部參考電路中施加第一參考電流,並且顯示或記錄第一電極的電壓。為了監測第二電極的電壓,在鋰源電極16與第二電極之間在第二外部參考電路中施加第二參考電流,並且顯示或記錄第二電極的電壓。
如果需要,可在不同時間進行對相應電極的電壓的監測。在此實例中,可重新定位第一外部參考電路並用作第二外部參考電路。或者,可利用兩個物理上相區分的外部參考電路。
也可同時進行對相應電極的電壓的監測。在此實例中,利用在物理上相區分的外部參考電路。
為了進一步說明本發明,本文給出實例。應了解,提供此實例以用於說明性目的並不應將其解釋成限制本發明的範圍。
實例
軟包電池製造
圖5描繪了形成以用於此實例的電化學測試電池40的示意圖。電化學測試電池40是軟包電池,其包括兩個負電極34、34』和兩個浸在低溫電 解質中的正電極36、36』。
電極製備
為了製造電極34、34』、36、36』,使用刮刀技術鑄造獨立電極帶,接著將兩個獨立電極帶層疊在集流體35、35』、37、37』的相對側面上。
用以形成負電極34、34』的獨立負電極帶由作為負活性材料的80重量%的Li4+3zTi5O12(LTO,0<z<1)(可購自韓華石油化學株式會社)、作為導電性填料的5重量%的Super碳(可購自特密高公司)、作為另一導電性填料的5重量%的KS6(可購自特密高公司),以及作為聚合物粘結劑的10重量%的KF1100(可購自吳羽株式會社)組成。如本文所提及,每個獨立負電極帶是使用刮刀技術進行鑄造的。
用以形成正電極36、36』的獨立正電極帶由作為正活性材料的84重量%的Lix+yMn2-yO4(LMO,0<x<1且0<y<0.1)(可購自戶田工業株式會社)、作為導電性填料的3重量%的Super碳(可購自特密高公司)、作為另一導電性填料的3重量%的KS6(可購自特密高公司),以及作為聚合物粘結劑的10重量%的2801PVDF(可購自阿科瑪公司)組成。
在製備電池40之前,通過將兩個獨立LMO帶層疊到鋁網格集流體37、37』上來製備每個正電極36、36』。類似地,通過將兩個獨立的LTO帶層疊到銅網格集流體35、35』來上製備每個負電極34、34』。接著講每個電極34、34』、36、36』切割成2×3cm2的投影面積。正電極36、36』和負電極34、34』的活性材料載荷分別為219mg和148mg。
電極36』和36,36和34』以及34』和34是通過相應的聚丙烯(PP)隔膜18進行分離的,所述聚丙烯(PP)隔離物18可從Celgard獲得。
電解質製備
實例電化學電池40中使用的低溫電解質溶劑由4∶3∶2∶1的v/v的碳酸丙烯酯(PC)、丁酸甲酯(MB)、碳酸甲乙酯(EMC)以及碳酸乙二酯(EC)(所有這些可購自諾萊特科技)組成。低溫電解質鹽是0.24M的LiPF6和0.96M的LiBF4(均可購自西格瑪奧德裡奇)的混合物。將鹽混合物添加 至溶劑混合物中以獲得低溫電解質。
將低溫電解質添加至軟包電池中以形成電化學電池40。在此實例電化學電池40中,正電極36、36』用作鋰源電極。進行測試以檢驗網格集流體將允許鋰離子跨電極輸送。
表徵方法
在環境試驗室的環境條件(例如,溫度為20℃並且壓力為101.325kPa)下進行所有電化學實驗。使用Arbin BT-2000電池測試站進行恆電流研究。將相應的循環電壓(在恆定電流下)施加到電極34和34』(在圖5中表示為C)、電極34』和36(在圖5中表示為A)以及電極36和36』(在圖5中表示為B)之間。循環電壓的範圍為:電極34』/36(A)之間為2.7V到1.5V,36/36′(B)之間為+0.6V到-0.6V,並且3434』(C)之間為+0.5V到-0.5V。在每個恆定電流充電/放電步驟結尾添加3小時的恆定電壓保持程序。這些結果示於圖6中。
也獲得AC阻抗譜或電化學阻抗譜(EIS)。在EIS測量之前,每個電極中的鋰的量通過在3小時電壓保持和3小時休息的C/10下將電極34、34』、36、36』放電至0V來進行再平衡的。EIS結果(示於圖7中)是通過Solartron電化學界面1260以及Solartron頻率響應分析儀1255獲得的。
結果
通過如上文所描述的三個循環將每個電極的電壓循環對時間量(秒)作圖。針對每一對A(全電池34』/36)、B(對稱電池36/36』)、C(對稱電池34/34』)的恆電流充電/放電曲線分別在圖6中示於A、B、C處。
由電極對A開始,初始充電容量是22.1mAh(101mAh/g LMO)並且在C/10速率下以範圍從1.5V至2.7V的電壓循環3次後,可逆容量是19.6mAh。在第三次循環結束時,對電池進行充電,指示電極36處於完全脫鋰狀態而電極34』被鋰化。這允許電極對B(36/36』)在沒有過度鋰化電極的情況下作為對稱電池循環。在C/10速率下且利用範圍從-0.6V至+0.6V的電壓,可逆容量是20.8mAh(95mAh/g LMO)。相似地,由在電極34』中從電極36轉移的19.6mAh的鋰開始,循環電極對C(34/34』)並且在利 用範圍從-0.5V至+0.5V的電壓進行3次循環後獲得16.0mAh(108mAh/g LTO)的可逆容量。
電化學電池循環的結果在圖6中示出。圖6展示電極在不同電極配置下操作。特別地,圖6的結果示出多個子電池可以用在單個電化學電池中並且單個電化學電池仍然在操作中,因為鋰離子能夠在整個電化學電池中遷移。
多孔集流體準許陰離子穿過電極36、36』、34、34』,並且這樣實現了量化電池中的獨立部件的動力學的新方法。如上文所提及,電化學測試電池40通過充電和放電而循環,同時進行電化學阻抗譜(EIS)測量。在充電和放電期間,EIS測量負電極34、34』和正電極36、36』中的每一者的以歐姆(Ω)計的阻抗。
圖7描繪一個電極(標記為「Z`」的X軸)的阻抗(Ω)對比另一個電極(標記為「Z``」的Y軸)的阻抗(Ω)。在圖7的相應圖表中,所測試的電極示出為36對比36』、34對比34』等,並且對於所列的第一電極(例如,36,然後34等)的阻抗沿著X軸並且對於所列的第二電極(例如,36』、34』等)的阻抗沿著Y軸。如圖7中所示,EIS結果展示鋰離子在電化學測試電池40中能夠跨越電極34、34』、36、36』遷移。在圖7中的各種圖表的每一個圖表中的結果說明隨著所列的第一電極的阻抗增加,所列的第二電極的阻抗降低(即,變得更負)。這些結果說明,所述鋰離子能夠遷移穿過整個電化學測試電池40。
具體地,所述結果說明了鋰離子能通過所存在的集流體從電極36、36』遷移至電極34、34』。據信這是至少部分地由於分別在負電極和正電極上的銅集流體和鋁集流體的多孔性質。因為鋰離子能穿過34、34』、36、36』和其相關聯的集流體自由地移動,所以單個鋰源可用於鋰化在一個電化學電池中的多個電極。這樣,使用鋰源電極和本文所公開的方法,可能在鋰離子或鋰硫電池中進行電極的原位預鋰化。
在整個說明書中參考「一個實例」、「另一個實例」、「實例」等等意味著結合所述實例描述的特定要素(例如,特徵、結構和/或特性)包括在本文所描述的至少一個實例中,並且可出現或可不出現在其它實例中。另外, 應了解,除非上下文另行明確指出,否則用於任何實例的所述要素以任何合適的方式可組合在各種實例中。
應了解,本文所提供的範圍包括所陳述範圍和在所陳述範圍內的任何值或子範圍。例如,從約1.5V至約5.0V的範圍應該理解成不僅包括從約1.5V至約5.0V的清晰引述的限制,而且包括單個值(例如,2.0V、3.5V、4.3V等)和子範圍(例如,從約3.5V至約4.5V;從約1.8V至約2.3V等)。此外,在「約」被用於描述值時,這意味著涵蓋來自所陳述值的少量變化(至多+/-5%)。
在描述和請求本文所公開的實例方面,除非上下文另有明確指示,否則單數形式「一」和「所述」包括複數個指示物。
雖然已詳細描述若干實例,但應了解,可修改所公開的實例。因此,前述描述應被視為非限制性的。
