一種乙醯化粒毛盤菌胞外多糖及其製備心血管藥物用途的製作方法
2023-06-18 21:07:22 1
本發明屬於粒毛盤菌胞外多糖的應用技術領域,具體涉及乙醯化粒毛盤菌胞外多糖及其在製備心血管保護藥物方面的用途。
背景技術:
糖尿病(dm)是當代社會最重要的慢性代謝性疾病,源於體細胞無法正常利用葡萄糖。作為糖尿病患者死亡的主要原因,心血管疾病因其高死亡率已引起人們的廣泛關注。許多口服降糖藥,包括磺脲類、非磺脲類胰島素促泌劑、雙胍類、α-葡萄糖苷酶抑制劑和胰島素增敏劑已被開發用於治療糖尿病。然而,糖尿病相關併發症,尤其是心血管疾病的治療仍是一項重要挑戰。因此,研究開發新型無毒副作用的心血管保護藥物具有重要意義。
大量的天然提取物,尤其是多糖能夠有效治療糖尿病。據《碳水化合物雜誌》(carbohydratepolymers,2011,86:285-290)報導,萼狀粒毛盤菌胞外多糖(lep-1)對四氧嘧啶致糖尿病小鼠具有強的降糖作用。但是,多糖對糖尿病相關併發症是否具有治療效果,還有待於進一步研究。
中國專利申請號201510030199.7公開了一種磷酸酯化瓜蔞皮多糖(pttp-1),並通過對衰老模型小鼠的抗衰老作用藥理實驗,表明磷酸酯化修飾能夠顯著提高瓜蔞皮多糖的抗衰老作用。中國專利申請號201510418916.3公開了一種硫酸酯化粒毛盤菌胞外多糖(slep-1),並通過對高凝模型小鼠的抗凝作用藥理實驗,表明硫酸酯化修飾能夠顯著提高粒毛盤菌胞外多糖的抗凝作用。本發明人課題組於2016年10月31日將一株粒毛盤菌ym216(本發明人課題組自定編號代碼)菌株保藏於湖北省武漢市武漢大學生命科學學院中國典型培養物保藏中心(簡稱cctcc),菌種保藏編號為cctccm2016603。目前,有關粒毛盤菌胞外多糖修飾改性的報導相對較多,但未見有公開文獻提及將粒毛盤菌胞外多糖修飾改性為乙醯化粒毛盤菌胞外多糖,以及將其作為製備心血管保護藥物的應用方面的報導。
技術實現要素:
本發明的目的在於提供一種採取乙醯化修飾改性的粒毛盤菌胞外多糖及其在製備心血管保護藥物中的應用。
本發明的乙醯化粒毛盤菌胞外多糖,是將菌種保藏編號為cctccm2016603的粒毛盤菌lachnumsp.ym216接種於100l發酵罐中發酵8-10d;抽濾、濃縮後,將濃縮的發酵液與3-4倍體積的體積百分濃度為95%的乙醇混合,然後於4℃醇沉24-48h;4000r/min離心10-15min後,濾出沉澱,並將沉澱復溶於蒸餾水;經sevage法除蛋白、以質量百分濃度為30%的h2o2脫色、透析除雜、冷凍乾燥得到粒毛盤菌胞外粗多糖;然後通過deae-纖維素52柱層析和瓊脂糖凝膠cl-6b柱層析依次對得到的粗多糖進行分離純化獲得均一的粒毛盤菌胞外多糖;其特徵在於通過以乙酸酐對粒毛盤菌胞外多糖進行如下的乙醯化修飾改性獲得乙醯化粒毛盤菌胞外多糖:即,將2-3g粒毛盤菌胞外多糖與80-150ml甲醯胺混合,於60℃攪拌30-60min後,加入50-80ml由n-溴代丁二醯亞胺(nbs)和乙酸酐(1:1,mg/ml)配製而成的溶液,於60℃反應6-8h後,加入20-30ml蒸餾水終止反應;冷卻至室溫後,使用體積百分濃度為95%的乙醇將溶液於4℃醇沉24-48h;4000r/min離心10-15min,濾出沉澱,並將沉澱復溶於100-150ml蒸餾水;使用1mol/lnaoh溶液中和該溶液,於截留分子量為14000da透析袋中先用自來水逆向流動透析48h,再用蒸餾水透析24h;將獲得物濃縮並凍幹,所得到的乙醯化粒毛盤菌胞外多糖。
本發明的乙醯化粒毛盤菌胞外多糖的醫藥用途,其特徵在於是由菌種保藏編號為cctccm2016603的粒毛盤菌ym216胞外多糖進行乙醯化修飾改性獲得的乙醯化粒毛盤菌胞外多糖,在製備心血管保護藥物中的應用;通過對糖尿病模型小鼠的心血管保護作用藥理實驗,確立了乙醯化粒毛盤菌胞外多糖的心血管保護作用,從而將乙醯化粒毛盤菌胞外多糖用於製備心血管保護藥物,即,按藥劑學的常規製備方法,將有效量的該乙醯化粒毛盤菌胞外多糖作為活性物質與藥用輔料混合加工,製備成片劑或膠囊劑。
與已有技術相比,本發明的有益效果體現在:
本發明的乙醯化粒毛盤菌胞外多糖具有顯著的心血管保護作用,且無毒副作用,不會對體內器官造成損傷。本發明方法簡單經濟,可將該乙醯化粒毛盤菌胞外多糖應用於製備片劑或膠囊劑型的心血管保護藥物。
附圖說明
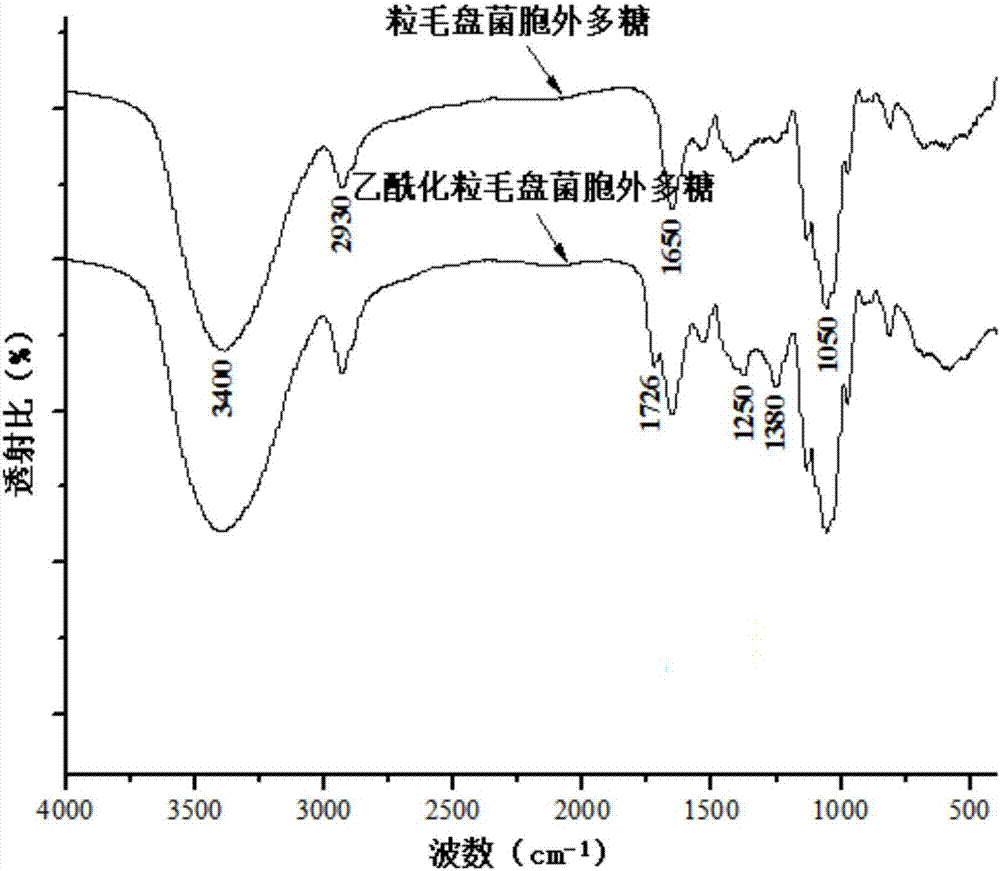
圖1為粒毛盤菌胞外多糖和乙醯化粒毛盤菌胞外多糖的紅外光譜;
圖2為粒毛盤菌胞外多糖和乙醯化粒毛盤菌胞外多糖的核磁共振碳譜。
具體實施方式
下面通過實施例並結合附圖對本發明作進一步具體詳細的說明。
實施例1:
一、粒毛盤菌胞外多糖(lep-2a)的製備
本實施例首先按如下步驟製備粒毛盤菌胞外多糖:
將菌種保藏編號為cctccm2016603的粒毛盤菌ym216接種於100l發酵罐中發酵8d。抽濾、濃縮後,將濃縮的發酵液與3倍體積的體積百分濃度為95%的乙醇混合,然後於4℃醇沉24h。4000r/min離心15min後,濾出沉澱,並將沉澱復溶於蒸餾水。經sevage法除蛋白、以質量百分濃度30%的h2o2脫色、透析除雜、冷凍乾燥得到粒毛盤菌胞外粗多糖(lep)。
通過deae-纖維素52柱層析和瓊脂糖凝膠cl-6b柱層析依次對得到的粗多糖進行分離純化。將300mglep溶於2ml蒸餾水,然後裝入deae-纖維素52色譜柱(2.6cm×60cm),依次使用蒸餾水和濃度為0.3mol/l的nacl溶液以0.5ml/min的速率進行洗脫。採用苯酚-硫酸法進行追蹤檢測,然後收集兩個組分(lep-1和lep-2)、透析、凍幹。將主要組分(lep-2)溶於蒸餾水,然後裝入瓊脂糖凝膠cl-6b色譜柱(1.6cm×60cm),使用質量百分濃度為0.9%的nacl溶液以0.5ml/min的速率進行洗脫。收集單一組分(lep-2a)、透析、凍幹。
二、乙醯化粒毛盤菌胞外多糖(alep-2a)的製備
本實施例以上述所獲得的粒毛盤菌胞外多糖為原料,按如下方法製備乙醯化粒毛盤菌胞外多糖:
將2g粒毛盤菌胞外多糖與80ml甲醯胺混合,於60℃攪拌30min後,加入50ml由n-溴代丁二醯亞胺(nbs)和乙酸酐(1:1,mg/ml)配製而成的溶液,於60℃反應6h後,加入20ml蒸餾水終止反應。冷卻至室溫後,使用體積百分濃度為95%的乙醇將溶液於4℃醇沉24h。4000r/min離心15min,濾出沉澱,並將沉澱復溶於100ml蒸餾水。使用1mol/lnaoh溶液中和該溶液,於截留分子量為14000da透析袋中先用自來水逆向流動透析48h,再用蒸餾水透析24h。將獲得物濃縮並凍幹得到乙醯化粒毛盤菌胞外多糖(alep-2a)。
按如下方法測試產物alep-2a中乙醯基的含量:
乙醯基標準曲線的繪製:將50ml鹽酸羥胺溶液(0.1mol/l)與50mlnaoh溶液(1.5mol/l)混合,然後分別向5ml含不同濃度乙醯基(0、20、40、60、80和100mg/l)的標準溶液中加入10ml該混合液。此後,依次加入5ml鹽酸(2mol/l)和10mlfecl3溶液(0.37mol/l)。於500nm處測定其吸光度值,並以a500對乙醯基濃度繪製標準曲線。
乙醯基含量的測定:將5mgalep-2a溶於5ml蒸餾水,然後依次加入5ml鹽酸羥胺溶液(0.1mol/l)、5mlnaoh溶液(1.5mol/l)、5ml鹽酸(2mol/l)和10mlfecl3溶液(0.37mol/l)。於500nm處測定其吸光度值,並根據標準曲線計算乙醯基含量。
經上述測試可知本實施例所得alep-2a中乙醯基的質量分數為4.6%。
三、乙醯化粒毛盤菌胞外多糖(alep-2a)的結構驗證
紅外光譜測定:分別取2mglep-2a和alep-2a與kbr(1:100)混合均勻,研磨後壓片,採用傅立葉變換紅外光譜儀(nexus670)進行ir分析,掃描範圍為4000-400cm-1。
圖1為lep-2a和alep-2a的紅外光譜。對比分析發現,lep-2a和alep-2a均具有粒毛盤菌胞外多糖的特徵吸收,3400、2930和1650cm-1處的強吸收峰分別歸因於o-h的伸縮振動、c-h的伸縮振動和結合水的彎曲振動,1050cm-1處的峰表明存在吡喃糖環;對於alep-2a,1726cm-1處的峰歸因於c=o伸縮振動的特徵吸收,1380cm-1處的峰是由c-ch3伸縮振動引起的,1250cm-1處的強吸收峰歸因於c-o的伸縮振動。以上結果表明,乙醯化修飾成功。
核磁共振碳譜測定:分別取50mglep-2a和alep-2a溶於1mld2o,採用brukerav-500核磁共振光譜儀進行13cnmr分析。
圖2為lep-2a和alep-2a的核磁共振碳譜。對比分析發現,alep-2a的核磁共振碳譜中δ99.469ppm、δ70.399ppm、δ70.091ppm、δ66.925ppm和δ61.031ppm處碳信號明顯減弱,表明→2)-α-d-manp-(1→的c-3、c-4和c-6位,α-d-manp-(1→的c-2、c-3、c-4和c-6位,→2,6)-α-d-manp-(1→的c-3和c-4位,→3,4)-α-d-manp-(1→的c-2、c-4和c-6位,→3)-β-d-galp-(1→的c-1、c-2、c-4和c-6位以及β-d-galp-(1→的c-2、c-4和c-6位可能被乙醯基部分取代。這一結果進一步證實了乙醯化修飾成功。
四、粒毛盤菌胞外多糖(lep-2a)及乙醯化粒毛盤菌胞外多糖(alep-2a)的心血管保護作用藥理實驗
(1)實驗所用動物:昆明小鼠42隻,雄性,體重20±2g。
(2)實驗所用試劑盒:超氧化物歧化酶(sod)測定試劑盒、穀胱甘肽過氧化物酶(gsh-px)測試盒、過氧化氫酶(cat)測試盒、丙二醛(mda)測試盒和一氧化氮(no)試劑盒購自南京建成生物工程研究所;小鼠晚期糖基化終末產物(ages)elisa檢測試劑盒、小鼠可溶性細胞間粘附分子1(sicam-1)elisa檢測試劑盒、小鼠高敏c反應蛋白(hs-crp)elisa檢測試劑盒和小鼠內皮素1(et-1)elisa檢測試劑盒購自上海研生生物技術科技有限公司。
(3)實驗方法:首先對42隻昆明小鼠進行適應性餵養1周後,稱重。取36隻昆明小鼠,腹腔注射60mg/kg劑量的鏈脲佐菌素(stz),若血糖水平>16.7mmol/l,表明糖尿病模型小鼠建模成功;同時對剩餘的6隻昆明小鼠腹腔注射等劑量的0.9%生理鹽水。然後,將36隻糖尿病模型小鼠隨機分為6組(每組6隻):
模型組:每日灌胃10ml/kg劑量的生理鹽水;
二甲雙胍組:每日灌胃100mg/kg劑量的二甲雙胍;
低劑量lep-2a組:每日灌胃50mg/kg劑量的lep-2a;
高劑量lep-2a組:每日灌胃200mg/kg劑量的lep-2a;
低劑量alep-2a組:每日灌胃50mg/kg劑量的alep-2a;
高劑量alep-2a組:每日灌胃200mg/kg劑量的alep-2a;
此外,將6隻正常昆明小鼠作為正常組,每日灌胃10ml/kg劑量的生理鹽水。
連續灌胃4周後,將小鼠禁食過夜,並再次測量血糖水平。稱重後,摘眼球取血,並通過頸椎脫位處死小鼠。於4℃以3500r/min離心10min立即分離血清,並於-80℃貯存直至測定。迅速取出心臟、腎臟和肝臟,吸乾並稱重。將心臟組織於生理鹽水中均質化(1:10,g/ml),然後於4℃以3500r/min離心10min,取上清用於生化測定。
(4)相關指標測定:
使用商用試劑盒測定心臟組織中sod、gsh-px、cat活性和mda水平;
參照檢測試劑盒的製造說明書並通過酶法測定血清中ages、hs-crp、sicam-1、no和et-1含量。
(5)藥理實驗結果:
表1給出了粒毛盤菌胞外多糖及乙醯化粒毛盤菌胞外多糖對糖尿病小鼠血糖水平的影響。
表1lep-2a及alep-2a對糖尿病小鼠血糖水平的影響
註:#p<0.05,##p<0.01,與正常組相比;*p<0.05,**p<0.01,與模型組相比。
對表1中的各組指標參數進行比較分析,可以看出lep-2a及alep-2a對各治療組小鼠相關指標的影響。如表1中所示,正常小鼠的血糖水平明顯(p<0.01)低於stz誘導的糖尿病小鼠的血糖水平。連續灌胃4周後,模型組小鼠的血糖水平仍處於較高水平(22.80±1.41),而lep-2a及alep-2a治療組小鼠的血糖水平顯著(p<0.01)降低,尤其是200mg/kg劑量的alep-2a治療組。
表2給出了粒毛盤菌胞外多糖及乙醯化粒毛盤菌胞外多糖對糖尿病小鼠心臟、腎臟和肝臟指數的影響。
表2lep-2a及alep-2a對糖尿病小鼠心臟、腎臟和肝臟指數的影響
註:#p<0.05,##p<0.01,與正常組相比;*p<0.05,**p<0.01,與模型組相比。
對表2中的各組指標參數進行比較分析,可以看出lep-2a及alep-2a對各治療組小鼠相關指標的影響。如表2中所示,與正常小鼠相比,stz誘導的糖尿病小鼠的心臟、腎臟和肝臟指數顯著(p<0.01)增加。與模型組小鼠相比,lep-2a及alep-2a治療組小鼠心臟、腎臟和肝臟指數顯著(p<0.05或p<0.01)降低;二甲雙胍治療也顯著(p<0.01)降低了糖尿病小鼠的這些指數。
表3給出了粒毛盤菌胞外多糖及乙醯化粒毛盤菌胞外多糖對糖尿病小鼠心臟組織中sod、gsh-px、cat活性和mda水平的影響。
表3lep-2a及alep-2a對糖尿病小鼠心臟組織中sod、gsh-px、cat活性和mda水平的影響
註:#p<0.05,##p<0.01,與正常組相比;*p<0.05,**p<0.01,與模型組相比。
對表3中的各組指標參數進行比較分析,可以看出lep-2a及alep-2a對各治療組小鼠相關指標的影響。如表3中所示,與正常小鼠相比,stz誘導的糖尿病小鼠心臟組織中sod活性顯著(p<0.01)降低。與模型組小鼠相比,lep-2a及alep-2a治療顯著(p<0.05或p<0.01)增加了糖尿病小鼠心臟組織中sod活性,尤其是200mg/kg劑量的alep-2a治療,而50mg/kg劑量的lep-2a治療無顯著差異;二甲雙胍治療也顯著(p<0.01)增加了糖尿病小鼠心臟組織中sod活性,且稍強於200mg/kg劑量的alep-2a治療。
與正常小鼠相比,stz誘導的糖尿病小鼠心臟組織中gsh-px活性顯著(p<0.01)降低。與模型組小鼠相比,lep-2a、alep-2a及二甲雙胍治療均顯著(p<0.01)增加了糖尿病小鼠心臟組織中gsh-px活性,且200mg/kg劑量的alep-2a治療相比二甲雙胍治療作用更強。
與正常小鼠相比,stz誘導的糖尿病小鼠心臟組織中另一種抗氧化酶cat活性顯著(p<0.01)降低。與模型組小鼠相比,lep-2a及alep-2a治療顯著(p<0.01)增加了糖尿病小鼠心臟組織中cat活性,尤其是200mg/kg劑量的alep-2a治療,但稍弱於二甲雙胍治療。
與正常小鼠相比,stz誘導的糖尿病小鼠心臟組織中mda水平顯著(p<0.01)增加。與模型組小鼠相比,lep-2a、alep-2a及二甲雙胍治療均顯著(p<0.01)降低了糖尿病小鼠心臟組織中mda水平,且200mg/kg劑量的alep-2a治療相比二甲雙胍治療作用更強。以上結果表明,lep-2a及alep-2a可能通過維持抗氧化酶水平以及改善糖代謝和脂質代謝發揮心血管保護作用。
表4給出了粒毛盤菌胞外多糖及乙醯化粒毛盤菌胞外多糖對糖尿病小鼠血清ages、hs-crp、sicam-1、no和et-1的影響。
表4lep-2a及alep-2a對糖尿病小鼠血清ages、hs-crp、sicam-1、no和et-1的影響
註:#p<0.05,##p<0.01,與正常組相比;*p<0.05,**p<0.01,與模型組相比。
對表4中的各組指標參數進行比較分析,可以看出lep-2a及alep-2a對各治療組小鼠相關指標的影響。如表4中所示,與正常小鼠相比,stz誘導的糖尿病小鼠血清中ages、hs-crp和sicam-1水平顯著(p<0.05或p<0.01)增加。經lep-2a及alep-2a治療,糖尿病小鼠血清中ages、hs-crp和sicam-1水平顯著(p<0.05或p<0.01)降低,尤其對於sicam-1。與模型組小鼠相比,二甲雙胍治療也顯著(p<0.05或p<0.01)降低了糖尿病小鼠血清中ages、hs-crp和sicam-1水平。
與正常小鼠相比,stz誘導的糖尿病小鼠血清中no水平顯著(p<0.01)降低。經lep-2a、alep-2a及二甲雙胍治療,糖尿病小鼠血清中no水平顯著(p<0.05或p<0.01)增加。
與正常小鼠相比,stz誘導的糖尿病小鼠血清中et-1水平顯著(p<0.01)增加。與模型組小鼠相比,lep-2a、alep-2a及二甲雙胍治療均顯著(p<0.01)降低了糖尿病小鼠血清中et-1水平,而50mg/kg劑量的lep-2a治療無顯著差異。以上結果表明,lep-2a及alep-2a主要通過改善心血管功能發揮心血管保護作用。
(6)結論:
綜上所述,lep-2a及alep-2a能夠有效治療糖尿病小鼠的心血管疾病,尤其是200mg/kg劑量的alep-2a治療,表明採取乙醯化修飾改性的粒毛盤菌胞外多糖的心血管保護作用明顯增強。一方面,主要通過提高抗氧化酶水平,從而抑制氧化應激;另一方面,主要通過增加no水平並降低et-1水平,恢復血管收縮和舒張平衡以改善心血管功能。
五、乙醯化粒毛盤菌胞外多糖(alep)製劑的加工
1、片劑加工
將300-600g乙醯化粒毛盤菌胞外多糖與藥用輔料稀釋劑200-300g、助流劑20-50g混勻後,與200-400ml乙醇混合均勻製得軟材,軟材過篩得到溼顆粒,乾燥後整粒,最後加入潤滑劑5-10g混勻後壓片,製成1000片片劑。所述藥用輔料稀釋劑選用糊精或幹澱粉;所述助流劑採用滑石粉、微粉矽膠或微晶纖維素;所述潤滑劑採用硬脂酸鎂或硬脂酸鋅。
本實施例推薦的片劑加工的優選例為:取過80-100目篩的上述乙醯化粒毛盤菌胞外多糖500g、稀釋劑糊精250g、助流劑滑石粉40g,混合均勻後加300ml乙醇混合均勻製得軟材,軟材過篩得到溼顆粒,乾燥後整粒,最後加入潤滑劑硬脂酸鎂10g混勻後壓片,製成1000片,片重0.8g,乙醯化粒毛盤菌胞外多糖含量0.5g/片。
2、膠囊劑加工
將藥用輔料稀釋劑200-300g、助流劑50-70g、潤溼劑2-6g混勻後,再與300-600g的上述乙醯化粒毛盤菌胞外多糖混合均勻,裝1#空心膠囊,製得膠囊劑1000粒。所述藥用輔料稀釋劑選用糊精或幹澱粉;所述助流劑採用滑石粉或微粉矽膠或微晶纖維素;所述潤溼劑採用十二烷基硫酸鈉或者磺基丁二酸二辛酯。
本實施例推薦的膠囊劑加工優選例為:取稀釋劑幹澱粉200g,助流劑滑石粉40g,潤溼劑十二烷基硫酸鈉5g混合均勻後,再與400g上述乙醯化粒毛盤菌胞外多糖混合均勻後裝1#空心膠囊1000粒,多糖含量0.4g/粒。
