一種具有雙加熱和顯像功能的靶向納米磁粒及其製備方法和用途與流程
2023-09-22 02:40:50 2
本發明涉及生物醫學工程和納米醫學領域,具體涉及構建的新型Fe3O4@Au-尼妥珠單抗(即Fe3O4@Au-Nimotuzumab)靶向複合納米磁粒,在腫瘤熱療中的應用。
背景技術:
磁性納米粒子(Magnetic Nanoparticles,納米磁粒)誘導的腫瘤組織熱療是一種極具潛力的治療手段,已在多種體外實驗的動物模型中被評估,取得可喜的結果,目前已經進入Ⅰ期臨床試驗。熱療是一個治療程序,其原理是促進人體組織溫度升高,以改變細胞結構和功能,即溫度增加到41℃至42℃之間時,可以誘導腫瘤細胞死亡。因為腫瘤細胞比周圍正常細胞對溫度突然升高的耐受性差。溫度的升高引起許多酶和結構蛋白質在細胞內的運作,進而改變細胞的增殖和分化,誘發細胞凋亡。一般認為熱療觸發的細胞膜改變導致跨膜轉運的減少並且破壞膜電位平衡。而且溫度升高可以影響核酸的合成並抑制修復酶,促進DNA結構變異。熱療所需的高溫可以通過不同的熱源獲得,如電磁輻射波(熱療用射頻或微波)、超聲波或電誘導熱療。這些技術顯示出了良好的效果,然而這些傳統方法的主要問題是如何達到熱療溫度均勻分布到腫瘤深部區域。從某種意義上說,治療失敗源於一些腫瘤區域溫度升高不足,使腫瘤復發。同時過熱也可導致癌旁組織損傷。目前磁流體熱療(magnetic fluid hyperthermia,MFH)技術已經部分解決了這些問題。MFH的原理,是在腫瘤內注射磁流體,隨後將腫瘤置於交變磁場(alternating magnetic field,AMF)下,促使腫瘤區域溫度升高。應用磁性材料提高熱療療效開始於20世紀50年代中後期Gilchrist等的研究。隨後,許多研究評估了在不同腫瘤中的治療。然而,這些初步的研究結果直到20世紀90年代初才在學術界廣泛使用,而且目前這一領域也僅有少數臨床研究。因此,為更好地應用於人體治療,有關物理條件、毒性程度和療效的更詳細研究是必要的。目前,MFH是一種非侵入性的極具前景的技術,能有效地對深部和難以觸及的組織進行熱療。MFH可以特異性的靶向腫瘤組織,其溫度分布均勻且熱傳導率高,並減少健康組織的損害。
除納米磁粒外,納米金(nanogo1d)作為熱療用光敏感劑,也越來越受到學術界廣泛的關注。納米金即指金納米粒子,其直徑在1~100nm,具有高電子密度、介電特性、高吸收截面和高光熱轉化效率,經過靜脈注射後,能夠富集在腫瘤部位,經近紅外光(near-infrared,NIR)照射後,通過吸收近紅外雷射能量,能迅速升溫「熱死」腫瘤細胞。此外,納米金還具有良好的生物相容性,能與多種生物大分子結合,且不影響其生物活性。作為現代四大標記技術之一的納米金標記技術(nanogold labelling techique),實質上是蛋白質等高分子被吸附到金納米粒子表面的包被過程。球形的金納米粒子對蛋白質有很強的吸附功能,吸附機理可能是金納米粒子表面負電荷,與蛋白質的正電荷基團因靜電吸附而形成牢固結合,而且吸附後不會使生物分子變性,因此金納米粒子又是理想的藥物載體。
表皮生長因子受體(epithelial growth factor receptor,EGFR)介導的信號通路在腫瘤生長、侵襲及轉移中發揮重要作用,與腫瘤惡性程度及不良預後密切相關,是腫瘤治療的重要靶點。尼妥珠單抗(Nimotuzumab)是在第一代人-鼠嵌合抗體西妥昔單抗基礎上開發的新一代IgGl型抗EGFR單克隆抗體,人源化程度達95%,免疫原性大大降低,安全性明顯提高,並且在人體內的血清半衰期延長。臨床前研究、臨床研究表明,尼妥珠單抗在頭頸部鱗狀細胞癌、鼻咽癌和膠質瘤等實體瘤均顯示出較高的抗腫瘤活性及腫瘤組織特異性,同時具有耐受性好、皮疹發生率低等優點。
EGFR單抗對腫瘤細胞的靶向性取決於其與受體的親和力常數(Kd)。尼妥珠單抗的Kd為4.5l×10-8mol/L,這種中度親和力既可有效靶向腫瘤細胞,阻斷配體與EGFR的結合,穩定受體構象不被二聚化,還可使皮膚等正常組織較低水平地攝取尼妥珠單抗。因此,尼妥珠單抗在發揮相似的最大抗腫瘤效應的同時,還允許低劑量的正常EGFR保持活性,有助於降低不良反應發生率。由此可見,尼妥珠單抗的靶向性是分子水平的,是靶向性很好的藥物,能夠賦予載體更好的靶向性。
技術實現要素:
為解決現有技術中的難題,既能賦予Fe3O4@Au更好的靶向性,使其進入腫瘤細胞,而非正常細胞進行熱療;又能利用Fe3O4的超順磁性在磁共振成像(Magnetic Resonance Imaging,MRI)下顯像示蹤、Fe3O4的磁感應性進行磁熱療,Au的光敏感性對腫瘤細胞進行近紅外熱療進而將其同時作為腫瘤熱療的磁感應劑、光敏感劑和陰性造影劑。本發明提供了一種具有雙加熱和顯像功能的靶向複合納米磁粒,技術方案如下:
本發明涉及一種具有雙加熱和顯像功能的靶向複合納米磁粒,其特徵在於,由Fe3O4納米粒子和Au複合而成的、具有核殼結構、並吸附單克隆抗體尼妥珠單抗,以形成Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒。
優選的,所述的靶向複合納米磁粒,其特徵在於,是以Fe3O4納米粒子作為核心,以Au作為納米磁粒殼層,具有核殼結構、並在該納米磁粒的表面吸附單克隆抗體尼妥珠單抗,以形成Fe3O4@Au-尼妥珠單抗複合納米磁粒。
另一方面,本發明還涉及一種上述靶向複合納米磁粒的製備方法,其特徵在於,
1)Fe3O4納米磁粒的製備:取0.01~0.1mol/L的FeCl3、FeCl2溶液,按摩爾比Fe3+:Fe2+=5:3將二者混合,去離子水分別配製10ml 1mol/L的檸檬酸三鈉溶液和50ml 1mol/L的氫氧化銨溶液,取混合液0.01~0.1倍量的0.1~1mol/L檸檬酸三鈉以及0.01~0.5倍量的0.1~1mol/L氫氧化銨混合液快速加入氮氣保護下的上述混合液中,溶液中迅速出現黑色沉澱物,繼續攪拌30~60min後停止。於60℃~80℃水浴恆溫30~60min進行熟化,然後用磁鐵吸住燒瓶底部,傾去上層廢液,用去離子水反覆衝洗生成物,至其溶液PH=7,將生成物真空乾燥,既得Fe3O4納米磁粒;
2)Fe3O4@Au複合納米磁粒的製備:用去氧處理後的去離子水和上述Fe3O4納米磁粒配製為濃度0.01~0.1mol/l的混懸液,超聲處理5min以上,功率為600W,將上述混懸液與0.1~1mol/l的檸檬酸三鈉溶液,按照體積比1:1~1:2混合攪拌10~30min,然後,再按照體積比1:5~1:10向上述混合液中加入去離子水稀釋,將所得混合液與質量體積濃度為0.1~1%金氯酸溶液按照體積比20:1~10:1混合後加熱,邊加熱邊攪拌,緩慢加入1~10:1倍量的0.1~2mol/l的鹽酸羥胺溶液,直至混合液顏色由淡黃變為金膠體的特徵紅色後,停止加熱;再利用磁鐵將磁性納米顆粒從上述液體中分離出,然後用HCl洗滌3次以上,並用去離子水清洗1~3次,真空乾燥後,即得到Fe3O4@Au複合納米磁粒;
3)製備Fe3O4@Au-尼妥珠單抗複合納米磁粒:稱取少量上述Fe3O4@Au複合納米磁粒,用去離子水配置成0.1~1g/L Fe3O4@Au複合納米磁粒混懸液,取上述混懸液1~5ml,並用0.01~0.1mol/l的HCl溶液調節其pH至9.0~10.0,加入1~5mg/ml的尼妥珠單抗注射液4~20μl,置於空氣中震蕩,於37℃、200r/min的速度充分混合上述混懸液並反應2~4h,再加入20~100μl的質量分數為1%的牛血清蛋白(BSA)溶液,反應30min~1h,然後用磁鐵分離20~60min,小心移去上清液,沉澱用1~5ml質量分數為1%的牛血清蛋白(BSA)溶液溶解搖勻後,於4℃下保存備用,即得Fe3O4@Au-尼妥珠單抗複合納米磁粒。
此外,本發明還涉及上述靶向複合納米磁粒的用途:
一方面,本發明涉及一種上述的Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的用途,其特徵在於,在製備靶向抗腫瘤藥物中的應用。
一方面,本發明涉及一種上述的Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的用途,其特徵在於,在製備顯像示蹤藥物中的應用;優選的,所述的用途為用於製備腫瘤活體追蹤藥物。
一方面,本發明涉及一種上述的Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的用途,其特徵在於,在製備輔助腫瘤熱療藥物中的應用;
優選的,所述的用途為用作腫瘤熱療的磁感應劑、光敏感劑或陰性造影劑;
優選的,所述的用途為在製備輔助腫瘤熱療的控溫及恆溫藥物中的應用;
優選的,所述的用途為在製備輔助腫瘤光熱轉換的近紅外光譜技術熱療藥物中的應用;
優選的,所述的用途為在製備輔助雙熱療藥物中的應用;進一步優選的,所述的雙熱療技術為磁流體熱療聯合近紅外光譜技術熱療技術。
有益效果
本發明與現有技術相比,具有以下優點:
1.採用檸檬酸鹽-金氯酸還原法來製備顆粒的金殼層,簡化Fe3O4@Au複合納米磁粒的構建工藝。先用化學共沉澱法合成水相分散的Fe3O4納米磁粒,然後再以這些納米磁粒為晶種,在其表面用金氯酸的檸檬酸鹽還原法生成金殼層。早在1951年,Turkevitch就最先報導了以較小的金納米顆粒為種子,用氫氧化亞胺與金氯酸反應來製備粒徑較大的金納米顆粒。最近的研究表明,通過改變晶種與金屬的比率,金納米顆粒的粒徑可控制在5~40納米範圍,尺寸分布相對誤差在10-15%。在避免二次成核方面,逐步的顆粒放大方法要比一次性晶種生長法更有效。只要反應試劑和條件選擇恰當,同質生長金納米顆粒的晶種調製法對異質生長Fe3O4@Au核殼結構納米顆粒也同樣有效。我們採用檸檬酸鈉與金氯酸反應的方法,在晶種Fe3O4納米磁粒表面異質生長金殼層,將製備得到的納米磁粒分散在HAuCl4溶液中,加熱煮沸,利用還原劑對Au3+進行還原,還原的Au原子會以Fe3O4為種子,在其表面沉積並生長。由於非均勻成核所需動力要低於均勻成核的動力要低於均勻成核,因此,Au原子優先在Fe3O4上成核。從單分散顆粒形成的機理可知:控制實驗條件,可以使成核與長大分兩個階段進行,經典的Frens方法製備金溶膠是均勻成核的過程,金核的形成往往需要一定誘導期,當溶液中金的濃度低於其成核濃度,但又高於飽和濃度的時候,不會形成新的金核,而是在己有種子的情況下以相同的速度慢慢長大,因此控制種子的量和HAuCl4的量,能夠控制複合粒子的大小和表面包覆量。
本發明製備的Fe3O4@Au複合納米磁粒大小均勻、圓形、平均直徑分別為30nm、殼層平均厚度5nm,分散性好、具有較好的穩定性,磁響應性和光學性質;並具有良好的生物相容性。
2.尼妥珠單抗在Fe3O4@Au複合納米磁粒上的吸附能力較好。為了最大程度保持尼妥珠單抗固定後的抗體活性,我們選擇採用吸附法將尼妥珠單抗固定在Fe3O4@Au複合納米磁粒的Au殼層上。借鑑膠體金標記蛋白技術,金納米粒子對蛋白的吸附主要取決於pH值,在接近蛋白質的等電點或偏鹼的條件下,二者容易形成牢固的結合物。這種結合目前認為是金表面負電荷和抗體正電荷基團因靜電作用而吸附,並形成Au-S等穩定化學鍵而形成了牢固結合。該Fe3O4@Au複合納米磁粒,平均粒徑30nm,且表面帶有較強負電荷,可以有效地固定IgG單克隆抗體尼妥珠單抗。由於鹽類成分能影響金膠體對抗體的吸附,並可使溶膠聚沉,利用這一特性,我們選擇尼妥珠單抗的最佳吸附量,結果顯示40-100μg/mL的尼妥珠單抗能穩定Fe3O4@Au複合納米磁粒混懸液,說明此範圍質量濃度下尼妥珠單抗和Fe3O4@Au複合納米磁粒比例合適。我們利用常見的酶免疫吸附法,研究了Fe3O4@Au複合納米磁粒和尼妥珠單抗的吸附情況。
Fe3O4@Au複合納米磁粒不僅能與抗體結合,而且可通過磁性分離形成沉澱。因此,在Fe3O4@Au複合納米磁粒吸附尼妥珠單抗的溶液中加入酶標羊抗人IgG的二抗,然後磁性分離,可將Fe3O4@Au-尼妥珠單抗複合納米磁粒-酶標羊抗人IgG複合物從溶液中分離。清液中的物質為未和尼妥珠單抗結合併保留下來的酶標抗體,加入底物顯色液,就可正常顯色。如果同時以同濃度的尼妥珠單抗溶液和酶標羊抗人IgG反應,加入底物顯色液,顯色後測定其OD值,通過兩次OD值得對比,可得到Fe3O4@Au複合納米磁粒對尼妥珠單抗對抗體Fc端的吸附率。結果表明Fe3O4@Au複合納米磁粒對尼妥珠單抗Fc端的吸附效率在90%以上(如表1所示),說明Fe3O4@Au複合納米磁粒對尼妥珠單抗的吸附效果比較優良。該過程方法簡單,利用了磁性分離和酶標抗體的顯色能力,通過免疫酶吸附技術進行測定,獲得了較理想的結果。採用雷射粒度分析、zeta電位測定、UV-Vis光譜和磁滯回線等對Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒進行表徵。雷射粒度分析Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的平均直徑為50nm,單峰狀,粒徑分布窄,與Fe3O4@Au的平均直徑30nm相比略有增大,這可能是由於Fe3O4@Au表面吸附尼妥珠單抗,形成一層蛋白質層,造成Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒在水相中粒徑增大。在pH 7.4中性環境中,Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的zeta電位值為正電荷,說明尼妥珠單抗牢固吸附在Fe3O4@Au複合納米磁粒表面,將粒子表面電荷轉變為正電荷。UV-Vis光譜顯示可以看出Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的最大光吸收峰較Fe3O4@Au複合納米磁粒的最大光吸收峰,出現明顯的紅移現象,這表明抗體很好的吸附在金表面。Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的磁滯回線接近為重合「S」型曲線,與Fe3O@Au複合納米磁粒相似,其矯頑力及剩磁很低,具有良好的超順磁性。
3.具有較強的腫瘤活體追蹤能力。該Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒,可以作為特異性的靶向腫瘤EGFR受體,同時其磁學性能表現為超順磁性,且具有良好的生物相容性。Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的超順磁性可使磁共振成像(即MRI)的靶區信號明顯降低而產生負性對比劑效應,從而可以在MRI上對靶細胞進行觀察、示蹤。利用自製備的Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒在MRI的成像特點我們評價了其對膠質瘤細胞的特異性靶向作用。結果顯示,Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒與U251細胞共孵育後在T2WI和T2*WI上信號強度均明顯降低,Fe3O4@Au複合納米磁粒和尼妥珠單抗與U251細胞共孵育後在T2WI和T2*WI上信號強度無明顯降低。表明Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒對U251細胞具有良好的靶向性,相對於Fe3O4@Au複合納米磁粒,其可以更多的進入U251細胞,造成T2WI和T2*WI信號明顯降低。
同時,我們建立了裸鼠膠質瘤移植瘤模型,進行在體MRI靶向性評價。在體MRI結果顯示,尾靜脈注射Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒後腫瘤組織不同時間點的T2WI、T2*WI強度及信號變化率均有明顯下降,其中T2*WI最為明顯,具有統計學差異,這可能是由於T2*WI對磁化率的差異更敏感,鐵引起的磁敏感效應更大。而Fe3O4@Au複合納米磁粒+尼妥珠單抗在注射後2h和8h兩個時間點的信號亦有輕度下降,但下降幅度較Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒小,且持續時間短,Fe3O4@Au複合納米磁粒注射後24h的信號強度即恢復至平掃水平,而Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒注射後24h的信號強度仍然維持在較低水平,表明通過尼妥珠單抗介導靶向性和胞吞作用,且效果較非複合納米磁粒具有顯著性差異,即取得了預料不到的技術效果。Fe3O4@Au複合納米磁粒主要聚集在膠質瘤U251細胞內,沒有被單核-吞噬細胞系統吞噬降解,這與體外U251細胞MRI結果相一致。
4.輔助腫瘤熱療的控溫及恆溫。Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒具有超順磁性,在一定磁場下能快速均勻吸收電磁能而升溫。體外升溫恆溫實驗發現其在230kHZ的AMF作用下,在最初的30min內升溫急劇,30min~45min升溫平緩,50min後溫度幾乎不再上升而恆定。這是因為在體外升溫實驗中Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒的濃度、AMF磁場的強度較低,並且存在著產熱和散熱的平衡,即以一定的濃度存在於某介質當中的Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒吸收電磁波所產生的熱量與散發到介質及環境中的熱量存在著一個動態的平衡過程。為此,我們可以利用不同濃度的Fe3O4@Au-尼妥珠單抗磁流體在一定磁場強度下的升溫恆溫特性,實現腫瘤熱療的控溫(調節磁流體的濃度)及恆溫。
5.輔助腫瘤光熱轉換的近紅外光譜技術(即NIR)熱療。Fe3O4@Au-尼妥珠單抗靶向複合納米磁粒,其吸收光譜較Au納米粒子出現了明顯的紅移。利用其光學特性,我們採用功率為2.5W的808nm NIR分別對其進行照射60min。在最初的15min內升溫急劇,30min後溫度幾乎不再上升而恆定。這是因為在體外升溫實驗中Fe3O4@Au複合納米磁粒的濃度較低,並且存在著產熱和散熱的平衡。同時我們認為溫度快速升高是由於NIR照射區域較小,熱量還未傳遞到周圍的環境中去,引起的局域溫度升高過快造成的。而且不同濃度的混懸液照射後的溫度梯度也不同,濃度越大溫度升高越快。由於腫瘤細胞在42℃左右即可被殺死,製備的Fe3O4@Au複合納米磁粒可以在利用光熱轉換的NIR熱療中得到應用。
6.磁流體熱療(MFH)聯合近紅外光譜技術(NIR)熱療。通過分別進行Fe3O4@Au靶向複合納米磁粒在AMF和NIR作用下進行升溫恆溫試驗,利用Fe3O4@Au靶向複合納米磁粒在AMF作用下升溫速度慢、達到熱平衡時間長、但恆定溫度高的特點;而其在NIR作用下升溫速度快、達到熱平衡時間短、但恆定溫度低的特點。因此我們將二者聯合應用進行升溫恆溫試驗。結果顯示,當AMF強度一定並且NIR雷射照射功率一定時,在二者同時作用下,開始15分鐘內溫度可以迅速上升,20min後溫度幾乎不再上升而保持穩定。這可能是由於Fe3O44@Au複合納米磁粒在AMF和NIR照射開始階段,其Au層對吸收NIR,可以快速的將光能轉化為熱能,使周圍環境溫度迅速升高;而其核心Fe3O4可以持續吸收AMF的電磁波,將電磁能量轉化為熱能,使周圍環境溫度繼續升高,且在較高溫度達到熱平衡。Fe3O4@Au複合納米磁粒的這種升溫恆溫特點,具有很好的臨床應用前景,可以縮短單純MFH的治療時間,並且可以獲得更好的治療效果。
附圖說明
圖1為Fe3O4@Au-Nimotuzumab複合納米磁粒透射電鏡圖(100000)
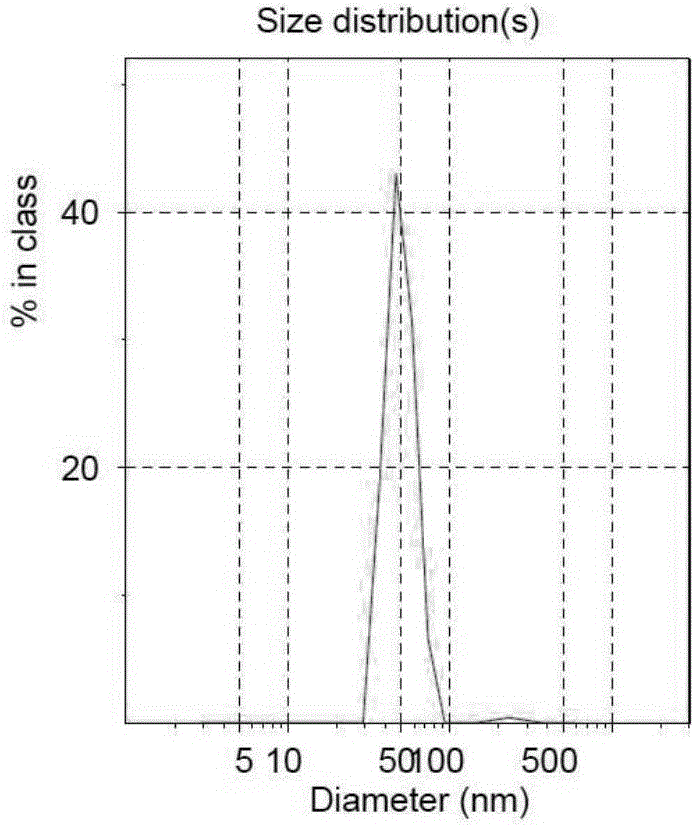
圖2為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒平均粒徑分布圖
圖3為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒zeta電位圖
圖4曲線d為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒吸收光譜
圖5為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒的磁滯回線
圖6為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒與U251細胞共孵育後在MRI T2WI上圖像
圖7為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒與U251細胞共孵育T2WI弛豫時間
圖8為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒注射後裸鼠移植瘤MRI T2*WI圖像
圖9為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒注射後裸鼠移植瘤MRI T2*WI弛豫時間
圖10為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒在交變磁場作用下體外熱動力學試驗結果
圖11為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒在近紅外光作用下體外熱動力學試驗結果
圖12為Fe3O4@Au-Nimotuzumab靶向複合納米磁粒在交變磁場和近紅外光聯合作用下體外熱動力學試驗結果。
具體實施方式
下面通過實施例對本發明做進一步具體說明。
1.主要試劑
1)三氯化鐵(FeCl3.6H2O,A.R):中國醫藥上海化學試劑採購供應站
2)氯化亞鐵(FeCl2.4H2O,A.R):中國醫藥上海化學試劑採購供應站
3)氨水(NH3.H2O,A.R):上海化學試劑有限公司
4)鹽酸(HCL A.R):南京化學試劑一廠
5)氫氧化鉀(KOH,A.R):上海凌峰化學試劑有限公司
6)氫氧化鈉(NaOH A.R):上海化學試劑有限公司
7)無水乙醇:分析純,南京化學試劑一廠
8)異丙醇:分析純,南京化學試劑一廠
9)氯仿:分析純,中國寶應化學試劑廠
10)無水乙醚:分析純,南京化學試劑一廠
11)鹽酸羥胺:分析純,中國醫藥上海化學試劑採購供應站
12)氯金酸(AuCl3.HCL.4H2O,A.R):中國醫藥上海化學試劑採購供應站
13)檸檬酸三鈉(C6H5Na3O7·2H2O,A.R):中國醫藥上海化學試劑採購供應站
14)HEPES:AMRESCO,美國
15)胎牛血清(BSA):杭州四季青生物工程公司,56℃水浴30分鐘滅活
16)PBS:準確稱取Na2HPO478.248g和NaH2PO430.592g置於大燒杯中,加雙蒸水350ml,攪拌均勻,定容至400ml,即得20×PBS儲存液,用時稀釋成1×PBS
17)DMEM培養基:GIBCO BD公司,美國
18)0.25%胰蛋白酶:AMRESCO,稱取胰蛋白酶0.25g,先用D-Hanks液調成糊狀,然後再用其定容至100ml,磁力攪拌30分鐘,使其完全溶解,用5.6%NaHCO3調pH值為7.2-7.6,過濾除菌,分裝後-20℃儲存備用
19)碳酸氫鈉(NaHCO3A.R):用雙蒸水配成5.6%溶液,微孔濾膜過濾除菌
20)25%戊二醛:生化試劑,中國醫藥(集團)上海化學試劑公司。用0.2M pH7.2的PBS配成4%戊二醛溶液,4℃保存
21)尼妥珠單抗注射液(每瓶含50mg尼妥珠單抗、4.5mg磷酸二氫鈉、18.0mg磷酸氫二鈉、86.0mg氯化鈉、2.0mg聚山梨醇酯80,50mg/瓶(10mL)),百泰生物藥業有限公司
2.主要儀器
1)SB3200型超聲波儀:BRANSON,上海
2)SL1001型電子天平:上海民橋電子儀器廠
3)JA1003型電子天平:上海天平儀器廠
4)SHZ-22水浴恆溫震蕩器:江蘇太倉醫療器械廠
5)微量加樣器:Eppendorf,美國
6)ZFQ-B型全自動蒸汽發生器:山東新華醫療器械股份有限公司
7)高速冷凍離心機:TA—2R(上海離心機械研究所)
8)免疫酶聯檢測儀:Multiskan MK3-353,美國
9)668型真空乾燥箱:江蘇東臺縣電器廠
10)振動磁強計:PPMS-9,Quantum Design,美國
11)數字溫度計:TM902C,深圳市經騰威實業有限公司
12)SPG-06A高頻磁感應加熱設備:頻率:230kHZ,輸出交變加熱電流:5A~30A,深圳雙平高頻加熱器廠
13)752稜光紫外可見分光光度計:上海精密科學儀器有限公司
14)808nm近紅外半導體雷射器:MDL-III-808,中國科學院長春光機所
15)7.0Tesla Mcrio-MR成像儀:PharmaScan,德國Bruker公司
3.細胞和動物
1)U251細胞株(人膠質瘤細胞):購自中科院上海細胞研究所
2)Babl/c nu/nu裸小鼠:5~7周齡,雌雄各半,SPF級,購自中科院上海萊克斯實驗動物中心,許可證號:SCXK(滬)2002-0010
實施例一、Fe3O4納米磁粒和Fe3O4@Au複合納米磁粒的製備
1.Fe3O4納米磁粒的製備
採用改良的化學共沉澱方法,用分析純FeCl3·6H2O和FeCl2·4H2O分別用去氧處理後的去離子水配製成0.1mol/L的FeCl3溶液和FeCl2溶液,按摩爾比Fe3+:Fe2+=5:3將100ml0.1mol/L的FeCl3溶液和60ml 0.1mol/L的FeCl2溶液混合於燒瓶中,再用去氧處理後的去離子水分別配製10ml 1mol/L的檸檬酸三鈉溶液和50ml 1mol/L的氫氧化銨溶液,將檸檬酸三鈉和氫氧化銨混合液快速加入氮氣保護下正劇烈磁力攪拌著的FeCl3和FeCl2混合液,溶液中迅速出現黑色沉澱物,繼續攪拌30min後停止。於80℃水浴恆溫30min進行熟化,然後用強磁鐵吸住燒瓶底部,傾去上層廢液,用去離子水反覆衝洗生成物,至其溶液PH=7,將生成物真空乾燥備用。
2.Fe3O4@Au複合納米磁粒的製備
用去氧處理後的去離子水溶解Fe3O4納米磁粒至0.01mol/L,超聲處理5分鐘,取20ml與20ml的0.1mol/L檸檬酸三鈉溶液混合攪拌10分鐘。再用去離子水稀釋混合液至200ml,加入濃度為0.1%金氯酸溶液10ml,開始加熱該溶液(配回流冷凝管)至沸後,逐次加入1mol/L鹽酸羥胺1ml,繼續加熱並攪拌,溶液顏色隨即由淡黃變為棕色,最後變為金膠體的特徵紅色,停止加熱。利用永久磁鐵將磁性納米顆粒從溶液中分離出,用lmol/1鹽酸反覆洗滌,以除去未包裹或包裹不完全的多餘的Fe3O4納米磁粒,並用去離子水清洗3次,即得到Fe3O4@Au複合納米磁粒,真空乾燥備用。
實施例二、Fe3O4@Au-Nimotuzumab靶向複合納米磁粒的製備和表徵
1.Fe3O4@Au複合納米磁粒對Nimotuzumab的吸附
取1g/L Fe3O4@Au複合納米磁粒混懸液5mL,用0.1mol/L的HCL溶液調節pH=9.0,加入5mg/mL的Nimotuzumab 20μL,置於空氣震蕩,於37℃、200轉/分左右的速度充分反應混合2h。再加入100μL質量分數1%的BSA溶液反應30min,磁性分離20min。小心移取上清液,沉澱用1mL 1%的BSA溶液溶解,搖勻後4℃下保存備用。
2.吸附免疫反應和吸附效果的測定
取100μL的Fe3O4@Au-Nimotuzumab混懸液,加入1mL酶標羊抗人Fc段二抗溶液(分別為500、1 000、2000、4000、8000、16000倍的酶標抗體稀溶液,pH=7.4),37℃水浴反應60min。4℃左右磁性分離60min,取上清液100μL加入100μL鄰苯二胺(OPD)底物溶液避光反應10min,加入50μL 2mol/L的硫酸溶液中止反應,在酶標儀中492nm波長下測定OD值。對照實驗中,將Fe3O4@Au表面的活性位點以BSA溶液完全封閉,然後加入Nimotuzumab溶液,從而獲得Fe3O4@Au-BSA,Nimotuzumab混合溶液。同樣取100uL該混合溶液,加入1mL酶標羊抗人Fc段二抗(分別為500、1 000、2000、4000、8000、16000倍的酶標抗體稀溶液,pH=7.4),步驟同上。
表1Fe3O4@Au對Nimotuzumab單抗Fc的吸附率
3.電鏡形態學檢測
取少量自製備的Fe3O4@Au-Nimotuzumab混懸液,滴有膜銅網,製得電鏡樣品,透射電子顯微鏡(transmission electron microscope,TEM)和掃描電子顯微鏡(scanning electron microscopy,SEM)下觀察。它們近似圓形,電子密度高,大小均一,呈散在分布。(圖1)
4.粒徑及zeta電位分析
應用ZETA SIZER3000雷射粒度分析儀進行粒徑、Zeta電位測定,應用動態光散射軟體進行數據處理,記錄平均粒徑及表面電位。Fe3O4@Au-Nimotuzumab靶向複合納米磁粒的平均直徑為51.4nm,單峰狀,粒徑分布窄(圖2)。在pH 7.4中性環境中,Fe3O4@Au-Nimotuzumab靶向複合納米磁粒的zeta電位值為38.6±6.1mV(圖3)。
5.光學性能檢測
應用752稜光紫外可見分光光度計測定紫外-可見光(UV-vis)吸收光譜。Fe3O4@Au溶液在612nm處有最大的光吸收峰,而Fe3O4@Au-Nimotuzumab溶液的最大光吸收峰在630nm,相同的稀釋倍數下,不僅Fe3O4@Au-Nimotuzumab的吸收峰值有所降低,而且出現明顯的紅移現象。這表明Nimotuzumab很好的吸附在納米金表面。(圖4)
6.磁學性能檢測
振動樣品磁強計(vibration sample magnetometer,VSM)進行體外磁響應性測定。磁滯回線表明,在300K溫度,Fe3O4@Au-Nimotuzumab靶向複合納米磁粒磁化強度均隨外加磁場強度的增大而增大,但最終都趨於飽和;當外加磁場強度逐漸降低至0時,其磁化強度也同樣趨近於0;反方向施加磁場,則反向趨於飽和。其磁滯回線接近為重合「S」型曲線,其矯頑力及剩磁很低,具有良好的超順磁性。(圖5)
7.穩定性檢測
Fe3O4納米磁粒和Fe3O4@Au-Nimotuzumab靶向複合納米磁粒分別用生理鹽水製備為磁流體後觀察其外觀形態、懸浮穩定性,然後4℃避光放置,然後每日觀察,持續2個月,進行觀察比較。製備的Fe3O4納米磁粒配製為磁流體後4℃、24h後均出現輕度沉降分層,上層為無色清亮液體,下層為黑色液體,境界清楚。予振蕩或超聲懸浮1min後,立即重懸為均勻黑色液體,呈膠體狀。而Fe3O4@Au-Nimotuzumab靶向複合納米磁粒配製為磁流體後4℃、1w後才出現輕度沉降分層,說明本實驗製備的Fe3O4@Au-Nimotuzumab靶向複合納米磁流體具有較好的懸浮穩定性。
實施例三、Fe3O4@Au-Nimotuzumab靶向複合納米磁粒體外靶向性評價
1.Fe3O4@Au、Nimotuzumab以及Fe3O4@Au-Nimotuzumab標記U251細胞的體外觀察
人膠質瘤細胞株U251接種於含10%小牛血清的高糖DMEM培養液中,在37℃,飽和溼度5%CO2的培養箱中培養,每2-3天傳代一次,使細胞處於貼壁狀態。倒置顯微鏡下觀察U251細胞均質而透明,成扁平不規則的多邊形,單層密集排列,細胞大小、形態表現出多樣性,以梭形細胞及有相對較大的細胞核的多角形細胞較為多見,胞質豐富,細胞核異型性明顯,核大小不一,細胞核與細胞質的比例較大,核染色質增加,核仁增大。分別以0.05mg/mL的Fe3O4@Au、Nimotuzumab和Fe3O4@Au-Nimotuzumab靶向複合納米磁粒體標記U251細胞。對比實驗顯示,U251細胞內吞對Nimotuzumab無內吞作用;對Fe3O4@Au-Nimotuzumab顯著強於Fe3O4@Au,其中複合納米磁粒較多,背景乾淨,細胞外無顆粒聚集。這個實驗充分說明了,Fe3O4@Au-Nimotuzumab的抗腫瘤效果顯著強於Fe3O4@Au,並且是由於形成了靶向複合納米磁粒而導致的、預料不到的技術效果。
2.標記U251細胞的的體外MRI
取對數生長期的U251細胞接種於6孔板中,每孔約含細胞1×106,24h細胞貼壁後,分為A,B和C三組,分別將濃度為0.05mg/mL的Fe3O4@Au-Nimotuzumab靶向複合納米磁粒(A組)、Fe3O4@Au(B組)和Fe3O4@Au-Nimotuzumab靶向複合納米磁粒+Nimotuzumab(0.05mg/mL)(C組)與U251細胞共孵育24h後,用0.25%胰蛋白酶消化後收集、離心,重懸於0.5ml,1%瓊脂糖的Eppendof管中,另取1個Eppendof管內為瓊脂糖作為對照。MRI採用7.0Tesla Micro-MR儀(Bruker,PharmaScan 7.0),內徑3.0cm的體線圈,T2加權自旋迴波成像序列,具體參數如下:視野(FOV)5cm×5cm;層厚1mm;矩陣256×256;TR2000ms,TE 36ms。測量信號強度及信號範圍,給出時間-信號衰減圖形。體外MRI顯示,Fe3O4@Au-Nimotuzumab靶向複合納米磁粒與U251細胞共孵育後(A組)在T2WI上信號強度與對照組相比明顯降低;Fe3O4@Au複合納米磁粒與U251細胞共孵育後(B組)在T2WI上信號強度無明顯降低;Fe3O4@Au-Nimotuzumab靶向複合納米磁粒+Nimotuzumab與U251細胞共孵育後(C組)在T2WI上信號強亦無明顯降低。其中,圖6表示:Fe3O4@Au-Nimotuzumab靶向複合納米磁粒與U251細胞共孵育後在MRI T2WI上圖像(A),Fe3O4@Au複合納米磁粒與U251細胞共孵育後在MRI T2WI上圖像(B),Fe3O4@Au-Nimotuzumab靶向複合納米磁粒和Nimotuzumab與U251細胞共孵育後在MRI T2WI上圖像(C),瓊脂糖為對照;圖7表示:Fe3O4@Au-Nimotuzumab靶向複合納米磁粒與U251細胞共孵育T2WI弛豫時間(A),Fe3O4@Au複合納米磁粒與U251細胞共孵育T2WI弛豫時間(B),Fe3O4@Au-Nimotuzumab靶向複合納米磁粒和Nimotuzumab與U251細胞共孵育(C)(*與對照組相比,P<0.05))
實施例四、Fe3O4@Au-Nimotuzumab靶向複合納米磁粒體內靶向性評價
1.裸鼠膠質瘤移植瘤模型製作
取對數生長期的人膠質瘤U251細胞,用0.25%胰酶消化離心後,以生理鹽水調整好濃度以2×106細胞數量注入裸鼠右下肢皮下。每個部位0.15mL,注射點距進針點1cm,均形成皮丘,經2-3周於接種部位腫瘤開始生長,經4周腫瘤直徑達0.5cm左右始用於試驗。
2.Fe3O4@Au-Nimotuzumab複合納米磁粒靶向膠質瘤的MRI
按分組要求,將12隻裸鼠隨機分成A和B三組,每組6隻,A組經尾靜脈注射Fe3O4@Au-Nimotuzumab複合納米磁粒,B組經尾靜脈注射Fe3O4@Au複合納米磁粒,納米磁粒濃度為0.05mg/mL,注射劑量均為10mg/kg。在注射前及注射後2h、8h、24h分別進行7.0Tesla超高場強實驗動物MR系統成像,觀察不同時間點腫瘤的信號變化,成像序列包括SE-T1WI、SE-T2WI、GRE-T2*WI。量化分析腫瘤組織信號改變的程度、範圍、隨時間的改變。在體MRI結果顯示,A組注射Fe3O4@Au-Nimotuzumab靶向複合納米磁粒後腫瘤組織不同時間點的T2WI、T2*WI強度及信號變化率均有明顯下降,具有統計學差異。而B組Fe3O4@Au複合納米磁粒在注射後2h和8h兩個時間點的信號亦有輕度下降,但下降幅度較A組小,且持續時間短。B組在注射後24h的信號強度即恢復至平掃水平,而A組注射後24h的信號強度仍然維持在較低水平。圖8表示:Fe3O4@Au-Nimotuzumab靶向複合納米磁粒注射後裸鼠移植瘤MRI T2*WI圖像(A),Fe3O4@Au複合納米磁粒注射後裸鼠移植瘤MRI T2*WI圖像(B)(白色箭頭指向移植瘤);圖9表示:Fe3O4@Au-Nimotuzumab靶向複合納米磁粒注射後不同時間點裸鼠移植瘤MRI T2*WI弛豫時間(A),Fe3O4@Au複合納米磁粒注射後不同時間點裸鼠移植瘤MRI T2*WI弛豫時間(B)(*與0時間點相比,P<0.05)。
實施例五、Fe3O4@Au-Nimotuzumab靶向複合納米磁粒熱動力學試驗
(1)將Fe3O4@Au-Nimotuzumab靶向複合納米磁粒用0.9%NaCl溶液配製成濃度分別為1.0g/L的納米磁流體,取5ml入25mm平底試管中,置於頻率230KHz,輸出電流30A的SPG-06A高頻磁感應加熱設備平板線圈上加熱1h,起始室溫25℃,試管底距高頻磁感應加熱線圈中心0.5cm,每隔5min用TM902C數字測溫儀測溫1次,以時間為橫坐標,溫度為縱坐標繪製Fe3O4@Au-Nimotuzumab靶向複合納米磁粒升溫曲線。當磁場強度一定時,Fe3O4@Au-Nimotuzumab靶向複合納米磁粒在磁場作用下,溫度可以上升至42.5℃,在作用前30min內升溫迅速、30~45min升溫平緩、50min後溫度幾乎不再上升而恆定。(圖10)
(2)將Fe3O4@Au-Nimotuzumab靶向複合納米磁粒用0.9%NaCl溶液配製成濃度分別為1.0g/L的納米磁流體,取5ml入25mm平底試管中,應用輸出功率為2.5W的808nm近紅外半導體雷射器照射1小時,起始室溫25℃,每隔5分鐘用TM902C數字測溫儀測溫1次,以時間為橫坐標,溫度為縱坐標繪製Fe3O4@Au-Nimotuzumab靶向複合納米磁粒升溫曲線。當近紅外(NIR)的雷射照射功率一定時,Fe3O4@Au-Nimotuzumab靶向複合納米磁粒在雷射照射下,溫度可以上升達41.3℃,在作用前15min內升溫迅速、30min後溫度幾乎不再上升而恆定。(圖11)
(3)將Fe3O4@Au-Nimotuzumab靶向複合納米磁粒用0.9%NaCl溶液配製成濃度分別為1.0g/L的納米磁流體,取5ml入25mm平底試管中,置於頻率230KHz,輸出電流30A的高頻磁感應加熱設備平板線圈上加熱,同時應用輸出功率為2.5W的808nm近紅外半導體雷射器照射,起始室溫25℃,時間1小時,每隔5min用TM902C數字測溫儀測溫1次,以時間為橫坐標,溫度為縱坐標繪製Fe3O4@Au複合納米磁粒升溫曲線。當磁場強度一定並且近紅外雷射照射功率一定時,在AMF和NIR同時作用下,開始15分鐘內溫度可以迅速上升至45.5℃,20min後溫度幾乎不再上升而保持穩定。(圖12)。
