一種快速檢測細菌整合子的LAMP試劑盒及其應用的製作方法
2023-09-20 06:04:00 1
本發明屬於分子生物學領域,具體涉及一種快速檢測細菌整合子的LAMP試劑盒及其應用。
背景技術:
近年來由於抗生素的廣泛應用及不合理的使用,導致細菌的耐藥問題越來越嚴重,多重耐藥現象也日益普遍。細菌有多種耐藥機制,大量研究表明整合子對細菌多重耐藥性具有重要影響。整合子是一種可移動基因元件,包括位點特異性重組功能的基因決定簇,在整合酶的作用下能捕獲外來耐藥基因,在整合子中可形成多種耐藥基因的組合、排列。在抗生素廣泛應用背景下,整合子通過捕獲各種耐藥基因,使耐藥性在細菌之間廣泛傳播,臨床中出現的多重耐藥細菌與整合子對耐藥基因的積累具有密切關聯。
整合子根據其整合酶基因序列的不同而分類。其中,I類整合子在多重耐藥細菌中最為常見,它與Tn21轉座子家族相關;II類整合子以Tn7及其家族為代表,與I類整合子有46%的同源性;III類整合子與I類整合子有61%的同源性,目前只發現碳青黴烯耐藥基因位於該整合子上。鑑於整合子在細菌獲得耐藥性中所起的重要作用,開展整合子檢測與分類對於進一步探究細菌耐藥性與耐藥機制具有重要意義。目前對細菌整合子的檢測主要使用常規的PCR方法,該方法不僅需要複雜的儀器設備,且擴增產物需通過瓊脂糖凝膠電泳與測序分析,費時較長,成本高,不適合進行批量化快速檢測。因此亟需研發操作簡便、準確快速的檢測技術。
環介導等溫擴增技術(LAMP)是一種新型的分子檢測方法,其特點是利用鏈置換型DNA聚合酶在等溫條件下可以特異地大量擴增靶序列。此外,LAMP擴增產物可通過螢光染料實現可視化判定。因此,LAMP技術具有靈敏性高、特異性好、反應時間短、判定結果方便、不需要昂貴儀器等諸多優勢。為快速、準確檢測細菌整合子提供了新方法。
技術實現要素:
針對現有技術中的不足,本發明進行了深入研究,提供了一種快速檢測細菌整合子的LAMP試劑盒及其應用。
本發明另一目的在於提供一種用於檢測細菌整合子的LAMP引物組。
本發明具體通過以下技術方案實現:
一種快速檢測細菌整合子的LAMP試劑盒,包括:10×LAMP緩衝液;10mM dNTPs;50μM鈣黃綠素;8000U/mLBstDNA聚合酶;外引物組(1-F3、1-B3;2-F3、2-B3;3-F3、3-B3);內引物組(1-FIP、1-BIP;2-FIP、2-BIP;3-FIP、3-BIP);無菌去離子水。
所述的10×LAMP緩衝液含有200mM Tris-HCl(pH 8.8,25℃)、100mM氯化鉀、100mM硫酸銨、20mM硫酸鎂、8M甜菜鹼和體積百分濃度為1%的曲拉通X-100。
所述的LAMP檢測引物序列如下所示,其中外引物和內引物的摩爾濃度比為1:8。
本發明LAMP反應條件為:65℃恆溫反應50min,並在80℃持續10min。
本發明的結果判定方法為:反應結束後用肉眼觀察,陽性菌株顏色變為綠色,陰性菌株顏色為橙色。
本發明所述的整合子為I類整合子、II類整合子和III類整合子。
相比於現有技術,本發明的有益效果為:
本研究提供了一種針對細菌整合子的LAMP檢測試劑盒及其檢測方法。該試劑盒及檢測方法可用於細菌整合子的快速檢測與分型。本發明試劑盒具有簡便快速、特異性強、靈敏度高的優點,此外本發明試劑盒實現了結果判定可視化,根據反應結束後顏色的差異,即可判定結果,非常適合現場快速檢測。
附圖說明
圖1為細菌整合子LAMP檢測電泳圖。圖中,泳道M為DL-5000DNAMarker;泳道1為I類整合子陽性菌株沙門氏菌SAL;泳道2為II類整合子陽性菌株大腸桿菌EC;泳道3為III類整合子陽性菌株粘質沙雷氏菌SM;泳道4為陰性對照。
圖2(A)為LAMP方法I類整合子敏感性試驗電泳圖。圖中,泳道M為DL-5000DNAMarke,泳道1-7分別表示DNA量為6.6×104pg/反應,6.6×103pg/反應,6.6×102pg/反應,6.6×101pg/反應,6.6×100pg/反應,6.6×10-1pg/反應,6.6×10-2pg/反應,泳道8為陰性對照。
圖2(B)為LAMP方法II類整合子敏感性試驗電泳圖。圖中,泳道M為DL-5000DNAMarke,泳道1-7分別表示DNA量為4.3×104pg/反應,4.3×103pg/反應,4.3×102pg/反應,4.3×101pg/反應,4.3×100pg/反應,4.3×10-1pg/反應,4.3×10-2pg/反應,泳道8為陰性對照。
圖2(C)為LAMP方法III類整合子敏感性試驗電泳圖。圖中,泳道M為DL-5000DNAMarke,泳道1-7分別表示DNA量為9.2×104pg/反應,9.2×103pg/反應,9.2×102pg/反應,9.2×101pg/反應,9.2×100pg/反應,9.2×10-1pg/反應,9.2×10-2pg/反應,泳道8為陰性對照。
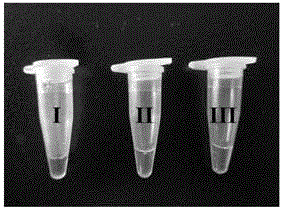
圖3(A)為目視法判定I類整合子陽性結果的示意圖。
圖3(B)為目視法判定II類整合子陽性結果的示意圖。
圖3(C)為目視法判定III類整合子陽性結果的示意圖。
圖3(D)為目視法判定I、II、III類整合子均為陰性結果的示意圖。
具體實施方式
下面結合實施例對本發明做進一步的說明,以下所述,僅是對本發明的較佳實施例而已,並非對本發明做其他形式的限制,任何熟悉本專業的技術人員可能利用上述揭示的技術內容加以變更為同等變化的等效實施例。凡是未脫離本發明方案內容,依據本發明的技術實質對以下實施例所做的任何簡單修改或等同變化,均在本發明的保護範圍內。
實施例1細菌整合子三重LAMP檢測方法的建立
1、供試菌株
整合子陽性菌株沙門氏菌SAL(含I類整合子)、大腸桿菌EC(含II類整合子)和粘質沙雷氏菌SM(含III類整合子)均由江蘇省家禽科學研究所保存提供。
2、LAMP引物組設計
根據GenBank中的細菌整合子(I、II、III)基因序列,通過分析後按照LAMP反應原理進行引物組的設計,結果優化得到6對引物,其中1-F3和1-B3為I類整合子LAMP檢測外引物,1-FIP和1-BIP為I類整合子LAMP檢測內引物;2-F3和2-B3為II類整合子LAMP檢測外引物,2-FIP和2-BIP為II類整合子LAMP檢測內引物;3-F3和3-B3為III類整合子LAMP檢測外引物,3-FIP和3-BIP為III類整合子LAMP檢測內引物。具體序列如表1所示。
表1 細菌整合子LAMP檢測引物序列
3、LAMP擴增模板製備
採用煮沸法提取細菌DNA:取過夜培養菌液1mL,12000rpm離心3min,棄去上清;加入1mL 1×PBS緩衝液,12000rpm離心3min,儘量棄淨上清液;重複以上步驟一遍;向管底加入100μL無菌超純水,劇烈渦旋混勻,100℃加熱10min,然後迅速冷卻(置於冰箱-20℃環境中)10min;8000rpm離心5min,將上清液轉移至新的離心管中,置於-20℃保存備用。
4、LAMP檢測試劑的配製
(1)10×LAMP緩衝液:包含200mM Tris-HCl(pH 8.8,25℃)、100mM氯化鉀、100mM硫酸銨、20mM硫酸鎂、8M甜菜鹼和體積百分濃度為1%的曲拉通X-100。
(2)10mM dNTPs;
(3)50μM鈣黃綠素試劑;
(4)8000U/mL Bst DNA聚合酶;
(5)LAMP引物(外引物濃度均為5pmol/μL,內引物濃度均為40pmol/μL);
(6)陽性對照:含有整合子的細菌模板DNA;
(7)陰性對照:滅菌雙蒸水。
5、三重LAMP檢測體系
經反覆篩選與優化後,得到細菌整合子三重LAMP檢測體系(如表2所示)。
表2:三重LAMP反應體系
6、LAMP反應條件與結果的判定
將LAMP反應體系配製於PCR管中,充分混勻後置於恆溫環境(65℃)反應50min,並在80℃維持10min,取出。反應結束後使用2%濃度瓊脂糖凝膠電泳檢測,陽性則可呈現特異的梯狀條帶(如圖1,不同類型整合子電泳檢測圖),陰性則無此現象。也可用肉眼觀察,陽性菌株顏色變為綠色,陰性菌株顏色為橙色。
實施例2特異性評價
選取整合子陽性菌株沙門氏菌SAL(含I類整合子)、大腸桿菌EC(含II類整合子)和粘質沙雷氏菌SM(含III類整合子),以及整合子陰性菌株大腸桿菌ATCC25922、金黃色葡萄球菌ATCC25923、銅綠假單胞菌ATCC27853、鼠傷寒沙門氏菌ATCC14028、腸炎沙門氏菌ATCC13076(均由江蘇省家禽科學研究所保存提供),用實施例1的方法進行本發明LAMP檢測方法的特異性評價,結果所有整合子陽性細菌的檢測結果均為陽性,所有整合子陰性細菌的檢測結果均為陰性(表3)。
表3 特異性評價實驗結果
註:表格結果欄中:「+」表示陽性;「-」表示陰性。
進一步將I、II、III類整合子擴增產物送華大基因公司進行DNA測序,結果序列如下:
I類整合子:
ATGCCCGTTCCATACAGAAGCTGGGCGAACAAACGATGCTCGCCTTCCAGAAAACCGAGGATGCGAACCACTTCATCCGGGGTCAGCACCACCGGCAAGCGCCGCGACGGCCGAGGTCTTCCGATCTCCTGAAGCCAGGGCAGATCCGTGCACAGCACCTTGCCGTAGAAGAACAGCAAGGCCGCCAATGCCTGACGATGCG
II類整合子:
TAACAGAGGGTAGCCGTCTAGGCTTGCTTGCAGGGATATAATCAATATCGCCCAACGGCTGTTGTAAAAACCTGTTGTACAAAAAAGCTAGGGCATTTAAAGCGATTTTCTGC GTGTTTATGGCTACATGTCTGCTGTTTGCTAAGCTGGATAAAAACAGCCTGACCTCTTCACTGCCCATGGTCTGAGGATGACGTTTTTTGTGAAACAGAATAAAACGCT
III類整合子:
TGAGTGGCGCAGGGTGTGGACAGATACGTGTTTGGCAATGCCAGCCTGAACTACCGCTTTTTTTAGTTGCCGGTTCAGTCTTTCCTCAAACAAGTGGTGGCGGCGCTCAACGCCGGTTTGTGGGTCCACAGACAGCTTGGCCGATGGAAACACCCAGAACCAGGCCCAGCTCTCGCCCGCCCTGGGGTACTTGCGCTCCAGTGCATGAGGCAGATACACGCC
將上述測序結果通過NCBI網站中BLAST進行序列同源性比較,結果顯示本發明方法克隆得到的序列和已登陸的整合子基因序列的核苷酸序列同源性均超過99%,表明本發明方法克隆得到的基因分別是I、II、III類整合子基因片段,因此本發明方法具有很好的特異性。
實施例3敏感性評價
分別選取整合子陽性菌株沙門氏菌SAL(含I類整合子)、大腸桿菌EC(含II類整合子)和粘質沙雷氏菌SM(含III類整合子),製備敏感性試驗模板。經核酸濃度測算後,將模板DNA進行10倍梯度稀釋,以每個稀釋度的基因組DNA作為模板,分別進行LAMP敏感性試驗。
從圖2的LAMP敏感性試驗電泳檢測結果可以看出,針對不同類型整合子的LAMP敏感性試驗,在第6條泳道均可出現較清晰的條帶(所對應DNA濃度分別為0.66pg/反應、0.43pg/反應和0.92pg/反應),而在第7條泳道開始未出現特異性擴增條帶。因此,本發明建立的LAMP檢測方法的靈敏度分別為0.66pg/反應(I類整合子)、0.43pg/反應(II類整合子)和0.92pg/反應(III類整合子)。
實施例4一種快速檢測細菌整合子的LAMP試劑盒的組裝
使用下列成分組成用於檢測細菌整合子的LAMP試劑盒:LAMP檢測引物組(根據表1中序列合成引物,用滅菌雙蒸水稀釋混合,其中外引物濃度為5pmol/μL,內引物濃度為40pmol/μL);10×LAMP buffer(其組分包括200mM Tris-HCl、100mM氯化鉀、100mM硫酸銨、20mM硫酸鎂、8M甜菜鹼和體積百分濃度為1%的曲拉通X-100);8000U/mL Bst DNA聚合酶;10mM dNTPs;50μM鈣黃綠素試劑;滅菌雙蒸水。
將以上所涉試劑和產品共同包裝,再配以產品使用說明書(包括保存條件、反應程序和結果判定方法等),組裝成本發明所述的一種快速檢測細菌整合子的LAMP試劑盒。
實施實例5臨床分離菌株整合子的篩查
對臨床分離自畜禽病料、飼料、食品和環境的358株細菌(含185株沙門氏菌,94株大腸桿菌,36株變形桿菌,21株肺炎克雷伯菌,12株銅綠假單胞菌,6株志賀氏菌和4株粘質沙雷氏菌),應用本發明試劑盒先進行整合子的篩查。具體步驟包括,按實施例1的方法配製三重LAMP反應體系,將反應體系混勻後置於PCR反應儀中,65℃反應50min,並在80℃持續10min後取出,通過觀察顏色判定結果(如顏色變為綠色,則說明樣品中含有整合子;顏色仍為橙色,說明樣品不含整合子)。對篩查含有整合子的菌株進一步進行整合子的分型研究,分別按表4、表5和表6中的組分配製I類整合子、II類整合子、III類整合子的單重LAMP檢測體系進一步檢測(反應條件與結果判定方法均與三重LAMP相同)。選取沙門氏菌SAL(含I類整合子)、大腸桿菌EC(含II類整合子)和粘質沙雷氏菌SM(含III類整合子)作為陽性對照,大腸桿菌ATCC25922、金黃色葡萄球菌ATCC25923、銅綠假單胞菌ATCC27853、鼠傷寒沙門氏菌ATCC14028、腸炎沙門氏菌ATCC13076作為陰性對照(如圖3,目視法檢測示意圖)。
表4 I類整合子LAMP反應體系
表5 II類整合子LAMP反應體系
表6 III類整合子LAMP反應體系
檢測結果見表7,在358株細菌中共有192株檢測到整合子,其中I類整合子陽性菌株數最高,達187株;II類整合子陽性菌株數僅5株(僅出現於大腸桿菌、肺炎克雷伯菌和銅綠假單胞菌);未檢測到III類整合子陽性菌株;也未發現I類整合子和II類整合子均為陽性的菌株。針對不同種屬細菌而言,粘質沙雷氏菌整合子陽性率最高(100%),其次是銅綠假單胞菌(75.0%)和大腸桿菌(67.0%),陽性率最低的是變形桿菌(33.3%)。
表7 細菌整合子LAMP檢測結果
以上所述實施例只是本發明的較佳實例,而沒有限制本發明的實施範圍。因此,凡是根據本發明內容的實質所作出的等效修改,都應屬於在本發明的保護範圍內。
