PSGL‑1調控劑及其用途的製作方法
2023-04-24 23:15:41 3
本申請要求2014年7月8日提交的美國流水號62/022,191依據35U.S.C.§119(e)的優先權,通過援引將其全部內容完整收入本文。
本發明是部分利用(美國)國家衛生研究院授予的基金No.P01AI046530-14,No.R01AI06895-01A1和No.P30CA030199-32在政府支持下做出的。美國政府享有本發明的某些權利。
發明領域
一般而言,本發明涉及抗體,更具體而言,涉及P-選擇蛋白糖蛋白配體-1(PSGL-1)調控劑的用途及其調控免疫應答和治療傳染病,癌症和免疫性和炎性相關疾病和病症的用途。
發明背景
由T淋巴細胞進行的免疫應答對於針對微生物保護宿主至關重要的,但是它們在慢性感染中會變成功能障礙的。有慢性病毒感染,諸如HIV和丙型和B型肝炎時,T細胞應答逐漸喪失功能且許多T細胞經歷凋亡。剩餘T細胞阻滯於功能障礙性狀態,即表型衰竭。雖然了解不完全,但是已經在克隆13株(Cl13)慢性感染的淋巴細胞性脈絡叢腦膜炎病毒(LCMV)模型中為T細胞衰竭鑑定了數種根本機制。在此模型中,將病毒特異性CD8+ T細胞長期暴露於抗原和I型幹擾素,導致包括PD-1,LAG-3,CD160,和BTLA在內的免疫抑制性受體表達上調。細胞還損失活動力,顯示改變的轉錄調節,且具有升高的抑制性細胞因子IL-10和TGFβ生成。隨著時間,CD8+ T細胞損失它們的增殖潛力,細胞毒性功能和生成IL-2,TNF-α和IFN-γ的能力。CD4+ T細胞展示類似改變的分化及抑制性受體上調和功能損失。重要的是,病毒特異性CD4+ T細胞能挽救衰竭的CD8+ T細胞,使得它們能夠介導病毒清除。認為由CD4+ T細胞生成的IL-2和IL-21有助於逆轉缺陷型CD8+ T細胞應答–暗示適宜的效應器分化必需的關鍵細胞因子在慢性感染後變成限制性的。因此,數種整合過程的相互作用聯合起來廢除免疫系統消除慢性病毒感染的能力。
包括皮膚,肺,和腎在內的許多癌症建立與在包括HIV,丙型和B型肝炎在內的慢性病毒感染中觀察到的那些相似的免疫遏制狀態且共享免疫功能障礙的許多共同特徵。這些包括響應的T細胞死亡及包括PD-1,Lag-3和CTLA-4在內的抑制性受體上調。因此,致力於強化抗腫瘤T細胞應答的至關重要功能的免疫療法是在這些設置中根除癌症所必需的。現在清楚慢性病毒和腫瘤通過強佔防止過度免疫應答的天然檢查來侵佔免疫系統。生物醫學研究的一項主要難題是如何開發逆轉這種免疫遏制和促進腫瘤消除的療法。
現在清楚逆轉T細胞功能障礙能在廣泛的臨床設置中重建免疫應答和實現疾病消退。粘附機制調節T細胞在淋巴樣和非淋巴樣組織二者中的積累。已經使用調控粘附分子表達來影響效應和記憶T細胞發育和區分處於不同分化階段的細胞。P-選擇蛋白糖蛋白配體-1(PSGL-1)(它是L,E,和P選擇蛋白受體家族的一種配體)在慢性LCMV感染後在T細胞上高度誘導。主要認識到PSGL-1調節T細胞運輸入發炎組織中,和在穩態條件下和在炎性應答後介導T細胞遷移入淋巴樣組織中。PSGL-1還能在應答消退後調節記憶T細胞歸巢至骨髓。
儘管有通過阻斷免疫抑制性受體(例如PD-1/PD-L1,CTLA-4)和通過抗腫瘤T細胞能極大改善廣泛癌症的免疫破壞的新治療,但是功效限於患者子集(常常<30%)。如此,存在至關重要的需要開發利用免疫系統的新策略在非響應性患者中實現有效的免疫療法。
發明概述
本發明涉及P-選擇蛋白糖蛋白配體-1(PSGL-1)調控免疫系統和免疫應答的開創性發現。具體而言,本發明提供提高多功能T細胞存活和病毒清除的PSGL-1激動劑和拮抗劑。本發明進一步提供使用PSGL-1調控劑治療傳染病,癌症和免疫性和炎性疾病和病症的方法。
在一個實施方案中,本發明提供一種治療T細胞介導的疾病或病症的方法,其包括對有需要的受試者施用P-選擇蛋白糖蛋白配體-1(PSGL-1)調控劑。在一個方面,該PSGL-1調控劑是激動劑或拮抗劑。在另一個方面,該T細胞介導的疾病或病症是傳染病,癌症,自身免疫性病症或炎性病症。在一個具體方面,該PSGL-1調控劑是激動劑且該T細胞介導的疾病或病症是自身免疫性或炎性疾病或病症。在某些方面,該PSGL-1調控劑是拮抗劑且該T細胞介導的疾病或病症是癌症或傳染病。
在一個方面,該PSGL-1調控劑是抗體,小分子,蛋白質,融合蛋白或核酸。在一個具體方面,該抗體是單克隆抗體,嵌合抗體,人抗體或人源化抗體。在另一個方面,CD4+依賴性CD8+ T細胞應答升高。在一個另外的方面,病毒特異性T細胞升高。在另一個方面,Treg和DC應答升高。在又一個方面,FoxP3,IL-10,TGF-β和/或II類MHC的表達升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表達降低或升高。在一個方面,CD25和T-bet的表達升高。在另一個方面,病毒清除升高。
在一個另外的實施方案中,本發明提供一種引發T細胞應答的方法,其包括對有需要的受試者施用PSGL-1調控劑。在一方面,該PSGL-1調控劑是激動劑或拮抗劑。在另一個方面,該T細胞介導的疾病或病症是傳染病,癌症,自身免疫性病症或炎性病症。在一個方面,該PSGL-1調控劑是抗體,小分子,蛋白質,融合蛋白或核酸。在一個具體方面,該抗體是單克隆抗體,嵌合抗體,人抗體或人源化抗體。在另一個方面,CD4+依賴性CD8+ T細胞應答升高。在一個另外的方面,病毒特異性T細胞升高。在另一個方面,Treg和DC應答升高。在又一個方面,FoxP3,IL-10,TGF-β和/或II類MHC的表達升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表達降低或升高。在一個方面,CD25和T-bet的表達升高。
在又一個實施方案中,本發明提供一種恢復T細胞功能的方法,其包括對有需要的受試者施用P-選擇蛋白糖蛋白配體-1(PSGL-1)調控劑。在一方面,該PSGL-1調控劑是激動劑或拮抗劑。在另一個方面,該T細胞介導的疾病或病症是傳染病,癌症,自身免疫性病症或炎性病症。在一個方面,該PSGL-1調控劑是抗體,小分子,蛋白質,融合蛋白或核酸。在一個具體方面,該抗體是單克隆抗體,嵌合抗體,人抗體或人源化抗體。在另一個方面,CD4+依賴性CD8+ T細胞應答升高。在一個另外的方面,病毒特異性T細胞升高。在另一個方面,Treg和DC應答升高。在又一個方面,FoxP3,IL-10,TGF-β和/或II類MHC的表達升高。在一方面,IFNγ,TNFα和CD107的CD8+分泌升高。在其它方面,PD-1,BTLA和CD160的表達降低或升高。在一個方面,CD25和T-bet的表達升高。
在一個實施方案中,本發明提供一種藥物組合物,其包含P-選擇蛋白糖蛋白配體-1(PSGL-1)調控劑和製藥學載劑。在一個方面,該PSGL-1調控劑是抗體,小分子,蛋白質,融合蛋白或核酸。在一個另外的方面,該抗體是單克隆抗體,嵌合抗體,人抗體或人源化抗體。
附圖簡述
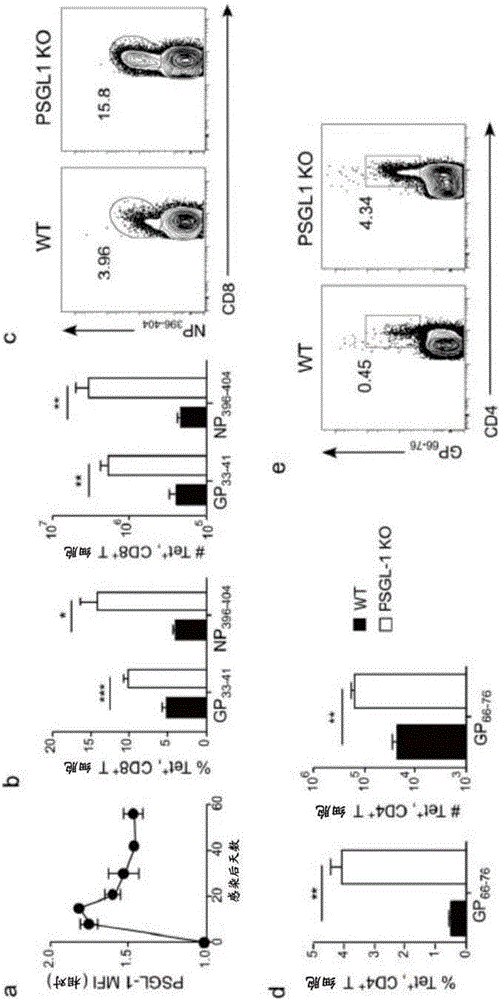
圖1A-E顯示PSGL-1動力學和LCMV Cl13感染後PSGL-1 KO小鼠中病毒特異性T細胞的積累。WT小鼠以黑色柱或黑色圓圈代表,PSGL-1 KO小鼠以白色柱代表。(A)相對於來自未感染WT小鼠的血液中的CD8+ T細胞,GP33-41+ CD8+ T細胞上PSGL-1水平的均值螢光強度(MFI)。(B)感染後8天時脾中計數的病毒特異性CD8+ T細胞頻率和絕對數。(C)GP33-41+ CD8+ T細胞上的病毒特異性CD8+ T細胞頻率的FACS圖。(D)感染後8天脾中病毒特異性GP66-76+ CD4+ T細胞的頻率和絕對數。(E)病毒特異性GP66-76+ CD4+ T細胞上的病毒特異性CD8+ T細胞頻率的FACS圖。
圖2A-E顯示病毒特異性PSGL-1 KO T細胞展示增強的存活但不展示增強的增殖。WT小鼠以黑色柱代表,PSGL-1 KO小鼠以白色柱代表。(A-B)來自感染後8天分離的WT和PSGL-1脾的GP33-41+ CD4+細胞(A)和GP66-76+ CD4+細胞(B)的水平。(C-D)來自感染後10天分離的WT和PSGL-1脾的IL7Rα(C)和Bcl-2(D)的水平。(E)來自感染後10天的WT和PSGL-1血液的CD25的水平。
圖3A-G顯示PSGL-1 KO小鼠中增強的效應器T細胞功能。WT小鼠以黑色柱代表,PSGL-1 KO小鼠以白色柱代表。(A)GP33-41+ CD8+細胞中的INF-γ和INF-γ+TNF-α生成。(B)NP396-404+ CD8+細胞中的INF-γ和INF-γ+TNF-α生成。(C)CD107+INF-γ+Tet+細胞的生成。(D)GP33-41+ CD8+細胞中的粒酶B生成。(E)GP33-41+ CD8+細胞中的T-bet生成。(F)GP33-41+ CD8+細胞中的Eomes生成。(G)GP66-76+ CD4+細胞中的INF-γ,INF-γ+TNF-α和INF-γ+TNF-α+IL-2生成。
圖4A-D顯示病毒特異性T細胞上的抑制性受體表達。WT小鼠以黑色柱代表,PSGL-1 KO小鼠以白色柱代表。(A)感染後7天病毒特異性GP66-76+CD4+ T細胞上的PD-1水平。(B)感染後8天病毒特異性GP66-76+ CD4+ T細胞上的PD-1水平。(C)感染後8天病毒特異性GP33-41+ CD8+細胞和NP396-404+ CD8+細胞上的PD-1水平。(D)病毒特異性GP33-41+ CD8+細胞上的CD160和BTLA水平。
圖5A-G顯示PSGL-1 KO病毒特異性CD8+和CD4+ T細胞的積累是細胞固有的且衰竭的CD8+ T細胞的PSGL-1連接降低它們的存活。WT和PSG-L-1 KO幼稚P14轉基因T細胞以圓圈代表或1PSGL-1 KO幼稚Smarta轉基因CD4+ T細胞以方框代表。(A-B)感染後1天來自WT和PSG-L-1 KO幼稚P14轉基因T細胞(圓圈)或1PSGL-1 KO幼稚Smarta轉基因CD4+ T細胞(方框)的脾(A)或肺(B)中PSGL-1 KO對WT的比。(C-D)感染後1天脾中WT(圓圈)和PSGL-1 KO(方框)P14細胞(C)或Smarta細胞(D)的數目。(E)感染後2天WT或PSGL-1 KO P14細胞中的CFSE稀釋。(F-G)來自感染後9天分離的脾細胞的丙啶陰性GP33-41+ CD8+ T細胞頻率(F)和GP33-41+ CD8+ T細胞上的PD-1水平(G)。
圖6A-E顯示PSGL-1 KO小鼠具有加速的病毒控制和廣泛的免疫病理。(A-C)感染後8天來自以黑色圓圈或黑色柱代表的WT小鼠和以白色方框或白色柱代表的PSGL-1 KO小鼠的血清LCMV病毒水平(A),存活曲線(B)和血清激酶水平(C)。(D)未感染的和感染後第8天的WT和PSGL-1 KO肺的H&E組織學。(E)未感染和感染後8天的WT和PSGL-1 KO的肺中的病理學得分。
圖7A-E顯示PSGL-1 KO小鼠中的最佳病毒特異性CD8+ T細胞功能依賴於CD4+ T細胞輔助。以黑色柱或黑色圓圈代表WT小鼠,以白色柱或白色方框代表PSGL-1 KO小鼠和以灰色柱或灰色三角形代表PSGL-1 KO CD4消減小鼠。(A)脾中GP66-76+ CD4+ T細胞的絕對數。(B)感染後8天時血液中GP33-41和NP396-404CD8+ T細胞的頻率。(C)感染後10天時脾中生成細胞因子的GP33-41CD8+ T細胞的絕對數。(D)感染後10天時脾中GP33-41+和NP396-404+特異性CD8+ T細胞上的PD-1水平。(E)感染後10天時的存活和血清病毒水平。
圖8A-E顯示Cl13感染後病毒特異性CD8+ T細胞應答的動力學。WT(黑色方框或柱)或PSGL1-KO(白色方框或柱)小鼠。(A-D)感染後4,6,和8天(A,B,C)和感染後30天(D)時GP33-41+或NP396-404+ CD8+ T細胞的絕對數。(E)點圖呈現一隻代表性小鼠。
圖9A-D顯示PSGL-1 KO病毒特異性T細胞有效遷移及在肺中積累。(A-D)感染後7.5天時來自WT(黑色柱)或PSGL1-KO(白色柱)小鼠肺的細胞,用DbGP33-41四聚體或DbNP396-404四聚體(A-B)或IAb-GP66-76(C-D)染色。
圖10A-E顯示病毒特異性T細胞上的細胞因子受體水平。以黑色方框或柱代表WT小鼠和以白色方框或柱代表PSGL-1 KO小鼠。(A)感染後4,6和8天時GP33-41細胞上IL-7Rα的水平。(B)感染後4,6和8天時NP396-404細胞上IL-7Rα的水平。(C)感染後9天時IL-21的水平。(D)感染後9天時CD122的水平。(E)感染後9天時IL-6R的水平。
圖11A-E顯示由來自PSGL-1 KO小鼠的效應T細胞表達的升高的細胞因子水平。以黑色柱代表WT小鼠和以白色柱代表PSGL-1 KO小鼠。(A-C)感染後10天時CD8+ T細胞上INF-γ(A,C)和TNF-α(B)的生成。(D-E)感染後10天時CD4+ T細胞上TNF-α(D)和IL-2(E)的生成。
圖12A-E顯示病毒特異性T細胞上的抑制性受體表達。以黑色柱代表WT小鼠和以白色柱代表PSGL-1 KO小鼠。(A-E)感染後8天脾中(A-B),感染後15天(C),感染後30天(D)時血液中,和感染後112天時脾中(E)病毒特異性GP33-41-和NP396-404-CD8+ T細胞上PD-1,CD160,和BTLA的水平。
圖13A-E顯示幼稚WT和PSGL-1 KO P14細胞的感染前表型和WT和PSGL-1 KO P14細胞的增殖。以黑色柱代表WT小鼠和以白色柱代表PSGL-1 KO轉基因P14+Tg小鼠。(A-B)用CD44和CD62L(A)和CD25,CD69,和CDI27(B)染色的脾。(C)感染後13天時脾和肺中WT或PSGL-1 KO P14細胞的頻率。(D)感染後13天時脾和肺中的Brdu摻入。(E)脾中的代表性柱狀圖。
圖14A-B顯示PSGL-1 KO小鼠中的更高病理。以黑色圓圈代表未感染WT小鼠,以白色柱或方框代表未感染PSGL-1 KO小鼠,以黑色三角形代表受感染WT小鼠,以白色三角形代表受感染PSGL-1 KO小鼠。(A)WT和PSGL-1 KO肺和肝的病理學得分。(B)感染後9天時自WT和PSGL-1 KO小鼠分離的胃,小腸和大腸。
圖15A-D顯示Cl13感染後病毒特異性PSGL-1KO T細胞的積累。(A-D)感染後8天(A)和感染後30天(B)時血液中和感染後8天時脾(C)和肺(D)中病毒特異性CD8+ T細胞的計數。
圖16A-C顯示來自PSGL-1 KO的CD8+ T細胞的增強的抗病毒功能。(A-C)用NP396-404或GP33-41肽刺激脾細胞並分析IFN-γ和TNF-α(A,B)或CD107(C)。
圖17A-B顯示病毒特異性CD8+ T細胞的降低的抑制性受體表達。(A-B)自PD-1(A)和CD60和BTLA(B)的水平評估病毒特異性T細胞。
圖18A-C顯示PSGL-1 KO CD4+ T細胞展示改善的存活和功能及降低的抑制性受體表達。(A-C)感染後8天時測量的頻率(A),細胞因子應答(B)和PD-1和BTLA水平(C)。
圖19A-B顯示PSGL-1 KO小鼠清除慢性LCMV且具有更高的循環中炎性細胞因子。(A)感染後的病毒滴度。(B)感染後8天時的細胞因子水平。
圖20A-D顯示響應病毒感染後和PSGL-1阻斷後T細胞存活和PD-1受到PGSL-1缺陷調控。(A-D)感染後分析的特異性CD8+ T細胞的NP396-404(A)和GP33-41(B)水平。(C)自WT和PSGL-1 KO小鼠測量的病毒特異性CD8+ T細胞的PD-1水平。(D)感染後8天時測量的IAV特異性NP396-404或LCMV特異性NP396-404CD8+ T細胞上的PD-1水平。
圖21A-B顯示腫瘤微環境中T細胞的PSGL-1和PD-1表達。(A)CD4+細胞的頻率(左邊),它們的PSGL-1表達(中間)和PSGL-1低細胞較之高PSGL-1高細胞的PD-1表達(右邊)。(B)CD8+ T細胞的頻率(左邊),它們的高PSGL-1表達(中間)和異質PD-1表達。
圖22A-B顯示黑素瘤陽性耳中CD8+ T細胞的PSGL-1表達和PSGL-1結合。(A)CD44高較之CD44低CD8+ T細胞中的PD-1和PSGL-1表達。(B)具有功能性PSGL-1結合的CD8+ T細胞的頻率。
圖23A-B顯示黑素瘤腫瘤中的CD3+ T細胞,和CD4+Treg和CD4+非Treg的頻率。(A)CD3+ T細胞單個核細胞。(B)破裂的腫瘤內高頻率的PSGL-1+,PD-1+(雙重陽性)CD4+非Treg(效應T細胞)和Treg,通過流式細胞術進行。
圖24顯示黑素瘤中免疫細胞的存在,和它們的PSGL-1表達。(A)黑素瘤腫瘤內鑑定的T細胞(CD4+非Treg,Treg,CD8+細胞),NK T細胞,NK細胞,樹突細胞(DC,MHC II+,CD11c),髓樣衍生抑制細胞(MDSC,Gr1+,CD11b)和巨噬細胞(MΦ,F4/80+,CD11b+)。(B)這些免疫細胞子集表達PSGL-1。
圖25A-F顯示PSGL-1缺陷小鼠與WT小鼠相比的抗腫瘤應答。(A)腫瘤體積和重量。(B)效應CD8+和CD4+ T細胞的頻率。(C)CD8+和CD4+ T細胞的PD-1表達。(D-F)CD8+和CD4+ T細胞的細胞因子生成。
發明詳述
本發明涉及P-選擇蛋白糖蛋白配體-1(PSGL-1)調控免疫系統和免疫應答的開創性發現。具體而言,本發明提供提高多功能T細胞存活和病毒清除的PSGL-1激動劑和拮抗劑。本發明進一步提供使用PSGL-1調控劑治療傳染病,癌症和免疫性和炎性疾病和病症的方法。
在描述本發明組合物和方法之前,要理解的是,本發明不限於所描述的特定組合物,方法,和實驗條件,因為此類組合物,方法,和條件可以有所變化。還要理解的是,本文中使用的術語僅僅是出於描述特定實施方案的目的,並非意圖是限制性的,因為本發明的範圍只會在所附權利要求書中限制。
除非另有定義,本文中使用的所有技術和科學術語具有與本發明所屬領域普通技術人員的共同理解相同的含義。雖然可以在本發明的實施或檢驗中使用與本文中描述的方法和材料相似或等同的任何方法和材料,但是現在描述優選的方法和材料。下文所列定義用於理解公開內容,但是決不應視為取代本領域普通技術人員對術語的理解。
如此說明書和所附權利要求書中使用的,單數形式「一個」,「一種」,和「該」包括複數提及物,除非上下文另有清楚敘述。如此,例如,提到「該方法」包括一種或多種方法,和/或本領域技術人員在閱讀此公開文本後會變得顯而易見的本文所述類型的步驟,等等。
抗體通常是約150,000道爾頓的異四聚體糖蛋白,由兩條相同的輕(L)鏈和兩條相同的重(H)鏈構成。每條輕鏈通過一個共價二硫鍵連接至一條重鏈,而二硫化物連接的數目在不同免疫球蛋白同種型的重鏈間有所變化。每條重和輕鏈還具有間隔規律的鏈內二硫橋。每條重鏈具有一端處的一個可變域(VH),接著是多個恆定域。每條輕鏈具有一端處的一個可變域(VL)和它的另一端處的一個恆定域;輕鏈的恆定域與重鏈的第一恆定域對齊,而輕鏈可變域與重鏈可變域對齊。認為特定胺基酸殘基形成輕和重鏈可變域之間的界面。每個可變區包含稱作互補決定區(CDR)或高變區的三個區段,而可變域中更加高度保守的部分稱作框架區(FR)。重和輕鏈的可變域各自包含四個FR區,它們大多採取β-片層構象,通過三個CDR連接,三個CDR形成環連接,而且在一些情況中形成β-片層結構的一部分。每條鏈中的CDR通過FR密切接近地保持在一起,而且與來自另一條鏈的CDR促成抗體的抗原結合位點形成。恆定域不直接牽涉抗體對抗原的結合,但是展現多種效應器功能,諸如抗體在抗體依賴性細胞的細胞毒性中的參與。
根據它們的重鏈恆定域的胺基酸序列,免疫球蛋白可以指派至不同的類。有五大類免疫球蛋白:IgA,IgD,IgE,IgG,和IgM,而且這些中的數類可以進一步分成亞類(同種型),例如IgG1,IgG2,IgG3,IgG4,IgA1,和IgA2。與不同類的免疫球蛋白對應的重鏈恆定域分別稱作α,δ,ε,γ,和μ。不同類的免疫球蛋白的亞基結構和三維構造是公知的。
抗體的Fc區是抗體中與細胞表面受體和補體系統的一些蛋白質相互作用的尾部區域。這種特性容許抗體激活免疫系統。在IgG,IgA和IgD抗體同種型中,Fc區由自抗體的兩條重鏈的第二和第三恆定域衍生的兩個相同的蛋白質片段構成;IgM和IgE Fc區在多肽鏈中每條含有三個重鏈恆定域(CH域2-4)。IgG的Fc區攜帶高度保守的N-糖基化位點。Fc片段的糖基化對於Fc受體介導的活性是必要的。附著至這個位點的N-聚糖主要是核心巖藻糖基化的複合類型的雙觸角結構。另外,小量的這些N-聚糖還攜帶兩分型GlcNAc和α-2,6連接的唾液酸殘基。
如本文中使用的,術語「抗體」指完整單克隆抗體,多克隆抗體,自至少兩種完整抗體形成的多特異性抗體(例如雙特異性抗體),和抗體片段,只要它們展現期望的生物學活性。
「抗體片段」包含完整抗體的一部分,優選完整抗體的抗原結合或可變區。抗體片段的例子包括Fab,Fab',F(ab')2,和Fv片段;雙抗體,三抗體等等;線性抗體;單鏈抗體分子;和自抗體片段形成的多特異性抗體。
如本文中使用的,術語「單克隆抗體」指自一群基本上同質的抗體獲得的抗體,即構成群體的抗體個體是相同的,除了可以以微小量存在的可能的天然發生的突變。單克隆抗體是高度特異性的,針對單一抗原性位點。而且,每種單克隆抗體針對抗原上的單一決定簇。在它們的特異性以外,單克隆抗體的優點在於它們由雜交瘤培養物合成,未受到其它免疫球蛋白汙染。例如,要依照本發明使用的單克隆抗體可以由雜交瘤生成,通過重組DNA方法生成或自噬菌體抗體文庫分離。
本文中的單克隆抗體具體包括「嵌合」抗體(免疫球蛋白),其中重和/或輕鏈的一部分與來自特定物種衍生的或屬於特定抗體類或亞類的抗體中的對應序列相同或同源,而鏈的剩餘部分與自另一個物種衍生的或屬於另一個抗體類或亞類的抗體中的對應序列相同或同源,以及此類抗體的片段,只要它們展現期望的生物學活性。
非人(例如鼠)抗體的「人源化」形式是含有自非人免疫球蛋白衍生的最少序列的嵌合免疫球蛋白,免疫球蛋白鏈或其片段(諸如Fv,Fab,Fab',F(ab')2或抗體的其它抗原結合亞序列)。在極大程度上,人源化抗體是如下的人免疫球蛋白(受體抗體),其中來自受體的互補決定區(CDR)的殘基用來自具有期望特異性,親和力,和能力的非人物種(供體抗體)諸如小鼠,大鼠或家兔的CDR的殘基替換。在一些情況中,人免疫球蛋白的Fv框架區(FR)殘基用對應的非人殘基替換。而且,人源化抗體可包含在受體抗體中和在輸入CDR或框架序列中都沒有找到的殘基。進行這些修飾是為了進一步提升和最大化抗體性能。一般而言,人源化抗體會包含至少一種,和通常兩種如下的基本上整個可變域,其中所有或基本上所有CDR對應於非人免疫球蛋白的CDR且所有或基本上所有FR是人免疫球蛋白序列的FR。最佳地,人源化抗體還會至少包含免疫球蛋白恆定區(Fc)的一部分,通常是人免疫球蛋白的。
「單鏈Fv」或「sFv」抗體片段包含抗體的VH和VL域,其中這些域存在於一條多肽鏈中。優選地,Fv多肽進一步包含VH和VL域之間的多肽接頭,使sFv能夠形成抗原結合所期望的結構。
術語「融合分子」和「融合蛋白」可互換使用且意圖指通過重組,化學或其它合適方法共價連接(即融合)的生物學活性多肽(通常是HVEM或抗體)和效應器分子(通常是蛋白質或肽序列)。如果想要的話,融合分子可以經由肽接頭序列在一個或數個位點處融合。或者,可以使用肽接頭來幫助構建融合分子。具體優選的融合分子是融合蛋白。通常,融合分子也可以由綴合物分子構成。
Fc融合蛋白(也稱作Fc嵌合融合蛋白,Fc-Ig,基於Ig的嵌合融合蛋白和帶Fc標籤的蛋白質)由遺傳連接至感興趣肽或蛋白質的IgG Fc域構成。Fc融合蛋白已經變成對於體內和體外研究有價值的試劑。
Fc融合的結合配偶的範圍可以包括單一肽,一旦與細胞表面受體結合就活化細胞表面受體的配體,信號分子,一旦二聚化就被活化的或作為用於在蛋白質微陣列中鑑定結合配偶的誘餌蛋白的受體的胞外域。
Fc域在體內最有價值的特徵之一是它能顯著延長感興趣蛋白質的血漿半衰期,這對於生物治療性藥物導致改善的治療功效;這一屬性使得Fc融合蛋白成為有吸引力的生物治療劑。
如本文中使用的,術語「核酸」或「核酸序列」指寡核苷酸,核苷酸,多核苷酸,或任何這些的任何片段;而且包括基因組或合成起源的DNA或RNA(例如mRNA,rRNA,tRNA,iRNA),可以是單鏈的或雙鏈的;而且可以是有義或反義鏈,或肽核酸(PNA),或任何DNA樣或RNA樣物質,天然或合成起源的,包括例如iRNA,核糖核蛋白(例如雙鏈iRNA,例如iRNP),核酸,即寡核苷酸,含有天然核苷酸的已知類似物的。
如本文中使用的,術語「多肽」和「蛋白質」在本文中可互換使用且指兩個或更多個子單元胺基酸,胺基酸類似物,或其它肽模擬物的化合物,不管翻譯後修飾,例如磷酸化或糖基化。子單元可以通過肽鍵或其它鍵諸如例如酯或醚鍵來連接。此定義涵蓋全長多肽,截短多肽,點突變體,插入突變體,剪接變體,嵌合蛋白,及其片段。在各種實施方案中,多肽可具有至少10個胺基酸或至少25,或至少50或至少75或至少100或至少125或至少150或至少175或至少200個胺基酸。
如本文中使用的,術語「小分子」指可幫助調節生物學過程的,尺寸在10-9m量級上的低分子量(50%死亡率有關,死亡在感染後8天開始(圖6b)。為了研究系統性炎症,檢查促炎性細胞因子,觀察到PSGL-1缺陷小鼠具有顯著升高的IL-6,IL-21,TNF-α,和IFN-γ血清水平(圖6c)。而且,感染後8天時包括肺浸潤物(圖6d,圖14a),水腫,和炎症(圖6d,e)在內的肺免疫病理學在PSGL-1缺陷感染小鼠中升高。升高的病理學在腎,肝,和腸中也是明顯的(圖14a,b)。如此,儘管PSGL-1缺陷小鼠控制病毒複製比WT小鼠有效得多,但是這由於免疫病理學而導致廣泛的炎症和升高的死亡率。因此,PSGL-1發揮限制過度旺盛的效應器應答的功能。
實施例8
PSGL-1缺陷小鼠中的最佳病毒特異性CD8+ T細胞功能需要CD4+ T細胞
到感染後5天在PSGL-1缺陷小鼠中觀察到GP66-76+CD4+ T細胞增多,而且至感染後9天進一步提高積累(圖7a),與CD4+ T細胞中的PSGL-1缺陷在影響CD8T細胞應答中的作用一致。為了檢查它們的貢獻,通過施用抗CD4抗體來消減來自PSGL-1缺陷小鼠的CD4+ T細胞。將針對Cl13的CD8+ T細胞應答與來自用對照抗體處理的小鼠的PSGL-1缺陷CD8+ T細胞的或WT T細胞的比較。發現CD4+ T細胞消減的PSGL-1缺陷小鼠具有降低至WT小鼠中找到的水平的GP33-41+和NP396-404+ CD8+ T細胞頻率(圖7b)。而且,感染後10天它們具有與具有CD4+ T細胞的PSGL-1缺陷小鼠相比降低的IFN-γ和IFN-γ+TNF-α+ CD8+ T細胞數目(圖7c)。這映射為GP33-41+和NP396-404+ T細胞上PD-1水平的變化,它們保持升高且與WT細胞上的水平相似(圖7d)。與血清Cl13水平在感染後10天時降低的PSGL-1缺陷小鼠不同,在CD4+ T細胞消減小鼠中,病毒水平保持與WT小鼠中的相當(圖7e),而PSGL-1缺陷小鼠中的滴度此時在降低中。而且,感染後10天後PSGL-1缺陷小鼠的死亡率在CD4+ T細胞消減小鼠中得到阻止(圖7e)。這些結果顯示,對於病毒特異性PSGL-1缺陷CD8+ T細胞要逃避功能性衰竭,它們需要來自CD4+ T細胞的幫助。如此,通過它們改善的數目和功能,確定了CD4+ T細胞在PSGL-1缺陷背景中調控CD8+ T細胞功能。
實施例9
材料和方法
小鼠。C57BL/6.1小鼠和Selplg-/-小鼠購自Jackson laboratories。在Sanford-Burnham醫學研究所,在無特定病原體的設備中繁殖和維持小鼠並在常規BSL-2設備中感染小鼠。將Selplg-/-小鼠與C57BL/6J小鼠回交超過10代。PI4和Smarta TCR轉基因小鼠得自Charles D.Surh(Scripps研究所)。將這些小鼠與Ly5.1(B6.SJL-Ptprca Pepcb/BoyJ)小鼠和Thy1.1(B6.PL-Thy la/CyJ),Selplg-/-小鼠繁殖。用於實驗的小鼠為至少6周齡。實驗符合Sanford-Burnham醫學研究所IACUC規章並得到獸醫批准。
感染,增殖,和細胞轉移。在幼倉鼠腎細胞中繁殖LCMV Cl13株並在Vero非洲綠猴腎細胞上滴定。用M Vero細胞培養基稀釋冷凍的儲液並靜脈內注射2x106個噬斑形成單位(PFU)LCMV Cl13。為了評估增殖,在感染後第8或13天對小鼠腹膜內注射2mg BrdU(Sigma-Aldrich),16小時後自脾和肺分離淋巴細胞。對於過繼性轉移,純化WT P14和PSGL-1 KO P14細胞(Stemcell Tech)並在1天後將1x103個細胞靜脈內轉移入用LCMV Cl13感染的WT小鼠。
流式細胞術和染色。在補充有FACS染色緩衝液(2%FBS和0.01%疊氮化鈉)的PBS中對細胞進行針對四聚體染色的表面染色,4℃20分鐘或室溫1小時15分鐘。使用來自Biolegend的下述抗體:抗CD8α(克隆53-6.7),抗PD-1(克隆RMP1-30),抗CD4(克隆GKI.5),抗CD90.1(克隆OX-7),抗CD45.1(克隆A20),抗IL-21R(克隆4A9),抗CD126(克隆D7715A7),抗CD44(克隆IM7),抗CD62L(克隆MEL-14)。下述克隆來自eBioscience:抗CD127(IL-7Ra克隆A7R34),抗CD160(克隆ebiocnx-3),抗BTLA(克隆6f7)。下述抗體來自BD:抗CD122(克隆TM-(31),抗BcI-2(克隆3F11),抗CD107(克隆1D4B),抗CD162(克隆2PH1),抗CD25(克隆3C7),抗CD69(克隆H12F3),抗Vα2(克隆B20.1)。H-2Db-GP33-41,H-2Db-NP396-404四聚體購自Beckman Coulter。lAb-66-77四聚體由NIH核心機構提供。將細胞用FACS染色緩衝液清洗兩次並用含1%甲醛的PBS固定15分鐘。清洗細胞兩次,並在FACS染色緩衝液中重懸浮。對於細胞內細胞因子染色,用Cytofix/Cytoperm試劑盒(BD)固定並透化細胞,並用抗GzmB(克隆MHGBO5:invitrogen),抗TNF-α(克隆MP6-XT22:biolegend),抗IFN-γ(克隆XIVIG1.2:Biolegend),抗IL-2(克隆JES6-5H4:eBioscience)染色。使用來自eBioscience的試劑盒實施BrdU染色。對於轉錄因子檢測,使用FoxP3染色試劑盒(eBioscience)固定並透化細胞,並用抗Tbet(克隆4B10:Biolegend),抗Eomes(克隆Dan11mag:eBioscience)染色。在LSRFortessa流式細胞儀(BD)上分析經過染色的細胞。
離體肽刺激。將2x106個來自感染動物的脾細胞接種入96孔圓底板。將細胞用2pg/mL GP33-41,NP396-404或GP61-80肽(AnaSpec),50U/mL IL-2(NCI),和1μg/ml布雷菲德菌素A(Sigma)於37℃體外(in vita-o)刺激5小時。然後對經過刺激的細胞清洗,表面染色,然後細胞內染色。
離體PSGL-1連接。將2x106個來自第9天LCMV Cl13感染動物的脾細胞接種入96孔圓底板。將細胞用補充有10mM hepes(Cellgro),1x MEM非必需胺基酸(Cellgro),1mM丙酮酸鈉(Cellgro)和10%熱滅活FBS(Hyclone)的RPMI-1640(Cellgro)培養基中的50U/mL IL-2(NIH)及下述條件於37℃體外刺激4天:10μg/mL大鼠IgG(JacksonImmunoResearch),10μg/mL抗PSGL-1(4RAIO BioXCell),2pg/mL GP33-41(AnaSpec),或抗PSGL-1(4RA10BioXCell)+2μg/mL GP33-41(AnaSpec)。然後清洗培養細胞,並用碘化丙啶(1μg/mL)於室溫染色10分鐘。清洗細胞並在FRCS染色緩衝液中用抗CD8αa,H-2D-GP33-41四聚體(Beckman Coulter),抗PD-1於室溫染色1小時15分鐘。在LSRFortessa流式細胞儀(BD)上分析經過染色的細胞並通過排除PI+細胞來確定活細胞。
CFSE標記。自未感染WT和PSGL-1 KO P14TCR轉基因小鼠(Stemcell Tech)的脾負富集CD8+ T細胞。合併相等數目的經過純化的WT和PSGL-1 KO P14細胞,用5μM CFSE(Life Technologies)於37℃標記10分鐘,並用PBS清洗。以1:1比率(各1x106個細胞)將WT和PSGL-1 KO P14細胞靜脈內共轉移入WT接受者。用2x106PFU LCMV Cl13感染WT宿主並在感染後2天通過FACS檢查CFSE稀釋。
CD4消減。小鼠在第-1和0天接受CD4消減性抗體(克隆GM.5,BioXCell)的兩次500μg腹膜內注射,然後用LCMV Cl13感染。在經過處理的小鼠的血液和脾中確認CD4消減的功效。
細胞因子和病理學。在感染後8天自WT和PSGL-1 KO小鼠分離血清並使用一種多路9珠定製細胞因子陣列(Millipore)檢查IL-6,IL-21,TNF-α,和IFN-γ的細胞因子水平。在Luminex IS200儀器上分析樣品。在福馬林鋅(z-fix Anatech)中固定肝,腎,和肺,在石蠟中包埋,並切片。用H&E對組織染色並使用Aperio ScanScope數碼掃描。病理學打分是由病理學家對組織樣品的盲評。得分範圍為0-3.5,零指示無病理且更大的得分指示升高的病理。
數據分析。使用FlowJo軟體(TreeStar)分析流式細胞術數據。使用GraphPad Prism軟體製圖。
統計分析。使用GraphPad Prism軟體使用Student t檢驗分析實驗組,顯著性設置為p<0.05。使用Mantel-Cox和Gehan-Breslow-Wilcoxon檢驗比較存活曲線。
實施例10
抗病毒應答
在LCMV Cl13病毒在小鼠中產生慢性感染的研究中,發現PSGL-1缺陷導致感染後數目增多的病毒特異性CD8+ T細胞(圖15A,B),其至少延伸至第30天(圖15C),指示對T細胞持久性的持續影響。這一發現對於在Cl13感染後刪除的NP396-404特異性T細胞是值得注意的。這一效果是由於改善的T細胞存活而非升高的擴充(未顯示)。因為PSGL-1調節白細胞歸巢且LCMV感染是系統性的,所以測試周圍部位(在這種情況中是肺)的T細胞募集以查看是否有影響。然而,PSGL-1 KO小鼠中有比WT小鼠中數目要多的病毒特異性T細胞(圖15D),排除遷移能力的總體受損。CD8+ T細胞在Cl13感染後逐漸喪失效應器功能,首先是生成IL-2,TNF-α的能力,最後是IFN-γ和CTL活性。在有效抗病毒應答中,CD8+ T細胞同時表達多種效應器功能。如圖16中顯示的,來自PSGL-1 KO小鼠的GP33-41特異性T細胞和NP396-404特異性T細胞均展現比來自WT小鼠的病毒特異性CD8+ T細胞頻率要高的IFN-γ+和IFN-γ/INF-α雙重陽性細胞(圖16A,B),指示更大的功能性。細胞毒性脫粒與IFN-y生成組合也更大(圖16C)。數據證明PSGL-1對CD8+ T細胞應答具有出乎意料的抑制效果。
衰竭的CD8+ T細胞特徵在於表達多種免疫抑制性受體,特別是PD-1,還有BTLA,CD160,LAG 3,TIM-3,和2B4。發現CD8+ T細胞上水平降低的抑制性受體與GP33-41和NP396-404特異性T細胞二者改善的功能有關(圖17)。還發現更低水平的2B4和LAG 3(未顯示)。分析WT和PSGL-1 KO小鼠中響應Cl13的CD4+ T細胞。如為CD8+ T細胞顯示的,KO小鼠中有頻率大大升高的病毒特異性CD4+ T細胞(圖18A),它們與更好的存活有關。而且,來自PSGL-1 KO小鼠的病毒特異性CD4+ T細胞生成比WT小鼠要多的細胞因子,而且還有更多的多功能細胞(圖18B)。更大的功能與抑制性受體PD-1和BTLA的表達降低有關(圖18C)。這些數據指示PSGL-1具有比在T細胞中介導遷移要寬的功能且作為CD8+和CD4+ T細胞應答二者的抑制劑起作用。為了確定改善的T細胞功能和存活是否影響抗病毒應答,測量病毒清除。如圖17A中顯示的,PSGL-1缺陷使Cl13病毒能夠被清除。在PSGL-1 KO小鼠的血清中檢測到與WT小鼠相比水平要高的細胞因子IL-6,1L-21,TNF-α,和IFN-γ(圖19B),如此為改善的應答提供一項讀出。為了在抗病毒免疫中進一步研究PSGL-1,分析感染受到免疫系統快速清除的Armstrong LCMV株後的PD-1表達水平。觀察到這種設置中更大的CD8+ T細胞持久性(圖20)及PD-1對NP396-404(圖20A)比GP33-41(圖20B)病毒特異性CD8+ T細胞更早且更顯著的影響。對於這兩種克隆,均觀察到PSGL-1 KO T細胞更低水平的PD-1(圖20C)。為了研究是否能靶向PSGL-1上的PD-1水平,在感染甲型流感病毒(IAV)或Cl13LCMV後對WT小鼠施用抗PSGL-1阻斷性抗體(4RA10)或對照IgG。抗PSGL-1處理組具有頻率升高的病毒特異性CD8+ T細胞(未顯示)且這些細胞表達比對照水平要低的PD-1(圖20D)。總之,發現指示PSGL-1在下調T細胞應答中具有先前未知的總體作用。
實施例11
BRAFV600E PTEN黑素瘤模型
攻擊性人黑素瘤的當前可得的最好的鼠模型之一是一種誘導型遺傳模型,其組合約65%的患者中存在的BRAFV600E突變與PTEN沉默,這是在約20%的患者中找到的一種組合。BRAFV600E和PTEN刪除的Cre/Lox誘導在黑色素細胞中受到通過用他莫昔芬局部處理皮膚活化黑色素細胞-酪氨酸酶啟動子Try:CreER的暫時控制。有100%的外顯率到2周時發生色素性病變及到1個月時發生轉移性疾病。檢測到皮膚相關腫瘤內的CD3+ T細胞和CD45+單個核細胞(數據未顯示)。通過流式細胞術分析腫瘤。容易檢測到CD4+和CD8+ T細胞二者(圖21A,B,左邊小圖)。PSGL-1在約1/2的CD4+細胞上表達,而且正是這些細胞具有高PD-1(圖21A,中間和右邊小圖)。CD8+ T細胞唯獨是PSGL-P,具有混合的PD-1表達(圖21B)。而且,在黑素瘤陽性耳中,在活化的CD44+CD8+ T細胞上檢測到升高的PD-1和PSGL-1表達(圖22A)。這些衰竭的PD-1高T細胞也具有功能性PSGL-1結合(圖22B)。這些發現指示腫瘤浸潤性CD8+ T細胞具有升高的PD-1,PSGL-1和PSGL-1結合活性。在另外的研究中,通過用他莫昔芬局部處理皮膚活化黑色素細胞酪氨酸酶啟動子Tyr::CreER,通過黑色素細胞中BRAFV600E突變和PTEN刪除的Cre/Lox誘導在小鼠中誘導黑素瘤。在處理後1個月,我們通過流式細胞術在破裂的腫瘤內以高頻率觀察到CD3+ T細胞單個核細胞(圖23A),和PSGL-1+,PD-1+(雙重陽性)CD4+非Treg(效應T細胞)和Treg(圖23B)。比較而言,在荷瘤小鼠或非荷瘤小鼠任一的皮膚引流LN中少數T細胞表達這兩種分子。發現CD3+ T細胞分布遍及黑素瘤(圖23A),而且CD4+非Treg以及Treg均是可檢測的且共表達PD-1和PSGL-1(圖23B)。來自這些小鼠的黑素瘤的另外的研究顯示通過流式細胞術能容易區分免疫細胞,包括CD8+和CD4+ T細胞,Treg,MDSC和DC,NK細胞,NK T細胞,和巨噬細胞(圖24)。
實施例12
在原發性和轉移性黑素瘤內鑑定表達PSGL-1的細胞和它們的應答。
免疫細胞隨黑素瘤發生而變化:通過在6周齡時在體側對Tyr:CreER;Braf/Ptenlox/lox小鼠的4-羥基他莫昔芬(4-HT)處理,建立腫瘤生長的動力學和浸潤物的發生。一旦檢測到腫瘤,就以每周間隔使用免疫組織化學來評估腫瘤,特別關注CD44-和CD8+ T細胞和它們在腫瘤邊緣較之浸潤入腫瘤的定位。對於流式細胞術研究,比較原發性黑素瘤和引流LN並評估轉移至其它皮膚部位,LN,和肺後發生的變化。4-HT處理後隨時間分析腫瘤,引流淋巴結和非引流淋巴結,血液,脾,和肺中的CD8+,CD4+和FoxP3+Treg上的PSGL-1和抑制性受體表達(PD-1,Tim-3,Lag-1,BTLA,CTLA-4,和CD160)。B16黑素瘤模型的研究顯示使用加載有pmel-1的肽gp10025-33(KVPRNQDWL)(由黑色素細胞以及惡性黑素瘤細胞表達的人黑色素體基質的一種結構成分(gp10025-33)的小鼠同源物)的MHC I類四聚體能監測腫瘤特異性CD84-T細胞。這種肽是由在BRAFV600E PTEN黑素瘤模型中誘導的黑素瘤表達的。因此,為了研究腫瘤特異性T細胞應答,使用商品化pmel-四聚體。研究黑素瘤特異性CD8+ T細胞的頻率,它們的PSGL-1表達水平是否有變化及它們是否與總的CD8+ T細胞群體顯示抑制性受體表達的差異。通過細胞因子生成(IL-2,IFN-γ,TNF-α)使用抗CD3刺激後的細胞內染色(ICS)來監測CD4+和CD8+ T細胞的功能,並使用pmel肽再刺激來評估腫瘤特異性CD8+ T細胞的細胞因子生成。對於CD8+ T細胞,通過粒酶B染色以及通過脫粒(通過測量CD107)測試細胞毒性活性。
通過與功能相關的FoxP3表達水平(16)測試Treg的免疫抑制性活性,以及通過ICS測試1L-10和TGF-β生成。評估黑素瘤和引流LN中效應CD4+和CD8+ T細胞對Treg的比率以測定皮膚中出現黑素瘤後隨時間發生的變化。通過在飲用水中施用BrdU,在4-HT處理後1,2,3,或4周啟動處理,分析黑素瘤,淋巴樣組織,和血液中的T細胞來檢查這些群體的擴充。為了進一步調查腫瘤微環境,分析DC(MHC II+,CD11c+),MDSC(Gr1+,CD11b+),和M4(F4/80+,CD11b+)的頻率。為了研究這些群體中的功能,使用ICS來分析分別與免疫原性較之耐受原性DC(17),和M1較之M2巨噬細胞有關的IL-12和1L-10生成,而IL-10區分MDSC。
實施例13
測定靶向PSGL-1是否能延遲或控制黑素瘤及其轉移的發生
PSGL-1對黑素瘤的影響。使用一種骨髓嵌合物辦法,研究PSGL-1缺陷是否引起黑素瘤內或淋巴樣隔室中免疫細胞的功能變化。通過將PSGL-1 KO骨髓注射入經過照射的Tyr:CreER;Braf/Ptenloxilox小鼠並在8周後用4-HT處理,在造血細胞中創建PSGL-1缺陷。對照接受WT骨髓。使用組織學和流式細胞術評估就腫瘤生長和轉移而言的變化,以及腫瘤微環境,淋巴樣隔室,肺和血液中的免疫細胞的頻率和功能以及該免疫細胞上的抑制性受體表達的變化,關注那些研究中限定的最佳讀出和時間點。通過組織學檢查自身免疫/免疫病理的證據,因為抑制性受體的缺陷或阻斷與炎症的發生有關。
圖25顯示PSGL-1缺陷小鼠中增強的抗腫瘤T細胞應答。接受黑素瘤細胞(Yumm 1.5)的皮下注射的WT(黑色柱或黑色圓圈)和PSGL-1 KO(白色柱或方框)(第14天的腫瘤重量和到注射後第12天的體積)(A)。效應CD8+(左邊)和CD4+(右邊)T細胞的絕對數/克腫瘤(B)。效應T細胞上的PD-1表達(C)。CD4+(D)和CD8+(E)T細胞的細胞因子生成。(F)中顯示代表性細胞因子染色。
為了研究PSGL-1缺陷的T細胞固有影響,使用兩種辦法。第一,生成唯獨在T細胞中刪除PSGL-1的嵌合物,用於與具有等位基因標記WT細胞的嵌合物比較。為此,用80:20比率的TCR WS KO(CD45.2):PSGL-1 KO骨髓細胞(Thy1.1,CD45.2)重建經過致死照射的Tyr:CreER;Braf/Ptenlox/lox小鼠(Thy1.2,CD45.2)。8周後用4-HT處理小鼠並評估腫瘤的發生和轉移及T細胞的應答。作為第二種辦法,將pmel Tg小鼠與PSGL-1Thy1.1,CD45.2KO小鼠繁殖。以經過優化的劑量將自這些或WT pmel Tg小鼠(Thy1.1,CD45.2)分離的CD8+ T細胞注射入Tyr:CreER;Braf/Pten lox/lox(Thy1.2,Ly 5.2)。作為備選,我們使用自誘發的原發性黑素瘤衍生的一種黑素瘤細胞系(Yumm 1.5)。以5x105的劑量將腫瘤細胞皮下植入WT或PSGL-1缺陷小鼠(右體側)。在圖24中,通過體積和重量監測腫瘤生長(A),並測定效應CD8+和CD4+ T細胞的頻率(B)。PSGL-1缺陷小鼠具有更小的腫瘤且含有數目更多的T細胞。T細胞表達更低水平的PD-1(C)且更具功能性,如通過細胞因子生成測量的(D-F)。
PSGL-1功能的免疫治療性抑制。測定用激動性單抗(4RA10)或重組PSGL-1 Fc融合蛋白阻斷PSGL-1是否能控制黑素瘤的生長和/或轉移及逆轉T細胞功能障礙。作為原發性黑素瘤的治療以及在轉移已經發生之後測試這些試劑。對於原發性腫瘤,比較將單抗局部注射入腫瘤與系統性處理。對於局部處理,在原發性腫瘤檢測時使用起始劑100μg抗PSGL-1或對照IgG。對於系統性處理,腹膜內注射300μg/單抗/劑,隔天治療,持續5天,而且跟蹤動物的腫瘤生長和皮膚轉移。在1個月時,對動物檢查血液,脾,LN,和所示腫瘤中的pmel-四聚體+ CD8+ T細胞,它們的抑制性受體的表面表達,和它們的應答。在檢測原發性腫瘤後1,2,3或4周時檢測啟動系統性單抗治療的效果以研究抗PSGL-1是否能隨疾病行進而影響抗腫瘤應答。作為阻斷PSGL-1的第二種策略,施用PSGL-1Fc,以人Ig作為對照。每3-4天通過ELISA評估血清中的單抗和融合蛋白水平以測定半衰期及研究T細胞表型和/或應答是否隨著這些試劑衰減而有變化。啟動療法後以每周間隔測量血清中的IL-6,IL-21,TNF-α,和IFN-γ水平以測定是否發生細胞因子水平變化,及是否有與改善的抗T細胞腫瘤活性或腫瘤消退的關聯。
雖然已經提到上述實施例描述本發明,但是會理解,修改和變化涵蓋在本發明的精神和範圍內。因而,本發明只受所附權利要求書限制。
