具有針對登革病毒的抗病毒特性的β‑髮夾肽的製作方法
2023-05-27 17:15:37 3
本發明涉及醫學和藥物工業,特別地涉及具有針對登革病毒(DENV)的抗病毒特性的合成肽的設計和獲得。設計所述肽的一級結構以有效地形成β-髮夾結構和模擬該病毒的包膜蛋白的結構域III(DIIIE)的功能性斑片。本發明還涉及包含這些合成肽的藥物組合物,其用於預防和/或治療由DENV引起的感染。
現有技術
DENV是黃病毒科(Flaviviridae)的成員,所述黃病毒科由具有正義單鏈核糖核酸(RNA)的有包膜病毒組成。黃病毒科由三個不同的屬構成:黃病毒屬(Flavivirus)、C型肝炎病毒屬(Hepacivirus)和瘟病毒屬(Pestivirus)。黃病毒屬包括超過70種已知的病毒,其中許多在人或其他物種中引起重要的疾病。這些之中包括黃熱病毒(YFV)和DENV。感染人血清的黃病毒屬病毒是通過節肢動物媒介(例如蜱和蚊子)進行傳播的,這使得這些疾病是非常難以根除的(Monath,T.P.,F.X.Heinz.1996.Flaviviruses,第961–1034頁.In:B.N.Fields,D.M.Knipe,P.M.Howley(編者),Fields virology,第3版,vol.1.Lippincott-Raven Publishers,Philadelphia,Pa.)。
DENV是在熱帶地區大範圍流行的,並且其近期的再度出現在這些國家的公共衛生中具有越來越大的重要性。據估計每年的感染為大約1億例;並且25億人生活在登革熱流行的地區(Gubler,D.J.(1998).Clin.Microbiol.Rev.11,480-496;Monath,T.P.(1994)Proc.Natl.Acad.Sci USA 91,2395-2400)。在1990-1998年期間,向世界衛生組織報告的登革出血熱(DHF)的病例的平均數是514,139例/年,包括15,000例死亡,雖然認為DHF的真實發病率還要高至幾倍。然而,目前還不存在有商購可得的疫苗,也沒有針對DENV的特異性抗病毒治療。
術語「DENV」是指由在遺傳上和在抗原性上相關的四種病毒或血清型(DENV1-DENV4)組成的病毒複合體。DENV通過蚊子,主要通過埃及伊蚊(Aedes aegypti)傳播給人。感染引起存在變化的臨床表現:從無症狀的和輕微的表現,例如無差別的發熱疾病,直至更嚴重的表現,例如DHF和可能致命的登革熱休克症候群(DSS)。最嚴重的臨床表現通常與由該病毒的兩種不同血清型引起的連續感染相關聯(KouríGP等人,(1987)Trans Roy Soc Trop Med Hyg,72:821-823;Halstead,S.B(2003).Adv.Virus Res.60:421-67)。該現象已通過由抗體介導的增強作用這一理論進行了解釋,該理論基於通過在由靶細胞的Fc受體協助的病毒-抗體複合物進入細胞方面的增加而產生的病毒感染性的提高(Halstead SB.(1988).Science,239:476-481)。
病毒複製循環的第一步在於病毒吸在宿主細胞的表面上。已證明了DENV結合至可能構成與細胞的初始相互作用位點的葡糖胺聚糖。還已證明了病毒結合至樹突細胞特異性細胞間粘附分子-3-抓捕性非整聯蛋白(DC-SIGN,Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integrin),雖然可能的是這些分子的作用與在細胞表面上的病毒積累或者病毒在體內散布至次級感染位點處相關。病毒向細胞中的生產性進入通過由受體介導的胞吞作用而發生。在初始結合後,病毒與牽涉內化過程的具有高親和力的受體和/或共同受體相互作用。一旦定位於胞吞區室中,pH的降低就誘導由病毒融合蛋白中的結構變化所介導的內體膜與病毒包膜膜的融合過程。該過程導致衣殼卸放到細胞質中,其中RNA隨後被釋放。一旦在細胞質中,RNA就通過其5』非翻譯區(5』UTR)與核糖體相互作用,其中發生它所編碼的病毒基因組的唯一開放讀碼框的翻譯。以該方式,合成出前體病毒多蛋白,其在黃病毒屬中包括三種結構蛋白即衣殼蛋白(C)、膜蛋白(prM)和包膜蛋白(E),以及非結構蛋白(NS1-5)。該多蛋白通過病毒來源的和宿主細胞的蛋白酶來進行共翻譯或翻譯後修飾,從而產生功能性的獨個病毒蛋白質。與輔助因子相聯合的病毒RNA依賴性RNA聚合酶產生負義單鏈RNA拷貝,其反過來充當用於合成正義單鏈基因組RNA的模板。參與複製的病毒蛋白質與看起來與內質網相關的膜結構相聯合。
在複製後,基因組RNA與核衣殼蛋白相聯合,並且在粗面內質網的膜中,或者在由病毒所誘導的膜結構中,產生包被有包含病毒蛋白質的脂質病毒包膜的未成熟病毒粒子的向著內腔的芽體。通過胞吐途徑,包膜的蛋白質被糖基化和成熟化,從而最後產生成熟病毒粒子向細胞外空間的釋放。
DENV的基因組由長度為大約11kb的正義單鏈RNA組成(Henchal,E.A.&Putnak,J.R.(1990).Clin.Microbiol.Rev.3,376-396)。病毒基因組編碼不間斷的開放讀碼框(ORF),其大小根據每種病毒血清型(包括相同血清型的毒株)而變化(Yabar V.C.(2003).Rev.Perú.Med.Exp.Salud Publica 20,51-57)。關於結構蛋白的基因位於朝向5』端,其中佔據ORF的大約四分之一。在基因組的其餘部分中編碼非結構蛋白(Lindenbach,B.D.&Rice,C.M.(1999).J.Virol.73,4611-4621)。
DENV和其他黃病毒的蛋白E在與細胞受體的結合、膜的融合和病毒粒子的裝配中發揮著根本性的作用。因此,其特性是對於宿主範圍和毒力以及保護性免疫的誘導來說重要的決定因素(Modis,Y.等人,(2005).J.Virol.79,1223-1231)。
蛋白E具有53至54kDa的分子量,並且它是結構多肽中最保守的。在血清型之間,相似性為60-70%。X射線晶體學(Modis,Y.,(2003).Proc.Natl.Acad.Sci.U.S.A.100,6986-6991)和冷凍電子顯微鏡術(Kuhn,R.J.等人,(2002).Cell 108,717-725)的研究揭示,與在其他黃病毒中一樣,DENV的蛋白E在成熟病毒粒子的表面上形成二聚體。
在病毒粒子中,暴露於稍微酸性的pH(低於6.5)誘導該蛋白質的不可逆的構象變化,所述構象變化在於二聚體的解離和其重新結合成三聚體。該構象變化對於病毒膜與內體膜的融合來說是必不可少的,所述融合在病毒粒子通過由受體所介導的胞吞作用而內化到哺乳動物細胞中之後發生(Modis,Y.等人,(2004).Nature 427,313-319)。
在蛋白E的每個單體的大約500個胺基酸殘基中,80%構成N-末端胞外結構域的一部分。其餘構成跨膜區,其將蛋白E錨定在脂質包膜中(Chambers,T.J.等人,(1990).Annu.Rev.Microbiol.44,649-688),並且其通過具有大約53個殘基的莖區與N-末端胞外結構域相連接(Modis,Y.等人,(2004).Nature 427,313-319)。使蛋白E的可溶性片段成形的多肽鏈摺疊為三個結構性結構域:β-片層類型摺疊的中心結構域(結構域I)、延長的二聚體化區域(結構域II)和其結構與免疫球蛋白的摺疊類型相似的第三區域(結構域III)(Modis,Y.等人,(2003).Proc.Natl.Acad.Sci.U.S.A.100,6986-6991)。
DIIIE是蛋白E的唯一的連續多肽。其位於朝向每個單體的末端羧基端,在胺基酸294和392之間。DIIIE的結構與免疫球蛋白恆定區的結構非常相似(Modis,Y.等人,(2005).J.Virol.79,1223-1231)。DIIIE的三級結構包括在位於位置302和333處的兩個Cys殘基(其在所有黃病毒中是嚴格保守的)之間建立的二硫橋。
DIIIE通過具有10個殘基的、延伸的且柔韌的區域與結構域I相連(Modis,Y.等人,(2004).Nature 427,313-319),這允許DIIIE採取相對於其餘結構域而言的方向(Rey,F.A.等人,(1995).Nature 375,291-298)。在二聚體至三聚體的轉換期間,DIIIE是遭受最顯著移位的結構域,其中經歷大約70°的旋轉和其質量中心向著結構域II的的移動。在DENV和其他黃病毒的DIIIE中,存在有大量的決定毒力、細胞向性和病毒宿主範圍的殘基(Rey,F.A.等人,(1995).Nature375,291-298),以及構成逃避中和突變的那些殘基(Modis,Y.等人,(2005).J.Virol.79,1223-1231)。
許多來自對於DENV的蛋白E和病毒粒子的結構進行的分析的數據,以及許多實驗證據暗示,DIIIE構成蛋白E與細胞受體的相互作用區域的一部分。在所述結構特徵之中,要強調作為病毒粒子的最突出區域的結構域的定位,其在與受體位點的相互作用中賦予更高度的可接近性(Mukhopadhyay,S.等人,(2005).Nat.Rev.Microbiol.3,13-22)。另外,該結構域所具有的免疫球蛋白類型的特有結構暗示了其在與細胞受體的相互作用中的可能作用,因為已在多種多樣的細胞粘附蛋白中發現了類似的結構。暗示了DIIIE與受體的可能結合的其他結構特徵為在該結構域中存在帶正電荷的親水性斑片。這些區域由殘基284-310和386-411形成,其可能牽涉該結構域與硫酸肝素分子的結合(Modis,Y.等人,(2005).J.Virol.79,1223-1231)。
用通過重組脫氧核糖核酸(DNA)技術獲得的該相同血清型的DIIIE分子來進行的研究證明,它們能夠直接結合至C6/36和BHK21細胞的表面並且阻斷病毒感染(Hung,J.J.等人,(2004).J.Virol.78,378-388)。
以前的研究已證明,DIIIE以30μΜ或更低的表觀解離常數(KD)(取決於所述黃病毒)特異性地與宿主細胞結合(Halstead,S.B.等人,(2005).Vaccine 23,849-856)。另一方面,已知以最高效率阻斷DENV與宿主細胞的結合的單克隆抗體是識別DIIIE的那些單克隆抗體,這間接地表明,該結構域構成蛋白E與細胞受體的相互作用區域的一部分(Thullier,P.等人,(2001).J.Gen.Virol.82,1885-1892)。
DENV向宿主細胞中的進入依賴於這些顆粒與在細胞表面上的特異性受體分子所建立的相互作用。在對DENV的受體進行的研究過程中獲得的證據表明,這些分子可以在不同的細胞類型之間以及對於不同的病毒血清型而變化。從關於DENV的受體的研究中積累的許多結果暗示,該病毒利用多分子複合物,其中某些分子起初級受體的作用,從而將病毒顆粒集中在細胞表面上並促進隨後與胞吞受體的相互作用。
阻斷病毒向細胞中的進入是一個令人感興趣的抗病毒策略,因為它代表了用於阻止感染開始的初級屏障。通過X射線晶體學和核磁共振波譜法來進行的分析已提供了該屬的三種結構蛋白的原子解析度結構:蛋白C、蛋白prM和蛋白E。這些研究已招致抑制病毒複製的備選方法,其朝著阻斷對於病毒的有效繁殖來說必需的結構轉換。在蛋白E與受體分子和中和抗體的相互作用的基礎上,已從結構研究中湧現出了數種特異性區域,作為用於針對DENV的抗病毒藥物的合理設計的靶標。
已提出被稱為低密度脂蛋白受體相關蛋白(Low Density Lipoprotein Receptor-Related Protein)(LRP1)的膜蛋白是DENV的推定的胞吞受體,並且其是對於抗病毒藥物的設計來說有吸引力的靶標(Huerta G.V.等人,WO 2007/124698)。LRP1是有效地介導多於30種天然配體的胞吞作用的受體,並且還是次要群鼻病毒的受體。該受體直接地和間接地(這由能夠同時與病毒相結合併與受體相互作用的載體分子來介導)與病毒的DIIIE相結合。蛋白質α2-巨球蛋白(α2M)的情況就是如此,所述α2M結合DIIIE並且是LRP1的配體。
已顯示,基於DIIIE的結構的β-髮夾肽在體外和在體內抑制登革病毒感染(Huerta G.V.等人,WO 2007/124698)。這些肽由DIIIE的FGβ-髮夾序列的片段組成,其序列依賴於病毒血清型而變化。它們通過在所選擇的髮夾片段的N-末端和C-末端處所添加的兩個半胱氨酸之間所形成的二硫橋而環化。該系列的具有最高抗病毒活性的肽為肽HDIII3CL(其序列相應於DENV3),並且抑制由四種血清型引起的病毒感染。
然而,所述系列的肽具有重大的缺點。首先,效力是非常低的,在Vero細胞中的感染抑制測定試驗之中所測定的HDIII3CL的50%抑制濃度(IC50)的值為15μΜ(對於DENV1)、20μΜ(對於DENV2和DENV3)和40μΜ(對於DENV4)。這樣的效力值使得在這些分子的臨床開發中成功是不可能的。所希望的效力值應當至少在亞μΜ範圍內,優選地在nM或更優範圍內。
這些分子的另一個可以看到的缺點是,鏈間環的區域為抗病毒抗體應答的免疫顯性表位(Matsui K.等人,(2009)Virology 384(1):16-20)。在公開文本Huerta G.V.等人,WO 2007/124698這一文獻中證明,中和抗體3H5識別包含鏈間環的肽。一部分抗結構域應答在血清型之間具有交叉反應性。這樣的由先前的感染所誘導的交叉反應性抗體可以具有針對該肽的中和效應,結果造成為了抵消所述中和效應,進一步需要增加治療劑量。
根據先前所提及的要素,針對DENV的具有高效力(優選地在nM範圍內)的抗病毒藥物的可得性是一個尚未解決的問題。本發明正是針對該目標。
發明描述
本發明通過提供經由對以前鑑定出的肽的效力進行優化而產生的抑制DENV的新型β-髮夾肽而解決了前面所提及的問題。本發明的β-髮夾肽的特徵在於,具有選自由下列各項組成的組的胺基酸序列:SEQ ID No.1至SEQ ID No.9,或者與所述序列類似的序列。
本發明的中心目標是設計抑制DENV感染的肽,其特徵在於,展示出高的(至少在亞μΜ範圍內,優選地在nM或更優範圍內)效力。高的效力是對於取得足夠低的治療劑量來說必需的特性。目前在臨床中針對其他病理學狀況進行使用的治療性合成肽是高度強有力的,其中具有在nM/亞nΜ範圍內的效用值(IC50,50%有效濃度(EC50),等等),並且也是高度特異性的,其中具有低的毒性。具有微小效力的肽需要更高的治療劑量,這可以具有重大的缺點。例如,高劑量的使用由於非特異性相互作用而增加了副作用的可能性。而且,較大的肽濃度可能與聚集問題相關聯,在生產過程期間和在其體內施用期間,所述聚集通過與血清蛋白質的非特異性相互作用而發生。高劑量增加了免疫原性/抗原性問題的可能性。抗肽免疫應答的誘導,特別是抗肽抗體的產生,可以中和所述肽的治療活性,尤其是在第二次施用中或者在足夠長的治療時間之後,從而導致需要進一步增加劑量。
相反地,低的有效劑量的使用具有經濟上的優點,在生產成本方面和在待由患者支付的價格方面。肽的合成技術比基於小分子的藥物的合成更昂貴。所有這些可能限制能夠獲得針對登革熱的抗病毒藥物的患者或人員的數目,尤其是如果治療劑量是高的話。
肽的效力首先取決於該肽與生物學上重要的靶受體結合的親和力。模擬蛋白質表面的功能性斑片的活性肽的設計是一個並不普通的問題,這是由於球狀蛋白質的功能性斑片通常是形貌學的(topographic)(牽涉多肽鏈的多於一個區段)和構象的(在與受體的相互作用中採取非常確定的空間結構)。相反,通常具有10-20個胺基酸的相應於蛋白質的短區段的肽在溶液中是柔韌的,並且不採取非常確定的唯一結構。
特別地,其序列相應於摺疊蛋白質的β-髮夾結構的肽通常在溶液中不是在結構上穩定的,其中平衡地共存在多種構象。一般地,所述肽在溶液中的構象可以作為在兩個狀態之間的平衡來看待:摺疊狀態(其三維結構與該蛋白質的天然結構相一致)和解摺疊或變性狀態(該肽在溶液中所採取的多種非天然構象的全體)。當肽的髮夾結構越穩定(和與在蛋白質的天然摺疊中所採取的結構越相像)時,與受體的相互作用的親和力就將會越大,這歸因於更小的與肽-受體複合物的形成過程相關聯的構象熵的損失。
如果假設在溶液中肽採取雜亂的結構並且結合過程通過構象選擇機制而發生,那麼肽與受體的結合過程的自由能變化可以表示為與肽的摺疊相關聯的自由能變化和其與結合位點偶聯(剛性的,在偶聯已經摺疊的肽這一意義上來說)的能量之和。
因此,在這樣的情況下,可以通過下列方式來實現在與結合過程相關聯的自由能差方面的增加:a)通過將原始序列的胺基酸置換為對於肽在溶液中摺疊的穩定性正面地作出貢獻的其他胺基酸來對肽進行修飾(尤其是當被置換的殘基不直接參與與受體的接觸表面時),和b)通過優化在肽與受體之間的分子間相互作用來增加偶聯能。
對於肽HDIII3CL(SEQ ID No.10,表1)的序列進行的檢查揭示了數種能夠關於髮夾類型的摺疊的穩定性進行改善的特徵。例如:a)位於F和Gβ-鏈這些區段中的胺基酸Asn3和Asn16的存在,其具有非常低的形成β-片層的傾向(圖1E);b)在所述鏈之間的具有六個殘基的長環;c)位於所述鏈間環中的兩個甘氨酸Gly7和Gly9的存在。胺基酸天冬醯胺是β-結構的差的形成者,具有對於β-鏈而言非常低的固有傾向值和對於以正的扭轉角為特徵的主鏈的環和結構的偏愛(Swindells MB等人,(1995).Nat Struct Biol.,2(7):596-603)。HDIII3CL的環的大小以四個殘基而大於兩個殘基的最佳值(Branden C.&Tooze J.Introduction to protein structure.New York:Carland Publishing,1991)。此外,一般地,在蛋白質的環中插入殘基導致與與其閉合相關聯的熵成本,所述熵成本隨著插入的大小而增加(Chan,H.S.&Dill,K.A.(1988).J.Chem.Phys.90:492-509;Nagi AD&Regan L.(1997)Fold Des.,2(1):67-75)。另外,甘氨酸是在摺疊過程中損失最多構象熵的殘基,因為它不具有與其餘天然胺基酸相關聯的對於主鏈扭轉角的限制。
導致本發明的β-髮夾肽的更大的摺疊穩定性的序列設計的基礎在於,引入對於可修飾位置具有高的結構傾向的殘基(比在待形成β-髮夾類型的結構的原始序列中存在的殘基更大的傾向)。待在β-髮夾的摺疊中佔據特定位置的殘基類型的結構傾向可以通過所述殘基類型在存在於蛋白質結構資料庫中的經由實驗測定的結構的β-髮夾的所述位置處的出現頻率來估計。從數學上,計算所觀察到的所述殘基類型在該特定位置處的出現頻率與所預期的頻率(根據該殘基在資料庫中的相對豐度)之比的對數。
在本發明中被定義為「可修飾的」位置為:
a)該肽的β-髮夾的第一條β-鏈的殘基,其相應於DIIIE的結構的F鏈的內面(未暴露於溶劑的殘基)。這些殘基佔據在該肽的第一條β-鏈和第二條β-鏈(相應於該結構域的G鏈的鏈)的主鏈的供者原子和受者原子之間建立氫橋的位置(HB位置);
b)鏈間環;
c)該肽的第二條β-鏈(相應於該結構域的G鏈)的HB位置,除了相應於保持不變的DIIIE的殘基TRP391(相應於DENV2的編號)的位置外。對於其餘的位置,允許用優選地具有疏水特徵的殘基來進行改變;
d)最接近所述環的F鏈的非HB位置(NHB位置);
e)第二條鏈(相應於G鏈)的第一個HB位置。除了具有高的結構傾向的殘基外,由於功能原因還允許Lys,因為該殘基模擬在所述四種血清型的DIIIE中在形貌學上保守的並且在與受體LRP1/α2M*(激活的α2M)的結合中可能重要的賴氨酸(Lys 385,相應於DENV2的編號)的作用。
在(a)點中所定義的本發明的可修飾殘基為在DIIIE的結構中對於溶劑來說不可接近的並因此不參與該結構域與在病毒感染中重要的受體的相互作用界面的殘基。因此,它們可以被置換為對於摺疊的穩定性來說更有利的殘基。
鏈間環的殘基(b)被認為是可修飾的,因為通過比較所述四種血清型的序列,它是可變區,這表明並不需要該環的任何區段的嚴格保守來保證與受體的相互作用。這得到了下述事實的支持:肽HDIII3CL抑制該病毒的四種血清型的感染,並且受體α2M*/LPR1的阻斷通常引起不依賴於血清型的抗病毒效應。本發明的鏈間環的優選變體由β-轉角的兩個中心殘基組成,其中該轉角的位置1和4與鄰近的β-鏈的末端的殘基相一致。所述環的該變體對於摺疊的穩定性來說是有利的,短的連接環在β-髮夾中是最常見的(Branden C.&Tooze J.New York:Carland Publishing,1991),並且該鏈間環的大小的減小降低了與變性狀態相關聯的構型熵,其隨著多肽鏈的大小增加而變得更大。
具有兩個殘基(本發明的環的優選的長度)的環的中心殘基之一可以作為DENV3的DIIIE的殘基Lys385的模擬殘基而擔當功能性作用。在本發明的某些肽中,在具有與DIIIE的FGβ-髮夾相同的拓撲學結構的肽中,在IIP型β-轉角的情況下,所述功能性作用由位於該環的第二個位置處的賴氨酸殘基(佔據該轉角的第二個中心位置)來執行。在另一種肽中,在該肽的拓撲學結構與DIIIE的FGβ-髮夾的拓撲學結構反向的情況下,所述功能性作用由位於該環的第一個位置(IIP型β-轉角的位置2)處的d-Lys殘基(胺基酸賴氨酸的D-立體異構體)來擔當。
在(c)點下所定義的可修飾殘基位於該髮夾的與(a)點的那些相同的面,並因此與這些是鄰近的並且在主鏈的原子之間形成氫橋。在該結構域的結構中的相應殘基部分地暴露於溶劑,因為G鏈是β-片層的邊緣的鏈。等價於由殘基Trp391(相應於DENV2的編號)所佔據的位置的β-髮夾的位置在本發明中不是可修飾殘基,因為該殘基在DENV的四種血清型中是嚴格保守的並因此可能是功能性的。在實施例2(表2)中證明,該位置在肽HDIII3CL(和表1的肽HDIII3CL2)的抗病毒活性中是必需的,因為將該殘基置換成丙氨酸引起抗病毒效應的喪失。在第二條鏈的第一個位置(作為(e)而提及的可修飾殘基)處,允許胺基酸賴氨酸,目的是可以構成DENV3的DIIIE的殘基Lys385的結構/功能的模擬物,所述殘基Lys385是在該結構域與蛋白質α2M*(其是推定的胞吞受體α2M*/LRP1的組分)的相互作用中必需的陽離子殘基。
作為(d)而提及的可修飾位置位於相應於該結構域的暴露表面的那一面,雖然其在血清型之間不是嚴格保守的(圖1E)。
為了設計經優化的序列,在每一個可修飾位置處,選取具有最高的結構偏好參數值的殘基。這些參數是從在具有已知結構的有著8個殘基的片段中每個胺基酸的觀察頻率開始來進行計算的,所述片段採取具有由兩個殘基組成的中心環的β-髮夾結構(所述片段的殘基4和5為β-轉角的兩個中心殘基)。通過使用具有大於的解析度的非冗餘蛋白質三維結構庫來進行分析(WHAT IF的資料庫;Vriend,G.(1990),J.Mol.Graph.8,52-6)。偏好參數被定義為在髮夾的一個位置處一種胺基酸類型的出現次數與根據在資料庫中該殘基的相對豐度而預期的次數之比的對數。對於具有IP和IIP型β-轉角的β-髮夾,分開地計算所述參數。為了最後的選擇,獲得β-髮夾的三維結構模型,考慮側鏈的最常見的旋轉異構體和鏈間接觸。
本發明還包括將非天然胺基酸引入到與所述胺基酸的化學結構和立體化學特性在結構上相容的β-髮夾的位置處。在採取正的主鏈扭轉角的髮夾的位置處所引入的天然胺基酸的D-立體異構體的情況就是如此。一個實例是d-Pro,其作為IIP型β-轉角的第二個殘基(等價於本發明的由兩個殘基組成的鏈間環的第一個殘基)是有利的。另一個實例是胺基酸d-Lys,其也被引入在相應於IIP型β-轉角的第二個殘基的位置處,但是在具有反向拓撲學結構的肽中。在該情況下,該Lys不是在該位置處在結構上有利的胺基酸(考慮到偏好參數,其是不利的,這反映了Lys對於採取位於拉氏圖(Ramachandran plot)的右下象限中的扭轉角來說是不利的這一事實),但是該殘基的側鏈值得想望作為結構域III(DENV3)的殘基Lys385的潛在模擬物。殘基d-Lys對於採取在IIP型β-轉角的位置2處所要求的扭轉角來說是有利的。
在上面段落中所描述的可修飾殘基的定義相應於其拓撲學結構與DIIIE的FGβ-髮夾相同(天然拓撲學結構)的β-髮夾肽。然而,本發明還揭示了具有反向拓撲學結構的肽。在這樣的肽中,該序列的第一條和第二條β-鏈在功能上/在結構上分別相應於DIIIE的G和F鏈。在具有反向拓撲學結構的肽中佔據NHB位置的殘基相應於具有天然拓撲學結構的肽的HB位置,反之亦然。
保持該結構域的FGβ-髮夾的原始拓撲學結構的所設計出的肽在NHB位置處包括二硫橋,其對於β-髮夾結構的摺疊的穩定性來說是有利的。所添加的半胱氨酸的位置為:a)F鏈的第一個殘基,和b)G鏈的最後一個殘基(圖1E)。
數種本發明的肽具有較大的β-鏈的大小,如果與肽HDIII3CL進行比較。所述鏈的殘基數目的增加對於摺疊的穩定性作出貢獻,其中包括兩個額外的氫橋的添加(一個HB殘基/鏈)。
增加肽與受體的相互作用的親和力(和還有其抗病毒活性)的另一種方式在於通過修飾對於相互作用能的貢獻很少或為負的界面殘基來優化分子間相互作用。一般地,大分子之間(特別地,蛋白質之間)的相互作用的特徵在於,由有限數目的界面殘基來支配。其餘殘基僅具有有限的貢獻。在本發明的肽的情況下,既不知道肽-受體相互作用的結構細節,也不知道DIIIE與受體之間的相互作用的結構細節。儘管如此,作為首次接近,可以假定相應於DIIIE的FG髮夾的暴露殘基的殘基可能是功能性的,任選地牽涉肽-受體界面。
在本發明的實施例2(表2)和實施例6中顯示,肽HDIII3CL2的殘基Lys14(相應於DENV3的DIIIE的殘基Lys388)被丙氨酸置換消除了在Vero細胞中該肽的抗病毒活性,並且影響該肽與受體LRP1的結合。通過用丙氨酸置換殘基Trp17(相應於DIIIE的殘基Trp391),獲得了相同的結果。因此,這兩個殘基在生物學活性中均是必需的,非常可能位於界面中,並且對於相互作用作出實質性貢獻。因此,在本發明中它們不被置換。該肽的殘基Cys1和Cys18被丙氨酸雙重置換還消除了肽HDIII3CL2的抗病毒活性,以及其與受體LRP1結合的能力,但是該效應歸因於在該肽的β-髮夾結構的穩定性方面的作用,而不是所述半胱氨酸對於分子間相互作用的有利貢獻。
本發明將β-髮夾肽的可能功能性的表面的延伸揭示為用於增加其效力的方式。在該情況下,向髮夾結構添加四個殘基,其中兩個相應於DIIIE的FGβ-髮夾的暴露面的殘基未包含在一系列與HDIII3CL類似的肽中。所述添加在於每條β-鏈兩個殘基,其中NHB位置被相應於(DENV3的)包膜蛋白的殘基375(F鏈)和392(G鏈)的胺基酸佔據。DIIIE的殘基375的特徵在所述四種血清型之間是保守的,並且它被胺基酸Glu和Asp佔據。這兩個殘基對於在本發明的β-髮夾肽中的等價位置來說都是符合條件的,雖然優選的解決方案是Glu,因為不利的採取延伸結構並形成β-鏈的傾向在Asp上更明顯。對於等價於該結構域的殘基392的位置,優選地採取Phe和Tyr,其是DENV的四種血清型的最具代表性的殘基。髮夾的延伸段的HB位置相應於關於摺疊的優化而言的可修飾殘基。在這些位置處,採取具有形成β-鏈類型的二級結構的傾向的、優選地疏水的殘基。
與在實施例2中所確定的必需殘基(相應於DIIIE的Lys388和Trp391的殘基)和相應於位置Glu/Asp392的殘基不同,其餘的外面殘基(NHB)被認為能夠進行修飾,因為其位置在血清型之間是更加可變的。本發明的優選的解決方案是在DENV的四種血清型的同源序列中在相同位置處出現的殘基。相應於DIIIE的位置377的殘基的情況就是如此,優選的解決方案為(DENV1和DENV4的)殘基Tyr,而非(DENV3的)Asn。與Asn一樣,殘基Tyr是極性的並且是氫橋的供者/受者,但是暴露出更大的非極性表面,並且是在蛋白質-蛋白質相互作用的位點處更頻繁出現的胺基酸。此外,採取延伸結構和β-鏈的傾向對於Tyr來說是更大的,其還可以具有有利的(π-陽離子)與相應於DIIIE的Lys388的殘基的相互作用並且對髮夾的穩定性作出貢獻。
非必需的(但可能功能性的)位置通常可以通過使用組合方法(例如,在噬菌體上表達的肽文庫)來進行測定/挑選,其中可以使必需位置和結構位置保持固定不動並且使其餘的可能功能性的位置隨機化。最佳序列的選擇通過結合測定試驗來實現,其中選擇表達有效地與受體分子(例如LRP1和/或α2M*)相結合的肽序列的噬菌體。經優化的序列的選擇還可以通過合理設計方法來實現。
為了本發明的目的,本發明的β-髮夾肽可以通過合成途徑來獲得,或者如果序列僅包含天然胺基酸,那麼可以通過重組DNA技術來獲得,單獨地或作為融合蛋白。在使用重組DNA技術的情況下,表達為融合蛋白可以提高表達水平以及所述肽對於蛋白水解的穩定性。可以將所述肽通過蛋白酶特異性底物序列而連接至融合蛋白。因此,通過用這些蛋白酶進行蛋白水解,能夠釋放出本發明的肽並隨後將其進行純化。
在實施例1中顯示了新型β-髮夾肽(SEQ ID No.1-SEQ ID No.9)的設計。這些肽的序列的基本結構由四個區段組成:兩個β-鏈區段(其與DIIIE的FGβ-髮夾在結構上類似),它們被一個β-轉角分隔開並且跟隨有一個包含三個賴氨酸的C-末端陽離子延伸段。這些肽的設計按照前面所討論的結構/功能標準來進行,其目標是增加這些分子的抗病毒活性效力以及其與細胞受體的結合。
為了本發明的目的,如果一個肽序列與至少一種選自PHB1-9的肽的序列相似,從而相應的序列同一性百分比等於或大於70%,優選地等於或大於80%,那麼認為那個序列與PHB1-9β-髮夾肽是類似的。所述類似肽的序列在一個或數個選自下列的位置處不同:1)上面所描述的可修飾位置a)-e),在該情況下,PHB1-9的殘基被置換為也具有高的在β-髮夾中佔據所述位置的結構傾向的殘基;2)上面所描述的可能功能性的位置,在該情況下,PHB1-9的所述殘基被置換為DENV的一種血清型的DIIIE的FG髮夾的殘基,以便所述殘基在肽PHB1-9的β-髮夾中佔據類似的位置;3)相應於C-末端賴氨酸尾巴的殘基的位置,在該情況下,所述尾巴可以包含兩個或三個賴氨酸,優選地三個賴氨酸;和4)相應於形成肽PHB1-4和PHB7-9的二硫橋的半胱氨酸的位置,在該情況下,所述半胱氨酸可以被置換為殘基Asp/Glu或Lys,以便該橋的配對半胱氨酸分別被置換為Lys或Asp/Glu,並且所述肽通過在所述殘基(一邊為Asp/Glu,和另一邊為Lys)的側鏈之間形成醯胺鍵而環化。
肽PHB1-9的活性通過在Vero細胞中的蝕斑形成抑制測定試驗來進行評價,並且顯示在實施例2中。所有這些肽均顯示出抗病毒活性,它們中的六個在所採用的實驗模型中比肽HDIII3CL更強有力。肽PHB4具有針對該病毒的四種血清型的在nM範圍內的強有力的抗病毒活性,並且顯示出非常有利的選擇性指數(在1290和6450之間,取決於血清型)。該肽是作為針對DENV的抗病毒藥物的具有優異特性的先導分子,並且展示出比以前所報導的抗病毒藥物更大的效力。
因此,本發明的目標還為包含一種或多種β-髮夾肽和至少一種藥學上可接受的賦形劑的藥物組合物,所述β-髮夾肽具有選自由下列各項組成的組的胺基酸序列:SEQ ID No.1-SEQ ID No.9,或者與所述序列類似的序列。
在本發明的一個實施方案中,在所述藥物組合物中,所述肽形成超分子聚集體。由於肽PHB4(和一般地,本發明的β-髮夾肽)是為了採取兩親性β-髮夾結構而設計的兩親分子,因而其能夠依賴於濃度和環境條件而形成超分子聚集體。
在實施例5中顯示,該肽進行自裝配並且形成納米結構,其大小和形態取決於實驗條件,例如濃度、溫度、溶劑、聚集時間、添加物的存在等。該肽的抗病毒活性可以依據這些條件而改變。
在本發明的背景下,「超分子聚集體」是指由許多肽分子(優選地,多於十個分子)形成的聚集體。
在實施例8中證明,在肽PHB4的鹽水溶液中於確定的溫育時間添加蛋白質人白蛋白(或稱為人血清白蛋白(HSA))導致獲得在低於nM/亞nM範圍內的效力。該結果表明,在HSA存在下配製該肽是可能的,並且肽聚集體與該蛋白質的推定的相互作用導致高度有活性的複合物。這樣的相互作用可能在該肽的藥物代謝動力學特性方面是非常有利的,因為HSA具有非常高的半壽期。此外,其可以提供針對蛋白酶的保護作用,並且影響與血清成分的不希望的可能相互作用。因此,在本發明的一個實施方案中,包含所公開的β-髮夾肽的藥物組合物還包含HSA。
不依賴於HSA的存在,肽PHB4自裝配成納米顆粒是從藥物代謝動力學/藥效動力學的觀點來看有利的特性。由於其大小,納米顆粒可以展示出比單體肽(其常常被迅速清除和被代謝)更長的在血液中的半壽期。單體肽易被宿主的蛋白酶降解,而納米顆粒提供更大的針對蛋白水解的保護作用。在納米顆粒的背景下,多個與受體的結合位點的呈現可以增加該受體對該肽的親和力,並且對於該肽的抗病毒活性效力作出有利貢獻。
在實施例3和6中證明,本發明的β-髮夾肽能夠結合蛋白質α2M*和受體LRP1(其是DENV的推定的胞吞受體的組分),並且是用於設計抗病毒藥物的有吸引力的靶標,根據在Huerta G.V.等人的專利申請公開文本WO 2007/124698中所報導的。
本發明的實質性要素是分析在nM範圍內的β-髮夾肽的生物學活性。如在實施例3中所顯示的,在nM/亞μM範圍內,肽PHB2、PHB4、PHB5、PHB8和PHB9抑制DENV1-牙買加毒株的重組DIIIE的生物素化變體(「DIIIE1J-生物素化的」)與蛋白質α2M*的結合,並且所述抑制能力明顯高於由非生物素化的DIIIE(DIIIE1J)所展示的。所述肽的抑制百分比為DIIIE1J的1.5至3倍。在該濃度範圍內,由肽HDIII3CL所顯示出的抑制是非常低的,相比於DIIIE1J而言。在實施例6中證明,本發明的β-髮夾肽以高親和力結合受體LRP1,其中肽PHB4顯示出最強有力的與受體的結合的那一個。該結果與PHB4是關於抗病毒活性而言最強有力的肽這一事實相一致。
在實施例8中證明,所述β-髮夾肽的抗病毒活性與其結合受體LRP1和蛋白質α2M*的能力相關,這是抗病毒作用機制涉及抑制病毒進入細胞的非常堅實的證據。這還支持了優化在本發明中所公開的β-髮夾肽的效力的策略。
本發明的β-髮夾肽結合蛋白質α2M和受體LRP1的能力可以用於設計用於控制由這些蛋白質介導的疾病的治療性試劑。在本發明中所顯示的對於DENV感染的強有力的抑制是該可能性的一個例子。
所述病毒與推定的胞吞受體α2M*/LRP1的結合的抑制(蛋白E的結合的抑制)是開發相對於在現有技術中所鑑定出的其他受體而言更優的針對DENV的抗病毒試劑的一個策略。由其他作者所描述的受體是粘附受體,其介導與質膜的結合,但其不介導胞吞作用過程。因此,本發明的肽通過阻斷進入過程的後面步驟而將會是有效的,而不依賴於由DENV所使用的粘附受體。
考慮到這些發現,本發明還包括在本發明中所公開的β-髮夾肽用於製備藥物的用途。在一個實施方案中,所述藥物用於抑制或減弱DENV感染。在另一個實施方案中,用本發明的β-髮夾肽製備的藥物用於治療由蛋白質α2M或蛋白質LRP1介導的疾病。
本發明的目標還在於提供用於在有此需要的受試者中抑制或減弱DENV感染的方法,其特徵在於,給所述個體施用一種或多種本發明的β-髮夾肽,或者包含至少一種這些肽的藥物組合物。
附圖簡述
圖1.抑制登革病毒的β-髮夾肽的設計。A)對於具有8個殘基和IP型中心β-轉角的β-髮夾的每一個位置所計算出的20種天然胺基酸的偏好參數的圖。更大的偏好參數值相應於更深的灰色色調。對於在用WHATIF選擇出的樣品中在β-髮夾的特定位置處未觀察到的胺基酸,給其分配0.5的觀察值並計算相應的偏好參數。B)對於具有8個殘基和IIP型中心β-轉角的β-髮夾的每一個位置所計算出的20種天然胺基酸的偏好參數的圖。著色方案和偏好參數的計算與在(A)中的相同。C-D)「標識(logo)」類型的圖,其顯示了來自具有IP型(C)和IIP型(D)中心β-轉角的β-髮夾的比對的共有序列,其中胺基酸的字母的大小與在樣品中所觀察到的胺基酸頻率(每個位置)和按照所使用的資料庫的胺基酸組成所預期的頻率之間的比率成正比。E)DENV的四種血清型的DIIIE的片段(相應於FGβ-髮夾)與肽PHB4的序列比對。MP:在本發明中所定義的可修飾位置(a-e),*為相應於在功能上重要的殘基Lys385的位置;SS:肽PHB4的「經設計的」二級結構;RN:PHB4的序列的殘基數目;SSDEN:DIIIE的二級結構;RNDEN:病毒DENV2的蛋白E的序列的殘基數目;鏈:相應於該病毒的DIIIE的F和G鏈的β-鏈。
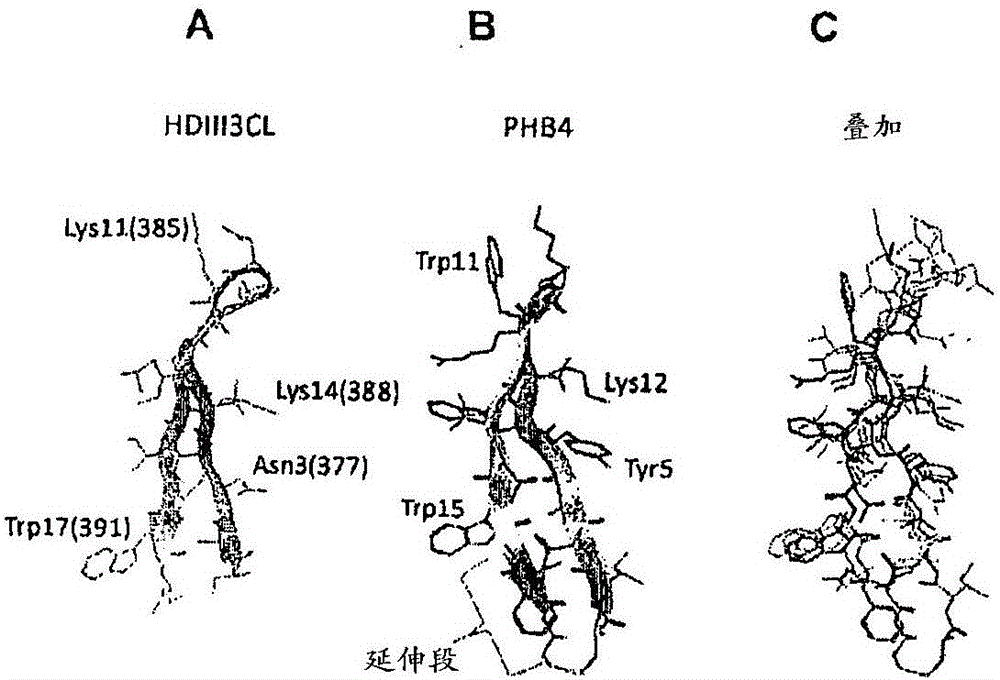
圖2:抑制DENV的β-髮夾肽的三維結構模型。A)β-髮夾肽HDIII3CL,顯示了相應於髮夾(沒有陽離子延伸段)的區段並且突顯了一些重要的殘基。在括號中出現了在DIIIE中等價的殘基的編號。B)肽PHB4。用大括號標示出了相對於HDIII3CL而言的β-鏈的延伸段的殘基。C)這兩個肽的結構疊加。
圖3.經生物素化的病毒DENV1的DIIIE(DIIIE1Jbiot)與蛋白質α2M*的結合的抑制。在縱坐標軸上顯示了在0.05-3μΜ的濃度範圍內的本發明的β-髮夾肽的抑制百分比。包括了肽HDIII3CL和重組DIIIE(DIIIE1J)的抑制活性。
圖4.劑量-應答曲線,其相應於經生物素化的DIIIE(DIIIE1Jbiot,病毒DENV1的序列)與α2M*的結合的抑制。顯示了相應於β-髮夾肽PHB5、肽HDIII3CL和重組DIIIE(DIIIE1J)的抑制百分比。
圖5.所示的β-髮夾肽對於經生物素化的病毒DENV1的DIIIE(DIIIE1Jbiot)與蛋白質α2M*的結合的抑制,以及與抗病毒活性的關係。在縱坐標軸上顯示了相對於對於DIIIE1J所測定的抑制百分比而言的結合抑制百分比。顯示了相應於亞μM(50-200nM)濃度範圍的數據。
圖6.質粒pET-DIII DENV1的示意圖。
圖7.在與蛋白質α2M的相互作用中必需的DIIIE的殘基的作圖。在縱軸上顯示了在每個丙氨酸突變體(相應於在橫軸上的每個特定殘基)的IC50值與重組DIIIE(DIIIE1PRS)的IC50值之間的比例。深色帶陰影的橢球體指明了限定初級相互作用位點的殘基。具有邊緣的淺色橢球體限定了次級相互作用位點。
圖8.參與與蛋白質α2M*的相互作用的位點在DIIIE的三維結構中的定位。顯示了病毒DENV1的DIIIE的結構的兩種視圖,包括二級結構的「棍」式詳細圖示和示意性圖示(分別用箭狀物和管狀物來強調β-片層和環)。鑑定了在相互作用中重要的殘基。重要的殘基集聚在由帶陰影的橢球體所呈現的兩個位點(第一個位點(A)和第二個位點(B))中。三維結構的圖示用PyMol(The PyMOL Molecular Graphics System,Version 1.2r3pre,LLC.)來製作。
圖9.在磷酸緩衝鹽水(PBS)存在下肽PHB4的聚集動力學。A-B)在PBS中,10μΜ的肽PHB4的聚集動力學。縱坐標軸相應於相對於在零時間處(在PBS中溶解的那一時刻處)該肽的散射而言的散射光的強度。A:0至300分鐘的聚集變化圖。B:聚集的最初30分鐘。C-D):在PBS中,5μΜ的肽PHB4的聚集動力學。C:早聚集,0-40分鐘。D:晚聚集,30-230分鐘。
圖10.通過透射電子顯微鏡術來進行的肽PHB4的聚集體的形態研究。研究了在水中和在PBS中以2mg/ml的濃度的該肽的聚集。所研究的條件為:剛剛在水中(A)和在PBS中(B)重懸浮的肽;在水中(C)和在PBS中(D)重懸浮並於50℃加熱一小時的肽;以及在水中(E)和在PBS中(F)溶解、於50℃加熱一小時並在環境溫度下溫育兩小時的肽。所述標尺條分別地在A、B、E和F中等於100nm,和在C-D中等於200nm。
圖11.在用於測定DENV的DIIIE與受體LRP1的直接相互作用的測定試驗中所使用的蛋白質。A)LRP1的結構域的構造的示意性圖示。MP:質膜。指明了相應於與配體結合的結構域簇的區域。B)嵌合蛋白sLRP1-CIV的示意性圖示,Fc:免疫球蛋白恆定區片段。C)重組蛋白質DIIIE1-4的示意性圖示。D)通過在變性條件下的聚丙烯醯胺電泳(SDS-PAGE)對蛋白質DIIIE的最終製備物進行的分析:1.DIIIE1(尤其是DIIIE1J);2.DIIIE2;3.DIIIE3;和4.DIIIE4。指明了相應於所使用的分子量標準參照物的14kDa那部分的條帶的位置。
圖12.在ELISA型測定試驗中DENV的DIIIE與LRP1的配體結合結構域的相互作用。在每張圖的上面部分中,指明了在平板孔的包被中所使用的蛋白質。通過使用綴合至過氧化物酶的抗人免疫球蛋白Fc的多克隆抗體製備物來進行蛋白質sLPR1-CII-IV的結合。
圖13.sLRP1-CIV的表面的表徵。A)通過施加α2M*和受體相關蛋白(RAP,Receptor-Associated Protein)(兩者都在100nM)而獲得的傳感圖(sensorgram)。顯示了在兩個溝道上獲得的信號:Fc1,具有經固定化的sLRP1-CIV;和Fc2,具有經固定化的HSArec。B)從針對濃度的最大共振單位(RU)的數據開始來測定RAP與sLRP1的相互作用的親和力。實線表示與具有兩個相互作用位點的模型的擬合。所述擬合通過使用程序GraphPad Prism v5.03來進行。在Biacore X上進行測量。
圖14.β-髮夾肽與sLRP1-CIV的相互作用。A和B)通過施加濃度為20μΜ的肽而獲得的傳感圖;C)在160s的相互作用下獲得的RU;和(D)在270s的相互作用下獲得的RU。
圖15.在β-髮夾肽與蛋白質LRP1(片段sLRP1-CIV)的結合和β-髮夾肽的體外抗病毒活性之間所觀察到的關係。顯示了在於Vero細胞中針對DENV2所測定的抗病毒活性的效力值[log(IC50,uM)]與在時間經過400s時所觀察到的Biacore信號的量值(RUrem)之間的線性回歸。該分析用與肽HDIII3CL共有相同的拓撲學結構(天然拓撲學結構)的PHB系列的肽來進行。95%的置信帶用虛線來顯示。在插入圖中顯示了不包括肽PHB4的相似的分析。
圖16.在β-髮夾肽與蛋白質α2M*的結合和β-髮夾肽的體外抗病毒活性之間所觀察到的關係。顯示了DIIIE與蛋白質α2M*的結合的抑制值針對相應於在Vero細胞中病毒DENV2感染的抑制的IC50值的線性回歸。相對於在關於所述肽的等摩爾濃度下對於重組DIIIE(DIIIE1J)所測定的抑制百分比而言來表示與α2M*的結合的抑制百分比。顯示了平均值和標準偏差的值,其在亞μM和nM的所述肽的濃度下測定:50、100、200和400nM。
圖17.肽PHB4的溫育溫度對於其抗病毒活性的影響。抗病毒活性的評價通過用DENV2(16803毒株)進行感染的Vero細胞的感染後(p.i.)24小時的上清液的滴度測定來進行。對於上清液的滴度測定,使用在Vero細胞上的裂解斑形成測定試驗。IC50的估計用統計學程序GraphPad Prism v5.3來進行。實線表示用「log10(濃度)vs應答」曲線模型來進行的非線性回歸擬合。
圖18.實驗設計流程,其用於評價聚集體的生長時間對於肽PHB4的抗病毒活性效力的影響。
圖19.肽PHB4的溫育時間和溫度對於抗病毒活性的影響。抗病毒活性的評價通過用DENV2(16803毒株)進行感染的Vero細胞的感染後24小時的上清液的滴度測定來進行。對於上清液的滴度測定,使用在Vero細胞上的裂解斑形成測定試驗。在沒有肽存在的情況下被感染的細胞的上清液的病毒滴度為4log10。A.在10℃下進行溫育;B.在37℃下進行溫育。
圖20.實驗設計流程,其用於評價在開始聚集體的生長過程時肽PHB4的初始濃度對於抗病毒活性效力的影響。
圖21.肽在水中的初始溶液的濃度對於抗病毒活性的影響。抗病毒活性的評價通過用DENV2(16803毒株)進行感染的Vero細胞的感染後24小時的上清液的滴度測定來進行。對於上清液的滴度測定,使用在Vero細胞上的裂解斑形成測定試驗。
圖22.肽PHB與組氨酸尾巴的融合的設計。在上圖中,將尾巴添加在該肽的C-末端處。在下圖中,尾巴位於N-末端處。
圖23.具有組氨酸尾巴的融合肽的聚集體/納米顆粒的示意性圖示,所述聚集體/納米顆粒通過用金屬離子的間隔物和絡合物EGTA(Me2)的間隔物進行交聯來穩定化。
圖24.單獨的以及與Zn和與EGTA(Zn2)形成絡合物的肽H5PHB4和PHB4H5的抗病毒活性。
實施方式的詳細描述/實施例
實施例1.抑制登革病毒感染的β-髮夾肽的設計和合成
在本發明中所使用的β-髮夾肽的序列的描述
設計了在表1中命名為PHB1-9的新型β-髮夾肽(其相應於SEQ ID No.1-9),這按照旨在相對於HDIII3CL(SEQ ID No.10)而言提高這些分子的抗病毒活性效力(和與細胞受體的結合)的結構/功能標準來進行。這些肽的序列的基本結構由四個區段組成:兩個β-鏈區段(其與該病毒的DIIIE的FGβ-髮夾在結構上類似),它們被一個β-轉角分隔開並且跟隨有一個包含三個賴氨酸的C-末端陽離子延伸段。定義了兩種不同的拓撲學結構:肽PHB1-4和PHB7-9具有與DIIIE的FGβ-髮夾相同的拓撲學結構(多肽鏈的方向是相同的或天然的),和肽PHB5和PHB6具有相反的或反向的拓撲學結構。具有天然拓撲學結構的肽的第一個β-鏈區段(在表1中的β1)在結構上相應於Fβ-鏈,和β2區段相應於Gβ-鏈(圖1E)。肽PHB1、PHB2和PHB7的鏈長與肽HDIII3CL的相應鏈(有著六個殘基的鏈)相一致,而肽PHB3-4和PHB8-9具有有著八個殘基的鏈,和PHB5-6具有有著七個殘基的鏈。鏈的較大的大小對於其結構穩定性作出有利貢獻(Stanger,H.E.等人,(2001).Proc.Natl.Acad.Sci.USA 98,12015–12020)。
肽PHB1、PHB2和PHB7的殘基Cys1、Asn/Tyr3和Thr5相應於DIIIE的FGβ-髮夾的NHB暴露位置。對於位置3,在PHB1和PHB7中選擇殘基Asn3,其等價於病毒DENV3的DIIIE的殘基Asn377;和對於肽PHB2,選擇殘基Tyr3,其等價於DENV1、DENV2和DENV4的Tyr377。Tyr3是比Asn3更優選的,因為它在血清型之間更保守,更好地形成β-鏈結構,並且佔據Lys10的對角線位置,這促進Tyr3和Lys10可以在其側鏈之間建立π-陽離子類型的有利的相互作用(圖2B)。在位置5處,選擇殘基Thr5,以代替DENV的DIIIE的序列的Val/Ile379(圖1E)。這是由於殘基Thr是相對於Val/Ile而言保守的胺基酸,是β-鏈結構的良好形成者,但是它是更親水的(這對於肽的更大的可溶性作出貢獻)並且顯示出更高的結構偏好參數值(圖1E的具有八個殘基的β-髮夾的位置2)。這些肽的殘基Cys14、Asn12和Lys10在β-髮夾的相同面上分別佔據與Cys1、Tyr/Asn3和Thr5相鄰的位置,但是主鏈不在所述殘基之間形成氫橋。殘基Lys10和Asn12在結構/功能上相應於殘基Lys388(其是在DENV1-3中保守的)和Asn390(其是在DENV2-3中保守的)。在位置13處選擇殘基Trp,因為DIIIE的相應殘基Trp391在所述四種血清型中是嚴格保守的。Cys1和Cys14這兩個半胱氨酸形成執行必需結構作用的二硫橋。這些殘基佔據NHB位置,並且在該位置處的二硫橋對於β-髮夾的穩定性是有利的(Santiveri C.M.等人,(2008).Chem.Eur.J.,14,488-499)。在本發明的後面,通過實驗證明了殘基Lys10、Trp13以及半胱氨酸Cys1和Cys14對於所述肽的抗病毒活性來說是必需的。與HDIII3CL類似的肽(其中一個位置(Lys10→Ala或Trp17→Ala,HDIII3CL的Trp17在結構上相應於PHB1、PHB2和PHB7的殘基Trp10)或兩個位置(Cys1→Ser和Cys18→Ser,在HDIII3CL中Trp18在結構上相應於PHB1、PHB2和PHB7的殘基Trp13)被置換)在所檢驗的濃度範圍內不具有抗病毒效應。另外,在後面還證明了Tyr3優於Asn3,其中考慮到肽PHB9比肽PHB8更有強有力,並且這些肽僅在相應於DENV1-2和DENV4的DIIIE的Tyr375的位置處不同。
表1.β-髮夾肽的設計
p,脯氨酸的D-立體異構體;k,賴氨酸的D-立體異構體;天然拓撲學結構,與DIIIE的FGβ-髮夾的拓撲學結構相同;反向拓撲學結構,與DIIIE的FGβ-髮夾的拓撲學結構相反。
殘基Val2、Trp/Val4、Glu/Arg/Ile6、Lys/Trp9、Val/Tyr11和Trp13形成該髮夾的對面,其中佔據HB位置。位置2、4和6分別與位置13、11和9相鄰,並且在主鏈的原子之間通過氫橋形成連接。由於在上面的段落中所闡明的原因,位置13僅被Trp佔據。通過考慮每個殘基的偏好參數值來選擇其餘的位置(圖1A和B)。在位置6和9的情況下,選擇偶對Glu6-Lys9(PHB1)和Arg6-Trp9(PHB2),它們是有利的,因為其分別可以建立鹽橋和π-陽離子相互作用。Lys9(PHB1和PHB7)可以作為DIIIE的Lys385的模擬物而發揮功能性作用。該殘基在DIIIE與蛋白質α2M*的相互作用中是必需的,如在本發明的後面所證明的那樣。
肽PHB1和PHB2被設計成在殘基6和9之間形成IIP型β-轉角。這些肽的位置7被殘基d-Pro(其是胺基酸脯氨酸的D-立體異構體)佔據。該胺基酸對於佔據IIP型β-轉角的第二個位置來說是有利的(Pantoja-Uceda D.等人,(2006)Methods Mol Biol.,340:27-51)。肽PHB1的殘基Asp8因高的偏好參數值而被選擇。PHB2的Lys8被選擇用於模擬DIIIE的殘基Lys385。在肽PHB7的情況下,在殘基6和9之間設計了一個IP型β-轉角。通過考慮偏好參數值而選擇了殘基Asn7和Gly8(圖1A和B)。該二肽是IP型β-轉角中非常常見的序列。
另外,肽PHB3和PHB4的β-髮夾的序列分別包含肽PHB1和PHB2的相應髮夾的序列(表1)。在該情況下,前者的位置4-15等價於後者的位置2-13,因此PHB3和PHB4的殘基4-15的選擇用在上面對於肽PHB1和PHB2所描述的標準來進行。
類似地,PHB8和PHB9包含PHB7的序列,並且殘基4-15以與PHB7的殘基2-13相同的方式來進行選擇。PHB3、PHB4、PHB8和PHB9的殘基Glu3和Phe16被選擇用於模擬DIIIE的殘基Glu375(其在DENV1和DENV3中是保守的,在DENV2和DENV4中為Asp)和Phe392(其在DENV1、DENV2和DENV4中是保守的,在DENV3中為Tyr)(圖1E)。選擇PHB3-4和PHB8-9的殘基Ile2和Ile17,因為這些殘基具有高的形成β-鏈結構的傾向。殘基Cys1和Cys18佔據NHB位置,並且被引入用於形成使β-髮夾結構穩定的二硫橋(圖1E和圖2)。
肽PHB5和PHB6具有反向拓撲學結構。殘基Phe1、Asn3、Lys5、Thr12、Asn14和Glu16在結構上等價於肽PHB3的殘基Phe16、Asn14、Lys12、Thr7、Asn5和Glu3,但是佔據通過氫橋連接的HB位置。殘基Trp4和Trp6與殘基Trp11和Trp13相鄰,佔據NHB位置,並且被設計用於形成對於β-髮夾的穩定性來說非常有利的Trp拉鏈。殘基Trp2在結構上相應於DIIIE的殘基Trp391,並且由於上面所闡明的原因而被選擇。殘基Glu7和Lys10具有高的偏好參數值,並且可以形成對於髮夾的穩定性來說有利的鹽橋。胺基酸Asn9也通過偏好參數而被選擇。選擇PHB6的殘基d-Pro8,因為它在IIPβ-轉角的位置2中是有利的。引入PHB5的d-Lys以用於模擬DIIIE的殘基Lys385,因為殘基d-Lys對於佔據IIP型β-轉角的位置2來說是非常有利的,相比於與立體異構體L-Lys而言。備選地,PHB5和PHB6的殘基Lys10也可以模擬DIIIE的殘基Lys385。
所有的肽PHB1-9的C-末端延伸段都包含三肽LysLysLys,其被引入用於提高肽的可溶性,因為受體LRP1是陰離子分子,其可以與本發明的β-髮夾肽的陽離子三肽建立有利的靜電相互作用。在肽PHB5和PHB6的情況下,所述陽離子三肽通過二肽GlyGly而與β-髮夾分隔開,以在這兩個區段之間引入柔韌性並且阻斷β2鏈的延伸的β結構的延長。
圖1C和1D是「標識」類型的圖(J.Gorodkin等人,(1997).Comput.Appl.Biosci.,Vol.13,no.6:583-586;T.D.Schneider&R.M.Stephens.(1990).Nucleic Acids Research,Vol.18,No.20,第6097-6100頁),其分別顯示了來自具有IP和IIP型中心β-轉角的有著八個殘基的β-髮夾的比對的共有序列。這些圖通過使用web伺服器「Protein Sequence Logos using Relative Entropy」(http://www.cbs.dtu.dk/~gorodkin/appl/plogo.html)來獲得。該呈現形式是在圖1A和1B中所顯示的偏好參數矩陣的備選方式,在此相應於每個胺基酸的字母的噴泉大小與該殘基類型在每個位置處的「重要性」成正比,即更大的字母意味著該殘基在結構上是更有利的。
除了肽PHB1-9外,表1還顯示了肽HDIII3CL(SEQ ID No.10)和其數種類似物(在其中殘基被變成丙氨酸)的序列,所述類似物被引入是為了調查所述肽的數種位置在抗病毒活性中的作用。以該目的而設計的肽為HDIII3CL2,其是與肽HDIII3CL類似的具有有著三個賴氨酸的延伸區段的肽(SEQ ID No.11);HDIII3CLW-,其是肽HDIII3CL2的Trp17→Ala突變體(SEQ ID No.12);HDIII3CLK-,其是肽HDIII3CL2的Lys14→Ala突變體(SEQ ID No.13);和HDIII3CLC-,其是肽HDIII3CL2的Cys1→Ala和Cys18→Ala雙突變體(SEQ ID No.14)。
圖2集合了β-髮夾肽HDIII3CL(A)和PHB4(B)的三維結構模型。在肽HDIII3CL的情況下(圖2A),顯示了相應於髮夾(沒有陽離子延伸段)的區段並且突顯了一些重要的殘基。在括號中出現了在DIIIE中等價的殘基的編號。在肽PHB4的情況下(圖2B),用大括號標示出了相對於HDIII3CL而言的β-鏈的延伸段的殘基。強調了在本發明中所描述的肽的生物學活性中重要的側鏈:1)位於相應於DIIIE的殘基Lys385的轉角/環中的Lys,2)位於第二條β-鏈中且相應於DIIIE的殘基Lys388的Lys,3)位於第二條β-鏈中且相應於DIIIE的殘基Trp391的Trp,4)位於第一條β-鏈中且相應於DIIIE的殘基Tyr377的Tyr。圖2C顯示了這兩個肽的結構疊加。
本發明的肽PHB1-9代表了可以從在發明詳述部分中和在該實施例中所闡明的一般原理出發而設計出的β-髮夾肽的具體示例,而所述設計旨在獲得針對DENV的高度強有力的抗病毒肽。因此,本發明保護與至少一種選自PHB1-9的肽的序列相似的β-髮夾肽的序列,從而相應的序列同一性百分比等於或大於70%,優選地等於或大於80%。所述類似肽的序列在一個或數個選自下列的位置處不同:1)在發明詳述部分中所描述的可修飾位置a-e),在該情況下,PHB1-9的殘基被置換為也具有高的在β-髮夾中佔據所述位置的結構傾向的殘基;2)在發明詳述部分中所描述的可能功能性的位置,在該情況下,PHB1-9的所述殘基被置換為DENV的一種血清型的DIIIE的FG髮夾的殘基,以便所述殘基在肽PHB1-9的β-髮夾中佔據類似的位置;3)相應於C-末端賴氨酸尾巴的殘基的位置,在該情況下,所述尾巴包含兩個或三個賴氨酸,優選地三個賴氨酸;和4)相應於形成肽PHB1-4和PHB7-9的二硫橋的半胱氨酸的位置,在該情況下,所述半胱氨酸可以被置換成殘基Asp/Glu或Lys,以便該橋的配對半胱氨酸分別被置換為Lys或Asp/Glu,並且所述肽通過在所述殘基(一邊為Asp/Glu,和另一邊為Lys)的側鏈之間形成醯胺鍵而環化。
一般地,與PHB1-9類似的β-髮夾肽的序列可以以下述方式來進行描述:
i.與PHB1和PHB2類似的肽為其序列具有相對於PHB1和PHB2的序列而言的70%或更高(優選地,80%或更高)同一性的相似性的肽,並且所述序列由下列組成,
位置1(結構的,環化):Cys或Lys或Asp或Glu,如果是Cys,那麼其與位置14的殘基Cys形成二硫橋,如果是Glu/Asp(Lys),那麼其側鏈與位置14的Lys(Glu/Asp)的側鏈形成醯胺鍵
位置2(「a」類可修飾的):Val或Ile或Trp或Phe或Tyr或Met
位置3(可能功能性的):Tyr或Asn
位置4(「a」類可修飾的):Trp或Val或Phe或Glu
位置5(「d」類可修飾的):Thr或Val或Ile(後兩者為在DENV的序列中出現的殘基)
位置6(「a」類可修飾的):Arg或Ile或Val或Glu或Leu
位置7(「b」類可修飾的):d-Pro
位置8(「b」類可修飾的):Asp或Lys或Asn
位置9(「a」和「e」類可修飾的):Trp或Lys或Met或Thr或Gln
位置10(可能功能性的):Lys
位置11(「a」類可修飾的):Val或Met或His或Leu
位置12(可能功能性的):Asn或Asp或Ser或His
位置13(必需位置):Trp
位置14(結構的,環化):Cys或Lys或Asp或Glu,如果是Cys,那麼其與位置1的殘基Cys形成二硫橋,如果是Glu/Asp(Lys),那麼其側鏈與位置1的Lys(Glu/Asp)的側鏈形成醯胺鍵
位置15-17或15-16(C-末端延伸段):三肽Lys-Lys-Lys或二肽Lys-Lys;
ii.與PHB3和PHB4類似的肽為其序列具有相對於PHB3和PHB4的序列而言的70%或更高(優選地,80%或更高)同一性的相似性的肽,並且所述序列由下列組成,
位置1(結構的,環化):Cys或Lys或Asp或Glu,如果是Cys,那麼其與位置18的殘基Cys形成二硫橋,如果是Glu/Asp(Lys),那麼其側鏈與位置18的Lys(Glu/Asp)的側鏈形成醯胺鍵
位置2(「a」類可修飾的):Ile或Val或Trp或Phe或Tyr或Met
位置3(可能功能性的):Glu或Asp
位置4(「a」類可修飾的):Val或Ile或Trp或Phe或Tyr或Met
位置5(可能功能性的):Tyr或Asn
位置6(「a」類可修飾的):Trp或Val或Phe或Glu
位置7(「d」類可修飾的):Thr或Val或Ile(後兩者為在DENV的序列中出現的殘基)
位置8(「a」類可修飾的):Arg或Ile或Val或Glu或Leu
位置9(「b」類可修飾的):d-Pro
位置10(「b」類可修飾的):Asp或Lys或Asn
位置11(「a」和「e」類可修飾的):Trp或Lys或Met或Thr或Gln
位置12(可能功能性的):Lys
位置13(「a」類可修飾的):Val或Met或His或Leu
位置14(可能功能性的):Asn或Asp或Ser或His
位置15(必需位置):Trp
位置16(可能功能性的):Phe或Tyr
位置17(「a」類可修飾的):Ile或Val或Trp或Phe或Tyr或Met
位置18(結構的,環化):Cys或Lys或Asp或Glu,如果是Cys,那麼其與位置1的殘基Cys形成二硫橋,如果是Glu/Asp(Lys),那麼其側鏈與位置1的Lys(Glu/Asp)的側鏈形成醯胺鍵
位置19-21或19-20(C-末端延伸段):三肽Lys-Lys-Lys或二肽Lys-Lys;
iii.與PHB7類似的肽為其序列具有相對於PHB7的序列而言的70%或更高(優選地,80%或更高)同一性的相似性的肽,並且所述序列由下列組成,
位置1(結構的,環化):Cys或Lys或Asp或Glu,如果是Cys,那麼其與位置14的殘基Cys形成二硫橋,如果是Glu/Asp(Lys),那麼其側鏈與位置14的Lys(Glu/Asp)的側鏈形成醯胺鍵
位置2(「a」類可修飾的):Val或Ile或Trp或Phe或Tyr或Met
位置3(可能功能性的):Tyr或Asn
位置4(「a」類可修飾的):Val或Ile或Phe或Tyr或Leu
位置5(「d」類可修飾的):Thr或Val或Ile(後兩者為在DENV的序列中出現的殘基
位置6(「a」類可修飾的):Ile或Val或Tyr,His或Lys
位置7(「b」類可修飾的):Asn或Asp
位置8(「b」類可修飾的):Gly
位置9(「a」和「e」類可修飾的):Lys或His或Arg或Val或Tyr或Glu或Met
位置10(可能功能性的):Lys
位置11(「a」類可修飾的):Tyr或Val或Gln或Trp,Phe
位置12(可能功能性的):Asn或Asp或Ser或His
位置13(必需位置):Trp
位置14(結構的,環化):Cys或Lys或Asp或Glu,如果是Cys,那麼其與位置1的殘基Cys形成二硫橋,如果是Glu/Asp(Lys),那麼其側鏈與位置1的Lys(Glu/Asp)的側鏈形成醯胺鍵
位置15-17或15-16(C-末端延伸段):三肽Lys-Lys-Lys或二肽Lys-Lys;
iv.與PHB8和PHB9類似的肽為其序列具有相對於PHB8和PHB9的序列而言的70%或更高(優選地,80%或更高)同一性的相似性的肽,並且所述序列由下列組成,
位置1(結構的,環化):Cys或Lys或Asp或Glu,如果是Cys,那麼其與位置18的殘基Cys形成二硫橋,如果是Glu/Asp(Lys),那麼其側鏈與位置18的Lys(Glu/Asp)的側鏈形成醯胺鍵
位置2(「a」類可修飾的):Ile或Val或Trp或Phe或Tyr或Met
位置3(可能功能性的):Glu或Asp
位置4(「a」類可修飾的):Val或Ile或Trp或Phe或Tyr或Met
位置5(可能功能性的):Tyr或Asn
位置6(「a」類可修飾的):Val或Ile或Phe或Tyr或Leu
位置7(「d」類可修飾的):Thr或Val或Ile(後兩者為在DENV的序列中出現的殘基)
位置8(「a」類可修飾的):Ile或Val或Tyr或His或Lys
位置9(「b」類可修飾的):Asn或Asp
位置10(「b」類可修飾的):Gly
位置11(「a」和「e」類可修飾的):Lys或His或Arg或Val或Tyr或Glu或Met
位置12(可能功能性的):Lys
位置13(「a」類可修飾的):Tyr或Val或Gln或Trp,Phe
位置14(可能功能性的):Asn或Asp或Ser或His
位置15(必需位置):Trp
位置16(可能功能性的):Phe或Tyr
位置17(「a」類可修飾的):Ile或Val或Trp或Phe或Tyr或Met
位置18(結構的,環化):Cys或Lys或Asp或Glu,如果是Cys,那麼其與位置1的殘基Cys形成二硫橋,如果是Glu/Asp(Lys),那麼其側鏈與位置1的Lys(Glu/Asp)的側鏈形成醯胺鍵
位置19-21或19-20(C-末端延伸段):三肽Lys-Lys-Lys或二肽Lys-Lys;
v.與PHB5和PHB6類似的肽為其序列具有相對於PHB5和PHB6的序列而言的70%或更高(優選地,80%或更高)同一性的相似性的肽,並且所述序列由下列組成,
位置1(可能功能性的):Phe或Tyr
位置12(必需位置):Trp
位置3(可能功能性的):Asn或Asp或Ser或His
位置4(「a」類可修飾的):Trp
位置5(可能功能性的):Lys
位置6(「a」類可修飾的):Trp
位置7(可能功能性的,「b」類可修飾的):Glu或Val或Arg或Ile或Asp
位置8(「b」類可修飾的):d-Pro或d-Lys
位置9(「b」類可修飾的):Asn或Asp或Lys
位置10(可能功能性的,「b」類可修飾的):Lys或Met或Trp或Gln或Thr
位置11(「a」類可修飾的):Trp
位置12(「d」類可修飾的):Thr或Val或Ile(後兩者為在DENV的序列中出現的殘基
位置13(「a」類可修飾的):Trp
位置5(可能功能性的):Tyr或Asn
位置13(「a」類可修飾的):Ile或Val或Trp或Phe或Tyr或Met
位置14(可能功能性的):Glu或Asp
位置15-19或15-18(C-末端延伸段):五肽Gly-Gly-Lys-Lys-Lys或四肽Gly-Gly-Lys-Lys。
肽的合成
在表1中所列出的肽的合成通過使用Fmoc/tBu策略在Fmoc-AM-MBHA樹脂上以固相方式來進行(Barany,G.&Merrifield,R.B.(1977)J Am Chem Soc.99 7363-7365)。所述合成在具有多孔玻璃料的10mL注射器中手工地進行,並且所有試劑和溶劑通過在真空中過濾來去除。胺基酸通過使用用DIC/HOBt進行活化的方法來進行偶聯,並且通過使用茚三酮測定試驗來驗證偶聯反應的完成(Kaiser,E.等人,(1970)Anal Biochem.34:595-598)。通過用三氟乙酸/EDT/H2O/TIS(94%/2.5%/2.5%/1%)的溶液進行處理來將肽與樹脂分開,用醚進行沉澱,並凍幹72小時。將肽通過經由用二甲亞碸(DMSO)進行氧化而形成二硫橋來進行環化(Andreu,D.等人,(編者),Peptide Synthesis Protocols,Methods in Molecular Biology,Totowa,NJ,1994,第91-169頁),並且在RP-C18柱上通過製備型RP-HPLC來進行純化。將收集的級分獨立地在分析型RP-HPLC中進行分析,並且通過合併具有大於99%純度的級分來製得每種肽的最終製備物。肽的最終製備物的分子量通過質譜法ESI-MS來進行驗證。
在配備有Z-噴射電霧化電離源的、具有八角形幾何形狀的混合型質譜儀QTOF-2TM(Micromass,UK)中獲取質譜。所使用的質譜加工和獲取程序為MassLinx,3.5版(Waters,USA)。
實施例2.在Vero細胞中病毒感染的抑制
為了證明本發明的β-髮夾合成肽在體外抑制DENV感染的能力,將所述肽在Vero細胞中在蝕斑形成抑制測定試驗中進行評價。
使Vero細胞在24-孔平板中生長,直至單層達到大約90%匯合。用沒有胎牛血清(FBS)的MEM培養基(極限必需培養基)洗滌單層兩次,添加肽的稀釋物,並且典型地在37℃下溫育1小時。接著,以0.001的感染複數(m.o.i.)添加病毒(DENV血清型2,NIBSC編碼S16803),並且在37℃下重新將細胞溫育1小時。在用病毒進行的溫育結束時,重新洗滌細胞以去除未結合的病毒,並且在37℃下在高密度培養基(補充有非必需胺基酸、1%FBS、1%羧甲基纖維素的MEM)中溫育5天,以有助於裂解斑的形成。對於染色,使用在0.15M乙酸鈉中的0.1%萘酚藍黑。在每個實驗中,以每個點兩次重複來進行檢定,並且進行三次獨立的測定。
β-髮夾肽的毒性效應藉助於MTT(溴化3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑Invitrogen,USA)方法(Mosmann,T.(1983).J.Immunol.Methods 65,55-63)並經由通過使用Newbauer計數室的細胞計數來進行測定。用200μL/孔的處於1×105個細胞/mL的Vero細胞的細胞懸浮液接種96-孔平板(Costar,USA)。溫育平板直至達到大約90%匯合,典型地18-24小時。將細胞用DMEM培養基(Dulbecco改良的Eagle培養基)洗滌2次,然後添加50μL/孔的待評價的肽和/或添加物的稀釋物。作為毒性的陽性對照,使用溶解在PBS中的Triton X-100TM。將平板在37℃和5%CO2下溫育2或24小時。對於細胞單層,採用兩種不同的毒性測定:
a)添加50μL/孔的在PBS中的2mg/ml的MTT溶液。將平板在37℃和5%CO2下溫育四小時。在平板中,撤去培養基,並添加100μL/孔的DMSO以溶解甲月朁沉澱物。最後,在平板閱讀器(Sensident ScanTM,Merck,Alemania)中於540nm處測量光密度(OD)。
b)用200μL/孔的DMEM培養基進行洗滌,然後添加50μL/孔的胰蛋白酶(Sigma,USA)。通過添加150μL/孔的補充有10%FBS的DMEM培養基來使胰蛋白酶失活。然後,通過使用活體染料錐蟲藍(Gibco,USA)來對細胞進行計數。通過使用統計學程序GraphPad Prism v5.3來分析數據。用「log10(濃度)vs應答」曲線模型來進行非線性回歸擬合。
表2顯示了相應於在Vero細胞中β-髮夾肽針對DENV2的抗病毒活性的IC50值,以及其毒性和選擇性指數。在該系統中所有肽都具有抗病毒活性,其中肽PHB2、PHB3、PHB4、PHB5、PHB8和PHB9比肽HDIII3CL更強有力。在該體外系統中,肽PHB3、PHB5和PHB8的活性僅稍微更優,而肽PHB1、PHB6和PHB7較不強有力。肽PHB4具有在nM範圍內的抗病毒活性,並且顯示出4333的選擇性指數,這是非常有利的。該肽是作為針對DENV的抗病毒藥物候選物的具有優異特性的先導分子。
結果證明,肽HDIII3CL的鏈間環是可有可無的,因為在本發明的β-髮夾肽的序列中,已去除了具有六個殘基的環。取而代之,引入了具有兩個中心殘基的β-轉角,其沒有保持與DIIIE的環的原始序列的(部分的序列)相似性。所述肽的該特徵在其用於繼發感染的情況下是有利的,因為所述環是抗病毒抗體應答的免疫顯性區域(Sukupolvi-Petty S.等人,(2007).J Virol.,81(23):12816-26)。這些預先存在的抗體可以中和基於FGβ-髮夾的肽的抗病毒活性,並且在本發明的肽中環的去除消除了可能的被這些抗體的識別。
所獲得的結果還暗示了所述β-髮夾肽的數個殘基在抗病毒活性中的有利作用。在鏈間β-轉角的中心位置處賴氨酸(d-賴氨酸)的存在的情況就是如此。肽PHB5比PHB6更強有力,並且它們之間的差異僅在於轉角的序列,即在PHB6中不包含賴氨酸(表1)。該觀察結果還支持這樣的事實,即PHB2和PHB4比其對應物PHB1和PHB3(其在環的中心位置處也不具有賴氨酸)更強有力。該賴氨酸在功能上/在結構上模擬該病毒的DIIIE的殘基Lys385。另一個有利的特徵是在等價於DIIIE的殘基377(病毒DENV3的包膜蛋白的編號)的位置處酪氨酸殘基的存在。包含殘基Tyr5的肽PHB9的效力比PHB8(其差異僅在於殘基Asn5的存在)更高。該結論也與下述事實相一致:PHB2(包含Tyr3)和PHB4(包含Tyr5)比其對應物肽PHB1和PHB3(其在等價的位置處也包含天冬醯胺)更強有力。
結果顯示,導致引入四個額外的胺基酸(兩個/鏈)的β-髮夾的延伸對於所述肽的抗病毒活性來說是有利的。肽PHB4(與PHB2相比)、PHB8和PHB9(與PHB7相比)的效力是更高的。肽PHB4是該系列中最強有力的,並且是唯一的在其序列中包含所鑑定的三種有利特徵的肽。因此,在該實施例中獲得的實驗數據以其整體方式支持了本發明的β-髮夾肽的設計的本質基礎。
表2.β-髮夾肽的效力、體外毒性和選擇性指數
*,抗病毒活性(50%抑制活性);NA,在小於或等於100μM的濃度下不具有抗病毒活性;在1000μM下沒有毒性;ND,未測定。
接著,測定了肽PHB4和HDIII3CL針對DENV的四種血清型的抗病毒活性,以為了比較各自的IC50值。在Vero細胞中在蝕斑形成抑制測定試驗中對所述肽進行評價,對於所述四種血清型(DENV1,NIBSC編號West Pac 74;DENV2,NIBSC編號S16803;DENV3,NIBSC編號CH53489;DENV4,NIBSC編號TVP360)使用0.001的感染複數。如在表3中所觀察到的,肽PHB4針對所述四種血清型是高度強有力的,其效力是肽HDIII3CL的4000至7500倍,取決於血清型。PHB4抑制所述四種血清型這一觀察結果與提議受體α2M*/LRP1作為DENV的四種血清型的內吞受體相一致,並且與後面給出的PHB4與這些蛋白質相結合的證據相一致。
表3.肽PHB4和HDIII3CL針對登革病毒的四種血清型的抗病毒活性
實施例3.β-髮夾肽抑制結構域III與α2M*的結合
人α2M的純化和激活
從由合併30-40歲的健康人的血漿樣品而得到的380mL人血漿開始來純化人α2M。將血漿在4℃下逆去離子水透析72小時,其中經常更換。通過以10000x g離心30分鐘來分離出不溶性物質。將上清液逆PBS(pH 6.0)進行透析;並施加到XK 50/30柱(Amersham,UK)上,所述柱裝有事先加載了Zn2+並用PBS(pH 6.0)進行平衡的65mL的Chelating Sepharose Fast Flow(Amersham,UK)。緊接著,將柱用PBS(pH 6.0)進行洗滌,直至在280nm下洗出液的吸光度達到基線。通過施加10mM乙酸鈉、150mM氯化鈉的緩衝液(pH 5.0)來洗脫經結合的蛋白質。將所收集的蛋白質通過超濾進行濃縮。然後,將樣品施加到裝有用PBS(pH 7.8)進行平衡的Superdex 200基質(Amersham,UK)的凝膠過濾柱上。在具有最高分子量的級分中蛋白質的存在通過Western印跡測定試驗來進行確證,其中使用抗人α2M的多克隆抗體製備物(Sigma,USA)。對於經純化的α2M的激活,將其與200mM甲胺一起在50mM磷酸鈉、150mM氯化鈉(pH 7.4)中進行溫育。將α2M_MeNH2(α2M*)逆50mM磷酸鈉、0.5M氯化鈉(pH 7.8)進行徹底透析。
競爭性測定試驗
肽PHB1-9和HDIII3CL抑制重組DIIIE(DIIIE1J)與蛋白質α2M*的相互作用的能力通過競爭性ELISA測定試驗來進行分析。將平板用經純化的α2M*級分進行包被,並且在數種濃度的肽和/或重組DIIIE(DIIIE1J)存在下與「DIIIE1J-生物素化的」(經純化的並事先經生物素化的DIIIE1J)一起進行溫育。與α2M*結合的「DIIIE1J-生物素化的」的檢測通過使用鏈黴抗生物素蛋白-過氧化物酶綴合物來進行。重組DIIIE(DIIIE1J)(SEQ ID No.19)的獲得在後面給出,並且其組成為DENV1 1636毒株的病毒多蛋白的殘基289-400(按照序列PIR:A32401的編號)(Chu,M.C.等人,(1989).Journal of General Virology 70(Pt 7),1701-1712),隨後為具有六個組氨酸的序列。
在低μM至亞μM/nM範圍內的肽濃度下,β-髮夾肽PHB5、PHB7、PHB8和PHB9顯示出對於「DIIIE1J-生物素化的」與蛋白質α2M*的結合的部分抑制(圖3),並且觀察到抑制百分比隨肽濃度以單調方式增加。肽PHB5、PHB8和PHB9是該組中最強有力的抑制劑,並且達到23%-50%的抑制的值,這與由重組DIIIE所顯示的相似。在所分析的濃度範圍內,這三種肽是比肽HDIII3CL更強有力的抑制劑,它們具有高至2-12倍的抑制百分比,取決於所分析的濃度。
在該測定試驗中,肽HDIII3CL達到僅18%的抑制的最大值,這比最小的β-髮夾肽(肽PHB7)的效力還低。該結果表明,如果考慮與蛋白質α2M*的相互作用,DIIIE的FGβ-髮夾的鏈間環的殘基實際上是可以摒棄的,因為在肽PHB7的設計中,具有6個原始殘基的環被替換成IP型β-轉角(具有兩個中心殘基)。該轉角的序列不與原始的環序列相關(因部分相似性和/或同源性),該肽的β-轉角的殘基是由於基本上結構的原因(高的形成連接β-髮夾的IP型轉角的傾向)而被引入的。從肽HDIII3CL的原始環中,在肽PHB7的序列中(和在肽PHB8和9中)僅保留了賴氨酸11(HDIII3CL的序列)(在該情況下,其由肽PHB7的賴氨酸9來代表)的功能性。在結構上,這些賴氨酸佔據相似的(在結構上準等價的)空間位置,並因此PHB7的賴氨酸9在功能上模擬HDIII3CL的賴氨酸11。
除了賴氨酸9(HDIII3CL的Lys11的模擬物)外,PHB7的其他殘基也在結構上/在功能上模擬HDIII3CL的殘基:a)Asn3、Lys10和Asn12模擬HDIII3CL的殘基Asn3、Lys14和Asn16(這些是在β-髮夾結構中不通過氫橋連接的殘基),其相應於DIIIE的FG髮夾的暴露面,並因此這些殘基是可能功能性的;b)Trp13相應於HDIII3CL的殘基TRP17並且是在黃病毒中嚴格保守的殘基;c)Cys1和Cys14形成等價於由HDIII3CL的Cys1-Cy18所建立的二硫橋的二硫橋。PHB7相對於HDIII3CL而言的抑制活性的增加有力地暗示了這些共同的殘基在本發明的肽的功能活性中的推定的作用。
肽PHB8和PHB9是比肽PHB7更強有力的抑制劑。這表明,在PHB8和PHB9中添加四個殘基(兩個/髮夾)對於本發明的β-髮夾肽的抑制活性作出了有利貢獻。
如在圖4中所觀察到的,β-髮夾肽PHB5抑制DIIIE與蛋白質α2M*的結合,其中具有與由DIIIE-α2M*所顯示出的相似的肽-α2M*相互作用的表觀親和力,在每一種所檢驗的肽濃度下PHB5的抑制百分比的值僅比由DIIIE1J所顯示的稍低。這些結果表明,本發明的髮夾肽的拓撲學結構可以進行修飾。這對於轉角的類型也是有效的,其在PHB5中為IIP型,而在PHB7-9中為IP型β-轉角。重要的是在相互作用中的必需殘基的結構等價性,這些必需殘基即使在結構上不同的模型中也類似地進行布置。在PHB8和PHB9的摺疊中二硫橋的穩定化作用被在PHB5的設計中所引入的Trp「拉鏈」所代替。
本發明的的一個基本要素是在nM範圍內的肽的生物學活性的分析。肽的高效力可以導致更低的治療劑量,其中具有在下列方面的隨之而來的優點:花費,以及和與高劑量相關聯的聚集、非特異性相互作用、抗原性和免疫原性問題有關的可能的不希望效應出現的可能性的降低。如在圖5中所顯示的,在nM/亞μM範圍內,肽PHB2、PHB4、PHB5、PHB8和PHB9具有明顯地高於重組DIIIE(DIIIE1J)的抑制「DIIIE1J-生物素化的」與蛋白質α2M*的結合的活性,其中所觀察到的抑制百分比典型地高至1.5-3倍。在該濃度範圍內,由肽HDIII3CL所顯示的抑制相比於DIIIE1J而言是非常低的。
實施例4.在DIIIE與α2M*的結合中的必需殘基的作圖
DIIIE(DIIIE1PRS)的丙氨酸突變體文庫的獲得
為了能夠測定DENV1的DIIIE的哪些殘基在與不同配體的相互作用中發揮重要作用,製備了其突變變體文庫,其中每個暴露殘基系統性地被丙氨酸代替(一種以「丙氨酸掃描」更為人所知的技術),以便隨後研究所述變體中的每一個與所研究的配體的結合。在該類型的實驗中,將關於特定突變體與所研究的配體的結合的任何改變解釋為該突變殘基參與原始蛋白質與所述配體的相互作用的證據。
為了製備該文庫,從DENV1PRS 288690毒株的包膜蛋白的殘基289至395(該編號按照蛋白質序列GenBank:AAN32775.1)出發(Goncalvez,A.P.等人,(2002),Virology 303(1),110-119)。將相應於病毒多蛋白的該片段(其在此被定義為病毒DENV1-PRS 288690毒株的DIIIE(DIIIE1PRS))的序列鑑定為SEQ ID No.15。
在DENV1的DIII中待突變的殘基的選擇
決定基本上基於下列方面來進行待突變的殘基的事先選擇:殘基相對於溶劑而言的可接近性,其通過使用程序包WHAT IF 20050919-1718版(Vriend,G.,(1990),J.Mol.Graph.8,52-6)來估計;和每個可能的變體相對於原始蛋白質而言在穩定性方面的差異的估計,其表示為通過FoldX 6.0版(Schymkowitz,J.等人,(2005).Nucleic Acids Res.33,W382-W388)而計算出的ΔΔG。這些計算基於DIIIE1PRS(SEQ ID No.15的殘基1-105)的同源性模型,其從DENV3的蛋白E的晶體學坐標(Modis,Y.等人,(2003).Proc.Natl.Acad.Sci.U.S.A 100,6986-6991)開始而獲得,並且經歷能量最小化過程。
最終所選用的選擇標準是:高於15%的相對可接近性,和低於4kcal/mol的ΔΔG。按照該標準而被選擇用於突變為Ala的79個位置以及關於所提及的參數的計算結果顯示在表4中。
表4.被選擇用於包括在DIIIE1PRS的Ala掃描中的殘基
ΔΔG:Ala突變體相對於野生型而言的在穩定性方面的差異(1:沒有最小化的模型,2:經最小化的模型);%AAC:對於溶劑的可接近性的%。帶陰影的殘基相應於具有高於4kcal/mol的ΔΔG的位置。
用於在大腸桿菌(Escherichia coli)中表達DIIIE1PRS及其突變變體的重組質粒的獲得
在選擇了待被包括在丙氨酸掃描中的DIIIE1PRS的殘基後,製備重組質粒以用於其以及文庫的變體中的每一個在大腸桿菌中的異源表達。這通過下述方式來進行:通過Agarwal等人的方法(Agarwal KL等人,(1970),Nature 227,27-34)並且從經由亞磷醯胺方法(Beaucage SL&Caruthers MH(1981).Tetrahedron Letters,22,1859)在固相上合成的寡核苷酸開始,合成雙鏈DNA分子,其編碼DENV1PRS 288690毒株的蛋白E的殘基289-400(蛋白質序列GenBank:AAN32775.1)(Goncalvez,A.P.等人,(2002).Virology 303(1),110-119),隨後為具有六個組氨酸的序列。在此,將所編碼的蛋白質定義為重組DIIIE1PRS(rDIIIE1PRS,SEQ ID No.17)。所合成的雙鏈DNA分子(SEQ ID No.16)包含對於限制酶Nde I和Xho I的切割位點,其被設計用於其同相插入到質粒pET22b(Novagen Inc.,USA)中。在用限制酶Nde I和Xho I於由製造商所明確說明的條件下消化該多核苷酸後,將其通過使用T4DNA連接酶於由製造商所明確說明的條件下連接至事先以相同方式進行消化的質粒pET22b(Novagen,Inc.)。將所獲得的反應混合物按照Sambrook等人(Sambrook J.等人,Molecular cloning:A laboratory manual.New York,USA:Cold Spring Harbor Laboratory Press,1989)轉化到大腸桿菌XL-1Blue株(Bullock WO等人,(1987).Biotechniques,5:376-8)中,並且對在於選擇培養基上獲得的菌落中所存在的質粒進行探查、純化和測序,最終選擇其序列相應於所期望的序列(給予其名稱pET-DIII DENV1(SEQ ID No.18))的質粒,其呈現在圖6中。
用於表達先前選擇的DIIIE1PRS的79個突變變體的重組質粒的構建以相同方式來進行,但在該情況下合成這樣的雙鏈DNA分子,其中相應於待突變的殘基的密碼子序列被序列GCG(其相應於丙氨酸的密碼子)代替。在每個變體中被代替的密碼子連同其所編碼的胺基酸一起顯示在表5中。
表5.在DIIIE1PRS的突變體文庫的每個變體中,被丙氨酸代替的殘基以及被GCG代替的相應密碼子
將DIIIE1PRS的突變體文庫的質粒轉化到大腸桿菌中和將所獲得的克隆冷凍保存
為了獲得包含用於在大腸桿菌宿主中表達所選擇的DIIIE1PRS變體的質粒的大腸桿菌克隆,製備大腸桿菌BL21(DE3)株的感受態細胞(Studier,F.W.&Moffatt,B.A.(1986)J.Mol.Biol.189(1),113-130)並將其分成等分試樣,將所述等分試樣中的每一個分開地用20ng的在所述突變體文庫的質粒中的僅一種進行轉化,其中使用常規方法(Sambrook,J.等人,Molecular cloning:A laboratory manual.1989.New York,USA,Cold Spring Harbor Laboratory Press)。將經轉化的等分試樣分開地接種在包含100μg/mL氨苄青黴素的LB-瓊脂培養基平板上。在於37℃下12小時的生長期後,從每一個板中選擇良好隔離的菌落,將其接種在處於試管中的5mL的補充有100μg/mL氨苄青黴素的液體LB培養基中。將所得的培養物在攪拌下(200rpm)於37℃進行溫育直至出現可見的混濁,然後分開地在無菌條件下於25℃以3000x g離心20分鐘,將每個重懸浮在250μL新鮮的LB+250μL40%(v/v)甘油中,並又分成100μL的等分試樣,將其貯存於-70℃。
DIIIE1PRS的突變變體的純化
在獲得了用於表達DIIIE1PRS的突變體文庫中的每一種變體的經冷凍保存的大腸桿菌克隆的集合之後,最後以小規模純化所述變體中的每一種。在每種情況下,這通過下述方式來進行:在具有50mL的補充有100μg/mL氨苄青黴素的ZYM5052培養基(Studier,F.W.(2005).Protein Expr.Purif.41(1),207-234)的1L的錐形瓶中接種包含相應質粒的大腸桿菌克隆的一個經冷凍保存的等分試樣,將所得的培養物在37℃和300r.p.m.下溫育12小時。在所述時間段結束時,將培養物於25℃以3000x g離心20分鐘並棄去上清液,將所得的生物質重懸浮在19mL的包含6M GuHCl的AG緩衝液(1X PBS,0.3mol/L NaCl,20mM咪唑)中,並且通過在配備有U200-14探頭的超聲發生器中以最大振幅和70%的功率進行超聲處理30秒鐘來消除勻漿物的粘性。接著,將勻漿物通過於25℃以3000x g離心45分鐘來進行澄清,並將上清液與0.3mL的Ni2+-氨三乙酸-瓊脂糖(Ni-NTA瓊脂糖,Qiagen,Germany)一起在25℃下在擺動的搖動器上溫育1小時。在該時間段後,將樹脂通過重力裝入空的NAP-10柱(GE Healthcare,USA)中,並通過重力順次地用一系列具有在6M和1.2M之間的逐漸降低的濃度的GuHCl的AG緩衝溶液和最後用A緩衝液(1X PBS,0.3M NaCl,20mM咪唑)進行洗滌。接著,將柱在0.3mL的E緩衝液(1X PBS,0.3M NaCl,300mM咪唑)中進行平衡,並且用E緩衝液來洗脫蛋白質。通過凝膠過濾(Sephadex G-25),將洗出物緩衝液立即變換成1X PBS。所得的製備物的總蛋白質濃度通過雙金雞寧酸方法(Smith,P.K.(1985).Anal.Biochem.150(1),76-85)來進行測定,在這之後將10μL的每種製備物通過在還原條件下的SDS-PAGE(Laemmli,U.K.(1970).Nature 227(259),680-685)來進行分析以保證不存在降解。將經純化的DIIIE1PRS的變體的集合貯存於-20℃直至其使用。
競爭性測定試驗
DIIIE1PRS的丙氨酸突變體抑制重組DIIIE與蛋白質α2M*的相互作用的能力通過競爭性ELISA測定試驗來進行分析。將平板用經純化的α2M*級分進行包被,並且在數種濃度的屬於上面所描述的單突變體文庫的每個DIIIE1PRS的丙氨酸突變體存在下與「DIIIE1PRS-生物素化的」一起進行溫育。與α2M*結合的「DIIIE1PRS-生物素化的」的檢測通過使用鏈黴抗生物素蛋白-過氧化物酶綴合物來進行。將光密度值擬合成劑量-應答曲線,並計算相應於每個突變體和重組蛋白質DIIIE1PRS(天然序列)的IC50值。
如在圖7中所觀察到的,結構域III的五個殘基(Lys361、Glu262、Pro264、Val365和Lys385)通過丙氨酸來進行的突變引起超過一個數量級的IC50值的增加(親和力的降低)。考慮到在IC50值降低方面的兩倍的閾值,全部13個殘基以該量值影響相互作用。除了已經提及的五個殘基外,在該組中還包括殘基Glu342、Thr34、Arg350、Lys363、Asn366、Pro372、Gly374和Glu375。
DIIIE與蛋白質α2M*的結合牽涉該結構域的表面的兩個獨立的斑片(圖7和8),其中一個位於上表面(N-末端所位於之處)和另一個位於下表面(該結構域的C-末端)。上表面的斑片包含對相互作用貢獻最大的殘基,包括其通過丙氨酸進行的突變引起在親和力方面的超過10倍降低的五個殘基。因此,可以認為所述斑片為在病毒的DIIIE與蛋白質α2M*之間的相互作用的初級位點。該斑片通過線性區段Lys361-Asn366和通過殘基Lys385(作為必需殘基)來成形。
位於該結構域的下表面的第二個斑片(圖7和8)由殘基Glu342、Thr346、Arg350、Pro372、Gly374和Glu375來限定。由於這些殘基被丙氨酸置換而引起的親和力的降低相比於上部斑片而言是較低的,因此其可以被認為是次級相互作用位點。
在DIIIE與蛋白質α2M*的相互作用位點的作圖中所獲得的結果有力地支持了本發明的β-髮夾肽的設計的基礎。所述肽具有在結構上/在功能上模擬DIIIE的殘基Lys385(其是單個地對相互作用貢獻最大的胺基酸)的賴氨酸殘基(超過22倍的在親和力方面的降低,當突變為丙氨酸時)。所述肽的模擬該殘基的殘基為:PHB2的Lys8和PHB5的d-Lys8,PHB1、PHB6和PHB7的Lys9,PHB4的Lys10,以及PHB3、PHB8和PHB9的Lys11。
當考慮與蛋白質α2M*的相互作用時最強有力的五種髮夾肽(圖5,實施例3)中的四種(PHB4、PHB5、PHB8和PHB9)具有在結構上/在功能上模擬DIIIE的殘基Glu375的殘基。該殘基是在該實施例4中所確定的次級結合位點的最重要的殘基。所述β-髮夾肽的模擬所述殘基Glu375的殘基為:PHB3、PHB4、PHB8和PHB9的Glu3;以及PHB5和PHB6的Glu16。因此,本發明的抑制與α2M*的結合的最強有力的肽同時具有模擬在該實施例中所描述的初級和次級斑片的最重要殘基的殘基。
實施例5.超分子結構的形成
肽PHB4的聚集動力學
使用光散射來監測肽PHB4的聚集。光散射的測量在分光螢光計ShimadzuTM RF-5301 PC(Shimadzu,Japan)中進行。通過使用由該儀器的製造公司所提供的程序來獲取數據。將入射(激發)和散射(發射)光束的波長調整至320nm,其中具有5nm的激發和發射孔徑。肽的散射通過從由肽溶液所散射的光的強度中減去由沒有肽的溶液(空白)所散射的光的強度值來計算。由於其溶解在PBS中而產生的肽的散射的變化通過以時間過程方式(採用一次或兩次測量/秒這樣的頻率)實施測量來進行研究。肽在PBS中的溶液從肽在水中的溶液開始通過在2X PBS中進行1:2稀釋來製備。
一旦溶解在PBS中且在少於2分鐘的潛伏時間後,由肽所散射的光的強度在最初30-40分鐘期間迅速增長,然後繼續以線性動力學緩慢地增加直至300分鐘(最大研究時間)。圖9顯示了對於10μΜ和5μΜ的肽濃度所獲得的相對於在零時間處的分散值而言的散射光強度的變化圖。肽的行為在兩種濃度下是相似的,儘管在5μΜ下所觀察到的的最大值大於在10μΜ下所觀察到的(11對7),這暗示在較低的肽濃度下發生的聚集最終導致形成具有相對於原始平均大小而言更大的平均大小的聚集體。所述圖用SigmaPlot 10.0(Systat Software Inc.)來繪製。
通過透射電子顯微鏡術來研究肽PHB4的超分子結構的形態
為了鑑定由肽PHB4所形成的聚集體的形態,使其經歷不同的與聚集過程相關聯的實驗條件:溫度、溫育時間和電解質的存在(圖10)。為了該研究,製備以2mg/ml(0.73mM)的濃度的該肽在水和PBS中的樣品。將這些中的一個部分直接固定在方格網中並在顯微鏡下進行觀察(樣品T0)。將每個樣品的第二個部分在50℃下溫育1小時並隨後立即固定(樣品T1),而將第三個部分在熱處理後在環境溫度下維持額外兩個小時的時間(樣品T2)。
如在圖10A中所觀察到的,在水中的肽在環境溫度下形成直徑為5-20nm的顆粒。在這些顆粒的基礎之上,在50℃下的處理誘導了5-10nm的初原纖維/原纖維類型的絲狀結構的形成(圖10E)。在水中原纖維的形成需要潛伏時間,因為在熱處理後僅在樣品T2中檢測到它們。纖維的形成機制在離子強度存在下(PBS)是非常有利的,其中緊接在將肽重懸浮在PBS中後觀察到存在有直徑為5-20nm的絲狀結構(圖10B)。在將樣品於50℃加熱一小時後纖維變得更多(圖10D和10F)。上面的結果證明,肽PHB4的聚集是一個由溫度和由離子強度(PBS)的存在促進的過程。
該研究清楚地表明,肽PHB4形成超分子聚集體,其形態取決於環境條件和溫度。纖維狀結構的尺寸與澱粉狀蛋白類型的結構的形成相一致,其特徵在於通過延伸的β-片層的形成而伸長的纖維的增長。
蛋白質的聚集過程由蛋白質分子之間的排斥相互作用和吸引相互作用之間的平衡來控制(Juárez,J.等人,(2009)Biophysical Journal96[6],2353-2370)。已知向蛋白質溶液中添加電解質使得原纖維形成速度的增加成為可能,這是屏蔽了蛋白質分子之間靜電排斥的結果,其中促進使得聚集體的形成成為可能的分子間相互作用(Juárez,J.等人,(2009)Biophysical Journal 96[6],2353-2370;Sagis,L.M.等人,(2004).Langmuir 20,924-927)。同時,分子間相互作用過程的動力學隨溫度的增長而得到促進,其是在蛋白質聚集體的誘導中的基本因素。實施例6.β-髮夾肽與受體LRP1的片段的相互作用的研究
已知使用幹擾DENV與稱為LRP1的受體的相互作用的分子阻斷對於細胞的感染(Huerta G.V.等人,WO 2007/124698)。
LRP1是一種膜內在蛋白質(圖11A),其由非共價地締合的大約500kDa的α鏈和85kDa的β鏈形成(Anna P.Lillis等人,(2008)Physiol Rev 88:887-918)。胞外區由α鏈和β鏈的片段構成。β鏈還包含一個跨膜區段和兩個NPxY序列,所述NPxY序列用作與牽涉信號傳導和胞吞作用的蛋白質偶聯的位點。LRP1是可以內化多於30種不同配體的組成性胞吞受體,並且與許多具有至關重要的重要性的功能(例如,脂質代謝、止血、溶酶體酶的激活和神經傳遞)相關。
LRP1的α鏈介導與LRP1的胞外配體的相互作用。該鏈具有LRP1所劃歸的低密度脂蛋白受體家族的成員蛋白質的典型的結構性結構域構造。特別地,LRP1包含四個集群,其分別具有2個(簇I)、8個(簇II)、10個(簇III)和11個(簇IV)與補體蛋白質的富含半胱氨酸的區域這樣類型的配體結合的位點。在每一個配體結合位點集群之後接著的是與表皮生長因子具有相似性的結構域(其由富含半胱氨酸的區域來成形)和YWTD結構域。
為了評價LRP1的配體結合結構域與DENV的DIIIE的直接相互作用,使用包含與6His尾巴相融合的下列殘基的重組蛋白質(SEQ ID No.19-22):相應於病毒毒株「牙買加/CV1636/1977」的DENV1的殘基289-399(DIIIE1J);DENV2「牙買加1409」毒株的殘基289-399(DIIIE2);DENV3H-87毒株的殘基287-397(DIIIE3);和DENV4「多米尼加814669」毒株的殘基289-399(DIIIE4),如在圖11C中所呈現的。蛋白質DIIIE1J和DIIIE2-DIIIE4通過在大腸桿菌中的異源表達來獲得,並且通過具有金屬螯合物的親和層析來進行純化,從而獲得具有大於90%純度的製備物,如在SDS-PAGE分析中所證明的那樣(圖11D)。還使用三種重組蛋白質,其包含與IgG1類型人免疫球蛋白的恆定區(R&D Systems,USA)相融合的LRP1的簇II、III和IV(分別命名為sLRP1-CII(SEQ ID No.23)、sLRP1-CIII(SEQ ID No.24)和sLRP1-CIV(SEQ ID No.25))(圖11B)。
相互作用的評價通過ELISA類型的測定試驗來進行,其中將96-孔平板用10μg/ml的蛋白質DIIIE1J和DIIIE2-DIIIE4進行包被,用牛血清白蛋白(BSA)進行封閉,並在37℃下與在20mM Hepes緩衝液(pH 7.0)、150mM NaCl、1mM CaCl2、0.05%Tween 20中的濃度為10μg/ml的sLRP1CII、sLRP1CIII和sLRP1CIV一起溫育1小時。在洗滌之後,將平板在37℃下與抗人IgG-過氧化物酶綴合物的1:1000稀釋物一起溫育1小時,並使用底物鄰苯二胺/H2O2來進行揭示。所獲得的結果顯示了所述四種血清型的DIIIE的相似的相互作用模式,其中用蛋白質sLRP1-CIV和sLRP1-CII獲得了較大的反應性(sLRP1-CIV>sLRP1-CII),而用蛋白質sLRP1-CIII則未檢測到反應性(圖12)。
為了研究所述肽與所述受體的可溶性片段的相互作用,使用Biacore X設備,其採用稱為表面等離子體共振的光學原理用於檢測。為了使用該技術,將待研究的分子之一固定化在構成測量室的面之一的晶片表面上。另一分子以溶液形式進行使用,並在受控流條件下流過測量室。相互作用物的締合和解離以RU來進行測量,並且按照時間在稱為傳感圖的圖中可視化。以該方式還可能的是,無需對分子進行標記就能獲得關於相互作用的詳細信息。
為了進行測量,將蛋白質sLRP1-CIV以高密度條件(參見表6)固定化在CM5晶片(General Electric Healthcare,USA)的溝道中。在同一晶片的另一溝道中固定化重組HSA(HSArec)(Sigma-Aldrich,USA)。從對於所述蛋白質之一所達到的RU密度出發,並考慮到每一個sLRP1-CIV分子中11個潛在的相互作用位點和每一個HSA分子中一個位點的存在,獲得了關於這兩種蛋白質的相似的每單位表面的結合位點密度(pmol/mm2)。
表6.用於評價與sLRP1-CIV的相互作用的CM5晶片的表面的特徵的概括
為了評價經固定化的蛋白質的反應性,使用兩種已知的LRP1的配體:α2M,和稱為受體相關蛋白(RAP,Receptor associated protein)的蛋白質。以前已證明,這兩種蛋白質與受體LRP1的簇IV相互作用(Jaap G.Neels等人,(1999).Journal of Biological Chemistry,274,44:31305-31311)。在圖13中,正如可以看出的,α2M和RAP的施加僅在相應於sLRP1-CIV的溝道中引起信號(RU)的增加,而在相應於HSArec的溝道中未觀察到任何信號增加。該結果證明,經固定化的蛋白質sLRP1-CIV能夠建立與這兩種配體的特異性相互作用。
以高密度進行的固定化應當有助於具有比蛋白質小的大小的分子(例如可以是肽)的特異性相互作用的檢測。然而,在該條件下,質量傳遞限制現象和建立與多於一個的配體分子的多價結合的可能性使得測定相互作用的動力學常數變得困難。為了更詳細地表徵sLRP1-CIV的表面的反應性,施加不同稀釋度(0.6-20μΜ)的蛋白質RAP,並在相互作用平衡條件下記錄RU(250秒,參見圖13B)。通過將對於不同稀釋度而達到的最大RU針對濃度進行繪圖而獲得曲線顯示了與雙位點相互作用模型擬合的行為,其表明存在KD為4.2nM的高親和力相互作用和KD為1.1μΜ的低親和力相互作用。該行為與在關於RAP與受體LRP1的相互作用的不同研究中所獲得的結果(其表明RAP可以以在6-18nM範圍內的親和力建立與LRP1的簇II和IV的多點相互作用)相一致。然而,還從某些在多價結合中發生的相互作用的喪失開始而獲得了在μM範圍內的親和力值。因此,在該工作中所使用的sLRP1-CIV表面上的親和力處於μM級別的相互作用的獲得可以從在晶片表面上的高蛋白質密度(其有助於在較大的RAP濃度下影響多價結合)來進行解釋。這些結果還指明,經固定化的蛋白質sLRP1-CIV複製了對於LRP1與RAP已經描述了的相互作用的特徵。
對於sLRP1-CIV的同一表面,以20μΜ的濃度施加在運行緩衝液中進行稀釋的肽的不同變體。在所獲得的結果中,對於不同的肽變體看出不同的相互作用水平。在所述肽的情況下,所獲得的信號的量值與其聚集形式的結合相一致。因此,所獲得的信號可以是在肽與受體中的相互作用位點之間的相互作用的內在親和力或者單一相互作用的強度方面的增加的結果,以及是由於被摻入到聚集結構中並具有與受體的不同相互作用位點建立相互作用的能力的肽單元的數量的增加而引起的親和力提高的結果。
在HDIII3CL家族的肽(表1的肽10-14)的情況下,對於變體HDIII3CL2獲得了最高的結合水平。在變體HDIII3CLW和HDIII3CLK的情況下,還獲得了證明這些肽具有一定水平的與經固定化的蛋白質結合的曲線。然而,這兩種變體的信號比對於肽HDIII3CL所獲得的信號小,這表明殘基W17和K14的獨個置換導致更小的與sLRP1-CIV的結合。對於變體HDIII3CLC所獲得的信號表明,通過殘基C1和C18的置換(和二硫橋的隨後消除)對於相互作用所產生的影響僅允許該肽與sLRP1-CIV的邊緣相互作用。該結果與由所述肽所顯示的抗病毒活性效力相一致;相對於HDIII3CL而言顯示出與受體的結合降低的HDIII3CLC、HDIII3CLW和HDIII3CLK在Vero細胞中不具有針對DENV2的抗病毒活性(參見表2)。相反,對於HDIII3CL2所觀察到的與受體的結合的增加未表現在相對於HDIII3CL而言的抗病毒活性的增加中(參見表2)。該結果表明,與受體的結合本身是必需的,但對於抗病毒活性來說不是足夠的。一種可能的解釋是,肽HDIII3CL2的一部分與在病毒-受體相互作用中不重要的和/或以非常低的親和力進行結合的該受體的位點相結合。考慮到受體LRP1和/或其簇是多結構域的,這樣的情形是合理的。肽HDIII3CL2和HDIII3CL之間的差異是:前者具有一個額外的C-末端賴氨酸。因此,所述肽是更加陽離子的,並且可能具有額外的與陰離子性質的受體LRP1的靜電類型的相互作用。此外,所述賴氨酸21不構成髮夾的一部分,所述髮夾是模擬在本發明中和以前(Huerta G.V.等人,WO 2007/124698)所描述的DIIIE的功能性斑片的拓撲學區域。
以相同的方式評價了β-髮夾肽PHB1、PHB2、PHB3、PHB4、PHB5、PHB8和PHB9與sLRP1-CIV的表面的相互作用。如在圖14B和14D中所顯示的,對於肽PHB4獲得了顯著更高的結合水平,所述肽PHB4還是在抗病毒活性測定試驗中最有活性的。肽PHB2、PHB4和PHB9也顯示了比對於肽HDIII3CL所觀察到的更高的最大結合(圖14A和14C),這與它們的更高的抗病毒活性相符。此外,在具有相同大小和β-轉角類型的肽PHB1-2、PHB3-4和PHB8-9之間所觀察到的最大結合的比較顯示,肽PHB2、PHB4和PHB9是比其對應物PHB1、PHB3和PHB8更好的結合劑,與對於抗病毒活性(在實施例2中所研究的)所觀察到的相似地。
實施例7.β-髮夾肽的抗病毒活性與其結合受體LRP1和蛋白質α2M*的能力之間的相關性
以前已提出了作為DENV的推定的胞吞受體的受體LRP1,和在病毒進入細胞的過程中具有可能的載體蛋白作用的蛋白質α2M*(Huerta G.V.等人,WO 2007/124698)。
在實施例6中證明了,本發明的β-髮夾肽能夠與受體LRP1的片段相結合。在本實施例中,探察在實施例2中所觀察到的抗病毒活性是否與所述肽與受體LRP1結合的能力定量地相關。如在圖15中所觀察到的,在Vero細胞中的抗病毒活性的IC50值的對數(-pIC50)顯示出與在運行400s時所觀察到的Biacore信號(RUrem)的線性關係。在該情況下,顯示了共有相同的拓撲學結構的PHB肽(按照表1)。肽PHB4顯示出比其餘肽高得多的在抗病毒活性方面的效力,但還觀察到超越了其餘肽的行為的該肽與受體的結合。即使抽出相應於PHB4的數據,線性也得到保留(圖15中的插入圖),線性回歸係數R2為0.99(在考慮PHB4的情況下),和0.97(如果沒有PHB4)。插入圖的數據的分析預測,如果保持關於PHB4的線性行為,那麼在Biacore中所觀察到的與受體結合的值與在nM範圍內的高的抗病毒活性效力相符。這樣的所期望的效力與在實施例2中通過實驗而觀察到的相一致。
該系列的具有相似拓撲學結構的肽的抗病毒活性的pIC50數據顯示出與RUrem值的在統計學上顯著的相關性,r(皮爾遜)=-0.9957和P<0.0001。在從數據中排除肽PHB4的情況下,相似地獲得r(皮爾遜)=-0.9868,P=0.0018。用程序GraphPad Prism v5.03來實現相關性分析、線性回歸和圖。
這些結果與通過影響在病毒與受體LRP1之間的相互作用(其導致病毒向細胞中的生產性進入的抑制)而介導的PHB肽的抗病毒作用機制相一致。
在考慮到PHB肽在亞μM/nM範圍內抑制DIIIE與蛋白質α2M*結合的能力的情況下,進行相似的分析。如在實施例3中所顯示的,在所述濃度範圍內,所述肽部分地抑制「DIIIE1J-生物素化的」與蛋白質α2M*的結合,其中肽PHB2、PHB4、PHB5、PHB8和PHB9明顯地優於重組DIIIE(DIIIE1J),並且所述肽顯示出典型地高至該結構域的1.5至3倍的抑制百分比。PHB肽的抑制能力(相對於重組DIIIE的抑制能力而言)與在Vero細胞中抑制DENV2感染的能力相關,正如在圖16中所觀察到的。在IC50值和與α2M*的結合的抑制百分比(相對於重組DIIIE的抑制而言來表示)之間的斯皮爾曼(Spearman)相關係數為Rs=-0.9762,P=0.0004。該結果暗示,本發明的β-髮夾肽可能在病毒進入細胞的過程中幹擾蛋白質α2M*的作用。
實施例8.改變聚集作用的試劑對於肽PHB4的抗病毒活性的影響
在不同的改變聚集作用的因素存在下,在有助於形成聚集體的條件下進行處理後評價肽PHB4的抗病毒活性,以便評價其對於由DENV2(S16803毒株)引起的Huh 7.5細胞感染的抑制活性的影響。Huh 7.5細胞系源自人肝細胞瘤。選擇該細胞系是鑑於這些細胞對於DENV2感染是高度敏感的,並且是從在人中感染的發病機制的觀點來看重要的系統(Lin YL等人,(2000)J Med Virol.,60(4):425-31)。
從在實施例5中所獲得的結果(其證明了肽PHB4在水至具有更大離子強度的介質中溶解的步驟改變聚集結構的大小和形態)開始,採用一般性的實驗設計,其中以肽在水中的溶液為出發點,並進行在(i)MEM培養基或(ii)PBS中的稀釋,在待評價的不同條件下。這兩種溶液分別包含6.8g/L和8.0g/L的NaCl,並且調整至pH 7.4。
在病毒產量測定試驗中評價抗病毒活性。為此,將Huh 7.5細胞的單層(80-90%匯合)用沒有補充物的DMEM培養基(DMEM s/FBS)洗滌兩次,並且在不同的肽PHB4製備物存在或不存在下在37℃和5%CO2下以0.01的m.o.i感染2小時。通過用DMEM s/FBS進行洗滌來除去病毒接種物,並添加200μL/孔的補充有2%FBS的DMEM培養基。在感染後24小時收集被感染的細胞的上清液,並且通過經由裂解斑形成測定試驗(Morens D.M.等人,(1985).N.J.Clin.Microbiology,22:250-254)對上清液進行滴度測定來測定病毒產量。
已知溫度是影響自裝配成超分子結構的肽的聚集過程的動力學的一個因素(SabatéR.等人,(2012).Biomacromolecules,13(2):474-83)。在第一系列的測定試驗中,以20μΜ的肽在水中的溶液為出發點,並製備在MEM中的在10-0.01μΜ範圍內的稀釋物,將其在10℃下和在37℃下平行地溫育2小時。作為對照,使用肽在MEM培養基中的相同的稀釋物,其在用於該測定試驗中之前不進行溫育。
結果顯示,溶解在MEM培養基中的肽能夠以依賴於濃度的行為和0.16μΜ的IC50值抑制病毒感染,其中在10μΜ的濃度下達到感染的完全抑制(圖17,表7)。然而,在10℃下在DMEM培養基中肽的預溫育引起效力的增加,達到0.037μΜ的IC50值;而在37℃下,具有直至0.89μΜ的值的IC50的增加。這些結果表明,在這兩種溫度下進行的肽的溫育正改變肽的聚合,其中使得其作為抗病毒試劑的效力變化了總共24倍。
表7.在10℃和37℃下進行溫育的肽PHB4的IC50值
通過使用統計學程序GraphPad Prism v5.3,經由非線性擬合來測定在每種實驗條件下IC50的調整。*在括號中指明了所述擬合的回歸係數(R2)的值。
為了調查聚集體的生長時間對於抗病毒活性效力的影響,設計了一個實驗(圖18),其中以不同的時間區間將肽在PBS中進行溫育,隨後在相同體積的在DMEM中的80mg/ml HSA之中進行稀釋,以便檢測聚集。HSA是強有力的改變聚集作用的試劑。證明了,HSA可以抑制澱粉狀蛋白的β-肽的原纖維的初始形成和生長(Reyes A.等人,(2009)Journal of Biological Engineering,3:5)。在10℃下和在37℃下平行地進行與HSA的溫育(圖18)。為了評價抗病毒活性,製備在DMEM中的HSA(以40mg/ml)之中的肽的稀釋物。
如在圖19中所觀察到的,在該測定試驗中所使用的條件下,獲得了倒U形的劑量-應答行為,這表明在抑制活性中存在最佳的肽濃度範圍。已在大量的生物系統的活性中獲得了該類型的應答。解釋該類型行為的機制在每個系統中是不同的,雖然共同要素是在所牽涉的分子之間存在多價相互作用。
所述結果證明,肽的抑制活性對於在PBS中的溫育時間(用於形成具有更大效力的聚集體)敏感,在該情況下效力是指達到將該測定試驗的感染對照的病毒產量減少50%的最小肽濃度。另外,在10℃下與HSA的溫育導致形成具有較小效力的變體,相比於通過在37℃下進行溫育所獲得的結果而言。該事實確證,應當存在肽(或肽的在生長中的聚集體形式)與HSA之間的相互作用,其改變聚集現象的演化並允許形成具有高效力的變體,從而以1nM-10pM的肽濃度達到感染的完全抑制,如通過在PBS中溫育45-60分鐘以及在37℃下與HSA溫育而獲得的那樣。
肽的初始濃度是另一個參數,已觀察到其可以顯著地影響聚集過程的動力學和結果。為了獲得關於該參數對於肽PHB4的抗病毒活性的影響的證據,進行在圖20中示意性地描繪的測定試驗,其中以在水中的在100μΜ-2μΜ範圍內的不同稀釋物為起點,將其在2X MEM培養基中進行1:1v/v稀釋,並在25℃下溫育2小時。在該溫育結束時,製備肽在DMEM s/FBS培養基中的稀釋物,其立即被用於抗病毒活性的測定試驗中。
在該實驗的結果中,觀察到肽PHB4的抗病毒活性對於該肽在水中溶解的初始濃度的依賴性,在將其添加至具有更大離子強度的溶液中以引發聚集體生長之前(圖21)。結果還顯示了在劑量-應答行為方面的變化,其確證了向著不同聚集結構的演化,這取決於肽在水中溶解的初始條件。最強有力的形式再次顯示出以倒U形式的劑量-應答曲線,並且是對於肽處於在該測定試驗中所評價的在水中的最大初始稀釋度這樣的條件而獲得的。
總之,所獲得的結果證明,肽PHB4可以實現具有在nM-亞nM濃度範圍內的效力的聚集形式,這取決於所採用的聚集體形成條件。重要的是強調,在這些實驗中所使用的抗病毒活性測定試驗代表了用於所評價的分子的最嚴苛測定試驗的變化形式之一,因為所述分子僅在感染的初始階段中存在,然後通過對細胞的洗滌而被撤去。在該實驗方案中所獲得的對感染的抑制與病毒感染細胞的早期階段(例如,與細胞表面的結合、內化和膜融合)的抑制相一致。
實施例9.在病毒感染動物模型中的保護作用
為了評價肽PHB4的體內抗病毒活性並將其與肽HDIII3CL進行比較,將具有12隻成年Balb/C小鼠(20g的平均體重)的組通過吸入乙醚來進行麻醉,並通過用相應於10倍半數致死劑量的病毒製備物實施顱內注射來進行接種。經麻醉的動物迅速恢復,並在處理後5分鐘就看起來是警醒的。觀察動物21天。將肽與病毒一起共接種。接種物的最終體積在所有情況下均為20μL。通過使用Kaplan-Meier對數秩檢驗來評價結果。
表8顯示了在用DENV的四種血清型進行的實驗中所獲得的結果。在所檢驗的劑量下,肽PHB4實現了小鼠的完全保護,其比肽HDIII3CL更強有力。在DENV2的情況下,保護試驗進行三次。
表8.在體內測定試驗中獲得的結果的概括
統計學顯著性:***,P<0.005;**,P<0.01;*,P<0.05。ND,未測定。a:未發現對於所使用的DENV3的毒株來說致死的劑量,因此該評價通過發病率來進行,考慮了下列徵候的存在:毛髮豎起、駝背、身體衰弱和下身癱瘓,以及這些症狀的以天表示的持續時間。
實施例10.用於形成金屬納米顆粒的與「組氨酸尾巴」序列相融合的肽PHB4
如前面所指出的,通過使用合成方法或通過重組DNA技術,可以單獨地或者與蛋白質/肽相融合地來獲得本發明的β-髮夾肽。如在實施例5中所證明的,所述β-髮夾肽可以聚集,採用不同類型的四級結構,這取決於肽的濃度,溶劑的性質,以及實驗條件,例如溫度、pH、離子強度、超聲處理、添加物的存在、與蛋白質(例如HSA)的非共價結合等。超分子結構也影響肽的抗病毒活性(實施例8)。納米顆粒的形成可以導致肽的效力的相當大的增加,其由更大的肽與受體的結合親和力來介導。所述肽納米顆粒可以通過數個肽單體與受體的數個配體結合結構域的結合而實現與受體的多點結合。納米顆粒還可以同時結合多於一個的存在於細胞膜上的受體鏈。類似地,納米顆粒的形成可以對藥物代謝動力學特性作出有利貢獻,其中增加在血液中的半壽期、對於蛋白水解的抗性等。
由本發明的PHB肽形成的納米顆粒可以通過下述方式而額外地穩定化:將所述肽融合至能夠支持以兩個或更多個基團「A」/一個基團「E」的化學計量的與「間隔物」分子或原子(E)的非共價相互作用的「受者」基團(A)。這種類型的設計允許通過間隔物「E」來進行的兩個或更多個PHB肽的締合。在本發明的一個實施方案中,已通過合成方式將具有五個組氨酸的「尾巴」的序列與肽PHB4相融合(圖22)。組氨酸尾巴可以作為用於多價金屬離子(Zn(II)、Cu(II)、Cu(II)、Cs,等等)的基團「A」發揮作用。在該情況下,胺基酸組氨酸的側鏈的咪唑基團與金屬離子建立配位鍵,以直至「3-4個咪唑基團/1個金屬離子」的化學計量比。這表明,在足夠的金屬濃度下,結合至尾巴的離子可以作為基團E起作用並使肽的二聚化穩定化。
在圖23中,示意性地顯示了,金屬離子可以直接地但也能通過與輔助螯合劑基團的配位而間接地介導具有可用的咪唑基團的肽的交織,所述輔助螯合劑基團例如為四陰離子化合物EGTA即乙二醇-雙(2-氨基乙基醚)-N,N,N』,N』-四乙酸和EDTA即2-({2-[雙(羧甲基)氨基]乙基}(羧甲基)氨基)乙酸。在這些情況下,金屬離子形成具有「2個金屬原子/1個二氨基四羧酸」的化學計量的EGTA(Me)2和EDTA(Me)2類型的絡合物。在這些絡合物中存在的金屬離子仍然可以與額外的咪唑基團進行配位,從而所述絡合物可以用作使肽和其聚合體的交織穩定化的基團「E」(圖23)。
圖22顯示了本發明的兩種類型的融合分子:在一種類型中組氨酸尾巴通過醯胺鍵而與肽PHB4的C-末端相結合(PHB4H5),和在另一種類型中所述尾巴位於N-末端(H5PHB4)。按照先前在實施例1中所描述的過程來合成和純化這兩種融合肽。
接著,在10mM MES緩衝液(pH 6.8-7.5)中在2mM ZnCl2(其提供金屬離子)或2mM絡合物EGTA(Zn2)存在下製備200μM的這兩種肽的儲液。絡合物EGTA(Zn2)事先通過在8mM ZnCl2存在下製備4mM EGTA的溶液來獲得。
單獨的以及以與Zn和與EGTA(Zn2)的絡合物形式的肽PHB4H5和H5PHB4的製備物通過在Vero細胞中的針對DEN2病毒(M2C毒株)的抗病毒活性測定試驗來進行評價。將細胞在每種肽製備物存在下於37℃溫育1小時,然後,以0.001的moi添加病毒。在兩個小時後,添加一層高密度培養基,並且於37℃在5%CO2的氣氛中溫育3天。作為陰性對照,取在具有相應濃度的ZnCl2和EGTA(Zn2)溶液存在下進行溫育的細胞。通過使用針對病毒包膜的單克隆抗體,採用免疫焦點(inmunofocus)技術來檢測病毒蝕斑。按照下述表達式來計算抑制百分比:
I=100-100×NP肽/NP陰性對照
其中I為抑制百分比,和NP為考慮了重複的病毒蝕斑數目的平均值。
如在圖24中所觀察到的,在20μΜ下,融合肽(單獨的,沒有金屬添加物)以高的百分比(將近100%)抑制病毒感染;然而,在4和0.16μΜ下,抗病毒活性消失。相反,肽與間隔物EGTA(Zn2)的絡合物保持了在50-70%的抑制範圍內的抗病毒活性。肽H5PHB4的絡合物在0.16μΜ下顯示出33%的抑制。
所獲得的結果顯示,從將肽PHB4與組氨酸尾巴相融合而得到的肽是更強有力的,當與間隔物試劑(特別是與間隔物EGTA(Zn2))形成絡合物時。
