純化CNTF的方法和製備修飾型CNTF的方法與流程
2023-10-10 18:58:09 1
本發明屬於生物醫藥領域,具體而言,涉及一種從液體混合物中純化重組人睫狀神經營養因子的方法、以及一種製備經化學修飾的重組人睫狀神經營養因子的方法。
背景技術:
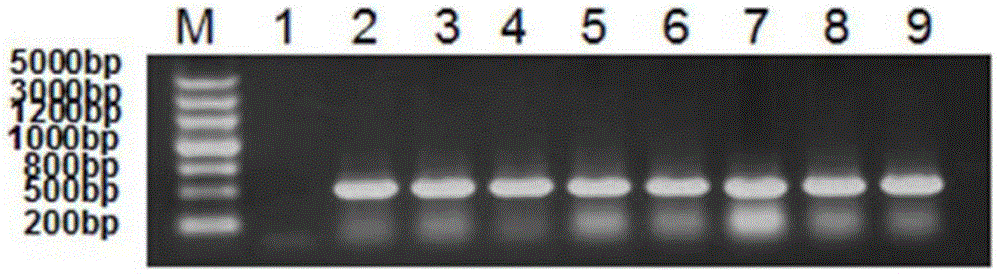
:人源睫狀神經營養因子(Ciliaryneurotrophicfactor,簡稱為CNTF)是一種小分子蛋白,全長由200胺基酸組成,分子量在23KD左右。CNTF在體內以兩個二聚體形式進行儲存,經過酶解成單體後發生生物學作用。CNTF可以促進包括運動神經元、感覺神經元、交感神經元、海馬神經元等多種神經細胞和神經膠質細胞的生長和分化。CNTF因為最初是從雞的睫狀體中提取出來,並可維持雞副交感神經節的存活而得名。90年代,在將人源CNTF用於治療肌肉萎縮性脊髓側索硬化症(ALS)的實驗研究中發現,對一組ALS患者進行臨床研究發現病人的體重大大降低,使用藥物組體重比安慰劑組明顯降低。CNTF曾被用來治療肌萎縮側索硬化症(ALS),但因副反應太大及療效不確切而終止了臨床實驗,但在實驗中意外地發現用藥者的體重都明顯下降。後Regeneron公司根據這一發現,開發了重組人CNTF藥物並已完成肥胖症的三期臨床實驗,並取得了統計學上具有顯著性差異的結果。研究表明CNTF可通過激活位於下丘腦的受體而對機體的體重設定點進行調節,從而起到減少攝食、減輕體重的作用。針對這一結果進行在肥胖症領域進行實驗,結果表明CNTF在體內可與下丘腦的特異性受體結合,激活抑制食慾的關鍵信號通路,抑制進食慾望且使機體不會產生飢餓感,從而使體重減輕。研究發現,CNTF具有多種功能,能促使多種神經細胞的存活、營養肌肉,促進糖、脂代謝和調節能量平衡以及攝食行為。在神經系統,肌肉系統,肥胖症 極其相關疾病的治療中具有重要意義和廣闊的臨床前景。由於CNTF在治療或預防肥胖症及其相關疾病中存在半衰期短,活性較低的缺陷,因此,為了開發出具有較高活性且療效時間較長的CNTF藥物,目前現有技術中已開發出了各種CNTF的突變體(或稱變異體),並且使用聚乙二醇(PEG)或PEG類聚合物對CNTF進行修飾,由此提高藥物的療效,延長藥物在體內作用的時間,並降低使用次數。然而,在採用基因工程技術由宿主細胞表達重組人睫狀神經營養因子(RecombinantHumanCiliaryneurotrophicfactor,簡稱為rhCNTF)或其突變體時,從宿主細胞中純化rhCNTF或其突變體的純度往往對後續的修飾率具有重要的影響。而修飾率則對rhCNTF藥物的工業化生產具有顯著的影響。另外,更重要的是,從宿主細胞中純化出來的目的蛋白中不可避免地具有殘留的核酸和內毒素。生物製藥的工業化生產需要嚴格控制終產品的核酸含量和內毒素含量。藥典規定人用單次劑量應不高於10ng。因此,在製備rhCNTF的過程中,對表達產物的純化是至關重要的。此外,對rhCNTF的修飾以及對修飾產物的純化也是重要的。然而,在現有技術中,對CNTF細胞表達產物的純化很難做到極其令人滿意的效果,並且CNTF的修飾效果以及修飾產物的純化效果也有待改善。技術實現要素:為解決上述現有技術中所存在的問題,本發明提供了一種從液體混合物中純化重組人睫狀神經營養因子的方法、以及一種製備經化學修飾的重組人睫狀神經營養因子的方法。具體而言,本發明提供了:(1)一種從液體混合物中純化重組人睫狀神經營養因子的方法,所述液體混合物至少包含重組人睫狀神經營養因子、核酸以及內毒素,該方法包括以下步驟:i)對所述液體混合物進行疏水層析,以獲得疏水層析洗脫液, 其中所述疏水層析所採用的介質為丁基-瓊脂糖;和ii)對所述疏水層析所得的洗脫液進行陰離子交換層析,以獲得陰離子層析洗脫液,其中所述陰離子交換層析所採用的介質為QHP。(2)根據(1)所述的方法,其中所述陰離子交換層析在pH為7.4-7.7的條件下進行。(3)根據(1)所述的方法,還包括對所述陰離子交換層析所得的洗脫液進行超濾。(4)根據(1)所述的方法,其中所述液體混合物為能表達重組人睫狀神經營養因子的細胞的裂解液的上清液。(5)根據(4)所述的方法,其中所述能表達重組人睫狀神經營養因子的細胞為遺傳工程化的原核宿主細胞。(6)根據(5)所述的方法,其中所述重組人睫狀神經營養因子具有SEQIDNO:1所示的胺基酸序列。(7)根據(5)所述的方法,其中所述遺傳工程化的原核宿主細胞為大腸桿菌CNTFnew/CC22,所述上清液是對該宿主細胞的裂解液進行離心而獲得的。(8)一種製備經化學修飾的重組人睫狀神經營養因子的方法,該方法包括以下步驟:a)利用化學修飾劑對重組人睫狀神經營養因子進行修飾,從而獲得包含修飾型重組人睫狀神經營養因子的混合物,其中所述重組人睫狀神經營養因子為根據權利要求1-7中任意一項所述方法純化得到的。(9)根據(8)所述的方法,其中在步驟a)中,所述重組人睫狀神經營養因子以濃度為1-4mg/ml,優選為2mg/ml的溶液使用,該重組人睫狀神經營養因子與所述化學修飾劑的摩爾比為1:(1-4),優選為1:2。(10)根據(9)所述的方法,其中在所述步驟a)中,所進行的修飾不需要進行終止反應。(11)根據(8)所述的方法,其中所述化學修飾為聚乙二醇化修飾,所述修飾劑選自:聚乙二醇、甲氧基聚乙二醇、甲氧基聚乙二 醇-琥珀醯亞胺琥珀酸酯、甲氧基聚乙二醇-琥珀醯亞胺碳酸酯、甲氧基聚乙二醇三氟乙基磺酸酯、甲氧基聚乙二醇-丙醛、甲氧基聚乙二醇-琥珀醯亞胺丙酸酯、甲氧基聚乙二醇-琥珀醯亞胺α甲基丁酸酯、甲氧基聚乙二醇-N-羥基琥珀醯亞胺、甲氧基聚乙二醇-馬來醯亞胺或甲氧基聚乙二醇-乙醛;優選為甲氧基聚乙二醇-馬來醯亞胺。(12)根據(8)所述的方法,其中所述方法還包括:b)對所述包含修飾型重組人睫狀神經營養因子的混合物進行陰離子交換層析,以獲得陰離子層析洗脫液。(13)根據(12)所述的方法,其中所述陰離子交換層析所採用的介質為QHP。(14)根據(12)所述的方法,其中所述方法還包括:c)對所得陰離子層析洗脫液進行超濾。本發明與現有技術相比具有以下優點和積極效果:1.在從包含重組人睫狀神經營養因子、核酸以及內毒素的混合物中純化rhCNTF的過程中,本發明優化了疏水層析所用的介質,並且在疏水層析之後採用陰離子交換層析,並進一步對陰離子交換層析所用的介質進行了優化選擇。這些優化方案的組合使得所得純化樣品的純度得到了突破性的提高,在經過疏水層析和陰離子交換層析之後,所得目的蛋白的純度可以達到98%,這使得後續對rhCNTF進行修飾的修飾率大大提高。不僅如此,採用陰離子交換介質還使純化產物中的核酸和內毒素的殘餘量大大減少,由此能夠使最終的rhCNTF藥物符合藥典的要求,具備生產放大的潛力。2.在以上優化的基礎上,通過在純化過程中增加超濾步驟,最終可以使從細胞中純化rhCNTF的純度提高到99%以上。3.在用化學修飾劑修飾rhCNTF的情況中,本發明優化了化學修飾劑與rhCNTF的修飾反應條件,即,優化了rhCNTF的使用濃度,及其與化學修飾劑的摩爾比。通過這樣的優化,本發明極大地提高了rhCNTF與化學修飾劑的反應率,並且由此可以省去利用DTT的修飾終止反應。這樣為後續純化的質量控制帶來了極大的方便,並且簡化 了製備流程。4.本發明還優化了修飾產物的純化過程,將陰離子交換介質由QFF改為QHP,由此提高了此步的純化效果。此外,進一步增加了超濾步驟,由此可以進一步提高純度,為後續的凍幹操作做好準備。附圖說明圖1為rhCNTF突變體表達載體的構建示意圖。圖2為CNTFnew/CC22的編碼序列PCR鑑定圖,其中,M為DNA分子量標準(DNAMarker);1為陰性對照;2-9分別為隨機挑選的8個CNTFnew/CC22工程菌的菌落的結果。圖3為NedI和EcoRI雙酶切鑑定的結果圖,其中,M為DNA分子量標準;1-8分別為隨機挑選的8個CNTFnew/CC22工程菌菌落的結果;9為陰性對照。圖4為CNTFnewCC22的全基因序列測定結果圖。圖5為目的蛋白CNTFnew/CC22的表達結果圖,其中,M為蛋白質分子量標準(ProteinMarker);1為陰性對照;2-9分別為隨機挑選的8個CNTFnew/CC22工程菌菌落的結果。圖6A為純化後,CNTFnew/CC22蛋白的SDS-PAGE電泳圖,其中左道為蛋白質分子量標準,右道為CNTFnew/CC22蛋白;圖6B為純化後,反相HPLC檢測CNTFnew/CC22蛋白純度的結果圖。圖7為SDS-PAGE電泳圖,顯示出不同疏水層析介質的純化效果,其中1為採用辛基-瓊脂糖介質的雜蛋白流穿;2為採用丁基-瓊脂糖介質的雜蛋白流穿;3為採用苯基-瓊脂糖介質的雜蛋白流穿;4為採用辛基-瓊脂糖介質的目的蛋白收集峰;5為採用丁基-瓊脂糖介質的目的蛋白收集峰;6為採用苯基-瓊脂糖介質的目的蛋白收集峰。圖8為CNTFnew/CC22蛋白的N端15個胺基酸序列的序列比對圖。圖9為純化後,CNTFnew/CC22蛋白免疫印跡結果圖,其中左道為蛋白質分子量標準,右道為CNTFnew/CC22蛋白。圖10為CNTFnew/CC22蛋白與MAL-mPEG分子結合的示意圖;圖11為用Y-40K-MAL-mPEG修飾CNTFnew/CC22蛋白之後進行的SDS-PAGE電泳圖,其中,M為蛋白質分子量標準(marker);1為用聚乙二醇Y-40K-MAL-mPEG修飾後的CNTFnew/CC22蛋白。圖12為聚乙二醇修飾反應混合物經QHP純化層析的結果圖。圖13為圖12中所收集的各峰的SDS-PAGE電泳圖,其中,1為蛋白質分子量標準;2為純化前,含CNTFnew/CC22蛋白、聚乙二醇Y-40K-MAL-mPEG以及修飾型CNTFnew/CC22的修飾反應混合物;3為QHP純化層析所收集的P0峰;4為QHP純化層析所收集的P1峰;5為QHP純化層析所收集的P2峰。圖14為純化後單修飾產物Y-40K-MAL-mPEG-CNTFnew/CC22的反相HPLC法純度分析結果圖。圖15為蛋白樣品用胰蛋白酶酶切後的反相HPLC分析圖譜。其中,上圖為Y-40K-MAL-mPEG-CNTFnew/CC22用胰蛋白酶酶切後的反相HPLC分析圖譜,下圖為原蛋白CNTFnew/CC22用胰蛋白酶酶切後的反相HPLC分析圖譜。圖16為Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22中m/z593的提取離子流圖(分別為圖中的1和2)和一級質譜圖(分別為圖中的3和4)。圖17為分子排阻色譜法測定40KDY-MAL-PEG修飾不同純度CNTFnew/CC22的修飾率。圖A為99%純度的CNTFnew/CC22的修飾率;圖B為95%純度的CNTFnew/CC22的修飾率。圖18為Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22的大鼠體內血藥濃度-時間曲線圖。A為CNTFnew/CC22靜脈注射結果;B為Y-40K-MAL-mPEG-CNTFnew/CC22靜脈注射結果;C為CNTFnew/CC22皮下注射結果;D為Y-40K-MAL-mPEG-CNTFnew/CC22皮下注射結果。圖19示出Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22對肥胖大鼠肝臟脂肪病變程度的改善結果。1為正常大鼠組;2為賦形劑組;3為飲食結構調整肥胖組;4為西布曲明處理 組;5、6、7分別為25、50、100μg/kgCNTFnew/CC22劑量組;8為200μg/kgY-40K-MAL-mPEG-CNTFnew/CC22食量配對組;9-13分別為25、50、100、200、400μg/kgY-40K-MAL-mPEG-CNTFnew/CC22劑量組。圖20示出Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22對db/db模型鼠的短期降糖作用。圖21示出Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22對db/db模型鼠口服葡萄糖耐量(OGTT)的改善。圖22為Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22蛋白免疫印跡結果圖,其中泳道1為蛋白質分子量標準,泳道2為Y-40K-MAL-mPEG-CNTFnew/CC22,泳道3為CNTFnew/CC22蛋白。圖23為純化後,反相HPLC檢測CNTFnew/CC22蛋白純度的結果圖。具體實施方式以下通過具體實施方式的描述並參照附圖對本發明作進一步說明,但這並非是對本發明的限制,本領域技術人員根據本發明的基本思想,可以做出各種修改或改進,但是只要不脫離本發明的基本思想,均在本發明的範圍之內。在從表達rhCNTF或其突變體的宿主細胞破碎上清中純化rhCNTF或其突變體的過程中,本發明的發明人發現,利用現有技術中常規的實驗操作進行純化後,純化洗脫液中仍然殘留有較多的核酸和內毒素。此外,純化後rhCNTF的純度仍然有待提高。通過大量的實驗研究,發明人驚奇地發現當選用丁基-瓊脂糖介質進行疏水層析,並且選用QHP介質進行陰離子交換層析時,不僅提高了rhCNTF的純度,還大大降低了純化樣品中的核酸和內毒素的殘餘量。基於以上發現,本發明一個方面提供了一種從液體混合物中純化重組人睫狀神經營養因子的方法,所述液體混合物至少包含重組人睫狀神經營養因子、核酸以及內毒素,該方法包括以下步驟:i)對所述液體混合物進行疏水層析,以獲得疏水層析洗脫液, 其中所述疏水層析所採用的介質為丁基-瓊脂糖;和ii)對所述疏水層析所得的洗脫液進行陰離子交換層析,以獲得陰離子層析洗脫液,其中所述陰離子交換層析所採用的介質為QHP。在本文中,術語「重組人睫狀神經營養因子」屬於重組DNA製品範疇,是採用遺傳修飾,將編碼人睫狀神經營養因子DNA通過質粒或者病毒載體引入適宜的微生物活細胞系,DNA經過表達和翻譯後,再經提取和純化而製得重組人睫狀神經營養因子。目前已經開發出多種多樣的可用於疏水層析的介質,以及多種多樣的可用於陰離子交換層析的介質,這些介質均是市售可得的。然而,在這些疏水層析介質和陰離子交換層析介質中,本發明的發明人驚奇地發現,丁基-瓊脂糖介質對rhCNTF的選擇性最佳,QHP介質具有優異的核酸和內毒素去除效果,並且當這兩者組合使用時,rhCNTF的純化效果格外突出,不僅純度得到了突破性地提高,純化樣品中的核酸和內毒素的殘餘量也大大減少。rhCNTFnew/CC22在大腸桿菌細胞裡是可溶形式表達的,破碎後獲得的上清混合物中含有大量的宿主蛋白雜質,以及核酸,內毒素等,從中純化出能達到藥用級別純度的rhCNTF/CC22是很大的技術挑戰。在現有技術中,純化所得rhCNTFnew/CC22蛋白的純度能夠達到98%已經達到了最好的水平,並且該純度需要進行至少三種層析或其它複雜的操作才能夠實現,進一步提高此純度將是困難的。策略之一是增加層析的步驟,但這會大大降低收率,將工藝放大以適應工業生產的潛力差。進一步提高rhCNTF/CC22蛋白純度(例如99%以上)將帶來如下的好處:首先,可以提高化學修飾劑與rhCNTFnew/CC22反應的反應效率,此處的反應效率是指反應的專一性和反應的程度(修飾率)。99%以上的純度已經極大地減少雜質蛋白對修飾反應的影響,其專一性的提高不言而喻。此外,由於雜質蛋白的大大減少,rhCNTFnew/CC22蛋白與修飾劑的反應減少了幹擾因素,反應將進行得更加徹底,從而提高了rhCNTFnew/CC22與修飾劑反應基團的接近和碰撞,由此提高發生反應的機率,進而提高修飾率。另外,進一步 提高rhCNTF/CC22蛋白純度有利於簡化後續的rhCNTFnew/CC22修飾產物的純化。以上優點使得本發明工藝在工業生產水平上能夠有效地減少生產成本。丁基-瓊脂糖介質(例如)可以採用美國GE(GEHealthcareLifeSciences)公司的ButylSepharoseHighPerformance和ButylSepharose4FastFlow。QHP介質(例如)可以購自GE公司。在本發明的方法中,所述疏水層析可以採用本領域已知的方法進行,例如,可以在pH為7.9-8.2的條件下進行,優選在pH為8.0的條件下進行。所述陰離子交換層析優選在pH為7.4-7.7的條件下進行,更優選在pH為7.5的條件下進行,緩衝液可以使用(例如)50mMTris-HCl。本領域技術人員可以理解的是,還可以使用其他本領域常用的緩衝液,只要pH滿足上述範圍即可。陰離子交換層析可以採用本領域已知的方法進行。優選的是,本發明所述的方法還包括對所述陰離子交換層析所得的洗脫液進行超濾。超濾可以採用本領域常規的方法進行,例如,可以使用50mMTris-HCl,pH8.0緩衝液,利用5K中空纖維柱(可以購自美國Spectrum公司)對所述洗脫液進行超濾。在本發明的一個具體實施方案中,本發明涉及從能表達重組人睫狀神經營養因子的基因工程用細胞中純化該重組人睫狀神經營養因子。在該情況中,所述至少包含重組人睫狀神經營養因子、核酸以及內毒素的液體混合物為能表達重組人睫狀神經營養因子的細胞的裂解液的上清液。所述能表達重組人睫狀神經營養因子的基因工程用細胞可以為遺傳工程化的原核宿主細胞,也可以為遺傳工程化的真核宿主細胞。所述上清液可以是對宿主細胞的裂解液進行離心而獲得的,例如,通過高壓勻漿破碎表達重組人睫狀神經營養因子的工程菌體後進行離心而獲得。優選的是,所述重組人睫狀神經營養因子具有SEQIDNO:1所示的胺基酸序列。即,該重組人睫狀神經營養因子是通過在重組人睫狀神經營養因子的胺基酸序列的基礎上,保留了第17位的半胱氨酸, 將第63位的穀氨醯胺突變為精氨酸,並且去除了C末端的15個胺基酸而得到的突變體。本發明將該突變體稱為CNTFnew/CC22。CNTFnew/CC22的DNA序列如SEQIDNO:2所示。本發明中優選使用大腸桿菌CNTFnew/CC22工程菌。該工程菌是將編碼CNTFnew/CC22的表達載體pET24a+/CNTFnew/CC22轉化到BL21(DE3)感受態細胞中而製備得到。該工程菌經培養,誘導可表達CNTFnew/CC22。本領域技術人員已知,該過程屬於基因工程領域的常規實驗操作。術語「遺傳工程化」是指通過遺傳工程手段對宿主細胞進行操作,以使其能夠表達目的蛋白。術語「疏水層析」是一種液相吸附層析,它是依據蛋白質分子之間的疏水性的差異來進行蛋白質分離的層析方法。術語「離子交換層析」是一種吸附層析,其根據蛋白質分子之間電荷的差異以及帶電荷蛋白質分子和層析填料上相反電荷之間可逆的相互作用進行蛋白質分離。本發明另一個方面提供了一種製備經化學修飾的重組人睫狀神經營養因子的方法,該方法包括以下步驟:a)利用化學修飾劑對重組人睫狀神經營養因子進行修飾,從而獲得包含修飾型重組人睫狀神經營養因子的混合物,其中所述重組人睫狀神經營養因子為根據本發明第一個方面所述的方法純化得到的。發明人經過反覆摸索,優化了所述步驟a)的反應條件。優選的是,在步驟a)中,所述重組人睫狀神經營養因子以濃度為1-4mg/ml,更優選為2mg/ml的溶液使用,該重組人睫狀神經營養因子與所述化學修飾劑的摩爾比為1:(1-4),更優選為1:2。這樣的反應條件極大地提高了rhCNTF與化學修飾劑的反應率,並且由此使得所進行的修飾不需要進行終止反應,從而省略DTT的使用。這樣為後續純化的質量控制帶來了極大的方便,並且簡化了製備流程。當所述重組人睫狀神經營養因子為上述具有SEQIDNO:1所示的胺基酸序列的重組人睫狀神經營養因子突變體時,利用化學修飾劑對其進行的修飾為定點修飾。該定點修飾是通過在所述的第17位半 胱氨酸上結合化學修飾劑而實現的。定點修飾的方法可採用本領域已知的方法,例如張霖琳等,聚乙二醇單修飾重組人粒細胞集落刺激因子的研究,生物工程學報,2005,21(6)中公開的方法。優選的是,所述步驟a)在4℃下反應12-20小時。所述的化學修飾劑可以使用在蛋白質工程領域中常用的化學修飾劑(包括高分子、聚合物修飾劑等),只要能夠與半胱氨酸的巰基相結合,獲得均一的修飾後產物即可。在本文中,「均一」是指沒有同分異構體,純度在95%以上。優選的是,所述化學修飾劑為聚乙二醇(PEG)或聚乙二醇類聚合物。在本文中,所述的「聚乙二醇類聚合物」指的是聚乙二醇衍生物,在聚乙二醇的應用中,端基起著決定性的作用,不同端基的聚乙二醇具有不同的用途。在實際應用中聚乙二醇高分子鏈端不僅僅局限於帶端羥基,其它反應性更強的功能化基團,如對甲苯磺酸酯基、氨基、羧基、醛基等亦可被引入到聚乙二醇鏈的兩端。這些功能化基團的引入擴大了聚乙二醇的應用範圍,使它在有機合成、多肽合成、高分子合成及藥物的緩釋控釋、靶向施藥等多方面均具有廣闊的應用前景。更優選的是,本發明的用於修飾的聚乙二醇或聚乙二醇類聚合物的分子量為1kD~100kD。優選的是,所述化學修飾為聚乙二醇化修飾,所述修飾劑選自:聚乙二醇、甲氧基聚乙二醇、甲氧基聚乙二醇-琥珀醯亞胺琥珀酸酯、甲氧基聚乙二醇-琥珀醯亞胺碳酸酯、甲氧基聚乙二醇三氟乙基磺酸酯、甲氧基聚乙二醇-丙醛、甲氧基聚乙二醇-琥珀醯亞胺丙酸酯、甲氧基聚乙二醇-琥珀醯亞胺α甲基丁酸酯、甲氧基聚乙二醇-N-羥基琥珀醯亞胺、甲氧基聚乙二醇-馬來醯亞胺或甲氧基聚乙二醇-乙醛;優選為甲氧基聚乙二醇-馬來醯亞胺。此外,優選的是,所述方法還包括:b)對所述包含修飾型重組人睫狀神經營養因子的混合物進行陰離子交換層析,以獲得陰離子層 析洗脫液。所述陰離子交換層析所採用的介質優選為QHP,其可以進一步提高修飾型rhCNTF的純度,為後續的凍幹操作做好準備。陰離子交換層析可以採用本領域已知的方法進行。優選的是,所述方法還包括:c)對所得陰離子層析洗脫液進行超濾。超濾可以採用本領域常規的方法進行。以下通過例子的方式進一步解釋或說明本
發明內容,但這些例子不應被理解為對本發明保護範圍的限制。製備例1:CNTF突變體(CNTFnew/CC22)的全基因序列合成全基因序列合成重組人睫狀神經營養因子的DNA序列SEQIDNO:2,其編碼的胺基酸序列為SEQIDNO:1。其中,重組人睫狀神經營養因子為保留原始人源CNTF胺基酸序列的第17位Cys,並將其中第63位穀氨醯胺突變成精氨酸,去除C末端的15個胺基酸形成新的CNTF突變體(CNTFnew/CC22)。CNTFnew/CC22的全基因序列合成可由上海捷瑞生物工程有限公司完成。製備例2:CNTFnew/CC22表達載體的構建與工程菌的鑑定全基因序列合成後,取合成片段5μL(20ng/μL),加入限制性內切酶NedI1μL(10U/μL)和EcorI1μL(15U/μL)(上述限制性內切酶購於TAKARA公司)。加入限制性內切酶緩衝液2μL,加雙蒸水11μL,成為20μL體系。37℃水浴,酶切1小時。同時,取pET24a+質粒(購於Novagen公司)5μL(100ng/μL),加入相同的限制性內切酶NedI1μL(10U/μL)和EcorI1μL(15U/μL)(限制性內切酶購於TAKARA公司),加雙蒸水11μL,成為20μL體系。37℃水浴,酶切1小時,以酶切載體pET24a+。酶切完成後,進行1%的瓊脂糖凝膠電泳。切割下帶有目的條帶(CNTF條帶約500bp)的膠,利用瓊脂糖凝膠回收試劑盒(購於天根生化科技有限公司)對酶切後的目的片段和載體片段進行回收。取酶切後的合成目的片段5μL(10ng/μL)、酶切後的載體pET24a+5μL(50ng/μL),加入1μL用(350U/μL)T4DNA連接酶(購於TAKARA公司),加入10×連接酶緩衝液2μL(為混合液,TAKARA公司的配方,Tris-HCl(pH7.6)660mM,MgCl266mM,DTT100mM,ATP1mM),加入雙蒸水7μL,成為20μL的連接反應體系。16℃連接過夜。連接成表達載體,命名為pET24a+/CNTFnew/CC22。圖1示意性地示出了該CNTF突變體表達載體的構建過程。(2)將表達載體pET24a+/CNTFnew/CC22轉化到感受態細胞BL21(DE3)中,製備出CNTFnew/CC22工程菌不含抗生素的LB液體培養基配方:胰蛋白腖(Tryptone)10g/L,酵母提取物(Yeastextract)5g/L,氯化鈉(NaCl)10g/L。含50μg/ml卡那黴素的LB固體培養基:胰蛋白腖(Tryptone)10g/L,酵母提取物(Yeastextract)5g/L,氯化鈉(NaCl)10g/L,卡那黴素50mg/L。具體步驟:取連接後的表達載體pET24a+/CNTFnew/CC22共2μL,加入到一支(100μl/支)感受態細胞BL21(DE3)(購於天根生化科技有限公司)中,輕敲後放置於冰上30分鐘,42℃水浴熱激60秒後,迅速置於冰上2分鐘。加入不含抗生素的LB液體培養基300μL,至於搖床中,37℃、200轉/分鐘培養1小時。經過培養後的菌液塗於含50μg/ml卡那黴素的LB固體培養基平板上,於37℃培養箱中過夜培養,得到帶有pET24a+/CNTFnew/CC22質粒的單個菌落。取單個菌落,接種到5mlLB液體培養基(含50μg/ml卡那黴素)中,37℃、200轉/分鐘過夜培養。得到工程菌,命名為CNTFnew/CC22工程菌。(3)經過PCR鑑定、雙酶切鑑定、全基因序列測定三種方法確定CNTFnew/CC22工程菌中包含有目的蛋白CNTFnew/CC22的編碼序列(SEQIDNO:2)。PCR鑑定過程:取過夜培養的CNTFnew/CC22工程菌的菌液1μL(OD3-4),加入引物1(序列為:ATGGCTTTCACAGAGCATTC)為1μL(10μM),引物2(序列為:GTCATGGATGGACCTTACTG) 為1μL(10μM),DNA聚合酶為1μL(2.5U/μL),2×PCR緩衝液10μL,雙蒸水6μL,成為20μL的PCR反應體系。放入PCR儀中,溫度循環為:第一步:94℃5分鐘。第二步:94℃30秒、55℃30秒、72℃1分鐘,共30個循環。第三步:72℃10分鐘。第四步:4℃恆溫後取出。PCR結束後對樣品進行1%的瓊脂糖凝膠電泳,觀察結果。PCR鑑定的結果參見圖2,其中,M為DNAMarker;1為陰性對照;2-9分別為隨機挑選的8個CNTFnew/CC22工程菌的菌落的結果。PCR鑑定結果:隨機挑取的8個工程菌菌落均為陽性菌落。雙酶切鑑定過程:取過夜培養的CNTFnew/CC22工程菌的菌液5ml(OD3-3.5),利用質粒小量提取試劑盒(購於Axeygen公司)提取質粒。取提取的質粒5μL(100ng/μL),限制性內切酶NedI10U/μL和EcorI各1μL(15U/μL),限制性內切酶緩衝液2μL,雙蒸水11μL,成為20μL的雙酶切體系,於37℃水浴,酶切1小時,之後進行1%的瓊脂糖凝膠電泳,觀察結果。雙酶切鑑定的結果參見圖3,其中,M為DNAMarker;1-8分別為隨機挑選的8個CNTFnew/CC22工程菌菌落的結果;9為陰性對照。雙酶切鑑定結果:隨機挑取的8個工程菌菌落均為陽性菌落。CNTFnewCC22的全基因序列測定由北京諾賽基因組研究中心完成。CNTFnewCC22的全基因序列測定結果見圖4。全基因序列測定結果:與事先設計併合成的序列一致。製備例3:目的蛋白CNTFnew/CC22的表達1)製備LB瓊脂平板:胰蛋白腖10g、酵母提取物5g、NaCl5g,瓊脂10g、加水定容至1L,高溫高壓滅菌,當溫度降到50℃左右時加入卡那黴素,至終濃度為50μg/ml,取20ml倒培養皿,凝固後即成LB瓊脂平板。2)培養CNTFnew/CC22工程菌:將CNTFnew/CC22工程菌劃線接種於LB瓊脂平板,37℃培養過夜。從培養基過夜的LB平板上挑選生長狀態良好的單個菌落,接種於含LB的試管中,37℃培養10h。 然後轉種至含有200mlLB液體培養液(胰蛋白腖10g、酵母提取物5g、NaCl5g,加水定容至1L,高壓滅菌,分裝三角瓶,每瓶200ml)的三角瓶中,37℃培養過夜製得種子液。將種子液按1%比例接種於含30L2YT培養液的50L發酵罐中,發酵培養基為2YT(胰蛋白腖480g、酵母提取物300g、NaCl50g,加入蒸餾水溶解,5NNaOH調節PH至7.0,定容到30L,0.12Mpa、121℃、30min,高壓滅菌)。控制發酵溫度37℃、轉速250-450r/min、通氣量30-50L/min、pH7.3,培養至A600=1.2左右後,加入異丙基硫代-β-D-半乳糖苷(IPTG)至終濃度為1.0mM進行誘導。繼續培養4.5小時,終止發酵,收集菌體,儲存於-30℃冰箱中備用。取表達目的蛋白後的菌體,進行SDS-PAGE電泳,觀察目的蛋白CNTFnew/CC22的表達結果見圖5,其中,M為蛋白質marker;1為陰性對照;2-9分別為隨機挑選的8個CNTFnew/CC22工程菌菌落的結果。實施例1:目的蛋白CNTFnew/CC22的純化將按製備例3的方法得到的發酵菌體,按1:10比例加入50mMTris-HCl,pH8.0,高壓勻漿破碎,操作條件:1000bar,溫度控制在8℃以下。3次循環,10,000rpm,4℃離心30分鐘,收集上清進行分離純化。首先採用疏水層析,所選用的介質為丁基-瓊脂糖介質(購自美國GE公司,ButylSepharoseHighPerformance),層析柱為XK50/10。選用50mMTris-HCl,pH8.0,1M(NH4)2SO4的緩衝液平衡層析柱,300ml(濃度為6.65mg/ml)的破碎上清中加入終濃度為1M硫酸銨後上樣,用平衡緩衝液淋洗1個柱體積,隨後採用梯度洗脫,5個柱體積內將緩衝液置換為50mMTris-HCl,pH8.0。收集洗脫峰,調pH7.5,用50mMTris-HCl,pH7.5緩衝液透析脫鹽,脫鹽後樣品採用陰離子交換介質QHP(購自美國GE公司,QSepharoseHighPerformance),柱子為XK50/10,進行精製純化,上樣量為450ml(濃度為0.26mg/ml);平衡緩衝液A為50mMTris-HCl,pH7.5,洗脫液B為50mMTris-HCl,1MNaC,pH7.5,10%(體積)B梯度洗脫獲得目的蛋白洗脫峰。所 得純化樣品進行超濾濃縮換液,使用5K中空纖維柱(購自美國Spectrum公司),緩衝液換為50mMTris-HCl,pH8.0。所得rhCNTF純度可達99%以上。純化結果見圖6:A為CNTFnew/CC22蛋白SDS-PAGE電泳圖,其中左道為蛋白質分子量標準,右道為CNTFnew/CC22蛋白;B為反相高效液相色譜(島津LC20AT,資生堂C8柱,緩衝液A:0.1%TFA/水,緩衝液B0.1%TFA/乙腈,洗脫梯度為50%-60%,30分鐘)檢測CNTFnew/CC22蛋白純度的結果,純度均達到99%以上(峰面積歸一法,反相HPLC檢測數據如下表所示)。檢測器ACh1220nm峰#保留時間面積高度面積%高度%111.8004216112810.1170.189214.8753600985067518299.74699.570319.0073138010070.0870.148420.05448371850.0130.027522.018133824410.0370.065總計36101609678096100.000100.000實施例2:目的蛋白CNTFnew/CC22的純化將按製備例3的方法得到的發酵菌體,按1∶10比例加入50mMTris-HCl,pH8.0,高壓勻漿破碎,操作條件:1000bar,溫度控制在8℃以下。3次循環,10,000rpm,4℃離心30分鐘,收集上清進行分離純化。首先採用疏水層析,所選用的介質為丁基-瓊脂糖介質(購自美國GE公司,ButylSepharoseHighPerformance),層析柱為XK50/10。選用50mMTris-HCl,pH8.0,1M(NH4)2SO4的緩衝液平衡層析柱,300ml(濃度為6.65mg/ml)破碎上清中加入終濃度為1M硫酸銨後上樣,用平衡緩衝液淋洗1個柱體積,隨後採用梯度洗脫,5個柱體積內將緩衝液置換為50mMTris-HCl,pH8.0。收集洗脫峰,調pH7.5,用50mMTris-HCl,pH7.5緩衝液透析脫鹽,脫鹽後樣品採用陰離子交換介質QHP(購自美國GE公司,QSepharoseHighPerformance),柱子為XK50/10,進行精製純化(具體操作同實施例1),上樣量為450ml(濃度為0.26mg/ml)。所得rhCNTF樣品,HPLC測定(島津LC20AT,資生堂C8柱,緩衝液A:0.1%TFA/水,緩衝液B0.1%TFA/ 乙腈,洗脫梯度為50%-60%,30分鐘)純度達到98.3%。純度檢測結果見圖23,數據表如下檢測器ACh1220nm峰#保留時間面積高度面積%高度%111.5623844413300.1070.172213.7253718820960.1040.271314.6793518110275335898.31597.387416.19219137071230.5350.921516.69217888949870.5000.645618.809249447280.0700.094721.82413201139530.3690.511總計35783947773575100.000100.000對比例1:目的蛋白CNTFnew/CC22的純化將按製備例3方法得到的發酵菌體,按1∶10比例加入50mMTris-HCl,pH8.0,高壓勻漿破碎,操作條件:1000bar,溫度控制在8℃以下。3次循環,10,000rpm,4℃離心30分鐘,收集上清進行分離純化。首先採用疏水層析,所選用的介質為辛基-瓊脂糖介質(購自美國GE公司,OctylSepharose4fastflow,層析柱為XK50/10)。選用50mMTris-HCl,pH8.0,1M(NH4)2SO4的緩衝液平衡層析柱,600ml(濃度為6.34mg/ml)破碎上清中加入1M硫酸銨後上樣,用平衡緩衝液淋洗1個柱體積,隨後採用梯度洗脫,5個柱體積內將緩衝液置換為50mMTris-HCl,pH8.0。收集洗脫峰,調pH5.0,用50mM乙酸-乙酸鈉,pH5.0緩衝液透析脫鹽,脫鹽後,460ml濃度為0.22mg/ml的樣品採用陽離子交換介質CMFF(得自GE公司,CM4FastFlow),柱子為XK50/10進行精製純化,平衡緩衝液A為50mMTris-HCl,pH8.0;洗脫緩衝液B為50mMTris-HCl,1MNaCl,pH8.0。10%(體積)B進行梯度洗脫。所得rhCNTFnew/CC22經HPLC(島津LC20AT,資生堂C8柱,緩衝液A:0.1%TFA/水,緩衝液B0.1%TFA/乙腈,洗脫梯度為50%-60%,30分鐘)測定純度為95.4%。試驗例1:不同疏水層析介質的純化效果比較按照實施例1的方法破碎發酵菌體,然後利用辛基瓊脂糖介質(購自美國GE公司,OctylSepharose4fastflow)丁基-瓊脂糖介質 (購自美國GE公司,ButylSepharoseHighPerformance)和苯基-瓊脂糖介質(購自GE公司,PhenylSepharoseHighPerformance)分別對破碎上清進行疏水層析純化。疏水層析操作按照實施例1中所述的方法進行。具體而言:以50mMTris-HCl,pH8.0,1M(NH4)2SO4的緩衝液平衡層析柱,破碎上清中加入1M硫酸銨後上樣,用平衡緩衝液淋洗1個柱體積,隨後採用梯度洗脫,5個柱體積內將緩衝液置換為50mMTris-HCl,pH8.0,收集洗脫峰,在相同條件下進行SDS-PAGE分析。由圖7可知,採用丁基-瓊脂糖介質時,流穿的雜蛋白最多,辛基-瓊脂糖介質和苯基-瓊脂糖介質流穿的雜蛋白較少。這說明丁基-瓊脂糖介質對目的蛋白CNTF/CC22new的選擇性比辛基-和苯基-瓊脂糖介質好。試驗例2:陽離子交換層析CMFF介質與陰離子交換層析QHP介質、QFF介質的純化效果比較按照實施例2的方法進行純化,獲得QHP純化的樣品;按照實施例2的方法進行純化,只是將QHP介質換成QFF介質,獲得QFF純化樣品;按照對比例1方法進行純化,獲得CMFF純化樣品。對以上三種純化樣品按照《中國藥典》第三部2010版推薦的螢光染色法進行測定其核酸殘餘量,進而比較這三種介質對核酸殘餘的去除效果。方法簡述如下:用TE緩衝液配製標準品溶液、CMFF純化樣品溶液,QHP純化樣品溶液和QFF純化樣品溶液,其中,標準品由螢光染料試劑盒(Quant-iTTMdsDNAAssayKit)提供。CMFF純化樣品中CNTFnew/CC22蛋白濃度為2.13mg/ml,反相高效液相色譜(島津LC20AT,資生堂C8柱,緩衝液A:0.1%TFA/水,緩衝液B0.1%TFA/乙腈,洗脫梯度為50%-60%,30分鐘)測定純度為95.4%;QHP純化樣品CNTFnew/CC22濃度為2.96mg/ml,反相高效液相色譜(測定條件同上)測定純度為98.3%,QFF純化樣品CNTFnew/CC22濃度為2.83mg/ml,反相高效液相色譜(測定條件同上)測定純度為97.1%。將DNA標準品溶液、CMFF純化樣品溶液,QHP純化樣品溶液, 和QFF純化樣品溶液分別加入黑色96孔酶標板中,每孔125μl,每個樣品做3個復孔。每孔再加入125μl新配製的雙鏈DNA螢光染料(按試劑盒Quant-iTTMdsDNAAssayKit說明書配製),避光混勻後靜置5分鐘。用螢光酶標儀InfiniteM200pro(廠家:Tecan)在激發波長480nm、發射波長520nm處測定螢光強度。以TE緩衝液測得的螢光強度為本底,記算各孔的螢光強度。以標準品溶液的濃度對其相應的螢光強度作直線回歸,求得直線回歸方程(r2>0.99)。將供試品溶液的螢光強度代入直線回歸方程,求出各供試品中的宿主細胞DNA殘留量(單位:ng/ml),如下表。供試品平均核酸殘餘(ng/ml)QHP純化樣品8.25QFF純化樣品17.31CMFF純化樣品302.51由結果可以看出,陰離子交換層析QHP介質的核酸殘餘去除效果最好。試驗例3:將按製備例3方法得到的發酵菌體,按1:10比例加入50mMTris-HCl,pH8.0,高壓勻漿破碎,操作條件:1000bar,溫度控制在8℃以下。3次循環,10,000rpm,4℃離心30分鐘,收集上清進行分離純化。首先採用疏水層析,所選用的介質為丁基-瓊脂糖介質(購自美國GE公司,ButylSepharoseHighPerformance,層析柱為XK50/10)。選用50mMTris-HCl,pH8.0,1M(NH4)2SO4的緩衝液平衡層析柱,300ml(濃度為6.13mg/ml)破碎上清中加入1M硫酸銨後上樣,用平衡緩衝液淋洗1個柱體積,隨後採用梯度洗脫,5個柱體積內將緩衝液置換為50mMTris-HCl,pH8.0。收集洗脫峰,調pH5.0,用50mM乙酸-乙酸鈉,pH5.0緩衝液透析脫鹽,脫鹽後,450ml濃度為0.25mg/ml的樣品採用陽離子交換介質CMFF(得自GE公司,CM4FastFlow),柱子為XK50/10進行精製純化(具體操作同實施例1),所得 rhCNTFnew/CC22經HPLC(島津LC20AT,資生堂C8柱,緩衝液A:0.1%TFA/水,緩衝液B0.1%TFA/乙腈,洗脫梯度為50%-60%,30分鐘)測定純度為96.9%。試驗例4:將按製備例3方法得到的發酵菌體,按1:10比例加入50mMTris-HCl,pH8.0,高壓勻漿破碎,操作條件:1000bar,溫度控制在8℃以下。3次循環,10,000rpm,4℃離心30分鐘,收集上清進行分離純化。首先採用疏水層析,所選用的介質為辛基-瓊脂糖介質(購自美國GE公司,OctylSepharose4fastflow,層析柱為XK50/10)。選用50mMTris-HCl,pH8.0,1M(NH4)2SO4的緩衝液平衡層析柱,300ml(濃度為6.34mg/ml)破碎上清中加入1M硫酸銨後上樣,用平衡緩衝液淋洗1個柱體積,隨後採用梯度洗脫,5個柱體積內將緩衝液置換為50mMTris-HCl,pH8.0。收集洗脫峰,調pH7.5,用50mMTris-HCl,pH7.5緩衝液透析脫鹽,脫鹽後樣品採用陰離子交換介質QHP(購自美國GE公司,QSepharoseHighPerformance),柱子為XK50/10,進行精製純化(具體操作同實施例1),上樣量為450ml(濃度為0.26mg/ml)。所得rhCNTF樣品,HPLC測定(島津LC20AT,資生堂C8柱,緩衝液A:0.1%TFA/水,緩衝液B0.1%TFA/乙腈,洗脫梯度為50%-60%,30分鐘)純度達到96.8%。試驗例5:CNTFnew/CC22蛋白的N端15個胺基酸序列測定序列比對為將CNTFnew/CC22蛋白的N端15個胺基酸序列與人源CNTF的N端測序結果進行比對,測定結果見圖8,結果說明CNTFnew/CC22蛋白的N端15個胺基酸序列的測序結果與預先設計完全相同。試驗例6:CNTFnew/CC22蛋白的體外活性鑑定TF-1CN5a1細胞是一個依賴於GM-CSF的細胞系,其細胞表面具有rhCNTF高親和力受體,所以CNTF能促進TF-1CN5a1細胞的 增殖。將不同濃度的CNTFnew/CC22加入TF-1CN5a1細胞培養物中,觀察細胞的生長情況,以測定CNTFnew/CC22體外活性,具體方法如下:將TF-1CN5a1細胞(購自美國ATCC,貨號為CRL-2512TM),常規培養於GM-CSF條件(100mlRPMI1640中含有500ng的GM-CSF)的培養液中,實驗時收集對數生長期的細胞,用無血清的RPMI1640(購自invitrogen公司)洗液洗滌3遍,然後用10%小牛血清RPMI1640培養液調整細胞數為1.0×106,每孔加50μl細胞懸液,使用實施例1中獲得的CNTFnew/CC22蛋白從初始濃度10μg/ml按4倍系列稀釋後,每孔加入50μl。以50μl無血清RPMI1640培養基作為陰性對照,以CNTF標準品(購自英國國家生物製品檢定所NIBSC,貨號:94/684)為陽性對照,初始濃度為200ng/ml,進行4倍系列稀釋後,每孔加入50μl。培養板在37℃、5%CO2條件下培養48h後,每孔加入50mg/ml的WST-8(購自碧雲天生物技術研究所。貨號:NIBSC94/684)溶液20μl,繼續培養4h後,混勻後在酶標儀上比色,測定波長為570nm,參比波長為630nm。每個實驗結果均重複3次,最後取3次實驗的平均結果。結果:實施例1獲得的CNTFnew/CC22蛋白的體外活性:5.43×106IU/mg。實驗同時設置了未突變的重組人睫狀神經營養因子對照組(購自sigma,C3710-10UG),實驗結果證實未突變的重組人睫狀神經營養因子的體外活性約為7.25×104IU/mg,經過定點突變的重組人睫狀神經營養因子突變體的生物學活性高於未突變的天然分子。試驗例7:CNTFnew/CC22在小鼠體內活性的測定實驗用小鼠使用雄性昆明鼠(得自北京維通利華實驗動物技術有限公司),體重18-22g。分為CNTF標準品陽性對照組、生理鹽水陰性對照組和CNTFnew/CC22處理組,每組8隻。陽性對照為用生理鹽水溶解的CNTF標準品(購自英國國家生物製品檢定所。貨號:NIBSC94/684),處理組為CNTFnew/CC22純品凍乾粉劑(實施例1 所得蛋白進一步凍幹所得),同樣以生理鹽水溶解並稀釋為100μg/ml。以每隻小鼠100μg/kg/天的量進行皮下注射。陰性對照即生理鹽水。注射前分別稱量每組每隻小鼠的體重。連續五天給藥,稱量小鼠的體重並觀察其變化。(1)流程如下表1:表1.CNTF對小鼠減重作用測定流程註:實驗時間以給藥前一天為-1天,首次給藥當天為0天。△:根據前一操作完成情況,可提前或推後,但儘量保持每天在同一時間。(2)測量指標:體重變化率體重變化率=(某組給藥後體重-某組給藥前體重)/給藥前體重×100%體重增長抑制率(%)=(對照組某日體重-對照組d0體重)-(受試組某日體重-該組d0體重)/(對照組某日體重-對照組d0體重)×100%小鼠體重變化結果見表2:表2小鼠體重變化表由表2可知:三組皮下注射後的小鼠,體重均有所增長,但是樣品組的小鼠體重增長低於陰性對照組(p<0.05),同時低於陽性對照(p<0.05)(CNTF標準品)組。(2)小鼠體重增長抑制率見下表3:表3小鼠體重增長抑制率由表3可知CNTFnew/CC22體重增長抑制率高於陽性對照(CNTF標準品)的體重增長抑制率。試驗例8:CNTFnew/CC22蛋白的免疫反應性以CNTF的單克隆抗體作為特異性抗體進行蛋白質免疫印跡實驗,研究免疫反應性。用CNTF的單克隆抗體(購自Abcam公司)作為一抗,以辣根過氧化物酶標記的羊抗鼠IgG(購自abcam公司)作為酶標二抗。首先將實施例1獲得的CNTFnew/CC22蛋白做SDS-PAGE電泳,分離膠濃度為12%,濃縮膠濃度為4%,上樣量為15μl,恆壓110V,電泳1.5小時,終止電泳,將凝膠轉入硝酸纖維膜(NC膜)上,分別 與一抗和二抗孵育後顯色。圖9所示的CNTFnew/CC22蛋白免疫印跡電泳圖結果顯示CNTFnew/CC22蛋白能夠與CNTF的單克隆抗體特異性結合,說明本發明的CNTFnew/CC22蛋白仍具有與天然CNTF相似的免疫反應性。本發明的修飾型CNTF蛋白在位點突變後沒有改變蛋白與特異抗體結合的能力。實施例3:CNTFnew/CC22蛋白的修飾本實施例中利用支鏈Y-40K-MAL-mPEG對實施例1獲得的CNTFnew/CC22蛋白進行修飾。1)Y-40K-MAL-mPEG修飾的CNTFnew/CC22蛋白的製備支鏈40KD的MAL-mPEG購於北京鍵凱科技有限公司。商品代號:Y-MAL-40K。分子式見下:CNTFnew/CC22蛋白與MAL-mPEG分子結合的示意圖可以參考圖10,具體方法如下:將純化的CNTFnew/CC22蛋白濃度調整為2mg/ml,按蛋白:修飾劑為1:2的摩爾比加入分子量為40KD的支鏈馬來醯亞胺-聚乙二醇修飾劑(即Y-40K-MAL-mPEG),4℃反應12小時。2)Y-40K-MAL-mPEG對CNTFnewCC22蛋白的修飾結果將上述方法獲得的用Y-40K-MAL-mPEG修飾的修飾型CNTFnew/CC22蛋白進行SDS電泳,結果見圖11,其中,M為蛋白質marker;1為用Y-40K-MAL-mPEG修飾後的CNTFnew/CC22蛋白,命名為Y-40K-MAL-mPEG-CNTFnew/CC22。試驗例9:不同純度CNTFnew/CC22蛋白進行Y-40K-MAL-mPEG修飾的修飾率比較以實施例1獲得的純度為99%的CNTFnew/CC22蛋白(反應1)和對比例1獲得的純度為95.4%的CNTFnew/CC22蛋白(反應2)分別按照實施例3所描述的方法進行修飾反應。反應後的修飾混合物使 用分子排阻層析測定修飾反應的修飾率:使用10/300GLSuperdex200分子排阻層析柱(購自GE公司),緩衝液為50mMTris-HCl,pH8.0。結果見圖17以及表4。圖17A為反應1的修飾率測定結果,圖17B為反應2的修飾率測定結果。圖17A中保留時間為11.83的峰以及圖17B中保留時間為12.45的峰為修飾產物峰,圖17A中保留時間為17.87的峰以及圖17B中保留時間為18.05的峰為CNTFnew/CC22蛋白峰。修飾率的計算是由總峰面積減去CNTFnew/CC22蛋白峰面積所得(見下面的分子排阻色譜結果數據表)。表4為修飾率測定結果匯總。表4不同純度CNTFnew/CC22對修飾率的影響修飾反應CNTFnew/CC22純度修飾率199%93.9%295%87.6%實施例4-11:CNTFnew/CC22蛋白的修飾按照實施例3所述的方法對實施例1獲得的CNTFnew/CC22蛋白進行修飾,不同之處在於:改變了所用的CNTFnew/CC22蛋白的濃度、以及蛋白:修飾劑的比例。按照試驗例9的方法測定修飾率。修飾條件和修飾結果請參見表5。表5CNTFnew/CC22蛋白的修飾條件和修飾結果實施例12:Y-40K-MAL-mPEG-CNTFnew/CC22蛋白的純化採用陰離子交換介質QHP(購自美國GE公司,型號:Hiprep16/10QHP)對實施例3獲得的Y-40K-MAL-mPEG-CNTFnew/CC22進行純化。所採用的平衡緩衝液為50mMTris-HCl,pH8.0,5個柱體積內用緩衝液B(50mMTris-HCl,pH8.0,1MNaCl)進行梯度洗脫,收集洗脫峰。所得洗脫峰收集液使用30K中空纖維柱(購自美國spectrum公司)進行超濾濃縮,緩衝液為50mMTris-HCl,pH8.0,從而獲得最後的純品。進行SDS-PAGE電泳以及使用反相高效液相色譜(島津LC20AT,資生堂C8柱,緩衝液A:0.1%TFA/水,緩衝液B0.1%TFA/乙腈,洗脫梯度為50%-60%,30分鐘)進行純度分析。結果見圖12-14。圖12為修飾反應混合物經QHP純化層析的結果圖,其中,P0為修飾反應混合物的流穿峰;P1為修飾型CNTFnew/CC22的洗脫峰;P2為雜質洗脫峰。圖13為圖12中所收集的各峰的相同條件下的SDS-PAGE電泳圖,其中,1為marker;2為純化前,含修飾型CNTFnew/CC22的修飾反應混合物;3為QHP純化層析所收集的P0峰;4為QHP純化層析所收集的P1峰;5為QHP純化層析所收集的P2峰。如圖14所示,純化的Y-40K-MAL-mPEG-CNTFnew/CC22經反相高效液相色譜檢測其純度約達到99%以上(峰面積歸一化法,反相HPLC檢測數據如下表所示)。檢測器ACh1220nm峰#保留時間面積高度面積%高度%16.617244315600.0910.13728.9922676764440662599.90999.863總計26792075407184100.000100.000試驗例10:Y-40K-MAL-mPEG-CNTFnew/CC22的免疫反應性以CNTF的單克隆抗體作為特異性抗體進行蛋白質免疫印跡實驗,研究免疫反應性。用CNTF的單克隆抗體(購自Abcam公司)作為一抗,用辣根過氧化物酶標記的羊抗鼠IgG(購自abcam公司)作為酶標二抗。首先將實施例1獲得的CNTFnew/CC22蛋白和實施例12獲得的修飾物Y-40K-MAL-mPEG-CNTFnew/CC22進行SDS-PAGE電泳,分離膠濃度為12%,濃縮膠濃度為4%,上樣量為10μg,恆壓120V,電泳1.5小時,終止電泳,將凝膠轉入硝酸纖維膜(NC膜)上,分別與一抗和二抗孵育後顯色。結果如圖22所示,泳道1為Marker,泳道2為Y-40K-MAL-mPEG-CNTFnew/CC22,泳道3為CNTFnew/CC22蛋白。結果顯示Y-40K-MAL-mPEG-CNTFnew/CC22與CNTFnew/CC22蛋白均能夠與CNTF的單克隆抗體特異性結合,說明本發明的CNTFnew/CC22蛋白及其修飾物Y-40K-MAL-mPEG-CNTFnew/CC22仍具有與天然CNTF相似的免疫反應性。本發明的修飾型CNTF蛋白在位點突變及mPEG修飾後沒有改變蛋白與特異抗體結合的能力。試驗例11:支鏈Y-40K-MAL-mPEG對CNTFnew/CC22蛋白進行修飾的修飾位點的確定對按實施例1方法得到的原蛋白CNTFnew/CC22、以及按實施例3的方法進行修飾並按實施例12的方法進行純化而得到的Y-40K-MAL-mPEG-CNTFnew/CC22進行胰蛋白酶酶切,以確定修飾產物的修飾位點。用5mL脫鹽柱(購自美國GE公司,型號HitrapDesalting),將原蛋白及修飾產物分別脫鹽至含2M脲的50mMNH4HCO3緩衝液中,收取峰尖,按質量比1∶50加入胰蛋白酶(購自美國sigma公司),37℃反應過夜(12小時),加入1%TFA(三氟乙 酸)終止。酶切樣品採用資生堂C18反相柱,洗脫梯度為5%-95%,60分鐘,檢測波長為214nm的條件下進行反相HPLC檢測。酶切樣品的反相圖譜參見圖15。上圖為Y-40K-MAL-mPEG-CNTFnew/CC22酶切樣品反相圖譜,下圖為CNTFnew/CC22酶切樣品反相圖譜。上下兩圖相比,上圖多了PEG化多肽(PEGylationPeptide)峰,少了DLCSR肽段峰(DLCSR肽段由D,L,C,S,R這五種胺基酸殘基組成,該肽段含有理論上的唯一修飾位點C,半胱氨酸),而下圖情況相反,多了DLCSR峰,少了PEG化多肽峰。由此可以看出,原蛋白CNTFnew/CC22與Y-40K-MAL-mPEG-CNTFnew/CC22的反相圖譜基本一致。原蛋白消失峰和修飾樣品新出現峰的一級質譜圖未能確認是否含C17的肽段。因此進一步通過離子流分析確定修飾發生的位點。根據原蛋白的胺基酸序列,得出理論上含C17的胰蛋白酶切片段為DLCSR(為蛋白分子從第15位到19位的胺基酸肽段),理論m/z=593。利用質譜分析軟體,分別提取原蛋白和修飾樣品的m/z593離子流圖以及對應的一級質譜,其分別為圖16所示的Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22中m/z593的提取離子流圖(分別為圖中的1和2)和一級質譜圖(分別為圖中的3和4)。可以看到,在原蛋白的酶切樣品中,對應於m/z593肽段離子流的洗脫峰保留時間為8.25分鐘,其一級質譜的分子量為593.2,與DLCSR的理論分子量一致,說明原蛋白中含有DLCSR的片段。在修飾樣品中,無8.25分鐘的洗脫峰,雖然對應m/z593肽段出現保留時間為29.7分鐘的洗脫峰,但其一級質譜不能得出明確分子量(荷質比),表明該洗脫峰不是m/z593片段。據此對比,得出修飾反應發生在含DLCSR肽段上,根據馬來醯亞胺修飾劑與半胱氨酸巰基發生特異性反應的特徵,確定修飾反應發生在DLCSR肽段的C17上。試驗例12:修飾後蛋白體外活性的測定TF-1CN5a1細胞是一個依賴於粒細胞-巨噬細胞集落刺激因子(GM-CSF)的細胞系,其細胞表面具有rhCNTF高親和力受體,所 以CNTF能促進TF-1CN5a1細胞的增殖。將不同濃度的Y-40K-MAL-mPEG-CNTFnew/CC22加入TF-1CN5a1細胞培養物中,觀察細胞的生長情況,以測定Y-40K-MAL-mPEG-CNTFnew/CC22體外活性,具體方法如下:將TF-1CN5a1細胞(購自美國ATCC,貨號為CRL-2512TM)常規培養於GM-CSF條件(100mlRPMI1640中含有500ng的GM-CSF(購自PEPROTECH公司,貨號300-03)的培養液中。實驗時收集對數生長期的細胞,用無血清的RPMI1640(購自invitrogen公司)洗液洗滌3遍。然後用10%小牛血清RPMI1640培養液調整細胞數為1.0×106,96孔板的每孔加50μl細胞懸液。使用按實施例12方法得到的純化的修飾型產物Y-40K-MAL-mPEG-CNTFnew/CC22,將其從10μg/ml按4倍系列稀釋後,每孔加入50μl。以50μl無血清RPMI1640培養基作為陰性對照,以CNTF標準品(未進行突變和修飾,購自英國國家生物製品檢定所NIBSC,貨號:94/684)為陽性對照。CNTF標準品初始濃度為200ng/ml,進行4倍系列稀釋後,每孔加入50μl。培養板在37℃、5%CO2條件下培養48h後,每孔加入50mg/ml的WST-8(購自碧雲天生物技術研究所。貨號:NIBSC94/684)溶液20μl,繼續培養4h。混勻後在酶標儀上比色,測定波長為570nm,參比波長為630nm。每次實驗結果均重複3次,最後結果取3次實驗的平均結果。結果如下:用Y-40K-MAL-mPEG修飾的CNTFnew/CC22蛋白體外活性平均值為:3.57×106IU/mg。陽性對照CNTF的體外活性平均值為:0.8×106IU/mg。上述結果說明Y-40K-MAL-mPEG修飾後,經過定點突變的重組人睫狀神經營養因子突變體的體外生物學活性一定程度的降低,修飾產物活性保留率為65.7%,但其體外活性均遠高於陽性對照組(p<0.05)。試驗例13:Y-40K-MAL-mPEG-CNTFnew/CC22和 CNTFnew/CC22的大鼠體內藥代動力學測定實驗使用Wistar大鼠(購自北京維通利華實驗動物技術有限公司)體重200g,實施例12獲得的Y-40K-MAL-mPEG-CNTFnew/CC22和實施例1獲得的CNTFnew/CC22各自通過靜脈注射和皮下注射兩種方式給藥,注射劑量均為200μg/kg。用雙抗體夾心ELISA法測定大鼠血清中的血藥濃度,用DAS藥動學統計軟體進行血藥濃度-時間曲線擬合及藥動學參數計算。結果見圖18和表6。大鼠靜脈注射200μg/kgCNTFnew/CC22或Y-40K-MAL-mPEG-CNTFnew/CC22的藥動學特徵均符合二室開放模型,CNTFnew/CC22的半衰期t1/2β為0.74±0.12小時,平均滯留時間MRT0-t(h)為0.44±0.02小時;而Y-40K-MAL-mPEG-CNTFnew/CC22的半衰期t1/2β為12.70±0.47小時,平均滯留時間MRT0-t(h)為16.63±0.57小時,這兩項參數分別延長了17倍和38倍。大鼠皮下注射200μg/kgCNTFnew/CC22或Y-40K-MAL-mPEG-CNTFnew/CC22的藥動學特徵符合一室開放模型。與CNTFnew/CC22皮下注射的藥代參數相比較,Y-40K-MAL-mPEG-CNTFnew/CC22的半衰期和平均滯留時間顯著延長,分別增加了16倍和12倍左右。二者的半衰期分變為1.23±0.13h和19.59±0.31h,平均滯留時間分別為2.62±0.25h和30.21±0.17h。結果顯示,CNTFnew/CC22進行Y-40K-MAL-mPEG修飾後,其半衰期顯著延長。表6Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22的大鼠體內主要動力學參數試驗例14:Y-40K-MAL-mPEG-CNTFnew/CC22在小鼠體內活性的測定實驗用小鼠使用雄性昆明鼠(得自北京維通利華實驗動物技術有限公司),體重18-22g。分為陽性對照組、陰性對照組和實驗組,每組8隻。陽性對照組為用生理鹽水溶解的CNTF標準品(購自英國國家生物製品檢定所,貨號:NIBSC94/684);實驗組樣品為Y-40K-MAL-mPEG-CNTFnew/CC22純品凍乾粉劑(實施例12所得蛋白進一步凍幹),以生理鹽水溶解並稀釋為0.5mg/ml。以每隻小鼠100μg/kg/天的量進行皮下注射給藥。陰性對照即生理鹽水。注射前分別稱量每組每隻小鼠的體重。連續五天給藥,稱量小鼠的體重,觀察小鼠的體重變化。另同時設置每周注射組,分為修飾樣品組(實施例12所得蛋白凍乾粉劑,濃度同上),未修飾樣品組(實施例1所得蛋白凍乾粉劑,濃度為0.5mg/ml),陽性對照組(同上)及陰性對照組,以每隻小鼠200μg/kg/天的量進行皮下注射給藥。陰性對照即生理鹽水。注射前分別稱量每組每隻小鼠的體重。每周給藥1次,稱量小鼠的體重,觀察小鼠的體重變化。(1)流程如下表7:表7.CNTF對小鼠減重作用測定流程(每天)註:實驗時間以給藥前一天為-1天,首次給藥當天為0天。△:根據前一操作完成情況,可提前或推後,但儘量保持每天在 同一時間。表8.CNTF對小鼠減重作用測定流程(每周)註:實驗時間以給藥前一天為-1天,首次給藥當天為0天。△:根據前一操作完成情況,可提前或推後,但儘量保持每天在同一時間。(2)測量指標:體重變化率體重變化率=(某組給藥後體重-某組給藥前體重)/給藥前體重×100%;體重增長抑制率(%)=(對照組某日體重-對照組d0體重)-(受試組某日體重-該組d0體重)/(對照組某日體重-對照組d0體重)×100%小鼠體重變化結果見表9和表10:表9.小鼠體重變化表(連續5天給藥)由表9可知:Y-40K-MAL-mPEG-CNTFnew/CC22, CNTFnew/CC22和CNTF標準品注射後的小鼠,體重均有所增長,但是Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22組的小鼠體重增長均小於陰性對照組(p<0.05),同時小於陽性對照(CNTF標準品)組(p<0.05)。表10.小鼠體重變化表(每周給藥1次)由表10可知:對於每周1次給藥組,三組注射後的小鼠,體重均有所增長,但是修飾樣品組Y-40K-MAL-mPEG-CNTFnew/CC22的小鼠體重增長小於陰性對照組(p<0.05),同時小於陽性對照(CNTF標準品)組(p<0.05),研究證實PEG修飾藥物與未修飾藥物相比較具有長效作用。(3)小鼠體重增長抑制率見下表11:表11.小鼠體重增長抑制率(連續5天給藥)由表11可知,Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22對小鼠的體重增長抑制率高於陽性對照(CNTF標準品)的體重增長抑制率(p<0.05)。表12.小鼠體重增長抑制率(每周給藥1次)由表12可知Y-40K-MAL-mPEG-CNTFnew/CC22樣品對小鼠的體重增長抑制率與對照組比較有顯著差異(p<0.01),特別是Y-40K-MAL-mPEG-CNTFnew/CC22樣品每周一次給藥即可達到CNTFnew/CC22每天給藥效果,而CNTFnew/CC22每周給藥不能有效抑制小鼠體重的增長。試驗例15:Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22對肥胖大鼠肝臟脂肪病變程度的改善大鼠(購自北京維通利華實驗動物技術有限公司)通過高脂飼料餵養成肥胖大鼠,體重為290g。分別皮下注射Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22,Y-40K-MAL-mPEG-CNTFnew/CC22設立了25、50、100、200、400μg/kg五個劑量組,CNTFnew/CC22設立了25、50、100μg/kg三個劑量組,同時設立了正常大鼠組,賦形劑組,飲食結構調整肥胖組,西布曲明 處理組,200μg/kgY-40K-MAL-mPEG-CNTFnew/CC22食量配對組(食量控制組)這五組作為對照組。CNTFnew/CC22每天給藥一次,Y-40K-MAL-mPEG-CNTFnew/CC22每周給藥一次,共給藥一個月。之後處死大鼠,取其肝臟做病理切片,顯微鏡下觀察統計處理組和對照組肝臟細胞脂肪性病變的程度。肝臟脂肪病變程度分為四級,0級指肝細胞形態正常,肝細胞幾乎無脂肪變性;I級指光鏡下脂肪變性的肝細胞數60%的肝細胞脂肪變性。結果見圖19。結果顯示西布曲明和25、50、100、400μg/kgY-40K-MAL-mPEG-CNTFnew/CC22處理組均比賦形劑組有顯著改善作用(*P<0.05),而50、100μg/kgCNTFnew/CC22和200μg/kgY-40K-MAL-mPEG-CNTFnew/CC22均較賦形劑組有極顯著改善作用(**P<0.01)。有結果可知,Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22均能有效改善肥胖大鼠肝臟細胞脂肪病變。修飾後的CNTFnew/CC22能有效地延長藥效,一周注射一次的效果相當於CNTFnew/CC22一天注射一次。試驗例16:Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22對db/db模型鼠的短期降糖作用Db/db小鼠是常用的肥胖型II型糖尿病小鼠模型,其四號染色體的瘦素受體基因缺失,出生約一個月後逐漸出現肥胖、高血糖、高血脂、糖尿病等糖尿病症狀。使用7-9周齡雌性db/db小鼠,以及7-9周齡雌性野生型C57BL/6J小鼠,SPF級,均購自上海斯萊克實驗動物責任有限公司,所有動物均以標準飼料餵養。實驗設立如下組別:db/db小鼠分為:賦形劑組(使用生理鹽水溶解後,皮下給藥,每4天給藥一次;Y-40K-MAL-mPEG-CNTFnew/CC22100μg/kg組,每4天給藥一次,只給藥一次;Y-40K-MAL-mPEG-CNTFnew/CC22200μg/kg組,每4天給藥一次,只給藥一次;CNTFnew/CC22100μg/kg組,每天給藥一次,共給藥四天。所有藥物均是皮下注射。在給藥完成後的第0.5、2、 4、6、8、10、24、36、48、60、72、84、96小時,用採血針刺小鼠尾出血,用試紙片法用羅氏血糖儀(購自羅氏公司,ACCU-CHEKMobil)測血糖濃度。計算血糖變化率並作圖,結果如圖20所示。血糖變化率計算公式為:血糖變化率=(給藥後血糖-給藥前血糖)/給藥前血糖×100%。結果顯示,四天給藥一次的Y-40K-MAL-mPEG-CNTFnew/CC22200μg/kg單針次降糖效果與CNTFnew/CC22100μg/kg每天給藥一次的降糖效果的穩定性相當,但降糖效果更顯著,顯示出了長效的降糖作用。試驗例17:Y-40K-MAL-mPEG-CNTFnew/CC22和CNTFnew/CC22單體對db/db模型鼠口服葡萄糖耐量(OGTT)的改善使用7-9周齡雌性db/db小鼠,以及7-9周齡雌性野生型C57BL/6J小鼠,SPF級,均購自上海斯萊克實驗動物責任有限公司,所有動物均以標準飼料餵養。實驗設立如下組別:Db/db小鼠分為:賦形劑組,每4天給藥一次;0.2mg/kg利拉魯肽組,每天給藥兩次;0.4mg/kg利拉魯肽組,每天給藥1次,觀察4天;0.1mg/kgCNTFnew/CC22組,每天給藥1次;50μg/kgY-40K-MAL-mPEG-CNTFnew/CC22組,每4天給藥一次;100μg/kgY-40K-MAL-mPEG-CNTFnew/CC22組,每4天給藥一次;200μg/kgY-40K-MAL-mPEG-CNTFnew/CC22組,每4天給藥一次;另外設置野生型C57BL/6J對照組。其中利拉魯肽(購自諾華諾德公司)組是陽性對照組。共八組,均是皮下注射給藥,共給藥16天。在給藥結束後的第0、0.5、1.0、1.5、2.0小時,小鼠尾用採血針針刺出血,用試紙片法用羅氏血糖儀(購自羅氏公司,ACCU-CHEKMobil)測血糖濃度,計算平均血糖,並作圖,結果如圖21所示。結果顯示,相比賦形劑對照組,每四天給藥一次的不同Y-40K-MAL-mPEG-CNTFnew/CC22劑量組均有改善OGTT的作用,與CNTFnew/CC22100μg/kg組相比,效果也較好,其顯示出了長效 的降糖效果。其中,200μg/kg的Y-40K-MAL-mPEG-CNTFnew/CC22對小鼠OGTT的改善作用明顯優於已上市產品利拉魯肽。當前第1頁1 2 3 
