一種用於快速培養小球藻的培養基及其培養方法與流程
2023-10-20 10:26:27 1
本發明屬於生物技術領域,具體涉及一種用於快速培養小球藻的培養基及其培養方法。
背景技術:
小球藻是一種球形單細胞綠藻,直徑3~8μm,以光合自生長繁殖,是第一種被人工培養的微藻,富含豐富的胺基酸、蛋白質、多糖、不飽和脂肪酸等營養成份,具有很高的醫療保健價值。在水產養殖中,小球藻促進浮遊動物如輪蟲、橈足類、枝角類和豐年蟲的生長於繁殖,還可作為許多魚、蝦、貝類的優質開口餌料,為養殖動物發育初期提供充足的營養物質。此外,小球藻在生長過程中能消耗掉水體中部分氮、磷等有機肥,從而達到淨化調節水質的目的,在水產養殖應用上是一種重要的微藻資源。
為使小球藻達到快速高密度生長的同時還能保證高品質的藻細胞,須對前期進行異養培養階段的培養基及方法進行創新優化,促使小球藻快速生長。中國專利cn102465098a、cn1807572a都是快速培養普通小球藻的培養基組合物,前者是在常規se培養基的基礎上添加亞硫酸鈉和有機碳源獲得,創新性不是很大,同時操作起來較繁瑣;後者則改變了培養基配方,但是有機碳源葡萄糖的耗用率較高,成本比較大;專利cn104830691a中描述了一種小球藻培養方法即在指數生長期中期,過濾出部分小球藻,在補充營養物質繼續培養,操作繁瑣,小球藻指數生長期的中期不易檢測,操作不方便,不適合規模化培養小球藻。
隨著水產養殖業的發展,小球藻規模化的培養也不短擴大,其前期異養階段藻細胞品質的高低直接影響到後期小球藻自養情況, 同時也是判斷其是否能夠達到高密度生長繁殖的關鍵。
技術實現要素:
本發明的目的是提供一種適用於小球藻光自養-異養混合培養的培養基及培養方法。通過使用該培養基組合物和該方法相結合可使小球藻在較短培養周期內達到高品質、高密度的培養效果,並在培養結束時藻細胞可達到光自養培養水平,實現規模化培養。
為實現上述目的,本發明提供了一種用於快速培養小球藻的培養基,所述的培養基組合物主要成份為ch3coona、nacl、kh2po4、k2hpo4、ch3ch2coona、(nh4)2so4、mgso4、feso4、znso4、mnso4、na2edta。
在本發明一個實施方案中,所述的培養基含有如下組分:ch3coona1.5~4g/l、nacl0.5~2g/l、kh2po40.2~1.5g/l、k2hpo40.1~1g/l、ch3ch2coona0.1~1g/l、(nh4)2so40.05~0.2g/l、mgso4·7h2o0.08~0.3g/l、feso4·7h2o1~15mg/l、znso4·7h2o0.1~3mg/l、mnso4·h2o0.1~3mg/l、na2edta0.5~5mg/l。
進一步,所述的培養基含有如下組分:ch3coona2.0~3.5g/l、nacl0.8~1.5g/l、kh2po40.5~1.2g/l、k2hpo40.3~0.8g/l、ch3ch2coona0.3~0.8g/l、(nh4)2so40.08~0.15g/l、mgso4·7h2o0.1~0.25g/l、feso4·7h2o5~10mg/l、znso4·7h2o0.5~2mg/l、mnso4·h2o0.5~2mg/l、na2edta1.5~4mg/l。
更進一步,所述的培養基含有如下組分:ch3coona2.5~3g/l、nacl1~1.2g/l、kh2po40.6~1g/l、k2hpo40.4~0.7g/l、ch3ch2coona0.4~0.7g/l、(nh4)2so40.1~0.13g/l、mgso4·7h2o0.15~0.2g/l、feso4·7h2o6~8mg/l、znso4·7h2o0.8~1.5mg/l、mnso4·h2o0.8~1.5mg/l、na2edta2~3mg/l。
其中,所述的培養基ph值為7.0~7.5。
本發明還提供利用本發明的培養基組合物快速培養小球藻的方 法,其為將小球藻接種到所述的培養基中,初始接種量為105~106細胞/ml,在溫度為26~32℃,光照強度為2800~3800lux,光暗比為16:8的條件下進行培養,每天分別於早、中、晚各對藻液充氣30min,防止藻細胞沉底;在藻細胞密度達到107~108細胞/ml時,按1l藻液5~25g的量,往藻液中添加葡萄糖溶液繼續培養,此時藻細胞密度達到2.0×108~2.5×108細胞/ml,即可收穫全部小球藻。
與現有技術相比,本發明公開的快速小球藻培養基組合物及其培養方法,可以迅速使小球藻成為生長優勢藻種,培養基製作過程及培養方法簡單方便;這種培養基組合物不僅可使未經馴化的普通小球藻在較短的培養周期內藻細胞達到高密度的培養水平,而且藻細胞品質達到與全程異養培養的小球藻同等水平,藻細胞蛋白質含量保持在60%以上,培養周期結束時小球藻可進行光自養培養,從而實現普通小球藻的快速高產培養模式,具有廣闊的應用前景。
附圖說明
圖1不同小球藻培養基組合物對比試驗。
圖2培養過程中添加不同碳源對比試驗。
圖3培養過程中不同時間添加葡萄糖碳源的對比實驗。
圖4本發明的3個實施例培養效果對比實驗。
具體實施方式
以下實施例用於說明本發明,但不用來限制本發明的範圍。
實施例1
稱取各成分,溶於蒸餾水中,配製成培養基:
ch3coona1.5g/l、nacl0.5g/l、kh2po40.5g/l、k2hpo40.2g/l、ch3ch2coona0.5g/l、(nh4)2so40.2g/l、mgso4·7h2o0.15g/l、feso4·7h2o6mg/l、znso4·7h2o0.8mg/l、mnso4·h2o0.8mg/l、na2edta2mg/l。培養基ph值在7.0左 右。
小球藻培養方法具體步驟操作如下:
將小球藻藻細胞按105細胞/ml的比例接種至配置好的培養基組合物中,在溫度為26℃,光照強度為3400lux,光暗比為16:8的條件下進行培養,並分別於每天早、中、晚各對藻液充氣30min,通氣量為1l/min。在培養中後期(第7天左右,此時藻細胞密度達到107~108細胞/ml),按1l藻液10g的量,往藻液中添加葡萄糖溶液繼續培養,接種後第10天,即可收穫全部小球藻。
實施例2
稱取各成分,溶於蒸餾水中,配製成培養基:
ch3coona2.8g/l、nacl0.8g/l、kh2po40.6g/l、k2hpo40.55g/l、ch3ch2coona0.5g/l、(nh4)2so40.11g/l、mgso4·7h2o0.18g/l、feso4·7h2o7mg/l、znso4·7h2o1mg/l、mnso4·h2o1.2mg/l、na2edta2.5mg/l。ph值在7.5左右。
小球藻培養方法具體步驟操作如下:
將小球藻藻細胞按106細胞/ml的比例接種至配置好的培養基組合物中,在溫度為28℃,光照強度為3000lux,光暗比為16:8的條件下進行培養,並分別於每天早、中、晚各對藻液充氣30min,通氣量為1l/min。在培養中後期(第7天左右,此時藻細胞密度達到107~108細胞/ml),按1l藻液5g的量,往藻液中添加葡萄糖溶液繼續培養,接種後第10天,即可收穫全部小球藻。實施例3
稱取各成分,溶於蒸餾水中,配製成培養基:
ch3coona4g/l、nacl2g/l、kh2po41.5g/l、k2hpo41g/l、ch3ch2coona0.1g/l、(nh4)2so40.08g/l、mgso4·7h2o0.25g/l、feso4·7h2o15mg/l、znso4·7h2o3mg/l、mnso4·h2o2mg/l、na2edta5mg/l。ph值在7.3左右。
小球藻培養方法具體步驟操作如下:
將小球藻藻細胞按106細胞/ml的比例接種至配置好的培養基組合物中,在溫度為32℃,光照強度為2800lux,光暗比為16:8的條件下進行培養,並分別於每天早、中、晚各對藻液充氣30min,通氣量為1l/min。在培養中後期(第7天左右,此時藻細胞密度達到107~108細胞/ml),按1l藻液20g的量,往藻液中添加葡萄糖溶液繼續培養,接種後第10天,即可收穫全部小球藻。實施例4
稱取各成分,溶於蒸餾水中,配製成培養基:
ch3coona1.5g/l、nacl0.5g/l、kh2po41.5g/l、k2hpo41g/l、ch3ch2coona0.1g/l、(nh4)2so40.05g/l、mgso4·7h2o0.08g/l、feso4·7h2o15mg/l、znso4·7h2o3mg/l、mnso4·h2o3mg/l、na2edta5mg/l。ph值在7.3左右。
小球藻培養方法具體步驟操作如下:
將小球藻藻細胞按106細胞/ml的比例接種至配置好的培養基組合物中,在溫度為30℃,光照強度為3800lux,光暗比為16:8的條件下進行培養,並分別於每天早、中、晚各對藻液充氣30min,通氣量為1l/min。在培養中後期(第7天左右,此時藻細胞密度達到107~108細胞/ml),按1l藻液5g的用量,往藻液中添加葡萄糖溶液繼續培養,接種後第10天,即可收穫全部小球藻。
實施例5
稱取各成分,溶於蒸餾水中,配製成培養基:
ch3coona4g/l、nacl2g/l、kh2po40.2g/l、k2hpo40.1g/l、ch3ch2coona1g/l、(nh4)2so40.2g/l、mgso4·7h2o0.3g/l、feso4·7h2o1mg/l、znso4·7h2o0.1mg/l、mnso4·h2o0.1mg/l、na2edta0.5mg/l。ph值在7.4左右。
小球藻培養方法具體步驟操作如下:
將小球藻藻細胞按106細胞/ml的比例接種至配置好的培養基 組合物中,在溫度為27℃,光照強度為3000lux,光暗比為16:8的條件下進行培養,並分別於每天早、中、晚各對藻液充氣30min,通氣量為1l/min。在培養中後期(第7天左右,此時藻細胞密度達到107~108細胞/ml),按1l藻液25g的量,往藻液中添加葡萄糖溶液繼續培養,接種後第10天,即可收穫全部小球藻。
試驗例1
採用本發明實施例1製備的小球藻培養基組合物及培養方法進行對比試驗。
培養瓶1(實驗組):在500m的l錐形瓶中加入300ml本發明實施例1製備的小球藻培養基組合物,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;
培養條件:按照實施例1所述的小球藻培養方法進行培養。
培養瓶2(對照組),在500ml錐形瓶中加入300mlf/2藻類培養基,培養基由nano375mg/l、nah2po4·h2o5mg/l、na2sio3·9h2o20mg/l、na2edta5mg/l、fecl3·6h2o3.5mg/l、cuso4·5h2o0.01mg/l、znso4·7h2o0.02mg/l、cocl2·6h2o0.02mg/l、mncl·4h2o0.2mg/l、na2moo4.·2h2o0.08mg/l、維生素b10.1mg/l、維生素b120.5mg/l、生物素0.5mg/l組成,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;培養條件:與實施例1一致。
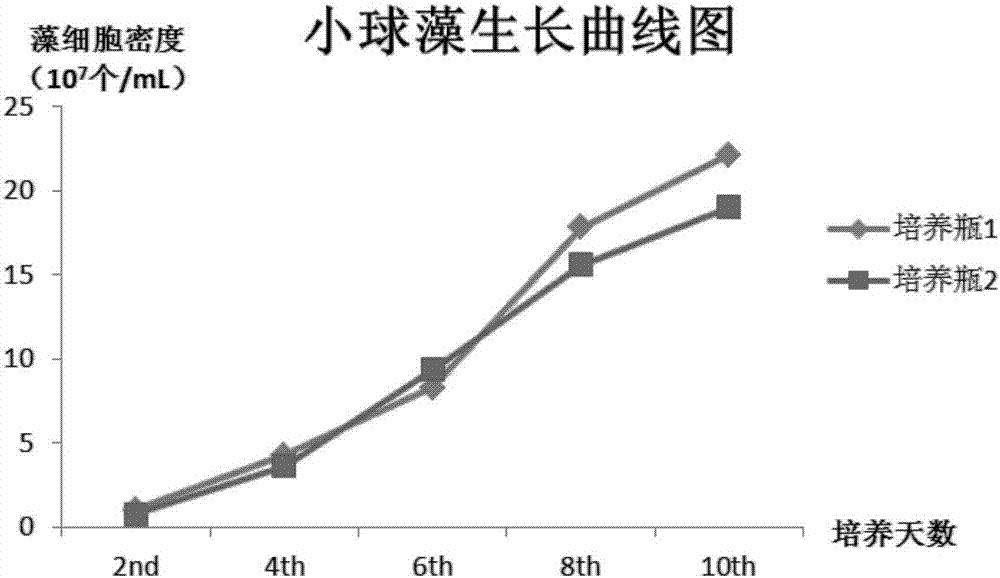
以培養瓶1中本發明所述培養基為實驗組,以培養瓶2為對照組,每隔兩天用血球計數板分別對兩瓶藻液的小球藻藻細胞進行計數,其結果如圖1所示:
由圖1可以看出,使用本發明所述培養基培養的培養瓶1中小球藻其藻細胞生長繁殖速度明顯高於使用f/2培養基的培養瓶2,在第十天培養周期結束時藻細胞密度達2.2×108細胞/ml,明顯高於對照組約5×107細胞/ml,且使用本發明所述培養基的小球藻其生長速 度在中後期也明顯快於f/2培養基,說明了使用本發明實施例1所述的小球藻培養基組合物及培養方法具有顯著的生長優勢。
試驗例2
採用本發明實施例2製備的小球藻培養基組合物及培養方法進行對比試驗。
培養瓶1(實驗組):在500m的l錐形瓶中加入300ml本發明實施例2製備的小球藻培養基組合物,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;
培養條件:按照實施例2所述的小球藻培養方法進行培養,在培養中後期(第7天左右,此時藻細胞密度達到107~108細胞/ml),往藻液中添加15g/l的葡萄糖繼續培養,接種後第10天收穫全部小球藻。
培養瓶2(對照組),在500m的l錐形瓶中加入300ml本發明實施例2製備的小球藻培養基組合物,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;培養條件:與實施例1所述的培養方法進行培養,在培養中後期(第6天,此時藻細胞密度達到107~108細胞/ml),往藻液中添加15g/l的尿素繼續培養,接種後第10天收穫全部小球藻。
以培養瓶1中本發明所述培養基為實驗組,以培養瓶2為對照組,每隔兩天用血球計數板分別對兩瓶藻液的小球藻藻細胞進行計數,其結果如圖2所示。
由圖2可以看出,在同樣使用本發明所述培養基的培養條件下,前期兩個培養瓶中的小球藻長勢基本持平,但在第六天兩個不同培養瓶分別加入葡萄糖和尿素(有機碳源和無機碳源)後,培養瓶1的藻細胞數量逐漸多於培養瓶2,後期培養瓶1的藻細胞密度約2.3×108細胞/ml,培養瓶2的藻細胞密度約1.8×108細胞/ml,藻細胞生長速度培養瓶1明顯高於培養2,說明了在同樣使用本發明實施 例2製備的培養基的條件下,採用本發明實施例2所述的中後期添加葡萄糖的小球藻培養方法具有顯著生長優勢。
試驗例3
採用本發明實施例3製備的小球藻培養基組合物及培養方法進行對比試驗。
培養瓶1(對照組),在500m的l錐形瓶中加入300ml本發明實施例3製備的小球藻培養基組合物,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;培養條件:與實施例1所述的培養方法進行培養,不同之處,在培養早期(第1天),往藻液中添加25g/l的葡糖糖進行培養,接種後第10天收穫全部小球藻。
培養瓶2(實驗組):在500m的l錐形瓶中加入300ml本發明實施例3製備的小球藻培養基組合物,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;
培養條件:按照實施例3所述的小球藻培養方法進行培養。
以培養瓶1為對照組,以培養瓶2中本發明實施例3所述的培養基為實驗組,每隔兩天用血球計數板分別對兩瓶藻液的小球藻藻細胞進行計數,其結果如圖3所:
由圖3可以看出,培養瓶1由於接種同時添加葡萄糖的原因在前六天藻細胞生長速度均優於培養瓶2,在第六天培養瓶2添加葡萄糖後,培養瓶2中的藻細胞生長速度顯著提高,第七天是藻細胞濃度已和培養瓶1持平,到第十天培養周期結束時培養瓶2中小球藻藻細胞數量超過培養瓶1約3.2×107細胞/ml,說明了在同樣使用葡萄糖進行異養培養的條件下,採用本發明實施例3所述的中後期添加葡萄糖的培養方法小球藻具有顯著生長優勢。
試驗例4
採用本發明實施例1、實施例2、實施例3製備的小球藻培養基組合物及培養方法進行對比試驗。
培養瓶1:在500m的l錐形瓶中加入300ml本發明實施例1製備的小球藻培養基組合物,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;
培養條件:按照實施例1所述的小球藻培養方法進行培養。
培養瓶2:在500m的l錐形瓶中加入300ml本發明實施例2製備的小球藻培養基組合物,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;
培養條件:按照實施例2所述的小球藻培養方法進行培養,。
培養瓶3:在500m的l錐形瓶中加入300ml本發明實施例3製備的小球藻培養基組合物,接種量:濃度為1×106細胞/ml的小球藻藻液200ml;
培養條件:按照實施例3所述的小球藻培養方法進行培養。
本發明實施例1、實施例2、實施例3製備的小球藻培養基組合物及培養方法進行對比試驗結果如圖4所示。
試驗結果表明,本發明實施例1、實施例2、實施例3製備的小球藻培養基組合物及培養方法都能夠顯著提高小球藻的生長繁殖速度,其中實施例2培養的小球藻培養瓶2效果最佳。
以上所述僅是本發明的優選實施方式,應當指出,對於本技術領域的普通技術人員來說,在不脫離本發明技術原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護範圍。
