一種篩選用於促進骨癒合的藥物的方法與流程
2023-10-04 11:59:54 2
本發明屬於醫學領域,尤其屬於骨科領域。
背景技術:
(1)骨延遲癒合和不癒合是臨床骨科極具挑戰性的科學問題
長久以來,由於嚴重創傷、疾病、感染等因素而導致骨塊丟失過多的一系列併發症嚴重影響著患者的生活質量,尤其是骨延遲癒合(Delayed bone healing)和骨不連(Bony non-union)。目前,如何使骨組織又好又快地癒合,提高患者生活質量,已經成為臨床骨科、口腔種植體醫師的研究熱點。在正常骨缺損癒合(Normal bone healing)過程中,主要包括三個階段:血腫(Hematoma)炎症機化期(Reactive phase),骨痂形成期(Reparative phase),和骨板形成塑形期(Remodeling phase)(圖1)。
骨組織的正常癒合涉及許多因素,包括足量的間充質幹細胞(Mesenchymal Stem Cells,MSCs)、生長因子、充足的血供、受損部位的機械力學穩定性等。在臨床實踐過程中,許多促進骨快速癒合的治療方案已經被嘗試,如骨替代物植入術、幹細胞移植術等。然而,這些方法在運用的同時,也不可避免地帶來一系列的問題,如新骨形成的誘導率不高、術中術後感染、材料本身的快速降解和機械強度不足、材料表面缺乏生物相容性。為了減少上述副作用,Platelet-rich plasma(PRP)技術曾一度被嘗試性運用於臨床上幫助骨早期癒合。PRP技術是將患者自體血液(10mL)加入到10%檸檬酸鈉溶液中,在室溫下放入離心機中離心(160G,20分鐘),血液將分為血清層和血細胞層,移取兩者分界線下6mm以上的溶液至新的無抗凝劑試管中,再次離心(400G,15分鐘),得到上層的血清層和下層的PRP層。臨床使用前,需用凝血酶(Thrombin,T)和氯化鈣溶液將其激活後局部使用。理論上講,在骨折部位局部運用患者自體的PRP,在凝血酶和氯化鈣刺激後,快速形成一個富集生長因子的纖維血凝塊,一方面填充骨缺損部位達到快速止血的作用,另一方面它能釋放內部的大量生長因子,從而促進骨折的早期癒合。儘管如此,一些學者通過構建大鼠和羊等骨缺損模型後植入PRP,並未發現PRP有任何明顯促進骨癒合的作用。
近年來,新興的Platelet-rich fibrin(PRF)技術得到臨床骨科醫師廣泛的認可。PRF技術是在PRP技術基礎的一種改良。在製作過程中,患者的血液被快速和直接地加入試管中,隨後立即離心機(3000rpm,10分鐘,20℃),血液將會分為三層:最上層Platelet poor plasma(PPP),中間層PRF層,最下層紅細胞層。由於在整個製作過程中未涉及到任何抗凝劑和凝血酶等生物製劑的參與,相比PRP而言,PRF自然而緩慢地形成的纖維結構被表明能更好地吸附激活血小板釋放的生長因子,從而緩慢釋放它們,提高成骨率。通過對比與成骨活動密切相關的生長因子Transforming growth factor-β(TGF-β)和Platelet-derived growth factor(PDGF)發現,儘管PRP中含量明顯高於PRF,但兩者植入骨缺損部位後,PRF的成骨效果卻較PRP更為顯著。所以,有研究者認為PRF中的纖維結構可能為等邊連接(Equilateral junction),為生長因子的緩慢釋放或細胞的遷移、粘附和增殖創造更有利的環境,而PRP中的纖維結構可能為等腰連接(Bilateral junction),導致過快地釋放生長因子或阻止細胞的遷移,因而並未達到顯著成骨作用。
血纖維結構的不同,提供給細胞活動的環境不同,對生長因子的粘附能力也有著不同,最終竟能導致截然不同的成骨效應。在導致骨延遲癒合或不癒合的眾多因素中,骨缺損面積大小(Gap size)一直被公認為是最為重要的因素之一。由於創傷過大,骨塊丟失面積達到或超過臨界點(Critical size defect,CSD)時,必將引發骨不連的出現。因此,值得我們考慮的是,那麼創傷較小的正常骨癒合和創傷較大的骨延遲癒合,兩種不同骨缺損中所形成的血凝塊的結構性質似乎也存在一些差異呢?簡言之,骨折血凝塊可能也有「好」或「壞」之分。
迄今為止,血凝塊變「好」或「壞」的最根本原因仍不清楚。血凝塊的性質似乎與發生部位有一定的聯繫。顯而易見地是,頭皮血腫和皮下血腫通常不會分化成為骨組織,而骨折血凝塊則可以機化、礦化為新鮮的骨組織。一般情況下,骨折部位形成的血凝塊能演變為正常骨組織而沒有任何併發症,但某些時候由於缺損過大、感染、血供不足等情況,骨折延遲癒合或骨不連仍會發生。所以,對於正常骨癒合和骨延遲癒合中血凝塊結構的基礎性研究,仍然是一個巨大的疑問。早在1990年,Mizuno就將一個4天的血凝塊從大鼠股骨骨折部位,移植入肌肉內,最終發現肌肉內新骨形成。而把一個2天的血凝塊採用相同的手術方式進行對照,則並未觀察到新骨形成。這個實驗表明了血凝塊內部結構的成熟程度能顯著影響骨癒合的能力。
一個「好」血凝塊應該具備以下的特徵:①.除了有效止血以外,它能作為一個臨時的纖維基質材料,進而促進MSC、成骨細胞的遷移、粘附、增殖和分化,因為細胞的遷移和粘附活動很大程度上依賴於基質的參與。②.一個「好」血凝塊還應具有一定的多孔性,才能更好地促進氧氣和其他營養物質的交換,同時也有利於代謝產物的排出。③.一個「好」血凝塊,由於高滲透性和低密度纖維束,使它更容易被降解,從而為新生肉芽組織的長入提供更多的空間。④.一個「好」血凝塊還應擁有一個較大的表面積,用以吸附游離的生長因子,並緩慢釋放它們,從而更有效地提高成骨細胞分化率。
(2)血凝塊的形成過程和結構特徵
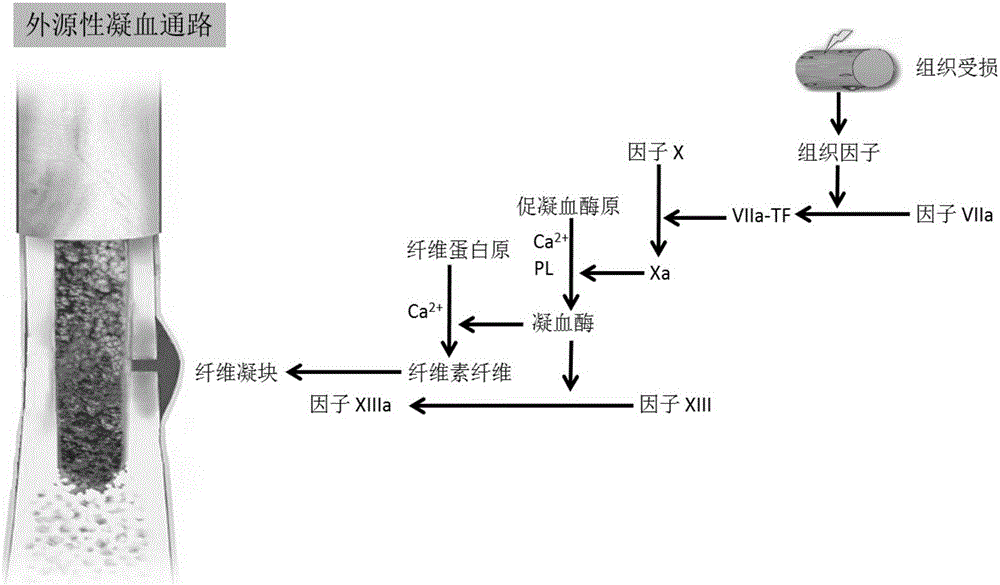
經典的凝血反應包括內源性和外源性兩條通路。內源性凝血起始於前激肽釋放酶、高分子量肽原(High Molecular Weight Kininogen,HMWK)和凝血因子XII等物質接觸到異物表面。凝血因子XII一旦被激活,首先激活HMWK,HMWK正反饋進一步激活更多的XII因子,從而放大凝血效應。XIIa繼續激活下遊的XI因子,而XIa進一步在鈣離子的協助下激活IX因子,激活的IXa和VIIIa因子,在鈣離子和磷脂(Phospholipid,PL)存在的條件下,激活X因子轉變為Xa,最後進入共同通路。
對於骨折血凝塊(實質上是纖維血凝塊)而言,是通過外源性凝血通路來達到止血效果的(圖2)。外源性凝血通路始於組織因子(Tissue Factor,TF)的釋放,它能進一步激活凝血因子VII,從而形成TF-VIIa複合物。該複合物繼續激活下遊的凝血因子X生成Xa,Xa激活凝血因子V並與其形成FXa-Va複合物,進而在鈣離子和磷脂協助下,使促凝血酶原(Prothrombin)轉變為具有生物活性的凝血酶。內源性和外源性的共同通路是從凝血因子X轉化為激活的Xa開始。凝血酶的生成具有兩個主要作用是:一方面可以轉化纖維蛋白原(Fibrinogen,Fg)成為纖維素纖維(Fibrin fiber),另一方面它還可以激活凝血因子XIII。激活後的XIIIa在纖維素纖維形成網狀纖維血凝塊的過程中,起著至關重要的作用。
在心臟內科和血液內科的前期基礎研究中,血栓凝塊主要包括以下結構特徵:纖維的直徑、密度、分支點的數量、分支點之間的距離、孔徑率(Porosity)和孔徑大小(Pore size)等。一般來說,纖維直徑的粗細與纖維的密度是成反比關係,但和孔徑的大小成正比關係。纖維直徑的粗細和孔徑大小對MSC的生理功能的調節起著非常重要的作用。儘管單根粗纖維(Coarse fiber)和單根細纖維(Thin fiber)相比,有較高的機械強度,然而由粗纖維構成為主的纖維凝塊卻通常表現出較低的硬度,可能的原因是由於粗纖維形成的數量較少。從血栓凝塊降解角度來看,纖維的密度是較為主要的決定性因素,而非直徑大小。決定纖維直徑和密度兩個極為重要的因素就是纖維蛋白原和凝血酶的濃度。低濃度的纖維蛋白原和(或)凝血酶能形成一個較渾濁、粗的、疏鬆的血栓凝塊;相反,高濃度的纖維蛋白原和(或)凝血酶則形成一個不渾濁、細的、緻密的血栓凝塊。這兩種不同類型的血栓凝塊,表現出不同的纖維降解速率,前者往往降解較快,從而增大了過早溶解、出血等可能;後者往往降解較慢,卻增加了血栓長期存在的風險。除了這兩個因素對血栓凝塊結構調節起著重要作用外,局部的PH值、離子強度、鈣離子濃度等諸多變量也能影響其結構變化。
(3)纖維素纖維形成的機制
纖維蛋白原是一個分子量約為340kDa的糖蛋白,長約45μm,由2組3條多肽鏈(AαBβγ)2組成,多肽鏈之間以二硫鍵相互連接而成。纖維蛋白原按區域來劃分,包括一個中央區(E domain),二個外圍區(D domain)由Bβ鏈和γ鏈的羧基端組成,Aα鏈的羧基端(αC region)折回參與E區結構,以及連接E區與D區之間的帶狀結構(Coiled-coil區)。
在轉變成纖維素纖維的聚合反應中(圖3),凝血酶首先會裂解2條Aα鏈氨基端Arg16-Gly17釋出一對纖維蛋白肽A(Fibrinopeptide A,FpA)從而暴露出Gly-Pro-Arg-Pro(GPRP)區域(也稱為knob A),從從而形成纖維蛋白單體Ⅰ(αBβγ)2(FMI),與knob A相對應的結構是位於γ鏈羧基端的hole『a』或pocket『a』結構。20-25個FMI間通過A:a間氫鍵結合(A:a interaction),先形成低聚體(Oligomer),最後聚合成以22.5nm為周期橫紋的不穩定的雙鏈原纖維(protofibrils)。此外,凝血酶繼續裂解原纖維上的2條Bβ鏈氨基端Arg14-Gly15釋出一對纖維蛋白肽B(FPB),暴露出Gly-His-Arg-Pro(GHRP)區域(也稱為knob B),形成纖維蛋白單體Ⅱ(αβγ)2,與之相對應的則是位於β鏈羧基端的hole『b』或pocket『b』結構。它們之間形成的B:b結合(B:b interaction)主要作用至今未知,但可以明確的是,B:b結合能促進側向聚集作用(Lateral aggregation)。最終,上述的(αβγ)2在凝血因子XIIIa的作用下,形成一個成熟的網狀纖維凝塊,從而達到止血目的。
B:b結合加強側向聚集作用的可能原因是:首先,由於knob B本身較長且靈活,以致於它和pocket『b』之間的綁定並不會顯著影響到原纖維結構的重新排列。其次,B:b結合後可能會誘導β鏈羧基端向外更加突出,從而使得與相鄰分子的β鏈羧基端接觸更為緊密。再次,FpB的釋放使原本依附於FpB的αC domain變成游離狀態(untethered state),而相鄰分子間游離狀的αC domain通過多種聚合方式形成αC多聚體(αC polymer),從而使纖維變粗。最後,B:b結合可能從動力學上更加穩定了原纖維的結構,繼而加強了側向聚集作用。不管以何種機制,可以肯定的是B:b結合鍵是真實存在並且在纖維聚合反應中起著重大作用。因此,如果僅僅釋放FpA而不釋放FpB,形成的纖維凝塊主要由緻密的細纖維構成。
側向聚集作用決定纖維的粗細程度,多種結構位點參與了側向聚集作用的發生機制。已知的研究結果表明,knob B和pocket『b』、γ鏈羧基端(γ350-360和γ370-380)和相鄰β鏈羧基端、Aα鏈羧基端的αC region、Coiled-coil區、和Bβ364Asn andγ52Asn上的N-葡糖胺多糖等都和側向聚集作用有密切關係。Lord在體外研究指出,運用截斷的Aα251纖維蛋白原(缺乏αC region部分),形成的纖維直徑較正常對照組下降25%。在αC region內部結構中,含有一條相對靈活的區域—αC連接體(αC connector)和一個獨立摺疊的緻密區域—αC區域(αCdomain),αC連接體位於Aα221-391基因序列,而αC區域則位於Aα392-610序列(圖4)。更重要的是,αC區域還可以細分為兩個亞區域(subdomain):即N端亞區域(Aα392-503)和C端亞區域(Aα504-610)。相鄰原纖維分子間發生側向聚集作用時,N端亞區域間通常以自交聯(Self-association)中的β髮夾交換方式(β-hairpin swapping)相互聚合,而C端亞區域上存在一些受體位點,如Lys-418、-448、-508等,這些位點能與αC連接體上的供體,如Gln-221、-237、-328等,藉助於激活的凝血因子XIII形成∈-amino(γ-Glutamyl)Lysine共軛鍵發生交聯(Crosslinking)。這種原纖維間的共軛交聯方式使整個纖維聚合過程不可逆轉,並形成穩定的αC多聚體,最終增強纖維凝塊的機械強度和抵抗溶解的能力。除此之外,由凝血因子XIII介導的∈-amino(γ-Glutamyl)Lysine共軛鍵還出現在相鄰γ鏈上的γ406Lys和γ398/399Gln之間,這種聚合方式叫γ-γ交聯。αC-αC交聯(即αC多聚體形成)和γ-γ交聯兩者都和纖維凝塊的硬度有緊密聯繫。因此,從一定程度上來說,αC多聚體的形成量能決定纖維凝塊中纖維直徑的粗細。也就是說,凡有利於發生側向聚集作用的因素,如αC多聚體形成越多,則形成一個粗纖維為主和少分支點的纖維凝塊;而不利於發生側向聚集作用的因素,則形成一個細纖維為主和多分支點的纖維凝塊。最近一項體外實驗表明,αC多聚體的形成能促進內皮細胞上整合素的聚集,從而增加它們的粘附、擴散力,並激活整合素介導的Focal adhesion kinase(FAK)和Extracellular signal regulated kinase(ERK1/2)兩條通路,最終促進內皮細胞遷移和增殖,促進癒合。
亞硝基穀胱甘肽(S-nitrosoglutathione,GSNO)作為一種S-亞硝化穀胱甘肽衍生物,通過抑制血小板的激活發揮抗凝作用從而可預防血栓形成。除了對血小板的抑制作用,GSNO也被報導能夠通過增加αC多聚體生成,從而形成以粗纖維為主的易於溶解的纖維凝塊。在大鼠牙周炎的模型中,局部齒齦內給藥注射GSNO可以明顯減少過度炎症反應所導致的骨破壞。臨床中,GSNO也被廣泛地用於預防心肌梗塞和心臟瓣膜術後的再度狹窄。
技術實現要素:
本發明的目的在於克服上述現有技術的不足之處而提供一種調節血凝塊纖維的結構在製備用於促進骨癒合的藥物中的用途,所述藥物用於調節血凝塊纖維的結構,所述調節血凝塊纖維的結構包括調節血凝塊的纖維直徑、纖維密度、孔徑率和孔徑大小來促進骨癒合。
為實現上述目的,本發明採取的技術方案為:一種篩選用於促進骨癒合的藥物的方法,所述方法包括以下步驟:
(1)提供纖維緻密型的血凝塊;
(2)將待測物質與步驟(1)的血凝塊混合,調節血凝塊的結構;
(3)如果步驟(2)中的血凝塊的結構由纖維緻密型變為纖維稀疏型,那麼步驟(2)中的待測物質為促進骨癒合的藥物。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,所述纖維緻密型的血凝塊纖維密度高、纖維直徑細;所述纖維稀疏型的血凝塊纖維密度低、纖維直徑粗。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,所述纖維緻密型的血凝塊纖維密度為26.92~34.68根/40μm2,纖維直徑為180-220nm;所述纖維稀疏型的血凝塊纖維密度為6.55~10.75根/40μm2,纖維直徑大於或等於400nm。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,所述步驟(2)中調節血凝塊纖維的結構包括調節血凝塊的纖維直徑、纖維密度。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,所述藥物為亞硝基穀胱甘肽。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,所述亞硝基穀胱甘肽的濃度從0mM到10mM時,隨著亞硝基穀胱甘肽濃度的增加,血凝塊的纖維直徑逐漸增大;所述亞硝基穀胱甘肽的濃度超過10mM時,隨著亞硝基穀胱甘肽濃度的增加,血凝塊的纖維直徑逐漸變小。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,所述亞硝基穀胱甘肽的濃度從0mM到0.1mM時,隨著亞硝基穀胱甘肽濃度的增加,血凝塊的纖維密度基本不變;所述亞硝基穀胱甘肽的濃度從1mM增加到10mM時,隨著亞硝基穀胱甘肽濃度的增加,血凝塊的纖維密度逐漸下降。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,所述亞硝基穀胱甘肽的濃度從0mM到1mM時,隨著亞硝基穀胱甘肽濃度的增加,礦化骨組織新生量和總量逐漸增加;所述亞硝基穀胱甘肽的濃度從1mM增加到10mM時,隨著亞硝基穀胱甘肽濃度的增加,礦化骨組織新生量和總量逐漸減少;所述亞硝基穀胱甘肽的濃度為10mM時,添加亞硝基穀胱甘肽組與空白對照組的礦化骨組織新生量和總量差別不顯著。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,在早期血凝塊階段,在正常骨缺損癒合模型中,在血凝塊的邊緣部分可見孔狀結構,而在骨延遲癒合模型中可見緻密的纖維結構。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,當在正常骨缺損癒合模型中,在血凝塊的邊緣部分可見肉芽組織時,而在骨延遲癒合模型中血凝塊邊緣無明顯變化。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,當在正常骨缺損癒合模型中,大部分血凝塊已經消退時,而在骨延遲癒合模型中血凝塊的主體部分仍然存在。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,當在正常骨缺損癒合模型的早期血凝階段和新生肉芽組織形成階段時,正常骨缺損癒合模型中的血凝塊纖維直徑均明顯大於骨延遲癒合模型中的血凝塊纖維直徑。
作為本發明所述的一種篩選用於促進骨癒合的藥物的方法的優選實施方式,當在正常骨缺損癒合模型的早期血凝階段和新生肉芽組織形成階段時,正常骨缺損癒合模型中的血凝塊纖維密度均明顯小於骨延遲癒合模型中的血凝塊纖維密度。
另外,本發明公開一種骨缺損中纖維緻密型血凝塊作為調節位點在篩選用於促進骨癒合的藥物中的用途。
本發明所述調節血凝塊纖維的結構在製備用於促進骨癒合的藥物中的用途對於骨科、口腔種植、頜面修復等領域具有重要意義。血凝塊無疑是最理想的『植入材料』,我們運用常見的骨缺損大鼠模型,對骨缺損中血凝塊分類這一概念進行了有益的提出,並通過調節血凝塊內部結構性質,從而促進骨缺損部位的骨再生,並且我們已經發現在正常骨缺損模型中的血凝塊邊緣存在一些「小孔」,而骨延遲癒合模型中血凝塊卻沒有發現類似結構。總之,血凝塊內部纖維結構的變化必將影響局部細胞的移入、粘附、增殖、分化和生長因子的粘附、釋放等一系列生理性活動,導致微環境的改變,從而影響骨的癒合進程。
附圖說明
圖1為骨折癒合的生理過程,引用自http://www.mc3cb.com;
圖2為骨折血凝塊形成的外源性凝血通路圖;
圖3為凝血酶作用下的纖維素纖維形成示意圖;
圖4為αC region結構及αC多聚體形成示意圖;
圖5為實施例1中正常骨缺損癒合模型和骨延遲癒合模型的骨缺損圖,即1mm和3mm骨缺損模型圖;
圖6中的A-E為實施例1中通過Micro-CT初步評估礦化骨組織新生量(BV)和總量(TV)的對比圖,Cartilage代表軟骨組織,Natural代表正常骨缺損癒合模型,Delayed代表骨延遲癒合模型,*代表新生礦化骨組織,A為第7天1mm骨缺損,B為第7天3mm骨缺損,C為第28天1mm骨缺損,D為第28天3mm骨缺損,E為第7和28天的BV/TV統計圖,F-I為組織學Safranin O染色圖,其中,F、G為第28天1mm的染色圖,H、I為第28天3mm的染色圖;
圖7為實施例3中正常骨缺損癒合模型和骨延遲癒合模型的纖維表面形貌和粗糙度等的差異電鏡圖(A-R),A、G、M為第1、4、7天1mm骨缺損中血凝塊的形態圖,D、J、P為第1、4、7天3mm骨缺損中血凝塊的形態圖;
圖8為本發明實施例4中血凝塊纖維結構的直徑和密度掃描電鏡圖,Natural和Natural healing均代表正常骨缺損癒合模型,Delayed和Delayed healing均代表骨延遲癒合模型,S、T為第1、4天1mm骨缺損中血凝塊邊緣的形態圖,U、V為第1、4天3mm骨缺損中血凝塊邊緣的形態圖;
圖9為本發明實施例5中調查不同濃度的GSNO調節血凝塊結構後對成骨的影響的SEM圖,A為0、0.1、1、10mM GSNO作用下,第1天血凝塊的掃描電鏡圖,B為手術過程中,加GSNO到3mm骨缺損部位,並和血液進行均勻地混合,C為不同濃度的GSNO作用下,纖維直徑的統計圖,D為不同濃度的GSNO作用下,纖維密度的統計圖;
圖10為本發明實施例5中調查不同濃度的GSNO調節血凝塊結構後對骨缺損中新生骨量的影響的X-ray和Micro-CT圖,A為第7、28天時,不同濃度的GSNO影響下骨缺損的X光片圖,B為第7、28天時,不同濃度的GSNO影響下骨缺損的Micro-CT圖和纖維直徑、密度統計圖。
具體實施方式
為更好地說明本發明的目的、技術方案和優點,下面將結合具體實施例對本發明作進一步說明。
實施例1正常骨缺損癒合(Normal bone healing,NBH)和骨延遲癒合(Delayed bone healing,DBH)模型建立
實驗方法:雄性Inbred fisher 344大鼠(6-8周)均分為正常骨缺損癒合組(直徑1mm,深度2mm)和骨延遲癒合組(直徑3mm,深度2mm)。Inbred fisher344大鼠是目前較為流行的一種鼠類,這種鼠類比較活躍相比其他種類,同時,該種屬的骨骼比較寬大,適合骨科手術。最重要的是,Inbred fisher 344大鼠屬於近親繁殖,所以一隻老鼠的細胞、組織等可以移植入另一隻老鼠體內,因為它們的血液具有同源性。麻醉狀態下,我們使用兩種不同規格的圓柱狀鑽頭(Australian Jewelers Supplies Pty Ltd.,Australia)在大鼠的雙側股骨內側髁上,分別鑽入直徑1mm+深度2mm和直徑3mm+深度2mm的骨缺損(圖5)。術後第7和28天,二氧化碳吸入法處死大鼠,取雙側股骨標本,行Micro-CT和Safranin O染色等方法來鑑定模型是否成功建立。
據文獻報導,1mm的大鼠骨缺損鑽孔模型在14天內,骨缺損癒合率高達92%,充分表明了1mm的骨缺損通過直接癒合的方式(膜內成骨)。同時,Marsell和Oryan也指出骨缺損範圍在800μm to 1mm,可直接通過膜內成骨。然而,在大鼠股骨內側髁鑽孔模型中,直徑3mm×深度2mm的骨缺損直到第90天時,癒合率僅為76.5±3.0%(仍未完全癒合),表明了該骨缺損通過間接癒合方式(軟骨內成骨)。根據骨癒合的標準,大鼠的骨正常癒合周期約為4-6周(28-42天),任何骨缺損超過42天或更長時間的癒合,均可視為骨延遲癒合。
實驗結果:如圖6中的A-E所示,通過Micro-CT初步評估礦化骨組織新生量(BV)和總量(TV)比值,可以發現在正常骨缺損癒合模型(1mm)中成骨速率遠比骨延遲癒合模型(3mm)的高,且具有顯著性統計學意義。第7天,1mm骨缺損中BV/TV比值為6.13%±0.86%(圖6A),而3mm骨缺損中BV/TV比值為1.80%±0.61%(圖6B)。第28天,1mm骨缺損中比值上升至66.01%±13.57%(圖6C),3mm骨缺損中比值上升達到35.65%±0.85%(圖6D)。
如圖6中的F、H所示,通過組織學Safranin O染色,軟骨組織(Cartilage)被染成典型的紅色。從1mm骨缺損來看,清晰地展示了在第28天中出現大量的新生礦化骨組織(*)(6G)。而從3mm骨缺損來看,由於血腫降解緩慢,停留在缺損部位時間過長,最後出現以纖維軟骨組織(Cartilage)主的典型骨延遲癒合表現(6I)。因此,可以鑑定模型的成功建立。
實施例2關於術後時間點的選擇
正常骨癒合的大致時間順序是:術後第1天,代表早期的血凝塊階段;術後第4天,新生肉芽組織形成;術後第7天,血凝塊大部分消失,軟組織和早期的礦化組織出現;術後第28天,新骨形成和塑形階段。
實施例3調查血凝塊在正常骨缺損癒合模型和骨延遲癒合模型中的結構性差異
實驗方法:
A.原始血凝塊形態觀察:術後第1、4、7天,NBH組和DBH組大鼠股骨分離後,使用磷酸鹽緩衝溶液(Phosphate buffer solution,PBS)(PH=7.4)衝洗至少3次,用3%戊二醛溶液過夜固定。標本被置於環境掃描電鏡SEM TM3000(Hitachi High-Technologies Corporation,Japan)中觀察血凝塊的自然形態。分別取血凝塊的邊緣和中心兩個區域,進行比較。放大率為50和1000倍,電壓範圍為15KV。
B.血凝塊中纖維結構的觀察:術後第1和4天,NBH組和DBH組的血凝塊隨著周圍骨和軟組織一起被移至二甲砷酸鹽緩衝液(0.1M)溶液中,後經4%餓酸後固定,不同梯度酒精脫水,固定和噴金。標本在掃描電鏡SEM Quanta 200(FEI,USA)下,放大率為5000倍,觀察纖維的直徑和密度等結構。通過組織學染色(HE染色)觀察血凝塊在NBH組和DBH組的形態學差異;通過原子力學顯微鏡(Atomic Force Microscopy,AFM),觀察纖維表面形貌和粗糙度等差異。
實驗結果:如圖7中的A、D所示,通過環境掃描電鏡觀察到,第1天時,在1mm骨缺損中血凝塊的邊緣部分(圖7C)發現有一些小孔狀結構(白色圓形框),而在3mm骨缺損中相同位置(圖7F)卻發現的是緻密的纖維結構。而兩者血凝塊的中央部分(圖7B、E),從視覺上來看,沒有發現明顯的區別。第4天時,在1mm骨缺損的血凝塊(圖7G)邊緣出現一些肉芽組織(圖7I),而3mm骨缺損的凝塊(圖7J)邊緣仍無明顯變化(圖7L)。而兩者血凝塊的中央部分(圖7H、K),未發現有明顯的結構變化。第7天時,在1mm骨缺損中大部分的血凝塊已經消退(圖7M、N、O),但在3mm骨缺損中血凝塊的主體部分仍然存在(圖7P、R、Q),相比第4天而言,在血凝塊的表面上的血細胞似乎明顯減少。
實施例4量化纖維的結構特徵
實驗方法:由實施例3進一步通過高解析度的掃描電鏡觀察第1和4天標本邊緣部分,藉助於Image J軟體從而量化纖維的結構特徵。
實驗結果:由圖8中的S-V看出,一方面,第1天時(圖8S、U),在1mm骨缺損中的血凝塊纖維直徑範圍約是397.58±125.34nm,而3mm骨缺損中的纖維直徑為245.76±41.26nm,具有明顯的統計學意義(P<0.001);第4天時(圖8T、V),兩者的值分別為295.72±49.86nm(1mm骨缺損)和226.16±57.0(3mm骨缺損),有明顯的統計學差異(P<0.001)。
另一方面,由圖8中的S-V看出,第1天時(圖8S、U),在1mm骨缺損中纖維密度約為8.65±2.1根/40μm2,相比而言,在3mm的骨缺損中纖維密度則為30.8±3.88根/40μm2(P<0.001)。第4天時(圖8T、V),1mm骨缺損中纖維密度為8.4±1.98根/40μm2,而3mm骨缺損中纖維密度為25.8±3.92根/40μm2(P<0.001)。
實施例5調查不同濃度的GSNO調節血凝塊結構後對成骨的影響
實驗方法:
A.麻醉狀態下,構建上述的骨延遲癒合骨缺損模型,隨後,不同濃度的GSNO(0,0.1,1或10mM)立即與骨缺損中血液進行適當地混合。過夜後,處死大鼠,使用上述高解析度的SEM進行血凝塊結構的觀察。
B.進行相同的手術方式後,加入不同濃度的GSNO,術後第7和28天,處死大鼠,進行X光片和Micro-CT檢測,評估骨缺損中新生骨量的情況。
實驗結果:如圖9中的A-D所示,SEM觀察後統計顯示,血凝塊中纖維平均直徑從245.8±41.7nm(空白對照組)上升至316.9±104nm(0.1mM GSNO組),隨著GSNO濃度增加,直徑增加到最大值596.6±249.4nm(1mM GSNO組)(P0.05)。而對比1mM GSNO組時,纖維密度則發生明顯下降(空白對照組為18.0±2.7根/40μm2,1mM GSNO為5.2±2.3根/40μm2),繼續增加GSNO至10mM時,纖維的生成幾乎全部消失。
如圖10中的A所示,第7和28天時,通過X-ray可以發現0.1和1mM GSNO組中骨缺損部位有骨癒合跡象,而10mM GSNO組骨缺損部位,仍有較明顯的缺損存在。圖10中的B所示,通過Micro-CT再次評估BV和TV比值發現,第7天時,在0.1和1mM GSNO組中骨量增加有顯著的統計學意義,其值分別為(15.41%±1.24%和18.35%±1.34%)(P<0.01)。第28天時,在0.1mM GSNO組中BV和TV比值達到55.17%±11.05%,相比空白對照組中36.65%±1.04%,具有統計學差異(P<0.05)。隨著GSNO濃度達到1mM時,其比值繼續增大至63.72%±14.13%。然而,對比10mM GSNO組和空白對照組,並未發現有明顯的統計學差異。
結論,我們首次揭示了血凝塊的質地在正常骨癒合模型和骨延遲癒合模型中的顯著差異,通過亞硝基穀胱甘肽幹預血凝塊的纖維結構,使其變為纖維疏鬆型血凝塊後能明顯地加快骨缺損癒合進程,從而得出一種篩選用於促進骨癒合的藥物的方法,其包括以下步驟:(1)提供纖維緻密型的血凝塊;(2)將待測物質與步驟(1)的血凝塊混合,調節血凝塊的結構;(3)如果步驟(2)中的血凝塊的結構由纖維緻密型變為纖維稀疏型,那麼步驟(2)中的待測物質為促進骨癒合的藥物。
最後所應當說明的是,以上實施例僅用以說明本發明的技術方案而非對本發明保護範圍的限制,儘管參照較佳實施例對本發明作了詳細說明,本領域的普通技術人員應當理解,可以對本發明的技術方案進行修改或者等同替換,而不脫離本發明技術方案的實質和範圍。
