一種內摻碳鋰離子電池材料及其製備方法與流程
2023-12-03 04:05:16 4
本發明屬於鋰離子電池領域,尤其涉及一種鋰離子電池材料及其製備方法。
背景技術:
現如今,全世界越來越多的人關注電動汽車(EVs),混合型電動汽車(HEVs)以及插入式混合型電動汽車(PEVs),它們都配備有高容量和高能量的鋰離子電池(LIBs)。作為最具潛力的LIBs正極材料的一種,橄欖石結構的磷酸鐵鋰(LFP)首次在1997年被Goodenough提出,由於其大規模和高倍率的應用立即得到了廣泛的關注。據報導LFP作為LIBs正極材料具有許多重要的優勢,包括容量較高,安全性能高,穩定性能高,可接受的工作電壓(3.4 V vs. Li+/Li),環境兼容性良好以及價格低廉。
但是和其他常用的鋰離子電池(LIBs)正極材料比較起來,LFP的理論容量比較低(170 mA h g-1)以及振實密度也比較低(1.1-1.3 g mL-1),這導致了LFP的體積能量密度並不高(600 W h L-1),並且在LFP的發展過程中,鋰離子和電子的傳輸問題仍然需要進一步改善。由於離子遷移率低,一些鋰離子不能定向地從橄欖石結構中完全脫離出來,這會導致一些容量的損失,進而導致商業化的LFP容量較低(低於150 m Ah g-1)。因此,LFP大多只是應用在固定的能量儲存上,例如可再生能源,智能電網以及車載電能儲存(HEVs,EVs和PEVs),而在可攜式電動設備上應用很少。
鈷酸鋰(LiCoO2)被廣泛用於可攜式設備,例如手機,電腦和照相機。LiCoO2主要優勢是體積能量密度高(1200 W h L-1),這得益於它高的振實密度(2.2 g mL-1),這幾乎是商業LFP的兩倍數值。但是LiCoO2的最大問題是容量衰減嚴重,這導致了LiCoO2的循環次數只有500左右。因此,商業化的LiCoO2面臨著壽命短的問題。
近來,越來越多的生物質材料被應用到製備鋰離子電池正極和負極材料,這主要是由於生物質材料具備環境友好性,儲存量豐富以及可持續性。生物質材料內部的碳源往往會影響材料最後的形貌和性能。植酸(PhyA){化學式C6H6(H2PO4)6},其以肌醇六磷酸或肌醇六磷酸鹽的形式被廣泛熟知,並且也是儲存磷的主要形式。植酸主要存在於豆類,包括大豆和玉米,它是一種天然存在的無毒有機大分子化合物。但是作為一種抗營養因子,植酸限制了豆類在食物和飼料中的應用。因此,植酸的分離和使用顯得尤為重要。植酸分子包含了6個碳原子和6個磷酸基團。植酸的特殊結構致使它可以和許多多價帶電陽離子發生螯合作用,比如Fe2+, Fe3+, Ca2+, Mg2+,和Zn2+,這是由於植酸表面很強的電負性。它們形成的螯合物在酸性條件下是可溶的而在中性條件下出現沉澱。
現有技術中有用植酸製備了碳包覆的磷酸鐵鋰(LiFePO4/C),他的具體方案是:
第一步:將植酸和LiOH先溶解在去離子水裡形成棕黃色的透明溶液,在不斷攪拌的條件下加入FeSO4,植酸/FeSO4/LiOH為1:6:18,溶液中Li/Fe/P的比例為3:1:1;
第二步:用氮氣鼓泡半小時;
第三步:鼓泡完成後,將溶液迅速轉移到不鏽鋼製的反應釜中,升溫到180℃並保持6小時後自然冷卻到室溫;
第四步:離心收集出沉澱物,用去離子水和乙醇反覆洗滌,最後在60℃乾燥8h;
第五步:將上述乾燥材料在管式爐中加熱到675 ℃,並通入含95%的氬氣和5%的氫氣的混合氣體,保溫12小時。
第六步:將純度為50%的乙炔氣體引入到上述管式爐中,通氣速率為30 cm3 min-1,通氣半小時後冷卻到室溫即可。
該方法是用植酸製備了碳包覆的磷酸鐵鋰LiFePO4/C,其製備出來的材料在1 C(庫倫)下容量僅為120 mA h g-1,0.1 C(庫倫)僅為140-160 mA h g-1,遠遠低於其它大多數製備出的磷酸鐵鋰的性能。其原因在於:1、沒有調節溶液最終的pH。由於植酸為十二元酸,且為粘稠液體,這導致了植酸不能像磷酸那樣快速且充分地溶解和反應。在該方法的比例下最終溶液的pH為較強的鹼性(10.2-11.8),這極易導致Fe2+在水溶液中被氧化成Fe3+,導致最終材料中Li+的含量嚴重不足引發容量大為減少;2、由於其煅燒溫度675 ℃,煅燒溫度不夠,植酸分解不徹底,導致能夠儲存額外鋰離子的內摻碳沒能很好地形成,沒有發揮植酸的最大的優勢;3、煅燒時間過長導致LFP晶體進一步增長以及晶體顆粒團聚嚴重,導致內摻碳很難進入到LFP晶體內並影響到最終的結構和性能;4、由於植酸是十二元酸,植酸和FeSO4的反應不如磷酸和FeSO4的反應速度快,先用LiOH和植酸混合反應,再加入FeSO4,這會導致了Fe2+和植酸在初期不能進行充分地反應,同時也增加了Fe2+被氧化的風險,這必然會影響到最終產物的成分,導致容量偏低;5、沒有在水熱反應中加入保護劑,無法有效地阻礙Fe2+的氧化,這必然會影響到最終產物的成分,導致容量偏低。總的說來,該方法最主要還是沒能夠得到足夠的內摻碳,並對LFP材料的結構和性能起到明顯的改善作用,以及Fe2+極易被氧化導致Li+含量不足從而引發能量損失。最終導致該材料在1 C(庫倫)下容量僅為120 mA h g-1,0.1 C(庫倫)僅為140-160 mA h g-1。
現有技術中還有通過電化學剝離薄層石墨烯(EG片),然後將其與商業化的磷酸鐵鋰材料複合形成薄層石墨烯包覆的磷酸鐵鋰(cLFP),然後經過水熱反應180℃反應,最後組裝成電池。該技術得到的cLFP雖然在0.1 C(庫倫)下的容量達到了208 mA h g-1,但是他所使用的石墨烯卻是非常昂貴的材料,生產成本高,在當前並不利於材料的大規模生產。
綜上所述,採用上述兩種方法製備出來的磷酸鐵鋰材料存在如下缺陷:
1、採用植酸製備出來的碳包覆磷酸鐵鋰(LiFePO4/C)材料在0.1 C(庫倫)僅為140-160 mA h g-1,嚴重低於磷酸鐵鋰的理論容量(170 mA h g-1),無法應用到大規模工業化生產。
2、薄層石墨烯包覆的磷酸鐵鋰(cLFP)雖然在0.1 C(庫倫)下的容量達到了208 mA h g-1,但是他所使用的石墨烯卻是非常昂貴的材料,生產成本高,在當前並不利於材料的大規模生產。
綜上所述,上述鋰離子電池材料各有自己的缺點,目前並沒有一種兼具上述鋰離子電池材料所有優點的鋰離子電池材料,因此,開發出一種容量高、振實密度高、使用壽命長且生產成本低的鋰離子電池材料是十分必要的。
技術實現要素:
為了克服上述現有鋰離子電池材料存在的各自的缺陷,本發明提供了一種內摻碳鋰離子電池材料,該鋰離子電池材料具有容量高、振實密度高、使用壽命長且生產成本低的優點。
為解決上述技術問題,本發明所採用的技術方案是:
一種內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳。
所述內摻碳鋰離子電池材料中,鋰、過渡金屬和磷元素的摩爾比為:鋰:過渡金屬:磷=(1.1~1.9):1:(0.8~1.2)。
本發明還提供了一種製備上述內摻碳鋰離子電池材料的方法,該方法製備出來的內摻碳鋰離子電池材料在低倍率下容量能夠超過磷酸鐵鋰的理論容量,振實密度高、使用壽命長,而且不用石墨烯包覆磷酸鐵鋰,生產成本低,利於大規模的推廣應用,該方法具體為:
步驟1,將具有碳基團的磷源、水溶性過渡金屬源、去離子水和水溶性鋰源混合溶解形成初始溶液Ⅰ;或者將具有碳基團的過渡金屬源、水溶性磷源、去離子水和水溶性鋰源混合溶解形成初始溶液Ⅱ;或者將具有碳基團的磷源和具有碳基團的過渡金屬源的混合物、去離子水和水溶性鋰源混合溶解形成初始溶液Ⅲ;或者將具有碳基團的磷源和具有碳基團的過渡金屬源的混合物、不具有碳基團的磷源的水溶性磷源或不具有碳基團的水溶性過渡金屬源、去離子水和水溶性鋰源混合溶解形成初始溶液Ⅳ;
步驟2,調節步驟1中初始溶液Ⅰ、初始溶液Ⅱ、初始溶液Ⅲ和初始溶液Ⅳ的pH值至5.5-10.5後,反應0.5-2 h;
步驟3, 將經過步驟2後的溶液加熱至180-240 ℃後,反應1-12 h;
步驟4, 將經過步驟3處理後得到的材料用去離子水洗0-2次,再用乙醇洗1次,然後進行離心分離,在水洗和醇洗時,加入的去離子水和醇的量要保證材料在去離子水和醇中的濃度為0.01-0.15 g mL-1;
步驟5,乾燥經過步驟4處理後的材料;
步驟6,向經過步驟5處理的後的材料中摻入碳源;
步驟7,將經過步驟6處理後的材料在惰性氣體、還原性氣體或兩者的混合氣體的氣氛下進行煅燒,煅燒溫度為:700-900 ℃,煅燒時間為:1-6 h。
步驟1中,所述初始溶液Ⅰ、初始溶液Ⅱ、初始溶液Ⅲ和初始溶液Ⅳ中的鋰:過渡金屬:磷的摩爾比=(2-4):(0.5-1.5):(0.5-1.5)。
步驟1中初始溶液Ⅰ、初始溶液Ⅱ、初始溶液Ⅲ和初始溶液Ⅳ中還要加入保護劑,保護劑為乙二醇、丙三醇或者二者的組合物。
所述初始溶液Ⅰ、初始溶液Ⅱ、初始溶液Ⅲ和初始溶液Ⅳ中去離子水和保護劑的體積比例為(0.5-5):1。
步驟1到步驟2中均通入惰性氣體、還原性氣體或者惰性氣體和還原性氣體的混合氣體,通氣速率為100-250 cm3 min-1,優選通氣速率為150-180 cm3 min-1。
步驟1到步驟2中,需要用磁力攪拌器進行攪拌。
步驟1中具有碳基團的磷源為植酸或者植酸鹽,植酸鹽為植酸鈉、植酸鉀、植酸鈣等鹽中的一種或多種。
步驟1中具有碳基團的過渡金屬源為含有碳基團的鐵、鈷、錳和鎳金屬源。
步驟1中水溶性過渡金屬源為鐵源為水溶性二價鐵源、水溶性鈷源、水溶性錳源或水溶性鎳源,例如水溶性二價鐵源可選擇硫酸亞鐵、氯化亞鐵、溴化亞鐵、硝酸亞鐵、醋酸亞鐵中的一種或多種,加入的水溶性二價鐵源需要充分溶解到溶液中。
步驟1中,水溶性鋰源選用氫氧化鋰、乙酸鋰、溴化鋰、氯化鋰、碘化鋰和硝酸鋰中的一種或多種,需要緩慢逐滴加入到步驟3中的溶液中,進行充分反應。
步驟2中,通過加入植酸或者氫氧化鋰調節溶液的pH值至6.8-7.2,溶液反應2 h。
步驟3中,將經過步驟2後的溶液快速轉移到反應釜中後,通過反應釜對溶液加熱至180-240 ℃後,反應1-12 h。
步驟3中,在將經過步驟2後的溶液快速轉移到反應釜中後,先向反應釜中通入惰性氣體、還原性氣體或者兩者的混合氣體,至少通氣5分鐘後,關閉反應釜的進氣口和出氣口,然後再將反應釜升溫至180-240 ℃後,反應1-12 h。
步驟3中,反應釜選用高溫高壓反應釜,並且用磁力攪拌器攪拌,通氣10 min後,高溫高壓反應釜升溫至200 ℃後,反應2-3h。
步驟5中,乾燥溫度為60 ℃-120 ℃下,乾燥時間為8-24 h,採用真空乾燥的方式進行乾燥,乾燥溫度優選80 ℃,乾燥時間優選12 h。
步驟6中,摻入的碳源的量為經過步驟5處理後的材料重量的5%-30%。
步驟6中,碳源為有機碳源,如葡萄糖、蔗糖、乳糖、麥芽糖、酚醛樹脂、環氧樹脂、聚乙二醇或者無機碳源,如乙炔氣,碳源摻入的量優選為經過步驟5的材料重量的10%。
在步驟6和步驟7之間還設置有冷壓步驟,將步驟10得到的材料冷壓製成圓片,圓片狀材料半徑為0.5-10 cm,厚度為0.5-12 mm,優選圓片狀材料半徑為2-4 cm,厚度為2-4 mm。
步驟7中,煅燒溫度為750 ℃,煅燒時間為2-3h。
相對於現有技術,本發明存在以下有益效果:
1、本發明提供的內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳。所述內摻碳鋰離子電池材料中,鋰、過渡金屬和磷元素的摩爾比為:鋰:過渡金屬:磷=(1.1~1.9):1:(0.8~1.2)。由於含有鋰和過渡金屬的磷酸鹽晶體內摻碳,且內摻碳上具有可以和鋰離子進行可逆的氧化還原反應的含氧官能團,顯著提高了含有鋰和過渡金屬的磷酸鹽的容量,其容量在0.1 C可以達到218 mA h g-1,遠遠超出了LFP理論容量值(170 mA h g-1),由於含有鋰和過渡金屬的磷酸鹽晶體外包覆碳,改善了磷酸鐵鋰的導電性,這也有利於本發明提供的含有鋰和過渡金屬的磷酸鹽的容量在低倍率能夠超過LFP的理論容量。
2、本發明還提供了內摻碳鋰離子電池材料的製備方法, 本方法增加了調節初始溶液Ⅰ、初始溶液Ⅱ、初始溶液Ⅲ和初始溶液Ⅳ的pH值至5.5-10.5後,反應0.5-2 h的步驟,如果pH值過高,過渡金屬離子在水溶液中非常容易被氧化,導致最終材料中Li+的含量不足引發容量損失;pH值過低,形成的含有鋰和過渡金屬的磷酸鹽材料在酸性條件中,會部分溶解,也會影響材料最後的形成。所以說pH值過低或者過高都會影響到含有鋰和過渡金屬的磷酸鹽的生長,必須控制在5.5-10.5,而背景技術中並沒有對pH進行控制,如果按照背景技術中的比例加入試劑,pH就會過高,而它容量很低就是因為裡面部分過渡金屬離子被氧化,導致其中Li+含量嚴重不足,最終導致了其容量較低;3.本發明是先摻入有機碳源,形成碳包覆之後再進行管式爐煅燒,這樣的好處在於,外部碳能夠充分地包覆在磷酸鐵鋰的表面,從而改善材料的導電性能。4.本發明在煅燒時的溫度為700-900 ℃下,煅燒時間為1-6 h,相對於背景技術來說,煅燒溫度更高,煅燒時間更少,而正是由於煅燒溫度提高到700℃,才使得具有碳基團的磷源和具有碳基團的過渡金屬源分解徹底,保證能夠儲存額外鋰離子的內摻碳很好地形成在含有鋰和過渡金屬的磷酸鹽晶體內,發揮植酸的最大的優勢,而煅燒時間縮短到6h以下,就能夠有效避免含有鋰和過渡金屬的磷酸鹽晶體增長以及晶體顆粒團聚,保證內摻碳能夠進入到含有鋰和過渡金屬的磷酸鹽晶體晶體內,最終形成外包覆碳且內摻碳的含有鋰和過渡金屬的磷酸材料,並使得在低倍率下容量超過磷酸鐵鋰的理論容量;5、在本發明中,步驟3得到的材料用去離子水洗0-2次,再用乙醇洗1次,然後進行離心處理,在水洗和醇洗時,加入的去離子水和醇的量要保證步驟3得到的材料在去離子水和醇中的濃度為0.01-0.15 g mL-1;如果反覆地水洗或者醇洗,將會把材料最後的內摻碳上需要的額外鋰離子洗掉,從而影響到材料最終的性能不會特別高。另外還會洗掉額外的具有碳基團的磷源和具有碳基團的過渡金屬源,而正是這些額外的具有碳基團的磷源和具有碳基團的過渡金屬源在煅燒過程中會形成最後的內摻碳,如果在洗滌過程中,額外的具有碳基團的磷源和具有碳基團的過渡金屬源被洗掉,會導致最終材料中沒有足夠的內摻碳的存在,從而無法為額外的鋰離子提供位置,從而不能提供額外的容量。這樣能保證最後得到足夠的內摻碳可以和鋰離子進行可逆的氧化還原反應,從而表現出超高容量的性能。
3、本發明經過保護劑的保護、二價鐵源與植酸進行反應、調節pH值5.5-10.5後反應0.5-2 h、先摻外碳後再煅燒以及煅燒溫度控制在700-900℃,煅燒時間控制在6h以下,才使得最後得到我們的最終產物形成了外包覆碳且內摻碳的的特殊結構,有機碳源作為外部摻入的碳源(GC)包覆在含有鋰和過渡金屬的磷酸鹽表面上,具有碳基團的磷源或者具有碳基團的過渡金屬源分解後的碳作為內部碳源(IC)存在於含有鋰和過渡金屬的磷酸鹽晶體內。最後製備出來的複合物展示出了它的特殊的形貌結構以及優異的電化學性能。最為重要的是,複合物展現了超越LFP理論容量的優異性能。而正是這種IC給本發明中的材料提供了額外的容量,使得材料的容量在0.1 C可以達到218 mA h g-1,遠遠超出了LFP理論容量值(170 m Ah g-1)。
4、本發明通過冷壓製片煅燒的方式使得材料振實密度可以達到1.5 g mL-1。同時還能防止過渡金屬離子被氧化,有利於最後產物的形成,在具備高容量和高振實密度的情況下,GC/IC/LFP的體積能量密度也可以達到1200 WhL-1。遠遠超過常規商用的LFP(600 W h L-1),材料的體積能量密度可以媲美LiCoO2。另外,商用LFP的壽命可以達到2000圈以上,這一點遠遠超過了LiCoO2。因此,考慮到安全性高,體積能量密度高以及使用壽命長,具有很大潛力成為一些可攜式設備的備選材料。本發明採用的是有機碳源作為外包覆碳,具有碳基團的磷源或者具有碳基團的過渡金屬源提供的碳作為內摻碳,相對於現有的用石墨烯包覆來講,生產成本大大降低,利於大規模生產。
5、步驟3中,在將經過步驟2後的溶液快速轉移到反應釜中後,先向反應釜中通入惰性氣體、還原性氣體或者兩者的混合氣體,至少通氣5分鐘後,關閉反應釜的進氣口和出氣口,然後再將反應釜升溫至180-240 ℃後,反應1-12 h。通入惰性氣體、還原性氣體或者兩者的混合氣體的目的在於排出反應釜內的氧氣,防止過渡金屬離子被氧氣氧化,而步驟1到步驟2中通入惰性氣體、還原性氣體或者惰性氣體和還原性氣體的混合氣體,也是為了防止過渡金屬離子被氧氣氧化。
附圖說明
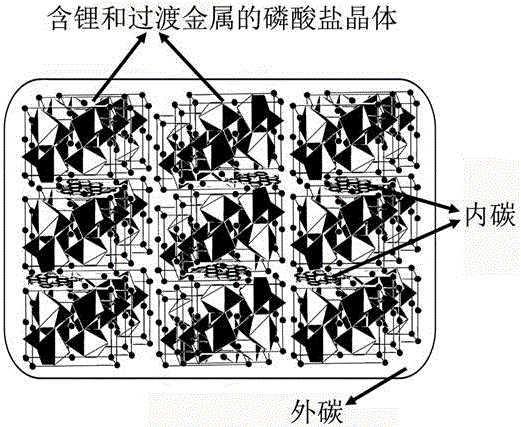
圖1 為 GC/IC/LFP結構示意圖;
圖2a為GC/LFP和GC/IC/LFP的XRD(X射線衍射)圖;
圖2b為圖2a中部分衍射峰局部放大圖;
圖2c為GC/IC/LFP的HRTEM(高解析度透射電鏡)圖;
圖2d為GC/LFP的HRTEM圖;
圖3為在低頻區間,GC/LFP和GC/IC/LFP的阻抗和角頻率的負二分之一次方之間相應的變化以及擬合曲線圖;
圖4為IC的XP SC1s(X射線光電子能譜碳1s分譜)譜圖;
圖5為SiO2,GC/SiO2和IC/SiO2的循環伏安圖,掃速為1 mV s-1;
圖6為0.1 C下GC/IC/LFP的充放電曲線;
圖7a為C/LFP/ECGO(電化學剝離氧化石墨)和GC/IC/LFP的充放電曲線圖;
圖7b為對圖7a中的曲線作出的微分曲線圖;
圖7c為SiO2,GC/SiO2和IC/SiO2的充放電曲線圖;
圖7d為對圖7c中IC/SiO2曲線作出的微分曲線圖;
圖8為GC/LFP和GC/IC/LFP的循環伏安圖,掃速0.1 mV s-1;
圖9a為GC/IC/LFP前驅體的SEM圖;
圖9b為GC/IC/LFP前驅體的TEM圖;
圖9c為GC/IC/LFP的SEM圖;
圖9d為GC/IC/LFP的TEM圖;
圖9e為GC/LFP的SEM圖;
圖9f為GC/LFP的TEM圖;
圖10為本發明GC/IC/LFP和現有的GC/LFP中元素含量對比表。
具體實施方式
本發明的原理為:
植酸製備的內碳IC能夠深入到LFP晶格內部(圖1),使得LFP的晶格參數獲得一定程度的增加(圖2),例如衍射峰的位置左移(圖2b)以及晶格間距的增長(圖2d為常見的磷酸製備的GC/LFP;圖2c為我們植酸製備的GC/IC/LFP)。上述因素將有利於促進LFP中鋰離子的擴散(圖3),進而改善LFP的性能。對比圖3中兩種材料在Warburg區域(低頻段區域)內斜率可以看出本申請中GC/IC/LFP具備更高的鋰離子擴散常數(D)。
植酸製備的內碳IC上富含很多含氧官能團(圖4)。對於碳材料,表面含氧功能化基團的引入是一種提高材料能量密度的有效方法。這種羰基或者其他含氧基團中的氧原子往往結合在碳的邊緣位置。這種表面含氧功能化基團能夠經歷可逆的法拉第反應,這種特徵性的法拉第反應峰往往出現在3.0 V和3.4 V附近(vs. Li+/Li)。該氧化還原反應可以表示如下:-C=O + Li+ + e- ↔ -C-OLi。含氧基團的氧化還原峰的位置會因為碳的形式以及碳的含量不同而有所改變。具有豐富含氧官能團的IC也具備上述特徵(圖5),它的氧化還原峰出現在大約3.3 V和3.5 V,而葡萄糖製備的GC由於缺乏含氧官能團導致沒有出現明顯的氧化還原峰。
正是這些富有含氧官能團的IC給更多的鋰離子提供了儲存位置,導致GC/IC/LFP中鋰離子含量偏高(圖10),圖10中對比了本申請中的GC/IC/LFP和常規的GC/LFP中元素含量的對比。而正是這種IC給本申請中的材料GC/IC/LFP提供了額外的容量,導致材料的容量在0.1 C可以達到218 mA h g-1(圖6),遠遠超出了LFP理論容量值(170 mA h g-1)。
對材料的充放電曲線進行微分處理也能得到相對應的結果。圖7b便是圖7a中充放電曲線的微分曲線,可以看出普通的GC/LFP只有一對峰,說明它的容量就是來源於LFP本身。但是本申請中的GC/IC/LFP擁有兩對峰,除了LFP的主峰外,還有一對次峰,而這對次峰的電壓位置就在3.34 V和3.49 V附近,和圖5中IC的氧化還原峰的位置是一致的。說明這對次峰就是IC的氧化還原峰,而正是IC提供了額外的容量導致GC/IC/LFP擁有遠遠超越理論容量的優異性能。此外,單獨測試IC的充放電曲線以及相應的微分曲線也能得到同樣的證明(圖7c和7d)。這更加證明了本申請的上述機理解釋。
對本申請的GC/IC/LFP和常規的GC/LFP只做循環伏安測試(圖8),也是能夠看出GC/IC/LFP擁有兩對氧化還原峰,並且面積也比GC/LFP大,證明了GC/IC/LFP的容量的確比GC/LFP更大。
結構特徵:
GC/IC/LFP和GC/LFP的形貌和結構通過SEM和TEM表徵出來。圖9a是水熱反應後GC/IC/LFP的前驅體(就是GC/IC/LFP未煅燒前的物質)。此時的晶體呈現出半徑大約1 μm的橢球體,每一個橢球體是由大量的藥片狀(50 nm左右)的納米晶體所構成。這些精細的晶體有序地排列組裝形成了大的晶體。如圖9b所示,GC/IC/LFP前驅體的晶體呈現出正方形的片狀結構,這些晶體恰當有序地排列。但是在煅燒之後,相較於前驅體,GC/IC/LFP結構和形貌發生了徹底地改變。如圖10c所示,煅燒後的材料變成了無序且擁簇在一起的塊狀晶體。這些所形成的磷酸鹽呈現出有稜有角的塊狀晶體,這是和使用磷酸製備的GC/LFP晶體是有所不同的(圖9e),因為常規的GC/LFP晶體是光滑圓潤的。圖9c顯示了我們的塊狀晶體尺寸大約在100到300 nm之間。另外,IC在IC/LFP沒能通過SEM觀察到(圖9d)。綜上所述,IC片從植酸鹽中分離出來然後存在於LFP晶體之間,而GC包覆在LFP晶體之外(圖9f)。
下面結合實施例對本發明作進一步的描述,所描述的實施例僅僅是本發明一部分實施例,並不是全部的實施例。基於本發明中的實施例,本領域的普通技術人員在沒有做出創造性勞動前提下所獲得的其他所用實施例,都屬於本發明的保護範圍。
實施例1
一種內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳,所述含有鋰和過渡金屬的磷酸鹽為磷酸鐵鋰,該內摻碳鋰離子電池材料中鋰、鐵和磷元素的重量比為:Li:Fe:P=1.1:1:1.08。
該實施例的內摻碳鋰離子電池材料的製備方法為:包括如下步驟:
步驟1,將植酸(具有碳基團的磷源)與去離子水混合,通入氬氣,通氣速率為100 cm3min-1,同時用磁力攪拌器攪拌溶液;
步驟2,將硫酸亞鐵,加入到步驟1中的溶液中溶解;
步驟3,將乙二醇加入步驟2中的溶液中溶解;
步驟4,將氫氧化鋰溶解到水中,然後加入步驟3中的溶液中,進行反應,形成初始溶液,初始溶液需要滿足如下要求:鋰:鐵:磷的摩爾比=2:1.5:0.5溶液中水和乙二醇的體積比例為0.5:1。
步驟5,測量經過步驟4後溶液的pH值,根據pH值用氫氧化鋰或者植酸調節pH值至5.5,讓溶液反應0.5 h;
步驟6, 將經過步驟5後的溶液快速轉移到不鏽鋼高溫高壓反應釜中,並且繼續用磁力攪拌器攪拌和通入氬氣,通氣10 min後封閉進氣口和出氣口,開始升溫反應,反應釜升溫至180 ℃後,反應10 h;
步驟7, 讓反應釜自然冷卻至室溫,拆釜收集得到的材料;
步驟8,醇洗1次,然後進行離心處理,在醇洗時,加入醇的量要保證步驟7得到的材料在醇中的濃度為0.01 g mL-1;
步驟9, 將收集到的材料在120 ℃下,真空乾燥8 h;
步驟10, 摻入葡萄糖後混合均勻,摻入的葡萄糖的重量為經過步驟9處理後的材料重量的5%;
步驟11, 將經過步驟10的材料進行冷壓成圓片,圓片狀材料半徑為0.5cm,厚度為0.5 mm;
步驟12, 將冷壓後的圓片材料放置在管式爐中,通入高純氬氣,在700℃下煅燒6 h。
經過上述步驟處理後,就得到了由葡萄糖製備的外碳包覆且內摻碳的磷酸鐵鋰材料,其在0.1C下容量為(202 mA h g-1)。
實施例2
一種內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳,所述含有鋰和過渡金屬的磷酸鹽為磷酸錳鋰,該內摻碳鋰離子電池材料中鋰、錳和磷元素的重量比為:鋰:錳:磷=1.9:1:0.8。
該實施例的製備方法,其特徵在於:包括如下步驟:
步驟1,將植酸鈉(具有碳基團的磷源)與去離子水混合,通入氦氣,通氣速率為150 cm3min-1,同時用磁力攪拌器攪拌溶液;
步驟2,將硫酸錳加入到步驟1中的溶液中溶解;
步驟3,將丙二醇加入步驟2中的溶液中溶解;
步驟4,將乙酸鋰溶解到水中,然後加入步驟3中的溶液中,進行反應,步驟4中形成的溶液需要滿足如下要求:鋰:錳:磷的摩爾比=2:1.1:0.8,溶液中去離子水和丙二醇的體積比例為5:1。
步驟5,測量經過步驟4後溶液的pH值,根據pH值用氫氧化鋰或者植酸調節pH值至6.8,讓溶液反應1 h;
步驟6, 將經過步驟5後的溶液快速轉移到不鏽鋼高溫高壓反應釜中,並且繼續用磁力攪拌器攪拌和通入氦氣,通氣5 min後封閉進氣口和出氣口,開始升溫反應,反應釜升溫至200 ℃後,反應8 h;
步驟7, 讓反應釜自然冷卻至室溫,拆釜收集得到的材料;
步驟8,用去離子水水洗1次步驟7得到的材料後,再醇洗1次,然後進行離心處理,在水洗和醇洗時,加入的去離子水和醇的量要保證步驟7得到的材料在去離子水和醇中的濃度為0.06g mL-1;
步驟9, 將收集到的材料在60 ℃下,真空乾燥24 h;
步驟10, 摻入蔗糖,混合均勻,摻入的蔗糖的重量為經過步驟9處理後的材料重量的10%;
步驟11, 將經過步驟10的材料進行冷壓成圓片,圓片狀材料半徑為1 cm,厚度為2 mm;
步驟12, 將冷壓後的圓片材料放置在管式爐中,通入純度為99.99%的氦氣,在850℃下煅燒1.5 h。
經過上述步驟處理後,就得到了由蔗糖製備的外碳包覆且內摻碳的磷酸錳鋰材料,在0.1 C下容量為212 mA h g-1。
實施例3
一種內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳,所述含有鋰和過渡金屬的磷酸鹽為磷酸鈷鋰,該內摻碳鋰離子電池材料中鋰、鈷和磷元素的重量比為:鋰:鈷:磷=1.6:1:1。
該實施例的製備方法為:包括如下步驟:
步驟1,將二茂鈷(具有碳基團的過渡金屬源)與去離子水混合,通入氖氣,通氣速率為180 cm3 min-1,同時用磁力攪拌器攪拌溶液;
步驟2,將磷酸加入到步驟1中的溶液中溶解;
步驟3,將乙二醇和丙二醇的混合物加入到步驟2中的溶液中溶解;
步驟4,將溴化鋰溶解到水中,然後加入到步驟3中的溶液中,進行反應,鋰:鈷:磷的摩爾比=4:1:1.5,溶液中水和兩種醇的混合物的體積比例為2:1。
步驟5,測量經過步驟4後溶液的pH值,根據pH值用氫氧化鋰或者植酸調節pH值至7.2,讓溶液反應1.2 h;
步驟6, 將經過步驟5後的溶液快速轉移到不鏽鋼高溫高壓反應釜中,並且繼續用磁力攪拌器攪拌和通入氬氣,通氣20 min後封閉進氣口和出氣口,開始升溫反應,反應釜升溫至220 ℃後,反應3 h;
步驟7, 讓反應釜自然冷卻至室溫,拆釜收集得到的材料;
步驟8,用去離子水水洗2次步驟7得到的材料後,再醇洗1次,然後進行離心處理,在水洗和醇洗時,加入的去離子水和醇的量要保證步驟7得到的材料在去離子水和醇中的濃度為0.02 g mL-1;
步驟9, 將收集到的材料在100 ℃下,真空乾燥10 h;
步驟10, 摻入乳糖,混合均勻,摻入乳糖的重量為經過步驟9處理後的材料重量的15%;
步驟11, 將經過步驟10的材料進行冷壓成圓片,圓片狀材料半徑為2 cm,厚度為1.5 mm;
步驟12, 將冷壓後的圓片材料放置在管式爐中,通入純度為99.999%的氪氣,在750℃下煅燒2 h。
經過上述步驟處理後,就得到了由乳糖製備的外碳包覆且內摻碳的磷酸鈷鋰材料,其在0.1C下容量為182 mA h g-1。
實施例4
一種內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳,所述含有鋰和過渡金屬的磷酸鹽為磷酸鎳鋰,該內摻碳鋰離子電池材料中鋰、鎳和磷元素的重量比為:鋰:鎳:磷=1.5:1:1.1。
該實施例的內摻碳鋰離子電池材料的製備方法為:包括如下步驟:
步驟1,將一苯基膦酸(具有碳基團的磷源)與二茂鎳(具有碳基團的過渡金屬源)去離子水混合,通入氙氣,通氣速率為200 cm3 min-1,同時用磁力攪拌器攪拌溶液;
步驟2,將氯化鎳,加入到經過步驟中的溶液中溶解;
步驟3,將乙二醇加入步驟2中的溶液中溶解;
步驟4,將氯化鎳溶解到水中,然後加入到步驟3中的溶液中,進行反應,步驟4中形成的溶液需要滿足如下要求:鋰:鎳:磷的摩爾比=3:1.5:0.5,溶液中水和乙二醇的體積比例為4.5:1。
步驟5,測量經過步驟4後溶液的pH值,根據pH值用氫氧化鋰或者植酸調節pH值至8,讓溶液反應2 h;
步驟6, 將經過步驟5後的溶液快速轉移到不鏽鋼高溫高壓反應釜中,並且繼續用磁力攪拌器攪拌和通入氫氣,通氣15 min後封閉進氣口和出氣口,開始升溫反應,反應釜升溫至240 ℃後,反應6 h;
步驟7, 讓反應釜自然冷卻至室溫,拆釜收集得到的材料;
步驟8,用去離子水水洗2次步驟7得到的材料後,再醇洗1次,然後進行離心處理,在水洗和醇洗時,加入的去離子水和醇的量要保證步驟7得到的材料在去離子水和醇中的濃度為0.02 g mL-1;
步驟9, 將收集到的材料在90 ℃下,真空乾燥24 h;
步驟10, 摻入麥芽糖,混合均勻,摻入麥芽糖的重量為經過步驟9處理後的材料重量的25%;
步驟11, 將經過步驟10的材料進行冷壓成圓片,圓片狀材料半徑為10 cm,厚度為12 mm;
步驟12, 將冷壓後的圓片材料放置在管式爐中,通入氫氣,在900℃下煅燒1 h。
經過上述步驟處理後,就得到了由麥芽糖製備的外碳包覆且內摻碳的磷酸鎳鋰材料,其在0.1C下容量為192 mA h g-1。
實施例5
一種內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳,所述含有鋰和過渡金屬的磷酸鹽為磷酸鐵鋰,該內摻碳鋰離子電池材料中鋰、鐵和磷元素的重量比為:Li:Fe:P=1.2:1:1.2。
該內摻碳鋰離子電池材料的製備方法為:包括如下步驟:
步驟1,將植酸(含有碳基團的磷源)與二茂鐵(含有碳基團的過渡金屬源)去離子水混合,通入氫氣,通氣速率為250 cm3 min-1,同時用磁力攪拌器攪拌溶液;
步驟2,將磷酸加入到經過步驟中的溶液中溶解;
步驟3,將乙二醇加入步驟2中的溶液中溶解;
步驟4,將碘化鋰溶解到水中,然後加入步驟3中的溶液中,進行反應,步驟4中形成的溶液需要滿足如下要求:鋰:鐵:磷的摩爾比=3:1:1溶液中水和乙醇的體積比例為3:1。
步驟5,測量經過步驟4後溶液的pH值,根據pH值用氫氧化鋰或者植酸調節pH值至7.2,讓溶液反應1.2 h;
步驟6, 將經過步驟5後的溶液快速轉移到不鏽鋼高溫高壓反應釜中,並且繼續用磁力攪拌器攪拌和通入氫氣,通氣30 min後封閉進氣口和出氣口,開始升溫反應,反應釜升溫至240 ℃後,反應2 h;
步驟7, 讓反應釜自然冷卻至室溫,拆釜收集得到的材料;
步驟8,用去離子水水洗1次步驟7得到的材料後,再醇洗1次,然後進行離心處理,在水洗和醇洗時,加入的去離子水和醇的量要保證步驟7得到的材料在去離子水和醇中的濃度為0.15 g mL-1;
步驟9, 將收集到的材料在98℃下,真空乾燥20 h;
步驟10, 摻入酚醛樹脂,混合均勻,摻入酚醛樹脂的重量為經過步驟9處理後的材料重量的25%;
步驟11, 將經過步驟10的材料進行冷壓成圓片,圓片狀材料半徑為8 cm,厚度為1.5 mm;
步驟12, 將冷壓後的圓片材料放置在管式爐中,通入氫氣,在750℃下煅燒2h。
經過上述步驟處理後,就得到了由酚醛樹脂製備的外碳包覆且內摻碳的磷酸鐵鋰材料,其在0.1C下容量為218 mA h g-1。
實施例6
一種內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳,所述含有鋰和過渡金屬的磷酸鹽為磷酸錳鋰,該內摻碳鋰離子電池材料中鋰、錳和磷元素的重量比為:鋰:錳:磷=1.18:1:1.15。
該內摻碳鋰離子電池材料的製備方法為:包括如下步驟:
步驟1,將植酸鈣(具有碳基團的磷源)、二茂錳(具有碳基團的過渡金屬源)與去離子水混合,通入一氧化碳,通氣速率為220 cm3 min-1,同時用磁力攪拌器攪拌溶液;
步驟2,將乙二醇加入步驟1中的溶液中溶解;
步驟3,將氫氧化鋰和乙酸鋰溶解到水中,然後加入步驟2中的溶液中,進行反應,步驟3中形成的溶液需要滿足如下要求:鋰:錳:磷的摩爾比=4:0.5:1.2溶液中水和乙二醇的體積比例為4:1。
步驟4,測量經過步驟3後溶液的pH值,根據pH值用氫氧化鋰或者植酸調節pH值至10.5,讓溶液反應2 h;
步驟5, 將經過步驟4後的溶液快速轉移到不鏽鋼高溫高壓反應釜中,並且繼續用磁力攪拌器攪拌和通入一氧化碳,通氣22 min後封閉進氣口和出氣口,開始升溫反應,反應釜升溫至230 ℃後,反應5 h;
步驟6, 讓反應釜自然冷卻至室溫,拆釜收集得到的材料;
步驟7,用去離子水水洗2步驟6得到的材料後,再醇洗1次,然後進行離心處理,在水洗和醇洗時,加入的去離子水和醇的量要保證步驟6得到的材料在去離子水和醇中的濃度為0.12 g mL-1;
步驟8, 將收集到的材料在78℃下,真空乾燥18 h;
步驟9, 摻入環氧樹脂,混合均勻,摻入環氧樹脂的重量為經過步驟8處理後的材料重量的5%;
步驟10, 將經過步驟10的材料進行冷壓成圓片,圓片狀材料半徑為2 cm,厚度為8 mm;
步驟11, 將冷壓後的圓片材料放置在管式爐中,通入高純一氧化碳,在820℃下煅燒2 h。
經過上述步驟處理後,就得到了由環氧樹脂製備的外碳包覆且內摻碳的磷酸錳鋰材料,其在0.1C下容量為213 mA h g-1。
實施例7
一種內摻碳鋰離子電池材料,包括含有鋰和過渡金屬的磷酸鹽,其特徵在於:所述含有鋰和過渡金屬的磷酸鹽晶體內摻碳,外包覆碳,所述含有鋰和過渡金屬的磷酸鹽為磷酸鐵鋰,該內摻碳鋰離子電池材料中鋰、鐵和磷元素的重量比為:Li:Fe:P=1.35:1:0.9。
該磷酸鐵鋰材料的製備方法為:包括如下步驟:
步驟1,將植酸鈣和植酸的混合物(具有碳基團的磷源)與去離子水混合,通入一氧化碳,通氣速率為220 cm3 min-1,同時用磁力攪拌器攪拌溶液;
步驟2,將硫酸亞鐵和氯化鐵,加入到經過步驟中的溶液中溶解;
步驟3,將乙二醇加入步驟2中的溶液中溶解;
步驟4,將氫氧化鋰和乙酸鋰溶解到水中,然後加入步驟3中的溶液中,進行反應,步驟4中形成的溶液需要滿足如下要求:鋰:鐵:磷的摩爾比=2.5:0.8:0.5,溶液中水和乙二醇的體積比例為4:1。
步驟5,測量經過步驟4後溶液的pH值,根據pH值用氫氧化鋰或者植酸調節pH值至7.2,讓溶液反應2 h;
步驟6, 將經過步驟5後的溶液快速轉移到不鏽鋼高溫高壓反應釜中,並且繼續用磁力攪拌器攪拌和通入一氧化碳,通氣22 min後封閉進氣口和出氣口,開始升溫反應,反應釜升溫至230 ℃後,反應5 h;
步驟7, 讓反應釜自然冷卻至室溫,拆釜收集得到的材料;
步驟8,用去離子水水洗2步驟7得到的材料後,再醇洗1次,然後進行離心處理,在水洗和醇洗時,加入的去離子水和醇的量要保證步驟7得到的材料在去離子水和醇中的濃度為0.08 g mL-1;
步驟9, 將收集到的材料在78℃下,真空乾燥18 h;
步驟10, 摻入乙炔氣,混合均勻,摻入的有乙炔氣的重量為經過步驟9處理後的材料重量的5%;
步驟11, 將經過步驟10的材料進行冷壓成圓片,圓片狀材料半徑為2 cm,厚度為8 mm;
步驟12, 將冷壓後的圓片材料放置在管式爐中,通入一氧化碳和氦氣,在820℃下煅燒2 h。
經過上述步驟處理後,就得到了由乙炔氣製備的外碳包覆且內摻碳的磷酸鐵鋰材料,其在0.1C下容量為208 mA h g-1。
縮略語、英文和關鍵術語定義列表:植酸(PhyA)、磷酸(PA)、磷酸鐵鋰(LFP)、植酸製備的內碳(IC)、葡萄糖製備的外碳(GC)、植酸製備放的內碳摻雜的磷酸鐵鋰(IC/LFP)、葡萄糖製備的外碳包覆,磷酸製備的磷酸鐵鋰(GC/LFP)、葡萄糖製備的外碳包覆,植酸製備的內碳摻雜的磷酸鐵鋰(GC/IC/LFP)、鋰離子電池(LIBs)、透射電鏡(TEM)、高解析度透射電鏡(HRTEM)、掃描電鏡(SEM),電化學剝離氧化石墨(ECGO )、電化學剝離氧化石墨摻雜的碳包覆LFP(C/LFP/ECGO)、X射線光電子能譜碳1s分譜(XPS C1s)。
