星形聚合物接枝多肽和聚乙烯亞胺的基因載體及製備方法與流程
2023-11-02 21:16:17 3
本發明屬於生物材料技術領域,特別是涉及基因治療領域,具體地涉及一種選擇性粘附內皮細胞的基於星形聚合物的基因載體及製備方法。
技術背景
在冠狀動脈硬化的臨床治療中,人工血管移植是一種重要的治療手段,而原位快速內皮化是解決人工血管移植後再狹窄問題的關鍵一步。在這一過程中,血液中的內皮細胞在移植的人工血管材料內壁上的吸附、遷移和增殖對於在植入體中形成新的內皮層十分重要。為了實現人工血管的快速內皮化,許多學者致力於提高材料表面對內皮細胞的選擇性粘附能力。一種方法是將能促進內皮細胞粘附的抗體(如CD34、CD133等)修飾或固定在人工血管的材料表面,另一種方法是將一些能夠選擇性粘附內皮細胞的活性多肽引入到材料表面促進原位快速內皮化。和抗體相比,活性多肽具有更簡單的結構,高生物活性和更穩定的性質。
三肽精氨酸(Arg)-穀氨酸(Gly)-天冬氨酸(Asp)(RGD)是一種序列最短的細胞吸附活性多肽,也是目前應用最為廣泛的活性多肽,用來修飾合成材料的表面以促進材料對細胞的吸附和增殖。然而RGD是一種普適性細胞吸附多肽,在吸附內皮細胞的同時還會吸附血小板、平滑肌細胞等其他一些細胞,容易造成人工血管的再狹窄。因此選擇一種能對內皮細胞特異性吸附的活性多肽,對實現人工血管材料的快速內皮化至關重要。四肽精氨酸(Arg)-穀氨酸(Gly)-天冬氨酸(Asp)-纈氨酸(Val)(REDV)是纖維粘連蛋白CS5區的多肽片段,能特異性識別整合素α4β1,而整合素α4β1大量存在於內皮細胞表面,在平滑肌細胞中含量很低,因此REDV可以特異性吸附內皮細胞,同時能夠抑制平滑肌細胞的吸附、增殖和遷移。
近年來,基因治療作為一種實現人工血管快速內皮化的新型手段受到了學者們越來越多的關注。與病毒基因載體不同,聚陽離子型的非病毒載體的安全性較高,容易被修飾到聚合物主鏈上,受到了人們較多的關注。其中聚乙烯亞胺(PEI)在體內和體外都是應用最為成功的一種聚陽離子基因載體。由於PEI含有大量的氨基,正電荷較多,進入細胞後可以通過「質子海綿作用」促使載體實現內涵體逃逸過程,大大增加了轉染效率。但是由於較高的電荷密度,PEI在具有高的細胞轉染效率的同時也具有一定的細胞毒性,並且PEI的分子量越大,表現出來的細胞毒性越高。因此,如何獲得低毒高效的靶向性基因載體仍然是研究者們的努力方向。
為降低PEI的毒性,獲得低毒高效的基因載體,本發明採用星形可降解聚合物接枝多肽和PEI,形成多肽修飾的兩親性聚合物,在水相中自組裝形成基因載體,有利於內涵體逃逸。而且,在基因載體表面引入活性多肽CREDVW,形成核-殼-冠型結構,作為基因載體,能夠獲得更低的毒性和更高的轉染效果。
此外,和相同分子量的線性聚合物相比,本發明製備的基於星型聚合物的基因載體在選擇性溶劑中自組裝形成的膠束一般會相對較小,有利於在體內的長循環,避免被體內網狀內皮系統捕獲並排出;同時,由於多條親水鏈段連接在同一疏水節點上,兩親性星型共聚物在水溶液中形成基因載體後,親水鏈段的活動受到限制,會使基因載體的結構更加穩定,增加基因載體在體內的循環時間。
技術實現要素:
本發明的目的是克服現有技術的不足,提供一種具有可降解性、低毒性、高效性及對內皮細胞靶向性的星形聚合物接枝多肽和聚乙烯亞胺的基因載體。
本發明的第二個目的是提供星形聚合物接枝多肽和聚乙烯亞胺的基因載體的製備方法。
本發明的第三個目的是提供星形聚合物接枝多肽和聚乙烯亞胺的基因載體的應用。
本發明的技術方案概述如下:
星形聚合物接枝多肽和聚乙烯亞胺的基因載體的製備方法,包括如下步驟:
(1)將山梨醇、LA和MMD放入乾燥的聚合管中,再加入辛酸亞錫作催化劑,密封;
所述山梨醇、LA、MMD和辛酸亞錫的摩爾比為33-66:616:62-616:20-25;
所述LA為丙交酯的簡稱,所述MMD為3(S)-甲基-嗎啉-2,5-二酮的簡稱;
(2)對聚合管抽真空,通氮氣;
(3)重複步驟(2)8-12次,於140-150℃反應24-28小時,得到P(LA-co-MMD)粗品;
(4)將P(LA-co-MMD)粗品用三氯甲烷溶解得到溶液1,將溶液1滴加入攪拌下的正己烷中,有沉澱生成;固液分離,所述三氯甲烷和正己烷的體積比為1:8-12;
(5)重複步驟(4)2-3次,得到的沉澱在真空乾燥箱中乾燥至恆重,得到P(LA-co-MMD);
(6)按摩爾比為1:15-30:15-30的比例,將P(LA-co-MMD)、丁二酸酐和二甲氨基吡啶,以及三乙胺溶解在乾燥的1,4-二氧六環中,在25-30℃、氮氣保護下反應20-25小時,得到溶液2,將溶液2滴加入攪拌下的0-10℃的乙醇中,有沉澱生成;固液分離,固體溶解於三氯甲烷中,依次用飽和NaHCO3水溶液洗滌2-3次,稀鹽酸洗滌3-4次,飽和NaCl水溶液洗滌4-5次,得到的溶液加入無水硫酸鈉乾燥,抽濾,濾液滴加入攪拌下的正己烷中,有沉澱生成,固液分離,固體真空乾燥至恆重,得端基為羧基的P(LA-co-MMD);所述三乙胺為P(LA-co-MMD)質量的1-3倍;
(7)按摩爾比為1:15-30:15-30的比例,將端基為羧基的P(LA-co-MMD)、EDC和NHS溶解在DMSO中,室溫攪拌1-2小時,加入PEI的二甲基亞碸溶液中,使端基為羧基的P(LA-co-MMD)和PEI的摩爾比為1:15-30,室溫攪拌反應20-24小時,置於截留分子量為1.4萬的透析袋中,用超純水透析2-3天,透析液冷凍乾燥得P(LA-co-MMD)-g-PEI;
所述EDC為(1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽)的簡稱;
所述NHS為(N-羥基丁二醯亞胺)的簡稱;
所述PEI為(聚乙烯亞胺)的簡稱;
所述DMSO為二甲基亞碸的簡稱;
(8)將P(LA-co-MMD)-g-PEI溶解於二甲基亞碸中得溶液3,向溶液3中逐滴加入MAL-PEG-NHS的DMSO溶液和CREDVW多肽的DMSO溶液;在25℃下攪拌10-15小時,置於截留分子量為7000的透析袋中,用超純水透析2-3天,透析液冷凍乾燥得P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽;
所述P(LA-co-MMD)-g-PEI、MAL-PEG-NHS和CREDVW多肽的摩爾比為1:6-12:9-18;
(9)以DMSO為溶劑,配製濃度為2-5毫克/毫升的P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽溶液為溶液4,將溶液4以10秒一滴的速度滴入攪拌的pH=7.4的PBS緩衝溶液中,密封、靜置10-14小時,移入截留分子量為3500的透析袋中,透析2-3天,得到星形聚合物接枝多肽和聚乙烯亞胺的基因載體;
溶液4與pH=7.4的PBS緩衝溶液的體積比為1:5-20。
上述方法製備的星形聚合物接枝多肽和聚乙烯亞胺的基因載體。
上述星形聚合物接枝多肽和聚乙烯亞胺的基因載體在製備促進內皮細胞遷移和增殖藥物的應用。
本發明的優點是:
(1)本發明的星形聚合物接枝多肽和聚乙烯亞胺的基因載體具有核-殼-冠結構,相對於其它基因載體,更加穩定,更有利於其內涵體逃逸,且引入可降解的疏水段,能夠降低其毒性,更有利於提高其細胞內在化和轉染效率。
(2)採用山梨醇作為引發劑,製備星形聚合物,相對於同分子量線形聚合物來說,能夠形成更小粒徑的基因載體,有利於進入細胞,從而提高內在化效率。
(3)本發明的基因載體具有對內皮細胞的靶向性,有利於在內皮細胞與平滑肌細胞共存條件下,選擇性的促進內皮細胞的增殖和遷移,從而達到快速內皮化的目的。
附圖說明
圖1為核磁圖,其中:
(a)為P(LA-co-MMD)的核磁圖,其特徵峰為:δa=5.18ppm(OCHCH3CO)、δb=4.70ppm(COCHCH3NH)、δc=1.55(OCHCH3CO)、δd=1.34(COCHCH3NH)。由δa和δb這兩個特徵峰的積分峰面積計算可得聚合物中LA含量為83.7%。
(b)為端基為羧基的P(LA-co-MMD)的核磁圖,新出現的特徵峰為:δe=2.73ppm(COCH2CH2COOH)。
(c)為P(LA-co-MMD)-g-PEI的核磁圖,δf=2.65ppm(CH2CH2)為聚合中PEI的特徵峰。
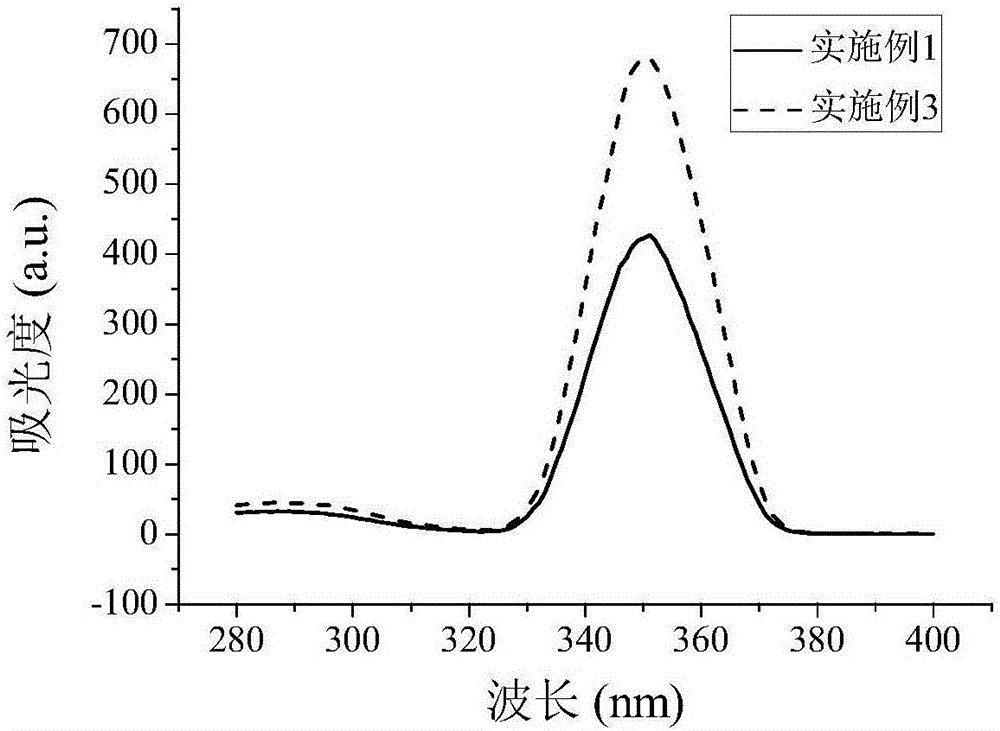
圖2為實施例1和實施例3製備的星形聚合物接枝多肽和聚乙烯亞胺的基因載體溶液的螢光吸收圖。
圖3為星形聚合物接枝多肽和聚乙烯亞胺的基因載體及其基因複合物的粒徑電位圖。
圖4星形聚合物接枝多肽和聚乙烯亞胺的基因載體及其基因複合物的細胞相對活性圖。
圖5內皮細胞劃痕圖。
具體實施方式
下面結合具體實施例進一步闡述本發明。應理解,該實施例僅用於說明本發明而不用於限制本發明的範圍。此外,在閱讀本發明講授的內容之後,本領域技術人員可以對本發明做改動或修改,該等價形式同樣落於本申請的權利要求所限定的範圍。
MAL-PEG-NHS購於北京鍵凱科技有限公司;
EA.hy926細胞購於中國科學院細胞庫(上海研發公共服務平臺);
CREDVW多肽序列為半胱氨酸-精氨酸-穀氨酸-天冬氨酸-纈氨酸-色氨酸
各實施例中:
LA為丙交酯的簡稱,MMD為3(S)-甲基-嗎啉-2,5-二酮的簡稱;
EDC為(1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽)的簡稱;
NHS為(N-羥基丁二醯亞胺)的簡稱;
PEI為(聚乙烯亞胺)的簡稱;
DMSO為二甲基亞碸的簡稱;
實施例1
星形聚合物接枝多肽和聚乙烯亞胺的基因載體的製備方法,包括如下步驟:
(1)將山梨醇、LA和MMD放入乾燥的聚合管中,再加入辛酸亞錫作催化劑,密封;
所述山梨醇、LA、MMD和辛酸亞錫的摩爾比為33:616:62:20;
(2)對聚合管抽真空,通氮氣;
(3)重複步驟(2)8次,於140℃反應28小時,得到P(LA-co-MMD)粗品;
(4)將P(LA-co-MMD)粗品用三氯甲烷溶解得到溶液1,將溶液1滴加入攪拌下的正己烷中,有沉澱生成;固液分離,所述三氯甲烷和正己烷的體積比為1:8;
(5)重複步驟(4)2次,得到的沉澱在真空乾燥箱中乾燥至恆重,得到P(LA-co-MMD),見圖1(a);
(6)按摩爾比為1:15:15的比例,將P(LA-co-MMD)、丁二酸酐和二甲氨基吡啶,以及三乙胺溶解在乾燥的1,4-二氧六環中,在25℃、氮氣保護下反應25小時,得到溶液2,將溶液2滴加入攪拌下的0℃的乙醇中,有沉澱生成;固液分離,固體溶解於三氯甲烷中,依次用飽和NaHCO3水溶液洗滌2次,稀鹽酸洗滌3次,飽和NaCl水溶液洗滌4次,得到的溶液加入無水硫酸鈉乾燥,抽濾,濾液滴加入攪拌下的正己烷中,有沉澱生成,固液分離,固體真空乾燥至恆重,得端基為羧基的P(LA-co-MMD),見圖1(b);所述三乙胺為P(LA-co-MMD)質量的1倍;
(7)按摩爾比為1:15:15的比例,將端基為羧基的P(LA-co-MMD)、EDC和NHS溶解在DMSO中,室溫攪拌1小時,加入PEI的二甲基亞碸溶液中,使端基為羧基的P(LA-co-MMD)和PEI的摩爾比為1:15,室溫攪拌反應20小時,置於截留分子量為1.4萬的透析袋中,用超純水透析2天,透析液冷凍乾燥得P(LA-co-MMD)-g-PEI,見圖1(c);
(8)將P(LA-co-MMD)-g-PEI溶解於二甲基亞碸中得溶液3,向溶液3中逐滴加入MAL-PEG-NHS的DMSO溶液和CREDVW多肽的DMSO溶液;在25℃下攪拌10小時,置於截留分子量為7000的透析袋中,用超純水透析2天,透析液冷凍乾燥得P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽;
所述P(LA-co-MMD)-g-PEI、MAL-PEG-NHS和CREDVW多肽的摩爾比為1:6:9;
(9)以DMSO為溶劑,配製濃度為2毫克/毫升的P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽溶液為溶液4,將溶液4以10秒一滴的速度滴入攪拌的pH=7.4的PBS緩衝溶液中,密封、靜置10小時,移入截留分子量為3500的透析袋中,透析2天,得到星形聚合物接枝多肽和聚乙烯亞胺的基因載體;
溶液4與pH=7.4的PBS緩衝溶液的體積比為1:5。
實施例2
星形聚合物接枝多肽和聚乙烯亞胺的基因載體的製備方法,包括如下步驟:
(1)將山梨醇、LA和MMD放入乾燥的聚合管中,再加入辛酸亞錫作催化劑,密封;
所述山梨醇、LA、MMD和辛酸亞錫的摩爾比為44:616:83:20;
(2)對聚合管抽真空,通氮氣;
(3)重複步驟(2)10次,於145℃反應26小時,得到P(LA-co-MMD)粗品;
(4)將P(LA-co-MMD)粗品用三氯甲烷溶解得到溶液1,將溶液1滴加入攪拌下的正己烷中,有沉澱生成;固液分離,所述三氯甲烷和正己烷的體積比為1:10;
(5)重複步驟(4)3次,得到的沉澱在真空乾燥箱中乾燥至恆重,得到P(LA-co-MMD);
(6)按摩爾比為1:20:20的比例,將P(LA-co-MMD)、丁二酸酐和二甲氨基吡啶,以及三乙胺溶解在乾燥的1,4-二氧六環中,在28℃、氮氣保護下反應23小時,得到溶液2,將溶液2滴加入攪拌下的5℃的乙醇中,有沉澱生成;固液分離,固體溶解於三氯甲烷中,依次用飽和NaHCO3水溶液洗滌3次,稀鹽酸洗滌4次,飽和NaCl水溶液洗滌5次,得到的溶液加入無水硫酸鈉乾燥,抽濾,濾液滴加入攪拌下的正己烷中,有沉澱生成,固液分離,固體真空乾燥至恆重,得端基為羧基的P(LA-co-MMD);所述三乙胺為P(LA-co-MMD)質量的2倍;
(7)按摩爾比為1:20:20的比例,將端基為羧基的P(LA-co-MMD)、EDC和NHS溶解在DMSO中,室溫攪拌2小時,加入PEI的二甲基亞碸溶液中,使端基為羧基的P(LA-co-MMD)和PEI的摩爾比為1:25,室溫攪拌反應22小時,置於截留分子量為1.4萬的透析袋中,用超純水透析3天,透析液冷凍乾燥得P(LA-co-MMD)-g-PEI;
(8)將P(LA-co-MMD)-g-PEI溶解於二甲基亞碸中得溶液3,向溶液3中逐滴加入MAL-PEG-NHS的DMSO溶液和CREDVW多肽的DMSO溶液;在25℃下攪拌13小時,置於截留分子量為7000的透析袋中,用超純水透析3天,透析液冷凍乾燥得P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽;
所述P(LA-co-MMD)-g-PEI、MAL-PEG-NHS和CREDVW多肽的摩爾比為1:8:12;
(9)以DMSO為溶劑,配製濃度為4毫克/毫升的P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽溶液為溶液4,將溶液4以10秒一滴的速度滴入攪拌的pH=7.4的PBS緩衝溶液中,密封、靜置12小時,移入截留分子量為3500的透析袋中,透析3天,得到星形聚合物接枝多肽和聚乙烯亞胺的基因載體;
溶液4與pH=7.4的PBS緩衝溶液的體積比為1:10。
實施例3
星形聚合物接枝多肽和聚乙烯亞胺的基因載體的製備方法,包括如下步驟:
(1)將山梨醇、LA和MMD放入乾燥的聚合管中,再加入辛酸亞錫作催化劑,密封;
所述山梨醇、LA、MMD和辛酸亞錫的摩爾比為66:616:616:25;
(2)對聚合管抽真空,通氮氣;
(3)重複步驟(2)12次,於150℃反應24小時,得到P(LA-co-MMD)粗品;
(4)將P(LA-co-MMD)粗品用三氯甲烷溶解得到溶液1,將溶液1滴加入攪拌下的正己烷中,有沉澱生成;固液分離,所述三氯甲烷和正己烷的體積比為1:12;
(5)重複步驟(4)3次,得到的沉澱在真空乾燥箱中乾燥至恆重,得到P(LA-co-MMD);
(6)按摩爾比為1:30:30的比例,將P(LA-co-MMD)、丁二酸酐和二甲氨基吡啶,以及三乙胺溶解在乾燥的1,4-二氧六環中,在30℃、氮氣保護下反應20小時,得到溶液2,將溶液2滴加入攪拌下的10℃的乙醇中,有沉澱生成;固液分離,固體溶解於三氯甲烷中,依次用飽和NaHCO3水溶液洗滌3次,稀鹽酸洗滌4次,飽和NaCl水溶液洗滌5次,得到的溶液加入無水硫酸鈉乾燥,抽濾,濾液滴加入攪拌下的正己烷中,有沉澱生成,固液分離,固體真空乾燥至恆重,得端基為羧基的P(LA-co-MMD);所述三乙胺為P(LA-co-MMD)質量的3倍;
(7)按摩爾比為1:30:30的比例,將端基為羧基的P(LA-co-MMD)、EDC和NHS溶解在DMSO中,室溫攪拌2小時,加入PEI的二甲基亞碸溶液中,使端基為羧基的P(LA-co-MMD)和PEI的摩爾比為1:30,室溫攪拌反應24小時,置於截留分子量為1.4萬的透析袋中,用超純水透析3天,透析液冷凍乾燥得P(LA-co-MMD)-g-PEI;
(8)將P(LA-co-MMD)-g-PEI溶解於二甲基亞碸中得溶液3,向溶液3中逐滴加入MAL-PEG-NHS的DMSO溶液和CREDVW多肽的DMSO溶液;在25℃下攪拌15小時,置於截留分子量為7000的透析袋中,用超純水透析3天,透析液冷凍乾燥得P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽;
所述P(LA-co-MMD)-g-PEI、MAL-PEG-NHS和CREDVW多肽的摩爾比為1:12:18;
(9)以DMSO為溶劑,配製濃度為5毫克/毫升的P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽溶液為溶液4,將溶液4以10秒一滴的速度滴入攪拌的pH=7.4的PBS緩衝溶液中,密封、靜置14小時,移入截留分子量為3500的透析袋中,透析3天,得到星形聚合物接枝多肽和聚乙烯亞胺的基因載體;
溶液4與pH=7.4的PBS緩衝溶液的體積比為1:20。
實施例4
星形聚合物接枝多肽和聚乙烯亞胺的基因載體(簡稱基因載體)與ZNF580基因(SEQ ID NO.1)製備N/P摩爾比為5的基因複合物:
步驟為:將濃度為0.10毫克/毫升的ZNF580基因水溶液在攪拌條件下,按N/P(PEI中的氮/DNA中的磷摩爾比)=5滴加到基因載體水溶液中,攪拌1小時,得到基因複合物。
對照:
星形聚合物接枝多肽(其中多肽序列為CREVDW,沒有活性)和聚乙烯亞胺的基因載體(簡稱對照基因載體)與ZNF580基因製備N/P摩爾比為5的對照基因複合物1:
步驟為:將濃度為0.10毫克/毫升的ZNF580基因水溶液在攪拌條件下,按N/P(PEI中的氮/DNA中的磷摩爾比)=5滴加到對照基因載體水溶液中,攪拌1小時,得到對照基因複合物1。
用聚乙烯亞胺(分子量為1萬)和ZNF580基因製備N/P摩爾比為5的對照基因複合物2:
步驟為:將濃度為0.10毫克/毫升的ZNF580基因水溶液在攪拌條件下,按N/P(PEI中的氮/DNA中的磷摩爾比)=5滴加到聚乙烯亞胺水溶液中,攪拌1小時,得到對照基因複合物2。
基因載體、基因複合物、對照基因載體、對照基因複合物1和對照基因複合物2的細胞毒性由MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽)比色法進行評價。
步驟如下:EA.hy926細胞接種到96孔板(1×104細胞/孔)細胞培養基中,細胞生長到90%後,將細胞培養基換為無血清培養基,進行飢餓處理12小時。之後培養基換為新鮮的生長培養基(10%FBS DMEM)。將不同濃度的基因載體、基因複合物、對照基因載體、對照基因複合物1和對照基因複合物2水溶液加入到生長培養基中,混合均勻,24小時後棄去上層清液,向每個孔中加入5毫克/毫升的MTT溶液20微升,繼續培養4小時,使甲瓚充分結晶。培養,小心棄去孔內培養基,而後向孔內加入150微升DMSO,置搖床上低速振蕩10分鐘,使結晶物充分溶解。用酶聯免疫檢測儀在490納米波長處測量各孔的光密度值(OD)。利用如下公式計算相對細胞活性(%):
其中,OD490』:實驗組減去調零組的吸光度值,avg(OD490C』):矯正後的對照組吸光度平均值。
分析結果:聚陽離子PEI由於具有高的正電荷密度,容易在細胞表面產生聚集而使細胞死亡,具有一定的細胞毒性,而基因治療則要求載體具有較低的細胞毒性。
圖4為細胞毒性,分別測定了對照基因複合物2、實施例1、實施例3製備的基因載體及其基因複合物、按實施例1、實施例3方法製備的對照基因載體及其對照基因複合物1。相同濃度下,基因載體及其基因複合物細胞毒性遠遠低於對照基因複合物2的細胞毒性,另外,與相同濃度下的對照基因複合物1的細胞毒性相比,可以看出基因複合物的細胞毒性低,這說明基因載體中接枝的活性多肽CREDVW明顯降低基因載體的細胞毒性。
實施例5
利用劃痕實驗來評價EA.hy926細胞經基因複合物、對照基因複合物1和對照基因複合物2轉染後的遷移能力。
在24孔板內利用基因複合物、對照基因複合物1和對照基因複合物2(N/P=5)轉染EA.hy926細胞,轉染48小時後,利用200微升移液器槍頭在每個孔內輕輕地劃出一條連續的細胞層斷面。用D-hanks緩衝液(pH=7.4)洗掉孔內的細胞碎屑。利用倒置顯微鏡(Olympus CKX41)觀察劃痕處細胞的遷移過程,在確定的時間間隔0、12、24小時對其拍照。利用Image J 2.1軟體計算照片中細胞的遷移面積。劃痕處細胞的遷移面積百分比按照如下公式計算:
分析結果:圖5為不同時間點EA.hy926細胞的遷移過程(A)和由Image-Pro Plus(6.0)計算的24小時後的細胞遷移面積(B)。其中,
a為對照基因複合物2轉染細胞的遷移面積;
b為實施例1製備的基因複合物轉染細胞的遷移面積;
c為實施例3製備的基因複合物轉染細胞的遷移面積;
d為按照實施例1方法製備的對照基因複合物1轉染細胞的遷移面積;
e為按照實施例3方法製備的對照基因複合物1轉染細胞的遷移面積。
經基因複合物轉染的細胞的遷移能力(76.2%(實施例1)和78.5%(實施例3))明顯高於經對照基因複合物1(58.9%(實施例1)和57.7%(實施例3))和對照基因複合物2(48%)轉染的細胞的遷移能力,這說明基因載體攜帶ZNF580基因轉染內皮細胞,可以大大提高內皮細胞的增殖和遷移能力。
實施例6
用星形聚合物接枝多肽和聚乙烯亞胺的基因載體(簡稱基因載體)和ZNF580基因製備N/P摩爾比為5,10,15和20的基因複合物:
將濃度為0.10毫克/毫升的ZNF580基因水溶液在攪拌條件下,按N/P(PEI中的氮/DNA中的磷摩爾比)=5,10,15和20分別滴加到基因載體水溶液中,攪拌1小時。用動態光散射測定基因載體及基因複合物的流體力學直徑和電位。
見圖3,從圖3中可以看出:
(a)為實施例1製備的基因載體和基因複合物的粒徑電位;
(b)為實施例3製備的基因載體和基因複合物的粒徑電位;
實施例1製備的基因載體及其基因複合物、實施例3製備的基因載體及其基因複合物的粒徑依次為232納米和209納米,電位依次為16.4毫伏和14.2毫伏。
粒徑和電位測試結果表明,基因載體及其基因複合物的粒徑較小(小於250納米)且電位為正,適合細胞攝取,有利於基因複合物對細胞的轉染。
SEQ ID NO.1,人工合成
SEQUENCE LISTING
天津大學
星形聚合物接枝多肽和聚乙烯亞胺的基因載體及製備方法
1
PatentIn version 3.3
1
519
DNA
人工合成
1
atgctgctgc tgcctccgcg cccaccgcat ccgcgttctt cttctccaga agcaatggac 60
ccgccgcctc cgaaagcccc accgttcccg aaagctgaag gcccgtcctc tactccgtct 120
agcgccgctg gcccgcgtcc gccacgcctg ggtcgtcacc tgctgatcga tgccaacggt 180
gtaccgtaca cctacactgt tcagctggaa gaggaaccac gtggcccgcc gcaacgtgaa 240
gcacctccgg gtgaaccggg ccctcgtaaa ggttattcct gcccggaatg tgcacgtgtg 300
ttcgcatctc cgctgcgtct gcagagccac cgcgttagcc actccgacct gaagccgttc 360
acctgcggcg cgtgcggtaa agctttcaaa cgtagctccc acctgtctcg tcaccgtgcg 420
acccaccgcg ctcgtgcggg tccgccgcat acgtgcccgc tgtgtccacg tcgctttcag 480
gatgctgcgg agctggcgca gcacgtccgc ctgcattaa 519
