綿馬次酸類化合物及其藥物組合物與應用的製作方法
2023-12-02 17:33:16 1
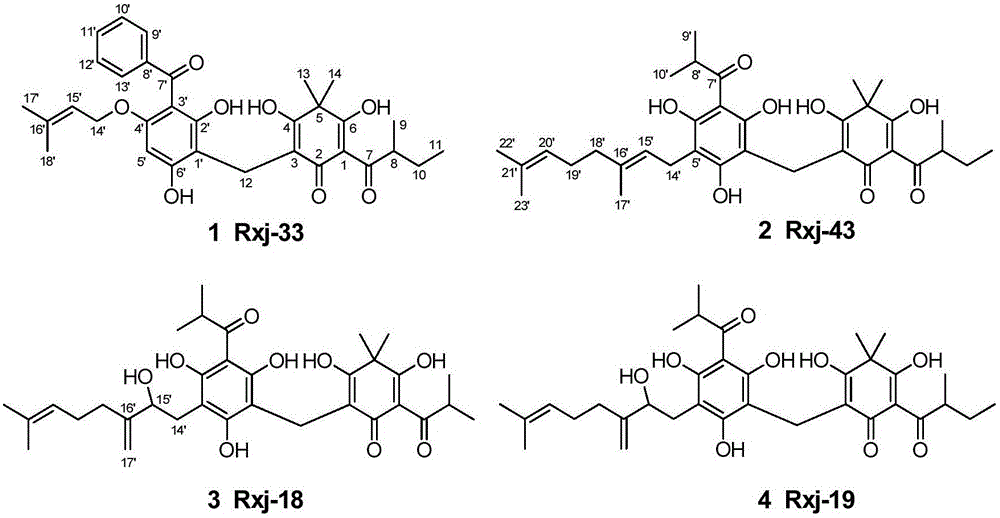
本發明屬於藥物技術領域,具體地說,涉及具有抑菌活性的綿馬次酸類化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)及其製備方法,以該化合物為活性成分的食品、化妝品、藥物組合物,以及其在製備預防和治療細菌感染導致的皮膚問題的化妝品和藥物中的應用。
背景技術:
:
金絲桃屬(Hypericum)是藤黃科(Guttiferae)的一個大屬,全世界約400種,除南北兩極地或荒漠地及大部分熱帶低地外世界廣布。我國約有55種8亞種,幾產於全國各地,但主要集中在西南地區。除了用於觀賞,金絲桃屬植物具有抗抑鬱、抗病毒、抗菌和抗腫瘤等多種藥理活性。
地耳草(Hypericum japonicum Thunb.):《中藥大辭典》記載品種,別名田基黃、雀舌草。一年生草本,產於江蘇、浙江、四川、雲南等地。具有清熱利溼,消腫解毒等功效,用於黃疸熱淋,腫毒,毒蛇咬傷。文獻報導該植物的化學成分有黃酮、xanthone等。現有技術中未見有本發明所涉及的從地耳草中分離所得的綿馬次酸類化合物,以及它們的藥物活性功能的報導。
技術實現要素:
:
本發明目的在於提供從地耳草(H.japonicum)中分離得到的綿馬次酸類化合物,以其為活性成分的食品、化妝品或藥物組合物,其製備方法,及其在製備預防和治療細菌感染疾病的藥物中的應用,以及在製備預防細菌感染導致的皮膚問題的化妝品中的應用,能用於預防細紋和/皺紋,皮膚紅疹,乾性、敏感肌膚,皮膚瘙癢,膚色不均或皮膚黑斑,皮膚發炎和其它與此相關的皮膚不適症。
為了實現本發明的上述目的,本發明提供了如下的技術方案:
下述結構式所示的綿馬次酸類化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)或其藥用鹽,
如所述的綿馬次酸類化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)或其藥用鹽,所述的藥用鹽為是指藥學上可接受的鹽,是與有機酸形成的鹽,所述的有機酸為酒石酸、甲酸、乙酸、乙二酸、丁酸、馬來酸、琥珀酸、己二酸、藻酸、檸檬酸、天冬氨酸、苯磺酸、樟腦酸、樟腦磺酸、二葡糖酸、環戊烷丙酸、十二烷基硫酸、乙磺酸、葡庚糖酸、甘油磷酸、庚酸、己酸、延胡索酸、2‐羥基乙磺酸、乳酸、甲磺酸、煙酸、2‐萘磺酸、撲酸、果膠酯酸、3‐苯基丙酸、新戊酸、丙酸、對‐甲苯磺酸和十一烷酸。
化妝品,由所述的綿馬次酸類化合物1-4任一種或任幾種的混合物和化妝品常用載體組成。
含有治療有效量的綿馬次酸類化合物1-4任一種或任幾種的混合物或其藥用鹽和藥學上可接受的載體的藥物組合物。
所述的綿馬次酸類化合物1-4任一種或任幾種的混合物在製備化妝品或食品中的應用。
所述的綿馬次酸類化合物1-4任一種或任幾種的混合物在製備預防細菌大腸桿菌、傷寒桿菌、金黃色葡萄球菌、糞腸桿菌感染導致的皮膚不適症的化妝品中的應用。
所述的綿馬次酸類化合物1-4任一種或任幾種的混合物在製備預防皮膚不適症的化妝品中的應用,所述的皮膚不適症為細紋和/皺紋,皮膚紅疹,乾性、敏感肌膚,皮膚瘙癢,膚色不均或皮膚黑斑,皮膚發炎。
所述的綿馬次酸類化合物1-4任一種或任幾種的混合物或其藥用鹽在製備預防或治療由細菌感染導致的疾病的藥物中的應用,所述的疾病是由大腸桿菌、傷寒桿菌、金黃色葡萄球菌、糞腸桿菌感染所導致的疾病。
製備權利要求1所述的綿馬次酸類化合物1-4的方法,取地耳草乾燥全草,粉碎,用甲醇室溫下冷浸2次,每次24小時,合併提取液,減壓蒸餾濃縮,得浸膏,浸膏用100-200目矽膠拌樣,矽膠柱層析,用氯仿洗脫得到氯仿段,氯仿段用1.5倍量的聚醯胺拌樣,過MCI柱,以7:3-10:0的MeOH-H2O進行梯度洗脫,得到5個大段A-E,B段經矽膠柱層析,以1:0-0:1的石油醚-丙酮進行梯度洗脫,得到4個小段B1-B4,其中B3段經製備HPLC,甲醇-水,95:5分離純化後得到Rxj-33;同樣,B4部分經製備HPLC,甲醇-水,95:5分離純化後得到Rxj-18和Rxj-19;C段用100-200目矽膠拌樣,矽膠柱層析,以1:0-0:1的石油醚-丙酮進行梯度洗脫,得到5個部分C1-C5,其中C2部分經製備HPLC,甲醇-水,95:5分離純化後得到Rxj-43。
本發明的化合物1-4為新的綿馬次酸類(二聚間苯三酚類衍生物)化合物,化學結構新穎,作為抗菌藥物有較多優勢。化合物1-4具有顯著的體外抑制細菌生長的活性,對大腸桿菌、傷寒桿菌、金黃色葡萄球菌、糞腸桿菌都有顯著的抑制作用。尤其是化合物1-4對傷寒桿菌抑制濃度低於陽性對照頭孢噻肟(cefotaxime),以及化合物1和3對金黃色葡萄球菌的抑制濃度也低於陽性對照。這些化合物可作為活性成分用於製備預防皮膚病的化妝品,或作為抗菌藥物製劑,具有較好的藥用價值。
本發明中含有化合物以及化妝品常用載體的組合物可用於局部皮膚護理或護髮產品。這些組合物可以做成乳化劑(例如水包油、油包水、矽油包水,水包矽油,水包油包水,油包水包油,油包水包矽油等),霜劑,護膚液,液體(例如水劑或水-醇溶液),無水基質(例如唇膏或粉劑等),啫喱,油膏,奶液,軟膏,噴霧劑,固體劑,眼霜等。局部施用這些組合物可治療乾性皮膚、敏感皮膚或皮膚搔癢或減小膚色不均的外觀。皮膚病包括乾性皮膚、皮膚搔癢、皮膚發炎、紅斑、皮膚過敏、瘙癢症、蜘蛛血管、雀斑、老年斑、老年性紫癜、角化症、黑斑病、疙瘩、細紋或皺紋、結節、皮膚太陽損傷、皮炎(脂溢性皮炎、錢幣狀皮炎、接觸性皮炎、異位性皮炎、剝脫性皮炎、口周皮炎和淤滯性皮炎等)、牛皮癬、毛囊炎、紅斑痤瘡、痤瘡、膿胞病、丹毒、紅癬、溼疹、日光灼傷、皮膚燒傷、開放性傷口、感染性皮膚病等。皮膚病還可由暴露在紫外光下、年齡、輻射、長期暴露在太陽下、環境汙染、空氣汙染、風、冷、熱、化學品、病理、吸菸或缺乏營養等引起。
附圖說明:
圖1為本發明化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)的結構示圖。
具體實施方式:
下面結合附圖,用本發明的實施例來進一步說明本發明的實質性內容,但並不以此來限定本發明。
實施例1:
化合物Rxj-33(1)、Rxj-43(2)、Rxj-18(3)、Rxj-19(4)的製備:
取地耳草乾燥全草(14kg),粉碎,用甲醇室溫下冷浸2次,每次24小時,合併提取液,減壓蒸餾濃縮,得浸膏2.5kg。粗提物用100-200目矽膠拌樣,矽膠柱層析,用氯仿洗脫得到氯仿段(164.2g)。氯仿段用1.5倍量的聚醯胺拌樣,過MCI柱,以MeOH-H2O(7:3-10:0)進行梯度洗脫,得到5個大段(A-E)。B段(25.5g)經矽膠柱層析,以石油醚-丙酮(1:0-0:1)進行梯度洗脫,得到4個小段(B1-B4)。其中B3段(3.0g)經製備HPLC(甲醇-水,95:5)分離純化後得到Rxj-33(180mg);同樣,B4部分(6.4g)經製備HPLC(甲醇-水,95:5)分離純化後得到Rxj-18(310mg)和Rxj-19(230mg)。C段(25.5g)用100-200目矽膠拌樣,矽膠柱層析,以石油醚-丙酮(1:0-0:1)進行梯度洗脫,得到5個部分(C1-C5),其中C2部分(3.2g)最終經製備HPLC(甲醇-水,95:5)分離純化後得到Rxj-43(850mg)。
化合物1-4的結構解析:
化合物1(Rxj-33),無色膠狀物。ESI-MS譜給出準分子離子峰為m/z 547[M-H]-,結合高分辨負離子HRESI-MS(m/z[M-H]-547.2337,calcd for 547.2332)及13C和DEPT NMR譜圖提供的信息,確定其分子式為C32H36O8,計算不飽和度為15。UV光譜在206(4.39),241(4.11),331(3.89)nm處有吸收,說明分子中存在較長的共軛系統。分析1H和13C NMR譜,再結合HSQC譜表明化合物1中含有32個碳信號,包括6個甲基,3個亞甲基,8個次甲基(包括7個烯碳),15個季碳(其中1個飽和季碳)。仔細分析這些數據表明1為綿馬次酸類化合物,且與已知化合物sarothralin很相似。最後通詳細地分析HMBC和1H-1H COSY譜,確定了化合物sarothralin中的異丙基被1中的仲丁基所取代。至此,化合物1的結構被確定。
同樣地,化合物2被確定為sarothralen A的衍生物,sarothralen A中C-7位異丙基被2中的仲丁基取代。化合物3為化合物2的15'氧化產物,並伴隨著16',17'雙鍵的形成。化合物4與3的不同之處為,C-7位羰基上攜帶的是一個仲丁基。化合物1-4的1H和13C NMR譜數據如表1和2所示。
表1.化合物1-4的NMR 13C譜數據(acetone)
表2.化合物1-4的NMR 1H譜數據(acetone)
化合物1-4的結構式如下所示:
實施例2
採用定量稀釋法測定化合物1-4的抑菌活性:
1培養基配置:將肉湯蛋白粉配置成濃度為20g/L的肉湯培養液和肉湯固體培養基,經滅菌處理後,待用。
2菌種活化:將大腸桿菌、傷寒桿菌、金黃色葡萄球菌、糞腸桿菌依次用肉湯固體培養接種,37℃培養24h。將活化的細菌用無菌環接種於肉湯固體培養基,置於搖床上,以220r/min,37℃培養18h,離心除去培養液後再用0.9%鹽水離心處理3次,以便於準確測定細菌懸浮液的吸光度。調節懸浮液的吸光度在0.10-600nm的範圍內,與此相關的懸浮液細菌濃度為108CFU/mL(吸光度為0.1時);使用前用肉湯培養液稀釋細菌懸浮液濃度100倍至106CFU/mL,待用。
3待測樣品配置:將待測的單體化合物溶解於DMSO溶液中,濃度配置為4μg/mL;陽性對照:以頭孢噻肟(cefotaxime)為陽性對照品,用肉湯液體培養基依照成倍稀釋的方法將待測化合物樣品濃度調整到1.56μg/mL、0.78μg/mL、0.39μg/mL、0.19μg/mL;空白對照:含DMSO 5%體積比的肉湯液體培養基溶液。
4抗菌活性測試:用移液槍吸取待測樣品(4μg/mL)100μL轉至96孔板中,其中DMSO的含量需低於5%體積比;繼續加入100μL的細菌培養液至每一個小孔,採用成倍稀釋的方法將待測化合物樣品濃度調整到2μg/mL、1μg/mL、0.5μg/mL、0.25μg/mL、0.125μg/mL、0.06μg/mL、0.03μg/mL、0.015μg/mL八個濃度梯度。每孔再加入需測試的濃度為106CFU/mL的細菌懸浮液,置恆溫箱(37℃)中培養24h後,用酶標儀進行測定。每個單體化合物均採用上述方法對每個菌種進行最小抑菌濃度(MIC值)的測定,檢測結果如表3所示。
表3.化合物1-4對4種細菌的最小抑菌濃度(MIC值)
由表3可見:化合物1-4對大腸桿菌、傷寒桿菌、金黃色葡萄球菌、糞腸桿菌都有顯著的抑制作用。尤其是化合物1-4對傷寒桿菌抑制濃度低於陽性對照頭孢噻肟(cefotaxime),以及化合物1和3對金黃色葡萄球菌的抑制濃度也低於陽性對照。這些化合物可作為活性成分用於製備抗菌藥物製劑,具有較好的藥用價值。
實施例3
化合物1-4體外抗氧化活性實驗:
將待測藥物與DPPH(終濃度為100μM)混合反應,設定3個重複孔,同時設置不含藥物的空白對照和Trolox陽性對照,30℃,1h,酶標儀測定OD值,檢測波長為515nm。計算得到抗氧化率。
表4樣品體外抗氧化活性結果
實施例4
酪氨酸酶抑制活性實驗:
將待測藥物與L-Dopa(終濃度1.25mM)混合,加入酪氨酸酶(終濃度25U/mL)開始反應,設定3個重複孔,同時設置不含藥物的空白對照和KojicAcid陽性對照,室溫,5min,酶標儀測定OD值,檢測波長為490nm。計算得到酪氨酸酶活性抑制率。
表5樣品對酪氨酸酶的抑制作用活性
實施例5
B16細胞黑色素生成抑制活性實驗:
96孔細胞培養板上,將B16細胞與不同濃度的待測藥物溶液混合,設定8個重複孔,同時設置不含藥物的空白照和KojicAcid陽性對照。37℃,5%CO2培養5天,酶標儀測定OD值,檢測波長為405nm,加入MTS,採用MTS比色法檢測490nm的OD值。計算得到B16細胞黑色素生成抑制率。
表6樣品對B16細胞黑色素生成的抑制作用結果
實施例6
促膠原蛋白分泌活性實驗:
12孔細胞培養板上,將HDFa細胞與不同濃度的待測藥物溶液混合,設置不含藥物的空白照和TGF-β陽性對照。37℃,5%CO2培養3天,收取細胞培養上清,存於-80℃;加入MTS,採用MTS比色法檢測490nm的OD值;按膠原蛋白ELISA試劑盒中提供的方法檢測膠原蛋白的分泌,酶標儀測定OD值,檢測波長為450nm。計算得到膠原蛋白分泌增加率。
表7樣品對HDFa細胞膠原蛋白分泌的促進作用結果
實施例7
TNF-α分泌抑制活性實驗:
12孔細胞培養板上,向HEKa細胞培養液中加入PMA(終濃度為0.01μg/mL),然後將不同濃度的待測藥物溶液與上述細胞溶液混合,同時設置不含藥物的空白照和PMA對照。37℃,5%CO2培養4-6h,收取細胞培養上清,存於-80℃;加入MTS,採用MTS比色法檢測490nm的OD值;按TNF-αELISA試劑盒中提供的方法檢測TNF-α的分泌,酶標儀測定OD值,檢測波長為450nm,校正波長為540nm。計算得到TNF-α分泌抑制率。
表8樣品對HEKa細胞TNF-α分泌的抑制作用結果
實施例8:
含有化合物1-4任一或組合的美白霜配方(W%):
按常規製作化妝品的方法製得本發明上述配方的化妝品。
實施例9:
含有化合物1-4任一或組合的乳劑配方(W%):
按常規製作化妝品的方法製得本發明上述配方的化妝品。
實施例10:
按實施例1製得化合物1-4,按化合物1-4任一種或任幾種混合與賦形劑重量比1:1或1:2的比例加入賦形劑,制粒壓片。
實施例11:
按實施例1製得化合物1-4,按常規膠囊製劑方法製成膠囊。
實施例12:
先按實施例1製得化合物1-4,再按下述方法製成片劑
製備方法:將化合物1-4任一種或任幾種混合與助劑混合,過篩,在合適的容器中均勻混合,把得到的混合物制粒壓片。
實施例13:
膠囊劑:化合物1-4任一種或任幾種混合 100mg
澱粉 適量
硬脂酸鎂 適量
製備方法:將化合物1-4任一種或任幾種混合與助劑混合,過篩,在合適的容器中均勻混合,把得到的混合物裝入硬明膠膠囊。
實施例14:
片劑:實施例1所得化合物1-4任一種或任幾種混合10mg,乳糖180mg,澱粉55mg,硬脂酸鎂5mg;
製備方法:將化合物1-4任一種或任幾種混合、乳糖和澱粉混合,用水均勻溼潤,把溼潤後的混合物過篩並乾燥,再過篩,加入硬脂酸鎂,然後將混合物壓片,每片重250mg,化合物含量為10mg。
實施例15:
安瓿劑:實施例1所得化合物1-4任一種或任幾種混合2mg,氯化鈉10mg;
製備方法:將化合物1-4任一種或任幾種混合和氯化鈉溶解於適量的注射用水中,過濾所得溶液,在無菌條件下裝入安瓿瓶中。
實施例16:
膠囊劑:實施例1所得化合物1-4任一種或任幾種混合10mg,乳糖187mg,硬脂酸鎂3mg;
製備方法:將化合物1-4任一種或任幾種混合與助劑混合,過篩,均勻混合,把得到的混合物裝入硬明膠膠囊,每個膠囊重200mg,活性成分含量為10mg。
