組合物及其應用的製作方法
2023-12-10 07:28:27 2
本發明涉及細胞領域,特別涉及組合物及其應用。
背景技術:
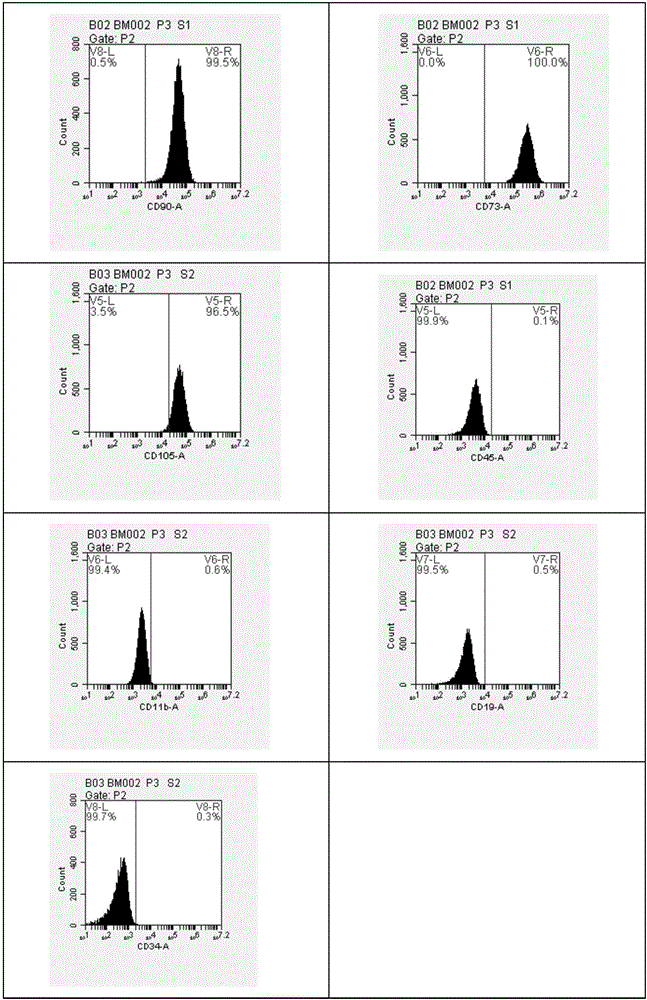
:肝衰竭是多種因素引起的嚴重肝臟損害,導致其合成、解毒、排洩和生物轉化等功能發生嚴重障礙或失代償,出現以凝血機能障礙和黃疽、肝性腦病、腹水等為主要表現的一組臨床症候群。近些年來,由於肝衰竭死亡的人數逐漸增多,據統計,美國每年約有萬人死於肝功能衰竭,而我國每年死於此症的患者約萬。急性肝衰竭是一種急性的嚴重肝功能障礙,其特點是起病急、病情危重、症狀表現多樣、肝細胞廣泛壞死。目前治療肝衰竭的主要手段為內科治療、肝移植和細胞治療等。內科治療療效有限,迄今為止尚未有對症的特效藥。目前,肝移植雖已成為治療終末期肝病的重要手段,但供體短缺、手術損傷、免疫排斥以及費用高昂等問題構成了肝移植技術發展的主要障礙。因此,開展具有侵入性小,併發症少等特點的幹細胞移植成為最近治療肝衰的研究熱點。幹細胞是一種未分化的細胞,有兩個基本特徵,一是自我複製能力,二是能分化成一種以上的功能細胞,根據分化潛能的大小,幹細胞一般分成三類,第一類是全能幹細胞即可以分類為功能一致的全能細胞。第二類是多潛能幹細胞,它能分化成為身體中每種細胞類型,但是不能形成胎盤和胎兒發育所必須的支持組織。第三類是成體幹細胞是一種將擁有終生自我複製或自我更新能力的幹細胞。它分布於不同組織並可養成為各種類型細胞。間充質幹細胞,屬於成體幹細胞,是一種具有自我複製能力和多向分化潛能的成體幹細胞,屬於非終末分化細胞,可分化為脂肪、軟骨、骨、肌肉、肌腿、神經、肝、心肌、胰島細胞和內皮等多種組織細胞。間充質幹細胞由於免疫原性低,成體組織來源豐富廣泛存在於人體的骨髓、脂肪組織、新生兒臍帶及胎盤等,易於分離,純度高,無腫瘤細胞汙染擴增時培養體系能統一,便於質控可製成種子細胞冷凍,多次使用,冷凍後細胞損失小潛伏性病毒和病原微生物的感染及傳播機率比較低採集時對產婦及新生兒無任何危害及損傷採集方便,易於保存和運輸,倫理學爭議少。目前不少研究證明幹細胞在體外進過特殊培養均有分化成為肝細胞的能力。近年來骨髓來源的間充質幹細胞,治療因其有重現性好、低免疫原性、費用低、運作方便、容易等優勢,成為繼原位肝移植後又一治療肝衰竭的有效方法。製備過程相對簡單、易於收集、生物特性穩定、安全性能穩定、重複性好,病人可以在心理上接受,因此能滿足臨床應用的需求。增殖能力強,其具有貼壁性有利於細胞的純化和培養,同時具有較強的分化能力、免疫原性低、避免了胚胎幹細胞移植後可能產生畸胎瘤和倫理問題;它可以在異基因移植中長期存活並發揮正常的生理功能,而且自體移植不存在免疫排斥問題,因此新的治療方法一在治療有著極大的優勢。目前不少研究證明幹細胞在體外進過特殊培養均有分化成為肝細胞的能力。證明造血幹細胞可以體外培養可以分化成為肝細胞。研究證明骨髓來源的間充質幹細胞體外分化培養可以分化成肝細胞。目前大鼠、大鼠和人的有關實驗模型,提示骨髓來源細胞可以轉化為肝細胞。目前關於不同來源幹細胞治療急性肝衰的報導也有很多。證明單個核骨髓細胞能治療對乙酞基氨基酚引起的急性肝衰。有人得出結論,肝臟中某些部分損傷可能更適合用骨髓來源的幹細胞進行修復。Hwang,S.等人分別使用骨髓間充質幹細胞和經HGF體外誘導1周或2周的骨髓間充質幹細胞治療肝衰竭大鼠,通過對肝功能血生化指標的檢測,他們認為幹細胞向肝幹細胞和肝臟細胞分化的早期可能有利於肝細胞的再生和肝功能的重建,而成熟肝細胞移植可能會限制肝功能的恢復。技術實現要素:有鑑於此,本發明提供一種組合物及其應用。該組合物對於防止和或治療由局部缺血、藥物如對乙醯氨基酚、病毒、肥胖症非酒精性脂肪性肝炎、以及阻塞膽管阻塞、腫瘤所引起的慢性肝損傷均有效。該組合物還可以預防肝衰竭、減緩慢性肝衰竭進展並去除有害的毒性。為了實現上述發明目的,本發明提供以下技術方案:本發明提供了一種組合物,包括生長因子、白蛋白和骨髓間充質幹細胞。在本發明的一些具體實施方案中,所述生長因子選自肝細胞生長因子、前列腺素、胰島素或胰高血糖素。在本發明的一些具體實施方案中,所述組合物中肝細胞生長因子佔組合物的含量為30μg/ml~60μg/ml、前列腺素佔組合物的含量為4μg/ml~8μg/ml、胰島素佔組合物的含量為20U/ml~40U/ml、胰高血糖素佔組合物的含量為3mg/ml~6mg/ml。在本發明的一些具體實施方案中,所述組合物中所述白蛋白佔組合物的質量百分含量為15~30%。在本發明的一些具體實施方案中,所述組合物中所述白蛋白佔組合物的質量百分含量為20%。在本發明的一些具體實施方案中,所述組合物中所述骨髓間充質幹細胞的濃度為1.0~10.0×107/ml。在本發明的一些具體實施方案中,所述組合物中所述骨髓間充質幹細胞的濃度為1.5×107/ml。肝再生啟動機制複雜,涉及多種細胞、細胞因子及生長因子。其中肝細胞生長因子是促肝再生因子中最重要的生長因子之一,主要由肝臟Kupffer細胞等間質細胞產生,在細胞損傷時具有保護肝細胞、抑制肝細胞的凋亡的作用,也是肝再生啟動所必需的信號。研究表明,肝細胞生長因子不但能促進成熟肝細胞增殖,還可以加快肝卵圓細胞的增殖、分化,從成熟肝細胞及肝前體細胞兩個方面有效促進肝臟再生。肝細胞大量壞死時,對胰島素滅活功能減弱,同時肝細胞源性血清胰島素樣生長因子1(insulin-likegrowthfactor-1,IGF-1)表達減少,使肝衰竭患者出現低血糖及糖的氧化利用率下降,轉以蛋白質、脂肪分解供能為主。肝衰竭患者在應激狀態下利用糖的能力很差,未被及時氧化可能引起或加重肝臟的脂肪變性。胰島素和胰高血糖素聯用不但可以提高機體對血糖的利用率並且具有刺激肝細胞增殖的功能。前列腺素E2(prostaglandinE2,PGE2)是花生四烯酸在磷脂酶A2、環氧酶,和PGE2合酶的順序催化作用下產生的代謝產物,可由多種細胞合成,對多種原因造成的包括胃腸道黏膜、肝臟在內的多種組織器官損傷具有保護作用,在肝臟遭受肝毒性物質時,可以減少肝細胞調亡和破壞。在本發明的一些具體實施方案中,所述組合物中所述生長因子選自重組人肝細胞生長因子、胰島素、胰高血糖素或前列腺素E2。在本發明的一些具體實施方案中,所述組合物中所述組合物的使用劑量以骨髓間充質幹細胞計為1.0~10.0×107/kg動物體重。本發明還提供了所述組合物在製備預防和/或治療肝臟疾病的藥物和/或保健品。所述肝臟疾病選自由局部缺血、藥物如對乙醯氨基酚、病毒、肥胖症非酒精性脂肪性肝炎,阻塞膽管阻塞、腫瘤所引起的慢性肝損傷,肝衰竭,或慢性肝衰竭。此外,本發明還提供了一種預防和/或治療肝臟疾病的藥物和/或保健品,其特徵在於,包括本發明提供的所述組合物。本發明提供了一種組合物,包括生長因子、白蛋白和骨髓間充質幹細胞。該組合物對於防止和或治療由局部缺血、藥物如對乙醯氨基酚、病毒、肥胖症非酒精性脂肪性肝炎、以及阻塞膽管阻塞、腫瘤所引起的慢性肝損傷均有效。該組合物還可以預防肝衰竭、減緩慢性肝衰竭進展並去除有害的毒性。附圖說明為了更清楚地說明本發明實施例或現有技術中的技術方案,下面將對實施例或現有技術描述中所需要使用的附圖作簡單地介紹。圖1示對照組流式細胞儀檢測結果;圖2示樣本組流式細胞儀檢測結果;圖3示病理切片顯示結果;其中,圖3(A)示正常組;圖3(B)示對照組;圖4示生存期結果。具體實施方式本發明公開了一種組合物及其應用,本領域技術人員可以借鑑本文內容,適當改進工藝參數實現。特別需要指出的是,所有類似的替換和改動對本領域技術人員來說是顯而易見的,它們都被視為包括在本發明。本發明的方法及應用已經通過較佳實施例進行了描述,相關人員明顯能在不脫離本
發明內容、精神和範圍內對本文所述的方法和應用進行改動或適當變更與組合,來實現和應用本發明技術。本發明提供的組合物及其應用中所用原料及試劑均可由市場購得。下面結合實施例,進一步闡述本發明:實施例1骨髓間充質幹細胞分離純化分離:給予大鼠腹腔注射肝素後短頸處死。75%乙醇溶液中浸泡消毒10min。超淨臺內無菌條件下取大鼠雙側腔骨,用PBS衝洗2次。大鼠股骨的端部被切斷,用注射器抽吸培養基反覆衝洗骨髓腔,將骨髓腔衝洗乾淨。將細胞懸浮液通過70μm的細胞過濾網來去除骨碎片和聚集的血液。用離心管收集細胞懸液,用培養基反覆洗滌2次,離心。以含10%FBS的DMEM-F12培養基重懸細胞,並調整細胞密度為2×105/ml接種到15cm培養皿,轉移至5%CO2、37℃、飽和溼度為95%的CO2培養箱中培養。細胞培養24h時半量換液,去除未貼壁細胞,72h後二次全量換液,此後3d換液一次,直到細胞生長至融合度達85%,胰酶消化傳代或凍存。此為原代骨髓間充質幹細胞。傳代培養:傳代時先全部吸出培養液後,用PBS洗滌二次,加入37℃預熱的0.25%(2.5g/L)胰蛋白酶(含1mmol/LEDTA,即用1mmol/L-EDTA-Na2配製)消化2分鐘,加入完全培養液終止胰酶作用。吸管反覆吹打後將細胞收集於15ml離心管中,1500r/min離心10分鐘後棄上清,再用PBS液洗滌二次徹底洗去混有的胰蛋白酶。將細胞再懸浮於培養液中,按2~5×105/ml再次接種傳代於新的培養瓶中。當這些細胞生長接近融合層時,即得到骨髓MSC。骨髓間充質幹細胞擴增培養用L-DMEM完全培養液將細胞濃度調整為1×106/mL培養骨髓間充質幹細胞細胞。5%CO2培養箱內,每3~4天半量換液1次,每隔2-3天補充所需的細胞因子;10~12d細胞達90%融合時傳代,用流式細胞術鑑定骨髓間充質幹細胞和臺盼藍計數測試細胞活力。骨髓間充質幹細胞的鑑定:取第3代細胞,細胞培養至接近融合時,0.25%胰蛋白酶消化2min,用含有5%FBS的冷PBS衝洗2次,加入1ml0.01mol/L的PBS重懸,反覆輕輕吹打細胞,使其成單細胞懸液,加入CD29、CD90、CD11b、CD45單克隆抗體,同時用同型對照,避光孵育1h,PBS洗3次後,上流式檢測。加入1ml0.5%多聚甲醛-PBS溶液固定、重懸細胞,上流式細胞儀檢測。分離純化後的大鼠外周血NK細胞經臺盼藍染色,表明其活性可以達到92%~95%,經流式細胞儀檢測,CD73、CD90、CD105>95%,CD19、CD34、CD11b、CD45<2%,證實分離純化擴增的骨髓間充質幹細胞細胞的純度可高達95%以上。實施例2構建大鼠慢性肝衰竭模型用腹腔注射四氯化碳誘發大鼠慢性肝衰竭模型,四氯化碳按照4:6溶解於植物油。選取健康周齡成年雄性SD大鼠60隻,體重(200士20)g,隨機分為4組:正常組(25隻)、模型組(25隻)、細胞組合物治療組1(20隻)、細胞組合物治療組2(20隻)、細胞組合物治療組3(20隻)及生理鹽水組(20隻)。模型組、細胞組合物治療組和生理鹽水組採用含有40%CCl4的植物油溶液1ml/kg體重進行腹腔注射,每隔三天注射一次,連續7周,誘發模型組大鼠慢性肝功能衰竭。正常組採用植物油1ml/kg體重進行腹腔注射,每隔三天注射一次,連續7周。模型製作7周後,隨機選取正常組和模型組大鼠各5隻採用全自動生化分析儀檢測血清和水平以觀察小鼠肝功能受損情況,顯微鏡下觀察小鼠肝臟的病理變化。造模後,模型組小鼠血清中AST和ALT水平均比正常組明顯升高;病理切片顯示,模型組小鼠肝組織出現水腫,空泡,大量炎性細胞浸潤,並且有細胞變性壞死,與其形態學和生化指標表現相符,則判定慢性肝衰竭模型製作成功。表1造模後大鼠肝功能指標血清ALB、ALT、AST和凝血酶原時間PT水平ASTALTALBPT(s)正常組30.46±15.35175.62±23.7543.52±6.4417.86±5.21模型組276.79±38.70▲648.31±34.65▲16.71±2.67▲37.63±8.19▲▲P<0.05vs正常組;造模後大鼠血清丙氨酸氨基轉移酶(ALT)和天冬氨酸氨基轉移酶(AST)均明顯升高,ALB明顯低於對照組(P<0.05)。實施例3骨髓間充質幹細胞組合物的製備經過流式細胞術鑑定和臺盼藍染色,純度超過90%、並且總數達到107的骨髓間充質幹細胞,離心去除上清液,加注射用生理鹽水清洗1-2遍,400g離心5min,收集細胞;按照30μg/ml肝細胞生長因子、4μg/ml前列腺素、20U/ml胰島素、3mg/ml胰高血糖素、20%(w/w)白蛋白、1.5×107/kg大鼠體重的骨髓間充質幹細胞重懸於注射用生理鹽水中製成1ml的骨髓間充質幹細胞組合物。實施例4骨髓間充質幹細胞組合物的製備經過流式細胞術鑑定和臺盼藍染色,純度超過90%、並且總數達到107的骨髓間充質幹細胞,離心去除上清液,加注射用生理鹽水清洗1-2遍,400g離心5min,收集細胞;按照40μg/ml肝細胞生長因子、6μg/ml前列腺素、30U/ml胰島素、5mg/ml胰高血糖素、15%(w/w)白蛋白、10×107/kg大鼠體重的骨髓間充質幹細胞重懸於注射用生理鹽水中製成1ml的骨髓間充質幹細胞組合物。實施例5骨髓間充質幹細胞組合物的製備經過流式細胞術鑑定和臺盼藍染色,純度超過90%、並且總數達到107的骨髓間充質幹細胞,離心去除上清液,加注射用生理鹽水清洗1-2遍,400g離心5min,收集細胞;按照60μg/ml肝細胞生長因子、8μg/ml前列腺素、40U/ml胰島素、6mg/ml胰高血糖素、30%(w/w)白蛋白、1.0×107/kg大鼠體重的骨髓間充質幹細胞重懸於注射用生理鹽水中製成1ml的骨髓間充質幹細胞組合物。實施例6尾靜脈移植造模7周後進行幹細胞組合物(實施例3~實施例5製得)移植,在大鼠麻醉後,消毒尾部,經過尾靜脈給予幹細胞組合物1ml注射移植,15min內注射完畢。生理鹽水對照組和正常組用以同體積生理鹽水注射尾靜脈。每周一次,共8周。實施例7主要藥效研究結果一般情況造模後,模型組大鼠逐漸出現食慾下降,行為遲鈍及對刺激的反應靈敏度下降等行為學改變。但與模型組相比,經過本發明幹細胞組合物治療後,大鼠的飲食量及行為靈敏度有所提高,上述症狀均明顯減輕,且本發明幹細胞組合物的作用更加明顯。更重要的是,在治療過程中沒有發現與幹細胞相關的不良反應。生存期如圖4所示,經過Kaplan-Meier分析,模型組的平均生存時間為4.65個月,生長因子對照組的平均生存時間為5.15個月,本發明幹細胞組(實施例3~5製得)的平均生存時間為5.88個月,同時經過檢驗提示,本發明幹細胞組的累積生存率高於模型組和生長因子組,差異有統計學意義。表2大鼠飲食量的影響(g/天)▲P<0.05vs空白組;△P<0.05vs模型組;★P<0.05vs生長因子組;記錄大鼠飲食、活動、對刺激反應、皮毛光澤、脫毛等情況。採用綜合評分標準判定如下:活動正常(記3分)為3~5次/min,活動減少(記2分)為1~2次/min,不活動(記1分)為<1次/min。反應靈敏(記3分)為對敲打籠壁聲音迅速轉向敲擊音方向並伴有肢體運動,反應減弱(記2分)為對敲打籠壁聲音僅轉向敲擊音方向,反應遲鈍(記1分)為對敲擊籠壁聲音僅睜眼或抬頭。結果:正常組大鼠均靈活,反應敏感、飲食正常,皮毛光亮柔順。大鼠建模後1個月較正常組及假手術組稍差,術後21d出現活動減少,對外界刺激反應減弱,倦怠,精神萎靡,術後28d則上述表現加重,各大鼠基本不活動,反應遲鈍,皮毛凌亂無序、脫落,易並發各種感染病。各組大鼠活動及反應評分情況見表3。表3大鼠活動及反應綜合評分比較▲P<0.05vs空白組;△P<0.05vs模型組;★P<0.05vs生長因子組;肝功能和凝血功能治療結束各組大鼠採尾靜脈血,用全自動生化分析儀檢測血清中ALT、AST、ALB水平,檢測肝功能及凝血功能。正常組:正常組採用生理鹽水1ml進行尾靜脈注射;模型組:模型組採用生理鹽水1ml進行尾靜脈注射;生長因子對照組:造模方法同模型組,在造模7周後用含有20%(v/v)白蛋白、150μg/kg肝細胞生長因子、20μg/kg前列腺素E2、0.1U/kg胰島素、15μg/kg胰高血糖素的生理鹽水1ml進行尾靜脈注射;治療組1~治療組3(幹細胞組):造模方法同模型組,在造模7周後給尾靜脈給予實施例3~5製得的組合物1ml進行尾靜脈注射。表4慢性肝衰竭小鼠脂肪間充質幹細胞移植後肝臟生化指標觀察(x±s)▲P<0.05vs空白組;△P<0.05vs模型組;★P<0.05vs生長因子組;如表4所示,腹腔注射CCl4連續7周後,模型組大鼠血清ALT、AST、TBIL及PT水平顯著升高,同時血清ALB、CHE水平顯著下降,與空白組比較,差異均有統計學意義。而經過本發明幹細胞治療後,血清ALT、AST、TBIL及PT水平顯著下降,同時血清ALB、CHE水平顯著上升,與模型組和生理鹽水組相比,差異均有統計學意義。肝組織病理評分正常組:正常組採用生理鹽水1ml進行尾靜脈注射;模型組:模型組採用生理鹽水1ml進行尾靜脈注射;生長因子對照組:造模方法同模型組,在造模7周後用含有20%(v/v)白蛋白、150μg/kg肝細胞生長因子、20μg/kg前列腺素E2、0.1U/kg胰島素、15μg/kg胰高血糖素的生理鹽水1ml進行尾靜脈注射;治療組1~治療組3(幹細胞組):造模方法同模型組,在造模7周後給尾靜脈給予實施例3~5製得的組合物1ml進行尾靜脈注射。方法:取材→脫水→浸蠟→包埋→切片→染色→封固取材:大鼠處死後,分別於肝臟同一部位取材,將肝臟組織用薄刀片切取大小約為10mm×10mm×2mm的組織塊,置於10%中性甲醛溶液中浸泡固定48h;固定後按照以下程序進行切片製作:脫水將固定組織塊依次浸泡在濃度遞增的脫水劑中:75%乙醇浸泡2小時,85%乙醇浸泡2小時,95%乙醇浸泡1小時,95%乙醇浸泡1小時,100%乙醇Ⅰ浸泡1小時,100%乙醇II浸泡1小時;透明二甲苯I浸泡1小時,二甲苯II浸泡1小時浸蠟在不同熔點的石蠟中浸泡:在石蠟I(軟蠟(52℃))中浸泡1小時,石蠟II(軟蠟(54℃))浸泡1小時,石蠟III(硬蠟(58℃))浸泡1小時;包埋用鑷子夾出組織塊置於容器中,加入石蠟III,隨後放入-20℃冰箱,使其冷凝成蠟塊;切片已固定和修好的蠟塊固定在切片機夾物臺上,切出若干5μm厚度的切片,切好的蠟片置於40℃水浴鍋中充分舒展,將蠟片貼附於載玻片上,乾燥過夜;脫蠟石蠟切片經過二甲苯II,二甲苯I,100%乙醇II,100%乙醇I,95%乙醇,95%乙醇,85%乙醇,75%乙醇,蒸餾水中各浸泡10min;染色蘇木素染色5min,自來水衝洗。(吸乾水)鹽酸乙醇分化30s(提插數下)。自來水浸泡15min或溫水(約50℃)5min。(吸乾水)置伊紅液2min。常規脫水,透明,封片:95%乙醇(I)min→95%乙醇(II)1min→100%乙醇(I)1min→100%乙醇(II)1min→二甲苯石碳酸(3:1)1min(省略)→二甲苯(I)1min→二甲苯(II)1min→中性樹膠封片結果見表5。表5組別n病理損害積分空白組200模型組202.11±0.47*生長因子對照組202.56±0.61*實驗組1201.29±0.34*△實驗組2201.62±0.77*△實驗組3201.56±0.48*△▲P<0.05vs空白組;△P<0.05vs模型組;★P<0.05vs生長因子組;如表5所示,腹腔注射CCl4連續7周後,模型組和生理鹽水組大鼠肝組織病理損害積分最高,經本發明幹細胞組合物(實施例3~5製得的)治療後,病理損害積分顯著下降,與模型組相比,差異有統計學意義。以上所述僅是本發明的優選實施方式,應當指出,對於本
技術領域:
的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護範圍。當前第1頁1 2 3 
