用於治療PVNS的抗CSF1R抗體的製作方法
2023-06-12 01:55:21 3
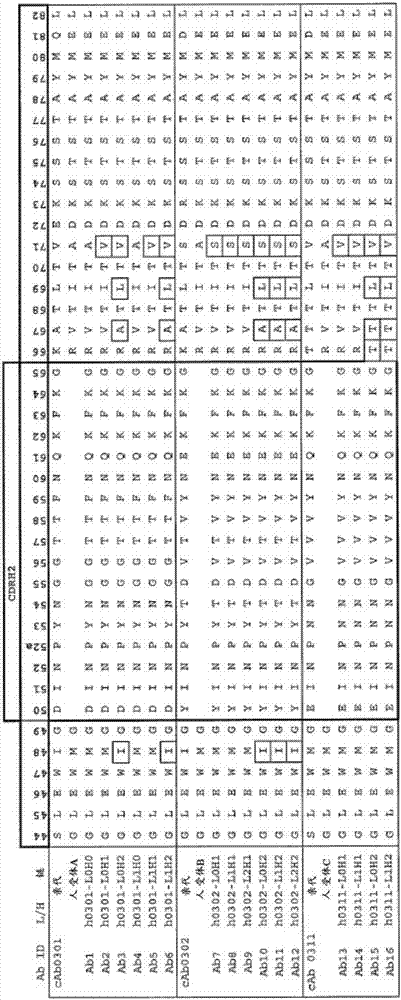
本發明提供使用結合集落刺激因子1受體(csf1r)的抗體治療色素絨毛結節性滑膜炎(pigmentedvillonodularsynovitis;pvns)的方法。發明背景集落刺激因子1受體(在本文中稱為csf1r;在本領域也稱為fms、fim2、c-fms、m-csf受體及cd115)是具有n-末端胞外結構域(ecd)及c-末端胞內結構域的擁有酪氨酸激酶活性的單跨膜受體。csf1或白細胞介素34配體(在本文中稱為il-34;lin等,science320:807-11(2008))與csf1r的配體結合導致受體二聚化、csf1r蛋白質酪氨酸激酶活性上調、csf1r酪氨酸殘基磷酸化及下遊信號傳導事件。通過csf1或il-34引起的csf1r活化導致單核細胞及巨噬細胞以及其他單核細胞細胞譜系(如破骨細胞、樹突細胞及小神經膠質細胞)的運輸、存活、增殖及分化。色素絨毛結節性滑膜炎(pvns)是具有反應性炎症及克隆贅瘤性增殖的特徵的滑膜實體腫瘤,其中集落刺激因子-1(csf1)是過表達的。csf1基因(1p13)至col6a3啟動子(2q35)的常見轉座存在於大約60%的pvns患者中。轉座伴有滑膜中的csf1過表達。另外,大約40%的pvns患者在不存在鑑定的csf1轉座的情況下具有csf1過表達。pvns及反應性滑膜炎的所有病例中csf1過表達的一致存在表明,csf1在滑膜病理學範疇中具有重要作用且具有在治療上靶向csf1/csf1r相互作用的實用性。參見west等,2006,proc.natl.acad.sciusa,103:690-695。在pvns中,csf1過表達存在於少數滑膜細胞中,而大部分細胞浸潤物表達csf1r而非csf1。將此現象表徵為在腫瘤細胞中具有異常csf1表現的腫瘤美化效應(tumor-landscapingeffect),其導致非贅瘤性細胞的異常累積而形成團塊。手術是患有局部性pvns的患者的治療選擇。復發發生於8-20%的患者中且通常通過再切除來管控。彌散性腱鞘滑膜巨細胞瘤(tgct/pvns或pvns/dttgct)往往更通常(33-50%)復發且具有更侵略性的臨床過程。患者通常是有症狀的且在其生命期間需要多個手術程序。對於患有不可切除的疾病或多次復發的患者而言,使用csf1r抑制劑的全身性療法可幫助延遲或避免手術程序並改善功能結果。參見ravi等,2011,am.j.pathol.,179:240-247。在pvns患者中評估伊馬替尼(imatinib)(csf1r的非特異性抑制劑)。納入了29名來自歐洲、澳大利亞及美國的12個機構的患者。中值年齡為41歲且最常見疾病位點是膝蓋(n=17;59%)。兩名患者患有肺和/或骨的轉移性疾病。根據recist針對19%的總體響應率,27名可評估患者中的5名具有完全(n=1)或部分(n=4)響應。27名患者中的20名(74%)具有穩定疾病。在可評估症狀的22名患者中的16名(73%)中發現症狀改善。儘管具有高症狀改善率及總體有益安全性概貌,但10名患者因毒性或其他原因而中斷治療。或者,需要用於pvns的毒性較小的治療。發明概述在一些實施方案中,提供了治療受試者中涉及滑膜關節和/或腱鞘的增生性病症的方法,其包括向該受試者施用有效量的結合csf1r的抗體。在一些實施方案中,增生性病症選自色素絨毛結節性滑膜炎(pvns)、腱鞘的巨細胞瘤(giantcelltumorofthetendonsheath;gctts)及腱鞘滑膜巨細胞瘤(tenosynovialgiantcelltumor;tgct),如彌散性腱鞘滑膜巨細胞瘤(diffusetypetenosynovialgiantcelltumor;dttgct)。在一些實施方案中,所述病症是色素絨毛結節性滑膜炎/彌散性腱鞘滑膜巨細胞瘤(pvns/dttgct)。在一些實施方案中,提供了治療受試者中色素絨毛結節性滑膜炎(pvns)的方法,其包括向該受試者施用有效量的結合csf1r的抗體。在一些實施方案中,抗體以每周一次、每兩周一次、每三周一次或每個月一次施用。在一些實施方案中,抗體以至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少10、至少12、至少15、至少16、至少20、至少30、至少40、至少50或至少100mg/kg的劑量施用。在一些實施方案中,抗體以1、2、3或4mg/kg的劑量施用。在一些實施方案中,在施用至少兩個、至少三個、至少四個、至少五個、至少六個、至少七個、至少八個、至少九個或至少十個劑量的結合csf1r的抗體之後,pvns腫瘤體積減小至少30%或至少40%或至少50%或至少60%或至少70%。在一些實施方案中,腫瘤體積是單一關節中的腫瘤體積。在一些實施方案中,單一關節選自髖關節及膝關節。在一些實施方案中,腫瘤體積是受pvns影響的所有關節中的總腫瘤體積。在一些實施方案中,在至少一個劑量的抗體後,受試者經歷如下症狀改善的一項或多於一項:(a)關節疼痛減小,(b)關節活動範圍增加,及(c)關節功能能力增加。在一些實施方案中,在施用第一劑量的抗體之前,受試者接受選自如下的第一治療:手術滑膜切除術、放射束治療、放射性同位素滑膜切除術及關節置換。在一些實施方案中,pvns在第一治療之後復發或進展。在一些實施方案中,抗體在選自如下的治療之前施用:手術滑膜切除術、放射束治療、放射性同位素滑膜切除術及關節置換。在一些實施方案中,腫瘤是不可切除的。在一些實施方案中,受試者未接受過使用伊馬替尼或尼羅替尼(nilotinib)的先前治療,而在其他實施方案中,受試者已接受過使用伊馬替尼或尼羅替尼的先前治療。在一些實施方案中,受試者未接受過使用csf1r抑制劑的先前治療,而在其他實施方案中,受試者已接受過使用csf1r抑制劑的先前治療。在本文所述的任一組合物或方法中,抗csf1r抗體的抗體重鏈和/或抗體輕鏈可具有下文所述的結構。在本文所述的任一組合物或方法中,抗csf1r抗體重鏈可包含與選自seqidno:9、11、13及39至45的序列至少90%、至少95%、至少97%、至少99%或100%相同的序列。在本文所述的任一方法中,抗csf1r抗體輕鏈可包含與選自seqidno:10、12、14及46至52的序列至少90%、至少95%、至少97%、至少99%或100%相同的序列。在本文所述的任一組合物或方法中,抗csf1r抗體重鏈可包含與選自seqidno:9、11、13及39至45的序列至少90%、至少95%、至少97%、至少99%或100%相同的序列,且抗csf1r抗體輕鏈可包含與選自seqidno:10、12、14及46至52的序列至少90%、至少95%、至少97%、至少99%或100%相同的序列。在本文所述的任一組合物或方法中,抗csf1r抗體hccdr1、hccdr2及hccdr3可包含選自如下的一組序列:(a)seqidno:15、16及17;(b)seqidno:21、22及23;和(c)seqidno:27、28及29。在本文所述的任一組合物或方法中,抗csf1r抗體lccdr1、lccdr2及lccdr3可包含選自如下的一組序列:(a)seqidno:18、19及20;(b)seqidno:24、25及26;和(c)seqidno:30、31及32。在本文所述的任一組合物或方法中,抗csf1r抗體重鏈可包含hccdr1、hccdr2及hccdr3,其中hccdr1、hccdr2及hccdr3包含選自如下的一組序列:(a)seqidno:15、16及17;(b)seqidno:21、22及23;及(c)seqidno:27、28及29;且輕鏈可包含lccdr1、lccdr2及lccdr3,其中lccdr1、lccdr2及lccdr3包含選自如下的一組序列:(a)seqidno:18、19及20;(b)seqidno:24、25及26;及(c)seqidno:30、31及32。在本文所述的任一組合物或方法中,抗csf1r抗體可含有:(a)包含與seqidno:9至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:10至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(b)包含與seqidno:11至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:12至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(c)包含與seqidno:13至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:14至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(d)包含與seqidno:39至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:46至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(e)包含與seqidno:40至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:46至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(f)包含與seqidno:41至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:46至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(g)包含與seqidno:39至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:47至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(h)包含與seqidno:40至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:47至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(i)包含與seqidno:41至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:47至少95%、至少97%、至少99%或100%相同的序列的輕鏈;及(j)包含與seqidno:42至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:48至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(k)包含與seqidno:42至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:49至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(1)包含與seqidno:42至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:50至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(m)包含與seqidno:43至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:48至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(n)包含與seqidno:43至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:49至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(o)包含與seqidno:43至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:50至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(p)包含與seqidno:44至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:51至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(q)包含與seqidno:44至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:52至少95%、至少97%、至少99%或100%相同的序列的輕鏈;(r)包含與seqidno:45至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與鏈seqidno:51至少95%、至少97%、至少99%或100%相同的序列的輕;或(s)包含與seqidno:45至少95%、至少97%、至少99%或100%相同的序列的重鏈及包含與seqidno:52至少95%、至少97%、至少99%或100%相同的序列的輕鏈。在本文所述的任一組合物或方法中,抗csf1r抗體可包含:(a)重鏈,其包含具有seqidno:15序列的重鏈(hc)cdr1、具有seqidno:16序列的hccdr2及具有seqidno:17序列的hccdr3;及輕鏈,其包含具有seqidno:18序列的輕鏈(lc)cdr1、具有seqidno:19序列的lccdr2及具有seqidno:20序列的lccdr3;(b)重鏈,其包含具有seqidno:21序列的重鏈(hc)cdr1、具有seqidno:22序列的hccdr2及具有seqidno:23序列的hccdr3;及輕鏈,其包含具有seqidno:24序列的輕鏈(lc)cdr1、具有seqidno:25序列的lccdr2及具有seqidno:26序列的lccdr3;或(c)重鏈,其包含具有seqidno:27序列的重鏈(hc)cdr1、具有seqidno:28序列的hccdr2及具有seqidno:29序列的hccdr3;及輕鏈,其包含具有seqidno:30序列的輕鏈(lc)cdr1、具有seqidno:31序列的lccdr2及具有seqidno:32序列的lccdr3。在本文所述的任一組合物或方法中,抗csf1r抗體可含有:(a)包含seqidno:53序列的重鏈及包含seqidno:60序列的輕鏈;(b)包含seqidno:53序列的重鏈及包含seqidno:61序列的輕鏈;或(c)包含seqidno:58序列的重鏈及包含seqidno:65序列的輕鏈。在一些實施方案中,抗體包含重鏈及輕鏈,其中所述抗體包含:(a)由seqidno:53序列組成的重鏈及由seqidno:60序列組成的輕鏈;(b)由seqidno:53序列組成的重鏈及由seqidno:61序列組成的輕鏈;或(c)由seqidno:58序列組成的重鏈及由seqidno:65序列組成的輕鏈。在本文所述的任一組合物或方法中,抗csf1r抗體可以是人源化抗體。在本文所述的任一組合物或方法中,抗csf1r抗體可以是huab1、huab2、huab3、huab4、huab5、huab6、huab7、huab8、huab9、huab10、huab11、huab12、huab13、huab14、huab15或huab16的任一項。(參見圖1-2)。在本文所述的任一組合物或方法中,抗csf1r抗體可選自fab、fv、scfv、fab』及(fab』)2。在本文所述的任一組合物或方法中,抗csf1r抗體可以是嵌合抗體。在本文所述的任一組合物或方法中,抗csf1r抗體可選自iga、igg及igd。在本文所述的任一組合物或方法中,抗csf1r抗體可以是igg。在本文所述的任一方法中,抗體可以是igg1或igg2。在本文所述的任一組合物或方法中,抗csf1r抗體可結合至人csf1r和/或結合至食蟹猴csf1r。在本文所述的任一組合物或方法中,抗csf1r抗體可阻斷與csf1r結合的配體。在本文所述的任一組合物或方法中,抗csf1r抗體可阻斷csf1和/或il-34與csf1r的結合。在本文所述的任一組合物或方法中,抗csf1r抗體可阻斷csf1及il-34與csf1r的結合。在本文所述的任一組合物或方法中,抗csf1r抗體可抑制配體誘導的csf1r磷酸化。在本文所述的任一組合物或方法中,抗csf1r抗體可抑制csf1和/或il-34誘導的csf1r磷酸化。在本文所述的任一組合物或方法中,抗csf1r抗體可以小於1nm的親和力(kd)結合至人csf1r。在本文所述的任一組合物或方法中,抗csf1r抗體可抑制在csf1或il-34存在下的單核細胞增殖和/或生存響應。附圖簡述圖1a-c顯示了人源化抗體huab1至huab16的每一個的人源化重鏈可變區的比對,如實施例1中所論述。加框的(boxed)殘基是人受體序列中變回相應小鼠殘基的胺基酸。圖2a-c顯示了人源化抗體huab1至huab16的每一個的人源化輕鏈可變區的比對,如實施例1中所論述。加框的殘基是人受體序列中變回相應小鼠殘基的胺基酸。圖3顯示了使用抗體huab1(也稱為fpa008)的實施例4和5中所匯總的臨床試驗的示意圖。發明詳述本發明提供治療受試者中的pvns的方法,包括對所述受試者施用抗csf1r抗體。本文所用的各章節標題僅出於組織性目的,而不應視為對所述的主題加以限制。本文所引用的所有參考文獻(包含專利申請及公開)出於任何目的通過提述以其整體併入本文。定義除非另有定義,否則結合本發明使用的科學及技術術語應具有本領域普通技術人員通常所理解的含義。另外,除非上下文另有需要,否則單數術語應包括複數形式且複數術語應包含單數形式。與重組dna、寡核苷酸合成、組織培養及轉化(例如電穿孔、脂質體轉染)、酶促反應及純化技術相關使用的示例性技術是本領域已知的。許多此類技術及程序闡述於例如sambrook等,molecularcloning:alaboratorymanual(第2版,coldspringharborlaboratorypress,coldspringharbor,n.y.(1989))中以及他處。另外,用於化學合成、化學分析、醫藥製備、配製和遞送及患者治療的示例性技術也是本領域已知的。在本申請中,除非另有說明,否則使用「或」意指「和/或」。在多項從屬權利要求的情況下,使用「或」僅以擇一形式引用多於一個的前述獨立權利要求或從屬權利要求。同樣地,除非另有明確說明,否則諸如「元素」或「組分」等術語涵蓋包括一個單元的元素及組分和包括一個以上亞單元的元素及組分兩種情況。應理解,除非另有說明,否則本公開內容所用的下列術語具有如下含義:術語「核酸分子」及「多核苷酸」可互換使用,且是指核苷酸聚合物。此類核苷酸聚合物可含有天然和/或非天然核苷酸,且包括但不限於dna、rna及pna。「核酸序列」是指核苷酸的的線性序列,包括核酸分子或多核苷酸。術語「多肽」及「蛋白」可互換使用且是指胺基酸殘基的聚合物,且不限於最小長度。此類胺基酸殘基聚合物可含有天然或非天然胺基酸殘基,且包括但不限於肽、寡肽、胺基酸殘基的二聚體、三聚體及多聚體。該定義涵蓋全長蛋白與其片段二者。該術語還包括多肽的表達後修飾,例如糖基化、唾液酸化、乙醯基化、磷酸化等等。此外,出於本發明目的,「多肽」是指包含對天然序列的修飾(例如缺失、添加及取代(通常為保守性質))的蛋白,只要該蛋白維持所需的活性。此類修飾可以是故意進行的,如經由定點誘變,或可以是偶然發生,例如經由宿主突變,其因pcr擴增而產生蛋白或誤差。本文中的術語「csf1r」是指全長csf1r,其包含n-末端ecd、跨膜結構域及胞內酪氨酸激酶結構域,其具有或不具有n-末端前導序列。在一些實施方案中,csf1r是具有seqidno:1或seqidno:2的胺基酸序列的人csf1r。在提及抗csf1r抗體時,術語「阻斷結合」配體(例如csf1和/或il-34)及其語法變化形式用於意指抑制csf1r與csf1r配體(例如csf1和/或il-34)之間的相互作用的能力。該抑制可經由任一機制發生,包括直接幹擾配體結合(例如因與csf1r上重疊的結合位點)和/或通過改變配體親和力的抗體誘導csf1r構象變化等。稱為「功能性」的抗體及抗體片段的特徵在於具有此類性質。本文所用的術語「抗體」是指包含至少重鏈的互補決定區(cdr)1、cdr2及cdr3和至少輕鏈的cdr1、cdr2及cdr3的分子,其中該分子能夠結合至抗原。術語抗體包括但不限於能夠結合抗原的片段(例如fv、單鏈fv(scfv)、fab、fab』及(fab』)2)。術語抗體還包括但不限於嵌合抗體、人源化抗體及各種物種(如小鼠、人、食蟹猴等)的抗體。在一些實施方案中,抗體包含重鏈可變區及輕鏈可變區。在一些實施方案中,抗體包含至少一條包含重鏈可變區及重鏈恆定區的至少一部分的重鏈及至少一條包含輕鏈可變區及輕鏈恆定區的至少一部分的輕鏈。在一些實施方案中,抗體包含兩條重鏈,其中每一重鏈包含重鏈可變區及重鏈恆定區的至少一部分;及兩條輕鏈,其中每一輕鏈包含輕鏈可變區及輕鏈恆定區的至少一部分。如本文中所使用的,單鏈fv(scfv)或任何包含例如單一多肽鏈(其包含全部六個cdr(三個重鏈cdr及三個輕鏈cdr))的其他抗體視為具有重鏈及輕鏈。在一些此類實施方案中,重鏈是抗體中包含三個重鏈cdr的區且輕鏈是抗體中包含三個輕鏈cdr的區。本文所用的術語「重鏈可變區」是指包含重鏈cdr1、框架(fr)2、cdr2、fr3及cdr3的區。在一些實施方案中,重鏈可變區還包含fr1的至少一部分和/或fr4的至少一部分。在一些實施方案中,重鏈cdr1對應於kabat殘基26至35;重鏈cdr2對應於kabat殘基50至65;且重鏈cdr3對應於kabat殘基95至102。參見例如kabatsequencesofproteinsofimmunologicalinterest(1987和1991,nih,bethesda,md.);及圖1。在一些實施方案中,重鏈cdr1對應於kabat殘基31至35;重鏈cdr2對應於kabat殘基50至65;且重鏈cdr3對應於kabat殘基95至102。參見同上。本文所用的術語「重鏈恆定區」是指包括至少三個重鏈恆定域ch1、ch2及ch3的區。非限制性的示例性重鏈恆定區包括γ、δ及α。非限制性的示例性重鏈恆定區還包括ε及u。每一重鏈恆定區對應於抗體同種型。例如,包含γ恆定區的抗體是igg抗體,包含δ恆定區的抗體是igd抗體,且包含α恆定區的抗體是iga抗體。此外,包含μ恆定區的抗體是igm抗體,且包含ε恆定區的抗體是ige抗體。某些同種型可進一步再細分成亞類。例如,igg抗體包括但不限於igg1(包含γ1恆定區)、igg2(包含γ2恆定區)、igg3(包含γ3恆定區)及igg4(包含γ4恆定區)抗體;iga抗體包括但不限於iga1(包含α1恆定區)及iga2(包含α2恆定區)抗體;且igm抗體包括但不限於igm1及igm2。在一些實施方案中,重鏈恆定區包含一個或多個賦予抗體期望的特性的突變(或取代)、添加或缺失。非限制性的示例性突變是igg4鉸鏈區(在恆定域ch1與ch2之間)中的s241p突變,其將igg4基序cpscp改變為cppcp,後者類似於igg1中的相應基序。在一些實施方案中,該突變產生更穩定的igg4抗體。參見例如angal等,mol.immunol.30:105-108(1993);bloom等,prot.sci.6:407-415(1997);schuurman等,mol.immunol.38:1-8(2001)。本文所用的術語「重鏈」是指至少包含重鏈可變區且具有或不具有前導序列的多肽。在一些實施方案中,重鏈包含重鏈恆定區的至少一部分。本文所用的術語「全長重鏈」是指包含重鏈可變區及重鏈恆定區且具有或不具有前導序列的多肽。本文所用的術語「輕鏈可變區」是指包含輕鏈cdr1、框架(fr)2、cdr2、fr3及cdr3的區。在一些實施方案中,輕鏈可變區還包含fr1和/或fr4。在一些實施方案中,輕鏈cdr1對應於kabat殘基24至34;輕鏈cdr2對應於kabat殘基50至56;且輕鏈cdr3對應於kabat殘基89至97。參見例如kabatsequencesofproteinsofimmunologicalinterest(1987和1991,nih,bethesda,md.);及圖1。本文所用的術語「輕鏈恆定區」是指包含輕鏈恆定域cl的區。非限制性示例性輕鏈恆定區包括λ及κ。本文所用的術語「輕鏈」是指包含至少輕鏈可變區且具有或不具有前導序列的多肽。在一些實施方案中,輕鏈包含輕鏈恆定區的至少一部分。本文所用的術語「全長輕鏈」是指包含輕鏈可變區及輕鏈恆定區且具有或不具有前導序列的多肽。本文所用的「嵌合抗體」是指包括至少一個來自第一物種(例如小鼠、大鼠、食蟹猴等)的可變區及至少一個來自第二物種(例如人、食蟹猴等)的恆定區的抗體。在一些實施方案中,嵌合抗體包含至少一個小鼠可變區及至少一個人恆定區。在一些實施方案中,嵌合抗體包含至少一個食蟹猴可變區及至少一個人恆定區。在一些實施方案中,嵌合抗體包括至少一個大鼠可變區及至少一個小鼠恆定區。在一些實施方案中,嵌合抗體的所有可變區來自第一物種且嵌合抗體的所有恆定區來自第二物種。本文所用的「人源化抗體」是指其中非人可變區的框架區中的至少一個胺基酸被來自人可變區的相應胺基酸替換的抗體。在一些實施方案中,人源化抗體包含至少一個人恆定區或其片段。在一些實施方案中,人源化抗體是fab、scfv、(fab』)2等。本文所用的「cdr移植抗體」是指將第一(非人)物種的互補決定區(cdr)移植於第二(人)物種的框架區(fr)上的人源化抗體。本文所用的「人抗體」是指在人中產生的抗體、在非人動物中產生的包含人免疫球蛋白基因的抗體(如)及選擇用於體外方法(如噬菌體展示)的抗體,其中抗體譜(antibodyrepertoire)基於人免疫球蛋白序列。術語「前導序列」是指位於多肽n末端的促進來自哺乳動物細胞的多肽分泌的胺基酸殘基序列。前導序列可在將多肽自哺乳動物細胞輸出後被切割,形成成熟蛋白質。前導序列可以是天然或合成序列,且其可與其所附接的蛋白異源或同源。示例性的前導序列包括但不限於抗體前導序列,如seqidno:3及4的胺基酸序列,其分別對應於人輕鏈及重鏈前導序列。非限制性的示例性前導序列還包括來自異源蛋白的前導序列。在一些實施方案中,抗體缺乏前導序列。在一些實施方案中,抗體包含至少一個前導序列,其可選自天然抗體前導序列及異源前導序列。術語「載體」用於描述可經改造以含有可在宿主細胞中繁殖的一個或多個克隆的多核苷酸的多核苷酸。載體可包含下列組件中的一項或多項:複製起點、一個或多個調控目的多肽的表達的調控序列(例如啟動子和/或增強子),和/或一種或多種可選標記物基因(例如抗生素抗性基因及可用於比色測定中的基因,例如β-半乳糖苷酶)。術語「表達載體」是指用於表達宿主細胞中的目的多肽的載體。「宿主細胞」是指可以是或已成為載體或分離的多核苷酸的接受者的細胞。宿主細胞可以是原核細胞或真核細胞。示例性的真核細胞包括哺乳動物細胞,例如靈長類動物或非靈長類動物動物細胞;真菌細胞,例如酵母;植物細胞;及昆蟲細胞。非限制性的示例性哺乳動物細胞包括但不限於nso細胞、per.細胞(crucell)及293和cho細胞及其衍生物,如分別為293-6e及dg44細胞。本文所用的術語「分離的」是指自至少一些通常發現於自然界中的組分分離的分子。例如,在自至少一些產生其的細胞中的組分分離時,多肽稱為「分離」的。在多肽是在表達之後由細胞分泌的情形下,以物理方式將含有多肽的上清液自產生其的細胞分離視為「分離」多肽。類似地,在多核苷酸並非通常見於自然界中的較大多核苷酸(例如在dna多核苷酸情形下的基因組dna或線粒體dna)中的一部分或是自至少一些產生其的細胞組分(例如在rna多核苷酸情形下)分離時,則其稱為「分離的」。因此,含於宿主細胞內部的載體中的dna多核苷酸可稱為「分離的」,只要該多核苷酸不是見於自然界中的載體中的。術語「升高的濃度」意指蛋白在受試者特定組織中的相對於對照中(例如一個或多個未患有pvns或本文所述的其他病狀的受試者)同一組織的較高濃度。升高的濃度可源自任一機制,例如蛋白質的增加的表達、增加的穩定性、降低的降解、增加的分泌、降低的清除等。術語「減少/降低(reduce或reduces)」意指將受試者特定組織中的蛋白水平降低至少10%。在一些實施方案中,藥劑(如結合csf1r的抗體)將受試者特定組織中的蛋白水平減少至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%或至少90%。在一些實施方案中,蛋白水平相對於與藥劑(例如結合csf1r的抗體)接觸之前的蛋白水平是減少的。在用於治療劑抗性的上下文中時,術語「有抗性的」意指相對於受試者在過去對標準劑量的治療劑的響應,或相對於患有類似病症的類似受試者對標準劑量的治療劑的預期反應,對標準劑量的治療劑具有降低的響應或沒有響應。因此,在一些實施方案中,受試者可以是對治療劑有抗性的,雖然受試者先前未被給予過治療劑,或受試者可在一個或多個先前時刻在對藥劑作出響應之後對治療劑產生抗性。術語「受試者」及「患者」可在本文中互換使用且是指人。在一些實施方案中,還提供治療其他哺乳動物(包括但不限於嚙齒類動物、猿猴、貓、犬、馬、牛、豬、綿羊、山羊、哺乳類實驗室動物、哺乳類家畜、哺乳類競技動物及哺乳類寵物)的方法。本文所用的術語「樣品」是指自含有要表徵、量化和/或鑑定(例如基於物理、生物化學、化學和/或生理學特性)的細胞和/或其他分子實體的受試者獲得或衍生的組合物。示例性樣品是組織樣品。術語「組織樣品」是指自受試者組織獲得的相似細胞的集合。組織樣品的來源可以是固體組織,如來自新鮮、冷凍和/或儲藏的器官或組織樣品或活檢組織或抽吸物;血液或任何血液組分;體液,例如腦脊液、羊水、腹膜液、滑液或間隙液;來自受試者妊娠或發育的任何時間的細胞。在一些實施方案中,組織樣品是滑膜活檢組織樣品和/或滑液樣品。在一些實施方案中,組織樣品是滑液樣品。組織樣品也可以是原代或經培養的細胞或細胞系。任選地,自疾病組織/器官獲得組織樣品。組織樣品可含有不與自然界中的組織天然互混的化合物,如防腐劑、抗凝劑、緩衝劑、固定劑、營養物、抗生素等等。本文所用的「對照樣品」或「對照組織」是指自已知或據信未罹患所述受試者所正在治療的疾病的來源獲得的樣品、細胞或組織。出於本文目的,組織樣品的「截面(section)」意指組織樣品的一部分或片段,例如自固體組織樣品切割的組織或細胞的薄切片。本文所用的術語「色素絨毛結節性滑膜炎」或「pvns」是指滑膜增厚且在一個或多個關節中過度生長的病狀。局部化pvns通常涉及支撐關節的腱且/或發生於關節的一個區域中,而彌散性pvns更為廣泛且可涉及整個關節。彌散性pvns通常影響大關節(例如髖和/或膝關節),而局部化(或結節性)pvns通常發生於較小關節(例如手及腳)中。可產生良性生長(有時稱為良性腫瘤),從而對毗鄰骨造成損傷和/或造成關節炎。本申請中所公開的治療pvns的方法也可用於治療涉及滑膜關節及腱鞘的其他增生性病症,例如腱鞘的巨細胞瘤(gctts)及腱鞘滑膜巨細胞瘤(tgct)(例如彌散性腱鞘滑膜巨細胞瘤(dttgct))。在藥劑中和、阻斷、抑制、消除、減少和/或幹擾因子活性(包括在因子是配體時其與一種或多種受體的結合)時,藥劑「拮抗」因子活性。本文所用的「治療」是指治療性處理及預防性(prophylactic或preventative)措施,其中目標是預防或減緩(減輕)靶病理學病狀或病症。在一些實施方案中,術語「治療」涵蓋任何施用或施加用於哺乳動物(包括人)疾病的治療劑,且包括抑制或減緩疾病或疾病進展;部分地或完全減輕疾病,例如通過引起消退或恢復或修復損失的、缺少的或缺陷的功能;刺激無效過程;或引起疾病平臺期以具有降低的嚴重程度。術語「治療」還包括降低任一表型特徵的嚴重程度和/或降低該特徵的發病率、程度或可能性。需要治療的那些包含已患有病症的那些以及易於患上病症的那些或要預防病症的那些。術語「有效量」或「治療有效量」是指有效治療受試者中疾病或病症的藥物量。在一些實施方案中,有效量是指在所需時間段內以所需劑量有效達成期望治療或預防效應的量。本發明的抗csf1r抗體的治療有效量可根據諸如以下等因素而有所變化:個體的疾病狀態、年齡、性別及體重以及一種或多種抗體在該個體內誘發期望響應的能力。治療有效量涵蓋一種或多種抗體的治療有益效應勝過其任何毒性或有害效應的量。在一些實施方案中,表述「有效量」是指有效治療pvns的抗體量。「預防有效量」是指以所需時間段和劑量有效達到期望的預防結果的量。通常但非必須地,因預防劑量是在患病之前或患病早期用於受試者的,故預防有效量會低於治療有效量。與一種或多種其他治療劑「組合」施用包括以任何順序同時(並行)及連續(順序)施用。「藥學上可接受的載劑」是指本領域通常與治療劑一起使用(其一起包含用於施用於受試者的「藥物組合物」)的無毒固體、半固體或液體填充劑、稀釋劑、囊封材料、配製物助劑或載劑。藥學上可接受的載劑在所用劑量及濃度處對接受者是無毒的且與配製物的其他成份兼容。藥學上可接受的載劑適用於所採用的配製物。例如,若治療劑要經口施用,則載劑可以是凝膠膠囊。若治療劑要皮下施用,則載劑理想地對皮膚無刺激性且並不引起注射部位反應。抗csf1r抗體抗csf1r抗體包括但不限於人源化抗體、嵌合抗體、小鼠抗體、人抗體及包含本文所述的重鏈和/或輕鏈cdr的抗體。示例性人源化抗體在一些實施方案中,提供結合csf1r的人源化抗體。人源化抗體可用作治療分子,這是由於人源化抗體減少或消除對非人抗體的人免疫響應(例如人抗小鼠抗體(hama)響應),該響應可對抗體治療劑產生免疫響應,且降低治療有效性。非限制性的示例性人源化抗體包括本文所述的huab1至huab16。非限制性的示例性人源化抗體還包括含有選自huab1至huab16的抗體的重鏈可變區和/或選自huab1至huab16的抗體的輕鏈可變區的抗體。非限制性的示例性人源化抗體包括含有選自seqidno:39至45的重鏈可變區和/或選自seqidno:46至52的輕鏈可變區的抗體。示例性人源化抗體還包括但不限於包含選自0301、0302及0311的抗體的重鏈cdr1、cdr2及cdr3和/或輕鏈cdr1、cdr2及cdr3的人源化抗體。在一些實施方案中,人源化抗csf1r抗體包含選自0301、0302及0311的抗體的重鏈cdr1、cdr2及cdr3和/或輕鏈cdr1、cdr2及cdr3。非限制性的示例性人源化抗csf1r抗體包括含有選自如下一組的重鏈cdr1、cdr2及cdr3的抗體:seqidno:15、16及17;seqidno:21、22及23;和seqidno:27、28及29。非限制性的示例性人源化抗csf1r抗體還包括含有選自如下的一組輕鏈cdr1、cdr2及cdr3的抗體:seqidno:18、19及20;seqidno:24、25及26;和seqidno:30、31及32。非限制性的示例性人源化抗csf1r抗體包括含有表1中的重鏈cdr1、cdr2及cdr3及輕鏈cdr1、cdr2及cdr3的組的抗體(所顯示的seqidno;序列可參見表8)。表1的每一行顯示了示例性抗體的重鏈cdr1、cdr2及cdr3及輕鏈cdr1、cdr2及cdr3。表1:重鏈和輕鏈的cdr其他示例性人源化抗體在一些實施方案中,人源化抗csf1r抗體包含重鏈,所述重鏈包含與選自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列,且其中該抗體結合csf1r。在一些實施方案中,人源化抗csf1r抗體包含輕鏈,所述輕鏈包含與選自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列,其中該抗體結合csf1r。在一些實施方案中,人源化抗csf1r抗體包含重鏈,所述重鏈包含與選自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列;及包含輕鏈,所述輕鏈包含與選自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列;其中該抗體結合csf1r。如本文中所使用,可使用例如電腦程式來測定具體多肽(例如)是否與胺基酸序列至少95%相同。在測定具體序列是否與參考序列例如95%相同時,相對於參考胺基酸序列的全長來計算同一性百分比。在一些實施方案中,人源化抗csf1r抗體包括本文所論述的至少一種cdr。換言之,在一些實施方案中,人源化抗csf1r抗體包含至少一個選自本文所論述的重鏈cdr1、本文所論述的重鏈cdr2、本文所論述的重鏈cdr3、本文所論述的輕鏈cdr1、本文所論述的輕鏈cdr2及本文所論述的輕鏈cdr3的cdr。此外,在一些實施方案中,人源化抗csf1r抗體包含至少一個基於本文所論述的cdr的突變cdr,其中突變cdr相對於本文所論述的cdr包括1、2、3或4個胺基酸取代。在一些實施方案中,胺基酸取代的一項或多項是保守胺基酸取代。本領域技術人員能選擇一種或多種用於特定cdr序列的適合的保守胺基酸取代,其中適合的保守胺基酸取代預計並不顯著改變包括突變cdr的抗體的結合性質。示例性的人源化抗csf1r抗體還包括與本文所述的抗體競爭與csf1r的結合的抗體。因此,在一些實施方案中,提供了與選自fab0301、0302及0311的抗體及那些fab的二價(即具有兩條重鏈及兩條輕鏈)抗體形式競爭與csf1r的結合的人源化抗csf1r抗體。示例性人源化抗體恆定區在一些實施方案中,本文所述的人源化抗體包含一個或多個人恆定區。在一些實施方案中,人重鏈恆定區是選自iga、igg及igd的同種型的。在一些實施方案中,人輕鏈恆定區是選自κ及λ的同種型的。在一些實施方案中,本文所述的人源化抗體包含人igg恆定區。在一些實施方案中,本文所述的人源化抗體包含人igg4重鏈恆定區。在一些此類實施方案中,本文所述的人源化抗體包含人igg4恆定區中的s241p突變。在一些實施方案中,本文所述的人源化抗體包含人igg4恆定區及人κ輕鏈。重鏈恆定區的選擇可決定抗體是否具有體內效應功能。在一些實施方案中該效應功能包括抗體依賴性細胞介導的細胞毒性作用(adcc)和/或補體依賴性細胞毒性作用(cdc),且可使得殺傷抗體所結合的細胞。在一些治療方法(包括治療一些腫瘤的方法)中,例如,在抗體結合至支持腫瘤的維持或生長的細胞時,細胞殺傷可以是期望的。可支持腫瘤的維持或生長的示例性細胞包括但不限於腫瘤細胞本身、有助於將血管募集至腫瘤中的細胞及提供配體、生長因子或支持或促進腫瘤生長或腫瘤存活的反受體的細胞。在一些實施方案中,在期望效應功能時,選擇包括人igg1重鏈或人igg3重鏈的抗csf1r抗體。在一些治療方法中,效應功能可能是不期望的。例如,在一些實施方案中,可能期望用於治療pvns的抗體不具有效應功能。因此,在一些實施方案中,使用缺乏顯著效應功能的抗csf1r抗體來治療pvns。在一些實施方案中,用於治療pvns的抗csf1r抗體包含人igg4或igg2重鏈恆定區。在一些實施方案中,igg4恆定區包含s241p突變。抗體可以通過任一方法人源化。人源化的非限制性的示例性方法包括闡述於(例如)以下文獻中的方法:美國專利第5,530,101號;第5,585,089號;第5,693,761號;第5,693,762號;第6,180,370號;jones等,nature321:522-525(1986);riechmann等,nature332:323-27(1988);verhoeyen等,science239:1534-36(1988);及美國公開第us2009/0136500號。如上所述,人源化抗體是這樣的抗體,所述抗體中非人可變區的框架區中的至少一個胺基酸由來自人框架區中相應位置的胺基酸代替。在一些實施方案中,非人可變區的框架區中的至少兩個、至少三個、至少4個、至少5個、至少6個、至少7個、至少8個、至少9個、至少10個、至少11個、至少12個、至少15個或至少20個胺基酸由來自一個或多個人框架區中一個或多個相應位置的胺基酸代替。在一些實施方案中,用於取代的一些相應的人胺基酸來自不同的人免疫球蛋白基因的框架區。即,在一些此類實施方案中,非人胺基酸的一個或多個可由來自第一人抗體的人框架區的相應胺基酸代替或由第一人免疫球蛋白基因編碼,非人胺基酸的一個或多個可由來自第二人抗體的人框架區的相應胺基酸代替或由第二人免疫球蛋白基因編碼,非人胺基酸的一個或多個可由來自第三人抗體的人框架區的相應胺基酸代替或由第三人免疫球蛋白基因編碼,等等。此外,在一些實施方案中,所有用於單一框架區(例如fr2)中的取代的相應人胺基酸無需來自同一人框架。然而,在一些實施方案中,所有用於取代的相應人胺基酸都來自同一人抗體或由同一人免疫球蛋白基因編碼。在一些實施方案中,通過使用相應的人框架區代替一個或多個整個框架區來將抗體人源化。在一些實施方案中,選擇與所代替的非人框架區具有最高同源性水平的人框架區。在一些實施方案中,該人源化抗體是cdr移植抗體。在一些實施方案中,在cdr移植後,一個或多個框架胺基酸變回小鼠框架區中的相應胺基酸。在一些實施方案中,進行此類「回復突變」以保留一種或多種看起來有助於一個或多個cdr的結構和/或可涉及抗原接觸和/或似乎涉及抗體的總體結構完整性的小鼠框架胺基酸。在一些實施方案中,在cdr接枝後,對抗體的框架區進行10個或更少、9個或更少、8個或更少、7個或更少、6個或更少、5個或更少、4個或更少、三個或更少、兩個或更少、一個或零個回復突變。在一些實施方案中,人源化抗體也包含人重鏈恆定區和/或人輕鏈恆定區。示例性嵌合抗體在一些實施方案中,抗csf1r抗體是嵌合抗體。在一些實施方案中,抗csf1r抗體包含至少一個非人可變區及至少一個人恆定區。在一些此類實施方案中,抗csf1r抗體的所有可變區是非人可變區,且抗csf1r抗體的所有恆定區是人恆定區。在一些實施方案中,嵌合抗體的一個或多個可變區是小鼠可變區。嵌合抗體的人恆定區無需與其所代替的非人恆定區(若存在)是同一同種型。嵌合抗體論述於例如美國專利no.4,816,567號;及morrison等,proc.natl.acad.sci.usa81:6851-55(1984)中。非限制性的示例性嵌合抗體包括含有選自0301、0302及0311的抗體的重鏈和/或輕鏈可變區的嵌合抗體。其他非限制性的示例性嵌合抗體包括含有選自0301、0302及0311的抗體的重鏈cdr1、cdr2及cdr3和/或輕鏈cdr1、cdr2及cdr3的嵌合抗體。非限制性的示例性嵌合抗csf1r抗體包括含有如下重鏈及輕鏈可變區對的抗體:seqidno:9及10;seqidno:11及12;及seqidno:13及14。非限制性的示例性抗csf1r抗體包括含有上表1中所示的重鏈cdr1、cdr2及cdr3和輕鏈cdr1、cdr2及cdr3的組的抗體。其他示例性嵌合抗體在一些實施方案中,嵌合抗csf1r抗體包括含有與選自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列的重鏈,其中該抗體結合csf1r。在一些實施方案中,嵌合抗csf1r抗體包括含有與選自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列的輕鏈,其中該抗體結合csf1r。在一些實施方案中,嵌合抗csf1r抗體包括含有與選自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列的重鏈;及含有與選自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列的輕鏈;其中該抗體結合csf1r。在一些實施方案中,嵌合抗csf1r抗體包含至少一個本文所論述的cdr。即,在一些實施方案中,嵌合抗csf1r抗體包含至少一個選自本文所論述的重鏈cdr1、本文所論述的重鏈cdr2、本文所論述的重鏈cdr3、本文所論述的輕鏈cdr1、本文所論述的輕鏈cdr2及本文所論述的輕鏈cdr3的cdr。此外,在一些實施方案中,嵌合抗csf1r抗體包含至少一個基於本文所論述的cdr的突變cdr,其中所述突變cdr相對於本文所論述的cdr包含1、2、3或4個胺基酸取代。在一些實施方案中,胺基酸取代的一個或多個是保守胺基酸取代。本領域技術人員可選擇一個或多個用於具體cdr序列的適合的保守胺基酸取代,其中預期適合的保守胺基酸取代並不顯著改變包括突變cdr的抗體的結合特性。示例性的嵌合抗csf1r抗體還包括與本文所述的抗體競爭與csf1r的結合的嵌合抗體。因此,在一些實施方案中,提供了與選自fab0301、0302及0311的抗體及那些fab的二價(即具有兩條重鏈及兩條輕鏈)抗體形式競爭與csf1r的結合的嵌合抗csf1r抗體。示例性的嵌合抗體恆定區在一些實施方案中,本文所述的嵌合抗體包含一個或多個人恆定區。在一些實施方案中,人重鏈恆定區是選自iga、igg及igd的同種型的。在一些實施方案中,人輕鏈恆定區是選自κ及λ的同種型的。在一些實施方案中,本文所述的嵌合抗體包含人igg恆定區。在一些實施方案中,本文所述的嵌合抗體包含人igg4重鏈恆定區。在一些此類實施方案中,本文所述的嵌合抗體包含人igg4恆定區中的s241p突變。在一些實施方案中,本文所述的嵌合抗體包含人igg4恆定區及人κ輕鏈。如上所述,效應功能是否是期望的可取決於意欲針對抗體的具體治療方法。因此,在一些實施方案中,在期望效應功能時,選擇包含人igg1重鏈恆定區或人igg3重鏈恆定區的嵌合抗csf1r抗體。在一些實施方案中,在不期望效應功能時,選擇包含人igg4或igg2重鏈恆定區的嵌合抗csf1r抗體。示例性的人抗體人抗體可通過任一合適方法製得。非限制性的示例性方法包括在包含人免疫球蛋白基因座的轉基因小鼠中製備人抗體。參見例如jakobovits等,proc.natl.acad.sci.usa90:2551-55(1993);jakobovits等,nature362:255-8(1993);lonberg等,nature368:856-9(1994);及美國專利第5,545,807號;第6,713,610號;第6,673,986號;第6,162,963號;第5,545,807號;第6,300,129號;第6,255,458號;第5,877,397號;第5,874,299號;及第5,545,806號。非限制性的示例性方法還包括使用噬菌體展示文庫來製備人抗體。參見例如hoogenboom等,j.mol.biol.227:381-8(1992);marks等,j.mol.biol.222:581-97(1991);及pct公開wo99/10494。在一些實施方案中,人抗csf1r抗體結合至具有seqidno:1的序列的多肽。示例性人抗csf1r抗體還包括與本文所述的抗體競爭與csf1r的結合的抗體。因此,在一些實施方案中,提供與選自fab0301、0302及0311的抗體和那些fab的二價(即具有兩條重鏈及兩條輕鏈)抗體形式競爭與csf1r的結合的人抗csf1r抗體。在一些實施方案中,人抗csf1r抗體包含一個或多個人恆定區。在一些實施方案中,人重鏈恆定區是選自iga、igg及igd的同種型的。在一些實施方案中,人輕鏈恆定區是選自κ及λ的同種型的。在一些實施方案中,本文所述的人抗體包含人igg恆定區。在一些實施方案中,本文所述的人抗體包含人igg4重鏈恆定區。在一些此類實施方案中,本文所述的人抗體包含人igg4恆定區中的s241p突變。在一些實施方案中,本文所述的人抗體包含人igg4恆定區及人κ輕鏈。在一些實施方案中,在期望效應功能時,選擇包含人igg1重鏈恆定區或人igg3重鏈恆定區的人抗csf1r抗體。在一些實施方案中,在不期望效應功能時,選擇包含人igg4或igg2重鏈恆定區的人抗csf1r抗體。其他示例性抗csf1r抗體示例性的抗csf1r抗體還包括但不限於包含例如本文所述的一個或多個cdr序列的小鼠抗體、人源化抗體、人抗體、嵌合抗體及工程化抗體。在一些實施方案中,抗csf1r抗體包含本文所述的重鏈可變區。在一些實施方案中,抗csf1r抗體包含本文所述的輕鏈可變區。在一些實施方案中,抗csf1r抗體包含本文所述的重鏈可變區及本文所述的輕鏈可變區。在一些實施方案中,抗csf1r抗體包含本文所述的重鏈cdr1、cdr2及cdr3。在一些實施方案中,抗csf1r抗體包含本文所述的輕鏈cdr1、cdr2及cdr3。在一些實施方案中,抗csf1r抗體包含本文所述的重鏈cdr1、cdr2及cdr3及本文所述的輕鏈cdr1、cdr2及cdr3。在一些實施方案中,抗csf1r抗體包含選自fab0301、0302及0311的抗體的重鏈可變區。非限制性的示例性抗csf1r抗體還包括含有選自人源化抗體huab1至huab16的抗體重鏈可變區的抗體。非限制性的示例性抗csf1r抗體包括含有重鏈可變區的抗體,所述重鏈可變區包含選自seqidno:9、11、13及39至45的序列。在一些實施方案中,抗csf1r抗體包含選自fab0301、0302及0311的抗體的輕鏈可變區。非限制性的示例性抗csf1r抗體還包括含有選自人源化抗體huab1至huab16的抗體的輕鏈可變區的抗體。非限制性的示例性抗csf1r抗體包括含有輕鏈可變區的抗體,所述輕鏈可變區包含選自seqidno:10、12、14及46至52的序列。在一些實施方案中,抗csf1r抗體包含選自fab0301、0302及0311的抗體的重鏈可變區及輕鏈可變區。非限制性的示例性抗csf1r抗體還包括含有選自人源化抗體huab1至huab16的抗體的重鏈可變區及輕鏈可變區的抗體。非限制性的示例性抗csf1r抗體包括含有如下重鏈及輕鏈可變區對的抗體:seqidno:9及10;seqidno:11及12;及seqidno:13及14;seqidno:39及40;seqidno:41及42;seqidno:43及44;seqidno:45及46;seqidno:47及48;seqidno:49及50;及seqidno:51及52。非限制性的示例性抗csf1r抗體還包括含有如下的重鏈及輕鏈對的抗體:seqidno:33及34;seqidno:35及36;及seqidno:37及38。在一些實施方案中,抗csf1r抗體包含選自fab0301、0302及0311的抗體的重鏈cdr1、cdr2及cdr3。非限制性的示例性抗csf1r抗體包括含有選自如下的重鏈cdr1、cdr2及cdr3的組的抗體:seqidno:15、16及17;seqidno:21、22及23;及seqidno:27、28及29。在一些實施方案中,抗csf1r抗體包含選自fab0301、0302及0311的抗體的輕鏈cdr1、cdr2及cdr3。非限制性的示例性抗csf1r抗體包括含有選自如下的輕鏈cdr1、cdr2及cdr3的組的抗體:seqidno:18、19及20;seqidno:24、25及26;及seqidno:30、31及32。在一些實施方案中,抗csf1r抗體包含選自fab0301、0302及0311的抗體的重鏈cdr1、cdr2及cdr3及輕鏈cdr1、cdr2及cdr3。非限制性的示例性抗csf1r抗體包括含有上表1中所示的重鏈cdr1、cdr2及cdr3及輕鏈cdr1、cdr2及cdr3的組的抗體。其他示例性抗體在一些實施方案中,抗csf1r抗體包含含有與選自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列的重鏈,其中該抗體結合csf1r。在一些實施方案中,抗csf1r抗體包含含有與選自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列的輕鏈,其中該抗體結合csf1r。在一些實施方案中,抗csf1r抗體包含含有與選自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列的重鏈;及含有與選自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列的輕鏈;其中該抗體結合csf1r。在一些實施方案中,抗csf1r抗體包含本文所論述的至少一個cdr。即,在一些實施方案中,抗csf1r抗體包含至少一個選自本文所論述的重鏈cdr1、本文所論述的重鏈cdr2、本文所論述的重鏈cdr3、本文所論述的輕鏈cdr1、本文所論述的輕鏈cdr2及本文所論述的輕鏈cdr3的cdr。此外,在一些實施方案中,抗csf1r抗體包含至少一個基於本文所論述cdr的突變cdr,其中突變cdr相對於本文所論述的cdr具有1、2、3或4個胺基酸取代。在一些實施方案中,胺基酸取代的一個或多個是保守胺基酸取代。本領域技術人員可選擇一種或多種用於具體cdr序列的適合的保守胺基酸取代,其中預期適合的保守胺基酸取代不顯著改變包括突變cdr的抗體的結合性質。示例性抗csf1r抗體也包含與本文所述的抗體競爭結合至csf1r的抗體。因此,在一些實施方案中,提供與選自fab0301、0302及0311的抗體及彼等fab的二價(即具有兩條重鏈及兩條輕鏈)抗體形式競爭結合至csf1r的抗csf1r抗體。示例性抗體恆定區在一些實施方案中,本文所述的抗體包含一個或多個人恆定區。在一些實施方案中,人重鏈恆定區是選自iga、igg及igd的同種型的。在一些實施方案中,人輕鏈恆定區是選自κ及λ的同種型的。在一些實施方案中,本文所述的抗體包含人igg恆定區。在一些實施方案中,本文所述的抗體包含人igg4重鏈恆定區。在一些此類實施方案中,本文所述的抗體包含人igg4恆定區中的s241p突變。在一些實施方案中,本文所述的抗體包含人igg4恆定區及人κ輕鏈。如上所述,效應功能是否是期望的可取決於意欲針對抗體的具體治療方法。因此,在一些實施方案中,在期望效應功能時,選擇包含人igg1重鏈恆定區或人igg3重鏈恆定區的抗csf1r抗體。在一些實施方案中,在不期望效應功能時,選擇包含人igg4或igg2重鏈恆定區的抗csf1r抗體。示例性抗-csf1r重鏈可變區在一些實施方案中,提供抗csf1r抗體重鏈可變區。在一些實施方案中,抗csf1r抗體重鏈可變區是小鼠可變區、人可變區或人源化可變區。抗csf1r抗體重鏈可變區包含重鏈cdr1、fr2、cdr2、fr3及cdr3。在一些實施方案中,抗csf1r抗體重鏈可變區進一步包含重鏈fr1和/或fr4。非限制性的示例性重鏈可變區包括但不限於具有選自seq1dno:9、11、13及39至45的胺基酸序列的重鏈可變區。在一些實施方案中,抗csf1r抗體重鏈可變區包含含有選自seqidno:15、21及27的序列的cdr1。在一些實施方案中,抗csf1r抗體重鏈可變區包含含有選自seqidno:16、22及28的序列的cdr2。在一些實施方案中,抗csf1r抗體重鏈可變區包含含有選自seqidno:17、23及29的序列的cdr3。非限制性的示例性重鏈可變區包括但不限於包含選自如下的cdr1、cdr2及cdr3的組的重鏈可變區:seqidno:15、16及17;seqidno:21、22及23;及seqidno:27、28及29。在一些實施方案中,抗csf1r抗體重鏈包含與選自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列,其中所述重鏈與輕鏈一起能夠形成結合csf1r的抗體。在一些實施方案中,抗csf1r抗體重鏈包含本文所論述的至少一個cdr。即,在一些實施方案中,抗csf1r抗體重鏈包含至少一個選自本文所論述的重鏈cdr1、本文所論述的重鏈cdr2及本文所論述的重鏈cdr3的cdr。此外,在一些實施方案中,抗csf1r抗體重鏈包含至少一個基於本文所論述cdr的突變cdr,其中突變cdr相對於本文所論述的cdr具有1、2、3或4個胺基酸取代。在一些實施方案中,胺基酸取代的一個或多個是保守胺基酸取代。本領域技術人員可選擇一種或多種用於具體cdr序列的適合的保守胺基酸取代,其中預期適合的保守胺基酸取代不顯著改變包括突變cdr的重鏈的結合特性。在一些實施方案中,重鏈包含重鏈恆定區。在一些實施方案中,重鏈包含人重鏈恆定區。在一些實施方案中,人重鏈恆定區是選自iga、igg及igd的同種型的。在一些實施方案中,人重鏈恆定區是igg恆定區。在一些實施方案中,重鏈包含人igg4重鏈恆定區。在一些此類實施方案中,人igg4重鏈恆定區包含s241p突變。在一些實施方案中,在期望效應功能時,重鏈包含人igg1或igg3重鏈恆定區。在一些實施方案中,在較不期望效應功能時,重鏈包含人igg4或igg2重鏈恆定區。示例性抗-csf1r輕鏈可變區在一些實施方案中,提供抗csf1r抗體輕鏈可變區。在一些實施方案中,抗csf1r抗體輕鏈可變區是小鼠可變區、人可變區或人源化可變區。抗csf1r抗體輕鏈可變區包含輕鏈cdr1、fr2、cdr2、fr3及cdr3。在一些實施方案中,抗csf1r抗體輕鏈可變區進一步包含輕鏈fr1和/或fr4。非限制性的示例性輕鏈可變區包括具有選自seqidno:10、12、14及46至52的胺基酸序列的輕鏈可變區。在一些實施方案中,抗csf1r抗體輕鏈可變區包含含有選自seqidno:18、24及30的序列的cdr1。在一些實施方案中,抗csf1r抗體輕鏈可變區包含含有選自seqidno:19、25及31的序列的cdr2。在一些實施方案中,抗csf1r抗體輕鏈可變區包含含有選自seqidno:20、26及32的序列的cdr3。非限制性的示例性輕鏈可變區包括但不限於包含選自如下的cdr1、cdr2及cdr3的組的輕鏈可變區:seqidno:18、19及20;seqidno:24、25及26;及seqidno:30、31及32。在一些實施方案中,抗csf1r抗體輕鏈包含與選自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可變區序列,其中所述輕鏈與重鏈一起能夠形成結合csf1r的抗體。在一些實施方案中,抗csf1r抗體輕鏈包含至少一個本文所論述的cdr。即,在一些實施方案中,抗csf1r抗體輕鏈包含至少一個選自本文所論述的輕鏈cdr1、本文所論述的輕鏈cdr2及本文所論述的輕鏈cdr3的cdr。此外,在一些實施方案中,抗csf1r抗體輕鏈包含至少一個基於本文所論述cdr的突變cdr,其中突變cdr相對於本文所論述的cdr具有1、2、3或4個胺基酸取代。在一些實施方案中,胺基酸取代的一個或多個是保守胺基酸取代。本領域技術人員可選擇一種或多種用於具體cdr序列的適合的保守胺基酸取代,其中預期適合的保守胺基酸取代不顯著改變包括突變cdr的輕鏈的結合特性。在一些實施方案中,輕鏈包含人輕鏈恆定區。在一些實施方案中,人輕鏈恆定區選自人κ及人λ輕鏈恆定區。示例性其他csf1r結合分子在一些實施方案中,提供其他結合csf1r的分子。此類分子包括但不限於非經典支架,例如抗運載蛋白(anti-calin)、阿德奈汀(adnectin)、錨蛋白重複序列(ankyrinrepeats)等。參見例如hosse等,prot.sci.15:14(2006);fiedler,m.和skerra,a.,「non-antibodyscaffolds」,第467-499頁,handbookoftherapeuticantibodies,dubel,s.編,wiley-vch,weinheim,germany,2007。抗csf1r抗體的示例性特性在一些實施方案中,具有上述結構的抗體以小於1nm的結合親和力(kd)結合至csf1r,阻斷csf1和/或il-34與csf1r的結合,並抑制由csf1和/或il-34誘導的csf1r磷酸化。在一些實施方案中,抗csf1r抗體結合至csf1r的胞外結構域(csf1r-ecd)。在一些實施方案中,抗csf1r抗體對csf1r具有小於1nm、小於0.5nm、小於0.1nm或小於0.05nm的結合親和力(kd)。在一些實施方案中,抗csf1r抗體具有0.01nm至1nm、0.01nm至0.5nm、0.01nm至0.1nm、0.01nm至0.05nm或0.02nm至0.05nm的kd。在一些實施方案中,抗csf1r抗體阻斷配體與csf1r的結合。在一些實施方案中,抗csf1r抗體阻斷csf1與csf1r的結合。在一些實施方案中,抗csf1r抗體阻斷il-34與csf1r的結合。在一些實施方案中,抗csf1r抗體阻斷csf1及il-34與csf1r的結合。在一些實施方案中,阻斷配體結合的抗體結合至csf1r的胞外結構域。在一些實施方案中,使用所述分析(例如美國專利no.8,206,715b2的實施例7,其通過提述併入本文用於任何目的),在抗體將配體與csf1r的可檢測結合量降低至少50%時,該抗體阻斷配體與csf1r的結合。在一些實施方案中,抗體將配體與csf1r的可檢測結合量降低至少60%、至少70%、至少80%或至少90%。在一些此類實施方案中,據述抗體將配體結合阻斷至少50%、至少60%、至少70%等。在一些實施方案中,抗csf1r抗體抑制配體誘導的csf1r磷酸化。在一些實施方案中,抗csf1r抗體抑制csf1誘導的csf1r磷酸化。在一些實施方案中,抗csf1r抗體抑制il-34誘導的csf1r磷酸化。在一些實施方案中,抗csf1r抗體抑制csf1誘導及il-34誘導的csf1r磷酸化二者。在一些實施方案中,使用所述分析(例如美國專利no.8,206,715b2,實施例6,其通過提述併入本文用於任何目的),在抗體將可檢測配體誘導的csf1r磷酸化的量降低至少50%時,將該抗體視為「抑制配體誘導的csf1r磷酸化」。在一些實施方案中,抗體將可檢測配體誘導的csf1r磷酸化的量降低至少60%、至少70%、至少80%或至少90%。在一些此類實施方案中,據述抗體將配體誘導的csf1r磷酸化抑制至少50%、至少60%、至少70%等。在一些實施方案中,抗體抑制csf1和/或il-34存在下的單核細胞增殖和/或生存響應。在一些實施方案中,使用所述分析(例如美國專利no.8,206,715b2,實施例10,其通過提述併入本文用於任何目的),在抗體將csf1和/或il-34存在下的單核細胞增殖和/或生存響應的量降低至少50%時,將該抗體視為「抑制單核細胞增殖和/或生存響應」。在一些實施方案中,抗體將csf1和/或il-34存在下的單核細胞增殖和/或生存響應的量降低至少60%、至少70%、至少80%或至少90%。在一些此類實施方案中,據述抗體將單核細胞增殖和/或生存響應抑制至少50%、至少60%、至少70%等。示例性抗體綴合物在一些實施方案中,抗體綴合至標記和/或細胞毒性劑。如本文中所使用,標記是有助於抗體檢測和/或有助於抗體所結合分子的檢測的部分。非限制性的示例性標記包括但不限於放射性同位素、螢光基團、酶基團、化學發光基團、生物素、表位標籤、金屬結合標籤等。本領域技術人員可根據預期應用來選擇合適的標記。如本文中所使用,細胞毒性劑是降低一種或多種細胞的增殖能力的部分。在細胞變得不太能夠增殖(例如由於細胞經經歷凋亡或以其他方式死亡,細胞不能繼續進行細胞周期和/或不能分裂,細胞分化等等)時,細胞具有降低的增殖能力。非限制性的示例性細胞毒性劑包括但不限於放射性同位素、毒素及化療劑。本領域技術人員可根據預期應用來選擇合適的細胞毒性劑。在一些實施方案中,使用體外化學方法將標記和/或細胞毒性劑綴合至抗體。綴合的非限制性的示例性化學方法是本領域已知的,且包含可購自例如thermoscientificlifescienceresearchproduces(曾經為pierce;rockford,il)、prozyme(hayward,ca)、sacriantibodyservices(calgary,canada)、abdserotec(raleigh,nc)等的服務、方法和/或試劑。在一些實施方案中,在標記和/或細胞毒性劑為多肽時,標記和/或細胞毒性劑可自具有至少一條抗體鏈的相同表達載體表達以產生包含融合至抗體鏈的標記和/或細胞毒性劑的多肽。本領域技術人員可根據預期應用來選擇將標記和/或細胞毒性劑綴合至抗體的合適方法。示例性的前導序列為大量表達及分泌一些分泌蛋白,可能需要來自異源蛋白的前導序列。在一些實施方案中,前導序列選自seqidno:3及4,其分別為輕鏈及重鏈前導序列。在一些實施方案中,採用異源前導序列可能是有利的,其中所得成熟多肽可以保持無變化,因為在分泌過程期間在er中前導序列被去除。可能需要添加異源前導序列以表達及分泌一些蛋白。一些示例性的前導序列描述於例如由新加坡國立大學生物化學系(departmentofbiochemistry,nationaluniversityofsingapore)維護的在線前導序列資料庫中。參見choo等,bmcbioinformatics,6:249(2005);及pct公開no.wo2006/081430。編碼抗體的核酸分子提供了包含編碼抗體的一條或多條鏈的多核苷酸的核酸分子。在一些實施方案中,核酸分子包含編碼抗體的重鏈或輕鏈的多核苷酸。在一些實施方案中,核酸分子包含編碼抗體重鏈的多核苷酸及編碼抗體輕鏈的多核苷酸。在一些實施方案中,第一核酸分子包含編碼重鏈的第一多核苷酸且第二核酸分子包含編碼輕鏈的第二多核苷酸。在一些此類實施方案中,重鏈及輕鏈自一個核酸分子或自兩個單獨核酸分子(作為兩個單獨多肽)表達。在一些實施方案中,例如在抗體為scfv時,單一多核苷酸編碼包含連接在一起的重鏈及輕鏈的單一多肽。在一些實施方案中,編碼抗體的重鏈或輕鏈的多核苷酸包含編碼前導序列(其在翻譯時位於重鏈或輕鏈中n末端處)的核苷酸序列。如上文所論述,前導序列可以是天然重鏈或輕鏈前導序列,或可以是另一異源前導序列。可使用本領域常規的重組dna技術來構建核酸分子。在一些實施方案中,核酸分子是適於在所選宿主細胞中表達的表達載體。抗體表達及生產載體提供了包含編碼抗體重鏈和/或輕鏈的多核苷酸的載體。還提供了包含編碼抗體重鏈和/或輕鏈的多核苷酸的載體。此類載體包括但不限於dna載體、噬菌體載體、病毒載體、逆轉錄病毒載體等。在一些實施方案中,載體包含編碼重鏈的第一多核苷酸序列編碼輕鏈的第二多核苷酸序列。在一些實施方案中,重鏈及輕鏈自載體以兩條單獨多肽表達。在一些實施方案中,重鏈及輕鏈作為單一多肽的一部分而表達,例如在抗體為scfv時。在一些實施方案中,第一載體包含編碼重鏈的多核苷酸且第二載體包含編碼輕鏈的多核苷酸。在一些實施方案中,以類似量(例如類似摩爾量或類似質量的量)將第一載體及第二載體轉染至宿主細胞中。在一些實施方案中,將摩爾-或質量比率為5∶1至1∶5的第一載體及第二載體轉染至宿主細胞在。在一些實施方案中,對於編碼重鏈的載體與編碼輕鏈的載體使用1∶1至1∶5的質量比率。在一些實施方案中,對於編碼重鏈的載體與編碼輕鏈的載體使用1∶2的質量比率。在一些實施方案中,選擇經優化以用於在cho或cho源細胞或nso細胞中表達多肽的載體。示例性的此類載體闡述於例如runningdeer等,biotechnol.prog.20:880-889(2004)中。在一些實施方案中,選擇載體以用於在動物(包括人)中體內表達抗體重鏈和/或抗體輕鏈。在一些此類實施方案中,多肽表現處於以組織特異性方式發揮作用的啟動子的控制下。例如,肝特異性啟動子闡述於例如pct公開no.wo2006/076288中。宿主細胞在多種實施方案中,可在原核細胞(例如細菌細胞)或真核細胞(例如真菌細胞(例如酵母)、植物細胞、昆蟲細胞及哺乳動物細胞)中表達抗體重鏈和/或輕鏈。例如,可根據本領域已知的程序實施該表達。可用於表達多肽的示例性真核細胞包括但不限於cos細胞,包括cos7細胞;293細胞,包括293-6e細胞;cho細胞,包括cho-s及dg44細胞;per.細胞(crucell);及nso細胞。在一些實施方案中,可在酵母中表達抗體重鏈和/或輕鏈。參見例如美國公開no.us2006/0270045al。在一些實施方案中,基於對抗體重鏈和/或輕鏈作出期望的翻譯後修飾的能力來選擇具體的真核宿主細胞。例如,在一些實施方案中,cho細胞產生唾液酸化水平比293細胞中所產生的相同多肽更高的多肽。可通過任一方法將一種或多種核酸引入期望的宿主細胞中,包括但不限於磷酸鈣轉染、deae-右旋糖酐介導的轉染、陽離子脂質介導的轉染、電穿孔、轉導、感染等。非限制性的示例性方法闡述於例如sambrook等,molecularcloning,alaboratorymanual,第3版,coldspringharborlaboratorypress(2001)中。可根據任何合適方法在期望的宿主細胞中瞬時或穩定轉染核酸。在一些實施方案中,可根據任何合適方法在動物中在體內產生一種或多種多肽,所述多肽由一種或多種編碼多肽的核酸分子工程化或轉染。抗體純化可通過任何合適方法純化抗體。此類方法包括但不限於使用親和力基質或疏水相互作用色譜。合適的親和力配體包括抗原及結合抗體恆定區的配體。例如,可使用蛋白a、蛋白g、蛋白a/g或抗體親和力柱來結合恆定區及純化抗體。疏水相互作用色譜(例如丁基或苯基柱)也可適於純化一些多肽。純化多肽的許多方法是本領域已知的。抗體的無細胞生產在一些實施方案中,在無細胞系統中產生抗體。非限制性的示例性無細胞系統闡述於(例如)sitaraman等,methodsmol.biol.498:229-44(2009);spirin,trendsbiotechnol.22:538-45(2004);endo等,biotechnol.adv.21:695-713(2003)中。治療組合物及方法治療色素絨毛結節性滑膜炎(pvns)及其他病狀的方法在一些實施方案中,提供治療pvns的方法,其包括施用有效量的抗csf1r抗體。在一些實施方案中,pvns是彌散性pvns。在一些此類實施方案中,pvns在髖和/或膝關節中。在一些此類實施方案中,pvns在手或腳關節中。在一些實施方案中,提供治療其他涉及滑膜關節及腱鞘的增生性病症(例如腱鞘的巨細胞瘤(gctts)及腱鞘滑膜巨細胞瘤(tgct))的方法,其包括施用有效量的抗csf1r抗體。在一些實施方案中,抗體以本文所述的劑量施用,及例如以如下劑量施用:至少1、至少2、至少4、至少8、至少10、至少12、至少16、至少20、至少30、至少40、至少50或至少100mg/kg。在一些實施方案中,抗體以本文所述的劑量施用,及例如以1mg/kg、2mg/kg或4mg/kg的劑量施用。在一些實施方案中,抗體以本文所述的頻率施用,及例如以如下頻率施用:每兩周一次、每三周一次、每4周一次、每5周一次、每6周一次、每8周一次或每10周一次。在一些實施方案中,可在抗體治療過程期間施用至少2個、至少3個、至少4個、至少5個、至少6個、至少7個、至少8個、至少9個、至少10個、至少11個或至少12個劑量。在一些實施方案中,在至少兩個或至少三個或至少4個劑量的抗體之後,用結合csf1r的抗體治療pvns使得腫瘤體積評分降低至少30%或至少40%或至少50%或至少60%或至少70%。可以例如使用mri測量腫瘤體積評分以評估受影響關節中的腫瘤體積。在一些實施方案中,在一個受影響關節中測量腫瘤體積評分。在一些實施方案中,以一個或多個受影響關節中的總腫瘤體積來測量腫瘤體積評分。抗csf1r抗體可在至少一種其他療法之前、同時和/或之後施用。非限制性的示例性的其他療法包括手術滑膜切除術、放射束治療、放射性同位素滑膜切除術及關節置換。在一些實施方案中,抗csf1r抗體阻斷csf1和/或il-34與csf1r的結合和/或抑制由csf1和/或il-34誘導的csf1r磷酸化。在一些實施方案中,抗csf1r抗體阻斷csf1及il-34與csf1r的結合和/或抑制由csf1和/或il-34誘導的csf1r磷酸化。在一些實施方案中,抗csf1r抗體包含本文所述的選自huab1至huab16的抗體的cdr或可變區。在一些實施方案中,抗csf1r抗體包含huab1的cdr或可變區。施用途徑及載劑在多種實施方案中,可在體內通過多種途徑施用抗體,包括但不限於經口、動脈內、胃腸外、鼻內、肌內、心內、心室內、氣管內、經頰(buccal)、直腸、腹膜內、真皮內、局部、經皮及鞘內或另外通過植入或吸入。可將標題組合物配製為固體、半固體、液體或氣態形式的製備物;包括但不限於片劑、膠囊、粉劑、顆粒劑、軟膏劑、溶液、栓劑、灌腸劑、注射劑、吸入劑及氣霧劑。可將編碼抗體的核酸分子包覆於金微粒上並通過粒子轟擊裝置或「基因槍」進行皮內遞送,如文獻中所述(參見例如tang等,nature356:152-154(1992))。可根據預期應用來選擇適當的配製物及施用途徑。在多種實施方案中,將包含抗體的組合物與各種藥學上可接受的載劑一起提供於配製物中(參見例如gennaro,remington:thescienceandpracticeofpharmacywithfactsandcomparisons:drugfactsplus,第20版(2003);ansel等,pharmaceuticaldosageformsanddrugdeliverysystems,第7版,lippencottwilliamsandwilkins(2004);kibbe等,handbookofpharmaceuticalexcipients,第3版,pharmaceuticalpress(2000))。各種藥學上可接受的載劑(包括介質、佐劑及稀釋劑)都是可獲得的。此外,各種藥學上可接受的輔助物質(如ph調節劑及緩衝劑、張力調節劑、穩定劑、潤溼劑等等)也是可獲得的。非限制性的示例性載劑包括鹽水、緩衝鹽水、右旋糖、水、甘油、乙醇,及其組合。在多種實施方案中,可通過如下方式來配製包括抗體的組合物以用於注射(bk皮下施用):將其(若需要的話)與常規添加劑(例如增溶劑、等張劑、懸浮劑、乳化劑、穩定劑及防腐劑),溶解、懸浮或乳化於水性或非水性溶劑(例如植物油或其他油、合成的脂肪酸甘油酯、高級脂肪酸的酯或丙二醇)中。在多種實施方案中,例如可使用可接受加壓的推進劑(例如二氯二氟甲烷、丙烷、氮等等)配製組合物以供吸入。在多種實施方案中,例如,也可使用生物可降解或生物不可降解聚合物將組合物配製成持續釋放微膠囊。非限制性的示例性生物可降解配製物包括聚乳酸-乙醇酸聚合物。非限制性的示例性生物不可降解配製物包括聚甘油脂肪酸酯。製備此類配製物的一些方法闡述於例如ep1125584a1中。本發明也提供包含一個或多個容器的藥物包和試劑盒,每一容器含有一個或多個劑量的抗體或抗體組合。在一些實施方案中,提供單位劑量,其中所述單位劑量含有預定量的組合物,所述組合物包含抗體或抗體組合且具有或不具有一種或多種其他藥劑。在一些實施方案中,以注射用一次性預填充的注射器形式供應所述單位劑量。在多種實施方案中,含於單位劑量中的組合物可包含鹽水、蔗糖等等;緩衝劑,如磷酸鹽等等;和/或配製在穩定且有效的ph範圍內。或者,在一些實施方案中,組合物可作為凍乾粉末提供,其可在添加適當液體(例如無菌水)後重建。在一些實施方案中,組合物包含一種或多種抑制蛋白質聚集的物質,包括但不限於蔗糖及精氨酸。在一些實施方案中,本發明組合物包含肝素和/或蛋白聚糖。以有效治療或預防具體適應症的量施用藥物組合物。治療有效量通常取決於所治療受試者的體重、其身體或健康狀況、要治療的病狀的擴展性(extensiveness)或所治療受試者的年齡。一般而言,可以約10μg/kg體重/劑量至約100mg/kg體重/劑的範圍的量施用抗體。在一些實施方案中,可以約50μg/kg體重/劑至約5mg/kg體重/劑的範圍的量施用抗體。在一些實施方案中,可以約100μg/kg體重/劑至約10mg/kg體重/劑的範圍的量施用抗體。在一些實施方案中,可以約100μg/kg體重/劑至約20mg/kg體重/劑的範圍的量施用抗體。在一些實施方案中,可以約0.5mg/kg體重/劑量至約20mg/kg體重/劑量範圍的量施用抗體。在一些實施方案中,可以至少1、至少2、至少4、至少8、至少10、至少12、至少16、至少20、至少30、至少40、至少50或至少100mg/kg的劑量施用抗體。在一些實施方案中,可以1mg/kg、2mg/kg或4mg/kg的劑量施用抗體。可視需要向受試者施用抗體組合物。施用頻率可由本領域技術人員(例如主治醫師)基於如下考慮來確定:所治療的病狀、所治療受試者的年齡、所治療病狀的嚴重程度、所治療受試者的一般健康狀態等等。在一些實施方案中,向受試者施用有效劑量的抗體一次或多次。在多種實施方案中,每月一次、每月小於一次(例如每兩個月一次或每三個月一次)向受試者施用有效劑量的抗體。在其他實施方案中,每月一次以上(例如每三周一次、每兩周一次或每周一次)施用有效劑量的抗體。在一些實施方案中,每1、2、3、4或5周一次施用有效劑量的抗體。在一些實施方案中,每周兩次或三次施用有效劑量的抗體。向受試者施用有效劑量的抗體至少一次。在一些實施方案中,可施用有效劑量的抗體多次,包含施用至少一個月、至少6個月或至少一年的時段。組合治療抗體可單獨或與其他治療模式一起施用。其可在其他治療模式(例如手術、放射治療、關節置換和/或另一治療劑)之前、基本上同時或之後提供。在一些實施方案中,pvns在選自手術、放射治療、關節置換、施用另一治療劑或其組合的治療後復發或進展。在一些實施方案中,在至少一種選自手術滑膜切除術、放射束治療、放射性同位素滑膜切除術及關節置換的治療之前、同時或之後施用抗csf1r抗體。實施例下文所論述的實施例僅意欲例示本發明而不應視為以如何方式限制本發明。此類實施例不意欲表示,下文實驗是所實施的所有或僅有的實驗。已努力確保所用數值(例如量、溫度等)的精確性,但應考慮到一些誤差及偏差。除非另有說明,否則份數是重量份數,分子量是重量平均分子量(weightaveragemolecularweight),溫度是攝氏度,且壓力是大氣壓或接近大氣壓。實施例1:人源化抗csf1r抗體先前研發了各種人源化抗csf1r抗體。參見例如pct公開no.wo2011/140249。人源化重鏈可變區及人源化輕鏈可變區的每一個的序列,其與親代嵌合抗體可變區的序列及人受體可變框架區的序列比對,示於圖1(重鏈)及2(輕鏈)中。人源化可變區序列相對於人受體可變框架區序列的變化以加框顯示。每一可變區的每一cdr顯示於加框區域中,且在加框序列上方標記為「cdr」。下表8顯示了抗體huab1至huab16的人源化重鏈及人源化輕鏈的完整序列。這些抗體的每一個的人源化重鏈及人源化輕鏈的名稱及seqidno顯示於表3中。表3:huab1至huab16的人源化重鏈和輕鏈人源化抗體人源化hcseqidno人源化lcseqidnohuab1h0301-h053h0301-l060huab2h0301-h154h0301-l060huab3h0301-h255h0301-l060huab4h0301-h053h0301-l161huab5h0301-h154h0301-l161huab6h0301-h255h0301-l161huab7h0302-h156h0302-l062huab8h0302-h156h0302-l163huab9h0302-h156h0302-l264huab10h0302-h257h0302-l062huab11h0302-h257h0302-l163huab12h0302-h257h0302-l264huab13h0311-h158h0311-l065huab14h0311-h158h0311-l166huab15h0311-h259h0311-l065huab16h0311-h259h0311-l166如先前所闡述,測試了16種人源化抗體與人、食蟹猴及小鼠csf1recd的結合。參見例如pct公開no.wo2011/140249。發現抗體結合人及食蟹猴csf1recd,但不結合小鼠csf1recd。還發現人源化抗體阻斷csf1和il-34與人和食蟹猴csf1r的結合且抑制cho細胞中表達的人csf1r的csf1誘導和il-34誘導的磷酸化。參見例如pct公開案no.wo2011/140249。先前已測定了與人csf1recd的結合的ka、kd及kd且顯示於表4中。參見例如pct公開no.wo2011/140249。表4:針對人csf1r的人源化抗體結合親和力huabka(m-1s-1)kd(s-1)kd(nm)huab0301-l0h03.22x1061.11x10-030.35huab0301-l0h13.56x1061.22x10-030.34huab0301-l0h22.32x1066.60x10-040.28huab0301-l1h03.29x1061.15x10-030.35huab0301-l1h12.87x1069.21x10-040.32huab0301-l1h22.95x1067.42x10-040.25huab0302-l0h13.54x1063.69x10-031.04huab0302-l1h13.47x1064.04x10-031.17huab0302-l2h11.60x1069.14x10-040.57huab0302-l0h23.40x1061.79x10-030.53huab0302-l1h22.71x1061.53x10-030.56huab0302-l2h21.84x1068.40x10-040.46huab0311-l0h11.22x1065.40x10-040.44huab0311-l1h11.32x1066.64x10-040.50huab0311-l0h21.34x1064.73x10-040.35huab0311-l1h21.51x1066.09x10-040.40實施例2:抗csf1r抗體的藥代動力學及藥效學在3個靜脈內(iv)研究中於食蟹猴中研究了huab1的藥代動力學(pk)及毒物動力學(tk)。所研究的劑量範圍為在單一劑量後的3-150mg/kg及重複劑量後的3-150mg/kg。輸注持續時間為30分鐘。重複劑量研究中的給藥間隔為每周一次且每個動物接受總共4個劑量。在scid小鼠中研究了嵌合替代(surrogate)抗體的單一及重複劑量pk以幫助闡釋huab1清除的機制,且更好地理解相對於單一劑量pk研究中的猴在glp毒理學研究的恢復組中的猴中所觀察到的延長暴露的機制。食蟹猴中在huab1的單一30分鐘iv輸注後的pk特徵的特徵在於快速分布,然後是止於huab1自血漿的加速消耗(與靶介導的清除一致)的較緩慢末期。除靶介導的清除之外,快速降低可部分地由huab1抗體導致。然而,嵌合替代抗體在缺乏產生ada響應的能力的scid小鼠中的單一劑量施用顯示出類似特徵並證實尤其在低劑量處靶介導的清除有助於huab1的總體清除。觀察到的最大血漿濃度(cmax)與所測試所有劑量水平處的劑量成比例增加,而自時間零外推至無限的血漿濃度-時間曲線下面積(auc∞)增加自3mg/kg至10mg/kg大於劑量成比例,且自10mg/kg至150mg/kg是劑量成比例的。在加速終末下降之前的半衰期(t1/2)範圍為1-12天且總體清除範圍為0.14-1.25ml/h/kg。總而言之,huab1在食蟹猴中具有飽和非線性清除。在3個食蟹猴研究中檢驗了huab1對已知在體內由csf1r抑制調節的各種藥效學(pd)標誌物的效應。此類標誌物包括csf1、cd16+單核細胞及骨吸收標誌物。csf1水平:csf1的血漿或血清濃度是huab1靶接合(engagement)的測量。csf1在正常生理學條件下通過巨噬細胞(主要是脾臟巨噬細胞及肝kupffer細胞)經由csf1r介導的胞吞作用及細胞內降解自循環清除。csf1在正常受試者中的穩態水平<1μg/ml。huab1結合csf1且預防csf1從csf1r被清除,從而使得循環csf1濃度發生較大、快速增加,然後csf1水平達到大約10μg/ml的新穩態。在中試毒理學研究中,在食蟹猴中經4周每周一次給藥後在谷底處(給藥後7天)獲得血漿csf1及血漿huab1樣品。數據顯示,最小生物效應出現於5μg/mlhuab1處,且半最大響應(ec50)為8μg/mlhuab1。cd16+單核細胞:在glp毒理學研究中,cd16+單核細胞在接受50mg/kg或150mg/kghuab1的4周靜脈內輸注的猴中有所減少,這與支持此單核細胞亞群體的體內生長及維持的csf1r通路一致。cd16+單核細胞減少發生於給藥1周內且在整個給藥及暴露時段中持續下去。cd16+單核細胞在huab1清除之後恢復至正常基線濃度。通過施用huab1來使cd16-單核細胞亞群體保持不受影響。骨吸收標誌物:在重複給藥huab1後於猴中評估骨吸收的血漿及尿液標誌物。尿液ntx、血漿ctx及trap5b均是降低的。此類效應在清除huab1後是可逆的。實施例3:使用抗csf1r抗體治療pvns將huab1抗體(分別包含seqidno:53及60的重鏈及輕鏈可變區的抗體)以1mg/kg至4mg/kg的增加劑量施用pvns患者。每2周一次施用huab1。以28天循環治療患者,其中每一循環由第1天及第15天的2個劑量組成。在完成一個循環之後,可在下一循環中向患者施用增加的劑量。監測患者的症狀改善及腫瘤體積評分(tvs)。可在開始huab1治療之前及之後自患者獲得基線及治療後腫瘤組織切片及滑液。另外,監測患者的總體響應、免疫相關響應及總體生存。在第一劑量的huab1之前28天內且然後在第一劑量後的某些時間間隔處(例如4、8、16及24周,且然後每12-16周)進行mri腫瘤評估。還在第一劑量之後每4周一次進行健康結果(例如功能及症狀)的臨床評估。使用recist評估可測量疾病的huab1響應。可根據最佳總體腫瘤響應(完全響應[cr]、部分響應[pr]、疾病穩定[sd]或疾病進展[pd])來將患者分類。計算(在適當時)按照最佳總體腫瘤響應分級的患者的頻率、比例及精確95%ci。將具有cr或pr的最佳總體腫瘤響應且持續時間為至少4周(28天)的患者進一步分類為具有客觀腫瘤響應。通過recist及腫瘤體積評分對患者響應進行分類。腫瘤體積評分根據如下定義來分類響應:完全響應[(cr)病灶在治療循環之後完全消失]、部分響應[(pr)體積評分相對於基線降低≥50%]、疾病進展[(pd)相對於治療期間(不論在基線處或在某些其他訪視時)的最低評分的體積增加≥30%]或疾病穩定[(sd)不滿足基於評分的任一先前標準]。響應持續時間計算為自總體響應(cr或pr)的第一記載至疾病進展的第一記載的天數。實施例4:色素絨毛結節性滑膜炎(pvns)/彌散性腱鞘的巨細胞瘤(dt-tgct)患者中的i/ii期臨床試驗的總結在患有色素絨毛結節性滑膜炎(pvns)及彌散性腱鞘的巨細胞瘤(dt-tgct)的一者或兩者的患者中使用huab1(也稱為fpa008)進行i/ii期臨床試驗。i期的目標在於測定患者中huab1的推薦劑量,而實施ii期以估計huab1在患者中的客觀響應率(orr)。orr=完全響應(cr)+部分響應(pr)。該研究還表徵huab1在患者中的安全性及耐受性並確定有響應的患者的響應持續時間並評估huab1在患者中的藥代動力學。另外,該研究評估huab1的藥效學,如通過csf1、il34、trap5b、ctx及全血cd14+/cd16+單核細胞子集的血清濃度變化所測量的;通過免疫組織化學(ihc)針對csf1、csf1r及cd68評估滑膜活檢組織;針對huab1濃度及細胞構成變化評估滑液;及評估功能結果,如通過特定針對pvns研發的ogilvie-harris評分(ogilvie-harris,1992;rhee,2010)及通過eq-5d-5l評分(rabin,2001;herdmann,2011)所測量的。i/ii期研究是開放標記的且將患者招募至任一期而非二者中。在28天循環中每2周一次用huab1治療患者。可在一個28天循環之後繼續治療。例如,第一劑量循環可用於安全性及藥代動力學評估,但患者可參與例如1、2或3個額外的28天循環的延長治療期或直至疾病進展(若在24周之前的話)、不可接受毒性、患者或醫師決定中斷或研究終止為止。在i期中,將3名患者招募至3個群組的每一個中,向所述群組分別施用1mg/kghuab1、2mg/kghuab1或4mg/kghuab1。可增加其他群組且可增加中間的3mg/kghuab1群組。若劑量繼續遞增至高於4mg/kg,則ii期的推薦劑量(rd)可為或可不為最大耐受劑量(mtd)(假設mtd是在i期中鑑定),但不高於mtd。ii期研究是基於選自i期結果的劑量或預計小於或等於4mg/kg的劑量。基於總體安全性、耐受性、客觀響應、pk、pd及自非臨床數據外推的有效暴露的估計來鑑定ii期劑量。ii期研究持續時間為24周且涉及名30患者。所治療患者為18歲或更大年齡且在組織學上確診有會引起不可接受的功能損失或發病率的不宜手術的pvns/dt-tgct或潛在可切除的腫瘤,如通過有資格的外科醫師或多學科腫瘤委員會所確定。患者可患有通過recist1.1在mri上可測量的pvns/dt-tgct。所治療患者未接受過使用抗csf1r抗體或使用plx3397的先前治療,除非因耐受不良而中斷。然而,患者可以接受過使用伊馬替尼或尼羅替尼的先前治療。患者在第一研究劑量施用之前12周內未進行所涉及關節的任何手術程序。在患者中評估藥代動力學參數。在適當且適用時,自fpa008的濃度-時間數據衍生出下列pk參數(也可計算其他參數(例如累積比率及半衰期)):血清濃度-時間曲線下面積(auc);最大血清濃度(cmax);最小血清濃度(cmin);清除率(cl);穩態分布體積(vss)。還評估了藥效學(pd)參數:血清-csf1及il34配體濃度、ctx及trap5b骨吸收標誌物濃度;全血-cd14+/cd16+單核細胞子集;滑膜(任選的)-評估滑膜活檢組織的csf1基因轉座(若先前未進行)、基線及治療中的滑膜活檢、csf1及csf1r和/或cd68的ihc;滑液(任選的)-huab1濃度;上述標誌物的細胞組分(通過ihc)。例如,通過收集血樣且針對huab1的抗藥物抗體分析樣品來評估免疫原性。例如,通過如下方式評估響應性:在篩選時、開始治療後4、8及16周(或直至治療中斷為止)進行受影響關節的mri。使用recist1.1及tvs基於獨立中心放射性評審評估mri響應。另外,若存在良好腫瘤響應率,可基於總體器官mri評分(worms)及類風溼性關節炎mri評分(ramris)評估周圍骨及其他關節組織的變化。在篩選時、c1d15(給藥前)、c2d1(給藥前)且然後在24周中的所有後續循環的第1天(給藥前)或直至治療中斷為止進行健康結果(功能、症狀)的臨床評估。每14(±2)周追蹤在治療完成/早期終止時尚未進展且同意繼續參與研究的患者(健康結果的mri及評估)直至進展為止,在c1d1後,患者經受局部療法(例如切除術、放射)或開始新全身性療法最長52周。通過監測不良事件及體檢變化、生命體徵、12導聯ecg及臨床實驗室測量來評估安全性。所有分析都是描述性且酌情按劑量組和總體呈現。將來自2期在患者數據匯總為單獨的組。還匯總所有以rd給藥的患者。因為可以在較低劑量水平處招募的患者數量較低,故可組合一些劑量水平以用於匯總。功效數據中的丟失值處理為丟失;不估算功效數據使用匯總表及患者數據列表呈現此研究中所收集的數據。使用描述性統計學(具體而言為平均值、中值、標準偏差(sd)、最小值及最大值)來匯總連續變量。通過頻率及百分比來匯總類別變量。在適當時,呈現95%置信區間。使用響應率及相應置信區間(ci)來評估功效。預計總共有大約33至36名在rd下治療的患者。表6顯示相應95%置信區間及各個樣本量及所觀察響應率的精確度。使用非分室分析方法計算pk參數,但可在適當時採用分室分析方法。實施例5:色素絨毛結節性滑膜炎(pvns)/彌散性腱鞘的巨細胞瘤(dt-tgct)患者中的i/ii期臨床試驗1.前言1.1.pvns背景色素絨毛結節性滑膜炎(pvns)是具有響應性炎症及克隆贅瘤性增殖的特徵的滑膜良性贅瘤,其中集落刺激因子-1(csf1)過表達。csf1基因(1p13)至col6a3啟動子(2q35)的常見轉座存在於大約60%的pvns患者中。轉座伴有滑膜中的csf1過表達。另外,大約40%的pvns患者在不存在鑑定的csf1轉座情況下具有csf1過表達。pvns及響應性滑膜炎的所有病例中csf1過表達的一致存在表明,csf1在滑膜病況範圍中具有重要作用且靶向csf1/csf1r相互作用在治療上有實用性(west,2006)。在pvns中,csf1過表達存在於少數滑膜細胞中,而大部分細胞浸潤物表達csf1r而非csf1。將此現象描述為在贅瘤性細胞中具有異常csf1表達的腫瘤美化效應,其引起非贅瘤性細胞的異常累積而形成團塊。選擇手術來治療患有局部pvns的患者。復發發生於8-20%的患者中且容易地通過再切除來管控。pvns/dt-tgct往往更通常(33-50%)復發且具有更具侵略性的臨床過程。患者通常具有症狀性且在其生命期間需要多個手術程序。對於患有不可切除疾病或多次復發的患者而言,使用csf1r抑制劑的全身性療法可幫助延遲或避免手術程序並改善功能結果(ravi,2011)。在29名pvns患者中評估伊馬替尼,一種csf1r的非特異性抑制劑。中值年齡為41歲且最常見疾病位點為膝蓋(n=17;59%)。根據recist,27名可評估患者中的5名具有完全(n=1)或部分(n=4)響應,總體響應率為19%。27名患者中的20名(74%)具有穩定疾病。在可評估症狀的22名患者中的16名(73%)中發現症狀改善。儘管具有高症狀改善率及總體良好的安全性特徵,但10名患者因毒性或其他原因而中斷治療(cassier,2012)。csf1信號傳導的強力抑制劑的最近兩項研究已顯示了在pvns患者中的初步但顯著的臨床活性。已在pvns患者中評估了plx3397(csf1r激酶抑制劑)及rg7155(靶向csf1r的單克隆抗體)(cassier,2014;tap,2014)。在兩項研究中,基於recist、fdg-pet和/或總體積評分(其是通過mri對疾病體積的測量),大部分pvns患者對治療具有響應。在pvns中,少數細胞的csf1過表達導致募集構成大部分腫瘤質量的表達csf1r的細胞。fpa008拮抗csf1r活化且應導致腫瘤中的表達csf1r的細胞的減少,由此提供臨床益處。1.2.fpa008:分子描述huab1(也稱為fpa008)是在鉸鏈區中具有單一胺基酸取代以防止半-二聚體交換的人源化igg4單克隆抗體。fpa008對人集落刺激因子1受體(csf1r)(受體酪氨酸激酶)具有高親和力結合。1.2.1.使用fpa008的非臨床研究1.2.1.1.csf1r信號傳導的fpa008抑制fpa008抑制經改造以過表達csf1r的細胞系(cho-csf1r)中的csf1及il34誘導的csf1r磷酸化,從而證實fpa008阻斷經配體誘導的csf1r信號傳導通路的活化。fpa008還在體外抑制周邊血單核細胞的csf1及il34誘導的增殖/存活,從而證實fpa008不僅抑制csf1及il34信號傳導通路的起始,且也抑制原代人單核細胞對此類配體的後續生理響應(關於進一步細節,參見fpa008研究者手冊(investigator’sbrochure)[ib])。1.2.2.非臨床藥代動力學及藥效學1.2.2.1.藥物代謝動力學在4個靜脈內(iv)研究中於食蟹猴中研究fpa008的藥代動力學(pk)及毒物動力學(tk)。所研究劑量範圍為在單一靜脈內濃注劑量之後的3-150mg/kg及在重複靜脈內輸注劑量之後的3-150mg/kg。輸注持續時間為30分鐘。重複劑量研究中的給藥間隔為每周一次且每一動物在兩個研究中接受總共4個劑量且在一個研究中接受總共13個劑量。食蟹猴中在fpa008的單一iv推注給藥後的pk特徵的特徵在於快速分布,隨後是止於fpa008自血漿的加速消耗(與靶介導的清除一致)的較緩慢末期。除靶介導的清除外,快速降低可部分地由抗fpa008抗體所致。然而,cmfpa008在缺乏產生ada響應的能力的scid小鼠中的單一劑量施用顯示類似特徵且證實尤其在低劑量處的靶介導的清除有助於pa008的總體清除。所觀察最大血漿濃度(cmax)與所測試所有劑量水平下的劑量成比例增加,而自時間零外推至無限的血漿濃度-時間曲線下面積(auc。。)增加自3mg/kg至10mg/kg大於劑量成比例,且自10mg/kg至150mg/kg是劑量成比例的。在加速終末下降之前的半衰期(t1/2)範圍為1-12天且總體清除範圍為0.14-1.25ml/h/kg。總而言之,fpa008在食蟹猴中具有飽和的靶介導的清除。1.2.2.2.藥效學在3個食蟹猴研究中檢驗了fpa008對已知在體內由csf1r抑制調節的各種藥效學(pd)標誌物的效應(細節提供於本文的5.1.1.7部分中)。此類標記物包括csf1、cd16+單核細胞及骨吸收標誌物。未在猴中測量il34,這是由於缺乏適當的測定。csf1水平:csf1的血漿或血清水平是fpa008靶接合的測量。csf1在正常生理學條件下通過巨噬細胞(主要是脾臟巨噬細胞及肝kupffer細胞)經由csf1r介導的胞吞作用及細胞內降解自循環清除(bartocci,1987)。csf1在正常受試者中的穩態濃度為<lng/ml。fpa008結合csf1且防止其被csf1r清除,從而使得循環csf1濃度發生大而快速的增加,然後csf1濃度達到大約10μg/ml的新穩態。在中試毒理學研究中,在食蟹猴中經4周每周一次給藥後在谷底處(給藥後7天)獲得血漿csf1及血漿fpa008樣品。數據顯示,最小生物效應出現於5μg/mlfpa008處,且半最大響應(ec50)為8μg/mlfpa008。儘管fpa008升高csf1,但fiveprime相信,此類升高不重要,這是因為:●csf1r是csf1信號傳導的唯一鑑定的受體且其受到fpa008拮抗。●csfl水平隨著fpa008的清除而下降。●在fpa008存在下,在csf1升高時,在fpa008細胞效力測定中評估極高濃度的csf1使fpa008自csf1r受體轉座的可能。數據顯示,高達10μg/mlcsf1的濃度對fpa008效力或csf1r信號傳導的最大抑制沒有影響。●在臨床前體內研究中清除fpa008後,未觀察到cd16+單核細胞的反彈增加。cd16+單核細胞:在glp毒理學研究中,cd16+單核細胞在接受50mg/kg或150mg/kgfpa008的4周靜脈內輸注的猴中有所減少,這與支持此單核細胞亞群體的體內生長及維持所需的csf1r通路一致。cd16+單核細胞減少發生在給藥1周內且在整個給藥及暴露時段中持續。cd16+單核細胞在fpa008清除之後恢復至正常基線水平。通過施用fpa008使cd16-單核細胞亞群體保持不受影響。骨吸收標誌物:在重複給藥fpa008後在猴中評估骨吸收的血漿及尿液標誌物。尿液ntx、血漿ctx及trap5b都是降低的。該效應在清除fpa008後是可逆的。1.2.3.非臨床毒理學研究及發現非臨床毒理學研究的全部細節提供於本文的第5.3部分中。所有毒性研究均在食蟹猴中實施,這是由於fpa008與嚙齒類動物沒有交叉反應性,但對食蟹猴及人csf1r顯示出相似的體外結合親和力且在比較人及食蟹猴組織的組的組織交叉反應性研究中具有相似組織結合特徵。使用fpa008實施以下4個非臨床體內毒理學研究:單劑量藥代動力學(pk)/耐受性研究,使用3、10、30及150mg/kg的劑量;劑量範圍發現重複劑量毒性研究,使用3、10及150mg/kg的4周iv劑量;重複劑量glp毒性研究,使用50mg/kg及150mg/kg的4周iv劑量及30周恢復期;及亞慢性重複劑量glp毒性研究,使用20、50及100mg/kg的13周iv劑量及29周恢復期。在食蟹猴中的體內毒理學研究中,fpa008通常是耐受良好的。測試物品相關發現包含臨床觀察、血液學及臨床化學變化及組織學變化。這些觀察中的大部分可視為非不良的。1.2.3.1.眶周水腫最突出的身體發現是在延長的fpa008暴露之後看到的可逆眶周水腫。水腫的發作未顯示與暴露程度的清晰關係,然而,水腫在全身性清除藥物之後得以消退。眶周水腫是使用影響csf1通路的藥物的已知副作用(ries,2014)。1.2.3.2.單核細胞消耗主要血液學變化是循環cd16+單核細胞的減少,這被視為藥效學(pd)效應。隨著fpa008自循環的清除,降低的細胞數得以正常化。1.2.3.3.酶升高fpa008相關臨床化學效應包含可逆增加的丙氨酸轉氨酶(alt)、天門冬氨酸鹽轉氨酶(ast)及肌酸激酶(ck)血清濃度。此類實驗室異常不與終末或恢復性屍檢時的肝、心臟或肌肉組織損傷的任何組織病理學有關。還在研究的生命中部分期間測量了心臟肌鈣蛋白、骨骼肌鈣蛋白、肌紅蛋白及醛縮酶,且檢測到此類參數中的任一項均無變化,這進一步證實沒有任何肝或肌肉損害。增加的血清水平歸因於alt、ast及ck分子因減少的肝kupffer細胞數量而自血清的清除減弱(radi,2011)。因此,alt、ast及ck升高可視為無毒的且是fpa008暴露的間接pd效應。1.2.3.4.細胞外基質的累積在終末屍檢時兩個主要研究中的最值得關注的組織病理學發現是觀察到黏膜下膠原纖維通過乾淨空間(clearspace)及不同量的藍色、顆粒狀胞外基質(ecm)發生可逆擴張。此發現存在於大量組織中且通常為最小至輕度嚴重程度。其最常見於食管中。此變化不與炎症性細胞或膠原纖維、纖維母細胞或擴展區域內的平滑肌細胞的退化或其他改變的任何體徵有關。在缺乏功能csf1的op/op小鼠中也得到了類似觀察(radi,2009)。在本公開中,作者假設減少的組織巨噬細胞很可能引起觀察到ecm的累積,這是由於巨噬細胞對葡糖氨基聚糖的清除降低。葡糖氨基聚糖,尤其玻尿酸在結締組織中較為突出且通常由巨噬細胞分解代謝(radi,2009)。此變化被視為fpa008的間接pd效應。尚無證據表明藍色顆粒狀ecm的累積是不良的;尚無與組織病理學觀察相關的有關臨床觀察或器官重量變化。另外,ecm的此類變化在無藥物恢復期期間可逆,且因此可視為非不良的。1.2.3.5.其他發現4周glp研究的獨特的處在於給藥150mg/kg的單一雌性中的發現。在終末處死時,觀察到心外膜輕度炎症及心臟肌細胞空泡形成的顯微學證據。此發現的重要性尚未知曉,但不能排除與fpa008的關聯。慢性、輕度心外膜炎症可以是非人靈長類動物中的背景病灶。然而,細胞空泡形成可以是對有害刺激的非特異性細胞響應的早期體徵。肌細胞空泡形成並未發現於任一其他給藥動物中。重要的是應注意,此空泡形成不引起退化或壞死,且不引起所記錄ecg的變化。在恢復時或在13周毒性研究中於任一動物中並未檢測到心臟變化。此事件被視為4周毒性研究中的不良發現。另外,4周研究的獨特的處在於,在雌性動物中具有增加的脾器官重量且具有最小至輕度濾泡增生的相應組織病理學發現。該發現可視為低毒物學重要性的且非不良的,且在13周毒性研究中並未觀察到脾增生。因為巨噬細胞吞沒病原體以破壞它們(dale,2008),故fpa008治療可與細胞內病原體(例如結核分枝桿菌(mycobacteriumtuberculosis)、單核增生李斯特氏菌(listeriamonocytogenes)、利什曼原蟲(leishmania)及其他細胞內病原體)的易感性的增加的風險有關。儘管迄今為止尚未在fpa008動物研究中發現自發感染,但臨床研究方案含有用於處於最大風險的那些患者的排除標準。在研究的同時,定期監測患者的不良事件及感染。1.2.3.6.總結在以13個每周劑量施用於食蟹猴時,fpa008的無可觀察不良效應水平(noael)經測定為100mg/kg。1.3.使用fpa008的臨床經歷當前在經設計在3個部分中研究安全性、藥代動力學(pk)及pd生物標誌物的雙盲、隨機化、安慰劑對照、首次應用於人的試驗中評估fpa008。在第1部分中,使8名健康志願者隨機(3∶1)接受單一靜脈內輸注的fpa008或安慰劑(0.2、1、3或10mg/kg/劑量群組)。在第2部分中,使8名健康志願者隨機(3∶1)接受2個劑量的fpa008或安慰劑(間隔14天以1mg/kg或3mg/kg施用)。劑量遞增決定是基於發生劑量限制毒性(dlt)以及超過dlt時段的所得不良事件。第3部分包括開放標記評估ra患者中的3個劑量水平,這些ra患者的疾病對疾病修飾抗炎症藥(dmard)並無響應且使用穩定劑量的氨甲蝶呤。每一劑量水平處的三個受試者接受2個劑量的fpa008且間隔14天在開放標記部分中經靜脈內施用。然後,使30個新受試者分別隨機(2∶2∶1)接受fpa008或安慰劑的兩個劑量水平中的一個,且接受3個劑量(經靜脈內每14天施用)。尚無臨床安全性數據可用於第3部分患者中。48個健康志願者完成該研究的第1及2部分;這些受試者中的36個接受fpa008且12個接受安慰劑。fpa008在健康志願者中於3mg/kg雙重劑量處耐受良好。最常見fpa008治療相關毒性是搔癢症、眼瞼水腫以及面部腫脹、疲勞及頭痛。所述事件是1級或2級及自限性的。在10mg/kg處,所有6個活動性受試者經歷中等(2級)眼瞼水腫或面部腫脹,一些伴有手腳腫脹、視力模糊及增重。所述事件持續長達3個月且同時在此劑量水平處具有延長pk暴露。沒有不良事件滿足劑量限制性毒性的方案定義。在1mg/kg及更高劑量處發現ck(最高6.8倍於正常值上限)及乳酸去氫酶(ldh)(最高2.2倍於正常值上限)的劑量依賴性升高;最高2.1倍於正常值上限的ast升高發生於3mg/kg及更高劑量處且發生於較大百分比的具有增加的劑量的志願者中;且最高1.2倍於正常值上限的輕度alt升高發生於1個受試者中的10mg/kg處。峰值出現於在藥物施用後2-8周,通常在12周時回歸正常。這些升高不與總膽紅素、ck同功酶或肌鈣蛋白的臨床體徵/症狀或異常有關。其是可逆的且預計由負責它們的清除的kupffer細胞的fpa008介導的抑制所致(radi,2011),且可視為抑制csf1r而非代表組織損害的藥理學效應。此研究中觀察到的不良事件特徵相對類似於在其他靶向csf1r通路的化合物中所報導的那些(cassier,2014;tap,2014)。fpa008在所測試劑量範圍中展現出飽和靶介導的清除。健康志願者中所觀察到的pk特徵證實每2周一次或以更低頻率給藥fpa008會維持期望藥物暴露。觀察到cd16+單核細胞減少、骨更新生物標誌物(ctx、trap5b)減少且血清csf1及il34濃度的劑量依賴性增加。1.4.風險-益處評估通常基於fpa008的非臨床毒理學研究來預測fpa008在健康志願者中的安全性、pk及pd。關於毒理學研究的更多細節提供於本文中。在非臨床毒理學研究中,fpa008在多至100mg/kg的高劑量處經最多13個每周劑量在動物中是耐受良好的。pd效應(csf1及cd16+單核細胞)出現於遠低在那些與不良事件或異常實驗室發現有關的藥物暴露水平處。來自用以評估與csf1及il34信號傳導幹擾有關的藥理學介導毒性的潛在風險的小鼠模型的證據顯示,csf1、il34或csf1r的缺失是非致死性的。缺少csf1的小鼠顯示出骨破骨細胞的損失且顯示在出生時一些骨髓細胞具有缺陷(yoshida,1990);缺少il34的小鼠在表皮中缺乏langerhans細胞且在一些腦區域中缺乏小神經膠質細胞(wang,2012;greter,2012);且缺少csf1r的小鼠顯示出骨質疏鬆症及langerhans細胞及小神經膠質細胞二者的缺乏(hamilton,2013)。fpa008結合至csf1r不產生激動劑效應,如通過在fiveprime處實施的實驗(細節提供於ib中)所證明的。另外,fpa008是igg4抗體,且體外測試證實,其沒有特異性的抗體依賴性細胞介導的細胞毒性(adcc)或補體依賴性細胞毒性(cdc)活性。儘管pvns在大部分患者中通過局部介入管控,但一些患者呈現或患有不通過手術或其他可用療法充分管控的慢性或復發性疾病。伊馬替尼在少數患者中有效,但具有一些限制其應用的中靶及脫靶毒性。特異性csf1r抑制劑的初步報告表明,fpa008可有益地治療非手術pvns(其可以是衰弱疾病)。2.研究及終點2.1.主要目標1期:確定fpa008在pvns/dt-tgct患者中的推薦劑量(rd)2期:估計fpa008在pvns/dt-tgct患者中的客觀響應率(orr=cr+pr)2.2.次要目標表徵fpa008在pvns/dt-tgct患者中的安全性及耐受性測定有響應的患者中的響應的持續時間評估fpa008在pvns/dt-tgct患者中的藥代動力學2.3.探索性目標評估fpa008的藥效學,如通過csf1、il34、trap5b、ctx及全血cd14+/cd16+單核細胞子集的血清水平變化所測量的通過免疫組織化學(ihc)評估所選患者中的滑膜活檢組織的csf1、csf1r及cd68標誌物評估所選患者中的滑液的fpa008濃度及細胞構成變化評估功能結果,如通過針對pvns特定研發的ogilvie-harris評分及通過eq-5d-5l評分所測量2.4.主要研究終點1期:3級及4級不良事件(ae)及定義為劑量限制毒性(dlt)的臨床實驗室異常的發病率2期:根據recist1.1所證實的客觀響應的發病率2.5.次要終點pk參數ae、臨床實驗室異常及ecg異常的發病率根據recist1.1的響應持續時間2.6.探索性終點pd參數症狀及功能結果,如通過針對pvns特定研發的ogilvie-harris評分及通過eq-5d-5l評分所測量的3.研究的總體設計及計劃3.1.概述這是一項1期/2期研究。1期是fpa008的劑量遞增、開放標記、安全性、耐受性、pk及pd研究。將患者招募至1期或2期任一的研究中,而非招募至二者中。所招募患者將在28天循環中接受治療。每一循環由在第1天及第15天的2個劑量組成。3.1.1.篩選時段必須完成所有篩選評估且由研究者及醫學監測器予以評審以證實患者在fpa008的第一輸注之前滿足所有合格性標準(附錄1)。在實施任一研究具體篩選測試或程序之前,必須獲得用於參與研究的書面知情同意書。除非另外規定,否則在第一劑量的fpa008之前28天內實施篩選評估。在此時段期間收集在籤署知情同意書之後且在施用第一fpa008劑量之前發生的研究程序相關的ae。3.1.2.1期(劑量遞增)繼續劑量遞增直至達到mtd或最大可行劑量為止,其中每一群組招募最少3名患者。預期劑量水平及計劃表如下:劑量水平1:1mg/kgq2w;劑量水平2:2mg/kgq2w;劑量水平3:4mg/kgq2w。所有劑量遞增決定均基於dlt、總體安全性及耐受性的評估並會在招募至每一群組中的最後患者已完成第一治療循環之後作出。研究者與發起人之間將就劑量遞增決定達成一致。在開始每一新劑量水平或擴大現有劑量水平之前,舉行安全性電話會議,其中研究者及發起人評審患者數據(包括但不限於人口統計數據、fpa008給藥、同步藥劑、血液學及血清化學及ae);且劑量遞增或擴大現有劑量水平的協議及文件同意書可視為適當。若發起人及研究者一致同意在安全性及藥代動力學數據的評審後,應使用與所概述那些不同的劑量遞增方案,則允許該方案。安全性、pk及pd參數的評審可告知決定增加使用替代劑量水平或劑量方案(例如較小頻率給藥或使用負荷劑量)的群組以達到最佳靶暴露。使用如下算法以用於劑量遞增決定:表1:劑量遞增考量mtd定義為在小於33%的接受fpa008(在28天循環的第1及15天施用)的患者中與dlt有關的最高劑量。此通常為推薦用於另一研究的劑量(rd);然而,基於安全性及pk數據的評審,rd可低於mtd。若未達到mtd,且最高評估fpa008劑量充分耐受,則評審數據以評估進一步的劑量遞增是否得以保證。若其他劑量遞增視為適當,則可修改該方案。若在1期期間未達到mtd,或1期中的後續治療循環提供了關於安全性特徵的其他見解,可基於總體耐受性、安全性及pk來選擇rd。若患者出於毒性外的原因(例如疾病進展或撤回同意書)不接受2個劑量且不完成循環1中的安全性及pk評估,則將另一患者招募至該群組中,從而該群組具有至少三名可在整個循環1中評估耐受性的患者。所有此類討論和決定會記載為劑量遞增決策過程的一部分。不允許用於每一患者的高於起始劑量的患者內劑量遞增。若出於不良事件降低患者劑量,則可在ae解決之後且在與發起人討論並由其批准之後將劑量遞增至最初分配劑量。ae復發至大於2級將使得持續減少劑量且不再遞增。在完成循環1(安全性及pk評估時段)後,1期患者可參與始於循環2的第1天的延長治療期。經多至24周以4周循環每2周施用fpa008或直至疾病進展(若在24周之前的話)、不可接受毒性、患者或醫師決定中斷、死亡或發起人終止研究為止,其中假設對供應藥物的可用性沒有限制或沒有可阻止發起人提供fpa008的其他問題。3.1.3.2期在crc基於總體安全性、耐受性、目標響應、pk、pd及自非臨床數據外推的有效暴露的估計鑑定rd時,開始2期中的招募。預計rd≤4mg/kg。然而,pvns/dt-tgct患者可具有不同於健康志願者的藥物暴露。若繼續遞增劑量至高於4mg/kg且若在1期中鑑定mtd,則rd可或可不為mtd。例如,若未達到mtd,或若mtd下的暴露遠高於功效所需的認可程度,或若後續治療循環提供了關於安全性特徵的其他見解,則rd可以不同但不高於mtd的劑量。計劃每2周經多至24周的繼續治療(不高於12個劑量)或直至疾病進展為止。若患者表現為具有穩定或改善的症狀且具有穩定可測量疾病或更佳狀況(通過mri),但具有不可耐受或3級或更大的不良事件,則經發起人同意可容許劑量減少25-50%。3.2.程序對患者實施安全性評估(dlt及其他ae、生命體徵、ecg、臨床實驗室測試)、ecog體能狀態(ps)測定及體檢(附錄1)。另外,收集所有患者的血樣以用於pk及pd分析(附錄2)。在篩選時、開始治療後4、8及16周實施受影響關節的mri。除非已在前6周內實施或先前已確定腫瘤進展,否則也應在30天(±7天)及90天(±7天)治療結束時隨訪訪視中實施mri。尚未進展且進入長期隨訪的患者應每14(±2)周一次進行mri直至進展為止,在c1d1後,患者經受局部療法(例如切除術、放射)或開始新全身性療法最長52周。使用recist1.1及tvs基於獨立中心放射性評審評估mri響應。在研究藥物的第一次施用之後每4周一次進行健康結果(功能、症狀)的臨床評估。通過監測ae及體檢、體重、生命體徵、12導聯ecg及實驗室測量的變化來評估安全性。遵循國家癌症研究所(nationalcancerinstitute,nci)-常見不良事件術語標準(commonterminologycriteriaforadverseevents,ctcae)4.03版中所提供的指南來評估ae。也在研究期間的排定時間點(附錄2)抽取血樣以用於確定藥物血清濃度及抗藥物抗體(ada)(即對fpa008的抗體響應)。在具有可用存檔腫瘤組織且已籤署可選研究樣品知情同意書的患者中,評估組織的csf1基因轉座(若先前未進行)(附錄1)。另外,測定csf1及csf1r及cd68標誌物。對於籤署適用的可選研究樣品知情同意書的患者而言,在開始fpa008治療之前且在已滿足合格性標準之後自患者獲得基線腫瘤組織切片(≥0.5cm至≤2cm)及滑液(若適用的話)。由病理學家評審基線組織樣品以測定組織是否可評估。若篩選組織樣品可評估,則在循環2施用fpa008第1天之前實施後續活檢(附錄1)。招募至研究的1期或2期的患者可繼續以28天循環使用fpa008治療多至24周或直至疾病進展、不可耐受毒性、患者或醫師決定中斷或發起人終止研究為止。除非開始其他療法以用於治療pvns/dt-tgct或撤回同意書,否則中斷治療同時仍具有響應(cr、pr或sd)的有響應的患者應在長期隨訪期期間以14(±2)周間隔獲得隨訪細查以確定響應持續時間。所有患者都應返回診療所進行三個治療結束時隨訪訪視,不論患者是否退出或在計劃訪視時或中期退出。自施用fpa008的第一劑量時至在fpa008的最後劑量之後90天(±7天)(參見6.2.1.1部分)評估ae。在籤署知情同意書之後於最後劑量之後經90天(±7天)收集所有嚴重不良事件(sae)(參見6.2.1.1部分)。3.3.研究設計的原理此研究的1期組成部分是劑量遞增、開放標記研究,其用以評估fpa008在pvns/dt-tgct患者中的安全性、pk、pd及初步功效。3+3劑量遞增設計是用於新型抗癌治療的早期階段試驗的標準。2期組成部分是經設計以大約20%的精確度估計目標響應率的單階段試驗,其中假設響應率與針對plx3397及rg.7155(csf1r信號傳導通路的其他強力抑制劑)所報導的那些相似。2期組成部分還容許更充分地研究fpa008在用於未來試驗的靶群體中的安全性、pk及生物效應。4.研究合格性及退出標準4.1.患者及研究中心的計劃數量1期:招募大約12-15名pvns/dt-tgct患者。1期中的招募將持續直至已達到mtd或直至已定義2期的rd。2期:招募大約30名pvns/dt-tgct患者。在北美、歐洲及亞洲的大約12個研究中心進行研究。4.2.參與研究的納入標準招募至1期或2中的患者必須滿足所有如下納入標準:1.在任一研究性評估之前,理解並籤署機構評審委員會/獨立倫理委員會(institutionalreviewboard/independentethicscommittee)批准的知情同意書2.年齡≥18歲3.在組織學上證實診斷有將引起不可接受功能損失或發病率的不宜手術pvns/dt-tgct或潛在可切除腫瘤,如通過有資格外科醫師或多學科腫瘤委員會所確定的(必須記載於在篩選期間的crf中)4.通過recist1.1根據mri的可測量的pvns/dt-tgct。5.ecog體能狀態≤16.願意且能夠遵守所有研究程序7.在性活躍患者(即可能分娩、經受絕經(如通過連續12個月無月經所定義)或進行永久性絕育程序的女性及尚未進行永久性絕育程序的男性)中,願意使用2種有效避孕方法(其中之一必須是物理屏障方法(保險套、隔膜或子宮頸/子宮帽))直至fpa008的最後劑量之後6個月為止。其他有效避孕形式是在篩選之前至少6個月進行永久性絕育(子宮切除術和/或雙側卵巢切除術或使用手術的雙側輸卵管結紮或輸精管切除術)。<55歲的女性應具有>40的fsh。育齡女性患者必須在研究之前使用穩定口服避孕療法或子宮內或移植裝置至少90天,或禁絕性交作為一種生活方式。這些納入標準不允許放棄。4.3.用於研究參與的排除標準若適用任一下列標準,則排除招募至1期或2中的患者:1.使用抗csf1r抗體的先前治療2.使用plx3397的先前治療,除非因耐受不良(即對於先前激酶抑制劑為非進展性)而中斷;容許使用伊馬替尼或尼羅替尼的先前治療3.在篩選時的ck及肝功能測試(包含alt、ast及總膽紅素)在地方實驗室正常範圍之外4.不適當器官或骨髓功能,其定義如下:血紅素<10g/dl,絕對嗜中性粒細胞計數<1.5×09/l,血小板計數<100×09/l,血清肌酸酐>1.5×uln或計算的肌酸酐清除<30ml/min5.所涉及關節在在第一研究劑量施用之前12周內進行任何手術程序(除基線滑膜活檢外(若實施的話))6.臨床顯著的當前或歷史肌肉病症(例如肌炎)、最近未消退肌肉損害或任何已知升高血清ck濃度的病狀7.在第一研究劑量施用之前<1年具有充血性心力衰竭或心肌梗塞的歷史8.nyha>2級的降低的心臟功能9.不受控或顯著心臟病症,例如不穩定性心絞痛10.在篩選時ecg具有顯著異常。在篩選時,男性的qtcf>450msec或女性的qtcf>470msec11.禁忌mri及使用基於釓的靜脈內造影劑12.對先前生物藥劑具有嚴重過敏的(allergic)、過敏性(anaphylactic)或其他輸注相關反應的歷史13.在fpa008的第一劑量之前≤28天使用任何抗癌療法進行治療或參與使用研究藥物在另一治療性臨床研究14.針對先前生物藥劑的ada的已知歷史15.對tween20(聚山梨醇酯20)敏感的已知歷史16.以規則方式消耗非消毒牛奶,或具有對暴露於機會性細胞內感染(例如李斯特氏菌(listeria))或其他感染(例如病原體)的已知重大風險。17.在治療第一天之前28天內接受任何疫苗。fpa008對確立免疫學疫苗響應的效應未知。可在研究的同時施用流感疫苗或其他疫苗,但fpa008對接種疫苗的安全性及功效的影響是未知的。18.當前具有未消退的感染或慢性活動性臨床顯著感染(病毒[例如hbv、hcv]、細菌、真菌或其他感染)的歷史,其在研究者看來會將患者置於暴露於csf1r抑制劑的風險下19.關於人免疫缺失病毒(hiv)的已知陽性測試20.活動性tb21.在篩選時關於潛伏性tb的陽性測試(quantiferon測試)22.先前惡性腫瘤史,以下情形除外:●治癒性治療的非黑色素瘤皮膚惡性腫瘤●原位子宮頸癌●先前治癒性治療2年以上且並無復發證據的實體腫瘤23.缺乏周邊靜脈通路或任何幹擾藥物施用或研究樣品收集的病狀24.任何在研究者看來對患者安全性施加風險或幹擾研究參與或受試者患者結果的詮釋的不受控醫學病況或精神病學病症25.不能實施和/或遵守研究及隨訪程序。這些排除標準不允許放棄。4.4.患者退出及替換患者有權停止治療或在任何時間自研究退出。患者可繼續fpa008治療的重複循環(最多6個循環)直至適用下列標準中的至少一項為止:●在患者請求下或在其法定代表請求下撤回同意書●患者潛在疾病發生進展●任何向患者施加不可接受的安全性風險的事件●在很大程度上影響臨床狀態評估且需要中斷療法的間發性病況●在研究期間的任何時間處的陽性懷孕測試●在發起人或其全權代表的特定請求下(例如,若出於患者安全性原因而終止研究)。記錄中止fpa008的日期及原因,且研究者必須盡力實施治療結束時隨訪訪視。出於安全性原因,在fpa008的最後劑量之後追蹤患者90天(±7天);追蹤患有進行中的sae的那些直至消退或穩定為止。來自過早中斷的患者的數據將保留為研究資料庫的一部分。4.5.患者鑑定及招募患者必須能夠提供書面知情同意書且滿足所有納入標準,且不滿足排除標準。對於在研究中所招募的任何患者,研究者及發起人或其指派者不準許納入或排除標準出現放棄。在招募患者之前,所有合格性標準必須得到滿足。將符合研究條件的1期的患者招募至第一可用群組中。在2期中,招募大約30名患者的群組。在研究中總共招募大約42-45名患者。若非合格發現被視為錯誤或急性發現可能滿足重複測試中的合格性標準,則研究者可在招募之前重複合格實驗室測試及重要器官測試/ecg。5.研究藥物5.1.fpa008藥物產物此研究中的研究藥物產物是fpa008。fpa008的研究供應將由發起人(或指派者)提供至研究中心並在臨床研究中由受訓醫護專業人員施用於患者。fpa008藥物產物的簡單描述提供於如下:●配製物:fpa008藥物質(drugsubstance)由如下組成:ph6.3緩衝液(含有20mml-組氨酸、142mml-精氨酸及0.01%聚山梨醇酯20)中的20mg/mlfpa008。●如何供應:以存於配備有丁基橡膠塞及翻轉鋁密封件的5mliso6r類型1玻璃小瓶中的無菌、水性、無色、無致熱原溶液形式供應fpa008藥物產物以用於靜脈內施用。每一小瓶含有最少5ml的20mg/mlfpa008溶液(大約100mg/小瓶)。●儲存條件:2-8℃(36-46°f)。●根據地方法規來標記fpa008小瓶及紙板箱。5.2.施用基於此研究中的患者的體重來施用fpa008劑量。研究藥師(或其他負責人員)將製備用於施用的溶液。在基於患者體重計算小瓶數量之後,在大約100ml0.9%氯化鈉溶液中稀釋研究藥物產物。所製得fpa008應在製備之後≤6小時施用(環境溫度)。用於fpa008輸注的靜脈內施用組必須含有0.22μm在線過濾器或0.22μm注射器過濾器。在醫學監督下將大約30分鐘靜脈內輸注經由周邊靜脈或中央靜脈導管施用fpa008。若患者在完成輸注之前經歷輸注反應,則必須停止輸注,且應迅速根據體徵及症狀及當地臨床方案來管控患者。若所有跡象及症狀均已消退,則可以較緩慢速率重新開始輸注。若體徵及症狀不消退,則不應重新開始輸注。患者應在研究藥物輸注結束之後密切觀察至少1小時。所有小瓶均僅使用一次。研究藥物製備及施用的說明提供於醫藥手冊(pharmacymanual)中。5.3.起始劑量及劑量修改各群組之間在1期中的fpa008起始劑量水平及後續劑量遞增描述於3.1.2部分中。通過評估來自研究的1期的數據來確定2期中的fpa008劑量。5.3.1.群組之間fpa008的劑量遞增劑量遞增至下一群組僅始於在前一劑量群組已完成dlt時段之後。在由crc根據crc綱領作出潛在劑量遞增決定之前,28天(dlt時段)的安全性數據必須可用於至少3名安全性可評估患者。若群組中的患者缺乏適當安全性數據(例如,因在早期自研究退出或與方案的依從性較差),則將其他患者招募至群組中。以逐步方式進行每一連續劑量群組中的劑量遞增。由crc評審第一群組或前一劑量群組的所有相關安全性信息。計劃繼續劑量遞增直至劑量限制毒性出現於群組中的2名或更多名患者中為止。中斷劑量遞增的決定將由發起人及研究者基於達到mtd或顯示適當藥效學效應的劑量水平共同作出。在第1群組中,最初在1mg/kgfpa008的起始劑量(通過輸注給予)處招募3名患者。dlt發生(5.3.3部分)將決定是否在後續群組中遞增劑量。劑量遞增決定規則匯總於表2中。表2:遞增的決定標準5.3.1.1.最大耐受劑量rd的選擇基於臨床響應數據以及pk及pd特徵。發起人及研究者可在達到4mg/kg的最高計劃劑量之前決定中斷劑量遞增,或可在安全性、pk及pd數據支持評估不同劑量水平時評估較高(>4mg/kg)或中間(3mg/kg)劑量。不意欲遞增至mtd,但其是可發生的。因此,將mtd定義為在小於33%的接受fpa008(在計劃28天循環的第1天及第15天施用)的患者中與循環1中的dlt有關的最高劑量。若在1期期間未達到mtd或1期中之後續治療循環提供關於安全性特徵的其他見解,則可根據總體耐受性、pk及自進行中的臨床評估外推的有效暴露的估計來選擇rd。5.3.1.2.最低劑量水平處的毒性若意外發現1mg/kg的第一劑量水平超過mtd,則關於進行方式的決定將基於安全性、耐受性及pk數據;且在研究者與發起人之間達成一致。可選擇較低劑量水平用於下一群組。5.3.2.群組內的劑量遞增不允許高於起始劑量的患者內劑量遞增。若出於ae降低患者劑量,則可在ae消退之後且在與發起人討論且由其批准之後劑量遞增至最初指定的劑量。ae復發至大於2級將使得持續減少劑量且不會再遞增。5.3.3.劑量限制性毒性dlt定義為發生於治療的循環1期間的下列事件中的任一項且由研究者以及涉及fpa008的crc進行評估。在適用時,根據ncictcae(4.03版)來對事件進行分類。●任何等級≥3相關事件,下列事件除外:-對於並無相關臨床或實驗室異常的alt、ast或ck升高而言,應用下列dlt定義:■ck相關dlt:ck>10×正常值上限(uln)■alt或ast相關dlt:◆alt或ast>8×uln◆alt或ast>3×uln且相關總膽紅素>2×uln自研究治療去除在dlt評估時段(循環1)期間經歷dlt的1期患者。在循環1之後的循環中經歷在dlt評估時段期間視為劑量限制性毒性的患者無需在研究中中斷研究參與。5.3.4.劑量修改標準對於超過1期中dlt時段的延長治療中的患者或2期中的任一患者而言,可根據下列指南允許劑量減少。若研究者考慮不符合此類指南的劑量減少或中斷,則此類劑量減少或中斷需要與發起人進行討論且由其批准。患者可出於不良事件或其他事件刪除最多2個連續劑量(在劑量之間最長6周)且可在治療中斷6周內事件返回基線或≤1級時重新開始研究藥物。出於不良事件刪除長於6周的其他給藥使得患者需要自研究中斷,除非發起人容許。患者可在參與研究的過程中刪除劑量,包含出於排定空閒或其他個人原因視需要刪除劑量,但不能刪除連續2個以上劑量。fpa008的循環2第1天輸注僅可在完成28天dlt窗之後施用。所有後續輸注皆可使用±3天窗口施用。患者不應在7天內接受2個fpa008劑量。每一循環的第一劑量可視為每一循環的第1天,除非存在治療延遲,否則每28天一次重複循環。患者可在後續循環的第1天具有治療延遲,只要第1天治療在最後治療的6周內。若患者的ck升高>5×uln但<10×uln,則基於伴隨體徵、症狀及其他實驗室發現的研究者評估(表3),下一排定研究治療可自最後施用治療劑量延遲最長28天。在alt或ast升高的情形下:●在任一時間下,若alt或ast升高>3×uln且伴有總膽紅素升高>2×uln,則應維持fpa008,且患者應退出安全性隨訪。●若alt或ast升高>3×uln但<5×uln且膽紅素不>2×uln,則應在下一排定訪視時重複測試,且若alt或ast持續較高但仍<5×uln,則劑量可延遲最多28天。2個連續劑量之間的最小間隔不能小於7天。●若患者的alt或ast升高>5×uln但<8×uln,則基於伴隨體徵、症狀及其他實驗室發現的研究者評估,下一排定研究治療可自最後施用治療劑量延遲最長28天。●若患者經歷歸因於研究治療的3級或更高alt或ast不良事件或alt或ast升高>8×uln(不論何種原因),則應中斷研究藥物且患者應退出研究治療。對於alt或ast升高>3×uln且伴有總膽紅素升高>2×uln的患者而言,也應自治療退出。在ck升高的情形下:●因ck升高>10×uln,應中斷治療表3:除alt、ast和ck外的研究藥物相關事件的劑量延遲及修改指南注意:表3適用於除上述alt、ast及ck規則外的不良事件。若出於不良事件降低患者劑量,則可在ae消退之後且在與發起人討論且由其批准之後劑量遞增至最初指定的劑量。ae復發至大於2級將使得持續減少劑量且不會再遞增。5.3.5.研究藥物輸注期間的劑量中斷若在輸注期間發生任何≥3級的ae,則必須停止fpa008輸注。若在輸注期間患者發生支氣管痙攣或呼吸困難,則應停止輸注。另外,在研究者的判斷下,若在輸注期間發生較不嚴重ae(1級或2),則可減少輸注速率或停止輸注。若3級或更小嚴重程度的ae在6小時內消退,則可以先前速率的一半重新開始輸注。若相同ae以相同嚴重程度在重新開始的輸注期間於任何時間再次出現,則應中斷輸注,且未經發起人(或指派者)商討即不能進一步給藥研究藥物。若患者經歷輸注反應,則應在輸注期間監測患者的生命體徵(溫度、血壓、脈搏及呼吸速率),且在輸注之後經最少1小時的每30分鐘一次進行監測且直至輸注反應消退為止。應在醫師的直接監督下且根據有效治療方案在研究場所處管控全身性過敏性響應。然而,在不存在此種方案的情況下,應使用附錄6中所提供的標準化治療方案。5.4.盲化及破盲盲化及破盲是不適用的,這是由於這是開放標記研究。5.5.藥物責任研究者或適當合格人員負責維持整個研究中的精確研究藥物責任記錄。研究者負責將所有未使用研究藥物返回發起人(或指派者),且必須確認研究者不擁有所剩餘的供應用品。在發起人(或指派者)已批准記載破壞程序後,允許研究場所根據站點政策破壞已使用或部分使用的研究藥物小瓶。應在研究期間及在完成研究時通過使用藥物庫存日誌核查及記錄在研究場所接收、自研究場所分配、返回研究場所及由研究場所處理的所有研究藥物的精確記錄。5.6.研究產品依從性僅合格受訓位點人員可施用fpa008。在研究需求中受訓的醫藥人員將監測與治療分配的依從性。經大約30分鐘經由周邊靜脈或中央靜脈導管由受訓醫護專業人員輸注fpa008。在患者的電子病例報告表(ecrf)中記錄所施用研究藥劑的記錄(日期、開始及停止時間及相對於製備時間施用的劑量)。5.7.伴隨藥物及治療在ecrf上獲得所有伴隨藥物(包含草本及其他非傳統治療劑)。收集下列參數:通用名、施用途徑、開始日期、停止日期、劑量、頻率及適應症。伴隨藥物的劑量或方案的任何變化也必須記錄於ecrf中。在篩選時,詢問患者其在前28天期間服用何種藥劑。在每一後續研究訪視時,詢問患者伴隨藥物自先前訪視的任何變化。在整個研究中,研究者可開出視為提供適當支持性護理所需的任何伴隨藥物或治療的處方,下列情形除外:●其他實驗藥物或裝置●其他用於治療pvns的全身性藥劑,例如伊馬替尼或尼羅替尼●慢性每日皮質類固醇≥10mg/kg普賴松(或等效物)若患者使用禁止藥劑或經歷腫瘤切除術,則發起人應商討決定患者是否應退出研究。患者可根據標準臨床實踐指示開始或繼續疼痛藥劑。視需要允許轉輸。對於初始fpa008劑量而言,不施用常規術前用藥。若患者發生噁心、嘔吐或其他輸注相關ae,則患者可在隨後輸注fpa008之前在研究者判斷下預先考慮止吐藥、類固醇或抗組織胺。根據機構標準方法施用治療,且應提供於患者ecrf上。6.評估參數及方法通過監測ae及體檢(包括體重)、生命體徵、12導聯ecg、疾病相關體徵及症狀及臨床實驗室測量的變化來評估fpa008的安全性。評估血樣的免疫原性。6.1.腫瘤響應參數在篩選時(在第一劑量之前28天內)、在開始治療後4、8及16周實施mri(附錄1)。在計劃再成像時,mri應在劑量施用1周內完成。除非已在前6周內實施腫瘤評估或先前已測得腫瘤進展,否則所有患者均應在30天(±7天)及90天(±7天)治療結束時隨訪訪視中進行腫瘤響應參數評估。在篩選時、c1d15(給藥前)、c2d1(給藥前)且然後在24周中的所有後續循環的第1天(給藥前)或直至治療中斷為止進行健康結果(功能、症狀)的臨床評估。每14(±2)周追蹤在治療結束時隨訪期之後尚未進展的患者(參見7.2.10部分)直至進展為止,在c1d1後,患者經受局部療法(例如切除術、放射)或開始新全身性療法最長52周。使用recist1.1(eisenhauer,2009)及總體積評分(tap,2014)評估放射學可測量疾病的響應。使用mri進行腫瘤的放射學測量。彌散性pvns的線性測量並發有諸多因素。因腫瘤在特徵上是非晶形且其形狀可有所變化,故連續線性測量與腫瘤體積變化的關聯取決於實施測量的位置。然而,在某些位置中腫瘤與毗鄰組織之間的較差對比性限制了可精確進行此類測量的位置。另外,線性測量對於連續獲取影像上的區段平面變化高度敏感。然而,考慮到recist在腫瘤學臨床試驗中的長久慣例,根據recist1.1指南,在此研究中使用每一關節或腱鞘中最多兩個可測量腫瘤位置的線性測量作為參考。也通過tvs評估放射學響應。tvs已用於顯示csf1r酪氨酸激酶抑制劑的治療效應的最新pvns研究中。據信,pvns的臨床影響主要源自由受限關節及關節周間隙內的腫瘤生長引起的質量效應及局部結構損害。腫瘤生長幹擾關節彎曲且也可破壞關節的結構及功能完整性,這是由於腫瘤會侵襲局部骨及軟組織。pvns臨床試驗中的成像目標由此在於監測腫瘤體積變化且監測對局部組織的任何相關損害。彌散性pvns的體積量化並發有腫瘤的不規則形狀、腫瘤與其周圍結構之間的異質性對比及通過基於釓的靜脈內造影劑所觀察到的可變增強。腫瘤因此難以在某些位置中描繪,從而使得自動化分段不可靠且人工分段較為主觀。血鐵黃素沉積通常不顯著改進對比性,這是由於血鐵黃素的分布可變、異質且不總是局限於腫瘤。另外,可能難以辨別活腫瘤與惰性瘢痕組織或病灶內及病灶周的流體收集物。在此類情況下,使用半定量順序量表的目測評分通常比體積量化更為可靠,如曾經在關節炎臨床試驗中使用滑膜增厚評估的經驗所述。採用mri來評估關節炎的抗炎症性療法的試驗基於半定量評分。tvs量表是基於最大膨脹滑膜腔(其在關節之間有所變化)或最大膨脹腱鞘(假設為所涉及腱的直徑的三倍)的估計體積的10%增量。因此,等於最大膨脹滑膜腔或腱鞘的體積的腫瘤評分為10,而為該體積的70%的腫瘤評分為7,且兩倍於該體積的腫瘤評分為20。根據下列標準來分類tvs的個體患者結果:●完全響應(cr):病灶完全消失●部分響應(pr):體積評分相對於基線降低≥50%●疾病進展(pd):體積相對於研究期間(不論在基線時或在某一其他訪視時)的最低評分的增加≥30%●疾病穩定(sd):不滿足基於研究期間的評分的任一先前標準。注意:在篩選期間無需重複實施為fpa008的第一劑量28天(4周)內的患者標準護理的一部分的腫瘤評估。6.2.安全性參數6.2.1.實驗室參數在每一研究場所實驗室藉助其確立方法來局部實施實驗室評估。在開始研究之前,研究者向發起人(和/或指派者)提供測量的正常範圍及單位的列表。應使用標準靜脈穿刺技術獲取血樣。根據評估計劃表(附錄1)來測定下列實驗室參數(表5):表5:實驗室評估引起患者治療管控變化(例如劑量延遲、需要其他藥劑或監測)的異常實驗室結果出於此研究的目的可視為臨床顯著且記錄於ecrf的ae頁中。滿足sae標準的值必須報告為sae。記載研究者對於ae與藥物療法的關係的確定及所採取的對策並描述於ecrf中。6.2.2.生命體徵生命體徵包含坐位血壓、脈搏、呼吸速率及溫度。在患者已休息至少5分鐘之後獲得所有生命體徵。根據評估計劃表(附錄1)來分析生命體徵。6.2.3.心電圖根據評估計劃表(附錄1)來實施12導聯ecg。研究者必須評審ecg,在源文件中記載此評審,且將在研究期間發生的任何臨床顯著變化作為ae記錄於ecrf中。6.2.4.懷孕懷孕是排除標準且育齡女性必須不能考慮在研究期間懷孕。在使用fpa008治療的第一給藥之前小於5天必須具有陰性血清孕檢。在研究期間及在最後治療之後6個月,可能生殖的患者(男性及女性)必須實施2種有效避孕方法(4.2部分)。。6.2.5.體檢根據評估計劃表(附錄1)來實施體檢。在篩選時實施包含身高及體重的完全體檢。應根據事件計劃表(附錄1)來實施完整體檢。6.2.6.免疫原性通過測量來自所有患者的總抗fpa008抗體來評估免疫原性(定義為對fpa008的免疫響應)。免疫原性測試包括篩選、證實及滴定。在附錄2中所設計的時間點處自每一患者抽取用於免疫原性評估的樣品。根據實驗室手冊中所提供的說明收集用於免疫原性測試的樣品且進行處理。6.2.7.ecog體能狀態在篩選時、在給藥之前72小時內及在整個治療結束時隨訪期中評估ecog體能狀態(附錄1)。6.3.藥代動力學參數在此研究中,如附錄2中概述收集用於測定血清fpa008的樣品。取樣將容許測定暴露(auc)、cmax、cmin(谷值濃度)、cl及vss。在數據容許時,也可計算其他pk參數(例如累積比率及半衰期)。根據單獨實驗室手冊中所提供的說明收集此類樣品且進行處理。6.4.藥效學參數評估下列探索性終點(附錄2):●血清:csf1及il34配體濃度、ctx及trap5b骨吸收標誌物濃度●全血-cd14+/cd16+單核細胞子集濃度下列程序(參見附錄1)僅適用於籤署適用可選研究知情同意書的患者;此類程序的目的在於理解fpa008對於炎症(滑膜及滑液)中局部生物標誌物的變化及fpa008在所涉及關節滑液)中的分布的影響:●滑膜(可選)-在預處理時,評估滑膜活檢組織的csf1基因轉座(若先前未進行)-針對以下的基線及治療滑膜活檢ihc:■csf1及csf1r■cd68●滑液(可選)-fpa008濃度;上述標記物的細胞組分(通過ihc)。6.5.患者及臨床醫師報告結果測量在篩選時、c1d15(給藥前)、c2d1(給藥前)且然後在24周中的所有後續循環的第1天(給藥前)或直至治療中斷為止且在整個治療結束時隨訪期中進行健康結果(功能、症狀)的臨床評估。尚未進展且進入長期隨訪的患者擬每14周(±2)周一次進行追蹤直至進展為止,在c1d1後,患者經受局部療法(例如切除術、放射)或開始新全身性療法最長52周。使用下列工具收集關於症狀及功能結果在探索性終點數據:●ogilvie-harris(oh)量表(附錄4):此工具是針對pvns患者特定研發的(ogilvie-harris,1992)且已用於其他pvns公開案(deponti,2003;rhee,2010)中。此工具的特徵包括如下:-其是臨床醫師報告的結果(cro)測量-其是基於用於4個區域的每一個的0-3間隔量表:■疼痛■滑膜炎/滲出■活動範圍■功能能力-其使用指示嚴重失能、疼痛及功能損失在量表下限(評分min=0)及指示無失能的較高值(評分max=12)。可將評分求和並分類如下:■較差病狀(0-3點)■普通病狀(4-6點)■良好病狀(7-9點)■優良病狀(10-12點)-相對於其他位置特異性結果測量(例如womac、koos等)而選擇用於此研究,這是由於:■其可用於受pvns影響的任何關節中■其是通過解決pvns的症狀(疼痛及滑膜炎/滲出)而對pvns疾病具有特異性■其具有低響應性負擔-4個「問題」-然而,其僅公開於膝pvns患者中且尚未針對金標準結果測量(例如sf-36或eq-5d-5l量表)進行驗證。因此,eq-5d-5l量表(患者報告結果)也用於此研究中。●eq-5d-5l(附錄5):這是健康狀態的熟知的一般測量,其最初公開於2001年(rabin)且包括如下特徵:-已用於多個國家的許多疾病及慢性病狀中-是患者報告結果(pro)測量-用作活動性pvns臨床試驗中的功能評估(mcs110,novartis)-是基於用於5個範圍的每一個的0-5間隔量表,其中量表下限(評分min=0)指示死亡(或較死亡更糟)健康狀態且較高值(評分max=100)指示完美健康狀態:■(1)運動性■(2)自我護理■(3)慣常活動■(4)疼痛/不適■(5)焦慮/抑鬱症-其也使用vas以20-cm垂直線來測量響應者當前健康,其中0=「最差可能的健康」且100=「最佳靠想像健康」-其已在多個國家進行驗證且可用於119種語言。其具有僅有6個問題的低響應性負擔且可用於若干媒介(紙、網絡及小傳單)中。7.研究實施7.1.患者評估的概述在最長28天(4周)的初始篩選時段之後,使用fpa008以28天循環每2周(±3天)一次治療患者,且經大約30分鐘施用fpa008。評估的所有時間點都應在所陳述的時間範圍中完成。在患者籤署知情同意書之前實施的評估僅在證實是標準護理情況下方可接受。詳述患者評估的計劃表顯示於附錄1及附錄2中。關於pk、pd及免疫原性數據的取樣及處理的說明描述於單獨方案特異性實驗室手冊中。7.2.通過訪視進行的研究評估及程序7.2.1.篩選時段(第-28天至第0天)完全同意參與研究的患者將在施用fpa008的第一輸注之前28天(4周)內經受篩選評估(除非另有說明)。為測定患者是否滿足所有納入標準且不違背排除標準,實施下列程序(附錄1):●必須在任何研究特異性程序之前收集所籤署書面知情同意書●完整醫學及疾病歷史●人口統計學及基線特性●生命體徵(在休息5分鐘之後的坐位血壓、脈搏、呼吸速率及溫度[℃])●完總體檢,包含身高及體重●ecog體能狀態評估●12導聯ecg(在篩選時需要,且若在研究期間臨床指示)●若適用,則報告ae●先前及並行藥劑的文件●quantiferon測試(用於潛伏性tb)●臨床安全性實驗室分析,如表5中所概述(包含ana)●ogilvie-harris及eq-5d-5l評估●任選的存檔組織●任選的滑膜活檢組織●任選的滑液抽吸液●育齡女性在循環1第1天之前≤5天的血清孕檢(β-人絨毛膜促性腺激素[β-hcg])●放射學成像:在fpa008的第一輸注之前28天內實施所涉及關節的mri。若在第一研究輸注28天內將mri實施是患者標準護理的一部分,則在提供結果記載且適於評估時,其無需重複。注意:在開始研究治療之前,必須將方案特異性患者登記表呈遞至發起人(或指派者)以證實患者合格性。7.2.2.治療配置(給藥分配)這是一項開放標記研究。將招募數量傳真或電郵至研究者(或指派者)。發起人(或指派者)會保留特定群組內治療的患者數的記錄且將決定向哪一治療群組分配新招募的患者。7.2.3.1及2期:循環1,第1天實施下列程序:●在fpa008輸注之前(≤72小時內,除非另有說明):-驗證合格性-更新醫學及疾病歷史以獲取來自篩選的任一變化-若適用,則報告ae-評審伴隨藥物-記錄體重-生命體徵(在休息5分鐘之後的坐位血壓、脈搏、呼吸速率及溫度[℃])-ecog體能狀態評估-臨床安全性實驗室分析(除尿分析及ana外),如表5中所概述-僅對於育齡女性而言,在fpa008的第一劑量之前≤5天實施血清β-hcg(通過地方實驗室評估)-pk、ada、血清生物標誌物及cd14+/cd16+單核細胞樣品收集(在≤4小時內),如附錄2中所概述。●研究藥物施用:通過靜脈內輸注經大約30分鐘施用fpa008●在施用fpa008後:-pk、血清生物標誌物及cd14+/cd16+單核細胞樣品收集(±5min),如附錄2中所概述。-在完成靜脈內輸注之後的下列時間點的給藥後生命體徵(在休息5分鐘之後的坐位心率、血壓、呼吸速率及溫度[℃]):○5分鐘、15分鐘、30分鐘及1小時-若適用,則報告ae-評審伴隨藥物7.2.4.1及2期:循環1,第2天pk、血清生物標誌物及cd14+/cd16+單核細胞樣品收集,如附錄2中所概述。若適用,則報告ae評審伴隨藥物7.2.5.1及2期:循環1,第8天研究患者將在第8天(±2天)返回研究中心。不施用治療。完成下列評估:●生命體徵(在休息5分鐘之後的坐位血壓、脈搏、呼吸速率及溫度[℃])●臨床安全性實驗室分析(除ana外),如表5中所概述●pk、血清生物標誌物、cd14+/cd16+單核細胞樣品收集,如附錄2中所概述。●若適用,則報告ae●評審伴隨藥物7.2.6.1及2期:循環1,第15天研究患者將在第15天返回研究中心,且完成下列評估。●在fpa008輸注之前(≤72小時內,除非另有說明):-記錄體重-生命體徵(在休息5分鐘之後的坐位血壓、心率、呼吸速率及溫度[℃])-臨床安全性實驗室分析(除尿分析及ana外),如表5中所概述-ogilvie-harris及eq-5d-5l評估-pk、ada、血清生物標誌物及cd14+/cd16+單核細胞樣品收集(在≤4小時內),如附錄2中所概述-更新醫學及疾病歷史-若適用,則報告ae-評審伴隨藥物●研究藥物施用:通過靜脈內輸注經30分鐘施用fpa008●在施用fpa008後:-在輸注結束之後15分鐘(±5min)收集pk樣品(如附錄2中所概述)-在完成靜脈內輸注之後的下列時間點的給藥後生命體徵(在休息5分鐘之後的坐位心率、血壓、呼吸速率及溫度[℃]):○5分鐘、15分鐘、30分鐘及1小時-12導聯ecg(在pk/pd樣品收集之後於給藥後大約30分鐘內)-若適用,則報告ae-評審伴隨藥物7.2.7.1期:循環1的結束對於1期患者而言,若在循環1結束時研究者測得患者可受益於繼續給藥fpa008,則可進入延長治療期。若患者繼續進行延長治療期(循環2及更多循環),則進行7.2.8部分中所概述的程序。若患者沒有資格接受fpa008的其他劑量,則患者返回診療所進行治療結束時隨訪訪視。7.2.8.1期延長治療/2期循環2及後續循環1期延長治療可開始於循環2第1天。若患者經歷疾病進展或不可接受毒性,則中斷給藥。在每一輸注訪視時,患者在每次施用fpa008之後逗留於研究場所處直至完成用於安全性監測的所有給藥後評估為止。除非另有說明,否則在每一訪視時實施下列評估((附錄1):7.2.8.1.1及2期:循環2及後續循環,第1天在研究藥物的每一輸注之前(≤72小時內,除非另有說明):-生命體徵(在休息5分鐘之後的坐位心率、血壓、呼吸速率及溫度[℃])-完總體檢,包含循環2、4及6中的重量-ecog體能狀態評估-ogilvie-harris及eq-5d-5l評估-臨床安全性實驗室分析(除尿分析及ana外),如表5中所概述-在循環2、3及5的第1天的pk、ada、血清生物標誌物及cd14+/cd16+單核細胞樣品收集(在≤4小時內),如附錄2中所概述。-在c2d1、c3d1及c5d1的1周內使用用於用於評估基線腫瘤測量的相同物理或放射學參數對所涉及關節實施mri-在劑量施用之前最多-2天的任選的滑膜活檢(僅循環2),如附錄1中所概述-在劑量施用之前最多-2天的任選的滑液抽吸液(僅循環2),如附錄1中所概述-若適用,則報告ae-評審伴隨藥物研究藥物施用:通過靜脈內輸注經大約30分鐘施用fpa008在研究藥物施用後:-在完成靜脈內輸注之後的下列時間點的給藥後生命體徵(在休息5分鐘之後的坐位心率、血壓、呼吸速率及溫度[℃]):-5分鐘、15分鐘、30分鐘及1小時-在循環3及5第1天於輸注結束之後15分鐘(±5min)收集pk樣品(附錄1)。-若適用,則報告ae-評審伴隨藥物7.2.8.2.1及2期:循環2及後續循環,第15天在研究藥物的每一輸注之前(≤72小時內,除非另有說明):-生命體徵(在休息5分鐘之後的坐位心率、血壓、呼吸速率及溫度[℃])-臨床安全性實驗室分析(除尿分析及ana外),如表5中所概述-若適用,則報告ae-評審伴隨藥物研究藥物施用:-通過靜脈內輸注經大約30分鐘施用fpa008在研究藥物施用後:-在完成靜脈內輸注之後的下列時間點的給藥後生命體徵(在休息5分鐘之後的坐位心率、血壓、呼吸速率及溫度[℃]):○5分鐘、15分鐘、30分鐘及1小時-12導聯ecg(在pk/pd樣品收集之後於給藥後大約30分鐘內)-若適用,則報告ae-評審伴隨藥物7.2.9.治療結束時隨訪期在fpa008的最後輸注之後大約30天(±7天)、60天(±7天)及90天(±7天),患者將返回研究中心三次以完成治療結束時隨訪期。實施下列評估:●生命體徵(在休息5分鐘之後的坐位脈搏、血壓、呼吸速率及溫度[℃])●僅在30天(±7天)治療結束時隨訪訪視中的12導聯ecg●僅在30天(±7天)治療結束時隨訪訪視中進行完總體檢。在所有訪視下均記錄體重●ecog體能狀態評估●臨床安全性實驗室分析,如表5中所概述(包含僅在30天(±7天)治療結束時隨訪訪視中的ana)●pk、ada、血清生物標誌物及cd14+/cd16+單核細胞樣品收集,如附錄2中所概述●育齡女性中的血清β-hcg(通過地方實驗室評估)●在30天(±7天)及90天(±7天)治療結束時隨訪訪視中的所涉及關節的mri、ogilvie-harris及eq-5d-5l評估。若在前6周內實施或若先前已測得腫瘤進展,則可刪除這些。)每14(±2)周追蹤在治療中斷時尚未進展且同意繼續參與研究的患者直至進展為止,在c1d1後,患者經受局部療法(例如切除術、放射)或開始新全身性療法最長52周。●若適用,則報告ae●評審伴隨藥物7.2.10.長期隨訪期尚未進展的患者應在完成治療結束時隨訪期之後繼續進行長期隨訪。每14周(±2)周一次追蹤患者直至進展為止,在c1d1後,患者經受局部療法(例如切除術、放射)或開始新全身性療法最長52周。實施下列評估:●臨床安全性實驗室分析,除尿分析及ana外●pk、ada、血清生物標誌物及cd14+/cd16+單核細胞樣品收集,如附錄2中所概述●所涉及關節的mri、ogilvie-harris及eq-5d-5l評估●若適用,則進行用於視為與研究治療相關的進行性不良事件的ae報告●報告伴隨藥物(局部療法(例如切除術、放射)或僅新全身性療法)8.統計學方法在資料庫鎖定之前,完成單獨統計學分析計劃(sap),從而提供用於下文時概述分析的詳細方法。描述與計劃分析的任何偏離且在最終總體研究報告中加以證實。8.1.研究患者8.1.1.患者概況呈現可評估dlt、安全性、功效、pk及pd的患者的數量及百分比。還匯總了退出原因。8.1.2.方案偏差提供具有方案偏差的患者的數量及百分比的匯總(根據偏差類型)。在資料庫鎖定之前,在sap中定義偏差。8.1.3.分析群體定義下列分析群體以用於研究:●安全性群體-所有已接受fpa008的至少一個劑量中的任一部分的患者。●dlt可評估群體-所有招募至研究的1期中且接受至少2個fpa008劑量並完成治療的循環1的患者,或在循環1中經歷dlt的那些。●pk可評估群體-所有接受至少一個fpa008劑量且具有適用於測定pk特徵的pk評估的患者。●功效可評估群體-所有滿足合格性標準、接受至少1個fpa008劑量、在基線下具有可測量腫瘤病灶且具有至少1個基線後疾病評估的患者。●治療意向群體(itt)-所有招募的患者。無基線後疾病評估的患者將視為非響應者。8.2.一般考慮所有分析都是描述性的且在適當時按劑量組及總體呈現。將來自2期的患者數據匯總為單獨組。還匯總了所有以rd給藥的患者。使用匯總表及患者數據列表呈現此研究中所收集的數據。使用描述性統計學(具體而言有效例數、算術平均值、中值、標準偏差(sd)、最小值及最大值)來匯總連續變量。按照頻率及百分比來匯總類別變量。方案中所描述數據分析方法的變化僅在改變方案主要特徵時需要修正方案。在資料庫鎖定之前完成sap。描述最終sap中所描述方法的任何變化且在臨床研究報告中予以證實。8.3.人口統計學、基線特性及伴隨藥物按照群組及總體匯總人口統計學數據、病歷、其他基線特性、伴隨疾病及伴隨藥物。為測定是否滿足研究實施標準,提供相應表格及列表。此類表格及列表包含方案偏差評估、研究藥物責任及其他可影響研究的一般實施的數據。8.4.治療依從性按群組匯總治療施用,包含劑量施用、劑量修改或延遲、累積劑量、平均劑量、輸注數量及療法持續時間。8.5.腫瘤響應分析根據最佳總體腫瘤響應(完全響應[cr]、部分響應[pr]、疾病穩定[sd]或疾病進展[pd])來對患者進行分類。計算(在適當時)按照最佳總體腫瘤響應分級的患者的頻率、比例及精確95%ci。將具有cr或pr的最佳總體腫瘤響應且持續時間為至少4周(28天)的患者進一步分類為具有客觀腫瘤響應。呈現具有目標腫瘤響應的患者的列表。通過recist1.1及總體體積評分對患者響應進行分類。腫瘤體積評分根據下列定義來分類響應:完全響應[(cr)病灶在研究結束時完全失去]、部分響應[(pr)體積評分相對於基線的降低≥50%]、疾病進展[(pd)體積相對於研究期間(不論在基線時或在某一其他訪視時)的最低評分的增加≥30%]或疾病穩定[(sd)不滿足基於研究期間的評分的任一先前標準]。除局部評審外,總體評審所有mri掃描,且測定腫瘤響應的局部評估及總體評估之間的同一性。響應持續時間計算為自總體響應(cr或pr)的第一記載至疾病進展或死亡(以先出現者為準)的第一記載的天數。在最後腫瘤響應評估時檢查在數據分析時存活且無進展的患者。在適當響應以便決定切除剩餘疾病的患者中,在手術程序時檢查響應持續時間。8.6.安全性分析在研究的兩個階段內並針對所組合的所有患者單獨實施安全性分析。在安全性分析中包含來自所有接受至少1個fpa008劑量的任一部分的患者的數據。將ae、臨床實驗室信息、生命體徵、ecog體能狀態、體重、ecg及伴隨藥物/程序制表並匯總。總體匯總ae且單獨匯總嚴重ae、引起中斷的ae、引起死亡的ae及ncictcae4.03版3級或更高級ae。描述性地匯總了體重及生命體徵(n、平均值、標準偏差、中值、最小值及最大值)。以分類方式及描述方式匯總了ecog體能狀態。對於群組及總體的實驗室數據,提供顯示按照治療的基線等級及最大等級分類的患者計數及百分比的轉換表。顯著實驗室變化定義為在治療中自基線0級轉移至3級(非血液學)或4級(血液學)或在治療中自基線1級轉移至4級。按照群組及總體對具有顯著實驗室變化的患者的數量及百分比進行制表。8.7.功效分析功效分析是描述性的。使用頻率及百分比匯總總體響應率。使用描述性統計學(n、算術平均值、標準偏差、中值、最小值及最大值)以及以範疇方式匯總cr及pr患者的響應持續時間。使用recist1.1測定響應及響應持續時間。使用kaplan-meier方法匯總響應及pfs的持續時間。8.8.藥代動力學分析將個別及平均(±sd)血清fpa008濃度-時間數據制表且按照劑量水平繪圖。自血清藥物濃度-時間數據使用非分室分析(nca)方法利用phoenixwinnonlin(certaralp,st.louis,mo)中的靜脈內輸注輸入來計算fpa008pk參數。可考慮替代方法。對估計的個別及平均(±sd)pk參數進行制表且按照劑量水平匯總。可針對血清fpa008濃度-時間數據及估計pk參數報告其他描述性統計。在可能時,評估劑量均衡、藥物累積及穩態達成。評估免疫原性對fpa008暴露的影響。8.9.中期分析未計劃正式的中期分析。以常規方式由發起人及cro評審安全性數據。在1期中,發起人(和/或指派者)及研究者在劑量遞增或遞減之前評審來自每一劑量群組的安全性數據。在可用時,將來自延長治療期的不良事件數據呈現至醫學監測器。8.10.樣本量的測定通常接受每個劑量樣本量組三名患者且在dlt情形下將樣本量增加至6作為適於測定遞增劑量的新穎腫瘤學藥物的安全性。若在3名患者中的1名中觀察到dlt,則在相同劑量水平下再招募3名患者。劑量遞增持續至在一定劑量水平下治療的3-6名患者中的2名經歷dlt。mtd定義為<33%的患者在循環1期間經歷dlt的最大劑量。在測得mtd之後,可在該劑量水平下募集其他患者以進一步表徵fpa008的安全性、pk、pd及初步功效。預計可在1期中招募12-15名患者。出於估計pvns/dt-tgct患者中的fpa008的orr的目標,估計在2期中招募大約30名患者。另外,總共在rd下招募大約33至36名患者。下表6顯示相應95%ci及各個樣本量及所觀察響應率的精確度(agresti,1998)。表6:響應者的概率參考文獻agrestia,coullb.approximateisbetterthan「exact」forintervalestimationofbinomialproportions.jamstatassoc,1998;52:119-26.bartoccia,mastrogiannisd,miglioratig,stockertr,wolkoffa,stanleye.macrophagesspecificallyregulatetheconcentrationoftheirowngrowthfactorinthecirculation.procnatlacadsci,1987;84:6179-6183.cassierp,gelderblomh,stacchiottis,thomasd,makir,kroepj,等efficacyofimatinibmesylateforthetreatmentoflocallyadvancedand/ormetastatictenosynovialgiantcelltumor/pigmentedvillonodularsynovitis.cancer,2012;118;1649-55.cassierp,gomez-rocac,italianoa,cannarilem,riesc,brilloueta,等phase1studyofrg7155,anovelanti-csf1rantibody,inpatientswithlocallyadvancedpigmentedvillonodularsynovitis(pvns).jclinoncolsuppl,2014;32:5摘要10504.daled,boxerl,lilesw.thephagocytes:neutrophilsandmonocytes.blood,2008;112(4):935-45.depontia,sansonev,malcherèm.resultofarthroscopictreatmentofpigmentedvillonodularsynovitisoftheknee.arthroscopy,2003;6:602-7.eisenhauere,therassep,bogaertsj,schwartzl,sargentd,fordr,等newresponseevaluationcriteriainsolidtumours:revisedrecistguideline(1.1版).eurjcancer,2009;45:228-247.greterm,leliosi,pelczarp,hoeffelg,pricej,leboeufm,等stroma-derivedinterleukin34controlsthedevelopmentandmaintenanceoflangerhanscellsandthemaintenanceofmicroglia.immunity,2012;37:1050-1060.hamiltonj,achuthana.colonystimulatingfactorsandmyeloidcellbiologyinhealthanddisease.trendsinimmunology,2013;34:81-89.herdmanm,gudexc,lloyda,janssenm,kindp,parkind,等developmentandpreliminarytestingofthenewfive-levelversionofeq-5d(eq-5d-5l).qualliferes,2011;20:1727-36.ogilvie-harrisd,mcleanj,zarnettm.pigmentedvillonodularsynovitisoftheknee.theresultsoftotalarthroscopicsynovectomy,partialarthroscopicsynovectomy,andarthroscopiclocalexcision.jbonejointsurgam,1992;74:119-123.rabinr,decharrof.eq-5d:ameasureofhealthstatusoftheeuroqolgroup.annmed,2001;33:337-343.radiz,guzmanr,bellr.increasedconnectivetissueextracellularmatrixintheop/opmodelofosteopetrosis.pathobiology,2009;76:199-203radiz,koza-taylorp,bellr,obertl,runnelsh,beebej,等increasedserumenzymelevelsassociatedwithkupffercellreductionwithnosignsofhepaticorskeletalmuscleinjury.amjpathol,2011;179:240-47.raviv,wangw-l,lewis,v.treatmentoftenosynovialgiantcelltumorandpigmentedvillonodularsynovitis.curropinoncol,2011;23:361-6.rheepc,sassoonaa,sayeedsa,stuartms,dahmdl.arthroscopictreatmentoflocalizedpigmentedvillonodularsynovitis:long-termfunctionalresults.amjorthop2010sep;39(9):e90-4.riesc,cannarilem,hovess,benzj,warthak,runzav,等targetingtumor-associatedmacrophageswithanti-csf-1rantibodyrevealsastrategyforcancertherapy.cancercell,2014;25:846-59.tapwd,anthonysp,chmielowskib等apilotstudyofplx3397,aselectivecolony-stimulatingfactor1receptor(csf1r)kinaseinhibitor,inpigmentedvillonodularsynovitis(pvns).jclinoncol2014;32:5s(suppl;abstr10503).wangy,szretterk,vermiw,gilfillans,rossinic,cellam,等il-34isatissue-restrictedligandofcsf1rrequiredforthedevelopmentoflangerhanscellsandmicroglia.natimmunol,2012;13:753-762.westr,rubinb,millerm,subramanians,kaygusuzg,montgomeryk,等alandscapeeffectintenosynovialgiant-celltumorfromactivationofcsf1expressionbyatranslocationinaminorityoftumorcells.procnatlacadsciusa,2006;103:690-5.yoshidah,hayashis,kunisadat,ogawam,nishikawas,okamurah,等themurinemutationosteopetrosisisinthecodingregionofthemacrophagecolonystimulatingfactorgene.nature,1990;345:442-444.縮寫及定義表ada抗藥物抗體adcc抗體依賴性細胞介導的細胞毒性作用ae不良事件alt丙氨酸轉氨酶anc絕對嗜中性粒細胞計數anova方差分析ast天冬氨酸轉氨酶auc血清濃度-時間曲線下面積β-hcgβ-人絨毛膜促性腺激素bun血尿素氮cbc完全血計數ck肌酐激酶cmax最大血清濃度cmin最小血清濃度cl清除率co2二氧化碳(碳酸氫鹽)cr完全響應crc群組評審委員會cro臨床醫師報告的結果cro合同研究組織csf1集落刺激因子-1ct計算機斷層掃描ctxi型膠原c-末端端肽ctcae常見不良事件術語標準dlt劑量限制性毒性dt-tgct彌散性腱鞘的巨細胞瘤ecrf電子病歷報告表ecg心電圖ecog美國東部腫瘤協作組(easterncooperativeoncologygroup)fda美國食品與藥物管理局(foodanddrugadministration)fna細針抽吸gcp優質臨床規範glp優質實驗室規範hiv人類免疫缺陷病毒ib研究者的手冊icf知情同意書ich國際協調會議(intemationalconferenceonharmonization)iec獨立倫理委員會ihc免疫組織化學ind試驗性新藥(申請)inr國際標準化比率irb機構審查委員會iv靜脈內ldh乳酸脫氫酶lvef左心室射血分數mch平均紅細胞血紅蛋白mchc平均紅細胞血紅蛋白濃度mcv平均紅細胞體積mri磁共振成像mtd最大耐受劑量nci國家癌症研究所(nationalcancerinstitute)noael未觀察到的不良作用水平ntxn-末端端肽nyha紐約心臟協會(newyorkheartassociation)orr客觀響應率pd疾病進展pd藥效學pet正電子放射成像術pfs無進展生存率pk藥代動力學pr部分響應pro患者報告的結果ps體能狀態pt凝血酶原時間ptt部分促凝血酶原激酶時間pvns色素絨毛結節性滑膜炎qtc校正的qt間隔rbc紅細胞rd推薦劑量recist實體瘤響應評估標準sae嚴重不良事件sap統計學分析計劃sd疾病穩定t1/2半衰期tb結核病trap5b抗酒石酸酸性磷酸酶5btvs腫瘤體積評分uln正常上限vss穩態分布體積wbc白細胞附錄2:用於藥代動力學、免疫原性及藥效學血樣收集的研究流程表*如果未施用fpa008,則不需要在輸注後15分鐘進行pk血液抽取。附錄3:ecog體能狀態附錄4:pvns的ogilvie-harris評分●疼痛□嚴重(0點)□中等(1點)□輕度(2點)□無(3點)●滑膜炎/滲出□嚴重(0點)□中等(1點)□輕度(2點)□無(3點)●活動範圍(*正常=150°)□>20%損失(0點)□10%-20%損失(1點)□0%-10%損失(2點)□無損失(3點)*實例:損失15°彎曲或伸展=損失10%(150-(150-15)/150)=10%●功能能力□最小活動(0點)□一些活動(1點)□大部分活動(2點)□所有活動(3點)附錄5:eq-5d-5l在每一標題處,請將最佳描述當前健康的一個框打鉤運動性我走路沒問題我走路有輕微問題我走路有中度問題我走路有嚴重問題我不能走路自我護理我洗澡和穿衣沒問題我洗澡和穿衣有輕微問題我洗澡和穿衣有中度問題我洗澡和穿衣有嚴重問題我不能洗澡和穿衣慣常活動(例如工作、研究、家庭工作、家庭或閒暇活動)我慣常活動沒問題我慣常活動有輕微問題我慣常活動有中度問題我慣常活動有嚴重問題我不能進行慣常活動疼痛/不適我沒有疼痛或不適我有輕度疼痛或不適我有中度疼痛或不適我有嚴重疼痛或不適我有極度疼痛或不適焦慮/抑鬱我沒有焦慮或抑鬱我有輕度焦慮或抑鬱我有中度焦慮或抑鬱我有嚴重焦慮或抑鬱我有極度焦慮或抑鬱●我們願意知曉今日您健康狀況有多良好或較差。●此量表編號0至100。●100意指您認為可能的最佳健康狀況。0意指您認為可能的最差健康狀況。●在量表上標記x以表示您今日健康狀況。●現在,請在下框中寫下在量表上所標記的數字。附錄6:全身性過敏性響應的管控施用研究藥物的人員需要在輸注之後前180分鐘中密切監測所有患者的可能全身性過敏性響應(例如全身性皮疹、蕁麻疹、感覺異常、支氣管縮小、心悸),尤其需要關注那些具有氣喘或對過敏原注射具有全身性響應的歷史的患者。將所有全身性過敏性表現提供於適當ecrf頁上且鑑定為是由過敏性響應所致。根據研究場所的實際治療方案來管控全身性過敏性響應。在不存在該方案的情況下,使用下列標準化治療方案:●儘快使用25mg至50mg(苯海拉明鹽酸鹽(diphenhydraminehydrochloride))經口或經靜脈內在研究者判斷下治療臨床輕度響應(例如全身性疹或搔癢、蕁麻疹)。觀察時段視需要延長至超過3小時,直至症狀及體徵已消退或穩定為止。經歷臨床輕度響應的患者可繼續施用研究藥物。●立即治療臨床中等響應(例如低血壓、呼吸短促、面部水腫)且如醫學上所指示開始支持性護理措施(例如iv流體、皮質類固醇、血管加壓藥、氧、支氣管擴張劑、苯海拉明(diphenhydramine)及對乙醯氨基酚(acetaminophen))。以10分鐘間隔監測生命體徵直至其正規化為止。觀察時段視需要延長至超過3小時,直至症狀及體徵已消退為止。在臨床中等響應的情形下,患者不應接受使用研究藥物的其他治療。●在研究者的直接監督下立即治療臨床嚴重響應(例如顯著低血壓、暈厥、嚴重支氣管縮小、舌或喉嚨腫脹、顯著血管性水腫),且如醫學上所指示開始支持性護理措施(例如iv流體、皮質類固醇、血管加壓藥、氧、支氣管擴張劑、苯海拉明及對乙醯氨基酚)。以最小10分鐘間隔監測生命體徵及系統,只要研究者認識其為確保患者安全性所需。在臨床嚴重響應的情形下,患者不應接受使用研究藥物的其他治療。此類臨床分類是出於向經歷全身性過敏性響應的患者推薦治療的目的。此類分類不用於對ecrf內全身性過敏性事件的嚴重程度進行分級。根據ncictcaev4.03中所呈現的分級系統來記載此類事件的嚴重程度。來自此試驗的初步數據顯示,使用低至1mg/kg的劑量治療的患者在根據pvns的ogilive-harris評分的一些參數中顯示臨床改善,包括:1)減少疼痛,例如自嚴重(0點)至無(3點),2)增強活動範圍,例如自損失20%以上至無損失,及3)增加功能能力,例如自能夠進行一些活動至能夠進行所有活動。使用eq-5d-5l評估也觀察到了改善治療效應,這是由於至少一些接受治療的患者在洗澡及穿衣及其他自我護理活動方面具有具有改善的能力。序列表表5提供本文所論述的一些序列。除非另有說明,否則顯示的所有多肽及抗體序列均不含前導序列。表5:序列及描述序列表戊瑞治療有限公司(fiveprimetherapeutics,inc.)用於治療pvns的抗csf1r抗體01134-0037-00pctus62/095,2972014-12-22us62/163,2512015-05-1895patentin版本3.51953prt人工序列hcsf1r(全長,無前導序列)1ileprovalilegluproservalprogluleuvalvallysprogly151015alathrvalthrleuargcysvalglyasnglyservalglutrpasp202530glyproproserprohistrpthrleutyrseraspglyserserser354045ileleuserthrasnasnalathrpheglnasnthrglythrtyrarg505560cysthrgluproglyaspproleuglyglyseralaalailehisleu65707580tyrvallysaspproalaargprotrpasnvalleualaglngluval859095valvalphegluaspglnaspalaleuleuprocysleuleuthrasp100105110provalleuglualaglyvalserleuvalargvalargglyargpro115120125leumetarghisthrasntyrserpheserprotrphisglyphethr130135140ilehisargalalyspheileglnserglnasptyrglncysserala145150155160leumetglyglyarglysvalmetserileserileargleulysval165170175glnlysvalileproglyproproalaleuthrleuvalproalaglu180185190leuvalargileargglyglualaalaglnilevalcysseralaser195200205servalaspvalasnpheaspvalpheleuglnhisasnasnthrlys210215220leualaileproglnglnseraspphehisasnasnargtyrglnlys225230235240valleuthrleuasnleuaspglnvalasppheglnhisalaglyasn245250255tyrsercysvalalaserasnvalglnglylyshisserthrsermet260265270phepheargvalvalgluseralatyrleuasnleuserserglugln275280285asnleuileglngluvalthrvalglygluglyleuasnleulysval290295300metvalglualatyrproglyleuglnglypheasntrpthrtyrleu305310315320glypropheserasphisglnprogluprolysleualaasnalathr325330335thrlysaspthrtyrarghisthrphethrleuserleuproargleu340345350lysproserglualaglyargtyrserpheleualaargasnprogly355360365glytrpargalaleuthrphegluleuthrleuargtyrproproglu370375380valservaliletrpthrpheileasnglyserglythrleuleucys385390395400alaalaserglytyrproglnproasnvalthrtrpleuglncysser405410415glyhisthraspargcysaspglualaglnvalleuglnvaltrpasp420425430aspprotyrprogluvalleuserglngluprophehislysvalthr435440445valglnserleuleuthrvalgluthrleugluhisasnglnthrtyr450455460glucysargalahisasnservalglyserglysertrpalapheile465470475480proileseralaglyalahisthrhisproproaspglupheleuphe485490495thrprovalvalvalalacysmetserilemetalaleuleuleuleu500505510leuleuleuleuleuleutyrlystyrlysglnlysprolystyrgln515520525valargtrplysileileglusertyrgluglyasnsertyrthrphe530535540ileaspprothrglnleuprotyrasnglulystrpglupheproarg545550555560asnasnleuglnpheglylysthrleuglyalaglyalapheglylys565570575valvalglualathralapheglyleuglylysgluaspalavalleu580585590lysvalalavallysmetleulysserthralahisalaaspglulys595600605glualaleumetsergluleulysilemetserhisleuglyglnhis610615620gluasnilevalasnleuleuglyalacysthrhisglyglyproval625630635640leuvalilethrglutyrcyscystyrglyaspleuleuasnpheleu645650655argarglysalaglualametleuglyproserleuserproglygln660665670aspprogluglyglyvalasptyrlysasnilehisleuglulyslys675680685tyrvalargargaspserglypheserserglnglyvalaspthrtyr690695700valglumetargprovalserthrserserasnaspserpheserglu705710715720glnaspleuasplysgluaspglyargproleugluleuargaspleu725730735leuhispheserserglnvalalaglnglymetalapheleualaser740745750lysasncysilehisargaspvalalaalaargasnvalleuleuthr755760765asnglyhisvalalalysileglyasppheglyleualaargaspile770775780metasnaspserasntyrilevallysglyasnalaargleuproval785790795800lystrpmetalaprogluserilepheaspcysvaltyrthrvalgln805810815seraspvaltrpsertyrglyileleuleutrpgluilepheserleu820825830glyleuasnprotyrproglyileleuvalasnserlysphetyrlys835840845leuvallysaspglytyrglnmetalaglnproalaphealaprolys850855860asniletyrserilemetglnalacystrpalaleugluprothrhis865870875880argprothrpheglnglnilecysserpheleuglngluglnalagln885890895gluaspargarggluargasptyrthrasnleuproserserserarg900905910serglyglyserglysersersersergluleugluglugluserser915920925sergluhisleuthrcyscysgluglnglyaspilealaglnproleu930935940leuglnproasnasntyrglnphecys9459502972prt人misc_feature(1)..(972)hcsf1r(全長,+前導序列)2metglyproglyvalleuleuleuleuleuvalalathralatrphis151015glyglnglyileprovalilegluproservalprogluleuvalval202530lysproglyalathrvalthrleuargcysvalglyasnglyserval354045glutrpaspglyproproserprohistrpthrleutyrseraspgly505560serserserileleuserthrasnasnalathrpheglnasnthrgly65707580thrtyrargcysthrgluproglyaspproleuglyglyseralaala859095ilehisleutyrvallysaspproalaargprotrpasnvalleuala100105110glngluvalvalvalphegluaspglnaspalaleuleuprocysleu115120125leuthraspprovalleuglualaglyvalserleuvalargvalarg130135140glyargproleumetarghisthrasntyrserpheserprotrphis145150155160glyphethrilehisargalalyspheileglnserglnasptyrgln165170175cysseralaleumetglyglyarglysvalmetserileserilearg180185190leulysvalglnlysvalileproglyproproalaleuthrleuval195200205proalagluleuvalargileargglyglualaalaglnilevalcys210215220seralaserservalaspvalasnpheaspvalpheleuglnhisasn225230235240asnthrlysleualaileproglnglnseraspphehisasnasnarg245250255tyrglnlysvalleuthrleuasnleuaspglnvalasppheglnhis260265270alaglyasntyrsercysvalalaserasnvalglnglylyshisser275280285thrsermetphepheargvalvalgluseralatyrleuasnleuser290295300sergluglnasnleuileglngluvalthrvalglygluglyleuasn305310315320leulysvalmetvalglualatyrproglyleuglnglypheasntrp325330335thrtyrleuglypropheserasphisglnprogluprolysleuala340345350asnalathrthrlysaspthrtyrarghisthrphethrleuserleu355360365proargleulysproserglualaglyargtyrserpheleualaarg370375380asnproglyglytrpargalaleuthrphegluleuthrleuargtyr385390395400proprogluvalservaliletrpthrpheileasnglyserglythr405410415leuleucysalaalaserglytyrproglnproasnvalthrtrpleu420425430glncysserglyhisthraspargcysaspglualaglnvalleugln435440445valtrpaspaspprotyrprogluvalleuserglngluprophehis450455460lysvalthrvalglnserleuleuthrvalgluthrleugluhisasn465470475480glnthrtyrglucysargalahisasnservalglyserglysertrp485490495alapheileproileseralaglyalahisthrhisproproaspglu500505510pheleuphethrprovalvalvalalacysmetserilemetalaleu515520525leuleuleuleuleuleuleuleuleutyrlystyrlysglnlyspro530535540lystyrglnvalargtrplysileileglusertyrgluglyasnser545550555560tyrthrpheileaspprothrglnleuprotyrasnglulystrpglu565570575pheproargasnasnleuglnpheglylysthrleuglyalaglyala580585590pheglylysvalvalglualathralapheglyleuglylysgluasp595600605alavalleulysvalalavallysmetleulysserthralahisala610615620aspglulysglualaleumetsergluleulysilemetserhisleu625630635640glyglnhisgluasnilevalasnleuleuglyalacysthrhisgly645650655glyprovalleuvalilethrglutyrcyscystyrglyaspleuleu660665670asnpheleuargarglysalaglualametleuglyproserleuser675680685proglyglnaspprogluglyglyvalasptyrlysasnilehisleu690695700glulyslystyrvalargargaspserglypheserserglnglyval705710715720aspthrtyrvalglumetargprovalserthrserserasnaspser725730735phesergluglnaspleuasplysgluaspglyargproleugluleu740745750argaspleuleuhispheserserglnvalalaglnglymetalaphe755760765leualaserlysasncysilehisargaspvalalaalaargasnval770775780leuleuthrasnglyhisvalalalysileglyasppheglyleuala785790795800argaspilemetasnaspserasntyrilevallysglyasnalaarg805810815leuprovallystrpmetalaprogluserilepheaspcysvaltyr820825830thrvalglnseraspvaltrpsertyrglyileleuleutrpgluile835840845pheserleuglyleuasnprotyrproglyileleuvalasnserlys850855860phetyrlysleuvallysaspglytyrglnmetalaglnproalaphe865870875880alaprolysasniletyrserilemetglnalacystrpalaleuglu885890895prothrhisargprothrpheglnglnilecysserpheleuglnglu900905910glnalaglngluaspargarggluargasptyrthrasnleuproser915920925serserargserglyglyserglysersersersergluleugluglu930935940glusersersergluhisleuthrcyscysgluglnglyaspileala945950955960glnproleuleuglnproasnasntyrglnphecys965970320prt人工序列輕鏈前導序列3metgluthraspthrleuleuleutrpvalleuleuleutrpvalpro151015glyserthrgly20419prt人工序列重鏈前導序列4metalavalleuglyleuleuleucysleuvalthrpheprosercys151015valleuser5487prt人工序列hcsf1recd.5065ileprovalilegluproservalprogluleuvalvallysprogly151015alathrvalthrleuargcysvalglyasnglyservalglutrpasp202530glyproproserprohistrpthrleutyrseraspglyserserser354045ileleuserthrasnasnalathrpheglnasnthrglythrtyrarg505560cysthrgluproglyaspproleuglyglyseralaalailehisleu65707580tyrvallysaspproalaargprotrpasnvalleualaglngluval859095valvalphegluaspglnaspalaleuleuprocysleuleuthrasp100105110provalleuglualaglyvalserleuvalargvalargglyargpro115120125leumetarghisthrasntyrserpheserprotrphisglyphethr130135140ilehisargalalyspheileglnserglnasptyrglncysserala145150155160leumetglyglyarglysvalmetserileserileargleulysval165170175glnlysvalileproglyproproalaleuthrleuvalproalaglu180185190leuvalargileargglyglualaalaglnilevalcysseralaser195200205servalaspvalasnpheaspvalpheleuglnhisasnasnthrlys210215220leualaileproglnglnseraspphehisasnasnargtyrglnlys225230235240valleuthrleuasnleuaspglnvalasppheglnhisalaglyasn245250255tyrsercysvalalaserasnvalglnglylyshisserthrsermet260265270phepheargvalvalgluseralatyrleuasnleuserserglugln275280285asnleuileglngluvalthrvalglygluglyleuasnleulysval290295300metvalglualatyrproglyleuglnglypheasntrpthrtyrleu305310315320glypropheserasphisglnprogluprolysleualaasnalathr325330335thrlysaspthrtyrarghisthrphethrleuserleuproargleu340345350lysproserglualaglyargtyrserpheleualaargasnprogly355360365glytrpargalaleuthrphegluleuthrleuargtyrproproglu370375380valservaliletrpthrpheileasnglyserglythrleuleucys385390395400alaalaserglytyrproglnproasnvalthrtrpleuglncysser405410415glyhisthraspargcysaspglualaglnvalleuglnvaltrpasp420425430aspprotyrprogluvalleuserglngluprophehislysvalthr435440445valglnserleuleuthrvalgluthrleugluhisasnglnthrtyr450455460glucysargalahisasnservalglyserglysertrpalapheile465470475480proileseralaglyalahis4856719prt人工序列hcsf1recd.506-fc6ileprovalilegluproservalprogluleuvalvallysprogly151015alathrvalthrleuargcysvalglyasnglyservalglutrpasp202530glyproproserprohistrpthrleutyrseraspglyserserser354045ileleuserthrasnasnalathrpheglnasnthrglythrtyrarg505560cysthrgluproglyaspproleuglyglyseralaalailehisleu65707580tyrvallysaspproalaargprotrpasnvalleualaglngluval859095valvalphegluaspglnaspalaleuleuprocysleuleuthrasp100105110provalleuglualaglyvalserleuvalargvalargglyargpro115120125leumetarghisthrasntyrserpheserprotrphisglyphethr130135140ilehisargalalyspheileglnserglnasptyrglncysserala145150155160leumetglyglyarglysvalmetserileserileargleulysval165170175glnlysvalileproglyproproalaleuthrleuvalproalaglu180185190leuvalargileargglyglualaalaglnilevalcysseralaser195200205servalaspvalasnpheaspvalpheleuglnhisasnasnthrlys210215220leualaileproglnglnseraspphehisasnasnargtyrglnlys225230235240valleuthrleuasnleuaspglnvalasppheglnhisalaglyasn245250255tyrsercysvalalaserasnvalglnglylyshisserthrsermet260265270phepheargvalvalgluseralatyrleuasnleuserserglugln275280285asnleuileglngluvalthrvalglygluglyleuasnleulysval290295300metvalglualatyrproglyleuglnglypheasntrpthrtyrleu305310315320glypropheserasphisglnprogluprolysleualaasnalathr325330335thrlysaspthrtyrarghisthrphethrleuserleuproargleu340345350lysproserglualaglyargtyrserpheleualaargasnprogly355360365glytrpargalaleuthrphegluleuthrleuargtyrproproglu370375380valservaliletrpthrpheileasnglyserglythrleuleucys385390395400alaalaserglytyrproglnproasnvalthrtrpleuglncysser405410415glyhisthraspargcysaspglualaglnvalleuglnvaltrpasp420425430aspprotyrprogluvalleuserglngluprophehislysvalthr435440445valglnserleuleuthrvalgluthrleugluhisasnglnthrtyr450455460glucysargalahisasnservalglyserglysertrpalapheile465470475480proileseralaglyalahisgluprolysserserasplysthrhis485490495thrcysproprocysproalaprogluleuleuglyglyproserval500505510pheleupheproprolysprolysaspthrleumetileserargthr515520525progluvalthrcysvalvalvalaspvalserhisgluaspproglu530535540vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys545550555560thrlysproargglugluglntyrasnserthrtyrargvalvalser565570575valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys580585590cyslysvalserasnlysalaleuproalaproileglulysthrile595600605serlysalalysglyglnproarggluproglnvaltyrthrleupro610615620proserargaspgluleuthrlysasnglnvalserleuthrcysleu625630635640vallysglyphetyrproseraspilealavalglutrpgluserasn645650655glyglnprogluasnasntyrlysthrthrproprovalleuaspser660665670aspglyserphepheleutyrserlysleuthrvalasplysserarg675680685trpglnglnglyasnvalphesercysservalmethisglualaleu690695700hisasnhistyrthrglnlysserleuserleuserproglylys7057107157506prt人工序列cynocsf1recd(有前導序列)7metglyproglyvalleuleuleuleuleuvalvalthralatrphis151015glyglnglyileprovalilegluproserglyprogluleuvalval202530lysproglygluthrvalthrleuargcysvalglyasnglyserval354045glutrpaspglyproileserprohistrpthrleutyrseraspgly505560proserservalleuthrthrthrasnalathrpheglnasnthrarg65707580thrtyrargcysthrgluproglyaspproleuglyglyseralaala859095ilehisleutyrvallysaspproalaargprotrpasnvalleuala100105110lysgluvalvalvalphegluaspglnaspalaleuleuprocysleu115120125leuthraspprovalleuglualaglyvalserleuvalargleuarg130135140glyargproleuleuarghisthrasntyrserpheserprotrphis145150155160glyphethrilehisargalalyspheileglnglyglnasptyrgln165170175cysseralaleumetglyserarglysvalmetserileserilearg180185190leulysvalglnlysvalileproglyproproalaleuthrleuval195200205proalagluleuvalargileargglyglualaalaglnilevalcys210215220seralaserasnileaspvalasppheaspvalpheleuglnhisasn225230235240thrthrlysleualaileproglnargseraspphehisaspasnarg245250255tyrglnlysvalleuthrleuserleuglyglnvalasppheglnhis260265270alaglyasntyrsercysvalalaserasnvalglnglylyshisser275280285thrsermetphepheargvalvalgluseralatyrleuaspleuser290295300sergluglnasnleuileglngluvalthrvalglygluglyleuasn305310315320leulysvalmetvalglualatyrproglyleuglnglypheasntrp325330335thrtyrleuglypropheserasphisglnprogluprolysleuala340345350asnalathrthrlysaspthrtyrarghisthrphethrleuserleu355360365proargleulysproserglualaglyargtyrserpheleualaarg370375380asnproglyglytrpargalaleuthrphegluleuthrleuargtyr385390395400proprogluvalservaliletrpthrserileasnglyserglythr405410415leuleucysalaalaserglytyrproglnproasnvalthrtrpleu420425430glncysalaglyhisthraspargcysaspglualaglnvalleugln435440445valtrpvalaspprohisprogluvalleuserglngluprophegln450455460lysvalthrvalglnserleuleuthralagluthrleugluhisasn465470475480glnthrtyrglucysargalahisasnservalglyserglysertrp485490495alapheileproileseralaglyalaarg5005058740prt人工序列cynocsf1recd-fc(有前導序列)8metglyproglyvalleuleuleuleuleuvalvalthralatrphis151015glyglnglyileprovalilegluproserglyprogluleuvalval202530lysproglygluthrvalthrleuargcysvalglyasnglyserval354045glutrpaspglyproileserprohistrpthrleutyrseraspgly505560proserservalleuthrthrthrasnalathrpheglnasnthrarg65707580thrtyrargcysthrgluproglyaspproleuglyglyseralaala859095ilehisleutyrvallysaspproalaargprotrpasnvalleuala100105110lysgluvalvalvalphegluaspglnaspalaleuleuprocysleu115120125leuthraspprovalleuglualaglyvalserleuvalargleuarg130135140glyargproleuleuarghisthrasntyrserpheserprotrphis145150155160glyphethrilehisargalalyspheileglnglyglnasptyrgln165170175cysseralaleumetglyserarglysvalmetserileserilearg180185190leulysvalglnlysvalileproglyproproalaleuthrleuval195200205proalagluleuvalargileargglyglualaalaglnilevalcys210215220seralaserasnileaspvalasppheaspvalpheleuglnhisasn225230235240thrthrlysleualaileproglnargseraspphehisaspasnarg245250255tyrglnlysvalleuthrleuserleuglyglnvalasppheglnhis260265270alaglyasntyrsercysvalalaserasnvalglnglylyshisser275280285thrsermetphepheargvalvalgluseralatyrleuaspleuser290295300sergluglnasnleuileglngluvalthrvalglygluglyleuasn305310315320leulysvalmetvalglualatyrproglyleuglnglypheasntrp325330335thrtyrleuglypropheserasphisglnprogluprolysleuala340345350asnalathrthrlysaspthrtyrarghisthrphethrleuserleu355360365proargleulysproserglualaglyargtyrserpheleualaarg370375380asnproglyglytrpargalaleuthrphegluleuthrleuargtyr385390395400proprogluvalservaliletrpthrserileasnglyserglythr405410415leuleucysalaalaserglytyrproglnproasnvalthrtrpleu420425430glncysalaglyhisthraspargcysaspglualaglnvalleugln435440445valtrpvalaspprohisprogluvalleuserglngluprophegln450455460lysvalthrvalglnserleuleuthralagluthrleugluhisasn465470475480glnthrtyrglucysargalahisasnservalglyserglysertrp485490495alapheileproileseralaglyalaargglysergluprolysser500505510serasplysthrhisthrcysproprocysproalaprogluleuleu515520525glyglyproservalpheleupheproprolysprolysaspthrleu530535540metileserargthrprogluvalthrcysvalvalvalaspvalser545550555560hisgluaspprogluvallyspheasntrptyrvalaspglyvalglu565570575valhisasnalalysthrlysproargglugluglntyrasnserthr580585590tyrargvalvalservalleuthrvalleuhisglnasptrpleuasn595600605glylysglutyrlyscyslysvalserasnlysalaleuproalapro610615620ileglulysthrileserlysalalysglyglnproarggluprogln625630635640valtyrthrleuproproserargaspgluleuthrlysasnglnval645650655serleuthrcysleuvallysglyphetyrproseraspilealaval660665670glutrpgluserasnglyglnprogluasnasntyrlysthrthrpro675680685provalleuaspseraspglyserphepheleutyrserlysleuthr690695700valasplysserargtrpglnglnglyasnvalphesercysserval705710715720methisglualaleuhisasnhistyrthrglnlysserleuserleu725730735serproglylys7409122prt人工序列fab0301重鏈可變區9gluvalglnleuglnglnserglyprogluleuvalargproglyala151015servallysmetsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvallysglnserhisglylysserleuglutrpile354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglylysalathrleuthrvalglulysserserserthralatyr65707580metglnleuasnserleuthrsergluaspseralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrservalthrvalserser11512010111prt人工序列fab0301輕鏈可變區10asnilevalleuthrglnserproalaserleualavalserleugly151015glnargalathrilesercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnpropro354045lysleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuasnilehis65707580provalgluglugluaspalaalathrtyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysleugluilelys10010511011121prt人工序列fab0302重鏈可變區11gluileglnleuglnglnserglyprogluleuvallysproglyala151015servallysmetsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvallysglnlysproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglylysalathrleuthrseraspargserserserthralatyr65707580metaspleuserserleuthrsergluaspseralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrserilethrvalserser11512012111prt人工序列fab0302輕鏈可變區12aspvalvalvalthrglnthrproalaserleualavalserleugly151015glnargalathrilesercysargalasergluservalaspasntyr202530glyleuserphemetasntrppheglnglnlysproglyglnpropro354045lysleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyglyglyserargthraspphethrleuthrileasp65707580provalglualaaspaspalaalathrtyrphecysglnglnserlys859095gluleuprotrpthrpheglyglyglythrargleugluilelys10010511013122prt人工序列fab0311重鏈可變區13gluileglnleuglnglnserglyproaspleumetlysproglyala151015servallysmetsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvallysglnasnglnglylysserleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglythrthrthrleuthrvalasplysserserserthralatyr65707580metaspleuhisserleuthrsergluaspseralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glylysglythrthrleuthrvalserser11512014111prt人工序列fab0311輕鏈可變區14aspilevalleuthrglnserproalaserleualavalserleugly151015glnargalathrilesercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnpropro354045lysleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglyalaaspphethrleuthrilehis65707580provalgluglugluaspalaalathrtyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglyglythrargleugluilelys1001051101510prt人工序列0301重鏈cdr115glytyrthrphethraspasntyrmetile15101617prt人工序列0301重鏈cdr16aspileasnprotyrasnglyglythrthrpheasnglnlysphelys151015gly1713prt人工序列0301重鏈cdr317gluserprotyrpheserasnleutyrvalmetasptyr15101815prt人工序列0301輕鏈cdr118lysalaserglnservalasptyraspglyaspasntyrmetasn151015197prt人工序列0301輕鏈cdr219alaalaserasnleugluser15209prt人工序列0301輕鏈cdr320hisleuserasngluaspleuserthr152110prt人工序列0302重鏈cdr121glytyrthrpheserasppheasnilehis15102217prt人工序列0302重鏈cdr222tyrileasnprotyrthraspvalthrvaltyrasnglulysphelys151015gly2312prt人工序列0302重鏈cdr323tyrpheaspglythrpheasptyralaleuasptyr15102415prt人工序列0302輕鏈cdr124argalasergluservalaspasntyrglyleuserphemetasn151015257prt人工序列0302輕鏈cdr225thralaserasnleugluser15269prt人工序列0302輕鏈cdr326glnglnserlysgluleuprotrpthr152710prt人工序列0311重鏈cdr127glytyrilephethrasptyrasnmethis15102817prt人工序列0311重鏈cdr228gluileasnproasnasnglyvalvalvaltyrasnglnlysphelys151015gly2913prt人工序列0311重鏈cdr329alaleutyrhisserasnpheglytrptyrpheaspser15103015prt人工序列0311輕鏈cdr130lysalaserglnservalasptyraspglyaspserhismetasn151015317prt人工序列0311輕鏈cdr231thralaserasnleugluser15329prt人工序列0311輕鏈cdr332glnglnglyasngluaspprotrpthr1533449prt人工序列cab0301重鏈33gluvalglnleuglnglnserglyprogluleuvalargproglyala151015servallysmetsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvallysglnserhisglylysserleuglutrpile354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglylysalathrleuthrvalglulysserserserthralatyr65707580metglnleuasnserleuthrsergluaspseralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrservalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys34448prt人工序列cab0301輕鏈34gluileglnleuglnglnserglyprogluleuvallysproglyala151015servallysmetsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvallysglnlysproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglylysalathrleuthrseraspargserserserthralatyr65707580metaspleuserserleuthrsergluaspseralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrserilethrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys43544044535448prt人工序列cab0302重鏈35gluileglnleuglnglnserglyprogluleuvallysproglyala151015servallysmetsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvallysglnlysproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglylysalathrleuthrseraspargserserserthralatyr65707580metaspleuserserleuthrsergluaspseralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrserilethrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys43544044536218prt人工序列cab0302輕鏈36aspvalvalvalthrglnthrproalaserleualavalserleugly151015glnargalathrilesercysargalasergluservalaspasntyr202530glyleuserphemetasntrppheglnglnlysproglyglnpropro354045lysleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyglyglyserargthraspphethrleuthrileasp65707580provalglualaaspaspalaalathrtyrphecysglnglnserlys859095gluleuprotrpthrpheglyglyglythrargleugluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021537449prt人工序列cab0311重鏈37gluileglnleuglnglnserglyproaspleumetlysproglyala151015servallysmetsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvallysglnasnglnglylysserleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglythrthrthrleuthrvalasplysserserserthralatyr65707580metaspleuhisserleuthrsergluaspseralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glylysglythrthrleuthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys38218prt人工序列cab0311輕鏈38aspilevalleuthrglnserproalaserleualavalserleugly151015glnargalathrilesercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnpropro354045lysleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglyalaaspphethrleuthrilehis65707580provalgluglugluaspalaalathrtyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglyglythrargleugluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021539122prt人工序列h0301-h0重鏈可變區39glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpmet354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargvalthrilethralaasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserser11512040122prt人工序列h0301-h1重鏈可變區40glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpmet354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargvalthrilethrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserser11512041122prt人工序列h0301-h2重鏈可變區41glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpile354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargalathrleuthrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserser11512042121prt人工序列h0302-h1重鏈可變區42glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvalargglnalaproglyglnglyleuglutrpmet354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglyargvalthrilethrserasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrleuvalthrvalserser11512043121prt人工序列h0302-h2重鏈可變區43glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvalargglnalaproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglyargalathrleuthrserasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrleuvalthrvalserser11512044122prt人工序列h0311-h1重鏈可變區44glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglyargvalthrilethrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glyglnglythrleuvalthrvalserser11512045122prt人工序列h0311-h2重鏈可變區45glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglythrthrthrleuthrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glyglnglythrleuvalthrvalserser11512046111prt人工序列h0301-l0輕鏈可變區46gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysvalgluilelys10010511047111prt人工序列h0301-l1輕鏈可變區47asnilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysvalgluilelys10010511048111prt人工序列h0302-l0輕鏈可變區48gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelys10010511049111prt人工序列h0302-l1輕鏈可變區49gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserargthraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelys10010511050111prt人工序列h0302-l2輕鏈可變區50gluilevalvalthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrppheglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserargthraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelys10010511051111prt人工序列h0311-l0輕鏈可變區51gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglnglythrlysvalgluilelys10010511052111prt人工序列h0311-l1輕鏈可變區52aspilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglyalaaspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglnglythrlysvalgluilelys10010511053449prt人工序列h0301-h0重鏈53glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpmet354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargvalthrilethralaasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys54449prt人工序列h0301-h1重鏈54glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpmet354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargvalthrilethrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys55449prt人工序列h0301-h2重鏈55glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpile354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargalathrleuthrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys56448prt人工序列h0302-h1重鏈56glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvalargglnalaproglyglnglyleuglutrpmet354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglyargvalthrilethrserasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrleuvalthrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys43544044557448prt人工序列h0302-h2重鏈57glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvalargglnalaproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglyargalathrleuthrserasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrleuvalthrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys43544044558449prt人工序列h0311-h1重鏈58glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglyargvalthrilethrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys59449prt人工序列h0311-h2重鏈59glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglythrthrthrleuthrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys60218prt人工序列h0301-l0輕鏈60gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021561218prt人工序列h0301-l1輕鏈61asnilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021562218prt人工序列h0302-l0輕鏈62gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021563218prt人工序列h0302-l1輕鏈63gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserargthraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021564218prt人工序列h0302-l2輕鏈64gluilevalvalthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrppheglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserargthraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021565218prt人工序列h0311-l0輕鏈65gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021566218prt人工序列h0311-l1輕鏈66aspilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglyalaaspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys21021567158prt人misc_feature(1)..(158)人csf167glugluvalserglutyrcysserhismetileglyserglyhisleu151015glnserleuglnargleuileaspserglnmetgluthrsercysgln202530ilethrphegluphevalaspglngluglnleulysaspprovalcys354045tyrleulyslysalapheleuleuvalglnaspilemetgluaspthr505560metargpheargaspasnthrproasnalailealailevalglnleu65707580glngluleuserleuargleulyssercysphethrlysasptyrglu859095gluhisasplysalacysvalargthrphetyrgluthrproleugln100105110leuleuglulysvallysasnvalpheasngluthrlysasnleuleu115120125asplysasptrpasnilepheserlysasncysasnasnserpheala130135140glucysserserglnglyhisgluargglnsergluglyser14515015568222prt人misc_feature(1)..(222)人il-3468asngluproleuglumettrpproleuthrglnasngluglucysthr151015valthrglypheleuargasplysleuglntyrargserargleugln202530tyrmetlyshistyrpheproileasntyrlysileservalprotyr354045gluglyvalpheargilealaasnvalthrargleuglnargalagln505560valsergluarggluleuargtyrleutrpvalleuvalserleuser65707580alathrgluservalglnaspvalleuleugluglyhisprosertrp859095lystyrleuglngluvalglnthrleuleuleuasnvalglnglngly100105110leuthraspvalgluvalserprolysvalgluservalleuserleu115120125leuasnalaproglyproasnleulysleuvalargprolysalaleu130135140leuaspasncyspheargvalmetgluleuleutyrcyssercyscys145150155160lysglnserservalleuasntrpglnaspcysgluvalproserpro165170175glnsercysserprogluproserleuglntyralaalathrglnleu180185190tyrproproproprotrpserproserserproprohisserthrgly195200205servalargprovalargalaglnglygluglyleuleupro2102152206925prt人工序列人受體afr169glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaser20257014prt人工序列人受體afr270trpvalargglnalaproglyglnglyleuglutrpmetgly15107132prt人工序列人受體afr371argvalthrilethralaasplysserthrserthralatyrmetglu151015leuserserleuargsergluaspthralavaltyrtyrcysalaarg2025307211prt人工序列人受體afr472trpglyglnglythrleuvalthrvalserser15107325prt人工序列人受體bfr173glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaser20257414prt人工序列人受體bfr274trpvalargglnalaproglyglnglyleuglutrpmetgly15107532prt人工序列人受體bfr375argvalthrilethralaasplysserthrserthralatyrmetglu151015leuserserleuargsergluaspthralavaltyrtyrcysalaarg2025307611prt人工序列人受體bfr476trpglyglnglythrleuvalthrvalserser15107725prt人工序列人受體cfr177glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaser20257814prt人工序列人受體cfr278trpvalargglnalaproglyglnglyleuglutrpmetgly15107932prt人工序列人受體cfr379argvalthrilethralaasplysserthrserthralatyrmetglu151015leuserserleuargsergluaspthralavaltyrtyrcysalaarg2025308011prt人工序列人受體cfr480trpglyglnglythrleuvalthrvalserser15108123prt人工序列人受體dfr181gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercys208215prt人工序列人受體dfr282trptyrglnglnlysproglyglnalaproargleuleuiletyr1510158332prt人工序列人受體dfr383glyileproalaargpheserglyserglyserglythraspphethr151015leuthrileserserleugluprogluaspphealavaltyrtyrcys2025308410prt人工序列人受體dfr484pheglyglyglythrlysvalgluilelys15108523prt人工序列人受體efr185gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercys208615prt人工序列人受體efr286trptyrglnglnlysproglyglnalaproargleuleuiletyr1510158732prt人工序列人受體efr387glyileproalaargpheserglyserglyserglythraspphethr151015leuthrileserserleugluprogluaspphealavaltyrtyrcys2025308810prt人工序列人受體efr488pheglyglnglythrlysvalgluilelys15108923prt人工序列人受體ffr189gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercys209015prt人工序列人受體ffr290trptyrglnglnlysproglyglnalaproargleuleuiletyr1510159132prt人工序列人受體ffr391glyileproalaargpheserglyserglyserglythraspphethr151015leuthrileserserleugluprogluaspphealavaltyrtyrcys2025309210prt人工序列人受體ffr492pheglyglnglythrlysvalgluilelys151093719prt人工序列mcsf1recd-fc93alaprovalilegluproserglyprogluleuvalvalgluprogly151015gluthrvalthrleuargcysvalserasnglyservalglutrpasp202530glyproileserprotyrtrpthrleuaspprogluserproglyser354045thrleuthrthrargasnalathrphelysasnthrglythrtyrarg505560cysthrgluleugluaspprometalaglyserthrthrilehisleu65707580tyrvallysaspproalahissertrpasnleuleualaglngluval859095thrvalvalgluglyglnglualavalleuprocysleuilethrasp100105110proalaleulysaspservalserleumetarggluglyglyarggln115120125valleuarglysthrvaltyrphepheserprotrpargglypheile130135140ilearglysalalysvalleuaspserasnthrtyrvalcyslysthr145150155160metvalasnglyarggluserthrserthrglyiletrpleulysval165170175asnargvalhisprogluproproglnilelysleugluproserlys180185190leuvalargileargglyglualaalaglnilevalcysseralathr195200205asnalagluvalglypheasnvalileleulysargglyaspthrlys210215220leugluileproleuasnserasppheglnaspasntyrtyrlyslys225230235240valargalaleuserleuasnalavalasppheglnaspalaglyile245250255tyrsercysvalalaserasnaspvalglythrargthralathrmet260265270asnpheglnvalvalgluseralatyrleuasnleuthrserglugln275280285serleuleuglngluvalservalglyaspserleuileleuthrval290295300hisalaaspalatyrproserileglnhistyrasntrpthrtyrleu305310315320glyprophephegluaspglnarglysleuglupheilethrglnarg325330335alailetyrargtyrthrphelysleupheleuasnargvallysala340345350serglualaglyglntyrpheleumetalaglnasnlysalaglytrp355360365asnasnleuthrphegluleuthrleuargtyrproprogluvalser370375380valthrtrpmetprovalasnglyseraspvalleuphecysaspval385390395400serglytyrproglnproservalthrtrpmetglucysargglyhis405410415thraspargcysaspglualaglnalaleuglnvaltrpasnaspthr420425430hisprogluvalleuserglnlyspropheasplysvalileilegln435440445serglnleuproileglythrleulyshisasnmetthrtyrphecys450455460lysthrhisasnservalglyasnserserglntyrpheargalaval465470475480serleuglyglnserlysglngluprolysserserasplysthrhis485490495thrcysproprocysproalaprogluleuleuglyglyproserval500505510pheleupheproprolysprolysaspthrleumetileserargthr515520525progluvalthrcysvalvalvalaspvalserhisgluaspproglu530535540vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys545550555560thrlysproargglugluglntyrasnserthrtyrargvalvalser565570575valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys580585590cyslysvalserasnlysalaleuproalaproileglulysthrile595600605serlysalalysglyglnproarggluproglnvaltyrthrleupro610615620proserargaspgluleuthrlysasnglnvalserleuthrcysleu625630635640vallysglyphetyrproseraspilealavalglutrpgluserasn645650655glyglnprogluasnasntyrlysthrthrproprovalleuaspser660665670aspglyserphepheleutyrserlysleuthrvalasplysserarg675680685trpglnglnglyasnvalphesercysservalmethisglualaleu690695700hisasnhistyrthrglnlysserleuserleuserproglylys70571071594327prt人工序列人igg4s241p94alaserthrlysglyproservalpheproleualaprocysserarg151015serthrsergluserthralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrlysthr65707580tyrthrcysasnvalasphislysproserasnthrlysvalasplys859095argvalgluserlystyrglyproprocysproprocysproalapro100105110glupheleuglyglyproservalpheleupheproprolysprolys115120125aspthrleumetileserargthrprogluvalthrcysvalvalval130135140aspvalserglngluaspprogluvalglnpheasntrptyrvalasp145150155160glyvalgluvalhisasnalalysthrlysproargglugluglnphe165170175asnserthrtyrargvalvalservalleuthrvalleuhisglnasp180185190trpleuasnglylysglutyrlyscyslysvalserasnlysglyleu195200205proserserileglulysthrileserlysalalysglyglnproarg210215220gluproglnvaltyrthrleuproproserglngluglumetthrlys225230235240asnglnvalserleuthrcysleuvallysglyphetyrproserasp245250255ilealavalglutrpgluserasnglyglnprogluasnasntyrlys260265270thrthrproprovalleuaspseraspglyserphepheleutyrser275280285argleuthrvalasplysserargtrpglngluglyasnvalpheser290295300cysservalmethisglualaleuhisasnhistyrthrglnlysser305310315320leuserleuserleuglylys32595107prt人misc_feature(1)..(107)人ig-κ95argthrvalalaalaproservalpheilepheproproseraspglu151015glnleulysserglythralaservalvalcysleuleuasnasnphe202530tyrproargglualalysvalglntrplysvalaspasnalaleugln354045serglyasnserglngluservalthrgluglnaspserlysaspser505560thrtyrserleuserserthrleuthrleuserlysalaasptyrglu65707580lyshislysvaltyralacysgluvalthrhisglnglyleuserser859095provalthrlysserpheasnargglyglucys100105當前第1頁12
