N-萘烷基取代的含氮雜環衍生物、製備方法及其抗腫瘤用途與流程
2023-11-09 22:32:53 1
本發明涉及製藥領域,具體涉及N-萘烷基取代的含氮雜環衍生物、其製備方法及其在預防或治療腫瘤疾病藥物中的應用。
背景技術:
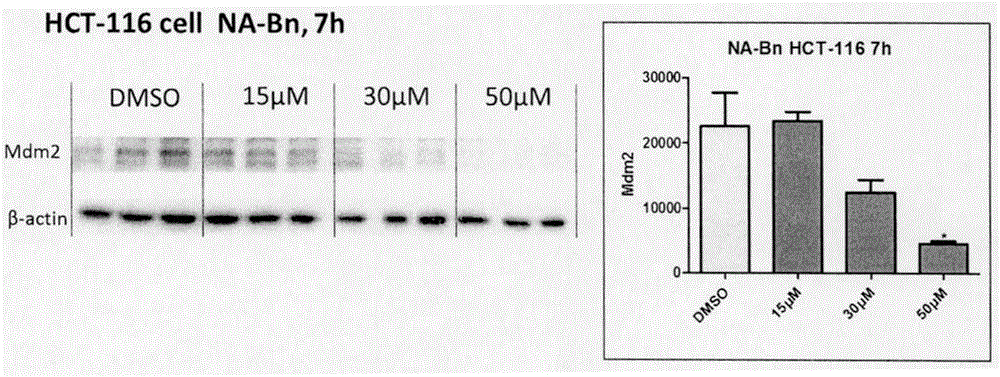
:癌症是全世界嚴重關切的公共健康問題,也是尚未攻克的人類健康的最大威脅之一。腫瘤的發生是以細胞自身對調節細胞生長、分化、功能及凋亡等信號的錯誤應答為特徵的。目前,在臨床上使用的抗腫瘤藥物包括細胞毒類藥物、激酶抑制劑、蛋白酶體抑制劑、HDAC抑制劑和hedgehog抑制劑等。Mdm2是一個泛素連接酶,其至關重要的功能是對p53進行多聚泛素化,促進其進入蛋白酶體降解。p53被稱為細胞的「基因衛士」,正常細胞中p53基因維持穩定的低轉錄水平,且細胞中濃度低到幾乎難以檢測,其主要原因是Mdm2對p53的泛素化降解作用和轉錄功能抑制作用(CellDeathDiffer.2010,17(1):86-92)。細胞受到DNA損傷、原癌因子的激活、活性氧的刺激、營養匱乏等壓力刺激時,p53將被激活,穩定且激活的p53就可以招募一些輔轉錄因子結合到DNA的特定區域內轉錄調控下遊基因的表達,產生一系列的生物學效應,調控細胞的生長、衰老、凋亡和代謝。研究表明,許多腫瘤組織中Mdm2過表達,從而使得腫瘤細胞中p53蛋白的轉錄功能和水平都有很大程度的下降,進而減弱p53對腫瘤細胞的抑制作用(Curr.CancerDrugTargets2005,5,3-8)。此外,Mdm2還通過非p53依賴的途徑而產生致癌作用(TrendsinBiochemicalSciences2009,34(6):279-286),例如,Mdm2可通過多聚泛素化導致抑癌因子Rb蛋白降解(Nature1995,375,694-698;EMBOJ.2005,24,160-169);Mdm2通過激活E2F1的轉錄功能進而促進細胞周期進程(Nature1995,375,691-694);Mdm2可促進抑癌因子p21的蛋白酶體降解(EMBOJ.2003,22,6365-6377)等。總之,Mdm2在調控細胞凋亡及細胞周期進程中發揮關鍵作用,是一個確證的致癌因子。因此,抑制Mdm2的功能有望成為腫瘤治療的新途徑。目前,基於Mdm2的抗腫瘤新藥研究主要是研製Mdm2-p53蛋白-蛋白相互作 用抑制劑(Curr.Med.Chem.2014;21(5):553-74),且已有若干Mdm2-p53蛋白-蛋白相互作用抑制劑(如:AMG232、DS-3032b、MI-77301等)進入臨床研究階段。儘管Mdm2-p53蛋白-蛋白相互作用抑制劑在臨床試驗中顯示了一定的抗腫瘤作用,但該類抑制劑具有明顯的作用機制相關的局限性,例如,該類藥物的療效高度依賴p53的狀態,因而對p53突變腫瘤(在50%以上的腫瘤中p53是突變或缺失的)療效有限(CellCycle2011,10,1590-1598)。此外,Mdm2-p53蛋白-蛋白相互作用抑制劑可顯著提高細胞中Mdm2的表達(Mdm2是p53的靶基因,p53水平的升高反而會促進Mdm2的表達),並通過抑制Mdm2的自身泛素化降解而增加Mdm2的穩定性,其結果是負反饋地增強了Mdm2的致癌效應,並因此而可能產生藥物抵抗(CellCycle2011,10,1590-1598)。近年來,去泛素化酶USP7作為抗腫瘤新靶標受到了關注。USP7可通過對Mdm2去泛素化而抑制Mdm2的泛素化降解,從而提高其穩定性(MolCell.2004,26;13(6):879-86)。研究表明,USP7在前列腺癌和多發性骨髓瘤等腫瘤中過表達(Nature2008,455,813-818;CancerCell2012,22,345-358)。USP7抑制劑可以有效降低細胞中Mdm2的含量,並通過p53依賴和非p53依賴的途徑發揮抑制腫瘤的作用(CancerCell2012,22,345-358;CellDeathandDisease2013,4,e867;NatCellBiol.2006,8(10):1064-73;Nature2008,455,813-818)。目前在研的USP7抑制劑種類較少,且選擇性較差(中國藥物化學雜誌2013,23,486-492)。此外,現有USP7抑制劑與USP7的結合位點及作用方式也尚不清楚。代表性的USP7抑制劑包括P5091,其對多發性骨髓瘤具有顯著的抑制作用(CancerCell2012,22,345-358)。綜上所述,與Mdm2-p53蛋白-蛋白相互作用抑制劑相比,能夠降低Mdm2穩定性進而降低其含量的藥物在抗腫瘤療效方面更具優勢。技術實現要素:本發明人基於USP7底物結合域-Mdm2肽的蛋白共晶結構(PLoSBiol2006,4(2):e27),採用片段生成法,設計併合成了一系列新型化合物,通過抗腫瘤生物活性評價及作用機制研究,發現了一類具有全新結構的抗腫瘤活性化合物。該類化合物可顯著降低腫瘤細胞中Mdm2的含量,且具有劑量依賴性。本發明公開了如 下式I所示的化合物或其藥學上可接受的鹽或溶劑化物:其中,K、M獨自選自CH、N或CR4;L為CH、N或CR5;R1為H、NO2、滷素、CN、三氟甲基、Y-R8、COR9、COOR10、CONR11R12、SO2NR11R12、或非取代的或一個或多個取代的芳基或雜芳基;R2為H、NO2、滷素、CN、三氟甲基、甲醯基、CH(R6)XR7、COR9、COOR10、CONR11R12、1~12個碳的烷基、取代的烷基、非取代的或一個或多個取代的芳基或雜芳基R3、R6獨自選自H、1~12個碳的烷基、取代的烷基、非取代的或一個或多個取代的芳基或雜芳基;n為0~2;R7為H、1~12個碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一個或多個取代的芳基或雜芳基;R4、R5獨自選自H、滷素、甲醯基、COR9、COOR10、CONR11R12、1~12個碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一個或多個取代的芳基或雜芳基;或R5和R6與其他原子一起形成一個4~8元環;R8為H、COR9、SO2R13、1~12個碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一個或多個取代的芳基或雜芳基、取代或非取代的雜芳基甲基;R9、R10、R11、R12、R13獨自選自H、1~12個碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一個或多個取代的芳基或雜芳基;X為NR14或O;Y為O、NR14、S、SO或SO2;R14獨自選自H、1~12個碳的烷基、取代的烷基、非取代的或一個或多個取代的芳基或雜芳基。在本發明中,K優選CH或CR4;M優選N或CH;L優選CH或CR5;R1優選Y-R8、COR9、COOR10、CONR11R12、SO2NR11R12、或非取代的或一個或多個取代的芳基或雜芳基;R2優選CH(R6)XR7、1~12個碳的烷基、取代的烷基、非取代的或一個或多個取代的芳基或雜芳基R3、R6優選自H、1~12個碳的烷基、取代的烷基、非取代的或一個或多個取代的芳基或雜芳基;n優選0或1;R7優選H、1~12個碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一個或多個取代的芳基或雜芳基;R4、R5優選H、滷素、甲醯基、COR9、COOR10、CONR11R12、1~12個碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一個或多個取代的芳基或雜芳基;或R5和R6與其他原子一起形成一個4~8元環;R8優選H、1~12個碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一個或多個取代的芳基或雜芳基、取代或非取代的雜芳基甲基;R9、R10、R11、R12、R13優選1~12個碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一個或多個取代的芳基或雜芳基;X優選NR14或O;Y優選O、NR14、S、SO或SO2;R14優選H、1~12個碳的烷基、取代的烷基、非取代的或一個或多個取代的芳基或雜芳基。進一步地,本發明的優選化合物如下:本發明的另一目的是提供了該類化合物的合成方法.具體包括以下步驟:(1)將化合物I與R5-X在鹼性條件下發生親核取代反應製得化合物II-a,採用的鹼性試劑選自碳酸鉀、碳酸鈉、碳酸銫、氫化鈉,優選碳酸鉀;採用的溶劑選自DMF、丙酮、乙腈,優選DMF;採用的反應時間為1-24小時;採用溫度為零下20℃至120℃,優選60℃至100℃。(2)化合物II或II-a發生還原反應製得化合物III或III-3,採用的還原試劑選自硼氫化鈉、硼氫化鉀、四氫鋁鋰,優選硼氫化鈉;採用的溶劑選自甲醇、乙醇、四氫呋喃,優選甲醇;採用的反應時間為0.5-10小時;採用溫度為零下20℃至100℃,優選0℃至30℃。(3)化合物III或III-3與滷化試劑發生取代反應生成化合物IV或IV-a,採用的滷化試劑選自三溴化磷、液溴、四溴化碳、氯化亞楓,優選三溴化磷;採用的溶劑選自二氯甲烷、乙腈、乙醚,優選二氯甲烷;採用的反應時間為1-24小時;採用溫度為零下20℃至60℃,優選0℃至25℃。(4)化合物IV或IV-a與含NH的雜環或芳雜環在鹼性條件下發生親核取代反應製得化合物V或V-a。採用的鹼性試劑選自碳酸鉀、碳酸鈉、碳酸銫,優選碳酸鉀;採用的溶劑為DMF、丙酮、乙腈,優選DMF;採用的反應時間為1-24小時;採用溫度為零下20℃至120℃,優選60℃至120℃。(5)化合物VI-1發生還原反應製得化合物VI-1a,採用的還原試劑選自硼氫化鈉、硼氫化鉀、四氫鋁鋰,優選硼氫化鈉;採用的溶劑選自甲醇、乙醇、四氫呋喃,優選甲醇;採用的反應時間為0.5-10小時;採用溫度為零下20℃至100℃,優選0℃至30℃。(7)化合物VI-2發生還原胺化反應製得VI-2a,採用的還原試劑為硼氫化鈉、氰基硼氫化鈉、三乙醯氧基硼氫化鈉,優選腈基硼氫化鈉;採用的溶劑為甲醇、乙醇、二氯甲烷、四氫呋喃,優選甲醇;採用的反應時間為1-24小時;採用溫度為零下20℃至100℃,優選25℃至50℃。(8)化合物VI-3在鹼性條件下發生烷基化反應製得VI-3a,採用的鹼性試劑選自甲醇鈉、乙醇鈉、叔丁醇鉀;採用的溶劑為甲醇、乙醇、乙腈,優選甲醇;採用的反應時間為1-24小時;採用溫度為零下20℃至120℃,優選20℃至80℃。具體的化合物製備方法參照實施例。本發明的又一目的是提供了化合物或藥學上可接受的鹽或溶劑化物在製備預防和治療腫瘤的藥物中的用途。藥效學實驗結果表明,本發明中化合物具有顯著的抗腫瘤細胞增殖作用。下面是本發明的化合物的部分藥理實驗及結果。【1】體外細胞活性藥理實驗1.實驗目的:採用CCK-8染色法測定各化合物對人結腸癌細胞HCT116體外增殖活性的影響,並計算各自的半數抑制濃度IC50。2.實驗材料:本發明化合物用DMSO溶解配製成母液,使用前採用完全培養基稀釋成適當濃度;試劑:CCK-8試劑盒購自南京建成生物科技有限公司;培 養基:改良型RMPI-1640培養基:購自Hyclone公司;類胎牛血清:購自Hyclone公司;96孔細胞培養板購自Costar公司。3.實驗方法:取活細胞比例達90%以上的細胞進行實驗。細胞增殖抑制試驗採用EnoGeneCellTMCountingKit-8(CCK-8)細胞活力檢測試劑盒。細胞消化、計數、製成濃度為3×104個/ml的細胞懸液,96孔板中每孔加入100μl細胞懸液(每孔3×103個細胞);96孔板置於37℃,5%CO2培養箱中培養24小時;用完全培養基稀釋藥物至所需濃度,每孔加入100μL相應的含藥物的培養基,同時設立陰性對照組,溶媒對照組。每組5個復孔;96孔板置於37℃,5%CO2培養箱中培養72小時;每孔加入10μLCCK-8溶液,將培養板在培養箱內孵育3.5小時,用酶標儀測定在450nm處的OD值,計算不同濃度狀態下的細胞抑制率並計算出IC50值。4.實驗結果:本發明化合物對人結腸癌細胞HCT116細胞株體外增殖的抑制活性(IC50)見下表。化合物IC50(μM)化合物IC50(μM)化合物IC50(μM)化合物IC50(μM)I-19.906I-14>100I-30>100I-4518.85I-210.08I-1530~100I-3130~100I-46>100I-311.26I-1630~100I-3230~100I-478.495I-49.077I-17>100I-33>100P509112.21I-59.875I-18>100I-355.060I-611.57I-19>100I-37>100I-75.055I-20>100I-38>100I-811.03I-21>100I-39>100I-94.68I-22>100I-4030~100I-10>100I-23>100I-417.782I-1114.55I-24>100I-424.177I-1211.25I-2529.27I-4328.55I-1313.1I-277.799I-4430~100上述測試結果顯示,本發明化合物對結腸癌細胞的生長具有不同程度的抑制作用。部分化合物顯示了比陽性藥P5091更強的抗腫瘤活性。該結果提示本發明化合物可以用於製備抗腫瘤藥物。【2】正常細胞毒性藥理實驗用類似於腫瘤細胞抑制活性類似的方法,選用代表化合物I-1進行了正常細胞毒性的藥理實驗檢測,實驗結果如下:結果表明,代表化合物I-1具有對腫瘤細胞和正常細胞的選擇性,同時其抗腫瘤活性具有一定的P53依賴性。【3】體外分子水平藥理實驗——腫瘤細胞Mdm2的水平測試(Westernblot)1.實驗目的:採用Westernblot方法測定化合物對人結腸癌細胞HCT116中Mdm2含量的影響2.實驗材料:本發明化合物用DMSO溶解配製成母液,使用前採用完全培養基稀釋成適當濃度;試劑購自生興生物公司;培養基:改良型RMPI-1640培養基:購自Hyclone公司;類胎牛血清:購自Hyclone公司;96孔細胞培養板購自Costar公司。3.實驗方法:取活細胞比例達90%以上的細胞進行實驗。細胞消化、計數、製成濃度為100000個/ml的細胞懸液,12孔板中每孔加入1000μl細胞懸液(每孔2×105個細胞);12孔板置於37℃,5%CO2培養箱中培養24小時貼壁,吸去上層培養基;用完全培養基稀釋藥物至所需濃度,每孔加入1000μL相應的含藥物的培養基,同時設立陰性對照組,溶媒對照組。每組3個復孔;12孔板置於37℃,5%CO2培養箱中培養7小時,除去上層培養基;用PBS清洗細胞後使用細胞裂解液裂解細胞,提取蛋白;將HCT-116細胞用陽性藥及化合物I-1作用,濃度選擇0μM、15μM、30μM和50μM,相應時間後裂解細胞,用10%分離膠電泳。結果表明:隨陽性藥或化合物I-1濃度的升高,Mdm2的細胞水平顯著降低(圖1,2)。本發明所述的化合物及其組合物可用於製備抗腫瘤藥物。所述腫瘤包括但不限於如下這些:骨癌,包括(例如):骨源性肉瘤(骨肉瘤)、纖維肉瘤、惡性纖維組織細胞瘤、軟骨肉瘤、尤因氏肉瘤、惡性淋巴瘤(網狀細胞肉瘤)、多發性骨髓瘤、惡性巨細胞瘤脊索瘤、骨軟骨瘤(顧軟管型外生骨疣)、良性軟骨瘤、成軟骨細胞 瘤、軟骨及瘤樣纖維瘤、骨樣骨瘤和巨細胞瘤。血液科癌症,包括(例如):血液癌症,如急性骨髓性白血病、慢性骨髓性白血病、急性淋巴細胞系白血病、慢性淋巴細胞系白血病、骨髓增生性疾病、多發性骨髓瘤和骨髓增生異常症候群、霍奇金氏淋巴瘤(惡性淋巴瘤)和瓦爾登斯特倫巨球蛋白血症。神經系統癌症,包括(例如):頭骨癌,如骨癌、血管瘤、肉芽瘤、黃瘤和畸形性骨炎;腦膜癌,如腦膜瘤、腦膜肉瘤和神經膠質瘤;腦癌,如星形細胞瘤、成神經管細胞瘤、神經膠質瘤、室管膜瘤、生殖細胞瘤(松果體瘤)、多形性成膠質細胞瘤、少突神經膠質細胞瘤、神經鞘瘤、成視網膜細胞瘤和先天性腫瘤;以及脊髓瘤,如纖維神經瘤、腦膜瘤、神經膠質瘤和肉瘤。胃腸瘤,包括(例如):食道癌症,如鱗狀細胞癌、腺癌、平滑肌肉瘤和淋巴瘤;胃癌,如腫瘤、淋巴瘤和平滑肌肉瘤;胰腺癌,如導管腺癌、胰島瘤、胰高血糖素瘤、胃泌素瘤、類癌瘤和血管活性腸肽瘤;小腸癌,如腺癌、淋巴瘤、類癌瘤、卡波濟氏肉瘤、平滑肌瘤、血管瘤、脂肪瘤、纖維神經瘤和纖維瘤;大腸癌,如腺癌、小管腺癌、絨毛狀腺瘤、錯構瘤和平滑肌瘤。泌尿系統癌症,包括(例如):腎癌,如腺癌、維爾姆斯瘤(腎母細胞瘤)、淋巴瘤和白血病;膀胱和尿道癌,如鱗狀細胞癌、移行細胞癌和腺癌;前列腺癌,如腺癌和肉瘤;睪丸癌,如精原細胞瘤、畸胎瘤、胚胎性癌、畸胎瘤、絨毛膜癌、肉瘤、間質細胞癌、纖維瘤、纖維腺瘤、腺瘤樣瘤和脂肪瘤。肺癌,包括(例如):支氣管癌,如鱗狀細胞癌、未分化小細胞癌、未分化大細胞癌和腺癌;細支氣管肺泡癌;支氣管腺瘤;肉瘤;淋巴瘤;肺軟骨瘤性錯構瘤和間皮瘤。肝癌,包括(例如):肝細胞癌,如肝細胞癌;膽管癌;肝胚細胞瘤;血管肉瘤;肝細胞腺瘤和血管瘤。皮膚癌,包括(例如):惡性黑素瘤、基底細胞癌、鱗狀細胞癌、卡波濟氏肉瘤、發育異常性痣、脂肪瘤、血管瘤、皮膚纖維瘤、瘢痕瘤、銀屑病。本發明還提供了一種預防和治療腫瘤的藥物組合物,其中含有治療有效量的該化合物或其藥學上可接受的鹽或溶劑化物作為活性成份和藥學上可接受的載體。所述藥物組合物可以是普通片劑或膠囊、緩釋片劑或膠囊、控釋片劑或膠囊、 顆粒劑、散劑、糖漿劑、口服液、注射劑等製劑學上常規的製劑形式。本發明藥物組合物中該化合物或其藥學上可接受的鹽或溶劑化物的劑量隨症狀和年齡等不同而不同。也可根據疾病程度的不同和劑型的不同而偏離此劑量範圍。施用本發明所述化合物進行治療或預防時,也可與現有治療癌症的方法(例如,通過化療、放療或手術)組合施用。因此本發明還提供了一種治療癌症的方法,包括向患者使用治療有效量的根據該化合物或其可藥用的鹽形式或製劑的同時向患者施用治療有效量的一種或多種其他的癌症化療劑。對於任何具體的患者,具體的藥物組合形式及具體的治療有效劑量水平需根據多重因素而定,所述因素包括所治療的腫瘤類型、特徵和其惡性程度;所採用的具體化合物的活性;患者的年齡、體重、一般健康狀況、性別和飲食;所採用的具體化合物的給藥時間、給藥途徑和排洩率;治療持續時間及醫療領域公知的類似因素。合適的化療劑的例子包括但不限於以下這些:烷化劑:氮芥類,環磷醯胺、異環磷醯胺、美法侖、苯丁酸氮芥、苯達莫司汀、雌莫司汀;乙撐亞胺類,塞替哌、亞胺醌;磺酸酯及多元醇類,白消安、二溴甘露醇;亞硝基脲類,環己亞硝、卡氮芥、嘧啶亞硝脲、甲環亞硝脲;三氮烯咪唑類,甲氮咪胺;肼類,甲基苄肼。抗代謝藥:嘧啶拮抗劑,氟尿嘧啶、阿糖胞苷、呋氟尿嘧啶、雙呋氟尿嘧啶;嘌呤拮抗劑,巰嘌呤、磺巰嘌呤鈉、硫唑嘌呤、硫鳥嘌呤;葉酸拮抗劑,甲氨蝶呤、氨蝶呤。抗腫瘤抗生素:絲裂黴素C、博來黴素、放線菌素D、光神黴素、柔紅黴素、阿黴素、色黴素A3、恩黴素、新制癌素、抗癌黴素、素道黴素。植物類抗癌藥:長春新鹼、秋水仙鹼、喜樹鹼、羥基喜樹鹼、斑蝥素、靛玉紅。激素:腎上腺素皮質激素,潑尼松、氫化潑尼松、氫化可的松、地塞米松;雌激素,己烯雌酚、溴乙醯己烷雌酚;雄激素及同化激素,丙酸睪丸酮、甲睪酮、苯丙酸諾龍、萘氧啶、三苯氧胺。其他類型:順氯氨鉑、幹擾素、左旋門冬醯胺酶、羥基脲、丙亞胺、丙咪腙、血卟啉;免疫製劑。附圖說明圖1顯示陽性藥p5091作用於HCT-116細胞時,細胞內Mdm2水平降低隨藥物濃度增加而降低;圖2顯示化合物I-1作用於HCT-116細胞時,細胞內Mdm2水平降低隨藥物濃度增加而降低;圖3是化合物I-1的核磁氫譜;圖4是化合物I-1的核磁碳譜。具體實施方式下面通過實施例具體說明本發明的內容。在本發明中,以下所述的實施例是為了更好的闡述本發明,並不是用來限制本發明的範圍。實施例16-苄氧基-萘-2-醛(II)的製備將6-羥基-2-萘酚(150mg,0.87mmol)、碳酸鉀(361mg,2.61mmol)加入乾燥的DMF(3ml)中,室溫下攪拌30分鐘。向反應液中滴加2-氯-溴苄(223mg,155μl,1.31mmol)後,置於80℃油浴,攪拌至反應完全。加水淬滅反應,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得目標化合物(200mg,收率87.5%)。1HNMR(300MHz,DMSO)δ10.06(s,1H),8.48(s,1H),8.07(d,J=9.0Hz,1H),7.92(d,J=8.6Hz,1H),7.83(d,J=8.5Hz,1H),7.55(s,1H),7.50(d,J=6.7Hz,2H),7.45-7.21(m,4H),5.25(s,2H).實施例2(6-苄氧基-萘-2-基)-甲醇(III)的製備將6-苄氧基-萘-2-醛(II)(200mg,0.76mmol)溶解於乾燥甲醇(5ml)中,加入乾燥硼氫化鈉(43mg,1.14mmol),室溫下攪拌2h至反應完全。將溶劑蒸乾,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得目標化合物III粗品,直接投入下步反應。(190mg,粗品收率94.3%)實施例32-苄氧基-6-溴甲基-萘(IV)的製備將(6-苄氧基-萘-2-基)-甲醇(III)(150mg,0.57mmol)溶於二氯甲烷(5ml)中,0℃冰浴下滴加三溴化磷的二氯甲烷溶液(384mg,135μl,1.42mmol/1ml),自然升溫至室溫攪拌4h。加水淬滅,二氯甲烷萃取,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得目標化合物V粗品,直接投入下步反應。(110mg,粗品收率59.2%)實施例41-[(6-苄氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(1)的製備將2-苄氧基-6-溴甲基-萘(100mg,0.31mmol)、碳酸鉀(93mg,0.67mmol)、2-甲醛-咪唑(48mg,0.50mmol)溶於DMF,80℃下攪拌至反應完全,升至室溫,加水淬滅,乙酸乙酯萃取,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得目標化合物1粗品,直接投入下步反應。(110mg,粗品收率94.35%)實施例51-{1-[(6-苄氧基萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-1)的製備將1-[(6-苄氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(100mg,0.29mmol)溶於乾燥甲醇,加入甲胺醇溶液(0.5ml),加入過量乾燥無水硫酸鈉作為附水劑,室溫攪拌過夜;濾去硫酸鈉固體,反應液中加入乾燥硼氫化鈉固體(17mg,0.44mmol),室溫攪拌至反應完全。將溶劑蒸乾,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得目標化合物I-1(90mg,收率86.2%)1HNMR(300MHz,DMSO)δ7.70(d,J=8.9Hz,2H),7.56-7.18(m,9H),7.03(s,1H),6.91(s,1H),5.36(s,2H),5.19(s,2H),3.85(s,2H),2.47(s,3H).13CNMR(75MHz,CDCl3)δ157.14,148.90,145.67,136.69,134.04,131.67,129.35,128.82,128.61,128.05,127.72,127.51,125.66,125.26,120.82,119.72,107.14,70.07,49.71,47.36.35.81.實施例61-{1-{[6-(2-氯苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-2)的製備反應步驟參照實施例1-5,得目標化合物I-2(65mg,收率62.50%)。1HNMR(300MHz,CDCl3)δ7.73(s,1H),7.70(s,1H),7.64-7.59(m,1H),7.46(s,1H),7.42(s,1H),7.29(s,3H),7.22(m,2H),7.02(s,1H),6.90(s,1H),5.34(s,2H),5.29(s,2H),3.82(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ156.81,146.32,134.00,131.95,129.42,129.06,128.96,128.81,127.76,127.49,126.97,126.91,125.61,125.34,120.66,119.51,107.31,67.18,49.62,47.79,36.10.實施例71-{1-{[6-(3-甲氧基苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-3)的製備反應步驟參照實施例1-5,得目標化合物I-3(85mg,收率81.70%)。1HNMR(300MHz,CDCl3)δ7.71(s,1H),7.68(s,1H),7.45(s,1H),7.36-7.25(m,2H),7.21(s,2H),7.04(m,3H),6.96(s,H),6.84(s,H),5.33(s,2H),5.15(s,2H),3.80(s,3H)3.11(s,2H),2.44(s,3H).13CNMR(75MHz,CDCl3)δ159.88,157.08,146.32,138.32,134.02,131.84,129.66,129.34,128.86,127.70,127.48,125.63,125.29,120.66,119.66,113.51,113.01,107.22,69.94,55.22,49.62,47.77,36.09.實施例81-{1-{[6-(3-氯苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-4)的製備反應步驟參照實施例1-5,得目標化合物I-4(63mg,收率43.27%)。1HNMR(300MHz,CDCl3)δ7.69(d,J=8.6Hz,2H),7.47(d,J=8.8Hz,2H),7.40-7.06(m,6H),7.01(s,1H),6.89(s,1H),5.33(s,2H),5.14(s,2H),3.80(s,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ157.22,146.69,139.23,134.98,134.38,132.43,130.29,129.89,129.38,128.57,128.12,127.95,127.84,126.06,125.80,125.77,121.09,119.94,107.65,69.61,50.03,48.20,36.50.實施例91-{1-{[6-(4-氟苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-5)的製備反應步驟參照實施例1-5,得目標化合物I-5(90mg,收率43.27%)。1HNMR(300MHz,CDCl3)δ7.70(d,J=8.3Hz,2H),7.45(s,2H),7.42(s.1H),7.26-7.16(m,3H),7.08(m,2H),7.02(s,1H),6.89(s,1H),5.33(s,2H),5.12(s,2H),3.81(s,2H), 2.44(s,3H).13CNMR(75MHz,CDCl3)δ164.17,160.90,156.95,146.35,133.99,131.95,129.41,129.29,127.68,127.48,125.64,125.36,120.65,119.60,115.64,115.36,107.20,69.39,49.60,47.79,36.10.實施例101-{1-{[6-(4-甲基苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-6)的製備反應步驟參照實施例1-5,得目標化合物I-6(67mg,收率58.44%)。1HNMR(300MHz,CDCl3)δ7.68(dd,J=8.4,4.6Hz,2H),7.45(s,1H),7.37(d,J=7.8Hz,2H),7.23(m,5H),7.01(s,1H),6.89(s,1H),5.32(s,2H),5.13(s,2H),3.80(s,2H),2.44(s,3H),2.37(s,3H).13CNMR(75MHz,CDCl3)δ157.63,146.76,143.78,138.26,134.47,134.10,132.18,129.71,129.23,128.10,128.06,127.90,126.05,125.67,121.07,120.18,107.58,70.45,50.06,48.21,36.52,21.57.實施例111-{1-{[6-(4-氯苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-7)的製備反應步驟參照實施例1-5,得目標化合物I-7(220mg,收率75.55%)。1HNMR(300MHz,CDCl3)δ7.70(d,J=8.3Hz,2H),7.46(s,1H),7.39(m,4H),7.21(m,3H),7.02(s,1H),6.90(s,1H),5.35(s,2H),5.15(s,2H),3.82(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ156.85,146.23,135.23,133.96,133.85,131.96,129.44,128.92,128.77,128.65,127.69,127.52,125.64,125.37,120.68,119.55,107.23,69.28,49.62,47.74,36.06.實施例121-{1-{[6-(4-硝基苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-8)的製備反應步驟參照實施例1-5,得目標化合物I-8(60mg,收率55.81%)。1HNMR(300MHz,CDCl3)δ8.28(d,J=8.5Hz,2H),7.70(dd,J=19.8,8.8Hz,4H),7.32-7.11(m,4H),7.03(s,1H),6.91(s,1H),5.36(s,2H),5.30(s,2H),3.83(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ148.64,146.74,136.48,134.76,132.28,130.34,130.21,130.06,129.80,128.27,128.10,126.45,123.32,122.65,121.94,117.18,109.91,71.32,52.24,50.13,38.57.實施例131-{1-{[6-(4-溴苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-9)的製備反應步驟參照實施例1-5,得目標化合物I-9(105mg,收率53.14%)。1HNMR(300MHz,CDCl3)δ7.68(d,J=8.6Hz,2H),7.52(d,J=8.1Hz,2H),7.45(s,1H),7.34(d,J=8.1Hz,2H),7.28-7.18(m,2H),7.17(s,1H),7.01(s,1H),6.85(d,J=17.8Hz,1H),5.33(s,2H),5.22-5.02(m,2H),3.75(d,J=33.2Hz,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ157.25,146.71,136.18,134.37,132.43,132.15,129.87,129.48,129.35,128.10,127.96,126.06,125.80,122.37,121.08,119.96,107.67,69.72,50.03,48.22,36.50.實施例141-{1-{[6-(萘-2-基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-10)的製備反應步驟參照實施例1-5,得目標化合物I-10(50mg,收率65.57%)。1HNMR(300MHz,CDCl3)δ7.95(s,1H),7.87(m,3H),7.72(d,J=8.6Hz,2H),7.60(d,J=8.5Hz,1H),7.56-7.48(m,2H),7.47(s,1H),7.03(s,1H),6.90(s,1H),5.36(s,2H),5.34(s,2H),3.82(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ157.16,146.28,134.20,134.04,133.32,133.12,131.82,129.39,128.89,128.43,127.93,127.73,127.65,127.47,126.37,126.27,126.11,125.65,125.30,125.24,120.67,119.71,107.32,61.62,49.64,47.70,36.06.實施例151-{1-[(6-異丁基氧基萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-11)的製備反應步驟參照實施例1-5,得目標化合物I-11(66mg,收率56.90%)。1HNMR(300MHz,CDCl3)δ7.69(t,J=8.2Hz,2H),7.47(d,J=11.2Hz,1H),7.27-7.08(m,2H),7.02(s,1H),6.90(s,1H),5.33(s,2H),3.85(d,J=6.5Hz,2H),3.81(s,2H),2.44(s,3H),2.20(dd,J=15.8,9.2Hz,1H),2.12(s,1H),1.08(d,J=6.7Hz,6H).13CNMR(75MHz,CDCl3)δ157.62,146.42,134.14,131.51,129.16,128.61,127.56,127.47,125.62,125.19,120.66,119.71,106.52,77.45,77.03,76.61,74.48,49.64,47.86,36.16,28.24,19.29.實施例161-[(6-苄氧基萘-2-基)甲基]-2-丙基-1H-咪唑(I-12)的製備反應步驟參照實施例1-4,得目標化合物I-12(60mg,收率53.47%)。1HNMR(300MHz,CDCl3)δ7.70(dd,J=8.6,5.1Hz,2H),7.52-7.13(m,9H),7.01(d,J=1.2Hz,1H),6.85(d,J=1.3Hz,1H),5.18(s,4H),2.67-2.59(m,2H),1.82-1.69(m,2H),0.95(t,J=7.4Hz,3H).13CNMR(75MHz,CDCl3)δ157.14,148.62,136.71,134.02,131.77,130.93,129.36,128.86,128.65,128.09,127.74,127.55,127.30,125.38,125.02,119.76,107.14,70.09,49.53,28.84,21.31,13.95.實施例171-[(6-苄氧基萘-2-基)甲基]-2-異丙基-1H-咪唑(I-13)的製備反應步驟參照實施例1-4,得目標化合物I-13(50mg,收率65.57%)。1HNMR(300MHz,CDCl3)δ7.69(dd,J=8.2,6.2Hz,2H),7.50-7.10(m,9H),7.03-6.77(m,2H),5.20(s,2H),5.17(s,2H),3.02(tt,J=13.5,6.9Hz,1H),1.28(d,J=6.8Hz,6H).13CNMR(75MHz,CDCl3)δ136.65,133.95,131.85,129.26,128.54,127.98,127.64,127.43,127.26,127.14,125.80,125.24,124.85,119.67,119.49,115.46,107.13,70.02,49.21,25.96,21.73.實施例181-[(6-苄氧基萘-2-基)甲基]-2-羥甲基-1H-咪唑(I-14)的製備將1-[(6-苄氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(100mg,0.29mmol)溶於乾燥甲醇(5ml),加入乾燥硼氫化鈉固體(17mg,0.44mmol),室溫攪拌至反應完全。將溶劑蒸乾,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後可作為I-14粗品直接投入下步反應(160mg,粗品收率113.62%),矽膠柱層析可得到目標化合物純品。1HNMR(300MHz,DMSO)δ7.78(dd,J=8.7,2.8Hz,1H),7.67(s,1H),7.50(d,J=6.9Hz,1H),7.46-7.29(m,2H),7.24(dd,J=9.0,2.4Hz,0H),7.16(s,0H),6.85(s,0H),5.74(s,1H),5.37(s,2H),5.21(s,2H),4.51(s,2H).13CNMR(75MHz,DMSO)δ156.88,147.59,137.31,134.03,133.11,129.71,128.83,128.74,128.27,128.17,127.62,126.91,126.49,126.35,121.47,119.60,107.64,69.74,56.09,49.19.實施例191-[(6-甲氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(V-a)的製備參考實施列四,將6-甲氧基-2-溴甲基-萘、2-甲醛咪唑,碳酸鉀加入乾燥DMF中,80℃下攪拌至反應完全。加水淬滅反應,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析將目標化合物粗品V-a(500mg,粗品收率32.58%)。實施例20N-苄基-1-{1-[(6-甲氧基萘-2-基)甲基]-1H-咪唑-2-基}甲胺(I-15)的製備1-[(6-甲氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(100mg,0.38mmol)溶於乾燥甲醇,滴加苄胺(44.26mg),加入過量乾燥無水硫酸鈉作為附水劑,室溫攪拌過夜;濾去硫酸鈉固體,反應液中加入乾燥硼氫化鈉固體(7.1mg),室溫攪拌至反應完全。將溶劑蒸乾,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得目標化合物16(120mg,收率89.40%)1HNMR(300MHz,CDCl3)δ7.66(dd,J=14.4,8.7Hz,2H),7.39(s,1H),7.35-7.05(m,8H),7.01(s,1H),6.90(s,1H),5.29(s,2H),3.91(s,3H),3.84(s,2H),3.79(s,2H),3.46(m,1H).13CNMR(75MHz,CDCl3)δ157.97,146.46,139.83,134.07,131.72,129.28,128.70,128.55,128.36,128.22,127.58,127.44,127.11,127.01,125.71,125.35,120.72,119.32,105.72,55.31,53.45,49.65,45.31.實施例21N-甲基-1-{1-[(6-甲氧基萘-2-基)甲基]-1H-咪唑-2-基}甲胺(I-16)的製備反應步驟參照實施例20,得目標化合物17(80mg,收率75.72%)。1HNMR(300MHz,CDCl3)δ7.69(dd,J=12.6,8.7Hz,2H),7.44(s,1H),7.20(dd,J=8.5,1.3Hz,1H),7.16(dd,J=8.9,2.4Hz,1H),7.12(s,1H),7.00(s,1H),6.89(s,1H),5.33(s,2H),3.91(s,3H),3.80(s,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ157.99,145.83,134.09,131.60,129.26,128.70,127.64,127.53,125.66,125.28,120.80,119.37,105.71,55.30,49.68,47.48,35.86.實施例22N-乙基-1-{1-[(6-甲氧基萘-2-基)甲基]-1H-咪唑-2-基}甲胺(I-17)的製備反應步驟參照實施例20,得目標化合物I-17(100mg,收率90.15%)。1HNMR(300MHz,CDCl3)δ7.69(dd,J=13.5,8.7Hz,2H),7.46(s,1H),7.29-7.10(m,3H),7.01(s,1H),6.90(s,1H),5.34(s,2H),3.92(s,3H),3.84(s,2H),2.66(q,J=7.1Hz,2H),1.08(t,J=7.1Hz,3H).13CNMR(75MHz,CDCl3)δ157.96,146.74,134.06,131.77,129.25,128.71,127.59,127.45,125.62,125.30,120.57,119.35,105.70,55.29,49.60,45.86,43.84,15.11.實施例23N-異丁基-1-{1-[(6-甲氧基萘-2-基)甲基]-1H-咪唑-2-基}甲胺(I-18)的製備反應步驟參照實施例20,得目標化合物I-18(86mg,收率70.81%)。1HNMR(300MHz,CDCl3)δ7.68(dd,J=12.7,8.8Hz,2H),7.45(s,1H),7.29-7.07(m,3H),6.99(s,1H),6.88(s,1H),5.35(s,2H),3.90(s,3H),3.83(s,2H),3.45(s,1H),2.42(d,J=6.7Hz,2H),1.70(dt,J=13.2,6.6Hz,1H),0.87(d,J=6.6Hz,6H).13CNMR(75MHz,CDCl3)δ157.96,146.50,134.07,131.75,129.24,128.71,127.59,127.35,125.68,125.36,120.70,119.33,105.71,77.45,77.03,76.60,57.62,55.29,49.66,46.22,28.26,20.58.實施例246-{[2-(甲氨基甲基)-1H-咪唑-1-基]甲基}萘-2-酚(I-19)的製備將化合物I-16(35mg)溶於2mlDCM中,於-20度加入三溴化磷(4M,2ml),完成後緩慢升至室溫,室溫攪拌3.5h,將反應液倒入冰水中,用碳酸氫鈉中和至中性,EA∶THF=1∶1萃取,無水硫酸鈉乾燥,矽膠層析柱純化的目標化合物I-19(32mg,收率91.4%)。1HNMR(300MHz,CDCl3)δ7.69(dd,J=12.6,8.7Hz,1H),7.44(s,0H),7.20(dd,J=8.5,1.3Hz,1H),7.16(dd,J=8.9,2.4Hz,0H),7.12(s,0H),7.00(s,1H),6.89(s,0H),5.33(s,1H),3.91(s,2H),3.80(s,1H),2.43(s,2H).實施例251-[(6-苄氧基萘-2-基)甲基]-3-(2-噻吩基)-1H-吡唑-5-甲酸乙酯(I-20)的製備反應步驟參照實施例1-4,得目標化合物I-20(20mg,收率27.9%)。1HNMR(300MHz,CDCl3)δ7.79-7.17(m,14H),7.08(s,1H),5.92(s,2H),5.17(s,2H),4.33(dd,J=13.9,6.9Hz,2H),1.36(t,J=6.9Hz,3H).13CNMR(75MHz,CDCl3)δ159.41,156.88,145.64,136.83,135.72,133.96,133.35,132.34,129.53,128.82,128.57,127.97,127.50,127.12,126.35,126.06,124.89,124.07,119.24,108.43,107.08,77.41,76.99,76.56,70.01,61.13,55.14,14.15.實施例261-[(6-苄氧基萘-2-基)甲基]-2,4,5-三溴-1H-咪唑(I-21)的製備反應步驟參照實施例1-4,得目標化合物I-21(35mg,收率41.56%)。1HNMR(300MHz,CDCl3)δ7.73(d,J=8.6Hz,2H),7.57-7.17(m,9H),5.34(s,2H),5.20(s,2H).13CNMR(75MHz,CDCl3)δ157.31,136.63,134.18,129.44,129.19,128.69,128.60,128.05,127.80,127.48,125.92,124.78,119.89,118.70,117.12,107.12,105.67,70.07,51.42.實施例271-[(6-苄氧基萘-2-基)甲基]-2-異丁基-1H-1,2,4-三氮唑-2-甲酸甲酯(I-22)的製備反應步驟參照實施例1-4,得目標化合物I-22(18mg,收率31.55%)。1HNMR(300MHz,CDCl3)δ8.10(s,1H),7.77(s,1H),7.73(d,J=4.1Hz,2H),7.53-7.29(m,7H),7.28(s,1H),7.24(s,1H),5.55(s,2H),5.20(s,2H),4.02(s,3H).13CNMR(75MHz,CDCl3)δ157.57,144.36,136.57,134.55,130.85,129.50,128.80,128.75,128.62,128.48,128.15,128.09,127.75,127.50,125.92,120.07,107.14,70.10,54.75,52.72.實施例281-[(6-苄氧基萘-2-基)甲基]-3,4,5-三溴-1H-吡唑(I-23)的製備反應步驟參照實施例1-4,得目標化合物I-23(47mg,收率55.82%)。1HNMR(300MHz,CDCl3)δ7.83-7.64(m,3H),7.56-7.31(m,6H),7.28-7.20(m,2H),5.49(s,2H),5.19(s,2H).13CNMR(75MHz,CDCl3)δ157.26,136.69,134.28,130.86,129.93, 129.52,128.72,128.60,128.29,128.04,127.64,127.50,126.92,125.72,119.71,116.26,107.12,70.06,56.08.實施例291-[(6-苄氧基萘-2-基)甲基]-3-(4-氯苯基)-1H-吡唑(I-24)的製備反應步驟參照實施例1-4,得目標化合物I-24(15mg,收率23.1%)。1HNMR(300MHz,CDCl3)δ7.75(m,4H),7.67(s,1H),7.50(d,J=7.2Hz,2H),7.41(m,7H),7.26(m,3H),6.56(d,J=2.2Hz,1H),5.48(s,2H),5.20(s,2H).13CNMR(75MHz,CDCl3)δ157.15,151.23,150.44,136.74,134.17,131.51,130.70,129.44,128.85,128.71,128.61,128.04,127.60,127.52,126.97,126.87,126.76,126.11,119.59,107.15,103.28,70.07,56.33.實施例301-[(6-苄氧基萘-2-基)甲基]-2-十二烷基-1H-咪唑(I-25)的製備反應步驟參照實施例1-4,得目標化合物I-25(30mg,收率41.9%)。1HNMR(300MHz,CDCl3)δ7.71(dd,J=8.5,5.2Hz,2H),7.53-7.31(m,7H),7.20(dd,J=19.7,5.9Hz,2H),7.03(s,1H),6.87(s,1H),5.19(s,4H),2.73-2.61(t,2H),1.72(m,J=7.6Hz,2H),1.29-1.20(m,16H),0.90(t,J=6.3Hz,3H).13CNMR(75MHz,CDCl3)δ157.14,148.78,136.70,134.00,132.13,131.74,130.86,129.31,128.81,128.60,128.04,127.70,127.49,127.24,125.38,124.99,119.72,107.13,77.40,76.98,76.56,70.07,49.54,31.86,29.56,29.44,29.39,29.29,27.91,26.90,22.64,14.06.實施例311-{1-[(6-苄氧基萘-2-基)甲基]-2-丁基-4-甲醯基-5-氯-1H-咪唑(I-26)的製備反應步驟參照實施例1-4,得目標化合物I-26(收率41.9%)。1HNMR(300MHz,CDCl3)δ9.78(s,1H),7.68(dd,J=8.6,3.6Hz,2H),7.39(dq,J=19.1,7.1Hz,6H),7.19(dd,J=12.0,7.1Hz,3H),5.67(s,2H),5.17(s,2H),2.73-2.57(m,2H),1.67(dt,J=15.4,7.6Hz,2H),1.33(tt,J=11.4,5.7Hz,2H),0.86(t,J=7.3Hz,3H).13CNMR(75MHz,CDCl3)δ177.98,157.15,154.66,136.69,134.03,130.80,129.33,128.78,128.60,128.04,127.76,127.50,125.08,124.76,124.35,119.75,114.59,107.12,70.07,48.30, 29.18,26.56,22.36,13.58.實施例321-{1-[(6-苄氧基萘-2-基)甲基]-2-丙基-4-甲基-1H-咪唑(I-27)的製備反應步驟參照實施例1-4,得目標化合物I-27(收率48%)。1HNMR(300MHz,CDCl3)δ7.71(d,J=8.5Hz,2H),7.50(d,J=7.2Hz,2H),7.41(dd,J=13.0,5.5Hz,4H),7.26(d,J=11.0Hz,2H),7.18(d,J=8.4Hz,1H),6.56(s,1H),5.19(s,2H),5.11(s,2H),2.73-2.61(m,2H),2.23(s,3H),1.30(d,J=7.5Hz,3H).13CNMR(75MHz,CDCl3)δ157.06,148.94,136.70,136.07,133.95,131.94,129.32,128.83,128.61,128.04,127.63,127.51,125.31,125.06,119.68,116.11,107.09,70.04,49.27,20.19,13.52,12.38.實施例331-[(6-苄氧基萘-2-基)甲基]-2-丙基-1H-咪唑-4,5-二甲酸二乙酯(I-28)的製備反應步驟參照實施例1-4,得目標化合物I-28(23mg,收率30%)。1HNMR(300MHz,CDCl3)δ7.68(dd,J=8.6,4.0Hz,2H),7.40(ddd,J=19.4,16.6,7.2Hz,6H),7.24(dd,J=8.9,2.4Hz,1H),7.21(s,1H),7.14(dd,J=8.5,1.6Hz,1H),5.53(s,2H),5.18(s,2H),4.44-4.35(m,2H),4.22(q,J=7.1Hz,2H),2.74-2.64(m,2H),1.74(dd,J=15.3,7.6Hz,2H),1.40(t,J=7.1Hz,3H),1.18(t,J=7.1Hz,3H),0.93(t,J=7.4Hz,3H).13CNMR(75MHz,CDCl3)δ163.04,160.60,157.11,151.82,136.69,133.96,130.98,129.34,128.77,128.59,128.03,127.69,127.50,124.82,124.53,119.71,107.10,70.05,61.20,48.32,29.12,21.24,14.25,13.83.實施例341-[(6-苄氧基萘-2-基)甲基]-4-甲基-5-甲醯基-1H-咪唑(I-29)的製備反應步驟參照實施例1-4,得目標化合物I-29(收率42%)。1HNMR(300MHz,CDCl3)δ9.86(s,1H),7.72(dd,J=8.6,4.0Hz,2H),7.61(d,J=4.7Hz,2H),7.49(d,J=7.0Hz,2H),7.46-7.28(m,4H),7.27-7.18(m,2H),5.60(s,2H),5.19(s,2H),2.53(s,3H).13CNMR(75MHz,CDCl3)δ178.68,157.19,153.61,144.13,143.22,142.10,142.05,136.67,134.17,130.94,129.46,128.79,128.61,128.04,127.66,127.51,126.69,125.81,119.70,107.06,70.03,50.45,13.34.實施例351-[(6-苄氧基萘-2-基)甲基]-1H-咪唑-4-甲酸乙酯(I-30)的製備反應步驟參照實施例1-4,得目標化合物I-30(40mg,收率67.74%)。1HNMR(300MHz,CDCl3)δ7.82(s,1H),7.76-7.66(m,3H),7.53-7.19(m,8H),5.65(s,2H),5.19(s,2H),4.29(dd,J=14.1,7.1Hz,2H),1.37-1.30(m,3H).13CNMR(75MHz,CDCl3)δ160.27,157.15,142.13,137.92,136.71,134.10,131.39,129.42,128.83,128.59,128.01,127.61,127.48,126.27,125.61,122.75,119.64,107.12,70.05,60.46,50.15,14.20.實施例361-[(6-苄氧基萘-2-基)甲基]-2,3-二氰基-1H-咪唑(I-31)的製備反應步驟參照實施例1-4,得目標化合物I-31(17mg,收率30.53%)。1HNMR(300MHz,DMSO)δ8.55(s,1H),7.89-7.77(m,3H),7.53-7.25(m,8H),5.60(s,2H),5.23(s,2H).13CNMR(75MHz,DMSO)δ157.32,144.06,137.25,134.49,131.93,130.01,129.94,129.09,128.89,128.61,128.34,128.23,128.14,127.48,126.30,119.97,112.82,108.92,107.76,69.81,51.28.實施例371-[(6-苄氧基萘-2-基)甲基]-2-苯基-1H-咪唑(I-32)的製備反應步驟參照實施例1-4,得目標化合物I-32(10mg,收率16.8%)。1HNMR(300MHz,CDCl3)δ7.71(t,J=8.7Hz,2H),7.60(dd,J=6.3,2.7Hz,2H),7.55-7.28(m,10H),7.21(m,3H),7.02(s,1H),5.35(s,2H),5.20(s,2H).13CNMR(75MHz,CDCl3)δ157.15,148.27,136.71,133.99,132.17,131.92,130.57,129.38,128.97,128.89,128.81,128.62,128.55,128.05,127.75,127.50,125.34,124.92,121.30,119.73,107.16,70.08,50.47.實施例381-[(6-苄氧基萘-2-基)甲基]-2-硝基-1H-咪唑(I-33)的製備反應步驟參照實施例1-4,得目標化合物I-33(20mg,收率36.42%)。1HNMR(300MHz,CDCl3)δ7.74(dd,J=8.6,3.2Hz,2H),7.62(s,1H),7.57-7.32(m,5H),7.29(dd,J=8.6,2.2Hz,2H),7.23(d,J=2.0Hz,1H),7.18(s,1H),7.09(s,1H),5.72(s,2H),5.20(s,2H).13CNMR(75MHz,CDCl3)δ157.50,136.58,134.43,130.86,129.49,129.22,128.75,128.62,128.41,128.07,127.50,127.13,125.73,125.60,120.03,114.57,107.13,70.09,53.55.實施例391-[(6-苄氧基萘-2-基)甲基]-2-甲醯基-1H-吡咯(I-34)的製備反應步驟參照實施例1-4,得目標化合物I-34(收率52.3%)。1HNMR(300MHz,CDCl3)δ9.59(d,J=0.8Hz,1H),7.73-7.64(m,2H),7.57-7.46(m,3H),7.46-7.28(m,4H),7.25-7.17(m,2H),7.04-6.95(m,2H),6.32-6.23(m,1H),5.70(s,2H),5.18(s,2H).13CNMR(75MHz,DMSO)δ179.95,156.79,137.34,134.11,133.94,132.77,131.52,130.07,129.71,128.86,128.72,128.64,128.30,128.21,127.50,126.17,125.82,124.83,119.56,110.43,107.66,69.75,51.31.實施例401-{1-[(6-苄氧基萘-2-基)甲基]-1H-吡咯-2-基}-N-甲基甲胺(I-35)的製備反應步驟參照實施例5,得目標化合物I-35(收率74%)。1HNMR(300MHz,CDCl3)δ7.67(d,J=8.5Hz,2H),7.49(d,J=7.1Hz,1H),7.40(dd,J=18.2,8.4Hz,4H),7.19(dd,J=18.5,9.5Hz,3H),6.73(s,1H),6.27(s,1H),6.15(s,1H),5.37(s,2H),5.18(s,2H),4.40-4.25(m,1H),3.76(s,2H),2.40(s,3H).13CNMR(75MHz,CDCl3)δ156.91,136.76,133.84,133.39,129.33,128.90,128.57,127.98,127.49,126.66,125.10,125.02,123.36,119.46,110.99,107.46,107.10,70.02,50.77,45.59,33.74.實施例411-[(6-苄氧基萘-2-基)甲基]-4-甲醯基-1H-咪唑(I-36)的製備反應步驟參照實施例1-4,得目標化合物I-36(收率30%)。1HNMR(300MHz,CDCl3)δ9.87(s,1H),7.77-7.68(m,2H),7.68-7.57(m,3H),7.48(d,J=7.1Hz,2H),7.45-7.31(m,3H),7.29(d,J=2.4Hz,1H),7.23(dd,J=5.7,2.1Hz,2H),5.27(s,2H), 5.18(s,2H).13CNMR(75MHz,CDCl3)δ186.17,157.52,138.82,136.54,134.43,130.89,129.53,129.42,129.42,128.81,128.64,128.64,128.22,128.22,128.11,128.11,127.53,127.53,126.96,125.45,124.60,120.13,107.12,70.09,51.68.實施例421-{1-[(1-溴代萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-37)的製備反應步驟參照實施例2-5。得目標化合物I-37(收率85.90%)。1HNMR(300MHz,CDCl3)δ8.34(d,J=8.4Hz,1H),7.77(2H),7.59(2H),7.04(s,1H),6.89(s,1H),6.80(d,J=8.4Hz,1H),5.53(s,2H),3.79(s,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ146.73,133.96,133.91,132.18,128.43,128.18,127.92,127.86,127.13,126.93,124.70,122.64,120.67,50.49,47.88,36.20.實施例431-(6-甲氧基萘-2-基)-2-(2-異丙基-1H-咪唑-1-基)-乙醇(I-38)的製備a.反應步驟參照實施例4。得化合物2-(2-異丙基-1H-咪唑-1-基)-1-(6-甲氧基萘酚-2-基)-乙酮(收率47.07%)。b.將2-(2-異丙基-1H-咪唑-1-基)-1-(6-甲氧基萘酚-2-基)-乙酮(20mg,0.065mmol)溶於乾燥甲醇(5ml),加入乾燥硼氫化鈉固體(5mg,0.13mmol),室溫攪拌至反應完全。將溶劑蒸乾,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得目標化合物I-38(20mg,收率99.35%)。1HNMR(300MHz,CDCl3)δ7.78-7.66(m,3H),7.34(d,1H),7.21-7.10(m,2H),7.01(s,1H),6.92(5,1H),5.33(s,1H),5.10(s,2H),4.19(s,2H),2.97-2.88(m,1H),1.25(d,6H).實施例441-[1-(萘-1-基甲基)1H-咪唑-2-基]-N-甲基甲胺(I-39)的製備反應步驟參照實施例2-5。得目標化合物I-39(收率50.14%)。1HNMR(300MHz,CDCl3)δ7.94(s,2H),7.83(d,J=8.4Hz,1H),7.55(d,J=9.2Hz,2H),7.40(t,J=7.6Hz,1H),6.99(s,1H),6.90(d,J=7.1Hz,1H),6.78(s,1H),5.70(s,2H),3.83(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ146.51,133.61,132.00,130.58,128.90,128.68,127.45,126.74,126.13,125.47,124.77,122.51,120.64.47.94,47.36,36.22.實施例451-{1-{[6-(吡啶-4-基甲氧基)萘-2-基]甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-40)的製備反應步驟參照實施例1-5。得目標化合物I-40(收率25.89%)。1HNMR(300MHz,CDCl3)δ8.62(d,J=6.0Hz,2H),7.69(t,J=9.1Hz,2H),7.44(s,1H),7.39(d,2H),7.26-7.17(m,2H),7.13(d,1H),7.00(s,1H),6.89(s,1H),5.34(s,2H),5.19(s,2H),3.80(s,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ150.02,146.11,145.88,133.86,132.16,129.62,129.03,127.70,127.56,127.53,125.62,125.46,121.46,120.72,119.33,107.24,68.17,49.60,47.66,36.02.實施例461-{1-{[6-(1,1-二苯基甲氧基)萘-2-基]甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-41)的製備反應步驟參照實施例1-5。得目標化合物I-41(收率82.05%)。1HNMR(300MHz,CDCl3)δ7.66(d,J=9.0Hz,1H),7.58(d,J=8.5Hz,1H),7.47(d,J=7.1Hz,3H),7.41(s,1H),7.31(dddd,J=9.7,7.3,5.6,1.6Hz,7H),7.20(d,J=2.2Hz,1H),7.14(dd,J=6.7,1.8Hz,2H),7.00(s,1H),6.86(s,1H),6.36(s,1H),5.30(s,2H),3.79(s,2H),2.43(s,3H),2.19(s,2H).13CNMR(75MHz,CDCl3)δ156.30,146.08,140.98,133.85,131.80,129.26,128.79,128.63,128.41,128.10,127.81,127.76,127.67,127.49,126.85,125.89,125.52,125.12,120.67,120.08,109.40,81.86,49.61,47.65,36.00.實施例47(E)-1-{1-{[6-(肉桂氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-42)的製備反應步驟參照實施例1-5。得目標化合物I-42(收率48.04%)。1HNMR(300MHz,CDCl3)δ7.71(dd,J=8.6,5.2Hz,2H),7.45(d,J=11.1Hz,3H),7.38-7.21(m,5H),7.03(s,1H),6.91(s,1H),6.80(d,J=16.0Hz,1H),6.48(dt,J=16.0,5.7Hz,1H),5.30(s,2H),4.82(d,J=5.7Hz,2H),3.82(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ134.02,133.22,131.79,129.34,128.80,128.57,127.93,127.66,126.55,125.62,125.28,124.11,120.67,119.62,107.05,68.67,49.62,47.79,36.09,29.65.實施例481-{1-[(6-苯磺醯氧基萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-43)的製備反應步驟參照實施例1-5。得目標化合物I-43(收率63.20%)。1HNMR(300MHz,CDCl3)δ7.76(d,J=7.5Hz,2H),7.65-7.55(m,3H),7.43(t,J=7.7Hz,2H),7.36(s,2H),7.19(d,J=5.8Hz,1H),7.00(dd,J=8.9,2.2Hz,1H),6.93(s,1H),6.80(s,1H),5.30(s,2H),3.70(s,2H),2.34(s,3H).13CNMR(75MHz,CDCl3)δ147.39,146.24,135.40,134.96,134.27,132.87,131.77,129.67,129.16,128.74,128.47,127.73,125.78,125.41,121.78,120.67,119.85,49.46,47.82,36.08.實施例491-{1-{[6-(1-苯甲醯基)甲氧基萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-44)的製備a.將6-羥基-萘-2-醛(I)(200mg,1.16mmol)溶解於乾燥甲醇(5ml)中,加入乾燥硼氫化鈉(89mg,2.32mmol),室溫下攪拌2h至反應完全。將溶劑蒸乾,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得6-羥甲基-2-萘酚粗品,直接投入下步反應。(200mg,粗品收率98.84%)b.將6-羥甲基-2-萘酚粗品(200mg,1.15mmol)、碳酸鉀(317mg,2.3mmol)、1-溴苯乙酮(343mg,1.72mmol)溶於乾燥DMF,80℃下攪拌至反應完全,升至室溫,加水淬滅,乙酸乙酯萃取,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得2-[(6-羥甲基萘酚-2-基)氧基]-1-苯基-乙基酮粗品,直接投入下步反應。(304mg,粗品收率90.58%)c.將2-[(6-羥甲基萘酚-2-基)氧基]-1-苯基-乙基酮(300mg,1.03mmol),三苯基膦(808mg,3.08mmol)溶於乾燥二氯甲烷中,0℃冰浴下滴加四溴化碳(1.02g,3.08mmol)的二氯甲烷溶液,自然升溫至室溫攪拌2h。加水淬滅,二氯甲烷萃取,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得2-[(6-溴甲基萘酚-2-基)氧基]-1-苯基-乙基酮粗品,直接投入下步反應。(142mg,粗品收率42.24%)d.反應步驟參照實施例4-5。得目標化合物I-44(收率48.04%)。1HNMR(300MHz,CDCl3)δ8.03(d,J=7.4Hz,2H),7.72-7.59(m,3H),7.51(t,J=7.6Hz,2H),7.38(s,1H),7.27(dd,J=8.9,2.3Hz,1H),7.12(dd,J=14.0,5.3Hz,2H),7.02(s,1H),6.81(s,1H),5.38(s,2H),5.20(s,2H),3.01(dq,J=20.5,6.9Hz,1H),1.26(d,J=6.8Hz, 6H).13CNMR(75MHz,DMSO)δ156.50,152.59,134.86,134.24,133.89,133.05,129.69,129.28,128.80,128.34,127.75,126.00,125.88,125.27,120.85,119.44,114.56,107.80,70.71,49.11,25.50,22.11.實施例501-{1-[(6-苄硫基萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-45)的製備a.6-溴-2-萘酸(500mg,1.99mmol)溶於20ml乾燥甲醇中,滴加1ml濃硫酸,80℃下加熱回流2h至反應完全。將溶劑蒸乾,飽和NaHCO3中和後,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得6-溴-2-萘酸甲酯粗品,直接投入下步反應。(520mg,粗品收率98.50%)b.將6-溴-2-萘酸甲酯(265mg,1mmol),二異丙基乙基胺(259mg,350μl,2mmol)溶於5ml無水二氧六環,滴加苯硫醇(248mg,235μl,2mmol)後,加入Pd2(dba)3(46mg,5%),Xantphos(58mg,5%),在氬氣保護下,105℃下加熱回流16h至反應完全。將溶劑蒸乾,用乙酸乙酯萃取,合併有機層,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得6-苄硫基-2-萘酸甲酯粗品,直接投入下步反應。(300mg,粗品收率97.32%)c.將6-苄硫基-2-萘酸甲酯(600mg,1.95mmol)溶於8ml乾燥四氫呋喃中,0℃冰浴下加入四氫鋁鋰固體(148mg,3.89mmol),自然升溫至室溫攪拌2h。加水淬滅,二氯甲烷萃取,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得(6-苄硫基萘-2-基)甲醇粗品,直接投入下步反應。(337mg,粗品收率61.78%)d.將(6-苄硫基萘-2-基)甲醇(337mg,1.2mmol),三苯基膦(946mg,3.61mmol)溶於乾燥二氯甲烷中,0℃冰浴下滴加四溴化碳(1.20g,3.61mmol)的二氯甲烷溶液,自然升溫至室溫攪拌2h。加水淬滅,二氯甲烷萃取,飽和食鹽水洗滌,無水硫酸鈉乾燥。蒸乾後矽膠柱層析得苄基[(6-溴甲基)萘2-基]硫醚粗品,直接投入下步反應。(270mg,粗品收率65.44%)e.反應步驟參照實施例3-5。得目標化合物I-45(收率71.98%)。1HNMR(300MHz,CDCl3)δ7.62-7.54(m,3H),7.32(m,2H),7.26-7.10(m,6H),6.94(s,1H),6.82(s,1H),5.27(s,2H),4.13(s,2H),3.72(s,2H),2.35(s,3H).13CNMR(75MHz,CDCl3)δ146.30,134.71,133.95,133.14,131.67,128.79,128.52,128.35,128.24,128.15,128.02,127.62,127.26,127.17,125.48,125.32,120.72,49.60,47.81,38.73,36.10.實施例511-[(6-苄氧基萘-2-基)甲基]-1H-吡咯-2-甲酸甲酯(I-46)的製備反應步驟參照實施例1-4。得目標化合物I-46(收率38.9%)。1HNMR(300MHz,CDCl3)δ7.80-7.66(m,3H),7.50-7.23(m,9H),7.04(dd,J=3.8,1.6Hz,1H),6.93(s,1H),5.69(s,2H),5.18(s,2H),3.78(s,3H).實施例523′-((6-(苄氧基)萘-2-基)甲基)-1,7′-二甲基-2′-丙基-1H,3′H-2,5′-而苯丙[d]咪唑(I-47)的製備反應步驟參照實施例1-4。得目標化合物I-47(收率47.0%)。1HNMR(300MHz,CDCl3)δ7.83-7.72(m,1H),7.70-7.59(m,2H),7.52-7.10(m,14H),5.50(s,2H),5.14(s,2H),3.65(s,3H),3.00-2.87(m,2H),2.78(s,3H),1.85(dt,J=14.9,7.5Hz,2H),1.03(t,J=7.3Hz,3H).實施例53藥用組合物的製備:片劑將化合物I-1(1g)與乳糖(23g)和微晶纖維素(5.7g)用混合機混合。用滾軸壓緊機將所得混合物壓製成型,值得薄片狀壓制物料。用錘式粉碎機將所述薄片狀壓制物料研磨成粉,使所得粉狀物料通過20目篩過篩。將一份輕質二氧化矽(0.3g)和硬脂酸鎂(0.3g)加入到已過篩的物料中,並混合。所得混合產物用製片機壓片,製備片劑。實施例54藥用組合物的製備:明膠膠囊劑將化合物I-1(1g)與微晶纖維素(0.35g)和乳糖(0.15g)用水制粒,然後將該顆粒與鉸鏈羧甲基纖維素鈉(0.04g)和硬脂酸鎂(0.01g)混合。所得混合產物填充明膠膠囊,製備明膠膠囊劑。當前第1頁1 2 3 
