利用亞甲基藍與G‑四鏈體的結合進行電化學檢測端粒酶活性的方法與流程
2023-12-03 22:32:56 6
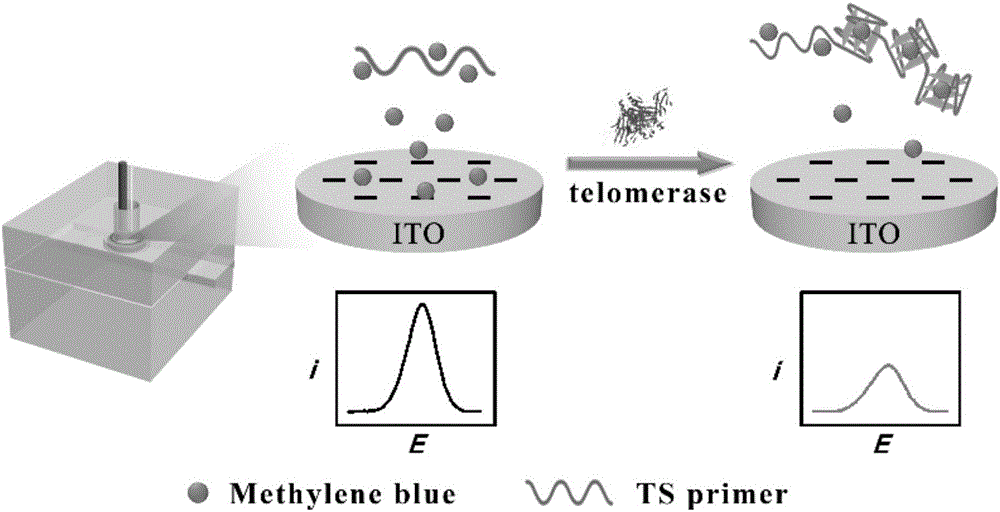
本發明屬於生物傳感技術領域,具體涉及利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的方法。
背景技術:
近半個世紀以來,肺癌的發病率及死亡率均在逐年增加。世界衛生組織定期公布的資料顯示,肺癌的發病率和死亡率在世界各國均呈明顯上升的趨勢,發達國家更為明顯。世界各國都投入大量的人力物力研究肺癌的早期檢測和治療。端粒酶與人類惡性腫瘤之間的緊密聯繫使它成為目前已知的最為廣泛的腫瘤分子標記物之一,端粒酶的檢測對癌症的早期發現、發展和預後有重大意義。
端粒酶是合成染色體末端的端粒的酶。端粒(telomere)是真核細胞染色體的天然末端,由上千個6鹼基重複序列(TTAGGG)組成,是細胞必需的遺傳組分。它的作用是維持端粒有足夠的長度,保證基因信息在複製過程中的準確性,以防止染色體末端遺傳信息的丟失。在正常情況下,每個細胞分裂周期都會使端粒變的越來越短,當端粒短到一定程度時就會發出信號,細胞停止分裂。端粒酶由RNA和蛋白質亞基組成,是基本的核蛋白逆轉錄酶,在細胞染色體複製過程中,能夠以自身RNA為模板,在染色體3』末端合成重複序列,維持端粒的長度。端粒酶在正常體細胞中的活性被抑制,但是大量的資料表明在一些惡性腫瘤中的表達高達85%。由於端粒酶特異地表達於各種腫瘤細胞,並且是大多數腫瘤細胞持續分裂所必需的。因此,端粒酶活性是診斷多數惡性腫瘤、判斷愈後的良好指標。
傳統的端粒酶活性檢測方法主要有端粒重複序列延伸法、端粒重複序列擴增法(TRAP)、螢光實時定量法(RT-PCR)。此方法系最早建立的方法,穩定性好,特異性高;缺點是需要樣品量較大,靈敏性差,檢測時間長,不適合臨床標本的大量檢測,另外在實驗中同位素的用量較大,對試驗人員的身體有危害。TRAP分析法能夠實現高通量高靈敏度的檢測,無疑是一個功能強大的測定方法,但保留著PCR放大技術帶來的缺點。此外,TRAP法需要使用昂貴的設備和試劑,相當耗時。再加上抑制端粒酶活性已被提議作為人類癌症治療的潛在方法,而TRAP在篩選有效的端粒酶抑制劑如G-四聯體配體時易受PCR派生產物的影響,因此,該方法存在很多局限性。螢光實時定量法(RT-PCR)測定端粒酶催化亞單位(hTERT)mRNA,具有靈敏度高、準確性好的優點,但由於檢測手段繁瑣,需要精密儀器,成本較高,限制了其在臨床上的應用。近年來,為替代傳統的TRAP分析法,研究者們已經開發了許多PCR-free分析方法並將之應用到端粒酶活性的檢測中,例如光學傳感器、表面等離子共振、電致化學發光、電化學檢測和指數等溫擴增分析等,然而,上述大多數策略因為端粒酶引物的固定化、成本高、靈敏度低和操作複雜等問題在應用時或多或少受到了限制。此外,當前的大多數檢測方法都使用細胞提取物來分析端粒酶活性,於臨床應用較為不符,而能夠實現原位分析和動態監測細胞內端粒酶活性的檢測方法則鳳毛麟角。端粒酶活性的檢測對癌症的早期診斷具有重要的生物學意義,對臨床上癌症的預警和治療這一複雜科學問題的研究起到促進作用。因此,對端粒酶活性分析的簡單、靈敏、低成本的原位實時監測和抑制劑篩查技術仍然是當前亟待解決的問題。
技術實現要素:
發明目的:本發明所要解決的技術問題是提供了一種利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的方法。本發明中針對端粒酶作用於端粒酶引物產生G-四鏈體,G-四鏈體與亞甲基藍的結合降低了溶液中自由存在的亞甲基藍的濃度,通過由此引發的電化學信號的變化測定端粒酶活性,它具有方便快捷、靈敏度高、準確性好、無標記等優點。
技術方案:為了解決上述技術問題,本發明所採用的技術方案為:一種利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的方法,包括以下步驟:
1)細胞的培養以及端粒酶的提取得到裂解後的細胞溶液;
2)在含有端粒酶引物的緩衝溶液中加入裂解後的細胞溶液進行擴增得到重複的富G序列,在鉀離子的存在下得到含有G-四鏈體的擴增溶液;
3)在含有G-四鏈體的擴增溶液中加入亞甲基藍使其與G-四鏈體結合得到溶液;
4)利用差分脈衝伏安法(DPV)對溶液中的亞甲基藍進行檢測。
其中,上述步驟1)的細胞為HeLa細胞。
其中,上述步驟2)的具體步驟如下:在45μL含有0.1~2μM端粒酶引物的端粒酶緩衝溶液中加入5μL裂解後的HeLa細胞,在30~37℃下進行擴增反應1~4小時,並在鉀離子的存在下形成G-四鏈體的擴增溶液。
其中,上述步驟2)的緩衝溶液為含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始濃度為1.5mM,KCl初始濃度為63mM,Tween 20初始濃度為0.005%(v/v),EGTA初始濃度為1mM,dNTPs初始濃度為1~2mM。
其中,上述步驟2)中所述的端粒酶引物序列為5』-AAT CCG TCG AGC AGA GTT-3』,此為端粒酶進行擴增的特異性識別序列。
其中,上述步驟3)的亞甲基藍的加入量為50μL,濃度為1~10mM。
其中,上述步驟4)的差分脈衝伏安法的步驟是通過三電極體系進行檢測,具體步驟如下:首先,將ITO電極依次浸泡在丙酮,乙醇和超純水中,並分別超聲15~20分鐘進行清洗;之後,將清洗後的ITO電極浸泡在1mM NaOH中進行修飾;4~6小時後,將完成修飾的ITO電極放入超純水中超聲清洗15~20分鐘,得到了表面帶有負電荷的ITO工作電極;然後將表面帶有負電荷的ITO工作電極放入電解池下半部分的凹槽內,之後,將帶有直徑為6mm孔的電解池上半部分固定在工作電極上方,在他們之間放入O型密封圈防止漏液,在直徑為6mm的孔中加入步驟3)得到的溶液,將一根鉑絲作為對電極,銀/氯化銀電極作為參比電極插入溶液中,與工作電極形成三電極體系並通過DPV法進行電化學檢測。
其中,上述HeLa細胞在端粒酶緩衝溶液中的數量為10~10000個細胞。
有益效果:與現有技術相比,本發明具有如下的特色及優點:
1)本發明沒有複雜的電極修飾過程,操作簡單,避免了因電極修飾而來帶的繁瑣以及耗時長的缺點。
(2)本發明無需標記DNA,可避免現有技術中對DNA進行標記而導致檢測成本高的缺點。
(3)本發明利用端粒酶對其引物的特異性識別進行擴增延伸,可以提高該方法的特異性。
(4)電化學生物傳感器具有高靈敏度、高兼容性和成本低廉等優點,降低了實驗的檢測限。
(5)該方法可用於實際樣品的檢測,具有一定的臨床意義。
附圖說明
圖1顯示了利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的方法的流程圖。
圖2顯示了端粒酶活性檢測實驗驗證圖。a:只存在亞甲基藍時的DPV曲線;b:加入了端粒酶引物並與亞甲基藍結合產生的DPV曲線;c:端粒酶引物與端粒酶進行擴增並形成G-四鏈體後與亞甲基藍結合產生的DPV曲線。
圖3顯示了定量檢測端粒酶活性的DPV曲線。圖3A:在不同量的HeLa細胞作用下,得到的DPV曲線(HeLa細胞的個數:(a)0、(b)10、(c)50、(d)100、(e)200、(f)500、(g)1000、(h)2000、(i)5000、(j)10000);圖3B:DPV電流峰值降低值與細胞個數的標準曲線圖;插圖:DPV電流峰值降低值與細胞個數的對數的線性關係。
圖4為不同細胞中的端粒酶活性,端粒酶的特異性檢測和重複性實驗的結果。圖4A顯示了從不同細胞中(HeLa細胞,加熱後的HeLa細胞,A549細胞,MCF-7細胞)提取出的端粒酶的活性;圖4B顯示了不同的酶(端粒酶,葡萄糖氧化酶,牛血清蛋白,辣根過氧化物酶)與端粒酶引物作用後DPV電流峰值降低值。
具體實施方式
下面通過具體的實施例和附圖對本發明進一步說明,應當指出,對於本領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干變型和改進,這些也應視為屬於本發明的保護範圍。
本實驗中用到的試劑和儀器:
HeLa細胞,A549細胞、MCF-7細胞等其他細胞購買於上海復祥生物科技有限公司,ITO電極,端粒酶(telomerase),亞甲基藍、牛血清蛋白(BSA),葡萄糖氧化酶(GOD),辣根過氧化物酶(HRP),電化學工作站(CHI660)等均為市面上購買。
端粒酶引物序列:5』-AAT CCG TCG AGC AGA GTT-3′
端粒酶引物來自上海生物工程技術服務有限公司合成;
實施例1:
利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的分析方法,檢測步驟是:
1)細胞培養和端粒酶提取:HeLa細胞接種在含有10%胎牛血清,青黴素和鏈黴素的DMEM培養基中,並在5%CO2,37℃培養箱中培養。所有細胞都是收集於指數生長時期。將100萬個細胞分裝於1.5mL的EP管中,用冰冷的磷酸鹽緩衝溶液(pH=7.4)洗滌兩次,並重新分散在200μL冰冷的CHAPS裂解緩衝液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇雙(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(膽醯氨丙基)二甲氨基]丙磺酸內鹽),10%(v/v)glycerol(甘油),0.1mM PMSF(苯甲基磺醯氟)中。將細胞在冰上孵育30分鐘,然後在4℃,12000rpm的轉速下離心20分鐘。離心後將澄清的裂解液小心地轉移到新的EP管中,得到裂解後的HeLa細胞,快速冷凍並儲存在-80℃的冰箱中;
2)在含有端粒酶引物的緩衝溶液中加入裂解後的HeLa細胞進行擴增得到重複的富G序列,在鉀離子的存在下得到含有G-四鏈體的擴增溶液:在45μL含有2μM端粒酶引物的端粒酶緩衝溶液中加入5μL稀釋後的裂解後的HeLa細胞,約100個,在37℃下進行擴增反應2小時,並在鉀離子的存在下形成G-四鏈體的擴增溶液;其中,所述端粒酶緩衝溶液為含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始濃度為1.5mM,KCl初始濃度為63mM,Tween 20初始濃度為0.005%(v/v),EGTA初始濃度為1mM,dNTPs初始濃度為1mM。
3)在含有G-四鏈體的擴增溶液加入亞甲基藍使其與G-四鏈體結合得到溶液:含有G-四鏈體的擴增溶液中加入亞甲基藍使其與G-四鏈體結合:將得到的含有G-四鏈體的擴增溶液與50μL濃度為4μM的亞甲基藍混合,使亞甲基藍與G-四鏈體進行結合得到溶液。
4)修飾工作電極使其表面帶有負電荷:首先,將ITO電極依次浸泡在丙酮,乙醇和超純水中,並分別超聲15分鐘進行清洗。之後,將清洗好的ITO電極浸泡在1mM NaOH中進行修飾。4小時後,將完成修飾的ITO電極放入超純水中超聲清洗15分鐘,得到了表面帶有負電荷的ITO工作電極。
5)所述利用差分脈衝伏安法(DPV)對溶液中的亞甲基藍進行檢測的具體步驟如下:自製一個電解池作為檢測元件。將表面帶有負電荷的ITO工作電極放入電解池下半部分的凹槽內,之後,將帶有直徑為6mm孔的電解池上半部分固定在ITO工作電極上方,在他們之間放入O型密封圈防止漏液。在直徑為6mm的孔中加入擴增後的溶液,將一根鉑絲作為對電極,銀/氯化銀電極作為參比電極插入溶液中,與ITO工作電極形成三電極體系並通過DPV法進行電化學檢測。設置參數:掃描電壓-0.5~0V,脈衝高度0.05V,脈衝寬度0.05s,脈衝增量0.004V,脈衝周期0.5s。檢測結束後,得到了圖3A中的d曲線。
實施例2
利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的分析方法,檢測步驟是:
1)細胞培養和端粒酶提取:HeLa細胞接種在含有10%胎牛血清,青黴素和鏈黴素的DMEM培養基中,並在5%CO2,37℃培養箱中培養。所有細胞都是收集於指數生長時期。將100萬個細胞分裝於1.5mL的EP管中,用冰冷的磷酸鹽緩衝溶液(pH=7.4)洗滌兩次,並重新分散在200μL冰冷的CHAPS裂解緩衝液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA,0.5%(w/v)CHAPS,10%(v/v)glycerol,0.1mM PMSF)中。將細胞在冰上孵育30分鐘,然後在4℃,12000rpm的轉速下離心20分鐘。離心後將澄清的裂解液小心地轉移到新的EP管中,得到裂解後的HeLa細胞,快速冷凍並儲存在-80℃的冰箱中;
2)在含有端粒酶引物的緩衝溶液中加入裂解後的HeLa細胞進行擴增得到重複的富G序列,在鉀離子的存在下得到含有G-四鏈體的擴增溶液:在45μL含有2μM端粒酶引物的端粒酶緩衝溶液中加入5μL稀釋後的裂解後的HeLa細胞,約1000個,在30℃下進行擴增反應2小時,並在鉀離子的存在下形成G-四鏈體。其中,所述端粒酶緩衝溶液為含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始濃度為1.5mM,KCl初始濃度為63mM,Tween 20初始濃度為0.005%(v/v),EGTA初始濃度為1mM,dNTPs初始濃度為1mM。
3)在擴增後的溶液中加入亞甲基藍使其與G-四鏈體結合:將得到的擴增後的溶液與50μL濃度為4μM的亞甲基藍混合,使亞甲基藍與G-四鏈體進行結合。
4)修飾工作電極使其表面帶有負電荷:首先,將ITO電極依次浸泡在丙酮,乙醇和超純水中,並分別超聲20分鐘進行清洗。之後,將清洗好的ITO電極浸泡在1mM NaOH中進行修飾。6小時後,將完成修飾的ITO電極放入超純水中超聲清洗20分鐘,得到了表面帶有負電荷的ITO工作電極。
5)利用差分脈衝伏安法(DPV)對溶液中的亞甲基藍進行檢測的具體步驟如下:自製一個電解池作為檢測元件。將表面帶有負電荷的ITO工作電極放入電解池下半部分的凹槽內,之後,將帶有直徑為6mm孔的電解池上半部分固定在ITO工作電極上方,在他們之間放入O型密封圈防止漏液。在直徑為6mm的孔中加入擴增後的溶液,將一根鉑絲作為對電極,銀/氯化銀電極作為參比電極插入溶液中,與ITO工作電極形成三電極體系並通過DPV法進行電化學檢測。設置參數:掃描電壓-0.5~0V,脈衝高度0.05V,脈衝寬度0.05s,脈衝增量0.004V,脈衝周期0.5s。檢測結束後,得到了圖3A中的g曲線。
實施例3
利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的分析方法,檢測步驟是:
1)細胞培養和端粒酶提取:HeLa細胞接種在含有10%胎牛血清,青黴素和鏈黴素的DMEM培養基中,並在5%CO2,37℃培養箱中培養。所有細胞都是收集於指數生長時期。將100萬個細胞分裝於1.5mL的EP管中,用冰冷的磷酸鹽緩衝溶液(pH=7.4)洗滌兩次,並重新分散在200μL冰冷的CHAPS裂解緩衝液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA,0.5%(w/v)CHAPS,10%(v/v)glycerol,0.1mM PMSF)中。將細胞在冰上孵育30分鐘,然後在4℃,12000rpm的轉速下離心20分鐘。離心後將澄清的裂解液小心地轉移到新的EP管中,得到裂解後的HeLa細胞,快速冷凍並儲存在-80℃的冰箱中;
2)在含有端粒酶引物的緩衝溶液中加入裂解後的HeLa細胞進行擴增得到重複的富G序列,在鉀離子的存在下得到含有G-四鏈體的擴增溶液:在45μL含有2μM端粒酶引物的端粒酶緩衝溶液中加入5μL稀釋後的裂解後的HeLa細胞,約5000個,在37℃下進行擴增反應2小時,並在鉀離子的存在下形成G-四鏈體。其中,所述端粒酶緩衝溶液為含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始濃度為1.5mM,KCl初始濃度為63mM,Tween 20初始濃度為0.005%(v/v),EGTA初始濃度為1mM,dNTPs初始濃度為1mM。
3)在擴增後的溶液中加入亞甲基藍使其與G-四鏈體結合:將得到的擴增後的溶液與50μL濃度為4μM的亞甲基藍混合,使亞甲基藍與G-四鏈體進行結合。
4)修飾工作電極使其表面帶有負電荷:首先,將ITO電極依次浸泡在丙酮,乙醇和超純水中,並分別超聲17分鐘進行清洗。之後,將清洗好的ITO電極浸泡在1mM NaOH中進行修飾。5小時後,將完成修飾的ITO電極放入超純水中超聲清洗17分鐘,得到了表面帶有負電荷的ITO工作電極。
5)所述利用差分脈衝伏安法(DPV)對溶液中的亞甲基藍進行檢測的具體步驟如下:自製一個電解池作為檢測元件。將表面帶有負電荷的ITO工作電極放入電解池下半部分的凹槽內,之後,將帶有直徑為6mm孔的電解池上半部分固定在ITO工作電極上方,在他們之間放入O型密封圈防止漏液。在直徑為6mm的孔中加入擴增後的溶液,將一根鉑絲作為對電極,銀/氯化銀電極作為參比電極插入溶液中,與ITO工作電極形成三電極體系並通過DPV法進行電化學檢測。設置參數:掃描電壓-0.5~0V,脈衝高度0.05V,脈衝寬度0.05s,脈衝增量0.004V,脈衝周期0.5s。檢測結束後,得到了圖3A中的i曲線。
將DPV電流峰值降低值定義為-Δip,則最終得到了DPV電流峰值降低值與細胞個數的對數之間的線性關係,即-Δip=0.1276-0.0517log N。線性範圍為10~10000個細胞,相關係數為0.9904。計算得到最低檢測限為3個細胞。
實施例4:
利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的分析方法,檢測步驟是:
1)細胞培養和端粒酶提取:HeLa細胞,A549細胞,和MCF-7細胞分別接種在含有10%胎牛血清,青黴素和鏈黴素的DMEM培養基中,並在5%CO2,37℃培養箱中培養。所有細胞都是收集於指數生長時期。將100萬個細胞分裝於1.5mL的EP管中,用冰冷的磷酸鹽緩衝溶液(pH=7.4)洗滌兩次,並重新分散在200μL冰冷的CHAPS裂解緩衝液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇雙(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(膽醯氨丙基)二甲氨基]丙磺酸內鹽),10%(v/v)glycerol(甘油),0.1mM PMSF(苯甲基磺醯氟)中。將細胞在冰上孵育30分鐘,然後在4℃,12000rpm的轉速下離心20分鐘。離心後將澄清的裂解液小心地轉移到新的EP管中,分別得到各自裂解後的細胞,快速冷凍並儲存在-80℃的冰箱中;
2)在含有端粒酶引物的緩衝溶液中加入裂解後的細胞進行擴增得到重複的富G序列,在鉀離子的存在下得到含有G-四鏈體的擴增溶液:在45μL含有2μM端粒酶引物的端粒酶緩衝溶液中分別加入5μL稀釋後的裂解後的細胞,加熱失活後的HeLa細胞,A549細胞,MCF-7細胞,約1000個,在37℃下進行擴增反應2小時,並在鉀離子的存在下形成G-四鏈體的擴增溶液;其中,所述端粒酶緩衝溶液為含有MgCl2、KCl、Tween20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始濃度為1.5mM,KCl初始濃度為63mM,Tween 20初始濃度為0.005%(v/v),EGTA初始濃度為1mM,dNTPs初始濃度為1mM。
3)在含有G-四鏈體的擴增溶液加入亞甲基藍使其與G-四鏈體結合得到溶液:含有G-四鏈體的擴增溶液中加入亞甲基藍使其與G-四鏈體結合:將得到的含有G-四鏈體的擴增溶液與50μL濃度為4μM的亞甲基藍混合,使亞甲基藍與G-四鏈體進行結合得到溶液。
4)修飾工作電極使其表面帶有負電荷:首先,將ITO電極依次浸泡在丙酮,乙醇和超純水中,並分別超聲15分鐘進行清洗。之後,將清洗好的ITO電極浸泡在1mM NaOH中進行修飾。4小時後,將完成修飾的ITO電極放入超純水中超聲清洗15分鐘,得到了表面帶有負電荷的ITO工作電極。
5)所述利用差分脈衝伏安法(DPV)對溶液中的亞甲基藍進行檢測的具體步驟如下:自製一個電解池作為檢測元件。將表面帶有負電荷的ITO工作電極放入電解池下半部分的凹槽內,之後,將帶有直徑為6mm孔的電解池上半部分固定在ITO工作電極上方,在他們之間放入O型密封圈防止漏液。在直徑為6mm的孔中加入擴增後的溶液,將一根鉑絲作為對電極,銀/氯化銀電極作為參比電極插入溶液中,與ITO工作電極形成三電極體系並通過DPV法進行電化學檢測。設置參數:掃描電壓-0.5~0V,脈衝高度0.05V,脈衝寬度0.05s,脈衝增量0.004V,脈衝周期0.5s。檢測結束後,得到了圖4A。
從圖中可以看出,利用A549和HeLa細胞檢測出的電流變化較大,這說明A549和HeLa細胞中的端粒酶活性較高,MCF-7中的端粒酶活性與這兩種細胞中的端粒酶活性相比偏低,而加熱的HeLa細胞由於加熱導致酶失活,電流信號的降低非常微弱。
實施例5:
利用亞甲基藍與G-四鏈體的結合進行電化學檢測端粒酶活性的分析方法,檢測步驟是:
1)細胞培養和端粒酶提取:HeLa細胞,A549細胞,和MCF-7細胞分別接種在含有10%胎牛血清,青黴素和鏈黴素的DMEM培養基中,並在5%CO2,37℃培養箱中培養。所有細胞都是收集於指數生長時期。將100萬個細胞分裝於1.5mL的EP管中,用冰冷的磷酸鹽緩衝溶液(pH=7.4)洗滌兩次,並重新分散在200μL冰冷的CHAPS裂解緩衝液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇雙(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(膽醯氨丙基)二甲氨基]丙磺酸內鹽),10%(v/v)glycerol(甘油),0.1mM PMSF(苯甲基磺醯氟)中。將細胞在冰上孵育30分鐘,然後在4℃,12000rpm的轉速下離心20分鐘。離心後將澄清的裂解液小心地轉移到新的EP管中,分別得到裂解後的細胞,快速冷凍並儲存在-80℃的冰箱中;
2)在含有端粒酶引物的緩衝溶液中加入裂解後的HeLa細胞進行擴增得到重複的富G序列,在鉀離子的存在下得到含有G-四鏈體的擴增溶液:在45μL含有2μM端粒酶引物的端粒酶緩衝溶液中分別加入5μL稀釋後的裂解後的HeLa細胞,約1000個,5μL GOD,5μL BSA,和5μL HRP,約100μg,在37℃下進行擴增反應2小時,並在鉀離子的存在下形成G-四鏈體的擴增溶液;其中,所述端粒酶緩衝溶液為含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始濃度為1.5mM,KCl初始濃度為63mM,Tween 20初始濃度為0.005%(v/v),EGTA初始濃度為1mM,dNTPs初始濃度為1mM。
3)在含有G-四鏈體的擴增溶液加入亞甲基藍使其與G-四鏈體結合得到溶液:含有G-四鏈體的擴增溶液中加入亞甲基藍使其與G-四鏈體結合:將得到的含有G-四鏈體的擴增溶液與50μL濃度為4μM的亞甲基藍混合,使亞甲基藍與G-四鏈體進行結合得到溶液。
4)修飾工作電極使其表面帶有負電荷:首先,將ITO電極依次浸泡在丙酮,乙醇和超純水中,並分別超聲15分鐘進行清洗。之後,將清洗好的ITO電極浸泡在1mM NaOH中進行修飾。4小時後,將完成修飾的ITO電極放入超純水中超聲清洗15分鐘,得到了表面帶有負電荷的ITO工作電極。
5)所述利用差分脈衝伏安法(DPV)對溶液中的亞甲基藍進行檢測的具體步驟如下:自製一個電解池作為檢測元件。將表面帶有負電荷的ITO工作電極放入電解池下半部分的凹槽內,之後,將帶有直徑為6mm孔的電解池上半部分固定在ITO工作電極上方,在他們之間放入O型密封圈防止漏液。在直徑為6mm的孔中加入擴增後的溶液,將一根鉑絲作為對電極,銀/氯化銀電極作為參比電極插入溶液中,與ITO工作電極形成三電極體系並通過DPV法進行電化學檢測。設置參數:掃描電壓-0.5~0V,脈衝高度0.05V,脈衝寬度0.05s,脈衝增量0.004V,脈衝周期0.5s。檢測結束後,得到了圖4B。
從圖4B中可以看出,只有加入了HeLa細胞後電流才有了明顯的降低,而加入葡萄糖氧化酶,牛血清蛋白,和辣根過氧化物酶的樣品,由於其中沒有端粒酶的存在而導致電流的降低非常微弱。由此說明,該檢測方法具有較好的特異性。
與目前現有檢測方法相比,該方法的檢測限具有明顯優勢。例如,武漢輕工大學生物與製藥工程學院利用有限延伸法檢測端粒酶活性的方案,檢測限達到250個細胞;河北大學化學與環境科學學院基於雜交鏈式反應信號放大和磁分離技術進行螢光檢測端粒酶活性的方法,檢測限為1×105個細胞;河北大學化學與環境科學學院基於恆溫指數擴增反應高靈敏度檢測端粒酶活性的方法,檢測限為50個細胞。
上述僅為本發明優選的實施例,並不限制於本發明。對於所屬領域的技術人員來說,在上述說明的基礎上還可以做出其他不同形式的變化或變動。這裡無需也無法對所有的實施例來舉例說明。而由此方案所引伸出的顯而易見的變化或變動仍處於本發明的保護範圍之內。
