馬齒莧中生物鹼化合物及其提取分離方法與流程
2023-12-06 10:20:36 1
本發明涉及中藥提取、分離領域,尤其涉及從馬齒莧藥材中提取、分離和鑑別出的一種生物鹼化合物及其提取分離方法,特別是馬齒莧中生物鹼化合物及其提取分離方法。
背景技術:
馬齒莧(portulacaoleraceal.),又名長命菜、馬莧菜,為馬齒莧科植物。馬齒莧性喜肥沃土壤,耐旱亦耐澇,生命力強,分布廣泛,資源豐富,而以我國東北部的更為常見。馬齒莧既可入藥,又可食用,是我國衛生部劃定的藥食同源的野生植物之一。2015版《中華人民共和國藥典》中收載馬齒莧的乾燥地上部分入藥,具有清熱解毒、涼血止血、止痢等功效,用於熱毒血痢、癰腫疔瘡、溼疹、丹毒、蛇蟲咬傷、便血、痔血、崩漏下血等。
現代藥理學研究表明,馬齒莧具有降血脂、降血糖、抗炎、抗氧化、抗腫瘤、抗動脈粥樣硬化、鬆弛或興奮平滑肌及增強免疫力等功效。研究表明馬齒莧中所含多種化學成分與其多樣的藥理作用息息相關,其主要化學成分包括:黃酮類、生物鹼類、萜類、香豆素類、有機酸類、揮髮油、多糖、胺基酸、各種色素類和礦物質類等。其中生物鹼是馬齒莧中的一大類活性成分,而醯胺類生物鹼又佔絕大多數。目前已報導的生物鹼類成分有去甲腎上腺素、多巴胺、少量多巴、腺苷、尿嘧啶、腺嘌呤、n,n-二環己基脲、尿囊素、n-反式-阿魏醯基酪胺;還有環二肽生物鹼和醯胺類生物鹼:馬齒莧醯胺a-i、k、l、n-s。
目前從馬齒莧中分離出的化學成分大多數是已知的,且結構一種性較低,因此,對馬齒莧中新化合物的開發和分離是亟待需要的。
技術實現要素:
針對上述問題,本發明提供從馬齒莧中提取的一種生物鹼化合物,經研究發現本發明的一種生物鹼具有抗炎、神經保護的作用,同時提供一種針對本發明一種生物鹼化合物的簡便、快速、環保、純度高的提取分離方法。
為實現本發明的上述目的,本發明提供一種生物鹼化合物,分子式為c18h17no4,命名為oleraciamided,化學結構式為。
為實現本發明的上述目的,本發明還提供一種馬齒莧中一種生物鹼化合物的提取分離方法,具體步驟為。
步驟1、取馬齒莧乾燥藥材,採用水煎煮提取,水提液濾過,合併濾液直接加熱濃縮,放涼至室溫,得藥液備用。
步驟2、將步驟1中藥液用乙酸乙酯反覆萃取,減壓回收乙酸乙酯至浸膏,得到乙酸乙酯萃取物。
步驟3、將步驟2中乙酸乙酯萃取物經矽膠柱層析分離,依次用乙酸乙酯-甲醇梯度洗脫得到若干洗脫部位,經薄層色譜進行檢測,顯色,合併顯色的洗脫部位,將合併後的洗脫部位經減壓濃縮至幹,得到濃縮物備用。
步驟4、將步驟3中所得物再經預處理的ods柱(octadecylsilyl,十八烷基矽烷鍵合矽膠填料)層析分離,用甲醇-水梯度洗脫,得到若干洗脫部位,經薄層色譜進行檢測,顯色,將顯色部位減壓濃縮至幹,得到濃縮物備用。
步驟5、將步驟4中所得濃縮物經預處理的sephadexlh-20(羥丙基葡聚糖凝膠)層析分離,以甲醇-水等度洗脫,經薄層色譜進行檢測,顯色,將顯色的洗脫部位分別減壓濃縮至幹,得濃縮物備用。
步驟6、將步驟5中所得濃縮物通過hplc(高效液相)分離製備,以乙腈-水為流動相進行等度洗脫,最終得到本發明所述的生物鹼。
所述ods和sephadexlh-20凝膠的預處理過程為甲醇浸泡過24小時,上柱,用甲醇洗至滴入水中無混濁,再以初始流動相平衡。
與現有技術相比,本發明的有益效果。
本發明中所述馬齒莧一種生物鹼化合物的分離和藥理活性研究未被現有論文期刊所報導;本發明提供來源於馬齒莧的一種生物鹼化合物及一種針對本發明新化合物的提取分離方法,依次採用水煎煮提取、乙酸乙酯萃取、矽膠柱層析、ods中壓柱、sephadexlh-20及hplc進行分離純化與製備,成功提取分離出一種新的生物鹼化合物,該方法操作步驟僅為六步,操作方法簡便及快速,提取分離過程主要採用水提取及乙酸乙酯萃取,工藝方法環保,且經該方法分離得到的化合物純度較高均大於90%,此外經研究表明以上化合物具有抗炎和神經保護作用,因此本發明一種生物鹼化合物及其鹽和衍生物可以作為其他化合物合成先導物,以及新藥開發和藥理活性研究的原料,亦可用於製備抗炎和神經保護的藥物。
附圖說明
圖1為本發明新生物鹼化合物oleraciamided的紫外光譜圖。
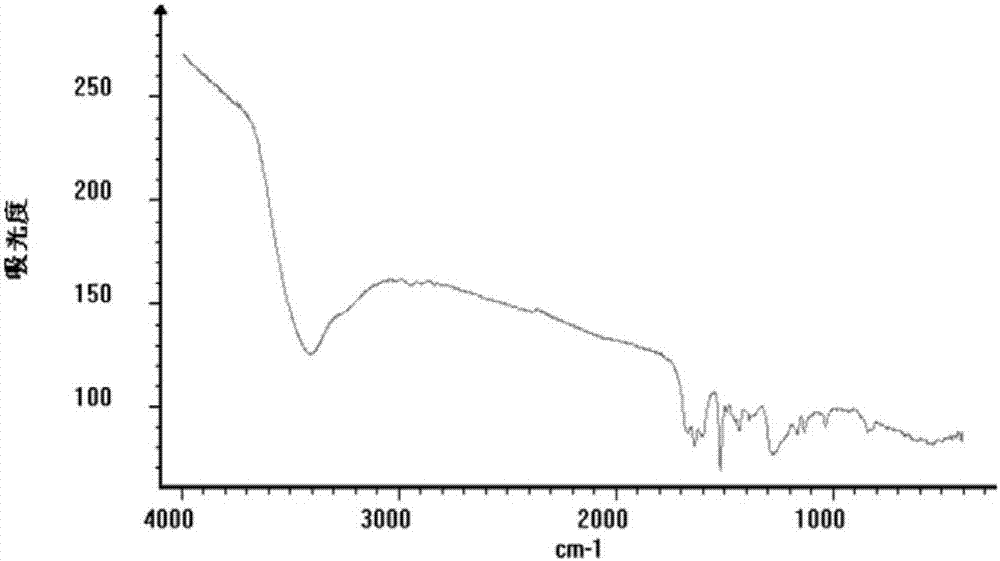
圖2為本發明新生物鹼化合物oleraciamided的紅外光譜圖。
圖3為本發明新生物鹼化合物oleraciamided的1h-nmr光譜圖。
圖4為本發明新生物鹼化合物oleraciamided的13c-nmr光譜圖。
圖5為本發明新生物鹼化合物oleraciamided的核磁共振碳譜(dept)光譜圖。
圖6為本發明新生物鹼化合物oleraciamided的核磁共振1h-1hcosy光譜圖。
圖7為本發明新生物鹼化合物oleraciamided的核磁共振hmbc光譜圖。
圖8為本發明新生物鹼化合物oleraciamided的核磁共振hsqc光譜圖。
圖9為本發明新生物鹼化合物oleraciamided的核磁共振noesy光譜圖。
具體實施方式
下面結合具體實施例對本發明做詳細的說明。
實施例1。
本發明提供一種生物鹼化合物,分子式為c18h17no4,命名為oleraciamided,化學結構式為。
所述一種生物鹼化合物根據結構命名為oleraciamided,表1為該一種生物鹼化合物的核磁數據:1h-nmr與13c-nmr在meod中。
表1:本發明新生物鹼化合物oleraciamided的核磁數據。
本發明一種生物鹼化合物oleraciamided的結構鑑定與推導。
oleraciamided:黃色粉末狀物,易溶於甲醇,不溶、微溶於水。點樣於矽膠薄層板後,噴稀碘化鉍鉀試液斑點顯橘黃色,提示該化合物為生物鹼成分。uv(meoh)λmax:320nm,irνn-h3415,νc=o1670,νc=c1634,1594,νc-n1515,νc-o1428,νs(c-o-c)1030,820cm-1。結合1h-nmr,13c-nmr以及dept數據,推測該化合物可能的分子式為c18h17no4,不飽和度為11。13c-nmr譜和dept譜顯示18個碳信號,分別為1個och3(δ:56.22)、1個ch2(δ:51.14)、9個ch(一個脂肪碳,δ:43.82;八個烯烴碳,δ:113.89,116.18,116.85,126.51,129.10,134.46,其中116.85,129.10為重疊峰)、7個季碳(一個羰基,δ:175.07;六個烯烴碳,δ:127.71,131.11,135.19,148.86,149.30,157.60)。
1h-nmr譜顯示一個abx系統,對應信號δ6.84(d,1h,j=1.85),δ6.70(d,1h,j=8.20)以及δ6.89(dd,1h,j=1.9,8.20).同時,1h-nmr信號δ6.73(d,2h,j=8.6),δ7.09(d,2h,j=8.5)以及3c-nmr譜信號δc129.10(c-2」,c-6」,重疊),δc=116.85(c-3」,c-5」,重疊)顯示一個aa』bb』系統的存在。依據hmbc譜的相關性,h-3/4與c-2,c-5相關,h-5與c-2,c-6相關,h-6與c-2,c-5相關,並結合一個由δc175.07醯胺特徵峰和紅外特徵吸收峰共同確定的醯胺基團,進一步確定一個5,6-二氫吡啶-2(1h)-酮的存在。由hmbc譜的相關峰,h-5與c-1」,c-2」,c-6」相關,h-6與c-1」相關,h-2」與c-5相關,h-6」與c-5相關,說明c-1」與c-5相連。同時,由h-3/4與c-2』,c-6』相關,h-2』與c-3相關,h-6』與c-3相關可知c-1』與c-3或c-4相連。考慮到δh7.41(d,1h,j=2.05)的耦合常數,可知此氫不會產生鄰位耦合作用,因此確定c-1』與c-4相連。此外,考慮到h-och3(s,3.54,3h)與c-3』在hmbc相關性,並結合noesy譜上h-2』與h-och3的相關峰,說明甲氧基與c-3』相連。最後,結合化合物分子式以及處於低場化學位移的c-4』(δc=149.30)和c-4」(δc=157.60)質子,可說明兩個羥基的存在,並且它們分別處於c-4』和c-4」位上。
根據以上信息,可確定此新生物鹼為上述結構。
本發明還提供上述此一種生物鹼化合物的提取分離方法,具體步驟為。
步驟1:稱取馬齒莧乾燥藥材150kg,採用水煎煮提取,水用量為藥材的8~16倍,煎煮提取兩次,每次煎煮2h,水提液濾過,合併濾液,100℃加熱濃縮至150l,放涼至室溫,得藥液備用。
步驟2:將步驟1中所得藥液,用乙酸乙酯反覆萃取3次,乙酸乙酯與濃縮液的體積比例為1:1(v:v),40℃以下減壓回收乙酸乙酯至浸膏,得到乙酸乙酯萃取物。
步驟3:將步驟2中所得乙酸乙酯萃取物幹法上樣,經矽膠柱層析分離,其中矽膠為200~300目,依次用乙酸乙酯-甲醇(1:1、1:2、1:3、1:5,v:v)梯度洗脫,共得到150個部位(即共得到150個瓶,每瓶400ml),經薄層色譜進行檢測,顯色,合併顯色的90~130洗脫部位(即合併顯色的90~130瓶,棄去1~89瓶與131~150瓶),將合併後的90~130部位經40℃以下減壓濃縮至幹,備用。
步驟4:將步驟3中所得物再經預處理的ods中壓柱層析分離,其中填料粒度為20~40μm,用甲醇-水(30/70,50/50,70/30,100/0,v/v)梯度洗脫(加壓,使流速為1ml/min,溫度為室溫),得到10個部位(即梯度洗脫得10個瓶,每瓶200ml),經薄層色譜進行檢測,顯色,將顯色的5~7部位合併,50℃以下減壓濃縮至幹,備用。所述ods的預處理過程為甲醇浸泡過24h,上柱,用甲醇洗至滴入水中無混濁,再以初始流動相平衡。
步驟5:將步驟4中所得顯色部位經預處理的sephadexlh-20柱層析,以甲醇-水(50/50,v/v)等度洗脫,得到35個部位(即梯度洗脫得35個瓶,每瓶20ml),經薄層色譜進行檢測,顯色,將顯色的5~10部位合併,50℃以下減壓濃縮至幹,備用。所述sephadexlh-20凝膠的預處理過程為甲醇浸泡過24h,上柱,用甲醇洗至滴入水中無混濁,再以初始流動相平衡。
步驟6:將步驟5中所得顯色部位經hplc分離製備,以乙腈和水體積比為16:84作為流動相,檢測波長為230,280nm,分離製備得到本發明新生物鹼化合物,歸一法測定純度均為90~99%。
本發明新生物鹼化合物的抗炎作用。
1、主要材料。
1.1、藥品和試劑:實驗所用新生物鹼化合物由上述方法製備,純度為90~99%,精密稱取,用dmso稀釋至下述各劑量組所需溶液。dmem高糖培養基、胎牛血清(美國hyclone公司);青黴素、鏈黴素(杭州四季青公司);lps(美國sigma公司);il-6、tnf-α、pge2的elisa試劑盒(美國cayman公司);細胞裂解液、griess試劑(碧雲天生物技術有限公司)。
1.2細胞株:raw264.7巨噬細胞(美國atcc細胞庫)
1.3分組:對照組、lps組和實驗組,各一組。
2實驗方法。
2.1細胞培養,dmem高糖培養基,加入10%的胎牛血清,l%抗菌素(100u/ml青黴素和100μg/ml鏈黴素),置於37.5%,co2培養箱中培養。
2.2mtt比色法測定細胞活力,上述三組分別取對數生長期raw264.7巨噬細胞接種於96孔培養板中,細胞密度為1×104個/ml,每孔100μl,溫度37℃,5%co2條件下培養過夜後,實驗組加入不同濃度的本發明新生物鹼化合物oleraciamided(1-100μm),孵育1h後向lps組和實驗組分別加入終濃度為1μg/ml的lps,另設調零組(含dmso溶媒的培養液),每組設3個復孔,考察加入藥物後對細胞的影響。上述各組細胞培養24h後,在各孔細胞中加入5mg/mlmtt20μl,溫度37℃,5%co2條件下繼續孵育4h後,終止培養,吸棄孔內液體,每孔加入100μl二甲基亞碸(dmso),振蕩10min,使細胞內結晶充分溶解,酶標儀570nm波長處測定各孔吸光值。
2.3利用格裡斯(griess)法測定no的含量,考察本發明生物鹼化合物對lps誘導的小鼠巨噬細胞raw264.7的no產生量的抑制作用。小鼠巨噬細胞raw264.7傳代後在含10%胎牛血清的高糖細胞培養基dmem中培養,實驗組加入不同濃度的本發明新生物鹼化合物oleraciamided(1-50μm),在37℃,5%co2條件下孵育1h後用lps(終濃度為1μg/ml)誘導炎症反應,24h後收集上清液,每組處理重複3孔。griess法測定細胞上清液中no的含量,根據不同濃度本發明新生物鹼化合物對lps誘導的raw264.7細胞釋放no的影響,用以反映no水平。
2.4elisa法測定炎症因子il-6、tnf-α和炎症介質pge2:將對數生長期raw264.7巨噬細胞接種於24孔培養板中,細胞密度為1×105個/ml,每孔1ml,溫度37℃,5%co2條件下培養過夜,實驗組加入本發明新生物鹼化合物oleraciamided(1-50μm),培育1h後,在每孔加入lps(終濃度為1μg/ml),共孵育24h,每組處理重複3孔。elisa法測定馬齒莧來源新生物鹼處理後的raw264.7巨噬細胞分泌的il-6、tnf-α和pge2的含量。
3實驗結果。
實驗結果表明本發明新生物鹼化合物對lps誘導的巨噬細胞raw264.7的增殖無影響,安全無毒;並可有效抑制lps誘導的巨噬細胞raw264.7所產生過量炎症細胞因子il-6、tnf-α和炎症介質no、pge2,且呈濃度依賴。
細胞相對存活率實驗結果如表2所示。
表2:本發明對raw264.7巨噬細胞相對存活率的影響。
註:*p<0.05與對照組比較(高濃度組有顯著性差異)。
利用格裡斯(griess)法測定no的含量實驗結果見表3。
表3:本發明對lps誘導的raw264.7細胞釋放no的影響(均數±標準差,n=3)。
註:*p<0.05與對照組比較,#p<0.05與lps組比較。
elisa法測定炎症因子il-6、tnf-α和炎症介質pge2結果如表4所示。
表4:本發明對lps誘導的raw264.7細胞分泌的il-6、tnf-α和pge2含量的影響(均數±標準差,n=3)。
註:*p<0.05與對照組比較,#p<0.05與lps組比較。
本發明新生物鹼化合物的神經保護作用。
1主要材料。
1.1藥品和試劑:實驗所用新生物鹼化合物由上述方法製備,純度為90~99%,精密稱取,用dmso稀釋至下述各劑量組所需溶液。dmem高糖培養基、胎牛血清(美國hyclone公司);青黴素、鏈黴素(杭州四季青公司),磷酸鹽緩衝液(pbs),(武漢博士德有限公司),ros檢測試劑盒(海門碧雲天試劑公司)
1.2細胞株:人神經母細胞瘤細胞株(sh-sy5y、imr-32)(中科院上海細胞
1.3分組:分為對照組、h2o2損傷模型組和實驗組。
2實驗方法。
2.1細胞培養,dmem高糖培養基,加入l0%的胎牛血清,l%抗菌素(100u/ml青黴素和100μg/ml鏈黴素),置於37℃、5%co2培養箱中培養。
2.2mtt比色法測定細胞活力,上述三組分別取對數生長期sh-sy5y細胞和imr-32細胞接種於96孔培養板中,細胞密度為1×104個/ml,每孔100μl,溫度37℃,5%co2條件下培養過夜後,實驗組加入不同濃度的本發明新生物鹼化合物oleraciamided(5-40μm),孵育1h後向h2o2組和實驗組分別加入終濃度為800μm/l的h2o2,另設調零組(含dmso溶媒的培養液),每組設3個復孔,考察加入藥物後對細胞的影響。上述各組細胞培養24h後,在各孔細胞中加入5mg/mlmtt20μl,溫度37℃,5%co2條件下繼續孵育4h後,終止培養,吸棄孔內液體,每孔加入100μl二甲基亞碸(dmso),振蕩10min,使細胞內結晶充分溶解,酶標儀450nm波長處測定各孔吸光值(a)值,計算細胞存活率,細胞存活率=(ah2o2損傷-a空白)/(a對照-a空白)。
2.3dcfh-da法檢測sh-sy5y細胞和imr-32細胞內ros,各組細胞給予相應物質後孵育24h,孵育結束前30min,各孔加入dcfh-da,使終濃度為10μmol/l,於37℃繼續孵育30min,收集細胞,pbs洗2次,細胞計數,將各組細胞製成相同濃度的細胞懸液。取100μl細胞懸液檢測螢光強度,激發波長485nm,發射波長538nm。以對照組螢光強度為100%,其餘各組與對照組螢光強度相比較,計算胞內ros變化。
2.4int顯色反應法測定ldh的釋放量,除上述對照組、h2o2損傷模型組和實驗組外,另設立空白對照組(空白對照組不接種細胞),各組細胞加入相應物質培養24h,取各孔上清120μl至新的96孔板中,加60μl配好的ldh檢測工作液,避光室溫孵育30min,在490nm處用多功能酶標儀測定a值,計算相對於對照管的ldh釋放量百分率。ldh釋放率=(a給藥-a空白)/(a對照-a空白)。
3實驗結果。
細胞相對存活率實驗結果如表5所示。
表5:本發明對人神經母細胞瘤細胞株sh-sy5y和imr-32細胞相對存活率的影響。
註:*p<0.05與h2o2損傷模型組比較。
sh-sy5y細胞和imr-32細胞內ros量檢測結果如表6所示。
表6:本發明對人神經母細胞瘤細胞株sh-sy5y和imr-32細胞內ros量的影響。
註:*p<0.05與對照組比較,#p<0.05與h2o2損傷模型組比較。
sh-sy5y細胞和imr-32細胞內ldh釋放的影響結果如表7所示。
表7:本發明對人神經母細胞瘤細胞株sh-sy5y和imr-32細胞內ldh釋放的影響。
註:*p<0.05與對照組比較,#p<0.05與h2o2損傷模型組比較。
綜上所述,本發明提供一種生物鹼化合物及其提取分離方法,依次採用水煎煮提取、乙酸乙酯萃取、矽膠柱層析、ods中壓柱層析、及sephadexlh-20柱層析,hplc分離製備,成功的分離得到新生物鹼化合物,該方法簡便,快速,環保,且經該方法分離得到的化合物純度較高,由於所得化合物化學結構獨特,從常用中藥馬齒莧中提取出來,其具有抗炎和神經保護作用,因此本發明新生物鹼及其鹽和衍生物可以作為天然產物開發中藥新藥,具有廣闊的前景。
