與胎兒絨毛外滋養層細胞測定有關的方法和組合物與流程
2023-07-18 21:08:32 2
相關申請的引用
本申請要求於2014年10月10日提交的美國臨時專利申請序列號62/062,433的優先權,所述臨時專利申請的全部內容以引用的方式納入本文。
本公開內容總體上涉及經分離的胎兒絨毛外滋養層細胞以及遺傳變異和病理狀況的產前檢測和診斷的測定方法。根據本公開內容的具體方面,本文記載了分離和測定來自妊娠中胎兒的胎兒絨毛外滋養層細胞的rna的方法,以及來自妊娠中胎兒的胎兒絨毛外滋養層細胞的蛋白的質譜測定方法。
背景技術:
遺傳變異和病理狀況的產前檢測和診斷適用於監測並維持母親和胎兒的健康和幸福。缺少無創性方法用於獲得並測定通常數量較少的胎兒細胞。持續需要這樣的測定,其向臨床醫生警示妊娠中的異常狀況,例如唐氏症候群和其他染色體數目疾病、遺傳病的診斷以及將發展先兆子癇或子宮內生長受限的妊娠中的胎兒的病理狀況。
技術實現要素:
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞,產生經分離的胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定經分離的胎兒絨毛外滋養層細胞,產生醛固定的經分離的胎兒絨毛外滋養層細胞;裂解所述醛固定的經分離的胎兒絨毛外滋養層細胞,產生裂解物;清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中所述用醛固定劑處理在從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞之前和/或之後進行;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞,產生經分離的胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中所述用醛固定劑處理在從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞之前和/或之後進行;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞,產生經分離的胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行,並且其中所述用醛固定劑處理在從母體子宮頸內樣品中分離出胎兒絨毛外滋養層細胞之前和/或之後進行;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行,並且其中所述用醛固定劑處理在從母體子宮頸內樣品中分離出胎兒絨毛外滋養層細胞之前和/或之後進行;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞,產生經分離的胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;在從妊娠受試者獲得樣品之後立即將所述母體子宮頸內樣品中的細胞在醛固定劑中固定;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠受試者獲得母體子宮頸內樣品;在從妊娠受試者獲得樣品之後立即將所述母體子宮頸內樣品中的細胞在醛固定劑中固定;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中所述用醛固定劑處理在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之前和/或之後進行;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中所述用醛固定劑處理在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之前和/或之後進行;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行,並且其中所述用醛固定劑處理在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之前和/或之後進行;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行,並且其中所述用醛固定劑處理在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之前和/或之後進行;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞,其中在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品中的細胞在醛固定劑中固定;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;清洗所述醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括:從妊娠人受試者獲得母體子宮頸內樣品;在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品中的細胞在醛固定劑中固定;從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;在醛固定之後裂解經分離的胎兒絨毛外滋養層細胞,產生裂解物,清洗所述裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的裂解物;從所述經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及測定所述胎兒絨毛外滋養層細胞rna以確定所述胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
根據本發明的方面,測定來自胎兒絨毛外滋養層細胞的rna的方法包括通過測序、pcr、定量pcr、實時pcr或其任意兩種或更多種的組合來測定胎兒絨毛外滋養層細胞rna。
根據本發明的方面,包括從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞的測定來自胎兒絨毛外滋養層細胞的rna的方法,其包括使胎兒絨毛外滋養層細胞與特異地針對胎兒絨毛外滋養層細胞的抗體接觸,其中所述抗體不與母體子宮頸內樣品中的母體細胞結合。
根據本發明的方面,包括從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞的測定來自胎兒絨毛外滋養層細胞的rna的方法,其包括使胎兒絨毛外滋養層細胞與特異地針對胎兒絨毛外滋養層細胞的抗體接觸,其中所述抗體不與母體子宮頸內樣品中的母體細胞結合,並且其中所述特異地針對胎兒絨毛外滋養層細胞的抗體連接於支持體(support)。
根據本發明的方面,記載了測定來自胎兒絨毛外滋養層細胞的rna的方法,其中沒有蛋白a或蛋白g連接於支持體。
根據本發明的方面,包括從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞的測定來自胎兒絨毛外滋養層細胞的rna的方法,其包括使胎兒絨毛外滋養層細胞與特異地針對胎兒絨毛外滋養層細胞的抗體接觸,其中所述抗體不與母體子宮頸內樣品中的母體細胞結合,並且其中所述特異地針對胎兒絨毛外滋養層細胞的抗體連接於支持體,其中所述支持體為多個磁性顆粒,並且從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞的步驟包括將所述磁性顆粒暴露於磁體。
根據本發明的方面,記載了測定來自胎兒絨毛外滋養層細胞的rna的方法,其中未用溶粘蛋白劑處理所述母體子宮頸內樣品。
根據本發明的方面,測定胎兒絨毛外滋養層細胞的方法包括從妊娠受試者獲得母體子宮頸內樣品;使所述母體子宮頸內樣品與第一抗體接觸,所述第一抗體特異地針對胎兒絨毛外滋養層細胞,其中所述第一抗體不與母體子宮頸內樣品中的母體細胞結合;使所述母體子宮頸內樣品與一種或更多種另外的抗體接觸,其中採用不同的標籤可區分地標記所述第一抗體和每種另外的抗體,所述不同的標籤可通過電感耦合等離子體質譜檢測;將所述母體子宮頸內樣品噴成霧狀以分離細胞;以及對細胞進行電感耦合等離子體質譜,從而測定胎兒絨毛外滋養層細胞。
根據本發明的方面,測定胎兒絨毛外滋養層細胞的方法包括從妊娠受試者獲得母體子宮頸內樣品;使所述母體子宮頸內樣品與第一抗體接觸,所述第一抗體特異地針對胎兒絨毛外滋養層細胞,其中所述第一抗體特異地針對主要組織相容性複合物i類g(hla-g);使所述母體子宮頸內樣品與一種或更多種另外的抗體接觸,其中採用不同的標籤可區分地標記所述第一抗體和每種另外的抗體,所述不同的標標籤可通過電感耦合等離子體質譜檢測;將所述母體子宮頸內樣品噴成霧狀以分離細胞;以及對細胞進行電感耦合等離子體質譜,從而測定胎兒絨毛外滋養層細胞。
根據本發明的方面,測定胎兒絨毛外滋養層細胞的方法包括從妊娠受試者獲得母體子宮頸內樣品;使所述母體子宮頸內樣品與第一抗體接觸,所述第一抗體特異地針對胎兒絨毛外滋養層細胞,其中所述第一抗體不與母體子宮頸內樣品中的母體細胞結合;使所述母體子宮頸內樣品與一種或更多種另外的抗體接觸,其中所述一種或更多種另外的抗體是特異地針對選自以下的蛋白的抗體:半乳糖凝集素13、半乳糖凝集素14、胎盤生長因子、妊娠相關血漿蛋白a、甲胎蛋白、內皮因子(endoglin)、fms相關酪氨酸激酶1和角蛋白7,其中採用不同的標籤可區分地標記所述第一抗體和每種另外的抗體,所述不同的標籤可通過電感耦合等離子體質譜檢測;將所述母體子宮頸內樣品噴成霧狀以分離細胞;以及對細胞進行電感耦合等離子體質譜,從而測定胎兒絨毛外滋養層細胞。
根據本發明的方面,測定胎兒絨毛外滋養層細胞的方法包括從妊娠受試者獲得母體子宮頸內樣品;使所述母體子宮頸內樣品與第一抗體接觸,所述第一抗體特異地針對胎兒絨毛外滋養層細胞,其中所述第一抗體特異地針對主要組織相容性複合物i類g(hla-g);使所述母體子宮頸內樣品與一種或更多種另外的抗體接觸,其中所述一種或更多種另外的抗體是特異地針對選自以下的蛋白的抗體:半乳糖凝集素13、半乳糖凝集素14、胎盤生長因子、妊娠相關血漿蛋白a、甲胎蛋白、內皮因子、fms相關酪氨酸激酶1和角蛋白7,其中採用不同的標籤可區分地標記所述第一抗體和每種另外的抗體,所述不同的標籤可通過電感耦合等離子體質譜檢測;將所述母體子宮頸內樣品噴成霧狀以分離細胞;以及對細胞進行電感耦合等離子體質譜,從而測定胎兒絨毛外滋養層細胞。
根據本發明的方面,記載了測定胎兒絨毛外滋養層細胞和/或來自胎兒絨毛外滋養層細胞的rna的方法,其中未用溶粘蛋白劑處理所述母體子宮頸內樣品。
根據本發明的方面,在妊娠中受孕後約3周(孕齡5周)直至妊娠約20周(妊娠中點)或更晚時採集樣品。
附圖說明
圖1是表示來自19份母體子宮頸內樣品的rna回收的圖,從「粗製」的thinprep樣品、經分離的胎兒絨毛外滋養層細胞(evt)或含有母體細胞但缺乏(depleted)胎兒絨毛外滋養層細胞的樣品中分離的rna;
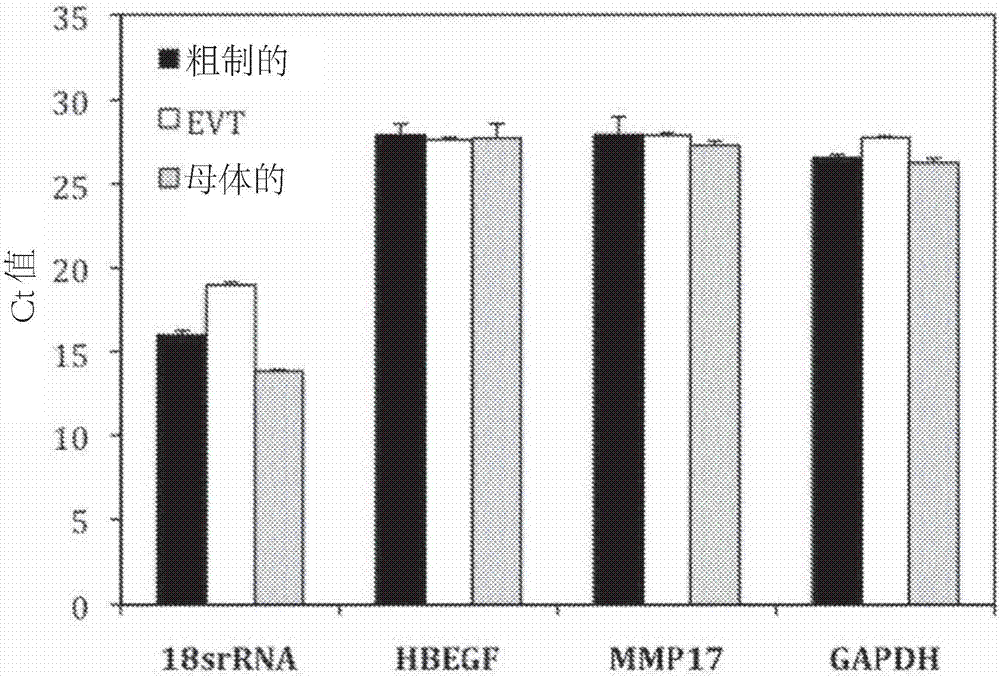
圖2是表示來自粗製的thinprep樣品、經分離的胎兒絨毛外滋養層細胞(evt)和缺乏胎兒絨毛外滋養層細胞的母體細胞(母體)的四種不同已知豐度的rna的定量pcr(qpcr)的ct值的圖;
圖3是凝膠圖,其表示從來自單一母體子宮頸內樣品的3份胎兒製品和3份母體製品中分離的rna的電泳結果;
圖4a是表示兩份母體樣品中rna測序和rna表達水平的比較結果的圖,其為「每100萬比對的(mapped)讀段(reads)中每1千鹼基的轉錄產物的讀段」(rpkm)數值,表明兩份母體rna樣品的相似性。
圖4b是表示兩份胎兒樣品中rna測序和rna表達水平的比較結果的圖,其為rpkm數值,表明兩份胎兒rna樣品的相似性;
圖4c是表示胎兒和母體樣品中rna測序和rna表達水平的比較結果的圖,其為rpkm數值,表明胎兒和母體樣品之間的差異;
圖5a是表示在tmt10plex標記的hrt-8/svneo細胞的同步化前體選擇(sps)分析中m/z829.01離子的ms2測序譜的圖;
圖5b是表示在tmt10plex標記的hrt-8/svneo細胞的同步化前體選擇(sps)分析中,在中等解析度下報告離子126至131的ms2測序譜的圖;
圖5c是表示tmt10plex標記的hrt-8/svneo細胞的同步化前體選擇(sps)分析中,在高解析度下報告離子126至131的ms2測序譜的圖,其中從m/z126至m/z131的波道(channel)包含所示數目的hrt細胞;
圖6是表示通過根據本發明的方面的方法而獲得的胎兒絨毛外滋養層細胞中生物標記的表達的圖;在箱線圖中示出了中位螢光強度(rfu),其中水平線為中值,箱描繪出偏離中值的第一四分位數,條棒表示偏離中值的第二四分位數,以及離群值表示為點。根據wilcoxon符號秩檢驗,除krt7以外,每一對對照和不良妊娠是顯著不同的;以及
圖7是表示從子宮頸(tric)分離的絨毛外滋養層(evt)細胞的滋養層回收和分離中的生物標記表達的定量的圖;使採用針對所示蛋白的抗體標記的evt細胞成像以獲得相對螢光單位(rfu)值,如實施例中所述。使用非參數wilcoxon檢驗來比較對照組(白色)和早期流產(epl)組(黑色)之間各蛋白標記的表達;通過對照/epl對上方的條棒和星號來表示顯著性差異(p<.05);箱=第25至第75百分位數;箱內水平線=中值;箱須(whisker)=1.5x四分位距(第三四分位數至第一四分位數);點代表單獨的離群值。
具體實施方式
本文使用的科學和技術術語意欲具有本領域普通技術人員通常理解的含義。許多標準文獻的文中定義和使用了這類術語,所述文獻示例性地包括j.sambrookandd.w.russell,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress;3rded.,2001;f.m.ausubel,ed.,shortprotocolsinmolecularbiology,currentprotocols;5thed.,2002;b.albertsetal.,molecularbiologyofthecell,4thed.,garland,2002;d.l.nelsonandm.m.cox,lehningerprinciplesofbiochemistry,4thed.,w.h.freeman&company,2004;engelke,d.r.,rnainterference(rnai):nutsandboltsofrnaitechnology,dnapressllc,eagleville,pa,2003;herdewijn,p.(ed.),oligonucleotidesynthesis:methodsandapplications,methodsinmolecularbiology,humanapress,2004;a.nagy,m.gertsenstein,k.vintersten,r.behringer,manipulatingthemouseembryo:alaboratorymanual,3rdedition,coldspringharborlaboratorypress;december15,2002,isbn-10:0879695919;kursadturksen(ed.),embryonicstemcells:methodsandprotocolsinmethodsmolbiol.2002;185,humanapress;currentprotocolsinstemcellbiology.isbn:9780470151808。
單數術語「一」、「一個」和「所述」不意欲進行限制並且包括複數指代對象,除非另外明確地說明或上下文另外清楚地指明。
根據本發明的方面,提供了與來自妊娠中的胎兒的胎兒細胞的分離和測定相關的組合物和方法。
胎兒細胞的分析提供了關於胎兒的信息,例如性別,並允許檢測胎兒異常,包括染色體非整倍性以及妊娠相關疾病,包括先兆子癇、子宮內生長受限、自然流產和早產。
胎兒細胞的分析允許檢測妊娠相關疾病(包括先兆子癇、子宮內生長受限、自然流產和早產)的生物標記。
本文所述的測定為任選地對胎兒絨毛外滋養層細胞表達的一種或更多種生物標記的測定,以檢測指示異常胎盤功能(例如先兆子癇、子宮內生長受限、自然流產和早產)的改變。
儘管本文所述的組合物和方法特別地涉及人類女性和人類胎兒,但它們並不限於人類,其他物種的胎兒細胞可被類似地分離和分析。
分離胎兒絨毛外滋養層細胞的方法
根據本發明的方面,提供了分離胎兒絨毛外滋養層細胞的方法,其包括從妊娠受試者獲得包含胎兒絨毛外滋養層細胞的母體子宮頸內樣品;採用核酸酶處理所述胎兒絨毛外滋養層細胞;以及從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞,從而分離所述胎兒絨毛外滋養層細胞。
從妊娠約1周至約45周(例如妊娠的第一個三個月、第二個三個月和/或第三個三個月)的孕婦收集母體子宮頸內樣品。
根據本發明的方面,從妊娠受試者中在受孕後約3周(孕齡5周)直至妊娠約20周(妊娠中點)或更晚時採集樣品。
使用任何有效裂解dna和/或rna的核酸酶來完成採用核酸酶對胎兒絨毛外滋養層細胞的處理。這類核酸酶包括內切核酸酶和外切核酸酶。可用於處理胎兒絨毛外滋養層細胞的核酸酶的非限制性實例包括脫氧核糖核酸酶(dnase),包括但不限於:dnasei,dnaseii,λ外切核酸酶,核酸酶bal-31,外切核糖核酸酶,大腸桿菌(e.coli)外切核酸酶i、ii、iii、iv、v、vi、vii和viii,限制性內切核酸酶例如aatii、acci、acui、afliii、agei、alei、alui、alwi、alw44i、apai、apoi、asci、asei、asni、avai、avaii、baei、bamhi、bani、banii、bcli、bgli、bglii、blni、blpi、bmri、bmti、bpmi、bsgi、bsmi、bsri、bsshii、bsteii、btgi、btsi、cfoi、clai、ddei、dpni、dpnii、drai、drdi、eaei、eagi、eari、ecii、eclxi、ecori、ecorii、ecorv、fati、faui、foki、fsei、haeii、haeii、hgai、hhai、hincii、hindiii、hpai、hpaii、kasi、kpn1、kspi、mboi、mboii、mfei、mlui、mluni、mlyi、mmei、mnli、msci、msei、mspi、mwoi、naei、nari、ncii、ncoi、ndei、ndeii、nhei、noti、nrui、nsii、nspi、paci、pcii、plei、pmei、pmli、psii、pspi、psti、pvui、pvuii、rsai、saci、sali、sapi、sbfi、sau3ai、scai、scrfi、sfci、sfii、sfoi、smai、smli、spei、sphi、sspi、stui、styi、swai、taqi、xbai、xhoixmai和xmni、大腸桿菌內切核酸酶i或ii、t7內切核酸酶、t4內切核酸酶、微球菌核酸酶、recbcd內切核酸酶、s1核酸酶、p1核酸酶和綠豆核酸酶。可用於處理胎兒絨毛外滋養層細胞的核酸酶的非限制性實例包括核糖核酸酶(rnase),包括內切核糖核酸酶和外切核糖核酸酶,例如rnasea、rnased、rnaseh、rnasel、rnasep、rnaseph、rnasephym、rnaser、rnaset1、rnaset2、rnaseu2、多聚核苷酸磷酸化酶、寡核糖核酸酶、外切核糖核酸酶i、外切核糖核酸酶ii、rnasei、rnaseii和rnaseiii。
任選地,採用兩種或更多種核酸酶處理胎兒絨毛外滋養層細胞。
在核酸酶反應條件下,通常在生理ph和溫度下的生理緩衝液中,進行胎兒絨毛外滋養層細胞的核酸酶處理。
根據本發明的方面,在不固定細胞的情況下、在固定細胞之前或固定細胞之後進行胎兒絨毛外滋養層細胞的核酸酶處理。
根據本發明的方面,在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之前或在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之後進行胎兒絨毛外滋養層細胞的核酸酶處理。應理解,在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之前進行的胎兒絨毛外滋養層細胞的核酸酶處理也是採用核酸酶對母體子宮頸內樣品的處理。
根據本發明的方面,在不固定樣品的情況下、在固定樣品之前或固定樣品之後進行母體子宮頸內樣品的核酸酶處理。
任選地,一種或更多種核酸酶連接於支持體,並且在核酸酶反應條件下,通過使胎兒絨毛外滋養層細胞與一種或更多種連接於支持體的核酸酶接觸來採用一種或更多種核酸酶處理胎兒絨毛外滋養層細胞。調整支持體的大小以防止其進入胎兒絨毛外滋養層細胞和/或母體子宮頸內樣品的母體細胞。在一個優選的選項中,採用一種或更多種連接於支持體的核酸酶處理的胎兒絨毛外滋養層細胞是固定的胎兒絨毛外滋養層細胞。
支持體是固體的或半固體的並且不溶於水溶液中。所述支持體可以為任何材料,例如玻璃、矽、矽膠、粘土、紙,合成或天然存在的聚合物,例如聚乙烯、聚酯、聚醯胺、聚氨基甲酸酯、聚環氧化物、聚苯乙烯、聚碳酸酯、聚丙烯、聚氯乙烯、聚乙烯乙酸酯、pvdf、聚甲基丙烯酸酯、尼龍、纖維素、纖維素酯、混合纖維素酯、纖維素醚、交聯的海藻酸、取代和交聯的瓜爾膠、瓊脂、瓊脂糖、凝膠、葡聚糖和聚丙烯醯胺,這類聚合物或可連接核酸酶的任何其他材料的混合物、共聚物和三元共聚物。
所使用的支持體可包含用於連接核酸酶的官能團,例如但不限於羧基、胺、氨基、羧化物、滷化物、酯、醇、脲、醛、氯甲基、氧化硫、氧化氮、環氧樹脂和/或甲苯磺醯基官能團。通過多種方法中的任何一種(示例性地包括吸附和化學鍵合)來實現核酸酶與支持體的連接。在一個實施例中,1-乙基-3-[3-二甲基氨基丙基]碳二亞胺氫氯化物、edc或edac化學品可用於將核酸酶連接於支持體。核酸酶可直接或間接地與支持體材料鍵合,例如經由與布置在支持體上的包膜或接頭鍵合。官能團、其修飾以及蛋白與支持體的連接是本領域已知的,例如記載於fitch,r.m,polymercolloids:acomprehensiveintroduction,academicpress,1997。
用於連接核酸酶的支持體可以為多種形式和形狀中的任何一種,包括但不限於微滴定板、微滴定孔、針、纖維、珠、載片、矽晶片和膜,例如硝酸纖維素膜或pvdf膜。
任選地,將核酸酶連接於顆粒形式的支持體。這類支持體可以是多種形狀和大小中任何一種的固體或半固體顆粒。顆粒示例性地為有機或無機顆粒,例如玻璃或金屬,並且可以為合成或天然存在的聚合物顆粒,例如聚苯乙烯、聚碳酸酯、矽、尼龍、纖維素、瓊脂糖、葡聚糖、聚丙烯醯胺,以及乳膠小珠(latexbead)。
支持體及所連接的核酸酶尺寸可阻止其進入固定的細胞,例如直徑大於10nm的顆粒尺寸。
根據本發明的方面,通過使胎兒絨毛外滋養層細胞與特異地針對胎兒絨毛外滋養層細胞的抗體接觸並捕獲結合至所述抗體的胎兒絨毛外滋養層細胞,來實現從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞,其中所述抗體不與母體子宮頸內樣品中的母體細胞結合。
根據本發明的方法的特定方面,所述抗體特異地針對主要組織相容性複合物i類g(hla-g)。
任選地,將特異地針對胎兒絨毛外滋養層細胞的抗體連接於不溶於水溶液的任何固體或半固體,例如本文所描述的用於連接核酸酶的那些。通過多種方法中的任何一種實現抗體與支持體的連接,所述方法示例性地包括本文所描述的用於連接核酸酶的吸附和化學鍵合。
任選地,將特異地針對胎兒絨毛外滋養層細胞的抗體直接連接於支持體。術語「直接連接」用於表示所述支持體共價或非共價地連接於特異地針對胎兒絨毛外滋養層細胞的抗體,並且所述支持體不通過第二抗體連接於所述抗體。
在另一個選項中,在沒有插入蛋白a或蛋白g分子的情況下將特異地針對胎兒絨毛外滋養層細胞的抗體連接於支持體。因此,根據本發明的方法的特定方面,沒有蛋白a或蛋白g連接於支持體。
將特異地針對胎兒絨毛外滋養層細胞的抗體連接於任何不溶性支持體。
根據本發明的方法的特定方面,所述支持體為多個磁性顆粒,並且從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞的步驟包括將所述磁性顆粒暴露於磁體。
與特異性結合至胎兒抗原的抗體直接偶聯的磁性納米顆粒通常具有10nm-1μm範圍的尺寸,儘管可使用更小或更大的磁性納米顆粒。
根據本發明的方法的特定方面,hla-g抗體連接於磁性納米顆粒。
任選地,分離胎兒絨毛外滋養層細胞的方法還包括:通過採用固定劑處理來固定母體子宮頸內樣品的細胞,其中所述採用固定劑的處理在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之前或之後進行。
採用核酸酶處理胎兒絨毛外滋養層細胞的步驟任選地在從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞之前或之後進行。
所使用的固定劑可以為戊二醛、甲醛、多聚甲醛,或其任意兩種或更多種的組合物。根據本發明的方法的特定方面,所述醛固定劑為多聚甲醛。
任選地,首先將母體子宮頸內樣品固定在非醛固定劑中。然後用醛固定劑來固定胎兒絨毛外滋養層細胞。任選地,通過用生理液體或緩衝劑(例如與哺乳細胞相容的鹽水或緩衝劑)清洗母體子宮頸內樣品以除去或部分除去非醛固定劑。
非醛固定劑示例性地包括丙酮、乙酸和醇類,例如乙醇和甲醇。任選地使用兩種或更多種非醛固定劑的組合。根據本發明的方面,將甲醇和乙酸的混合物用作非醛固定劑。
根據本發明的方法的特定方面,用蛋白酶和/或糖胺聚糖降解酶(gagase)來進一步處理胎兒絨毛外滋養層細胞,其中用蛋白酶和/或gagase處理胎兒絨毛外滋養層細胞的步驟在從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞之前或之後並且在用核酸酶處理胎兒絨毛外滋養層細胞之前或之後進行。
糖胺聚糖降解酶包括,例如透明質酸酶、肝素酶和軟骨素酶。
根據本發明的方法的特定方面,未用溶粘蛋白劑處理母體子宮頸內樣品。根據本發明的方法的特定方面,未用選自n-乙醯-l-半胱氨酸、dtt、胰蛋白酶和胰蛋白酶/edta的溶粘蛋白劑處理母體子宮頸內樣品。根據本發明的方法的特定方面,未用膠原酶、蛋白酶、liberaseblendzyme和溶粘蛋白劑中的一種或更多種處理母體子宮頸內樣品。
任選地,在分離胎兒絨毛外滋養層細胞之前對母體子宮頸內樣品進行酸化。任選地,將酸化劑添加到樣品中,使樣品的ph至約ph5-6。酸化劑可以是例如任何酸或酸性緩衝劑。
根據本發明的方面的方法任選地還包括測定經分離的胎兒絨毛外滋養層細胞。根據本發明的方面,分離並分析胎兒絨毛外滋養層細胞以輔助診斷和治療胎兒和/或孕育胎兒的孕婦,以促進胎兒和/或孕育胎兒的孕婦的健康。
這類測定包括胎兒絨毛外滋養層細胞的一種或更多種蛋白或肽的測定和/或胎兒絨毛外滋養層細胞的一種或更多種核酸的測定。
根據本發明的方面,將結合測定任選地用於胎兒絨毛外滋養層細胞測定中。
結合測定是通過與結合伴侶的結合來檢測靶分析物(例如生物標記)的測定。術語「結合伴侶」指能夠特異性地結合至靶分析物的生物分子。結合伴侶的非限制性實例包括靶分析物的抗體、適體(aptamer)、受體、配體和酶反應底物。結合伴侶也可以是核酸探針。技術人員能夠常規地鑑定、分離和/或製備結合伴侶並將它們用於結合測定中。這樣的技術是本領域普通技術人員公知的。
可根據允許通過結合至結合伴侶來檢測一種或更多種靶分析物的多種方法中的任何一種,進行結合測定。可直接或間接地(例如通過使用可檢測的標籤)檢測靶分析物和結合試劑的結合。
核酸測定,例如測序、擴增測定和/或雜交測定,可用於檢測經分離的胎兒絨毛外滋養層細胞的靶分析物(例如生物標記)的表達。根據標準dna提取步驟,從胎兒絨毛外滋養層細胞分離dna。優選從胎兒絨毛外滋養層細胞分離rna,如本文中根據本發明的方面所描述的。
核酸測定包括但不限於擴增反應,例如聚合酶鏈反應(pcr),例如rt-pcr;斑點印跡法;原位雜交;rna印跡法;和rnase保護。這類測定的詳細內容例如記載於j.sambrookandd.w.russell,molecularcloning:alaboratorymanual.coldspringharborlaboratorypress;3rded.,2001;和f.m.ausubel,ed.,shortprotocolsinmolecularbiology,currentprotocols;5thed.,2002。
在核酸測定中可使用核酸探針或引物,其能夠與靶分析物mrna或cdna雜交以檢測和/或對mrna或cdna進行定量。核酸探針可以是長度至少為10、15、30、50或100個核苷酸並且足以在嚴格條件下與靶mrna或cdna或其互補序列特異性雜交的寡核苷酸。核酸引物可以是長度至少為10、15或20個核苷酸並且足以在嚴格條件下與mrna或cdna或其互補序列特異性雜交的寡核苷酸。術語「特異性雜交」和「特異性地雜交」是指特定的核酸與靶核酸的雜交,並且基本上不與樣品中靶核酸以外的核酸雜交。
雜交嚴格度和清洗條件取決於若干因素,包括探針和靶標的tm,以及雜交和清洗條件的離子強度,如技術人員公知的。雜交和實現所需雜交嚴格度的條件記載於,例如sambrooketal.,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress,2001;和ausubel,f.etal.,(eds.),shortprotocolsinmolecularbiology,wiley,2002。
根據本發明的方法,任選地純化來自非人類動物的樣品用於測定。
術語「核酸」是指具有多於一個核苷酸的rna或dna分子,其為任何形式,包括單鏈、雙鏈的寡核苷酸或多聚核苷酸。術語「核苷酸序列」是指在核酸的單鏈形式中寡核苷酸或多聚核苷酸中的核苷酸的排序。
術語「擴增測定」是指複製模板核酸,從而產生包含全部或部分模板核酸的副本的核酸的方法。
擴增測定包括下述測定,其包括使用位於靶核酸側翼的一對引物通過核酸聚合酶催化的模板引導的引物延伸,所述測定示例性地包括但不限於聚合酶鏈反應(pcr)、逆轉錄pcr(rt-pcr)、連接介導的pcr(lm-pcr)、phi-29pcr和其他核酸擴增方法,例如c.w.dieffenbachetal.,pcrprimer:alaboratorymanual,coldspringharborlaboratorypress,2003;和v.demidovetal.,dnaamplification:currenttechnologiesandapplications.taylor&francis,2004中所描述的。術語「引物」是指長度通常為約9-60個核苷酸的單鏈寡核苷酸,其可以更長或更短,並且作為模板引導的dna合成的起始點而起作用。
體外核酸擴增方法的適合的反應條件包括存在適合的反應組分,其包括但不限於聚合酶和三磷酸核苷酸。本領域技術人員使用本發明的引物,僅通過常規實驗就能夠確定適於靶核酸擴增的條件,包括選擇因素例如緩衝劑、核苷酸、ph、mg鹽濃度、引物濃度和溫度。擴增方法的核酸產物任選地包括另外的材料,例如但不限於非靶核酸序列、用於化學反應的官能團和存在於引物中且不存在於原始dna模板中的可檢測的標籤。所進行的pcr也可以為定量pcr(q-pcr),也稱為實時pcr或動力學pcr(kpcr)。q-pcr也用於擴增並且同時對靶dna分子進行定量。
術語「定量pcr」或「q-pcr」是指用於對聚合酶鏈反應的結果進行定量的多種方法。q-pcr方法通常測定或比較擴增因子,例如測定循環閾值(ct),或為共擴增方法,其比較從靶標和標準模板同時擴增而產生的產物的量。許多q-pcr技術包括報告探針、插入劑染料或二者。報告探針包括但不限於探針(appliedbiosystems)、分子信標、引物、luxtm引物和fret引物;插入劑染料包括但不限於溴化乙錠、greeni(molecularprobes)和(molecularprobes)。
對於dna樣品中的一個或更多個特異性序列,實時pcr能夠進行檢測和定量兩者。當歸一化至dna輸入或另外的歸一化基因時,所述量可以是絕對拷貝數或相對量。兩種用於檢測實時pcr產物的常規方法為:(1)插入任何雙鏈dna的非特異性螢光染料,和(2)由用螢光報告物標記的寡核苷酸組成的序列特異性dna探針,所述螢光報告物僅在所述探針與其互補dna靶標雜交之後才能檢測。例如,使用taqman探針。在與互補靶序列雜交和基於螢光團檢測過程中,taqman探針原理依賴於taq聚合酶的5′-3′外切核酸酶活性以切開雙標記探針。如在其他實時pcr方法中,產生的螢光信號允許定量測量pcr指數階段的產物累積;然而,taqman探針顯著提高檢測特異性。taqman探針由共價連接到寡核苷酸探針5』-末端的螢光團和位於3』-末端的猝滅劑組成。可使用若干不同的螢光團(例如6-羧基螢光素,首字母縮略詞:fam,或四氯螢光素,首字母縮略詞:tet)和猝滅劑(例如,四甲基羅丹明,首字母縮略詞:tamra,或二氫環吡咯並吲哚三肽小溝結合物,首字母縮略詞:mgb)。猝滅劑分子猝滅螢光團經由fret(螢光共振能量轉移)被循環光源激發時發出的螢光。只要螢光團和猝滅劑位置接近,猝滅反應即能抑制任何螢光信號。
設計taqman探針以使它們在由特定引物組擴增的dna區域內退火。由於taq聚合酶使引物延伸併合成新產生的鏈(同樣,在單鏈模板上,但是在與圖中所示方向相反的方向上,即從互補鏈的3』-末端至5』-末端),所述聚合酶的5』至3』外切核酸酶活性降解已退火至模板的探針。探針的降解從其中釋放螢光團並且使與猝滅團的緊密接近斷裂,因此解除猝滅效應並使螢光團發出螢光。因此,在實時pcr熱循環儀中檢測到的螢光與所釋放的螢光團和pcr中存在的dna模板的量直接成比例。
根據本發明的方面,pcr用於全基因組擴增。
靶核酸的雜交測定包括但不限於斑點印跡法、核酸雜交、珠測定、原位雜交、rna印跡法、dna印跡法和微陣列測定。這些測定的具體內容記載於例如j.sambrookandd.w.russell,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress;3rded.,2001;和f.m.ausubel,ed.,shortprotocolsinmolecularbiology,currentprotocols;5thed.,2002。
核酸雜交測定包括使用核酸探針,所述探針在確定的雜交和清洗條件下與靶核酸特異性雜交。術語「探針」包括各種長度的核酸序列,通常長度至少為約9至約8000個核苷酸,但可以更短或更長,只要在核酸雜交測定中探針能夠與靶核酸特異性雜交即可。探針可以是單鏈或雙鏈的,並且可以通過重組方法、化學合成、從天然來源分離或這些方法中的兩種或更多種的組合而產生。
適用於多種測定(例如比較轉錄組和鑑定生物標記)的測序方法包括例如大規模平行信號測序、單分子實時測序、聚合酶克隆測序(polonysequencing)、離子半導體(iontorrent測序)、焦磷酸測序(454)、合成測序(illumina)、連接測序(solid測序)、鏈終止測序(sanger測序)。
根據本發明的方面,從胎兒絨毛外滋養層細胞分離胎兒rna用於測定。
根據本發明的方面,提供了從胎兒絨毛外滋養層細胞分離和/或測定rna的方法,其包括:從妊娠受試者獲得母體子宮頸內樣品;用dnase處理胎兒絨毛外滋養層細胞;從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞;清洗醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;以及從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna。
根據本發明的方面,提供了從胎兒絨毛外滋養層細胞分離和/或測定rna的方法,其中在裂解胎兒絨毛外滋養層細胞之前不用dnase處理胎兒絨毛外滋養層細胞,所述方法包括:從妊娠受試者獲得母體子宮頸內樣品;從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞;通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞;清洗醛固定的胎兒絨毛外滋養層細胞以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞;以及從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna。從所述經清洗的胎兒絨毛外滋養層細胞中提取胎兒絨毛外滋養層細胞rna的步驟包括裂解經清洗的胎兒絨毛外滋養層細胞,產生裂解的胎兒絨毛外滋養層細胞。
用dnase和蛋白酶處理所述裂解的胎兒絨毛外滋養層細胞以降解胎兒絨毛外滋養層細胞dna和蛋白。
測定胎兒絨毛外滋養層細胞rna以確定胎兒絨毛外滋養層細胞rna的一個或更多個特徵,並且任選地將所述rna與標準物進行比較。
在從母體子宮頸內樣品中分離胎兒絨毛外滋養層細胞之前和/或之後,任選地用醛固定劑處理胎兒絨毛外滋養層細胞。
在另一個選項中,在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品固定。進一步任選地,在從妊娠受試者獲得樣品之後立即將母體子宮頸內樣品在非醛固定劑中固定,並且該在非醛固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行。在又一個選項中,在從妊娠受試者獲得樣品之後立即通過用醛固定劑處理來固定母體子宮頸內樣品。
在從母體子宮頸內樣品中分離之前或之後,任選地用dnase處理胎兒絨毛外滋養層細胞。
根據優選的方面,在將完整的胎兒絨毛外滋養層細胞從母體宮頸內樣品分離之前或之後,不用dnase處理所述完整的胎兒絨毛外滋養層細胞。在分離胎兒絨毛外滋養層細胞rna的過程中,用dnase處理裂解的胎兒絨毛外滋養層細胞以除去胎兒絨毛外滋養層細胞dna。
可用醛固定劑來固定細胞,所述醛固定劑選自戊二醛、甲醛、多聚甲醛和其任意兩種或更多種的混合物。根據本發明的方面,採用多聚甲醛來固定細胞。
在醛固定條件下進行胎兒絨毛外滋養層細胞的固定。醛固定條件包括醛固定劑濃度、任選的緩衝劑、時間和溫度。
所使用的醛固定劑的濃度取決於待使用的所需固定時間和溫度。所使用的醛固定劑的濃度通常為0.1至10%(w/v)的水溶液,例如0.5至6重量%(w/v)的水溶液或1至4%(w/v)的水溶液。
可通過將醛固定劑溶解於水溶液中來製備醛固定劑。所述水溶液任選地為緩衝液,例如生理ph下的生理緩衝液。
固定溫度可發生變化,例如,根據所需的固定時間而變化。固定溫度通常為約4℃-40℃。
通過下述方法至少部分地除去由醛固定劑引入的交聯:通過在確定的熱和鹽的條件下在水清洗液中清洗來處理醛固定的胎兒絨毛外滋養層細胞。通過下述方法來實現由醛固定引入的交聯的去除:在4℃-80℃的溫度下,在約ph7.0-8.0的生理ph範圍下的生理緩衝劑(例如但不限於磷酸鹽緩衝液如pbs、tris緩衝液如tris-hcl、hepes或三乙醇胺緩衝液)中在清洗液中清洗細胞,清洗時間為幾天(針對低於室溫的溫度)至15分鐘(針對高於約60℃的溫度)。可通過例如下述方法來實現由醛固定引入的交聯的去除:在具有高於生理鹽濃度(例如160mm-300mm的nacl濃度)的溶液中清洗細胞,清洗時間為幾天至15分鐘。可使用熱和高於生理鹽濃度的組合。
在清洗液中任選地包含穩定劑,例如但不限於edta。edta任選地以0.1mm-20mm、0.5mm-10mm或0.75-5mm的量存在。
至少部分去除由醛固定引入的交聯的具體條件以及對去除醛交聯的評估記載於darlingetal.,anal.chem.,86:5678-5681,2014和niranjanakumaris.etal.,methods2002;26:182-190中。
通過多種方法中的任何一種來實現細胞裂解,所述方法示例性地包括超聲處理或用洗滌劑處理。
根據本發明的方面,在裂解前清洗經分離的胎兒絨毛外滋養層細胞以至少部分去除由醛固定引入的交聯。
進一步處理經清洗的胎兒絨毛外滋養層細胞以分離rna。這樣的處理包括裂解胎兒絨毛外滋養層細胞,以及將胎兒絨毛外滋養層細胞dna和蛋白與rna分離。通過多種方法中的任何一種來實現胎兒絨毛外滋養層細胞dna和蛋白與rna的分離,所述方法示例性地包括:通過裂解細胞的dnase處理來降解胎兒絨毛外滋養層細胞dna,和/或通過裂解細胞的蛋白酶處理來降解蛋白。任選地,在清洗液中包含蛋白酶。
然後通過多種方法中的任何一種(例如沉澱和清洗)可進一步純化rna以除去dnase和/或蛋白酶和降解的dna和/或蛋白。
或者,根據本發明的方面,裂解經分離的胎兒絨毛外滋養層細胞並清洗胎兒絨毛外滋養層細胞裂解物以至少部分除去由醛固定引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞裂解物。
根據本發明的方面,通過在清洗液中包含洗滌劑來同時進行經分離的胎兒絨毛外滋養層細胞的裂解和清洗以至少部分除去由醛固定引入的交聯。例如,洗滌劑任選地以清洗液的0.1-5%w/v、0.25-2.5%w/v或0.5-1.5%w/v的量而包含在清洗液中。所包含的洗滌劑例如但不限於sds、nonidetp-40、tween-20和triton-x100。同時裂解的清洗液的實例為200mmnacl、10mmtris-hclph8.0、1mmedta和1%sds。同時裂解的清洗液的另一個實例為200mmnacl、10mmtris-hclph8.0、1mmedta、1%sds和蛋白酶,例如50-1500mg/ml的蛋白酶k。
進一步處理經清洗的胎兒絨毛外滋養層細胞裂解物以分離rna。這樣的處理包括將胎兒絨毛外滋養層細胞dna和蛋白與rna分離。胎兒絨毛外滋養層細胞dna和蛋白與rna的分離可通過多種方法中的任何一種來實現,所述方法示例性地包括:通常通過裂解細胞的dnase處理和/或裂解細胞的蛋白酶處理來降解胎兒絨毛外滋養層細胞dna。dnase通常以約50-500kunitiz單位/毫升裂解物的量使用。然後通過多種方法中的任何一種(例如沉澱、離心和清洗)可進一步純化rna以除去dnase以及降解的dna和/或蛋白。
測定胎兒絨毛外滋養層細胞rna包括任何適用的核酸測定。
經分離的rna任選地用於構建「下一代測序」文庫,該文庫通過使用scriptseqv2rna-seq文庫製備試劑盒(epicentre)產生條碼文庫而構建。
可對從胎兒和母體細胞分離的rna進行測序以鑑定胎兒和母體細胞中的基因產物。不同細胞群中的基因產物的比較用於鑑定共性和差異,所述共性和差異指示出胎兒和/或母親的健康以及妊娠相關的病理狀態,例如先兆子癇、子宮內生長受限、早產和流產。
使用qpcr可將rna反轉錄為cdna用於分析。根據本發明的方面,本發明的方法可用於鑑定具有正常結果的妊娠與具有不良結果的妊娠(先兆子癇、子宮內生長受限、早產、流產及其他)在5至20孕周中由胎兒絨毛外滋養層細胞差異化表達的基因。一旦鑑定,經分離的rna可用於核酸測定,例如定量rt-pcr,例如來前瞻性地篩選患者以評估她們產生不良結果的風險。
免疫測定方法可用於測定靶分析物(例如樣品中的生物標記),所述方法包括但不限於酶聯免疫吸附測定(elisa)、酶聯免疫過濾測定(elifa)、流式細胞術、免疫印跡法、免疫沉澱、免疫組織化學、免疫細胞化學、發光免疫測定(lia)、螢光免疫測定(fia)和放射性免疫測定。測定方法可用於獲得定性和/或定量結果。同時適於樣品的定性和定量測定的測定方法的具體內容記載於標準文獻中,示例性地包括e.harlowandd.lane,antibodies:alaboratorymanual,coldspringharborlaboratorypress,1988;f.breitlingands.dubel,recombinantantibodies,johnwiley&sons,newyork,1999;h.zola,monoclonalantibodies:preparationanduseofmonoclonalantibodiesandengineeredantibodyderivatives,basics:frombackgroundtobench,biosscientificpublishers,2000;b.k.c.lo,antibodyengineering:methodsandprotocols,methodsinmolecularbiology,humanapress,2003;f.m.ausubeletal.,eds.,shortprotocolsinmolecularbiology,currentprotocols,wiley,2002;s.klussman,ed.,theaptamerhandbook:functionaloligonucleotidesandtheirapplications,wiley,2006;ormerod,m.g.,flowcytometry:apracticalapproach,oxforduniversitypress,2000;givan,a.l.,flowcytometry:firstprinciples,wiley,newyork,2001;gorczyca,w.,flowcytometryinneoplastichematology:morphologic-immunophenotypiccorrelation,taylor&francis,2006;crowther,j.r.,theelisaguidebook(methodsinmolecularbiology),humanapress,2000;wild,d.,theimmunoassayhandbook,3rdedition,elsevierscience,2005,和j.sambrookandd.w.russell,molecularcloning:alaboratory′manual,coldspringharborlaboratorypress,3rded.,2001。
抗體和製備抗體的方法是本領域公知的。本文使用的術語「抗體」包括單克隆抗體、多克隆抗體、雙特異性抗體、多特異性抗體、人抗體、人源化抗體、嵌合抗體、駱駝化抗體、單區抗體、單鏈fvs(scfv)、單鏈抗體、二硫化物連接的fvs(sdfv)和抗獨特型(抗id)抗體,以及上述任何一種的抗原結合片段。特別地,抗體包括免疫球蛋白分子和免疫球蛋白分子的免疫活性片段,即包含抗原結合位點的分子。免疫球蛋白分子為任何類型(例如igg、ige、igm、igd、iga和igy)、類別(例如igg1、igg2、igg3、igg4、iga1和iga2)或子類別。
本文使用的術語「抗體片段」和「抗原結合片段」定義了與靶分析物免疫特異性結合的抗體片段。可通過本領域技術人員已知的任何技術產生抗體片段。例如,使用酶例如木瓜蛋白酶(以產生fab片段)或胃蛋白酶(以產生f(ab′)2片段),通過免疫球蛋白分子的蛋白水解裂解可產生fab和f(ab′)2片段。也可通過重組dna技術產生抗體片段。
抗體、抗原結合片段、它們的產生方法和在產生的抗體中篩選與抗原基本上特異性結合的抗體的方法是本領域已知的,並且這樣的抗體、抗原結合片段和方法進一步詳細記載於例如antibodyengineering,kontermann,r.anddubel,s.(eds.),springer,2001;harlow,e.andlane,d.,antibodies:alaboratorymanual,coldspringharborlaboratorypress,1988;f.breitlingands.dubel,recombinantantibodies,johnwiley&sons,newyork,1999;h.zola,monoclonalantibodies:preparationanduseofmonoclonalantibodiesandengineeredantibodyderivatives,basics:frombackgroundtobench,biosscientificpublishers,2000;ausubel,f.etal.,(eds.),shortprotocolsinmolecularbiology,wiley,2002;j.d.pound(ed.)immunochemicalprotocols,methodsinmolecularbiology,humanapress,2nded.,1998;b.k.c.lo(ed.),antibodyengineering:methodsandprotocols,methodsinmolecularbiology,humanapress,2003;和kohler,g.andmilstein,c,nature,256:495-497(1975)。針對靶分析物(例如生物標記)的抗體可在動物中產生,合成,通過重組方法產生,和/或從商業上獲得。
適體可用於測定靶分析物。術語「適體」是指與特定物質基本上特異性結合的肽和/或核酸。在核酸適體的情況下,所述適體的特徵在於除watson/crick鹼基配對以外與靶標的結合相互作用或與第二和/或第三核酸的三螺旋結合。這樣的結合相互作用可包括例如範德華相互作用、疏水相互作用、氫鍵和/或靜電相互作用。類似地,基於肽的適體的特徵在於與靶標的特異性結合,其中所述適體不是靶標的天然存在的配體。鑑定和產生肽和核酸適體的技術以及它們的用途是本領域已知的,例如f.m.ausubeletal.,eds.,shortprotocolsinmolecularbiology,currentprotocols,wiley,2002;s.klussman,ed.,theaptamerhandbook:functionaloligonucleotidesandtheirapplications,wiley,2006;和j.sambrookandd.w.russell,molecularcloning:alaboratorymanual.coldspringharborlaboratorypress,3rded.,2001中記載的。
通過本領域已知的多種方法中的任何一種來實現檢測樣品中存在的靶分析物和結合伴侶之間的結合,所述方法示例性地包括檢測直接或間接地連接於靶分析物或結合伴侶的可檢測的標籤。術語「可檢測的標籤」是指通過任何適合的方法能夠產生指示存在可檢測的標籤的信號的材料,所述方法示例性地包括光譜法、光學法、光化學法、生物化學法、酶法、電學法和/或免疫化學法。可檢測的標籤的實例示例性地包括螢光基團、化學發光基團、生物發光基團、電子緻密顆粒、磁性顆粒、酶、底物、放射性同位素和生色團。
所使用的具體的可檢測的標籤取決於所使用的檢測方法。這樣的檢測方法被併入特定的測定形式中,示例性地包括elisa、蛋白質印跡法、免疫沉澱、免疫細胞化學、免疫螢光測定、液相色譜法、流式細胞術、本領域已知的其他檢測方法,或它們的組合。
結合測定可包括連接於支持體的結合伴侶。在結合測定中使用的連接了結合伴侶的支持體可以是固體或半固體的,並且可以是多種材料中的任何一種,例如玻璃、矽、紙、合成或天然存在的聚合物,例如聚苯乙烯、聚碳酸酯、聚丙烯、pvdf、尼龍、纖維素、瓊脂糖、葡聚糖和聚丙烯醯胺,或可穩定連接結合伴侶以用於結合測定的任何其他材料。
所使用的支持體可包含用於結合至結合伴侶的官能團,例如但不限於羧基、胺、氨基、羧化物、滷化物、酯、醇、脲、醛、氯甲基、氧化硫、氧化氮、環氧樹脂和/或甲苯磺醯基官能團。通過多種方法中的任何一種(示例性地包括吸附和化學鍵合)來實現結合伴侶與支持體的連接。在一個實施例中,1-乙基-3-[3-二甲基氨基丙基]碳二亞胺氫氯化物、edc或edac化學可用於將結合伴侶連接於顆粒。結合伴侶可直接或間接地與支持體材料鍵合,例如通過與布置在支持體上的包膜或接頭鍵合。官能團、其修飾和結合伴侶與支持體的連接是本領域已知的,例如記載於fitch,r.m,polymercolloids:acomprehensiveintroduction,academicpress,1997中。
這類支持體可以是多種形式和形狀中的任何一種,包括但不限於微滴定板、微滴定孔、針、纖維、珠、載片、矽晶片和膜,例如硝酸纖維素膜或pvdf膜。
根據本發明的實施方案,多種光譜法的任何一種可用於測定靶分析物,例如生物標記,所述方法包括但不限於氣相色譜法、液相色譜法、離子遷移譜、質譜、液相色譜-質譜(lc-ms或hplc-ms)、離子遷移譜-質譜、串聯質譜、氣相色譜-質譜、基質輔助解析電離飛行時間(maldi-tof)質譜、表面增強雷射解析電離(seldi)和核磁共振光譜,這些都是本領域技術人員公知的。
任選地,光譜分析用於測定樣品中的靶分析物,例如生物標記。質譜分析可用於根據本發明的方面的測定中。使用例如飛行時間
(tof)質譜或傅立葉變換離子迴旋共振質譜來進行質量分析。質譜技術是本領域已知的,並且蛋白質和/或肽測定方法的示例性詳細描述記載於lij.,etal.,clinchem.,48(8):1296-304,2002;hortin,g.l.,clinicalchemistry52:1223-1237,2006;a.l.burlingame,etal.(eds.),massspectrometryinbiologyandmedicine,humanapress,2000;和d.m.desiderio,massspectrometry0fpeptides,crcpress,1990中。
使用分離細胞的質譜法
用於不良妊娠結果的生物標記之前被局限於可在母體循環中檢測到的那些,其通常為由胎盤或其他受影響的器官分泌的蛋白。胎盤釋放的蛋白需要達到某一閾值(在第二個和第三個三個月),以在母體血液中檢測。
根據本發明的方法的方面,經分離的胎兒絨毛外滋養層細胞的質譜(ms)分析提供了少量細胞的靈敏的分析。典型的母體子宮頸內樣品產生500-2000個胎兒evt細胞。根據本發明的方法的方面,ms方法能夠進行少量細胞的分析。
使用質譜的高解析度表型分析
根據本發明的方面,提供了測定胎兒絨毛外滋養層細胞的方法,其包括從妊娠受試者獲得母體子宮頸內樣品;使母體子宮頸內樣品與第一抗體接觸,所述第一抗體特異地針對胎兒絨毛外滋養層細胞,其中所述第一抗體不與母體子宮頸內樣品中的母體細胞結合;使母體子宮頸內樣品與一種或更多種另外的抗體接觸,其中採用不同的標籤可區分地標記所述第一抗體和每種另外的抗體,所述不同的標籤可通過電感耦合等離子體質譜檢測;將所述母體子宮頸內樣品噴成霧狀以分離細胞;以及對細胞進行電感耦合等離子體質譜,從而測定胎兒絨毛外滋養層細胞。
根據本發明的方面,使用靶向質譜用於蛋白、肽和翻譯後修飾的靈敏的和定量的檢測。為了增加靈敏度和對特定蛋白進行定量,可將肽引入質譜生物標記中,其可用於對小樣品量進行蛋白定量。
根據本發明的方面,任選地使用「cytotof」用於胎兒絨毛外滋養層細胞特異性蛋白的深度表型分析。「cytotof」將質譜和細胞上的蛋白的抗體標記相結合。採用不同同位素標記針對特異性靶標的抗體,這使得可通過質譜方法區分所述抗體。將待測定的細胞用抗體標記,將細胞噴成霧狀,並且測量各質量/金屬標記的抗體的飛行時間並進行定量。這種方法使得能夠分析一個單獨細胞上最多達100種標記。在該方法中,不需要純化胎兒絨毛外滋養層細胞。hla-g陽性可用作深度表型分析方法和高單細胞解析度中的標識。
標準
適用於測定的標準是本領域熟知的,並且所使用的標準可以為任意適合的標準。
在一個實施例中,標準是來自對照動物的可比較的樣品中的生物標記的測定結果。
標準可以是之前在單獨的對照動物或對照動物群體的樣品中測定的一個或更多個生物標記的參照水平,並且存儲在印刷品或電子媒介中,以用於檢索並與給予測試化合物的動物中的一個或更多個生物標記的測定結果進行比較。
標準可以是在不同的時間在可比較的動物樣品中的一個或更多個生物標記的測定結果。例如,標準可以是在不同的時間(給予測試化合物之前或之後)從相同動物獲得的可比較樣品中的一個或更多個生物標記的測定結果。第一樣品可在第一時間從個體動物獲得,以獲得所述第一樣品中一個或更多個生物標記的動物特異性基線水平。第二樣品可在第二時間時從個體動物獲得,並測定一個或更多個生物標記以監測與第一樣品相比一個或更多個生物標記的水平差異。其他樣品可在其他時間點從動物獲得,並測定一個或更多個指示物以監測與第一樣品、第二樣品或其他樣品相比一個或更多個指示物的水平差異。
標準可以是在從一個或更多個群體獲得的可比較樣品中的一個或更多個生物標記的平均水平。通過測定從群體的各動物獲得的可比較的樣品中一個或更多個指示物來確定「平均水平」。術語「可比較的樣品」用於表示樣品為相同類型,即例如可比較的樣品的每一種都是血清樣品。
與標準相比,本發明的測定中檢測到的一個或更多個生物標記的水平或表達的差異可以是所述一個或更多個生物標記的水平或表達的升高或降低。升高或降低的範圍可以為,例如標準水平的至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更高。
通過多種方法的任何一種,使用統計分析可分析測定結果,所述方法例如參數檢驗或非參數檢驗、方差分析、協方差分析、多元分析的對數回歸、fisher精確檢驗、卡方檢驗、學生t檢驗、mann-whitney檢驗、wilcoxon符號秩檢驗、mcnemar檢驗、friedman檢驗和page′sl趨勢檢驗。這些和其他統計學檢驗是本領域公知的,如hicks,cm,researchmethodsforclinicaltherapists:appliedprojectdesignandanalysis,churchilllivingstone(publisher);5thed.,2009;和freund,rjetal.,statisticalmethods,academicpress;3rded.,2010中詳細記載的。
任選地,本文所述的測定為由胎兒絨毛外滋養層細胞表達的一個或更多個生物標記的測定。例如,測定半乳糖凝集素13(lgals13,又稱為pp13)、半乳糖凝集素14(lgals14)、胎盤生長因子(pgf)、妊娠相關血漿蛋白a(pappa)、α胎兒蛋白(afp)、內皮因子(eng)或fms相關酪氨酸激酶1(flt-1)中的一個或更多個以檢測指示異常胎盤功能(例如先兆子癇、子宮內生長受限、自然流產和早產)的改變。
任選地,本文所述的測定為由妊娠的第一個和第二個三個月的胎兒的胎兒絨毛外滋養層細胞表達的一個或更多個生物標記的測定,所述生物標記例如半乳糖凝集素13(lgals13,又稱為pp13)、半乳糖凝集素14(lgals14)、胎盤生長因子(pgf)、妊娠相關血漿蛋白a(pappa)、α胎兒蛋白(afp)、內皮因子(eng)或fms相關酪氨酸激酶1(flt-1)中的一個或更多個。
本發明的組合物和方法的實施方案在以下實施例中舉例說明。提供這些實施例為示例性的目的,不應認為這些實施例限制了本發明的組合物和方法的範圍。
實施例
實施例1
分離未固定的胎兒絨毛外滋養層細胞,以及從未固定的胎兒絨毛外滋養層細胞分離dna
使用細胞刷採集母體子宮頸內樣品,並在冰冷的培養基或pbs(137mmnacl,10mm磷酸緩衝液)中漂洗所述細胞刷。
將細胞離心,並重新懸浮於升溫至室溫的10mlpbs加2.7mmcacl2,1mmmgcl2中。
通過將1mgdnasei粉末(worthingtoncat#2138,>2000kunitz單位/mg)溶於10mlpbs加0.9mmmgcl2中來製備dnasei。
將dnase溶液的100μl等分部分加到細胞中並在室溫下孵育15min。然後用含有30mmedta的10mlpbs清洗細胞3次,然後再用pbs清洗兩次。
通過250微米的濾器將細胞離心,並將細胞在4℃重新懸浮於10mlpbs中。然後將細胞在10mlpbs中清洗2次並使最終細胞團的的體積為1ml於pbs中。
通過以下方法開始磁性分離步驟以移除胎兒細胞:在將細胞重新懸浮於1mlpbs之後,將20μl與抗-hla-g抗體綴合的250nm磁性納米顆粒添加到經清洗的細胞中並在4℃振蕩孵育1至24小時。
使用dynamagtm自旋磁體(lifetechnologies),將母體細胞(hla-g陰性)與磁化的(hla-g陽性)胎兒絨毛外滋養層細胞分離。
然後使用磁體將胎兒絨毛外滋養層細胞清洗3次以除去殘留的母體細胞。
將經分離的胎兒絨毛外滋養層細胞重新懸浮於50-100μlpbs/10mmedta溶液中。任選地,將經分離的母體細胞重新懸浮於50-100μlpbs/10mmedta溶液中。如果需要,取出15μl的等分溶液用於胎兒細胞和如果需要任選的母體細胞的細胞計數和質量控制。
將經分離的母體細胞和經分離的胎兒絨毛外滋養層細胞各50μl的等分溶液用於dna分離。
將3x濃縮的dna提取緩衝液(90mmtris、90mmedta、1.5%edta,ph8.0,3mg/ml蛋白酶k)的25微升等分溶液加到50微升經分離的母體細胞或經分離的胎兒絨毛外滋養層細胞中,用於dna分離。然後將這些混合物在65℃孵育3小時,之後在95℃孵育10min。將所提取的dna冷凍用於pcr測定,或可通過在微量離心機中高速離心5分鐘來進一步純化所提取的dna。任選地,仍然進一步純化dna,例如使用市售的dna純化和濃縮試劑盒,例如zymresearchdna10濃縮試劑盒。類似試劑的picogreen可用於dna定量。
在小珠上或在溶液中,在含有或不含有dnase的情況下孵育未固定的細胞。採用可溶的dnase處理的新鮮細胞平均產生3-6ng總dna。
使用zymresearchdna濃縮試劑盒的少量dna的dna純化導致30-50%的dna損失。從採用細胞刷取出的母體子宮頸內材料的單一樣品中分離平均2-4ng純的高品質dna。
實施例2
分離固定的胎兒絨毛外滋養層細胞,以及從固定的胎兒絨毛外滋養層細胞分離dna
使用細胞刷,通過將其插入子宮頸內管約2cm並在將其取出時旋轉2或3次,來採集母體子宮頸內樣品。在所述刷中也採集了子宮頸內管中存在的粘液。例如使用thinprep試劑盒,將細胞刷在固定劑中漂洗。冷凍或在室溫下保存樣品,並將其運送到實驗室以進行進一步處理。可將樣品在4℃保存至少一周,而不損失rna或hla-g蛋白。
為了分離胎兒絨毛外滋養層細胞和任選的母體細胞,在將母體子宮頸內樣品酸化之後用pbs清洗所有細胞兩次,所述酸化通過將0.6ml乙酸添加到20ml包含細胞的thinprep中而使最終濃度為3%乙酸。
通過250微米濾器來將細胞離心並在4℃將細胞重新懸浮於10mlpbs中。然後將細胞在10mlpbs中再清洗兩次,最終細胞團的體積為1ml於pbs中。
為了避免核dna被進入固定的可滲透的細胞中的核酸酶降解,將dnase連接(例如通過共價連接)至一個或更多個支持體(例如無法透過固定的細胞的小珠或顆粒)。在本實施例中,將共價連接於非磁性小珠的dnase——5微升f7(mobiotec,德國)——添加到細胞中,並在室溫下孵育10min。
開始磁性分離步驟以移除胎兒細胞,振蕩1小時至24小時,如bolrticketal.,fertil.steril.,102:135-142.e6,2014中所述。
使用dynamagtm自旋磁體(lifetechnologies)將母體細胞(hla-g陰性)與磁化的(hla-g陽性)胎兒絨毛外滋養層細胞分離。
然後將胎兒絨毛外滋養層細胞在含有30mmedta的pbs中清洗3次。
任選地,使用15微米的網孔來純化母體細胞,然後清洗和濃縮細胞。
將經分離的胎兒絨毛外滋養層細胞重新懸浮於50-100μlpbs/10mmedta溶液中。任選地,將經分離的母體細胞重新懸浮於50-100μlpbs/10mmedta溶液中。如果需要,取出15微升等分溶液用於胎兒細胞和如果需要任選的母體細胞用於細胞計數和質量控制。
將3x濃縮的dna提取緩衝液(90mmtris、90mmedta、1.5%edta,ph8.0,3mg/ml蛋白酶k)的25微升等分溶液加到50微升經分離的母體細胞或經分離的胎兒絨毛外滋養層細胞中用於dna分離。然後將這些混合物在65℃孵育3小時,之後在95℃孵育10min。將所提取的dna冷凍用於pcr測定,或可通過在微量離心機中高速離心5分鐘來進一步純化所提取的dna。任選地,仍然進一步純化dna,例如使用市售的dna純化和濃縮試劑盒,例如zymresearchdna10濃縮試劑盒。類似試劑的picogreen用於dna定量。
在小珠上或在溶液中,在含有或不含有dnase的情況下孵育固定的細胞。採用結合於小珠的dnasei處理的固定的母體細胞或胎兒細胞(500-1000)平均產生3-6ng總dna。
採用zymresearchdna濃縮試劑盒的少量dna的dna純化導致30-50%的dna損失。從採用細胞刷取出的母體子宮頸內材料的單一樣品中分離平均2-4ng純的高品質dna。
實施例3
從胎兒絨毛外滋養層細胞分離rna
使用細胞刷,通過將其插入子宮頸內管約2cm並在將其取出時旋轉2或3次,來採集母體子宮頸內樣品。在所述刷中也採集了子宮頸內管中存在的粘液。將細胞刷在固定劑(例如緩衝甲醇溶液)中漂洗。將樣本在冷凍或室溫下保存,並將其運送到實驗室以進行進一步處理。可將樣品在4℃保存至少一周,而不損失rna或hla-g蛋白。
為了從胎兒絨毛外滋養層細胞中分離rna,在將母體子宮頸內樣品酸化之後用pbs清洗全部細胞兩次,所述酸化通過將0.6ml乙酸添加到20ml包含細胞的緩衝甲醇溶液而使最終濃度為3%乙酸。
通過250微米濾器來離心細胞,除去上清液並將細胞團迅速地重新懸浮於4%多聚甲醛/pbs中10分鐘,然後再次使細胞成團並用pbs或tris緩衝劑衝洗細胞。甲醛固定防止了高度可溶的核酸的損失並有效地使內源rnase失活。
通過免疫磁性分離來移除hla-g陽性的胎兒絨毛外滋養層細胞,所述免疫磁性分離包括將細胞與附著於磁珠的抗hla-g抗體孵育的步驟,如bolnicketal.,fertil.steril.,102:135-142.e6,2014所述,並且使用dynamagtm自旋磁體(lifetechnologies)將母體細胞(hla-g陰性)與磁化的(hla-g陽性)胎兒絨毛外滋養層細胞分離。
然後在含有30mmedta的pbs中清洗胎兒絨毛外滋養層細胞3次。
在胎兒絨毛外滋養層細胞的免疫磁性分離之後,將它們去交聯化,然後通過在56℃在200mmnacl、10mmtris-hclph8.0、1mmedta和1%sds以及1300μg/ml蛋白酶k中孵育15min和在80℃孵育15min來進行rna分離。清洗之後用180kunitz單位dnase/ml處理裂解物以除去dna。然後使用離心柱(spincolumn)來純化裂解物中的rna並使用不含rnase的水洗脫。使用agilent2100電泳微流體分析儀、使用rnapico試劑盒(agilenttechnologies)來對經分離的rna進行定量並評估純度。
在細胞裂解之前的任選的dnase處理在提取rna之前消除了dna汙染,所述rna在去交聯過程中被片段化。
使用agilent2100電泳微流體分析儀採用rnapico試劑盒(agilenttechnologies),對經分離的rna進行定量並評估其純度。使用cfx384biorad熱循環儀(lifetechnologies)通過半定量實時pcr來驗證片段化的rna的性質。對於粗製的thinprep樣品、經分離的胎兒絨毛外滋養層細胞和缺乏胎兒絨毛外滋養層細胞的母體細胞,評估來自19份母體子宮頸內樣品的rna回收,如圖1所示,四種不同已知豐度的rna的qpcr的ct值示於圖2。對於圖2,採用用於所示rrna或mrna的引物,通過qpcr來測定從等量rna所製備的cdna。在胎兒絨毛外滋養層細胞和母體分離物中回收的rna的量與粗製的未分離的子宮頸樣品相當。將來自經分離的胎兒絨毛外滋養層細胞(evt)的rna與從母體樣品中分離的rna進行比較,所述母體樣品不需要醛固定,因為直接使用細胞而不進行evt分離。儘管分析表明分離物中的rna是高度片段化的,但是當通過qpcr測定四種不同rna的等量rna時,分離物中的rna產生與粗製細胞相當的ct值。發現使用該方法回收了約50ng有用的rna。對本發明的經分離的胎兒絨毛外滋養層細胞進行的rna分離產生了足量的來自胎兒絨毛外滋養層細胞的rna,以用於qpcr分析。
然後通過使用scriptseqv2rna-seq文庫製備試劑盒(epicentre)產生條碼化的文庫,將經分離的rna用於構建rna測序文庫(圖3)。在illumina基因組分析ii測序儀上,對從單一樣品中的胎兒和母體細胞分離的rna進行測序,測序平行進行三次。測序後,使用多路解編軟體(demultiplexingsoft)處理rna數據。使用生物信息學工具novoalign,將測序數據與人類基因組構建(hg19)和核糖體序列18s和28s進行比對。獲得95%比對,表明rna文庫製備和多路解編均成功。在每種樣品中鑑定了超過20000種基因產物。將如此產生的讀段轉化為bed.文件並輸入genomatix比對站(gms)。gms產生rpkm(每100萬比對的片段中每一千鹼基外顯子的讀段)形式的數據用於資料庫中的25000個基因。樣品中rpkm值的比較表明母體樣品之間或胎兒樣品之間的緊密比對,但是當將胎兒樣品和母體樣品進行比對時出現明顯的離群值。各比較的實例示於圖4a-4c中。使用通過在evt細胞分離過程中將其與多聚甲醛交聯而獲得的rna,通過下一代測序分析產生了高質量的數據。
實施例4
對於罕見細胞群中的深度蛋白質組分析,根據本發明的方面,多路化的(multiplexed)分析包含了來自緊密相關的htr-8/svneo(htr)細胞滋養層細胞系的參照樣品。樣品中的每個通道包含100至1000個細胞。在ms1中離子選擇的信號和ms2中這些離子的測序是加和的,提供在100個細胞的樣品中結合其他多路化的樣品中的肽信號的擴增。使用同步化前體選擇(sps)——其中將10個ms2離子結合以產生用於定量的ms3光譜——以增加特異性和靈敏度,如tingetal.,natmethods2011;8:937-940;和mcalisteretal.,analchem2012;84:7469-7478中所述。在ms3光譜中發生個體樣品中蛋白質的指認和相對定量,如圖5a-5c所示出的,圖5a-5c表示ms2光譜(圖5a)和相應的定量ms3光譜(圖5b-5c)。在此處,滋養層細胞被等分為1000、500、250或100個細胞/管。採用proteasemax洗滌劑裂解細胞,該洗滌劑為有利於質譜的洗滌劑,其不需要從樣品中除去。在採用最小濃度的tcep和碘乙醯胺(iaa)將經裂解的細胞還原並烷基化之後,採用胰蛋白酶/lys-c消化所述經裂解的細胞。過夜消化之後,採用對於5毫克蛋白而言足量的tmt10plex試劑(thermoscientific)來標記肽。將被標記的肽混合,通過speed-vac濃縮,並使用sps直接在orbitrapfusion上運行以獲得定量光譜。通過與包含1000個細胞的『126』通道相比的信號比來確定更小的細胞樣品的定量。對於三個其他的1000個細胞的樣品,這些比例為0.99、1.031和1.031;對於500個細胞的樣品,這些比例為0.523和0.559;對於250個細胞的樣品,這些比例為0.226和0.232;對於100個細胞的樣品,這些比例為0.124和0.141(圖5c)。在從2至30%乙腈的90分鐘梯度中,鑑定並定量了931種蛋白,其代表了寬範圍的細胞器和生物化學活動。所有被鑑定的蛋白在全部10個通道中被定量,這表明對100個細胞的樣品的分析達到與1000個細胞的樣品的分析相同的深度。注意到在生殖和生殖過程分類中有109種蛋白的顯著表徵,如對於滋養層細胞所期望的那樣。這些數據代表了罕見細胞群的定量蛋白質組分析中的重要突破。相同的步驟用於分析胎兒絨毛外滋養層細胞以鑑定患者組之間的差異。
實施例5
先兆子癇(pe)和子宮內生長受限(iugr)的生物標記
根據實施例的細胞分離
通過半定量免疫細胞化學篩選從妊娠第一個和第二個三個月獲得的胎兒絨毛外滋養層細胞,結果顯示7種與先兆子癇和子宮內生長受限相關的蛋白——半乳糖凝集素13(lgals13,又稱為pp13)、半乳糖凝集素14(lgals14)、胎盤生長因子(pgf)、妊娠相關血漿蛋白a(pappa)、α胎兒蛋白(afp)、內皮因子(eng)或fms相關酪氨酸激酶1(flt-1)——顯著改變。特別地,在後來發展先兆子癇或子宮內生長受限的妊娠中三種蛋白顯著增加(afp、flt1、eng)並且四種蛋白減少(pappa、pgf、lgals13、lgals14),而在這兩組中角蛋白-7(krt7)水平相似(圖6)。查看醫學記錄以選擇存檔的樣本,用於對具有正常結果的妊娠(n=20)或發生子宮胎盤功能不足(先兆子癇或子宮內生長受限;n=12)的妊娠進行分析。在5至20周之間的相似(p=0.34)孕齡(ga)(對於正常組,平均ga=10.9周;對於pe/iugr,平均ga=12.7周)時通過tric獲得樣本。使用免疫細胞化學和圖像分析(simplepci,hamamatsu)來對個體細胞的免疫螢光密度進行半定量,如wangetal.,devbiol2007;302:143-153;和routetal.,devbiol2004;268:135-151中所述。分別滴定抗體以確保帶有標記的螢光信號是線性的。使用相似的相機曝光時間,採用相同批次的抗體一起評估信號的降低(slide)以優化信號定量。測定平均10個細胞,減去由非免疫igg產生的背景染色。未改變的krt7(圖6)提供了非特異性變化的對照。對於各推定的生物標記蛋白,發現在正常組和pe/iugr組之間存在表達的顯著差異(t檢驗,經過校正以適用等方差和不等方差)(圖6)。在正常組內染色強度和ga之間沒有關聯,儘管權威性(power)很可能不充分。對各蛋白所構建的接受者操作特徵(roc)曲線具有如下表i中所示的曲線下面積(auc)。
實施例6
自然流產和早產的生物標記
使用7種蛋白——afp、flt1、eng、pappa、pgf、lgals13和lgals14——的小組,通過定量免疫細胞化學來分析從已知自然流產的8名患者和無併發症的足月妊娠的13名患者的妊娠第一個和第二個三個月收集的胎兒絨毛外滋養層細胞。在自然流產患者中,平均孕齡為7.2周,對照患者的平均孕齡為10.9周。自然流產患者相比對照患者,觀察到eng、flt-1和afp顯著升高,並且lgals14顯著降低(表ii)。在自然流產患者中,妊娠早期胎兒絨毛外滋養層細胞中具有明顯的異常蛋白表達。
表ii詳述了在具有正常妊娠結果的患者(對照)中和具有自然流產的患者中蛋白生物標記的表達。示出了平均螢光強度±sem和來自對各蛋白進行的t檢驗的p值以比較對照組和自然流產患者組。
條目
1.測定來自胎兒絨毛外滋養層細胞的rna的方法,包括:
從妊娠受試者獲得母體子宮頸內樣品;
從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞,產生經分離的胎兒絨毛外滋養層細胞;
通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞,產生醛固定的胎兒絨毛外滋養層細胞;
清洗所述醛固定的胎兒絨毛外滋養層細胞或清洗經分離的醛固定的胎兒絨毛外滋養層細胞的裂解物以促使除去由醛固定劑引入的交聯,產生經清洗的胎兒絨毛外滋養層細胞或經清洗的裂解物;
從經清洗的胎兒絨毛外滋養層細胞或經清洗的裂解物中提取胎兒絨毛外滋養層細胞rna;以及
測定所述胎兒絨毛外滋養層細胞rna以確定胎兒絨毛外滋養層細胞rna的一個或更多個特徵。
2.條目1的方法,其中所述用醛固定劑處理在從母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞之前和/或之後進行。
3.條目1的方法,其中在從妊娠受試者獲得樣品之後立即固定所述母體子宮頸內樣品。
4.條目1-3中任一項的方法,其中在從妊娠受試者獲得樣品之後立即將所述母體子宮頸內樣品在醇固定劑中固定,並且該在醇固定劑中的固定在通過用醛固定劑處理來固定胎兒絨毛外滋養層細胞產生醛固定的胎兒絨毛外滋養層細胞之前進行。
5.條目1-3中任一項的方法,其中在從妊娠受試者獲得樣品之後立即通過用醛固定劑處理來固定所述母體子宮頸內樣品。
6.條目1-5中任一項的方法,其中測定所述胎兒絨毛外滋養層細胞rna的方法包括測序、pcr、定量pcr、實時pcr或其任意兩種或更多種的組合。
7.條目1-6中任一項的方法,其中所述妊娠受試者是人。
8.條目1-7中任一項的方法,其中從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞的步驟包括使胎兒絨毛外滋養層細胞與特異地針對胎兒絨毛外滋養層細胞的抗體接觸,其中所述抗體不與所述母體子宮頸內樣品中的母體細胞結合。
9.條目1-8中任一項的方法,其中所述特異地針對胎兒絨毛外滋養層細胞的抗體連接於支持體。
10.條目1-9中任一項的方法,其中沒有蛋白a或蛋白g連接於支持體。
11.條目1-10中任一項的方法,其中所述支持體是多個磁性顆粒。
12.條目1-11中任一項的方法,其中從所述母體子宮頸內樣品中移除胎兒絨毛外滋養層細胞的步驟包括將磁性顆粒暴露於磁體。
13.條目1-12中任一項的方法,其中所述母體子宮頸內樣品未用溶粘蛋白劑處理。
14.測定胎兒絨毛外滋養層細胞的方法,包括:
從妊娠受試者獲得母體子宮頸內樣品;
將所述母體子宮頸內樣品與第一抗體接觸,所述第一抗體特異地針對胎兒絨毛外滋養層細胞,其中所述第一抗體不與所述母體子宮頸內樣品中的母體細胞結合;
使所述母體子宮頸內樣品與一種或更多種另外的抗體接觸,其中採用不同的標籤可區分地標記所述第一抗體和每種另外的抗體,所述不同的標籤可通過電感耦合等離子體質譜檢測;
將所述母體子宮頸內樣品噴成霧狀以分離細胞;以及
對所述細胞進行電感耦合等離子體質譜,從而測定胎兒絨毛外滋養層細胞。
15.條目14的方法,其中所述第一抗體特異地針對主要組織相容性複合物i類g(hla-g)。
16.條目14或15的方法,其中所述一種或更多種另外的抗體是特異地針對選自以下的蛋白的抗體:半乳糖凝集素13、半乳糖凝集素14、胎盤生長因子、妊娠相關血漿蛋白a、甲胎蛋白、內皮因子、fms相關酪氨酸激酶1和角蛋白7。
17.條目14-16中任一項的方法,其中所述母體子宮頸內樣品未用溶粘蛋白劑處理。
18.條目1-17中任一項的方法,其中在妊娠中受孕後約3周(孕齡5周)或更晚時從妊娠受試者採集母體子宮頸內樣品。
18.測定經分離的胎兒絨毛外滋養層細胞的方法,其基本上如本文所述。
19.測定經分離的胎兒絨毛外滋養層細胞rna的方法,其基本上如本文所述。
本說明書中提及的任何專利或公開出版物以引用的方式納入本文,引用的程度等同於具體且單獨地指明各個出版物以引用的方式納入。
本文當前所述的組合物和方法代表示例性的優選實施方案,並且不意欲限制本發明的範圍。本領域技術人員將想到其中的改變和其他用途。可在不偏離權利要求中闡述的本發明的範圍的條件下作出這樣的改變和其他用途。
