產酸克雷伯菌及其應用的製作方法
2024-04-04 22:51:05 2
(一)技術領域
本發明涉及一株產腈水解酶的菌株,及其在生物催化α-氨基腈底物(2-氨基-4(羥乙基甲基磷醯基)-丁腈)製備作為l-草銨膦重要手性前體的l-2-氨基-4(羥乙基甲基磷醯基)-丁酸的應用。
(二)
背景技術:
腈水解酶(nitrilase,ec3.5.5.1)能將腈類化合物中的氰基直接轉化為羧基製備羧酸,它對腈化合物具有獨特的化學選擇性、立體選擇性和區域選擇性,可以用於合成多種化學法合成效率低下或難以合成的羧酸。其選擇性好,轉化率高,同時,該途徑與傳統工藝相比具有反應條件溫和,無需高溫高壓、強酸強鹼,汙染較少,有著化學方法無可比擬的優越性,符合原子經濟型和綠色化學的發展方向,在化學合成中表現出巨大的應用潛力,無論在應用數量還是種類上都有較大發展,在醫藥及其中間體、農藥及其中間體、食品及飼料添加劑等領域得到了廣泛應用:腈水解酶催化製備瑞舒伐他汀(rosuvastatin)的關鍵中間體(r)-3-羥基戊二酸乙酯;製備抗血小板聚集藥物氯吡格雷(clopidogrel)的關鍵中間體r型鄰氯扁桃酸;製備ida路線生產除草劑草甘膦的關鍵中間體亞氨基二乙酸等。
l-2-氨基-4(羥乙基甲基磷醯基)-丁酸是製備l-草銨膦的重要手性前體。dl-草銨膦,有效成分是phosphinothricin(簡稱ppt),其化學名稱為:4-[羥基甲基膦醯基]-dl-高丙氨酸(別名:d,l-草銨膦胺鹽),為廣譜、觸殺型、滅生性、非殘留除草劑,是由德國赫斯特公司(目前為拜耳公司旗下企業)於20世紀80年代開發的新型滅生性除草劑。除了具有除草活性外還具有殺蟲殺菌活性可以與殺蟲劑等混配達到同時防治的效果。該除草劑具有高效、低毒、易降解等特點。草銨膦是外消旋體混合物,只有l–型具有植物毒性,其除草活性為外消旋混合物的2倍。目前,市售的草銨膦一般都是外消旋混合物,如果能以l-型的草銨膦來代替其使用,不僅可以降低使用成本,還能減輕環境壓力。草銨膦的合成方法有很多,包括化學法合成外消旋草銨膦:蓋布瑞爾(gabriel)–丙二酸二乙酯合成法、阿布佐夫(arbuzov)合成法、高壓催化合成法、赫勒-貝格斯(bucherer-bergs)法、赫勒-貝格斯(bucherer-bergs)法、(neber)重排法、michael自由基加成法、(srecker)法合成dl-草銨膦;化學法合成l-草銨膦:d-纈氨酸甲酯和(s)-2-羥基-3-蒎酮為輔助劑的手性輔助劑誘導法、l-穀氨酸和l-蛋氨酸為手性源的天然胺基酸手性源法、不對稱strecker反應和不對稱michael加成法、利用奎寧進行外消旋體拆分法;酶法合成l-草銨膦主要有蛋白酶水解法、磷酸二酯酶i水解法,醯基轉移酶i催化法,穀氨醯胺酶三種酶協同水解法;轉氨酶法;α-胰乳蛋白酶拆分法、醯胺酶拆分法、脫乙醯基酶拆分法、d-胺基酸氧化酶拆分法等(現代農藥,2009,8(3):1-5)。
目前應用於工業化生產草銨膦的方法可歸結為以下三條路線:拜耳公司利用michael自由基加成法製備d,l-草銨膦;srecker法合成d,l-草銨膦;明治制果不對稱催化加氫合成l-草銨膦。其中srecker法合成d,l-草銨膦路線反應條件溫和,是目前產業化大生產所採用的路線。該路線以亞磷酸三乙酯和三氯化磷為起始原料,經歧化、格氏、甲基化、加成、腈銨化、酸解、銨化反應製得d,l-草銨膦。用腈水解酶選擇性催化水解反應替換srecker路線中的酸解步驟,催化路線中的α-氨基腈底物(2-氨基-4(羥乙基甲基磷醯基)-丁腈)製備合成l-草銨膦的重要手性前體:l-2-氨基-4(羥乙基甲基磷醯基)-丁酸,為實現工業化路線的srecker法合成l-草銨膦提供了依據。
(三)
技術實現要素:
本發明目的是提供一株產腈水解酶的菌株--產酸克雷伯菌(klebsiellaoxytoca)zjb-16005,及其生物催化α-氨基腈底物(2-氨基-4(羥乙基甲基磷醯基)-丁腈)製備l-2-氨基-4(羥乙基甲基磷醯基)-丁酸的應用。
本發明採用的技術方案是:
本發明提供一株具有產腈水解酶性能的新菌株--產酸克雷伯菌(klebsiellaoxytoca)zjb-16005,保藏於中國典型培養物保藏中心,保藏編號cctccno:m2017032,保藏日期2017年01月13日,地址:中國.武漢.武漢大學,郵編430072。
本發明還涉及所述的產酸克雷伯菌(klebsiellaoxytoca)zjb-16005催化α-氨基腈(2-氨基-4(羥乙基甲基磷醯基)-丁腈)製備作為l-草銨膦重要手性前體的l-2-氨基-4(羥乙基甲基磷醯基)-丁酸中的應用,所述的應用為:以產酸克雷伯菌zjb-16005經發酵培養獲得的溼菌體為催化劑,以2-氨基-4(羥乙基甲基磷醯基)-丁腈為底物,以蒸餾水或100mm、ph7.0磷酸緩衝液為反應介質,在30-50℃、100-200rpm條件下進行轉化反應,反應結束,將反應液分離純化,獲得l-2-氨基-4(羥乙基甲基磷醯基)-丁酸。
腈水解酶生物催化α-氨基腈(2-氨基-4(羥乙基甲基磷醯基)-丁腈)生成l-2-氨基-4(羥乙基甲基磷醯基)-丁酸過程如下:
進一步,所述催化劑用量以溼菌體重量計為10-100g/l反應介質,優選35g/l,所述底物初始加入終濃度為2-100g/l反應介質,優選5g/l。
進一步,所述催化劑按如下方法製備:(1)斜面培養:將產酸克雷伯菌zjb-16005接種至斜面培養基,在30℃培養48h,獲得斜面菌體;所述斜面培養基終濃度組成為:甘露醇1~20.0g/l,穀氨酸鈉1~10.0g/l,酵母膏1~5.0g/l,k2hpo40.1~1.0g/l,kh2po40.1~1.0g/l,mgso40.1~1.0g/l,己內醯胺0.1~2.0g/l,瓊脂20.0g/l,溶劑為去離子水,ph7.0-7.5;優選所述斜面培養基終濃度組成為:甘露醇10.0g/l,穀氨酸鈉7.0g/l,酵母膏3.0g/l,k2hpo40.75g/l,kh2po40.75g/l,mgso40.5g/l,己內醯胺1.0g/l,瓊脂20.0g/l,溶劑為去離子水,ph7.0-7.5;
(2)種子培養:挑取斜面菌體接種至種子培養基,在30℃培養24h,獲得種子液;所述種子培養基終濃度組成為:甘露醇1~20.0g/l,穀氨酸鈉1~10.0g/l,酵母膏1~5.0g/l,k2hpo40.1~1.0g/l,kh2po40.1~1.0g/l,mgso40.1~1.0g/l,己內醯胺0.1~2.0g/l,溶劑為去離子水,ph7.0-7.5;優選所述種子培養基終濃度組成為:甘露醇10.0g/l,穀氨酸鈉7.0g/l,酵母膏3.0g/l,k2hpo40.75g/l,kh2po40.75g/l,mgso40.5g/l,己內醯胺1.0g/l,溶劑為去離子水,ph7.0-7.5;
(3)發酵培養:將種子液以體積濃度1~10%的接種量接種至發酵培養基中,30℃,150rpm振蕩培養48h後,在12000g下離心10min,收集溼菌體;所述發酵培養基終濃度組成為:甘露醇1~20.0g/l,穀氨酸鈉1~10.0g/l,酵母膏1~5.0g/l,k2hpo40.1~1.0g/l,kh2po40.1~1.0g/l,mgso40.1~1.0g/l,己內醯胺0.1~2.0g/l,溶劑為去離子水,ph7.0-7.5,優選所述發酵培養基終濃度組成為:甘露醇10.0g/l,穀氨酸鈉7.0g/l,酵母膏3.0g/l,k2hpo40.75g/l,kh2po40.75g/l,mgso40.5g/l,己內醯胺1.0g/l,溶劑為去離子水,ph7.0-7.5。
本發明所述反應液分離純化的方法為:將反應液調至ph2.5,採用陰離子交換樹脂201×7進行柱層析,以上柱流速為1~6.0bv/h(優選4.0bv/h)進行上樣,先用去離子水洗滌,再用0.5~2.0m(優選1m)的氨水進行洗脫,洗脫速度為1.0~4.0bv/h(優選2bv/h),收集含有目標物的洗脫液;將洗脫液減壓蒸餾至無溶劑流出,加入甲醇溶解,在冰浴下攪拌,重結晶,過濾,濾餅乾燥,即得產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸。
本發明中利用腈水解酶選擇性催化水解2-氨基-4(羥乙基甲基磷醯基)-丁腈製得作為l-草銨膦重要手性前體的l-2-氨基-4(羥乙基甲基磷醯基)-丁酸,為實現工業化路線成熟的srecker法合成l-草銨膦提供了依據。同時替代了國內工業化strecker路線中的酸解反應,減少了酸解反應產生的酸性廢水汙染和酸解反應對設備的腐蝕損害。
本發明的有益效果主要體現在:本發明提供了一株能夠產腈水解酶的菌株--產酸克雷伯菌(klebsiellaoxytoca)zjb-16005,本發明還提供了利用產酸克雷伯菌zjb-16005經發酵培養獲得的溼菌體為生物催化劑催化2-氨基-4(羥乙基甲基磷醯基)-丁腈製得作為l-草銨膦重要手性前體的l-2-氨基-4(羥乙基甲基磷醯基)-丁酸的方法,具有重要應用前景。
(四)附圖說明
圖1為柱前衍生化反相高效液相色譜條件下d-2-氨基-4(羥乙基甲基磷醯基)-丁酸與l-2-氨基-4(羥乙基甲基磷醯基)-丁酸的液相結果譜圖。
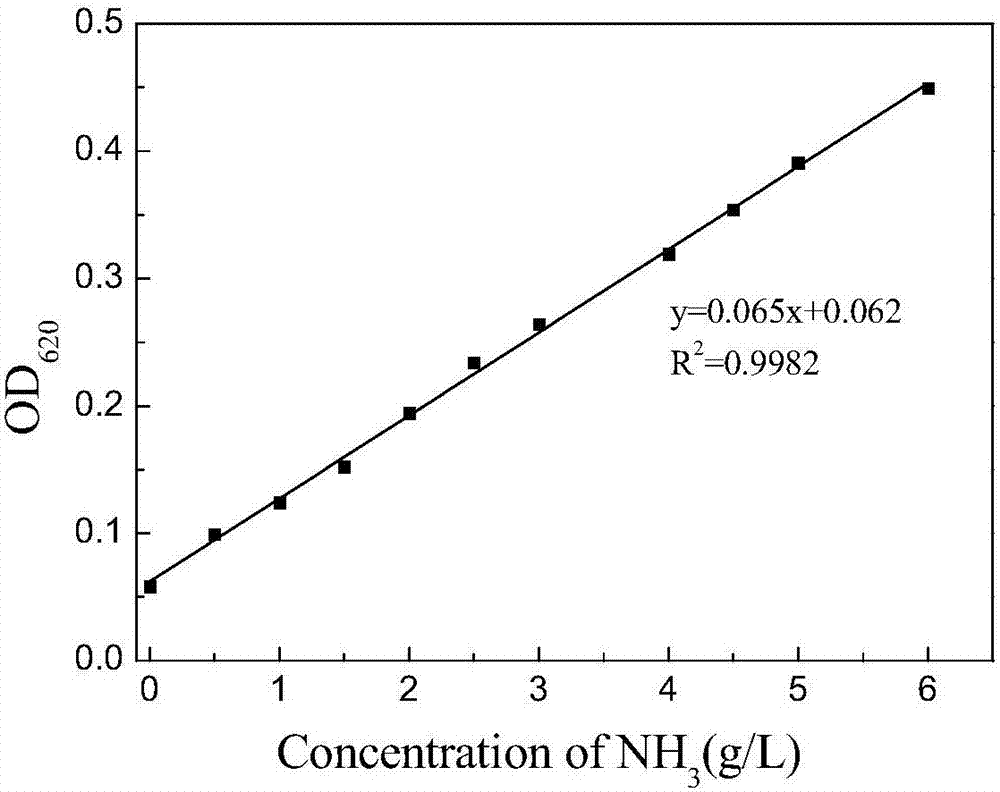
圖2為銨根離子濃度標準曲線。
(五)具體實施方式
下面結合具體實施例對本發明進行進一步描述,但本發明的保護範圍並不僅限於此:
實施例1:產腈水解酶菌株的篩選及鑑定
1、產腈水解酶菌株的篩選
(1)本發明從全國各地取土樣,各稱取1g用0.85%生理鹽水懸浮,靜置,加1ml上清於50ml添加有1g/lα-氨基腈底物(2-氨基-4(羥乙基甲基磷醯基)-丁腈)作為唯一碳源的富集培養基中,在30℃,150rpm的搖床上培養3天;待培養基渾濁後,取1ml培養液轉接到添加有1g/l2-氨基-4(羥乙基甲基磷醯基)-丁腈的新鮮的富集培養基中,再培養3天。如此循環富集3~4個循環;
(2)將最後一次富集培養液用無菌水逐級稀釋10個梯度,選取10-4、10-5、10-6、10-7、10-8五個梯度的稀釋液各取0.1ml均勻塗布在添加有1g/l2-氨基-4(羥乙基甲基磷醯基)-丁腈的平板培養基上,在30℃恆溫培養箱中培養2-3天,將平板上的單菌落挑取,接種於斜面培養基上,在30℃恆溫培養箱中培養2-3天,於4℃保藏;
(3)將保存於斜面上的菌株接種至種子培養基中,在30℃培養24h。將種子液以體積濃度1%的接種量接種至發酵培養基中,30℃,150rpm振蕩培養48h。在12000g下離心10min,收集溼菌體,取一定量的菌體和底物(2-氨基-4(羥乙基甲基磷醯基)-丁腈)懸浮於蒸餾水中,製成0.2g/10ml菌濃度,10g/l底物濃度的反應體系進行轉化,置於30℃水浴搖床轉化24h。取樣,進行苯酚-次氯酸鹽法初篩,腈水解酶活力相對好的,再進行高效液相色譜檢測產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸的濃度和光學純度,最終篩選獲得菌株zjb-16005。
所述富集培養基終濃度組成為(g/l):葡萄糖5.0,氯化鈉1.0,k2hpo4·3h2o0.8,kh2po43.3,mgso4·7h2o0.2,溶劑為去離子水,ph為7.0,在此培養基中添加1g/l的2-氨基-4(羥乙基甲基磷醯基)-丁腈作為唯一的碳源。
所述平板篩選培養基為(g/l):葡萄糖5.0,氯化鈉1.0,k2hpo4·3h2o0.8,kh2po43.3,mgso4·7h2o0.2,瓊脂20.0,溶劑為去離子水,ph為7.0。115℃30min滅菌。冷卻至室溫後加入2-氨基-4(羥基甲基磷醯基)-丁腈1.0g/l。
所述斜面培養基終濃度組成為(g/l):甘露醇10.0,穀氨酸鈉7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己內醯胺1.0,瓊脂20.0,溶劑為去離子水,ph7.0-7.5。
所述發酵培養基終濃度組成為(g/l):甘露醇10.0,穀氨酸鈉7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己內醯胺1.0,溶劑為去離子水,ph7.0-7.5。
(4)苯酚-次氯酸鹽法初篩
用移液管取2ml的a液置於10ml的離心管中,加入4μl待測液,蓋上蓋子,用力混勻。之後再用移液管加入2ml的b液,蓋上蓋子,再次混勻。置於37℃水浴加熱5min後,至離心管內顏色不再發生變化,取200μl置於96孔板中,620nm處測量吸光度後同標準曲線對比得到待測液中銨根的濃度,銨根濃度等於轉化後得到的2-氨基-4(羥乙基甲基磷醯基)-丁酸的濃度,用此可以檢測轉化過程中2-氨基-4(羥乙基甲基磷醯基)-丁酸的產量。
所述a液:稱量5g苯酚和25mg亞硝基鐵氰化鈉,置於500ml容量瓶中,加入超純水定容後,保存於棕色瓶中,4℃冰箱中儲存。
所述b液:稱量2.5g的naoh置於500ml容量瓶,用移液管加入4.4ml含5.2%有效氯的次氯酸鈉水溶液後,用超純水定容,保存於棕色瓶中,4℃冰箱中儲存。
標準曲線的製備:苯酚-次氯酸鹽法在室溫下用比色皿和紫外-可見分光光度計或者在96孔板和通用微孔板分光光度計下都可以對銨根的濃度進行測量,在620nm波長下,od620值與銨根離子的濃度有著良好的線性關係(如圖2),r2=0.9982,表明此法有很高的可行性和準確性。
(5)柱前衍生化反相高效液相色譜法復篩
取經初篩後得到的結果較好的反應液500μl,加入等體積的衍生化試劑,混勻,進行衍生化反應5min,然後進樣15μl,進行hplc分析。
所述的衍生化試劑:分別稱取10mg鄰苯二甲醛(opa)和12mgn-乙醯-l-半胱氨酸(nac),以lml無水乙醇溶解後,用0.2mol/l硼酸緩衝液(ph值9.8)稀釋至5ml,-4℃冰箱保存備用(存放時間不宜超過3d)。
高效液相色譜分析條件為:採用的氣相色譜儀為美國戴安u3000液相色譜儀(配置螢光檢測器);色譜柱:戴安c18(4.6mm×250mm,矽羥基填料);流動相:甲醇:0.05mol/l醋酸銨溶液(體積比10:90,ph值5.7);流速:1ml/min;柱溫:35℃;進樣量:15μl;螢光檢測波長:激發波長ex350nm,發射波長em450nm。
在該條件下,l-2-氨基-4(羥乙基甲基磷醯基)-丁酸與d-2-氨基-4(羥乙基甲基磷醯基)-丁酸的出峰時間分別為9.2min和11.1min,見圖1。
2、菌株zjb-16005的分子鑑定
將步驟1篩選得到的菌株zjb-16005用分子試劑盒提取其總dna,以該菌株zjb-16005的總dna為模板,利用引物:p1:5'-agagtttgatcctggctcag-3'和p2:5'-aaggaggtgatccagccgca-3'擴增菌株的16srdna基因(seqidno:1所示),將基因產物同t載體連接後,委託上海生工對該菌16srdna擴增及測序,得到該菌株的16srdna序列後,在ncbi網站上用blast檢索genbank中相關菌株的16srdna基因序列,並進行同源性比對。本發明微生物與klebsiellaoxytoca菌株jko3同源性最高(homology,99%,basedon16srdna),根據微生物分子遺傳學鑑定原則,基於16srdna序列的同源性高於95%,鑑定菌基本屬於對照菌。因此,本實驗鑑定的菌株zjb-16005為產酸克雷伯菌(klebsiellaoxytoca),擬命名為產酸克雷伯菌(klebsiellaoxytoca)zjb-16005。
任何對seqidno:1所示核苷酸序列進行一個或多個核苷酸的取代、缺失或插入處理獲得的核苷酸序列,只要其與該核苷酸具有90%以上的同源性,均屬於本發明的保護範圍。
實施例2:溼菌體的製備
(1)斜面培養
將產酸克雷伯菌(klebsiellaoxytoca)zjb-16005接種至斜面培養基,在30℃培養48h,獲得斜面菌體。
所述斜面培養基終濃度組成為(g/l):甘露醇10.0,穀氨酸鈉7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己內醯胺1.0,瓊脂20.0,溶劑為去離子水,ph7.0-7.5。
(2)種子培養
從斜面菌體挑取菌體接種至種子培養基,在30℃培養24h,獲得種子液;所述種子培養基終濃度組成為(g/l):甘露醇10.0,穀氨酸鈉7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己內醯胺1.0,溶劑為去離子水,ph7.0-7.5;
(3)發酵培養
將種子液以體積濃度1%的接種量接種至發酵培養基中,30℃,150rpm振蕩培養48h後,在12000g下離心10min,收集溼菌體。
所述發酵培養基終濃度組成為(g/l):甘露醇10.0,穀氨酸鈉7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己內醯胺1.0,溶劑為去離子水,ph7.0-7.5。
實施例3:以α-氨基腈(2-氨基-4(羥乙基甲基磷醯基)-丁腈)為底物的生物轉化反應
(1)在10ml磷酸緩衝液(100mm,ph7.0)中加入實施例2方法製備的溼菌體0.2g,底物2-氨基-4(羥乙基甲基磷醯基)-丁腈終濃度為2g/l,放入水浴搖床30℃,150rpm條件下轉化24h。取1ml轉化液於ep管中,12000r/min離心2min,取上清進行手性液相檢測。結果表明菌株zjb-16005對2-氨基-4(羥乙基甲基磷醯基)-丁腈的轉化得到產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸的光學純度為99.9%。
(2)酶反應得到含產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸的轉化液在離子交換柱上採用陰離子交換樹脂201×7進行產物的分離。
1)樹脂預處理
用50℃溫水浸泡,使其充分膨脹並除去細小顆粒(傾斜或浮選法);依次用l.0m的naoh水溶液浸泡3h用去離子水洗至中性,再用l.0m的hcl水溶液浸泡3h後用去離子水洗至中性,然後用l.0m的naoh水溶液浸泡3h,轉化為oh-形式,最後用去離子水洗至中性備用。
2)裝柱
採用溼法裝柱(內徑1.5cm,高40cm),先在離子交換柱內先加入一定高度的去離子水(一般為柱長的1/3),在取30ml溼樹脂201×7裝入玻璃杯,加入50ml去離子水,慢慢攪拌,懸浮狀的樹脂倒入離子交換柱中,讓其自然沉降,樹脂在柱內必須分布均勻,不應有明顯的分界線,不要有氣泡產生。
3)上樣,洗脫
將步驟(1)轉化液調至ph2.5,以上柱流速為4.0bv/h進行上樣,每隔一段時間取流出的液體進行液相檢測,當吸附達到了最高值時,柱子先用去離子水洗滌,再用1.0m的氨水進行洗脫,洗脫速度為2.0bv/h,收集洗脫液,並每隔一段時間檢測其中所含的l-2-氨基-4(羥乙基甲基磷醯基)-丁酸。洗脫完畢後離子交換柱用去離子水洗滌,並將樹脂201×7轉化為oh-用於下一次的分離提取。
4)純化
洗脫液減壓蒸餾得黃色粘稠物質,加入甲醇溶解,在冰浴下攪拌,重結晶得白色固體,過濾即得產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸。
以步驟(1)反應條件製備轉化液1l,經上述分離純化後,最後得到l-2-氨基-4(羥乙基甲基磷醯基)-丁酸固體0.7g,光學純度為99.9%。
實施例4:
在10ml磷酸緩衝液(100mm,ph7.0)中加入實施例2方法製備的溼菌體0.2g,底物2-氨基-4(羥乙基甲基磷醯基)-丁腈終濃度為10g/l,放入水浴搖床30℃,150rpm條件下轉化24h。取1ml轉化液於ep管中,12000r/min離心2min,取上清進行手性液相檢測。同樣的反應條件下製備轉化液1l,經實施例3的方法進行分離純化後,得到產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸3g,光學純度為99.9%。
實施例5:
在10ml磷酸緩衝液(100mm,ph7.0)中加入實施例2方法製備的溼菌體1g,底物2-氨基-4(羥乙基甲基磷醯基)-丁腈終濃度為10g/l,放入水浴搖床30℃,150rpm條件下轉化24h。取1ml轉化液於ep管中,12000r/min離心2min,取上清進行手性液相檢測。同樣的反應條件下製備轉化液1l,經實施例3的方法進行分離純化後,得到產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸4.2g,光學純度為99.9%。
實施例6:
在10ml磷酸緩衝液(100mm,ph7.0)中加入實施例2方法製備的溼菌體0.2g,底物2-氨基-4(羥乙基甲基磷醯基)-丁腈終濃度為10g/l,放入水浴搖床40℃,150rpm條件下轉化24h。取1ml轉化液於ep管中,12000r/min離心2min,取上清進行手性液相檢測。同樣的反應條件下製備轉化液1l,經實施例3的方法進行分離純化後,得到產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸3.2g,光學純度為99.9%。
實施例7:
在100ml磷酸緩衝液(100mm,ph7.0)中加入實施例2方法製備的溼菌體5g,底物2-氨基-4(羥乙基甲基磷醯基)-丁腈終濃度為10g/l,放入水浴搖床30℃,150rpm條件下轉化48h。取1ml轉化液於ep管中,12000r/min離心2min,取上清進行手性液相檢測。同樣的反應條件下製備轉化液1l,經實施例3的方法進行分離純化後,得到產物l-2-氨基-4(羥乙基甲基磷醯基)-丁酸5.1g,光學純度為99.9%。
sequencelisting
浙江工業大學
產酸克雷伯菌及其應用
1
patentinversion3.5
1
1458
dna
klebsiellaoxytoca
1
cgcattgcggcagctaccatgcaagtcgaacggtagcacagagagcttgctctcgggtga60
cgagtggcggacgggtgagtaatgtctgggaaactgcctgatggagggggataactactg120
gaaacggtagctaataccgcataacgtcgcaagaccaaagagggggaccttcgggcctct180
tgccatcagatgtgcccagatgggattagctagtaggtggggtaacggctcacctaggcg240
acgatccctagctggtctgagaggatgaccagccacactggaactgagacacggtccaga300
ctcctacgggaggcagcagtggggaatattgcacaatgggcgcaagcctgatgcagccat360
gccgcgtgtatgaagaaggccttcgggttgtaaagtactttcagcggggaggaaggcgat420
aaggttaataaccttgtcgattgacgttacccgcagaagaagcaccggctaactccgtgc480
cagcagccgcggtaatacggagggtgcaagcgttaatcggaattactgggcgtaaagcgc540
acgcaggcggtctgtcaagtcggatgtgaaatccccgggctcaacctgggaactgcattc600
gaaactggcaggctggagtcttgtagaggggggtagaattccaggtgtagcggtgaaatg660
cgtagagatctggaggaataccggtggcgaaggcggccccctggacaaagactgacgctc720
aggtgcgaaagcgtggggagcaaacaggattagataccctggtagtccacgctgtaaacg780
atgtcgacttggaggttgttcccttgaggagtggcttccggagctaacgcgttaagtcga840
ccgcctggggagtacggccgcaaggttaaaactcaaatgaattgacgggggcccgcacaa900
gcggtggagcatgtggtttaattcgatgcaacgcgaagaaccttacctactcttgacatc960
cagagaacttagcagagatgctttggtgccttcgggaactgtgagacaggtgctgcatgg1020
ctgtcgtcagctcgtgttgtgaaatgttgggttaagtcccgcaacgagcgcaacccttat1080
cctttgttgccagcggtccggccgggaactcaaaggagactgccagtgataaactggagg1140
aaggtggggatgacgtcaagtcatcatggcccttacgagtagggctacacacgtgctaca1200
atggcatatacaaagagaagcgacctcgcgagagcaagcggacctcataaagtatgtcgt1260
agtccggattggagtctgcaactcgactccatgaagtcggaatcgctagtaatcgtggat1320
cagaatgccacggtgaatacgttcccgggccttgtacacaccgcccgtcacaccatggga1380
gtgggttgcaaaagaagtaggtagcttaaccttcgggagggcgcttaccactttgtgatt1440
catgactgggggaagtcg1458
