Hg‑snb1基因片段介導的RNAi載體及其在培育抗大豆胞囊線蟲轉基因植物中的應用的製作方法
2024-04-03 03:48:05 2
本發明為植物基因工程技術領域,涉及一種hg-snb1基因片段介導的rnai載體及其在培育抗大豆胞囊線蟲轉基因植物中的應用。
背景技術:
大豆胞囊線蟲病(soybeancystnematode,scn)是由大豆胞囊線蟲(heteroderaglycinesichinohe)引起的一種世界性大豆病害,在世界各大豆主要生產國如美國、巴西、阿根延、中國等均廣泛分布。據統計,scn每年可造成大豆減產7%~10%,嚴重地塊可達15-50%,甚至絕產,每年造成約10-15億美元的經濟損失。scn在我國東北和黃淮海大豆主產區均有發生,其中又尤以黑龍江省、吉林省中西部及內蒙古的鹽鹼地、白漿土和沙壤土地發生較為嚴重,每年危害面積達2.0×106hm2以上。除危害大豆外,scn還危害小豆,赤小豆、飯豆、菜豆等170多種作物。
大豆胞囊線蟲是一種定居型內寄生線蟲,主要通過2齡幼蟲侵染大豆根部維管束,危害大豆生長發育,造成植株發育不良,根系減少,根上附有白色的球狀物,莖和葉變淡黃色,豆莢和種子萎縮癟小,甚至不結莢。大豆胞囊線蟲是嚴格的專性寄生物,存在明顯的寄主分化現象,不同生理小種致病性存在明顯差異。按照riggs等提出的分類標準,scn存在16個生理小種。目前在我國已發現1、2、3、4、5、7、14號小種,其中東北大豆產區主要是3號小種,另外還有1號、4號和14號;黃淮海大豆產區主要以1號和4號小種為主。
scn作為一類土傳病害,其分布與大豆種植區域高度重疊,是一種極難防治的土傳病害。由於目前尚無有效可使用的化學殺線蟲劑,生產上主要通過種植抗性品種和田間輪作控制scn的發生與危害。由於胞囊在土壤中存活時間較長(9年以上),採用輪作等方式雖然可以減少大豆產量損失,但並不能完全控制scn的危害,實際應用效果有限。目前生產上利用的抗線蟲大豆品種主要來源於peking、pi88788等少數幾個抗源品種,其中,具有peking或pi88788血緣的品種佔所有抗線蟲大豆品種的97%以上,抗性遺傳基礎極為狹窄。同時,由於大豆胞囊線蟲生理小種較為複雜,易造成線蟲產生抗性,目前已報導多個胞囊線蟲生理小種對pi88788血緣的抗線蟲品種產生了抗性。因此,如何進一步開發新型抗線蟲資源,拓寬抗性資源遺傳基礎,加快抗線蟲大豆品種的選育是我國抗病大豆育種中面臨的主要問題之一。
rna沉默(rnainterference,rnai)是植物抵抗外來核酸(病毒、轉座子等)入侵以保持自身基因組完整性的一種防禦機制。雙鏈rna(double-strandedrna,dsrna)導入細胞後被切割成21-23個核苷酸長度的短核苷酸雙鏈,在其它作用因子的參與下能夠特異地與其同源的mrna結合併導致該同源mrna降解,進而導致內源基因發生沉默。rnai作為一種簡單有效的基因敲除的工具,已廣泛應用於秀麗隱杆線蟲(c.elegans)等多種線蟲基因功能研究及轉基因研究。目前,國際上已完成基因組測序工作的線蟲有10種(nematode.net),其中2種為植物寄生線蟲,包括北方根結線蟲(meloidogynehapla)和南方根結線蟲(m.incognita)。截至2011年,nematode.net資料庫中已經有超過一千萬個ests序列和二十多萬個來自50多種線蟲的基因組序列。儘管目前h.glycines基因組測序工作尚未完成,但利用已有的ests資料庫信息,結合模式生物c.elegans生物學數據信息,篩選與大豆胞囊線蟲寄生、發育及繁殖等相關的關鍵基因,開展大豆胞囊線蟲基因功能驗證和轉基因研究提供了極大的便利。
目前已發現h.glycines和c.elegans基因組中共有8334個基因存在保守性,其中1508個基因在c.elegans中為致死基因。通過dsrna溶液浸泡或毛狀根表達系統,進一步研究這些致死基因在h.glycines中的功能時發現,抑制這些基因的表達可以顯著降低胞囊線蟲的胞囊或雌蟲數量。urwin等(2002)利用半胱氨酸蛋白酶編碼基因(hgcp-i)dsrna溶液浸泡線蟲後,寄生胞囊線蟲雌蟲和胞囊數都顯著降低。klink等(2009)利用毛狀根表達系統研究了核糖體蛋白3a(hg-rps-3a)、核糖體蛋白4(hg-rps-4)、剪接體蛋白(hg-spk-1)及突觸小泡蛋白(hg-snb-1)的抑制表達對h.glycines的影響。結果表明,抑制上述4個基因的表達,均可以顯著降低毛狀根中胞囊線蟲的雌蟲數量。li等(2010)利用毛狀根表達系統對h.glycines的3個靶基因(y25、prp-17、cpn-1)進行rnai研究表明,與對照相比,轉基因毛狀根中的胞囊數量降低79-95%。此外,huang等(2006年)將線蟲寄生必需的分泌肽-16d10基因反向重複序列導入擬南芥,轉基因植物對4種根結線蟲均產生較高的抗性。steeves等(2006)將h.glycines精子蛋白基因msp的一段反向重複序列構建到rnai表達載體上並轉化大豆。接種鑑定結果表明,轉基因大豆植株根部胞囊數比對照降低68%。可見,rnai介導h.glycines基因沉默技術不僅可以為胞囊線蟲抗性育種研究提供了更為廣泛的抗源基因。同時,通過選擇高度保守的rnai靶序列,也為兼抗多個胞囊線蟲生理小種提供了一條更為有效的技術途徑。
目前,有關rnai介導h.glycines基因沉默的研究主要集中在基因功能驗證方面,尚未見到利用胞囊線蟲hg-snb1基因片段培育抗大豆胞囊線蟲轉基因植物的技術資料。基於上述理解,本研究通過rnai介導胞囊線蟲hg-snb1基因沉默,獲得了對scn抗性顯著提高的轉基因大豆。在此研究基礎上,提出本發明。
技術實現要素:
本發明提供一種hg-snb1基因片段介導的rnai載體及其在培育抗大豆胞囊線蟲轉基因植物中的應用,本發明對於培育抗大豆胞囊線蟲植物(特別是大豆)具有重要的應用價值。
為實現上述目的,本發明提供一種hg-snb1基因片段介導的rnai載體,包括dna片段與根特異性啟動子的組合,所述根特異性啟動子可以驅動下遊基因或dna片段在植物根中的特異性表達。
其中,該載體還包括含有dna片段的質粒,dna片段包括dna片段1,dna片段2,以及位於所述dna片段1和dna片段2之間的間隔序列;且所述dna片段1和dna片段2反向互補。
其中,該載體還包括含有dna片段的質粒,所述dna片段從上遊至下遊依次包括如下元件:根特異性啟動子、dna片段1、間隔序列、dna片段2和終止子。
其中,dna片段與根特異性啟動子的組合或是權2中的質粒或是權3中的質粒在培育抗大豆胞囊線蟲轉基因植物的應用。
為實現上述的目的,本發明提供一種hg-snb1基因片段介導的rnai載體在培育抗大豆胞囊線蟲轉基因植物中的應用,dna片段與根特異性啟動子的組合或是上述權利中質粒在製備大豆胞囊線蟲生防製劑中的應用。
其中,培育抗大豆胞囊線蟲轉基因植物的方法為將dna片段與根特異性啟動子組合導入目標植物,使所述dna片段主要在目標植物根中特異表達,獲得對大豆胞囊線蟲抗性顯著提高的轉基因植物。
其中,在目標植物中表達dna片段的實現方式有:將上述權利中的質粒導入目標植物。
其中,所述目標植物和轉基因植物為雙子葉植物或單子葉植物,所述雙子葉植物為大豆。
本發明的有益效果是:與現有技術相比,本發明提供的hg-snb1基因片段介導的rnai載體及其在培育抗大豆胞囊線蟲轉基因植物中的應用,本發明將dna片段與根特異性啟動子組合導入目標植物,使所述dna片段主要在目標植物根中特異表達,獲得對大豆胞囊線蟲抗性顯著提高的轉基因植物。本發明對於培育抗大豆胞囊線蟲植物(特別是大豆)具有重要的應用價值。
附圖說明
圖1為重組質粒pcambia3301-snb1rnai的結構示意圖;
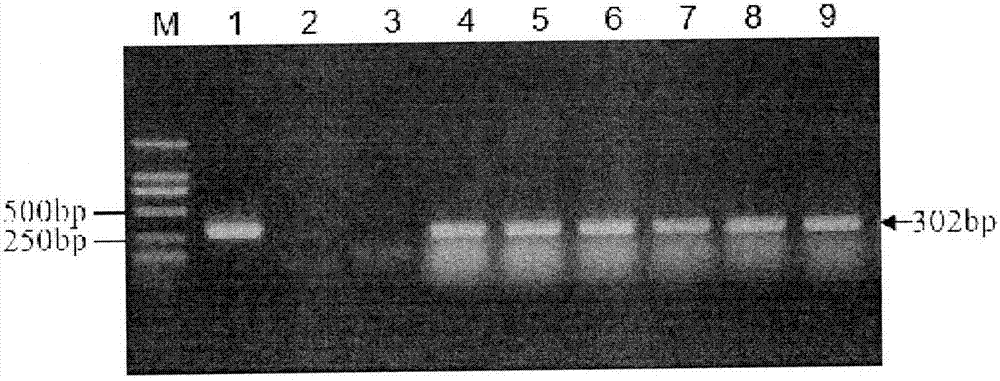
圖2為t1代pat/bar試紙條陽性植株pcr鑑定結果;m:dna標準分子量,1:質粒pcambia3301-snb1rnai,2:對照非轉化植株,3:ddh20對照,4~9為pat/bar試紙條陽性植株b8010、b8171、b8194、b8212、b8234、b8294圖;
圖3為t1代轉基因大豆southern雜交鑑定結果.m:dna標準分子量,1:空白,2::質粒pcambia3301-snb1rnai,3:對照非轉化植株,4~5:b8010(2個單株),6-7:b8171(2個單株),8-9:b8194(2個單株)。植物基因組dna(50μg)用ecori酶切後,用dig標記bar基因探針進行檢測圖;
圖4為t2和t3代轉基因大豆株系接種大豆胞囊線蟲3號生理小種鑑定圖;
圖5為dna片段的seq-1序列圖;
圖6為根特異性啟動子的seq-2序列圖;
圖7為質粒中dna片段的seq-3序列圖。
具體實施方式
為了更清楚地表述本發明,下面結合附圖對本發明作進一步地描述。
本發明的hg-snb1基因片段介導的rnai載體,包括dna片段與根特異性啟動子的組合,所述根特異性啟動子可以驅動下遊基因或dna片段在植物根中的特異性表達;所述dna片段如圖5中的seq-1所示,所述根特異性啟動子序列如圖6中的seq-2所示。
在本實施例中,所述dna片段可以通過反轉錄獲得cdna片段,或是通過人工合成獲得;所述根特異性啟動子可以通過pcr擴增獲得,或是通過人工合成獲得。
在本實施例中,該載體還包括含有dna片段的質粒,dna片段包括dna片段1,dna片段2,以及位於所述dna片段1和dna片段2之間的間隔序列;且所述dna片段1和dna片段2反向互補,dna片段如圖7中的seq-3所示。
在本實施例中,該載體還包括含有dna片段的質粒,所述dna片段從上遊至下遊依次包括如下元件:根特異性啟動子、dna片段1、間隔序列、dna片段2和終止子。
本發明還提供hg-snb1基因片段介導的rnai載體在培育抗大豆胞囊線蟲轉基因植物中的應用,其特徵在於,dna片段與根特異性啟動子的組合或是上述任一質粒在培育抗大豆胞囊線蟲轉基因植物的應用。
本發明還提供一種hg-snb1基因片段介導的rnai載體在培育抗大豆胞囊線蟲轉基因植物中的應用,dna片段與根特異性啟動子的組合或是上述任一質粒在製備大豆胞囊線蟲生防製劑中的應用。大豆胞囊線蟲具體可為大豆胞囊線蟲3號生理小種,儘管本發明僅利用大豆胞囊線蟲3生理號小種進行了接種鑑定,但所述dna片段為保守序列,具有廣譜性,所以對其它大豆胞囊線蟲生理小種也具有相同的抑制效果。
在本實施例中,培育抗大豆胞囊線蟲轉基因植物的方法為將dna片段與根特異性啟動子組合導入目標植物,使所述dna片段主要在目標植物根中特異表達,獲得對大豆胞囊線蟲抗性顯著提高的轉基因植物。
在本實施例中,在目標植物中表達dna片段的實現方式有:將上述任一一種所述質粒導入目標植物。
在本實施例中,在轉基因植物或細胞中含有所述dna片段,其主要在植物根細胞中特異表達,並直接或間接調控寄生大豆胞囊線蟲內源基因的表達。在本實施例中,所述目標植物和轉基因植物為雙子葉植物或單子葉植物,所述雙子葉植物為大豆。更具體可為栽培大豆,所述質粒可通過農桿菌介導法、基因槍法、花粉管介導法等導入目標植物。
相較於現有技術,本發明提供的hg-snb1基因片段介導的rnai載體及其在培育抗大豆胞囊線蟲轉基因植物中的應用,具有如下優勢:本發明將dna片段與根特異性啟動子組合導入目標植物,使所述dna片段主要在目標植物根中特異表達,獲得對大豆胞囊線蟲抗性顯著提高的轉基因植物。本發明對於培育抗大豆胞囊線蟲植物(特別是大豆)具有重要的應用價值。
下述實施例中的實驗方法,如無特殊說明,均為本領域技術人員所熟知的常規方法。實施例中所用的試驗材料,如無特殊說明,均可通過商業途徑獲得。
質粒phannibal-attb1:公眾可以從吉林省農業科學院農業生物技術研究所獲得。
質粒pcambia3301:公眾可以從商業途徑獲得。
栽培大豆品種williams82:公眾可以從國家作物種質資源資料庫(http://www.cgris.net/query/croplist.php)獲得。
大豆胞囊線蟲3號生理小種:為我國東北大豆產區scn主要生理小種,公眾可以從吉林省農業科學院植物保護研究所獲得。參考文獻:段玉璽周博陳立傑吳海燕.抗大豆胞囊線蟲3號生理小種(scn3)核心種質代表性分析.大豆科學,2008,3:366-372。
實施例中所用到的各種培養基配方見表1。ms合成鹽購自sigma公司,貨號為m5524。b5合成鹽購自sigma公司,貨號為g5768。
表1.培養基配方
實施例1.大豆胞囊線蟲hg-snb1基因片段及大豆根特異性啟動子的發現
利用線蟲基因組資料庫(nematode.net)及大豆胞囊線蟲ests資料庫信息,發現大豆胞囊線蟲基因hg-snb1存在保守序列。在該保守區內最終確定了序列長度為302bp的片段,如seq-1所示。該序列與c.elegans小突觸泡蛋白(synaptobrevin-relatedprotein1)編碼基因序列相似。該基因突變導致c.elegan死亡。預期通過seq-1所示片段編碼的rna抑制大豆胞囊線蟲在根中發育或死亡。
利用phytozome資料庫(https://phytozomejgi.doe.gov/pz/portal.html)、大豆公共資料庫(http://soybase.org/),根據大豆根特異表達基因gmglp7(glyma.20g220800.1,germin-likeproteinsubfamily1member7-like)上遊序列設計特異性引物gmglp7-f1/gmglp7-r1。以大豆栽培品種williams82基因組dna為模板,利用kodfx高保真酶(日本toyobo公司)進行pcr擴增,pcr反應條件為:95℃5min;(94℃30s,59℃45s,72℃2min),30個循環;72℃10min。用1.0%瓊脂糖凝膠電泳回收純化pcr擴增產物並測序。擴增產物長度為1491bp,如seq-2所示。
gmglp7-f1:5』-tgaataagataagcttatatattatacgcaat-3』
gmglp7-r1:5』-aaaaaacctccatggttctccct-3』
實施例2.rnai重組質粒的構建
(1)以seq-2所示的雙鏈dna分子為模板,採用gmglp7-f2-attb5r和gmglp7-r2組成引物對,利用kodfx高保真酶進行pcr擴增,得到pcr擴增產物。
gmglp7-f2-attb5r:5』-cgagctcggggacaacttttgtatacaaagttgttgaataagataagcttatatattatacgcaat-3』
gmglp7-r2:5』-ccgctcgagaaaaaacctccatggttctccct-3』
gmglp7-f2-attb5r和gmglp7-r2引物對中,下劃線標註酶切識別序列,其中,「gagctc」為限制性內切酶saci的酶切識別序列。「ctcgag」為限制性內切酶xhoi的酶切識別序列,「ggggacaacttttgtatacaaagttgtt」為重組位點attb5r。
pgr反應條件為:95℃2min;(94℃30s,56℃45s,72℃2min),共35個循環;72℃10min。用1.0%瓊脂糖凝膠電泳回收純化pgr擴增產物,產物大小約為1.5kb。
(2)用限制性內切酶saci和xhoi雙酶切步驟(1)的pcr擴增產物,並回收酶切產物。
(3)用限制性內切酶saci和xhoi雙酶切質粒phannibal-attb1,回收載體骨架序列。
(4)將步驟(2)的酶切產物和步驟(3)的載體骨架序列連接,得到重組質粒phannibal-attb5r-gmglp7-attb1。
(5)合成序列表的seq-1所示的雙鏈dna分子。
(6)以步驟(5)合成的雙鏈dna分子為模板,採用hg-snb1-f和hg-snb1-r組成的引物對
hg-snb1-f1:5』-ccggatccctcgaggaacccaaacgctcaacaacaag-3』
hg-snb1-r1:5』-ggatcgatggtaccttccagcccaaatgacgatgat-3』
hg-snb1-f1與hg-snb1-r1中,下劃線標註酶切識別序列,其中「ggatcc」為限制性內切酶bamhi的酶切識別序列,「ctcgag」為限制性內切酶xhoi的酶切識別序列,「atcgat」為限制性內切酶clai的酶切識別序列,「ggtacc」為限制性內切酶kpni的酶切識別序列。
pcr反應條件為:95℃2min;(94℃30s,56℃45s,72℃1min),共30個循環;72℃5min。用1.0%瓊脂糖凝膠電泳回收純化pcr擴增產物,產物大小約為300bp。
(7)用限制性內切酶xhoi和kpni雙酶切步驟(6)的pcr擴增產物,並回收酶切產物。
(8)用限制性內切酶xhoi和kpni雙酶切質粒phannibal-attb5r-gmglp7-attb1,回收載體骨架序列(約6.0kb)。
(9)將步驟(7)的酶切產物和步驟(8)的載體骨架序列連接,得到重組質粒phannibal-gmglp7-revsnb1。
(10)用限制性內切酶bamhi和clai雙酶切步驟(6)的pcr擴增產物,並回收酶切產物。
(11)用限制性內切酶bamhi和clai雙酶切重組質粒phannibal-gmglp7-revsnb1,回收載體骨架序列(約6.3kb)。
(12)將步驟(10)的酶切產物和步驟(11)的載體骨架序列連接,得到重組質粒phannibal-gmglp7-snb1rnai。
(13)用限制性內切酶saci和bamhi雙酶切質粒phannibal-gmglp7-snb1rnai,回收約2.88kb酶切小片段(該片段自上遊至下遊依次包括大豆根特異啟動子gmglp7,正義rna片段的編碼序列,間隔內含子序列,反義rna片段的編碼序列。酶切dna片段兩端均為粘末端。
(14)用限制性內切酶saci和bamhi雙酶切質粒pcambia3301,回收載體骨架序列(約9.5kb),dna酶切片段兩端均為粘末端。
(15)將步驟(13)的酶切小片段和步驟(14)的載體骨架序列連接,得到rnai重組質粒pcambia3301-snb1rnai。載體質粒示意圖見圖1。
實施例3.抗大豆胞囊線蟲轉基因植物的獲得與鑑定
1.農桿菌介導大豆遺傳轉化
(1)採用凍融法將重組質粒pcambia3301-snb1rnai導入農桿菌eha105,得到重組農桿菌。
(2)用附表1中的ccm液體培養基重懸農桿菌,得到od600nm=0.5-0.8的菌懸液備用。
(3)選取栽培大豆williams82種子,在含有氯氣的密閉容器中滅菌12-16個小時。
(4)取步驟(3)中滅菌後的種子,種臍朝下置於gm培養基平板上,23℃暗培養24小時。
(5)用無菌解剖刀沿種臍切開,並去掉腋芽,在腋芽上方子葉節位置輕微劃傷,然後置於步驟(2)得到的菌懸液中浸泡30-40分鐘。
(6)完成步驟(5)後,將種子移至鋪有無菌濾紙的ccm培養基平板上,23℃暗培養4-5天。
(7)完成步驟(6)後,將種子轉移至sim培養基上,25℃,16h(光)/8h(暗)條件下培養,每2-3周繼代1次。
(8)將誘導出叢生芽的外植體上的子葉切去,置於sem培養基平板上,25℃,16h(光)/8h(暗)條件下培養,每2-3周繼代1次,繼代時切去褐化的愈傷組織。
(9)當再生芽生長至4-8cm時,將再生芽切下,然後轉移至rm培養基平板上,25℃,16h(光)/8h(暗)條件下培養。
(10)待抗性芽長至3-5cm,且長出健壯的根時,移至煉苗室馴化3-5天,然後轉移至溫室中生長,得到t0代植株。
(11)對移栽至溫室的t0代植株進行pat/bar試紙條(libertylinkstrips,envirologix,usa)檢測。試紙條檢測陽性的植株即初步鑑定為轉基因植株。
2.轉基因大豆分子鑑定
(1)pat/bar試紙條檢測的陽性t0代植株自交後即獲得t1代株系。採用500mg/l除草劑-草丁膦進行噴施,7天後非轉基因苗出現葉片黃化或枯死現象,而轉基因植株則表現正常。
(2)剪取t1代pat/bar試紙條陽性植株葉片進行pcr檢測。提植株葉片的基因組dna,採用hg-snb1-f2和hg-snb1-r2組成的引物進行pcr擴增,擴增片段大小為302bp。部分幼苗pcr鑑定結果見圖2。
hg-snb1-f2:5』-gaacccaaacgctcaacaacaagg-3』
hg-snb1-r2:5』-ttccagcccaaatgacgatgatgatg-3』
(3)剪取t1代轉基因植株葉片進行southern雜交檢測。採用高鹽ctab法提取高純度大豆基因組dna。ecori酶切總dna(~50μg)後,用0.8%瓊脂糖凝膠分離酶切片段。採用高鹽轉移法,將酶切片段轉移至帶正電荷的hyboodtm-n+尼龍膜(amersham,usa)上。以重組質粒pcambia3301-snb1rnai為模板,採用bar-f和bar-r引物對擴增bar基因片段,擴增片段大小為441bp。利用dig隨機引物標記試劑盒(roche,usa)標記探針。
bar-f:5』-gcaccatcgtcaaccactacatcgag-3』
bar-r:5』-tgaagtccagctgccagaaacccac-3』
採用roche公司的dighighprimednalabelinganddetectionstarterkitll試劑盒進行分子雜交。雜交溫度為42℃,洗膜條件為2×ssc(含0.1%sds),37℃條件下洗膜2次,每次5min;0.5×ssc(含0.1%sds),66℃條件下洗膜2次,每次15min。然後利用bcip/nbt在雜交膜上化學顯色。部分轉基因大豆southern雜交檢測結果見圖3。
(4)收穫southern雜交陽性的t1代植株自交後得到的種子,播種後長出t2代幼苗,繼續採用500mg/l除草劑-草丁膦和pcr進行跟蹤檢測,並去除非轉基因植株,直至獲得純合的轉基因株系。
4.轉基因大豆抗胞囊線蟲鑑定
採用病土接種法(病土採自吉林省洮南地區),對t2代和t3代轉基因大豆株系b8010、b8171、b8194、b8212、b8234、b8294進行抗性鑑定,受體對照品種為栽培大豆品種williams82。採用golden(1970)確立的一套鑑別寄主,riggs(1988)給定的鑑定模式,確定接種土樣中胞囊線蟲為3號小種。抗性分級參照shannon1992年提出鑑定大豆抗病性的ip標準進行分級,高抗0~9%(hr),中抗10%~30%(mr),中感31%~60%(ms),高感大於60%(vs)。ip指數=(供試品種的平均胞囊量/感病對照品種的平均胞囊量)×100。抗性鑑定試驗重複3次,每個重複鑑定植株12株。
連續2代鑑定結果表明,與受體對照品種相比,轉基因大豆b8010、b8171、b8194、b8212、b8234、b8294平均胞囊數量和ip值均顯著降低。在鑑定的6個株系中,其中b8212、b8294和b8194平均胞囊數量和ip值最低,表現為高抗(hr)。另外3個株系b8234、b8171和b8010的平均胞囊數量和ip值也顯著低於對照非轉基因大豆williams82,在不同年份間表現為中抗或高抗。表明將重組rnai表達載體導入植物,可以顯著提高植物對大豆胞囊線蟲的抗性。抗性鑑定結果見表2和圖4。
表2.t2/t3代轉基因大豆抗scn鑑定結果
以上公開的僅為本發明的幾個具體實施例,但是本發明並非局限於此,任何本領域的技術人員能思之的變化都應落入本發明的保護範圍。
