硫化鉬協同氮雜石墨烯材料及在近紅外光脫氮中的應用的製作方法
2023-05-22 02:51:12
本發明涉及一種硫化鉬複合氮雜石墨烯材料及其在光催化降解氨氮中的應用。
背景技術:
利用太陽能解決環境能源問題,起源於1972年Fujishima利用TiO2光電極電解水制氫,隨後Carey在1976年報導了利用TiO2光催化氧化消除多氯二酚的毒性,從此,利用太陽能降解環境汙染物的研究迅速成為人們研究的熱點。但是,TiO2隻能利用佔太陽能4%左右的紫外光,對TiO2進行摻雜及開發Fe2O3、WO3、Bi2WO6等新型催化劑,雖然部分解決了對可見光的利用問題,但是佔太陽能46%的紅外光尚需開發利用。
MoS2是一種與石墨烯具有類似結構的二維材料。作為一種半導體光催化劑,人們研究了MoS2在可見光輻射下的產氫特性。而在近紅外光的應用方面,文獻僅報導了MoS2用於光熱藥物釋放治療癌症的研究。作為一種半導體材料,MoS2的禁帶寬度為1.29eV,理論吸收邊帶可延伸至961nm,可以吸收近紅外光,這為近紅外光光催化打下了科學基礎。
另一方面,氮雜石墨烯(N-doped graphene,NG)是一種零帶隙半導體材料,理論上對太陽光可以全吸收利用;此外,與石墨烯相比,NG有更高的載流子傳輸速率、更低的光生電子/空穴複合率、更高的量子產率,因此具有更強的光催化活性。將NG與MoS2複合,有望製備對近紅外光有催化活性的NG-MoS2雜化光催化劑,以期實現對太陽能的充分利用。
技術實現要素:
本發明的目的在於提供一種硫化鉬協同氮雜石墨烯材料及在近紅外光脫氮中的應用,以克服現有技術的不足。
為實現前述發明目的,本發明採用的技術方案包括:
本發明實施例提供了一種硫化鉬複合氮雜石墨烯材料包括硫化鉬和氮雜石墨烯,所述硫化鉬分布於所述氮雜石墨烯表面和/或所述氮雜石墨烯的層狀結構中,其中所述硫化鉬具有空間群結構。
進一步的,所述硫化鉬複合氮雜石墨烯材料的粒徑為4.0-5.2nm。
進一步的,相鄰硫化鉬層間距為0.55-0.65nm。
進一步的,所述硫化鉬複合氮雜石墨烯材料的比表面積為8-9m2/g。
進一步的,所述氮雜石墨烯於所述硫化鉬複合氮雜石墨烯材料中的質量百分數為1-10wt%。
本發明實施例提供了一種硫化鉬複合氮雜石墨烯材料的製備方法包括:
提供硫化鉬固體;
將氮雜石墨烯、硫化鉬固體於溶劑中混合均勻製得混合液,之後將混合液在溫度為100-150℃條件下反應6-10h,製得所述的硫化鉬複合氮雜石墨烯材料。
本發明實施例還提供了所述硫化鉬複合氮雜石墨烯材料於光催化降解氨氮中的用途。
本發明實施例還提供了一種降解氨氮的方法,其包括:在近紅外光光照條件下,以硫化鉬複合氮雜石墨烯材料作為光催化劑在鹼性氛圍中直接催化氧化氨氮,實現水體中氨氮的脫除。
較為優選的,採用0.1mol/L NaHCO3-Na2CO3的緩衝溶液調節所述含氨氮溶液的pH值。
較為優選的,所述近紅外光的波長λ範圍為780nm-2500nm。
較為優選的,所述硫化鉬複合氮雜石墨烯材料與氨氮的質量比為100mg:5-50mg。
在一較為優選的實施方案中,一種降解氨氮的方法包括:將含有氨氮的水溶液與硫化鉬複合氮雜石墨烯材料混合置入避光反應器中,並在所述避光反應器的光照窗口處設置僅可使近紅外光通過的濾光片,之後以光源照射所述避光反應器,實現水體中氨氮的脫除。
與現有技術相比,本發明的優點包括:
(1)本發明的複合光催化劑,包括層狀的氮雜石墨烯和分布於所述氮雜石墨烯表面的硫化鉬,複合氮雜石墨烯之後,加速了光生電子的轉移,導致吸收光譜紅移,增大了對太陽能的利用率,且所述催化劑重複催化降解氨氮5-10次後,氨氮的降解率仍>90%。
(2)本發明的複合光催化劑的製備方法,利用近紅外光光將氨氮一步降解為氮氣放出,且無需添加多餘的氧化劑,從而降低了成本,且光催化劑製備過程簡單,易操作。
附圖說明
為了更清楚地說明本發明實施例或現有技術中的技術方案,下面將對實施例或現有技術描述中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖僅僅是本發明中記載的一些實施例,對於本領域普通技術人員來講,在不付出創造性勞動的前提下,還可以根據這些附圖獲得其他的附圖。
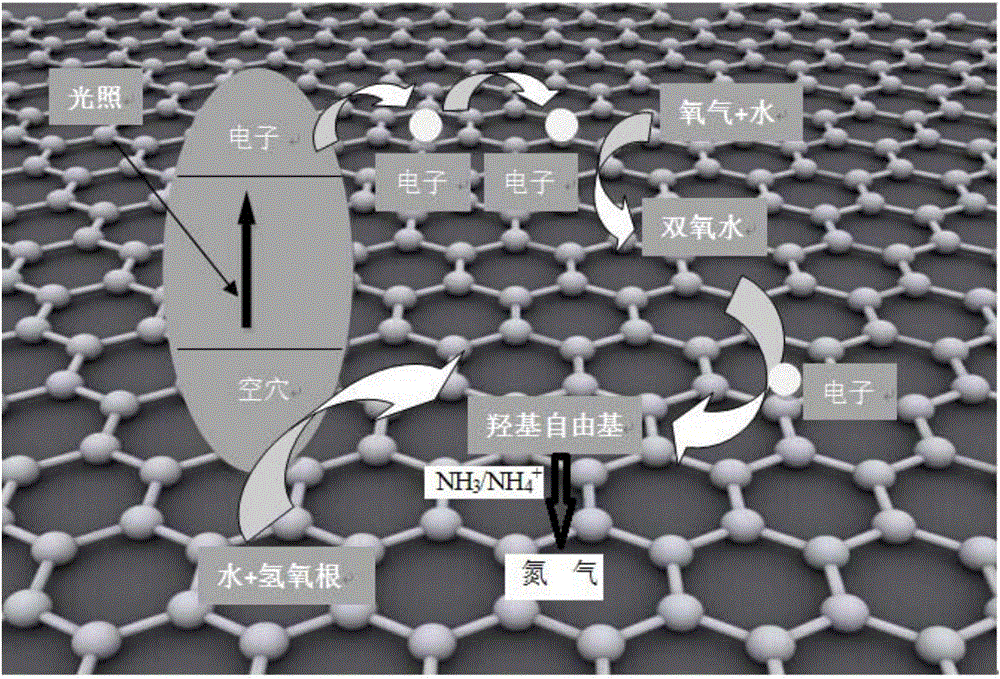
圖1是本發明實施例1的反應機理圖;
圖2是本發明實施例1中硫化鉬(MoS2)、氮雜石墨烯(NG)與氮雜石墨烯複合硫化鉬(NG-MoS2)的XRD圖;
圖3是本發明實施例2中MoS2、NG與NG-MoS2的拉曼光譜圖;
圖4a-圖4d是本發明實施例1中MoS2、NG與NG-MoS2的TEM圖,其中圖4a為氮雜石墨烯的TEM圖,圖4b為硫化鉬的TEM圖,圖4c和圖4d為硫化鉬複合氮雜石墨烯材料的TEM圖;
圖5是本發明實施例1中NG-MoS2重複7後氨氮降解率的曲線圖。
具體實施方式
為使本發明的目的、技術方案和優點更加清楚,下面結合附圖對本發明的具體實施方式進行詳細說明。這些優選實施方式的示例在附圖中進行了例示。附圖中所示和根據附圖描述的本發明的實施方式僅僅是示例性的,並且本發明並不限於這些實施方式。
在此,還需要說明的是,為了避免因不必要的細節而模糊了本發明,在附圖中僅僅示出了與根據本發明的方案密切相關的結構和/或處理步驟,而省略了與本發明關係不大的其他細節。
本發明的反應機理包括以下步驟:
NH3+·OH→NH2+H2O........................(1)
NH2+·OH→NH+H2O.........................(2)
NH+·OH→N+H2O............................(3)
NHx+NHy→N2Hx+y(x,y=0,1,2)..............(4)
N2Hx+y+(x+y)OH→N2+(x+y)H2O..........(5)
參見圖1為本發明的反應機理圖。
本發明實施例提供了一種硫化鉬複合氮雜石墨烯材料包括硫化鉬和氮雜石墨烯,所述硫化鉬分布於所述氮雜石墨烯表面和/或所述氮雜石墨烯的層狀結構中,其中所述硫化鉬具有空間群結構。
進一步的,所述硫化鉬複合氮雜石墨烯材料的粒徑為4.0-5.2nm。
進一步的,相鄰硫化鉬層間距為0.55-0.65nm。
進一步的,所述硫化鉬複合氮雜石墨烯材料的比表面積為8-9m2/g。
進一步的,所述氮雜石墨烯於所述硫化鉬複合氮雜石墨烯材料中的質量百分數為1-10wt%。
本發明實施例提供了一種硫化鉬複合氮雜石墨烯材料的製備方法包括:
提供硫化鉬固體;
將氮雜石墨烯、硫化鉬固體於溶劑中混合均勻製得混合液,之後將混合液在溫度為100-150℃條件下反應6-10h,製得所述的硫化鉬複合氮雜石墨烯材料。
本發明實施例還提供了所述硫化鉬複合氮雜石墨烯材料於光催化降解氨氮中的用途。
本發明實施例還提供了一種降解氨氮的方法,其包括:在近紅外光光照條件下,以硫化鉬複合氮雜石墨烯材料作為光催化劑在鹼性氛圍中直接催化氧化氨氮,實現水體中氨氮的脫除。
較為優選的,採用0.1mol/L NaHCO3-Na2CO3的緩衝溶液調節所述含氨氮溶液的pH值。
較為優選的,所述近紅外光的波長λ範圍為780nm-2500nm。
較為優選的,所述硫化鉬複合氮雜石墨烯材料與氨氮的質量比為100mg:5-50mg。
在一較為優選的實施方案中,一種降解氨氮的方法包括:將含有氨氮的水溶液與硫化鉬複合氮雜石墨烯材料混合置入避光反應器中,並在所述避光反應器的光照窗口處設置僅可使近紅外光通過的濾光片,之後以光源照射所述避光反應器,實現水體中氨氮的脫除。
在一較為優選的實施方案中,一種降解氨氮的處理方法具體包括:
(1)提供近紅外光截止型濾光片及避光反應器,所述濾光片能覆蓋所述避光反應器上部,
(2)調節含有氨氮的待測樣品的pH值為鹼性後與硫化鉬複合氮雜石墨烯材料混合置於步驟(1)中的避光反應器並用所述濾光片覆蓋,攪拌下置於光源中,之後採用納氏試劑法每隔一小時測定剩餘氨氮溶液的吸光度。
進一步的,所述納氏試劑法包括:取1mL步驟(2)中的氨氮溶液,加1.5mL納氏試劑,1mL酒石酸鉀鈉溶液稀釋至50mL,用T1901紫外可見分光光度計測定388nm處的吸光度,按照以下公式計算氨氮的降解率:
氨氮降解率=(1-Ci/C0)×100%=(1-Ai/A0)×100%
式中,C0為氨氮的初始濃度,A0為初始溶液的吸光度,Ci為剩餘氨氮的濃度,Ai為剩餘氨氮的吸光度。
進一步的,所述硫化鉬複合氮雜石墨烯材料重複催化降解氨氮5-10次後,氨氮的降解率仍>87%。
以下結合附圖和實施例對本發明的技術作進一步的解釋說明。
實施例1
(1)MoS2的製備:取1.21g Na2MoO4·2H2O(0.005mol),1.56g CS(NH2)2(0.020mol),倒於容積為100mL的燒杯中,攪拌直至全部溶解,然後轉入聚四氟乙烯內套筒中,加入去離子水至總體積的80%,使固體充分溶解將內套筒置於不鏽鋼外套筒中,密封,加熱至200℃,反應24小時。然後將樣品在室溫下冷卻,用去離子水洗滌,將可溶性物質除去。得到的黑色固體在40℃烘箱中乾燥6h,制的MoS2半導體材料,參見圖4b所示為硫化鉬的TEM圖,可以清晰得看到硫化鉬的層狀結構。
(2)氮雜石墨烯(NG)的製備:準確稱取氧化石墨烯(0.22g)溶解於100ml去離子水,超聲至分散,之後配置的NH3·H2O(1.0mol/L)調節pH值約為10再取尿素(22.0g,99%)加入上述溶液混合攪拌2h。再將水合肼(2.5mL 0.16mol)磁力攪拌下加入混合液中,之後把上述混合液轉入燒瓶(三口,250mL),控制溫度80℃,磁力攪拌,冷凝回流反應24h,過濾,水洗,在真空箱中控制溫度(70℃,6h)乾燥,製得所述氮雜石墨烯,參見圖4a為氮雜石墨烯的TEM圖,所製備的氮雜石墨烯也是片層結構。
(4)NG-MoS2的製備。在合成MoS2的過程中,Na2MoO4·2H2O與CS(NH2)2的混合溶液裡面分別加入質量分數分別為1%、3%、5%、7%、9%的NG,200℃水熱反應24小時。得到不同NG含量的NG-MoS2納米複合半導體材料。光催化實驗中以NG含量為5%的MoS2作為光催化劑。參見圖2所示,在2θ=14.2°,33.5°,39.5°和59.0°處的衍射峰分別對應於MoS2的(002)、(100)、(103)和(110)晶面指標,MoS2與NG-MoS2的衍射峰與標準圖譜(JCPDS37-1492)一致,因此可以確定所得樣品為MoS2(空間群為),參見圖4c和圖4d為硫化鉬複合氮雜石墨烯材料的TEM圖可以看出硫化鉬生長在氮雜石墨烯的表面,且雜化催化劑中MoS2具有較好的結晶性。
(5)光催化實驗:用錫箔紙將一個100ml燒杯的杯壁包住,以避免紫外光和可見光進入反應體系,用λ>780nm截止型濾光片覆蓋在燒杯口上,以保證只有近紅外光輻射進入光反應器,將300W紫外-可見光燈置於反應器上方。燒杯中加入一定濃度的氨氮溶液,用NaHCO3-Na2CO3(0.1mol/L)緩衝溶液調節pH值,向燒杯中加入一定量的催化劑,置於光源下,磁力攪拌器攪拌,每隔一小時測定剩餘氨氮溶液的吸光度。取1ml氨氮溶液,加1.5ml納氏試劑,1ml酒石酸鉀鈉溶液稀釋至50ml,用T1901紫外可見分光光度計測定388nm處的吸光度,以此計算氨氮的降解率。
氨氮降解率=(1-Ci/C0)×100%=(1-Ai/A0)×100%
式中,C0為氨氮的初始濃度,A0為初始溶液的吸光度,Ci為剩餘氨氮的濃度,Ai為剩餘氨氮的吸光度。
(6)催化劑穩定性:通過多次循環實驗來評價雜化催化劑的穩定性。NG-MoS2催化劑在近紅外光輻射下連續7次催化降解氨氮的降解率。每一次實驗持續8h,在每一次降解結束後,通過離心分離、去離子水洗滌得到催化劑,然後再繼續循環使用該催化劑。參見圖5,在硫化鉬複合氮雜石墨烯材料作為光催化劑光催化降解氨氮7次後氨氮去除率仍在87%以上。
實施例2
(1)MoS2的製備:取1.21g Na2MoO4·2H2O(0.005mol),1.56g CS(NH2)2(0.020mol),倒於容積為100mL的燒杯中,攪拌直至全部溶解,然後轉入聚四氟乙烯內套筒中,加入去離子水至總體積的80%,使固體充分溶解將內套筒置於不鏽鋼外套筒中,密封,加熱至200℃,反應24小時。然後將樣品在室溫下冷卻,用去離子水洗滌,將可溶性物質除去。得到的黑色固體在40℃烘箱中乾燥6h,制的MoS2半導體材料。
(2)氮雜石墨烯(NG)的製備:準確稱取氧化石墨烯(0.22g)溶解於100ml去離子水,超聲至分散,之後配置的NH3·H2O(1.0mol/L)調節pH值約為10再取尿素(44.0g,99%)加入上述溶液混合攪拌2h。再將水合肼(2.5mL 0.16mol)磁力攪拌下加入混合液中,之後把上述混合液轉入燒瓶(三口,250mL),控制溫度80℃,磁力攪拌,冷凝回流反應24h,過濾,水洗,在真空箱中控制溫度(70℃,6h)乾燥,製得所述氮雜石墨烯。
(4)NG-MoS2的製備。在合成MoS2的過程中,Na2MoO4·2H2O與CS(NH2)2的混合溶液裡面分別加入質量分數分別為1%、3%、5%、7%、9%的NG,200℃水熱反應24小時。得到不同NG含量的NG-MoS2納米複合半導體材料。光催化實驗中以NG含量為7%的MoS2作為光催化劑。參見圖3所示,MoS2單位晶胞是按照六角對稱性堆垛而成的,屬於空間群根據對稱性,MoS2具有4個拉曼活性的振動模式:E1g,A1g[32],且位於385cm-1以及408cm-1處的拉曼峰分別歸屬於和A1g振動,這進一步表明所製備的樣品是MoS2,NG-MoS2的拉曼譜圖出現了硫化鉬的特徵和A1g振動模式,同時在1600cm-1和1335cm-1處觀測出兩個小峰,分別對應於石墨烯的G帶及D帶位移,這進一步表明NG與MoS2成功複合。
(5)光催化實驗:用錫箔紙將一個100ml燒杯的杯壁包住,以避免紫外光和可見光進入反應體系,用λ>780nm截止型濾光片覆蓋在燒杯口上,以保證只有近紅外光輻射進入光反應器,將300W紫外-可見光燈置於反應器上方。燒杯中加入一定濃度的氨氮溶液,用NaHCO3-Na2CO3(0.1mol/L)緩衝溶液調節pH值,向燒杯中加入一定量的催化劑,置於光源下,磁力攪拌器攪拌,每隔一小時測定剩餘氨氮溶液的吸光度。取1ml氨氮溶液,加1.5ml納氏試劑,1ml酒石酸鉀鈉溶液稀釋至50ml,用T1901紫外可見分光光度計測定388nm處的吸光度,以此計算氨氮的降解率。
氨氮降解率=(1-Ci/C0)×100%=(1-Ai/A0)×100%
式中,C0為氨氮的初始濃度,A0為初始溶液的吸光度,Ci為剩餘氨氮的濃度,Ai為剩餘氨氮的吸光度。
(6)催化劑穩定性:通過多次循環實驗來評價雜化催化劑的穩定性。NG-MoS2催化劑在近紅外光輻射下連續5次催化降解氨氮的降解率。每一次實驗持續8h,在每一次降解結束後,通過離心分離、去離子水洗滌得到催化劑,然後再繼續循環使用該催化劑。在5次循環降解氨氮後,氨氮去除率仍在90%以上。
應當理解,上述實施例僅為說明本發明的技術構思及特點,其目的在於讓熟悉此項技術的人士能夠了解本發明的內容並據以實施,並不能以此限制本發明的保護範圍。凡根據本發明精神實質所作的等效變化或修飾,都應涵蓋在本發明的保護範圍之內。
