M1巨噬細胞腫瘤疫苗的製備方法與流程
2023-05-13 23:51:51 2
本發明涉及腫瘤免疫治療技術領域,特別是M1巨噬細胞腫瘤疫苗的製備方法。
背景技術:
特異性主動免疫療法治療腫瘤具有一定的療效已為許多研究所證實,如何製備出高抗原表達的瘤苗是提高此療法療效的關鍵。目前,處於基礎和臨床研究階段的瘤苗主要有修飾的自體腫瘤細胞瘤苗、單一蛋白成分瘤苗或熱休克蛋白肽複合體瘤苗及樹突狀細胞瘤苗等,如專利93112060.8等。修飾的自體腫瘤細胞瘤苗是採用適當的理化因素對腫瘤細胞進行處理以促進細胞表面蛋白質的變構或偶聯,或用病毒轉染和轉基因等手段使腫瘤細胞的異物性增加,以提高腫瘤細胞的免疫原性而製備的瘤苗,腫瘤細胞經處理後雖在一定程度上可增加腫瘤細胞的抗原性,但修飾方法沒有從根本上改變腫瘤細胞表面MHC1類分子表達減少,腫瘤特異或非特異性抗原不能表達在細胞表面的弊端,自體修飾腫瘤細胞瘤苗免疫反應的誘發作用不強,臨床療效並不十分理想。
單一蛋白成分瘤苗(如用從黑色素瘤細胞中提取出的MAGE1、MAGE2製備的瘤苗),這些瘤苗不能克服腫瘤的異質性,採用這樣的瘤苗治療只會使免疫系統對實體瘤中表達該抗原腫瘤細胞產生殺傷,而對同一腫瘤中不表達該抗原的腫瘤細胞不會殺傷,單一蛋白成分瘤苗的臨床療效亦不理想。
熱休克蛋白肽複合體瘤苗是利用從腫瘤細胞中分離出的熱休克蛋白肽複合體製備的腫瘤疫苗,這種蛋白成分的瘤苗可以克服MHCI類分子的限制能夠用於同種異體,並能夠克服腫瘤的異質性,實驗研究表明這種瘤苗具有較好的抑瘤作用,但這種瘤苗的製備成本很高、瘤苗細胞數量少,不便於臨床實際應用。
樹突狀細胞腫瘤疫苗(DC細胞瘤苗)是目前國內外熱點研究的腫瘤疫苗,DC細胞瘤苗是利用樹突狀細胞與腫瘤細或腫瘤細胞內容物混合培養而製備的腫瘤瘤苗,這些腫瘤苗瘤苗雖可克服了腫瘤細胞抗原性弱和不能用於同種異體的弊端,但熱休克蛋白肽複合體和DC前體細胞的分離提取比較複雜,且費用較高,不適於臨床應用。本項發明是為建立一種有效並便於臨床應用的腫瘤疫苗製備方法。
技術實現要素:
本發明的目的在於克服現有技術的不足,本發明提供一種M1巨噬細胞腫瘤疫苗的製備方法。本發明解決其技術問題是採取以下技術方案實現的:M1巨噬細胞腫瘤疫苗的製備方法,包含下列步驟:誘導腫瘤細胞壞死及製備裂解液,進行單核細胞-巨噬細胞的分化培養,進行巨噬細胞的M1極化誘導以及腫瘤細胞裂解液刺激M1巨噬細胞。
優選地,所述製備腫瘤細胞裂解液步驟包含下列步驟:研碎腫瘤組織並進行一次過濾得到濾液;將所述濾液加入到裝有Ficoll-Hypaque淋巴細胞分離液的試管中,2000rpm離心20min,吸取單個核細胞層得到腫瘤細胞,將所述腫瘤細胞移入到另一試管中;生理鹽水懸浮所述腫瘤細胞,1000rpm離心10min,棄上清,重複三次;用生理鹽水將所述腫瘤細胞調成4×107c/mL,37℃、5%CO2條件下放置48小時製得細胞懸液;將所述細胞懸液置於-80℃冰箱25min,取出迅速放入37℃水浴中10min,反覆3次;將所述細胞懸液1000rpm離心5min,取上清液,分裝到離心管中,-20℃保存。
優選地,所述巨噬細胞的分化培養步驟包含下列步驟:將肝素抗凝血注入離心管中,在4℃下1000rpm離心5min,棄上層血漿得到血細胞;向所述血細胞中加Hank’s液或生理鹽水並混勻製成血細胞懸液,將所述血細胞懸液緩慢加入到裝有Ficoll-Hypaque的離心管中,在4℃下2000rpm離心20min;取PBMC並將其移入離心管中,加Hank’s液或生理鹽水,在4℃下1000rpm離心5min,棄上清,用Hank’s液或生理鹽水洗細胞3次;加入無血清培基懸浮所述細胞,將細胞懸液加入培養瓶中,37℃、5%CO2條件下培養2小時;輕輕搖晃培養瓶,吸棄非貼壁細胞。
優選地,所述巨噬細胞的M1極化誘導步驟包含下列步驟:加入含GM-CSF的無血清培基,37℃、5%CO2條件下培養9天;加入含IFN-γ以及腫瘤細胞裂解液的無血清培基,37℃、5%CO2條件下培養3天;輕輕搖晃培養瓶,吸棄培基;用生理鹽水衝洗貼壁細胞,刮下貼壁細胞,轉至離心管中,補加鹽水,4℃下1000rpm離心5min,棄去上清;生理鹽水洗細胞並重懸細胞,加入CpG,過濾,將細胞懸液裝入凍存管中,封口粘貼標籤。
本發明的優點和積極效果是:M1型巨噬細胞是機體病原微生物和壞死組織的主要清理細胞,且具有抗原呈遞功能,在特異性免疫反應的誘發和免疫調節過程中起關鍵作用。採用壞死腫瘤細胞裂解液刺激M1巨噬細胞而製備的M1巨噬細胞腫瘤疫苗,將能夠克服腫瘤細胞因表面抗原表達不足、抗原性弱的弊端,具有良好的誘發特異性抗腫瘤免疫反應作用。
附圖說明
圖1為M1型巨噬細胞程度CD68、CD14分子的表達率;
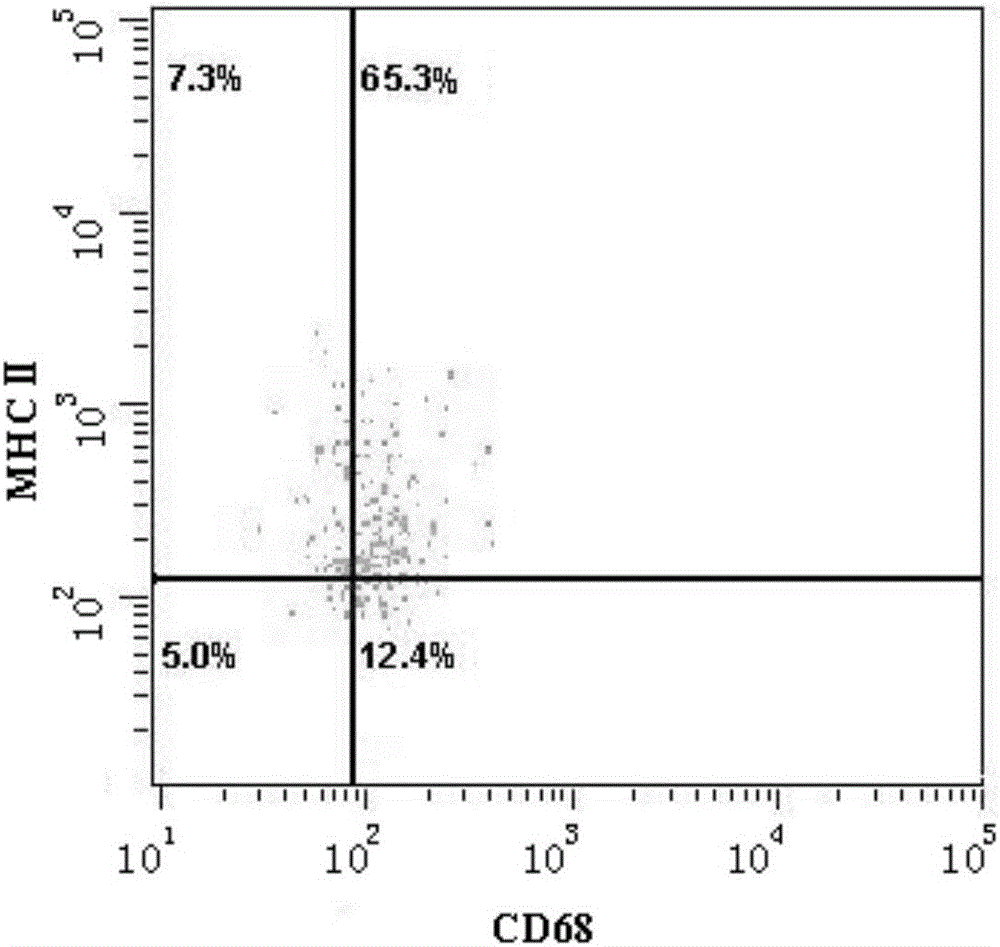
圖2為M1型巨噬細胞程度CD68、MHCⅡ分子的表達率;
圖3為M1型巨噬細胞程度CD80、CD86分子的表達率;
圖4為實驗組小鼠的處理流程;
圖5為各組小鼠的腫瘤形成率;
圖6為各組小鼠的腫瘤體積;
圖7為各組小鼠的腫瘤重量;
圖8為各組小鼠的腫瘤脾細胞腫瘤殺傷率。
具體實施方式
下面結合附圖、通過具體實施例對本發明作進一步詳述。以下實施例只是描述性的,不是限定性的,不能以此限定本發明的保護範圍。
實驗器材
低溫常速離心機(美國,Beckman)、CO2細胞培養箱(日本,Sanyo)、移液器(美國,Thermo)、刻度吸管(美國,Kimble)、25cm2培養瓶(美國,Corning)、15ml離心管(美國,Corning)、50ml離心管(美國,Corning)、細胞刮刀(美國,Corning)、注射器芯(中國,山東威高醫用高分子股份有限公司)、培養皿(美國,Corning)、細胞濾器(美國,Corning)、倒置顯微鏡(日本,Nikon)、凍存管(美國,Corning)。
實驗試劑
Ficoll-Hypaque細胞分離液(天津灝洋生物製品科技有限責任公司))、氯化鈉注射液(石家莊四藥公司)、NaCl(國藥瀘試)、KCl(國藥瀘試)、MgSO4·7H2O(天津致遠化學有限公司)、MgCl2·6H2O(天津致遠化學有限公司)、CaCl2(天津博迪化學有限公司)、Na2HPO4·12H2O(天津市光復科技發展有限公司)、KH2PO4(天津致遠化學有限公司)、葡萄糖(國藥瀘試)、酚紅(上海寶曼生物科技有限公司)、肝素鈉(上海第一生化藥業有限公司)、IFN-γ(北京四環生物製藥有限公司)、GM-CSF(北京雙鷺藥業股份有限公司)、無血清培基(Thermo)、CpG(Peprotech)。
腫瘤細胞裂解液的製備:新鮮腫瘤組織(離體0.5小時內)剪成1mm3方塊,洗滌後,採用注射器芯在培養皿中將瘤塊研碎,200目濾網過濾,將濾液加入到裝有稀釋的Ficoll-Hypaque試管中[Ficoll-Hypaque的密度為1.077±0.02):生理鹽水=3:1],2000rpm離心20min,吸取單個核細胞層,將腫瘤細胞移入到另一試管中。生理鹽水懸浮細胞,1000rpm離心10min,棄上清,重複三次。用生理鹽水將細胞調成4×107c/mL,37℃、5%CO2條件下放置48小時,將細胞懸液置於-80℃冰箱25min,取出迅速放入37℃水浴中10min,反覆3次。1000rpm離心5min,取上清液,分裝到離心管中,-20℃保存。
配置Hank’s液:1.甲液:NaCl 160g、KCl8g、MgSO4·7H2O 2g、MgCl2·6H2O 2g加入到800ml三蒸水,溶解。CaCl2 2.8g溶於100ml三蒸水,溶解後加入到上述800ml溶液中,補足三蒸水至1000ml。2.乙液:Na2HPO4·12H2O 3.04g、KH2PO41.2g、葡萄糖20g加入800ml雙蒸水,溶解。加入0.4%酚紅溶液100ml,上述二液混合,加三蒸水至1000ml。使用時按甲液1份、乙液1份、三蒸水18份濾過,8磅20min分鐘滅菌,4℃保存。
巨噬細胞的分化培養與M1極化誘導:將20ml肝素抗凝血注入50ml離心管中,在4℃下1000rpm離心5min。移棄上層血漿,加Hank’s液或生理鹽水至20ml,混勻。將血細胞懸液緩慢加入到裝有4ml Ficoll-Hypaque(密度:1.077±0.001)的離心管中,每管10ml,在4℃下2000rpm離心20min,吸取沉澱(PBMC層)細胞並將其移入15ml離心管中。加Hank’s液或生理鹽水至15ml,在4℃下1000rpm離心5min,棄上清。Hank’s液或生理鹽水洗細胞3次。加入16ml無血清培基懸浮PBMC細胞,將細胞懸液加入到25cm2培養瓶中,每瓶8ml細胞懸液,37℃、5%CO2條件下培養2小時。輕輕搖晃培養瓶,吸棄非貼壁細胞。加入含100ng/mlGM-CSF的無血清培基,每瓶12ml,37℃、5%CO2條件下培養9天。加入含100IU/ml IFN-γ及100μl/ml腫瘤細胞裂解液(製備方法如方法1)的無血清培基,每瓶4ml,37℃、5%CO2條件下培養3天。吸取2ml上清液用於支原體檢查(RT-PCR法),然後輕輕搖晃培養瓶,吸棄培基。用生理鹽水衝洗貼壁細胞3次,用細胞刮刀刮下貼壁細胞,轉至離心管中,補加生理鹽水至50mL。4℃下1000rpm離心5min,棄去上清。生理鹽水洗細胞3次。1ml生理鹽水重懸細胞,加入4mg/ml的0.1mlCpG,200目濾網過濾,將細胞懸液裝入到2mL凍存管中,封口,粘貼標籤,用於皮下接種。
效果測試:在圖5到圖8中,A為生理鹽水注射組;B為巨噬細胞接種組;C為巨噬細胞腫瘤疫苗接種組。A、B及C組小鼠分別於左後肢皮下接種生理鹽水、未經腫瘤刺激的巨噬細胞及巨噬細胞腫瘤疫苗(壞死H22腫瘤細胞刺激M1巨噬細胞而得),0.1ml/只(B組與C組接種的巨噬細胞濃度為2×106/ml,生理鹽水稀釋),每周1次,連續2次,間隔2周後四組小鼠分別於左前肢皮下接種生長良好的H22腫瘤細胞,0.1ml/只(細胞懸液濃度為2×106/ml,生理鹽水稀釋),腫瘤細胞接種4周後處死全部小鼠,並分別計算四組小鼠成瘤率,電子天平稱量瘤重量,遊標卡尺測量腫瘤結節的長度(L)與寬度(W),計算瘤體積。注(:體積=0.5×L×W2)。結果顯示巨噬細胞腫瘤疫苗接種組腫瘤細胞攻擊後腫瘤成瘤率、瘤體積及瘤重量明顯低於未刺激巨噬細胞接種組和生理鹽水接種組(P<0.05)。巨噬細胞腫瘤疫苗接種組的脾細胞對腫瘤細胞的殺傷率明顯高於未刺激巨噬細胞接種組和生理鹽水接種組(P<0.05),表明巨噬細胞腫瘤疫苗在體內能夠誘發特異性抗腫瘤免疫反應。
