2,3‑丁二醇的生成能力得到增強的重組微生物及利用其的2,3‑丁二醇的生產方法與流程
2023-12-05 10:06:16 2
本發明涉及2,3-丁二醇的生成能力得到增強的重組微生物及利用其的2,3-丁二醇的生產方法。
背景技術:
作為具有4個碳和2個羥基(-oh)的醇的一種(ch3chohchohch3)的2,3-丁二醇,可化學性地催化轉化為作為合成橡膠製備工序的原料物質的1,3-丁二烯(1,3-butadiene)和用於燃料添加劑及溶劑的甲基乙基甲酮(methylethylketone,mek)。(jietal.,biotechnol.adv.,29:351,2011)).並且,2,3-丁二醇與汽油(gasoline)相混合可適用於辛烷值增進劑(octanebooster),是在產業上極其重要的中間體(celinskaetal.,biotechnol.adv.,27:715,2009)。
2,3-丁二醇可通過化學合成工序和微生物發酵工序進行生產。然而,通過上述工序的2,3-丁二醇的生產成本非常高,因此還未實現商業規模的2,3-丁二醇的生產。另一方面,近來,與通過微生物發酵工序的2,3-丁二醇生產技術的飛躍發展一同,隨著化石燃料物質的價格的急劇上漲和國際性的對環境汙染的限制,對於通過微生物發酵的生物基2,3-丁二醇的生產的關心和研究開發的重要性逐漸增大。
基於生物的2,3-丁二醇的生產方法通過保留2,3-丁二醇生產能力的微生物的發酵,來將可再生的生物原料物質(biomass)轉換為2,3-丁二醇。通過克雷伯氏菌(klebsiella)、腸桿菌(enterobacter)、芽孢桿菌(bacillus)、沙雷氏菌(serratia)種(species)等不同種類的微生物生產2,3-丁二醇(maddoxis,biotechnol.,6:269,1996)。尤其,肺炎克雷伯氏菌(k.pneumoniae)、產酸克雷伯氏菌(k.oxytoca)、多粘類芽孢桿菌(paenibacilluspolymyxa)生產相對多量的2,3-丁二醇,尤其,肺炎克雷伯氏菌與產酸克雷伯氏菌具有如下優點:培養容易,生長速度快,可從包含來源於木質類5碳糖的不同種類的生物原料物質生產2,3-丁二醇(jietal.,biotechnol.adv.,29:351,2011;chandeletal.,sustainablebiotechnol.,63,2010;jansenetal.,biotechnol.bioeng.,26:362,1984;jansenetal.,adv.biochem.eng.,27:85,1983)。
大致分為發酵工序最優化(溫度、ph、溶解氧等)、微生物開發(微生物挖掘、生理學特性把握、突變、基因操作等)領域來進行通過微生物發酵工序的基於生物的2,3-丁二醇的生產研究。在發酵工序最優化方面,查明了可有效地生產2,3-丁二醇的溫度、ph、溶解氧濃度等多種條件(jietal.,bioresour.technol.,100:3410,2009;nakashimadaetal.,j.biosci.bioeng.,90:661,2000;nakashimadaetal.,biotechnol.lett.,20:1133,1998)。但是,在上述條件下的通過微生物發酵工序的2,3-丁二醇生產仍然存在由於生產率(productivity)及收率(yield)低,因而難以直接適用於商業工序的問題。並且,還存在如下問題:在發酵中生成與2,3-丁二醇一同包含乳酸的有機酸(organicacids)和包含乙醇的乙醇(alcohols)等的多種副產物。副產物的生成不僅降低與生物原料物質相關的2,3-丁二醇的收率,並且從培養液回收2,3-丁二醇過程中需要莫大的分離及純化費用。
因此,主要想減少副產物的方向進行與2,3-丁二醇生產相關的微生物開發研究。代表性地,ji等使作為物理/化學性突變方法的一種的紫外線(uv)露出於野生型產酸克雷伯氏菌菌株,來成功於對作為副產物的有機酸的生成進行一部分抑制(jietal.、biotechnol.lett.、30:731、2008)。除此之外,通過將離子束(ionbeam)方式適用於肺炎克雷伯氏菌菌株,來使生物質的消耗速度增加,從而還試圖提高2,3-丁二醇的生產(maetal.,appl.microbiol.biotechnol.,82:49,2009)。但是,上述開發的菌株在2,3-丁二醇生產率、最終濃度(concentration)及收率方面仍然存在難以直接適用於商業工序的問題。
對此,本發明人在對2,3-丁二醇的生產率、濃度及收率高的重組微生物進行研究中,發現導入特定基因的重組微生物對2,3-丁二醇的選擇度及生產率高,並且完成了本發明。
技術實現要素:
本發明要解決的技術問題
本發明的目的在於提供2,3-丁二醇的生成能力得到增強的重組微生物及利用其的2,3-丁二醇的生產方法。
技術方案
為了實現本發明,本發明提供2,3-丁二醇生產用重組微生物,用於生產2,3-丁二醇,促進用於將丙酮酸轉換為α-乙醯乳酸的途徑、用於將α-乙醯乳酸轉換為乙偶姻的途徑或用於將乙偶姻轉換為2,3-丁二醇的途徑。
並且,本發明提供2,3-丁二醇的生產方法,上述2,3-丁二醇的生產方法包括:對本發明的重組微生物進行接種的步驟;以及對上述重組微生物進行培養的步驟。
有益效果
本發明的重組微生物對2,3-丁二醇的生產率高。
附圖說明
圖1示出在2,3-丁二醇生成菌株中2,3-丁二醇的生物合成途徑。
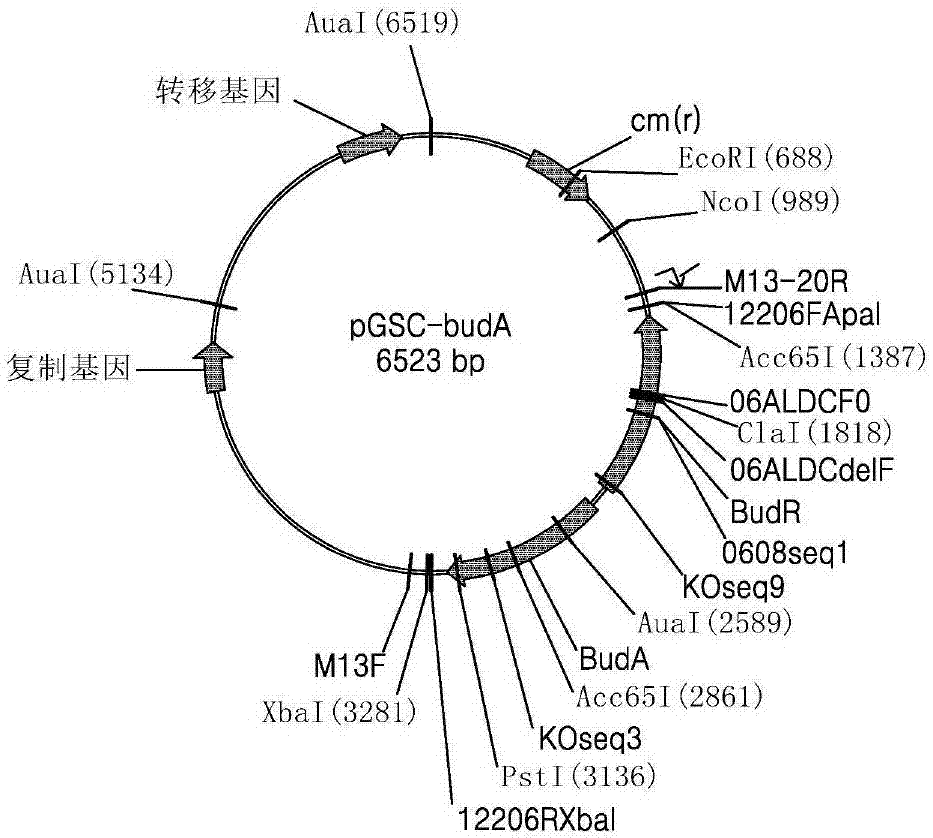
圖2示出pgsc-buda質粒。
圖3示出pgsc-budb質粒。
圖4示出pgsc-budabc質粒。
圖5為比較例1的野生型產酸克雷伯氏菌菌株(k.oxytocawildtype)的發酵結果。
圖6為比較例2的重組產酸克雷伯氏菌菌株(產酸克雷伯氏菌(k.oxytoca)△ldha△pflb)的發酵結果。
圖7為實施例1的重組產酸克雷伯氏菌菌株(野生型產酸克雷伯氏菌(k.oxytocawildtype)+pgsc-budrabc)的發酵結果。
圖8為實施例2的重組產酸克雷伯氏菌菌株(產酸克雷伯氏菌△ldha△pflb+pgsc-budra)的發酵結果。
圖9為實施例3的重組產酸克雷伯氏菌菌株(產酸克雷伯氏菌△ldha△pflb+pgsc-budrab)的發酵結果。
圖10為實施例4的重組產酸克雷伯氏菌菌株(產酸克雷伯氏菌△ldha△pflb+pgsc-budrabc)的發酵結果。
具體實施方式
本發明涉及2,3-丁二醇生產用重組微生物,用於生產2,3-丁二醇,促進用於將丙酮酸轉換為α-乙醯乳酸的途徑、用於將α-乙醯乳酸轉換為乙偶姻的途徑或用於將乙偶姻轉換為2,3-丁二醇的途徑。
並且,本發明涉及2,3-丁二醇的生產方法,上述2,3-丁二醇的生產方法包括:對本發明的重組微生物進行接種的步驟;以及對上述重組微生物進行培養的步驟。
以下對本發明進行詳細說明。
2,3-丁二醇生成能力得到增加的重組微生物
本發明的重組微生物為2,3-丁二醇生產用重組微生物,上述2,3-丁二醇生產用重組微生物用於生產2,3-丁二醇,促進用於將丙酮酸轉換為α-乙醯乳酸的途徑、用於將α-乙醯乳酸轉換為乙偶姻的途徑或用於將乙偶姻轉換為2,3-丁二醇的途徑。
並且,本發明的重組微生物為如下重組微生物:生產2,3-丁二醇的微生物,增加選自由乙醯乳酸合成酶、乙醯乳酸脫羧酶及乙偶姻還原酶組成的組中的一種以上的酶的活性。
並且,本發明的重組微生物為如下重組微生物:生產2,3-丁二醇的微生物,增加選自由乙醯乳酸合成酶、乙醯乳酸脫羧酶及乙偶姻還原酶組成的組中的兩種以上的酶的活性。
並且,本發明的重組微生物為如下重組微生物:生產2,3-丁二醇的微生物,增加乙醯乳酸合成酶、乙醯乳酸脫羧酶及乙偶姻還原酶的活性。
並且,本發明的重組微生物可以為2,3-丁二醇生產用重組微生物,上述2,3-丁二醇生產用重組微生物在2,3-丁二醇生產微生物中,抑制用於將丙酮酸轉換為乙醯輔酶a的途徑、用於將丙酮酸轉換為甲酸的途徑或用於將丙酮酸轉換為乳酸的途徑,並促進用於將丙酮酸轉換為α-乙醯乳酸的途徑、用於將α-乙醯乳酸轉換為乙偶姻的途徑或用於將乙偶姻轉換為2,3-丁二醇的途徑。
在上述情況下,本發明的重組微生物可以為如下重組微生物:生產2,3-丁二醇的微生物,抑制用於將丙酮酸轉換為乙醯輔酶a的途徑、用於將丙酮酸轉換為甲酸的途徑及用於將丙酮酸轉換為乳酸的途徑,並促進用於將丙酮酸轉換為α-乙醯乳酸的途徑。
並且,在上述情況下,本發明的重組微生物可以為如下重組微生物,生產2,3-丁二醇的微生物,抑制用於將丙酮酸轉換為乙醯輔酶a的途徑、用於將丙酮酸轉換為甲酸的途徑及用於將丙酮酸轉換為乳酸的途徑,並促進用於將丙酮酸轉換為α-乙醯乳酸的途徑及用於將α-乙醯乳酸轉換為乙偶姻的途徑。
並且,在上述情況下,本發明的重組微生物可以為如下重組微生物,生產2,3-丁二醇的微生物,抑制用於將丙酮酸轉換為乙醯輔酶a的途徑、用於將丙酮酸轉換為甲酸的途徑及用於將丙酮酸轉換為乳酸的途徑,並促進用於將丙酮酸轉換為α-乙醯乳酸的途徑及用於將α-乙醯乳酸轉換為乙偶姻的途徑及用於將乙偶姻轉換為2,3-丁二醇的途徑。
並且,本發明的重組微生物可以為如下重組微生物:生產2,3-丁二醇的微生物,抑制丙酮酸-甲酸裂解酶及乳酸脫氫酶的活性,並增加乙醯乳酸合成酶的活性。
並且,本發明的重組微生物可以為如下重組微生物:生產2,3-丁二醇的微生物,抑制丙酮酸-甲酸裂解酶及乳酸脫氫酶的活性,並增加乙醯乳酸合成酶及乙醯乳酸脫羧酶的活性。
並且,本發明的重組微生物可以為如下重組微生物:生產2,3-丁二醇的微生物,抑制丙酮酸-甲酸裂解酶及乳酸脫氫酶的活性,並增加乙醯乳酸合成酶及乙醯乳酸脫羧酶及乙偶姻還原酶的活性。
並且,本發明的重組微生物對2,3-丁二醇的選擇度、收率濃度及生產率高。並且由上述重組,本發明的重組微生物可以為與野生型微生物相比,如甲酸、乳酸等副產物的生成能力得到抑制的重組微生物。
乙醯輔酶a生物合成途徑
本發明的重組微生物可以為利用具有乙醯輔酶a及乳酸生物合成途徑的2,3-丁二醇生產微生物來製備重組微生物。本發明的乙醯輔酶a(acetyl-coa)生物合成途徑意味著從微生物內特定代謝產物合成乙醯輔酶a的途徑。本發明的乙醯輔酶a生物合成途徑可成為從丙酮酸(pyruvate)合成乙醯輔酶a的途徑等。
乳酸生物合成途徑
本發明的重組微生物可以為利用具有乙醯輔酶a及乳酸生物合成途徑的2,3-丁二醇生產微生物來製備重組微生物。本發明的乳酸(lactate)生物合成途徑意味著從微生物內特定代謝產物合成乳酸的途徑。本發明的乙醯輔酶a生物合成途徑可成為從丙酮酸(pyruvate)合成乳酸的途徑等。
2,3丁二醇生產微生物
本發明的重組微生物為遺傳上對2,3丁二醇生產微生物進行重組來製備的重組微生物。例如,上述2,3丁二醇生產微生物可以為克雷伯氏菌(klebsiella)屬、芽孢桿菌(bacillus)屬、沙雷氏菌(serratia)屬或腸桿菌(enterobacter)屬的微生物,優選地,可以為產酸克雷伯氏菌(k.oxytoca)、肺炎克雷伯氏菌(k.pneumoniae)等,最優選地,可以為產酸克雷伯氏菌(k.oxytoca)。在2,3丁二醇的產業規模的生產中,利用產酸克雷伯氏菌製備本發明的重組微生物有利於利用肺炎克雷伯氏菌。
抑制用於將丙酮酸轉化為乙醯輔酶a的途徑
丙酮酸-甲酸裂解酶(pyruvate-formatelyase)用於調節丙酮酸向乙醯輔酶a的轉換。通過抑制上述丙酮酸-甲酸裂解酶,來可抑制用於將丙酮酸轉換為乙醯輔酶a的途徑。可通過丙酮酸-甲酸裂解酶的表達抑制、丙酮酸-甲酸裂解酶的酶活性抑制等來實現上述丙酮酸-甲酸裂解酶的抑制。例如,使作為用於對丙酮酸-甲酸裂解酶進行編碼的基因的pflb缺失或在上述基因中引起突變(使一部分鹼基突變、取代或刪除或導入一部分鹼基來抑制正常的基因的表達等的突變),轉錄過程或翻譯過程中的基因表達調節等,本發明所屬技術領域的普通技術人員可選擇適當的方法來抑制丙酮酸-甲酸裂解酶。
抑制用於將丙酮酸轉換為甲酸的途徑
丙酮酸-甲酸裂解酶(pyruvate-formatelyase)用於調節丙酮酸向甲酸的轉換。通過抑制上述丙酮酸-甲酸裂解酶,來可抑制用於將丙酮酸轉換為甲酸的途徑。可通過丙酮酸-甲酸裂解酶的表達抑制、丙酮酸-甲酸裂解酶的酶活性抑制等來實現上述丙酮酸-甲酸裂解酶的抑制。例如,使作為用於對丙酮酸-甲酸裂解酶進行編碼的基因的pflb缺失或在上述基因中引起突變(使一部分鹼基突變、取代或刪除或導入一部分鹼基來抑制正常的基因的表達等的突變),轉錄過程或翻譯過程中的基因表達調節等,本發明所屬技術領域的普通技術人員可選擇適當的方法來抑制丙酮酸-甲酸裂解酶。
抑制用於將丙酮酸轉換為乳酸的途徑
乳酸脫氫酶(lactatedehydrogenase)用於調節丙酮酸向乳酸的轉換。通過抑制上述乳酸脫氫酶,可抑制用於將丙酮酸轉換為乳酸的路徑。上述乳酸脫氫酶的抑制可通過乳酸脫氫酶的表達抑制、乳酸脫氫酶的酶活性抑制等來實現。例如,使作為用於對乳酸脫氫酶進行編碼的基因的ldha缺失或在上述基因中引起基因突變(使一部分鹼基突變、取代或刪除或導入一部分鹼基來抑制正常的基因的表達等的突變),轉錄過程或翻譯過程中的基因表達調節等,本發明所屬技術領域的普通技術人員可選擇適當的方法來抑制乳酸脫氫酶。
促進用於將丙酮酸轉換為α-乙醯乳酸的途徑
乙醯乳酸合成酶(acetolactatesynthase)通過調節丙酮酸向α-乙醯乳酸的轉換,來參與α-乙醯乳酸的生成。可通過使上述乙醯乳酸合成酶的活性增加,來促進用於將丙酮酸轉換為α-乙醯乳酸的途徑。通過乙醯乳酸合成酶基因的擴增表達、乙醯乳酸合成酶的酶活性增加等,可實現上述乙醯乳酸合成酶的活性增加。例如,使作為對乳酸脫氫酶進行編碼的基因的budb導入於微生物或在上述基因中引起突變(使一部分鹼基突變、取代或刪除或導入一部分鹼基來擴增基因的表達等的突變),或在轉錄過程或翻譯過程中的基因表達調節等,本發明所屬技術領域的普通技術人員可選擇適當的方法來增加乙醯乳酸合成酶的活性。
促進用於將α-乙醯乳酸轉換為乙偶姻的途徑
乙醯乳酸脫羧酶(acetolactatedecarboxylase)通過調節α-乙醯乳酸向乙偶姻的轉換,來參與乙偶姻的生成。可通過使上述乙醯乳酸脫羧酶的活性增加,來促進用於將α-乙醯乳酸轉換為乙偶姻的途徑。通過乙醯乳酸脫羧酶基因的擴增表達、乙醯乳酸合成酶的酶活性增加等,可實現上述乙醯乳酸脫羧酶的活性增加。例如,使作為對乙醯乳酸脫羧酶進行編碼的基因的buda導入於微生物或在上述基因中引起突變(使一部分鹼基突變、取代或刪除或導入一部分鹼基來擴增基因的表達等的突變),或在轉錄過程或翻譯過程中的基因表達調節等,本發明所屬技術領域的普通技術人員可選擇適當的方法來增加乙醯乳酸合成酶的活性。
促進用於將乙偶姻轉換為2,3-丁二醇的途徑
乙偶姻還原酶(acetoinreductase)通過調節乙偶姻向2,3-丁二醇的轉換,來參與2,3-丁二醇的生成。可通過使上述乙偶姻還原酶的活性增加,來促進用於將乙偶姻還原酶轉換為2,3-丁二醇的途徑。通過乙偶姻還原酶基因的擴增表達、乙偶姻還原酶的酶活性增加等,可實現上述乙醯乳酸脫羧酶的活性增加。例如,使作為對乙偶姻還原酶進行編碼的基因的budc導入於微生物或在上述基因中引起突變(使一部分鹼基突變、取代或刪除或導入一部分鹼基來擴增基因的表達等的突變),或在轉錄過程或翻譯過程中的基因表達調節等,本發明所屬技術領域的普通技術人員可選擇適當的方法來增加乙偶姻還原酶的活性。
2,3-丁二醇的生產方法
本發明的2,3-丁二醇的生產方法包括:對本發明的重組微生物進行培養的步驟;以及從上述培養液回收2,3-丁二醇的步驟。
培養
本發明的重組微生物在好氧條件下進行培養,優選地,在微好氧條件(microaerobiccondition)下進行。例如,一邊提供氧,即,提供空氣來進行上述培養,作為具體例,上述培養可通過攪拌來完成,但不局限於此。本發明的重組微生物可在複合培養基中進行培養,複合培養基的種類不受特別限制,通常本發明所屬技術領域的普通技術人員可適當地選擇在市場中銷售、所使用的複合培養基來使用是顯而易見的。
具體實施例
通過參照詳細敘述的實施例,可明確本發明的優點及特徵、及用於實現它們的方法。然而,本發明不局限於以下公開的實施例,而是以其他多種方式來實現,本實施例僅用於使本發明的公開完整,並且為了使本發明所屬技術領域的普通技術人員完全地理解發明的範疇而提供,本發明僅由發明要求保護範圍的範疇來進行定義。
準備作為野生型菌株的產酸克雷伯氏菌kctc12132bp,並將此用作比較例1的菌株,並且利用產酸克雷伯氏菌kctc12132bp,在以下1-1及1-3中製備了重組微生物。
產酸克雷伯氏菌kctc12132bp
保藏機關名稱:韓國生命工學研究院
保藏號:kctc12132bp
保藏日期:2012年2月8日
-2,3-丁二醇的濃度(g/l):每單位體積生產的2,3-丁二醇的量
-2,3-丁二醇的收率(g/g):2,3-丁二醇的生產量(g)/碳源(g)×100
-2,3-丁二醇的生產率(g/l/h):每單位時間、單位體積生產的2,3-丁二醇的量
製備缺失ldha及pflb的重組產酸克雷伯氏菌
製備包含靶基因的相同部位的脫氧核糖核酸(dna)片段
為了使產酸克雷伯氏菌的靶基因未活性化,利用細菌的重組機制,並利用聚合酶鏈式反應擴增了基因的同源區域(homologousregion)。之後,將包含同源區域的相關脫氧核糖核酸片段轉移於細菌之後,利用基於位於脫氧核糖核酸片段的基因的同源區域和位於產酸克雷伯氏菌的染色體的基因之間的重組酶(recombinase)的重組機制去除靶基因。
首先,為了克隆產酸克雷伯氏菌的乳酸脫氫酶,利用seqidno.3及seqidno.4的引物對作為靶基因的ldha(seqidno.1)的同源區域1(seqidno.2)進行了聚合酶鏈式反應(pcr)擴增。並且,利用seqidno.6及seqidno.7的引物,對同源區域2(seqidno.5)進行了聚合酶鏈式反應擴增。之後,將同源區域1和同源區域2同時作為模板來進行聚合酶鏈式反應擴增,來完成了包含同源區域1與同源區域2的脫氧核糖核酸片段(seqidno.8)。
另一方面,為了克隆產酸克雷伯氏菌的丙酮酸甲酸裂解酶的相同區域,利用seqidno.11及seqidno.12的引物對作為靶基因的pflb(seqidno.9)的同源區域1(seqidno.10)進行了聚合酶鏈式反應(pcr)擴增。並且,利用seqidno.14及seqidno.15的引物,對同源區域2(seqidno.13)進行了聚合酶鏈式反應擴增。之後,將同源區域1和同源區域2同時作為模板來進行聚合酶鏈式反應擴增,來完成了包含同源區域1與同源區域2的脫氧核糖核酸片段(seqidno.16)(表1)。為了提高靶基因的重組概率,上述完成的脫氧核糖核酸片段可包含抗生素耐性基因等,為了去除染色體內重組的抗生素耐性基因,可包含對果聚糖蔗糖酶進行編碼的sacb基因。
表1
製備缺失ldha及pflb的重組產酸克雷伯氏菌
利用電穿孔法(electroporation,25uf、200ω、18kv/cm),向產酸克雷伯氏菌的野生型轉移了上述製備的氧核糖核酸片段,可利用微生物的重組機制,去除靶基因。
通過向產酸克雷伯氏菌野生型轉移包含ldha基因的同源區域的氧核糖核酸片段,來製備了去除ldha基因的重組產酸克雷伯氏菌。並且從產酸克雷伯氏菌野生型中去除ldha基因之後,轉移包含pflb基因的同源區域的脫氧核糖片段,來製備了在ldha基因中還去除pflb基因的產酸克雷伯氏菌。
利用如像這樣製備的缺失ldha及pflb的產酸克雷伯氏菌kctc12132bp重組微生物(以下,被稱為「比較例2」、「產酸克雷伯氏菌(產酸克雷伯氏菌(k.oxytoca)△ldha△pflb)」)來執行了重組工序及發酵實驗。
製備pgsc-buda質粒、pgsc-budab質粒及pgsc-budabc質粒
製備了使用於基因的表達擴增的重組質粒,上述基因用於對來源於產酸克雷伯氏菌的乙醯乳酸脫羧酶(buda)、乙醯乳酸合成酶(budb)及乙偶姻還原酶(budc)進行編碼。
為了製備使產酸克雷伯氏菌的靶基因表達擴增的重組載體,需要克隆對包含限制酶位點、多克隆位點(multiplecloningsite)、氯黴素耐性基因的pbbr1mcs(kovachetal.、biotechniques、800-802、1994)質粒進行擴增的基因。將相關質粒克隆在細菌,在細胞內種利用質粒的複製機制擴增基因的表達。
為了克隆對產酸克雷伯氏菌的乙醯乳酸脫羧酶進行編碼的基因(buda、seqidno.17)、對乙醯乳酸合成酶進行編碼的基因(budb、seqidno.18)及對乙偶姻還原酶進行編碼的基因(budc、seqidno.19),對靶基因進行了聚合酶鏈式反應擴增(表2)。此時,還同時導入作為調節(regulator)基因的budr(seqidno.20)。當進行擴增時,利用包含位於質粒的多克隆位點的限制酶位點(xbai、apai等)的引物來進行了擴增。利用位於多克隆位點的限制酶相同地處理包含各個基因的脫氧核糖核酸片段和質粒後,利用t4脫氧核糖核酸連接酶(t4dnaligase)接合上述兩個片段來完成了pgsc-buda、pgsc-budab及pgsc-budabc質粒(圖2至圖4)
表2
對乙醯乳酸脫羧酶、乙醯乳酸合成酶及乙偶姻還原酶進行編碼的基因的表達擴增
擴增了對來源於產酸克雷伯氏菌的乙醯乳酸脫羧酶(buda)、乙醯乳酸合成酶(budb)及乙偶姻還原酶(budc)進行編碼的基因的表達。
利用電穿孔法(electroporation,25uf、200ω、18kv/cm),對比較例1及比較例2的重組產酸克雷伯氏菌克隆了在上述1-2中製備的pgsc-buda質粒、pgsc-budab質粒及pgsc-budabc質粒。具體地,對野生型產酸克雷伯氏菌kctc12132bp(比較例1)克隆pgsc-budabc質粒來完成了上述基因的表達得到擴增的重組產酸克雷伯氏菌(以下,實施例1,被稱為「野生型產酸克雷伯氏菌(k.oxytocawildtype)+pgsc-budabc」)。並且,對作為同時去除ldha和pflb的重組微生物的比較例2的產酸克雷伯氏菌分別克隆pgsc-buda質粒、pgsc-budab質粒及pgsc-budabc質粒,來完成了上述基因的表達分別得到擴增的重組產酸克雷伯氏菌(實施例2至實施例4)。此時,還同時導入作為調節基因的budr。進行電穿孔法之後,在30℃溫度下,將上述重組產酸克雷伯氏菌培養1小時來進行穩定化之後,在37℃下在lb複合固體培養基中分別進行擴散(spreading)來培養了上述重組產酸克雷伯氏菌。之後,篩選在含有氯黴素的固體培養基中生長的菌落(colony)。接著,分離(miniprep)含於篩選的菌落的質粒,從而通過電泳確認了是否克隆基因。其結果,製備了以下重組微生物(表3)。
表3
缺失野生型微生物及ldha及pflb的重組微生物的2,3-丁二醇的生成能力
利用同時去除野生型克雷伯氏菌、ldha及pflb的比較例2的重組克雷伯氏菌菌株,對2,3-丁二醇的生產發酵能力進行了評價。
對同時去除比較例1的野生型產酸克雷伯氏菌、ldha及pflb的比較例2的重組產酸克雷伯氏菌執行了發酵。如下進行上述微生物的培養。
首先,將上述微生物接種於包含9g/l的葡萄糖的250ml的複合培養基,來在37℃溫度下培養16小時之後,將上述培養液接種於3l複合培養基來執行。發酵條件為微好氧條件(micro-aerobiccondition;呼氣流速:1vvm、攪拌速度:150rpm),90g/l的初始葡萄糖濃度、ph6.5及培養溫度為37℃。向培養基內添加了25mg/l的氯黴素。發酵當中為了調節ph而使用了5n的naoh。對上述野生型克雷伯氏菌及重組克雷伯氏菌採集了發酵中的樣品,並且通過測定採集的試樣的光密度od600(opticaldensity)來測定了生長速度,在13000rpm條件下,對採集的試樣離心分離10分鐘之後,利用高效液相色譜分析法(hplc)分析了上層液的代謝產物及2,3-丙二醇的濃度。
其結果,在產酸克雷伯氏菌中去除乳酸脫氫酶(ldha)和丙酮酸-甲酸分解酶(pflb)的情況下,2,3-丁二醇生產量為39.49g/l,2,3-丁二醇的生產收率(2,3-丁二醇g/葡萄糖g)為0.45。上述比較例2的重組微生物的生產率(g/l/h)為0.58。當與比較例1的野生型菌株進行比較時,比較例2的重組微生物的乳酸、甲酸及乙醇顯著減少,並2,3-丁二醇的生產能力變好,並且2,3-丁二醇的生產濃度、生產收率、生產率、選擇度均得到改善了(表4)(圖5及圖6)。
表4
選擇性的擴增表達buda、budab及budabc基因的重組微生物的2,3-丁二醇生產能力
對在上述1-3中製備的實施例1至實施例4的重組產酸克雷伯氏菌執行了發酵。
具體發酵如下:將作為實驗對象的重組微生物接種於包含9g/l的葡萄糖的250ml的複合培養基,來在37℃溫度下培養16小時之後,將上述培養液接種於3l複合培養基來執行。發酵條件為微好氧條件(micro-aerobiccondition;呼氣流速:1vvm、攪拌速度:150rpm),90g/l的初始葡萄糖濃度、ph6.5及培養溫度為37℃。向培養基內添加了25mg/l的氯黴素。發酵當中為了調節ph而使用了5n的naoh。對上述野生型克雷伯氏菌及重組克雷伯氏菌採集了發酵中的樣品,並且通過測定採集的試樣的光密度od600來測定了生長速度,在13000rpm條件下,對採集的試樣離心分離10分鐘之後,利用高效液相色譜分析法(hplc)分析了上層液的代謝產物及2,3-丙二醇的濃度。
其結果,可知在對野生型擴增表達budabc的情況下,與(實施例1)、比較例1(野生型)相比,2,3-丁二醇的收率、濃度增加了。但是,可知,乳酸(lactate)等副產物的生產量仍然與2,3-丁二醇相比多。
另一方面,當未去除基因pflb及ldha的實施例1與去除基因pflb及ldha的實施例4進行比較時,可確認如下:實施例4與實施例相比乳酸等的副產物降低效果優秀,2,3-丁二醇的收率、濃度及生產率更優秀(參照表4、圖7及圖10)。
並且,可知實施例2的重組微生物與比較例2的重組微生物(產酸克雷伯氏菌△ldha△pflb)相比2,3-丁二醇的收率及生產率顯著增加。並且,若相互比較實施例2及實施例3的重組微生物,則可確認不僅擴增buda時,2,3-丁二醇的生產率能得到了改善,而且當擴增budb時,2,3-丁二醇的生產率能還得到了改善。並且,若比較實施例3及實施例4的重組微生物,則可確認當擴增budc時,2,3-丁二醇的生產率能得到了改善。最終,當對budabc均進行擴增表達的實施例4的重組微生物與比較例2的重組微生物進行比較時,可知2,3-丁二醇生產率能最得到改善了。
因此,可確認如下:在2,3-丁二醇生產中不僅用於降低副產物的基因pflb及ldha的去除重要,而且擴增基因的表達為非常重要,上述基因為對克雷伯氏菌的乙醯乳酸脫羧酶進行編碼的基因、對乙醯乳酸合成酶進行編碼的基因、對乙偶姻還原酶進行編碼的基因(表5、圖7至圖10、圖7:實施例1、圖8:實施例2、圖9:實施例3、圖10:實施例4)。
表5
工業實用性
本發明涉及2,3-丁二醇生產用重組微生物,生產2,3-丁二醇的微生物,促進用於將丙酮酸轉換為α-乙醯乳酸的途徑、用於將α-乙醯乳酸轉換為乙偶姻的途徑或用於將乙偶姻轉換為2,3-丁二醇的途徑。
序列目錄
seqidno.1為作為對產酸克雷伯氏菌的乳酸脫氫酶進行編碼的基因的ldha的鹼基序列。seqidno.2為ldha的同源區域1,seqidno.3及seqidno.4為用於ldha的同源區域1的擴增聚合酶鏈式反應的引物。seqidno.5為ldha的同源區域2,seqidno.6及seqidno.7為用於ldha的同源區域2的的擴增聚合酶鏈式反應的引物。seqidno.8為將ldha的上述同源區域1及同源區域2同時作為模板利用聚合酶鏈式反應進行擴增的脫氧核糖核酸片段。
seqidno.9為作為對產酸克雷伯氏菌的丙酮酸甲酸裂解酶進行編碼的基因的pflb的鹼基序列。seqidno.10為pflb的同源區域1,seqidno.11及seqidno.12為用於pflb的同源區域2的擴增聚合酶鏈式反應的引物。seqidno.13為pflb的同源區域2,seqidno.14及seqidno.15為用於pflb的同源區域2的的擴增聚合酶鏈式反應的引物。seqidno.16為將pflb的上述同源區域1及同源區域2同時作為模板利用聚合酶鏈式反應進行擴增的脫氧核糖核酸片段。
seqidno.17為作為對產酸克雷伯氏菌的乙醯乳酸脫羧酶進行編碼的基因的buda的鹼基序列。seqidno.18為作為對乙醯乳酸合成酶進行編碼的基因的budb的鹼基序列,seqidno.19為作為對乙偶姻還原酶進行編碼的基因的budc的鹼基序列,seqidno.20為作為調節(regulator)基因的budr的鹼基序列。
