一種納米複合材料的合成方法和應用與流程
2023-12-10 07:43:37 1
本發明涉及材料科學與生物醫藥技術領域,具體為一種納米複合材料的合成方法和應用。
背景技術:
目前,惡性腫瘤嚴重威脅著人類的健康,是死亡率較大的疾病之一。臨床上,腫瘤治療的手段主要是手術治療、藥物治療及放射治療。但是,感染、機體的耐藥性及對正常組織的殺傷力等問題限制了其發展。光線治療,是腫瘤治療的一種新發現,包括光線治療和光動治療,它是利用特定波長的光照將能量傳遞給敏化劑而使周圍環境溫度上升或者觸動產生大量的單基態的氧,消融腫瘤細胞使其迅速死亡。光線療法可以對腫瘤部位選擇性治療,可避免對正常組織的傷害作用,幾乎對所有的腫瘤細胞都有殺傷,可治療複雜地非特異性腫瘤。協同光熱與光動治療效應可以達到更強的腫瘤細胞殺傷力。因此,開發新穎高效的光熱/光動材料對腫瘤治療有深遠的意義。
金屬有機框架結構納米粒子(nanoscalemetal-organicframeworks,nmofs)是金屬離子或者其金屬氧化物為中心與有機物為配體絡合作用而形成的一種新穎的材料,由於其金屬和有機配體的可變化性,可以將納米材料功能化而擴展其應用。本研究利用對生物體毒性作用較少的三價鐵離子為金屬中心,卟啉類分子為有機配體製備出的新穎nmofs,可以作為潛在的光動/光熱材料治療腫瘤。
同時,光動治療需要大量的氧氣參與,但是惡性腫瘤生命力旺盛,消耗了大量的氧氣,使得光動治療效應不是很好。有研究報導,磺胺類分子可以抑制腫瘤部位的缺氧誘導因子產生,從而可改善腫瘤部位缺氧的狀態,可以提高光動治療作用,並且磺胺類衍生物可以對腫瘤組織選擇性富集,有主動靶向的功能。同時,為了達到納米材料更好的生物相容性,蛋白質是充當修飾作用的最佳選擇,牛血清蛋白製備簡單易的,價格低廉而被廣泛地應用。基於此,利用牛血清蛋白與磺胺相互作用製備出複合物,並通過共價鍵作用將牛血清蛋白/磺胺修飾在上述nmofs上,製備出蛋白質/磺胺-金屬有機框架結構納米複合材料。
技術實現要素:
為實現上述目的,本發明提供了一種簡單而高效的具有光動/光熱效應的蛋白質/磺胺-金屬有機框架結構的納米複合材料及製備方法,該複合材料可作為高效的光熱/光動材料對腫瘤進行治療,對腫瘤部位有良好的靶向性,針對腫瘤部位的常氧、厭氧區都有很好的抑制作用。
為了實現本發明的目的,發明人通過大量試驗研究和不懈探索,最終獲得了如下技術方案:
一種納米複合材料的合成方法,該方法包括如下步驟:
(1)nmofs納米粒子的製備:分別取三價鐵鹽溶液、卟啉衍生物於三口燒瓶中,加入有機溶劑及醋酸,室溫攪拌2-4h;隨後,將體系升溫至80-120℃,反應20-24h,待反應溫度冷卻至室溫,分別用有機溶劑,乙醇,去離子水離心洗滌數次,將產品放在50-60℃的真空乾燥箱乾燥20-24h,即製備出nmofs納米粒子;
所述的三價鐵鹽為六水和氯化鐵、硫酸鐵或九水合硝酸鐵中的一種;
所述的卟啉衍生物為原卟啉、內消旋-四(4-羧基苯基)卟吩中的一種;
所述的三價鐵鹽與卟啉衍生物的摩爾比為1.0-1.5:1;
有機溶劑、醋酸的體積比為20-25:1;
所述的反應溶劑有機溶劑為n,n-二甲基甲醯胺(dmf),n,n-二甲基乙醯胺(dmac),甲醇中的一種或幾種;
(2)蛋白質/磺胺複合物的製備:蛋白質溶液與磺胺溶液共混,磁力攪拌10-12h,備用;
所述的蛋白質與磺胺複合物的摩爾比為1:1-10;
(3)蛋白質/磺胺-nmofs納米複合材料的製備:
a、稱取步驟(1)中所製備好的nmofs納米粒子,分散於去離子水中,用400-500w超聲儀反覆超聲2-4h,至納米粒子均勻的分散在水溶液中;隨後加入1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽((edc)於室溫下磁力攪拌15-30min,最後加入n-羥基琥珀醯亞胺(nhs)於室溫下磁力攪拌2-3h,反應完成後,用去離子水離心洗滌兩次後備用;
nmofs納米粒子在去離子水的濃度比5-10mg/ml;
nmofs納米粒與edc、nhs的質量比為1:5-4:3;
b、將步驟(2)中所製備的蛋白質/磺胺複合物溶液緩慢地滴加到步驟a已活化處理的nmofs溶液中,在室溫下反覆超聲10-12h,反應完成後,用去離子水離心洗滌數次,棄其上清液,最後的產品分散在水溶液中備用,即得蛋白質/磺胺-金屬有機框架結構納米複合材料溶液;
所述及蛋白/磺胺與nmofs質量比為55-60:1:285-290。
優選地,如上所述的一種納米複合材料的合成方法,所述的蛋白為牛血清蛋白。
本發明的另一目的在於提供一種納米複合材料的應用,該複合材料可應用於腫瘤治療。
與現有技術相比,本發明的積極效果如下:
(1)本發明以三價鐵離子為金屬中心,卟啉類分子為有機配體,採用自組裝的方式製備出金屬有機框架結構的納米粒子,其納米粒子粒徑均勻,為一種單分散性的納米粒子。
(2)本發明利用蛋白質/磺胺修飾金屬有機框架結構的納米粒子,製備出蛋白質/磺胺-金屬有機框架結構的納米複合材料,該製備方法具有操作簡單、反應條件溫和、環境友好、成本低廉、便於推廣的特點。
(3)本發明所述蛋白質/磺胺-金屬有機框架結構納米複合材料粒徑均一,結構穩定,合成條件簡單,生物相容性良好,毒性較低,具有較好的光熱/光動效應,屬於材料和生物醫藥的交叉領域,具有潛在的應用價值。
(4)本發明製備的蛋白質/磺胺-金屬有機框架結構的納米複合材料可通過主動/被動靶向而在腫瘤部位富集,從而可以減少治療試劑的劑量,降低對正常組織的毒副作用,也能更好的發揮其治療作用。
(5)本發明製備的蛋白質/磺胺-金屬有機框架結構的納米複合材料,具有光動/光熱效應,可以對腫瘤細胞有很強的殺傷力,可以作為一種潛在的腫瘤治療試劑。
(6)本發明中的磺胺類分子可以抑制腫瘤部位的缺氧誘導因子產生,從而可改善腫瘤部位缺氧的狀態,可以提高光動治療作用,並且磺胺類衍生物可以對腫瘤組織選擇性富集,有主動靶向的功能。
附圖說明
圖1為本發明的蛋白質與磺胺相互作用的螢光淬滅研究譜圖。
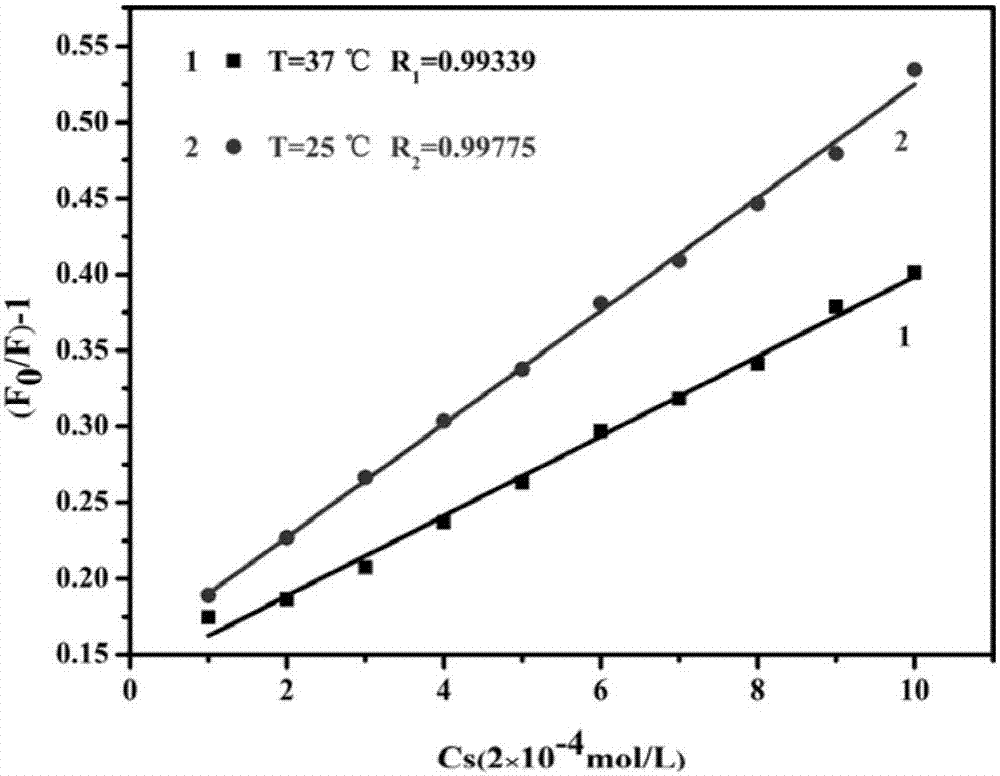
圖2是本發明的蛋白質與磺胺相互作用,在不同溫度下的螢光淬滅常數圖。
圖3是本發明的紅外譜圖。
圖4是本發明蛋白質/磺胺金屬有機框架結構的納米複合材料光熱轉換溫度上升圖。
圖5是本發明蛋白質/磺胺金屬有機框架結構的納米複合材料的細胞毒性研究。
圖6是本發明蛋白質/磺胺金屬有機框架結構的納米複合材料光動效應圖。
圖7是本發明蛋白質/磺胺金屬有機框架結構的納米複合材料體外研究光動/光熱治療腫瘤細胞圖。
具體實施方式
以下是本發明的具體實施例,對本發明的技術方案做進一步作描述,但是本發明的保護範圍並不限於這些實施例。凡是不背離本發明構思的改變或等同替代均包括在本發明的保護範圍之內。
實施例1
(1)nmofs納米粒子的製備,具體步驟如下:
配製三價鐵離子溶液,稱取2.7mgfecl3·6h2o溶於10ml的n,n-二甲基甲醯胺(1mmol/l),備用;配製卟啉溶液,稱取7.90mg內消旋-四(4-羧基苯基)卟吩(tcpp,相對分子質量=790g/mol)溶於10ml的n,n-二甲基甲醯胺(1mmol/l),備用。
分別取上述所配製好的1mlfecl3·6h2o,tcpp溶液於25ml的三口燒瓶中,加入10ml的n,n-二甲基甲醯胺,並加入0.4ml的醋酸,室溫攪拌2h;隨後,將體系升溫至80℃,反應24h,等反應溫度冷卻至室溫後,分別用n,n-二甲基甲醯胺溶劑,乙醇,去離子水離心洗滌數次,將產品放在60℃的真空乾燥箱乾燥24h,即製備出nmofs納米粒子。
(2)蛋白質/磺胺複合物的製備,具體步驟如下:
配製牛血清蛋白溶液(1×10-5mol/l),稱取66.43mg(相對分子質量=66.430kda)的牛血清蛋白,溶於100ml去離子水,備用;配製磺胺溶液(2×10-4mol/l),稱取3.444mg(相對分子質量=172.2g/mol),溶於100ml去離子水,備用。
取3ml已配製好的牛血清蛋白溶液於1.5ml磺胺溶液共混,磁力攪拌12h備用。
(3)牛血清蛋白/磺胺-nmofs納米複合材料的製備,具體步驟如下:
稱取步驟(1)中所製備好的10mgnmofs納米粒子,分散於10ml去離子水中,用400w超聲儀反覆超聲2h,至納米粒子均勻的分散在水溶液中,隨後加入(1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽/n-羥基琥珀醯亞胺)edc/nhs對nmofs溶液進行活化處理,具體為在上述溶液中加入1ml的4mg/mledc溶液,室溫下磁力攪拌15min後,加入1ml的3mg/mlnhs溶液,室溫下磁力攪拌2h,反應完成後,用去離子水離心洗滌兩次後備用。
將步驟(2)中所製備的4.5ml蛋白質/磺胺複合物溶液緩慢地滴加到上述已活化處理的nmofs溶液中,在室溫下反覆超聲12h,反應完成後,用去離子水離心洗滌數次,棄其上清液,最後的產品分散在水溶液中備用,即得蛋白質/磺胺-金屬有機框架結構納米複合材料溶液。
實施例2
(1)nmofs納米粒子的製備,具體步驟如下:
配製三價鐵離子溶液,稱取4.04mgfe(no3)3·9h2o溶於10ml的n,n-二甲基乙醯胺(1mmol/l),備用;配製卟啉溶液,稱取7.90mg內消旋-四(4-羧基苯基)卟吩(tcpp,相對分子質量=790g/mol)溶於10ml的n,n-二甲基乙醯胺(1mmol/l),備用。
分別取上述所配製好的1mlfe(no3)3·9h2o,tcpp溶液於25ml的三口燒瓶中,加入10ml的n,n-二甲基乙醯胺,並加入0.4ml的醋酸,室溫攪拌2h;隨後,將體系升溫至100℃,反應20h,等反應溫度冷卻至室溫後,分別用n,n-二甲基乙醯胺,乙醇,去離子水離心洗滌數次,將產品放在60℃的真空乾燥箱乾燥24h,即製備出nmofs納米粒子。
(2)蛋白質/磺胺複合物的製備,具體步驟如下:
配製牛血清蛋白溶液(1×10-5mol/l),稱取66.43mg(相對分子質量=66.430kda)的牛血清蛋白,溶於100ml去離子水,備用;配製磺胺溶液(2×10-4mol/l),稱取3.444mg(相對分子質量=172.2g/mol),溶於100ml去離子水,備用。
取3ml已配製好的牛血清蛋白溶液於1.5ml磺胺溶液共混,磁力攪拌12h備用。
(3)牛血清蛋白/磺胺-nmofs納米複合材料的製備,具體步驟如下:
稱取步驟(1)中所製備好的10mgnmofs納米粒子,分散於10ml去離子水中,用500w超聲儀反覆超聲2h,至納米粒子均勻的分散在水溶液中,隨後加入(1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽/n-羥基琥珀醯亞胺)edc/nhs對nmofs溶液進行活化處理,具體為在上述溶液中加入1ml的4mg/mledc溶液,室溫下磁力攪拌15min後,加入1ml的3mg/mlnhs溶液,室溫下磁力攪拌2h,反應完成後,用去離子水離心洗滌兩次後備用。
將步驟(2)中所製備的4.5ml蛋白質/磺胺複合物溶液緩慢地滴加到上述已活化處理的nmofs溶液中,在室溫下反覆超聲12h,反應完成後,用去離子水離心洗滌數次,棄其上清液,最後的產品分散在水溶液中備用,即得蛋白質/磺胺-金屬有機框架結構納米複合材料溶液。
實施例3
(1)nmofs納米粒子的製備,具體步驟如下:
配製三價鐵離子溶液,稱取5.62mgfe2(so4)3·9h2o溶於10ml的甲醇(1mmol/l),備用;配製卟啉溶液,稱取7.90mg內消旋-四(4-羧基苯基)卟吩(tcpp,相對分子質量=790g/mol)溶於10ml的甲醇(1mmol/l),備用。
分別取上述所配製好的1mlfecl3·6h2o,tcpp溶液於25ml的三口燒瓶中,加入10ml的有機溶劑,並加入0.4ml的醋酸,室溫攪拌2h;隨後,將體系升溫至80℃,反應20h,等反應溫度冷卻至室溫後,分別用甲醇,乙醇,去離子水離心洗滌數次,將產品放在60℃的真空乾燥箱乾燥24h,即製備出nmofs納米粒子。
(2)蛋白質/磺胺複合物的製備,具體步驟如下:
配製牛血清蛋白溶液(1×10-5mol/l),稱取66.43mg(相對分子質量=66.430kda)的牛血清蛋白,溶於100ml去離子水,備用;配製磺胺溶液(2×10-4mol/l),稱取3.444mg(相對分子質量=172.2g/mol),溶於100ml去離子水,備用。
取3ml已配製好的牛血清蛋白溶液於1.5ml磺胺溶液共混,磁力攪拌12h備用。
(3)牛血清蛋白/磺胺-nmofs納米複合材料的製備,具體步驟如下:
稱取步驟(1)中所製備好的5mgnmofs納米粒子,分散於10ml去離子水中,用400w超聲儀反覆超聲2h,至納米粒子均勻的分散在水溶液中,隨後加入(1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽/n-羥基琥珀醯亞胺)edc/nhs對nmofs溶液進行活化處理,具體為在上述溶液中加入1ml的4mg/mledc溶液,室溫下磁力攪拌15min後,加入1ml的3mg/mlnhs溶液,室溫下磁力攪拌2h,反應完成後,用去離子水離心洗滌兩次後備用。
將步驟(2)中所製備的4.5ml蛋白質/磺胺複合物溶液緩慢地滴加到上述已活化處理的nmofs溶液中,在室溫下反覆超聲12h,反應完成後,用去離子水離心洗滌數次,棄其上清液,最後的產品分散在水溶液中備用,即得蛋白質/磺胺-金屬有機框架結構納米複合材料溶液。
我們研究了蛋白質與磺胺相互作用的螢光淬滅譜圖,從圖1可知,蛋白質與磺胺分子可以很好的相互作用。
我們也研究了蛋白質與磺胺相互作用,在不同溫度下的螢光淬滅常數,從圖2可知,牛血清蛋白與磺胺是發生的靜態淬滅,即有化學鍵的生成,形成了牛血清蛋白/磺胺複合物。
對實施例1製備的樣品進行了紅外掃描,由圖3可知,nmofs的譜線1000cm-1出現fe-n峰,蛋白質/磺胺-金屬有機框架結構納米複合材料在1600-1700cm-1明顯出現蛋白質醯胺i與醯胺ii的特殊伸縮振動峰,證明已成功合成蛋白質/磺胺-金屬有機框架結構納米複合材料。
對實施例1製備的蛋白質/磺胺-金屬有機框架結構納米複合材料的性能測試:
(1)光熱效應測試
用1.5ml離心管裝入蛋白質/磺胺-金屬有機框架結構納米複合材料的水溶液,並按一定的複合材料的濃度配製樣品,以清水作為對照組。分別用1.2w/cm的660nm雷射照射10min,用紅外溫度顯示照相機每隔30s記錄溶液上升的溫度。
由圖4可以發現,雷射照射後,離心管內的溫度明顯上升,證明蛋白質/磺胺-金屬有機框架結構納米複合材料是很好的光熱轉換材料,可用於光熱治療於腫瘤。
(2)細胞毒性測試
將蛋白質/磺胺-金屬有機框架結構納米複合材料與4t1細胞共培養24h後,用mtt法檢測細胞的相對存活率。
由圖5可知,複合材料有很好的生物相容性,在實驗的最大濃度下(400μg/ml),細胞的相對存活率依然能達到80%以上。
(3)光動效應測試
光動效應主要是產生大量的單基態氧,因此我們用單基態的氧指示劑(cm-h2dcfda)檢測,單基態的氧可以使cm-h2dcfda變成不可逆轉的dcf,dcf可以顯示出綠色螢光,從而我們根據綠色螢光來證明其光動效應。將蛋白質/磺胺-金屬有機框架結構納米複合材料與4t1細胞共培育8h,用60mw/cm2的660nm雷射照射10min後,加入2μl的cm-h2dcfda溶液,通過螢光共聚焦顯微鏡可以直觀的觀察光動效應。
由圖6可知,光照過後的腫瘤細胞出現大面積的綠色螢光,證明蛋白質/磺胺-金屬有機框架結構納米複合材料受雷射激發可以產生大量的單基態氧,從而為殺死腫瘤細胞提供條件。
(4)抗腫瘤性質測試
蛋白質/磺胺-金屬有機框架結構納米複合材料的抗腫瘤性質,我們依然用mtt檢測法驗證。將同等濃度的蛋白質/磺胺-金屬有機框架結構納米複合材料與腫瘤細胞4t1細胞共培養8h,模擬蛋白質/磺胺-金屬有機框架結構納米複合材料對腫瘤細胞的光動、光熱治療,分別對上述已培養好的腫瘤細胞進行不同需要的光照實驗,用mtt測定細胞的相對存活率。
由圖7可知,蛋白質/磺胺-金屬有機框架結構納米複合材料是一種很好的光動/光熱協同材料,可以利用其光動/光熱效應很好的殺死腫瘤細胞。
