一種高效分離製備單一分子量透明質酸寡糖的方法與流程
2023-05-17 14:52:23 2
本發明涉及一種高效分離製備單一分子量透明質酸寡糖的方法,屬於生物工程技術領域。
背景技術:
透明質酸(hyaluronic acid,簡稱HA),俗稱玻璃尿酸,是一種由D-葡萄糖醛酸和N-乙醯氨基葡萄糖為重複雙糖單位,通過β(1-3)和β(1-4)糖苷鍵交替連接而成的大分子酸性黏性多糖,1934年由Meyer等人從牛玻璃球眼中首次提取獲得,廣泛用於醫藥、化妝品、食品等領域。研究表明,分子量對透明質酸的活性有很大影響,不同分子量的透明質酸甚至表現出截然相反的活性。
透明質酸以其獨特的分子結構和理化性質在機體內顯示出多種重要的生理功能,如潤滑關節,調節血管壁的通透性,調節蛋白質,水電解質擴散及運轉,促進創傷癒合等。尤為重要的是,透明質酸具有特殊的保水作用,是目前發現的自然界中保溼性最好的物質,被稱為理想的天然保溼因子,由於HA具有良好的保溼性、粘彈性、滲透性和延展性,同時無任何免疫原性和毒性,被廣泛應用於化妝品、食品和醫藥等行業領域。
根據文獻研究表明,分子量大小對HA的生物活性影響較大,不同分子量範圍的HA表現出截然不同的生理學功能。高分子量的HA(Mr>2×106)由於具有較好的粘彈性、保溼性、抑制炎性反應、潤滑等功能,可應用於高端化妝品行業、眼科手術黏彈劑和關節腔內注射治療。中等分子量的HA(介於1×105-106)具有良好的保溼性、潤滑和藥物緩釋作用,可廣泛用於化妝品、滴眼液、皮膚燒傷癒合及術後防粘連。低分子量的HA和寡聚透明質酸,表現出非常強的生物活性,具有抑制腫瘤擴散、促進創傷癒合、促進骨和血管生成、免疫調節等作用,且易於滲透到真皮中,免疫細胞、細胞因子的激活劑。因此,小分子透明質酸在食品保健、化妝品以及臨床醫療領域具有廣闊的應用前景。
透明質酸經過酶解得到的產物一般為多種O-HA的混合物,如果要製備不同糖殘基數的O-HA,必須經過分離。Tawada等用陰離子交換色譜柱進行分離,將凍幹的樣品溶於蒸餾水,通過陰離子交換色譜柱將不同殘基數的寡糖分離開,不同的O-HA片段用凝膠過濾脫鹽,然後用離心超濾裝置除菌除熱原,得到不同大小的O-HA。Ikegami-Kawai等用聚丙烯醯胺凝膠色譜進行分離,此外還有凝膠滲透色譜法(GPC)、HPLC法等分離方法。O-HA經凝膠層析分離只能得到一定Mr範圍的混合物,不能製得單一分子量的O-HA。O-HA經Bio-gel P6凝膠層析分離只能夠將大分子HA分離出來。Dowex1×2強陰離子交換層析不能完全將不同Mr的O-HA分離出來。
技術實現要素:
本發明公開了一種利用離子交換柱實現單一分子量透明質酸寡糖的製備方法。
所述方法包括以下步驟:
(1)以透明質酸酶水解透明質酸得到透明質酸寡糖混合物;
(2)使用離子交換柱HiPrep Q FF 16/10對透明質酸寡糖混合物進行分離純化;
所述步驟(2)中,先使用10倍柱體積的緩衝液A衝洗柱子,再通過10倍柱體積的洗脫劑,以2mL/min的流速對色譜柱進行線性洗脫,;所述洗脫劑由緩衝液A、緩衝液B組成,其中NaCl濃度於100min內從0提高到0.2mol/L,收集、合併同一峰對應的洗脫液;所述緩衝液A是50mmol/L的pH 8.5的甘氨酸-氫氧化鈉緩衝液,所述緩衝液B是pH 8.5的0.5mol/L的NaCl緩衝液。
在本發明的一種實施方式中,緩衝液A的製備是稱取3.75g甘氨酸溶解於500mL去離子水,用5MNaOH溶液調節pH至8.5,加去離子水定容至1L;緩衝液B的製備是稱取29.22gNaCl溶於緩衝液A中,並定容至1L。
在本發明的一種實施方式中,步驟(1)是在發酵罐中加入900mL的水,並加入透明質酸酶3.5×107U和透明質酸40g,並加水至1L,在45℃、轉速為700rpm條件下反應,反應11小時後高溫滅活。
本發明為解決規模化製備單一分子量透明質酸寡糖的的問題,採用生物酶法催化降解HA,將製備的寡糖規模化分離和純化,實現了工業化生產製備單一分子量的透明質酸寡糖。本發明將單一分子量的透明質酸寡聚糖進行分離,在工業上用於製備單一寡聚透明質酸及其衍生體具有潛在而非常廣泛的價值。
附圖說明
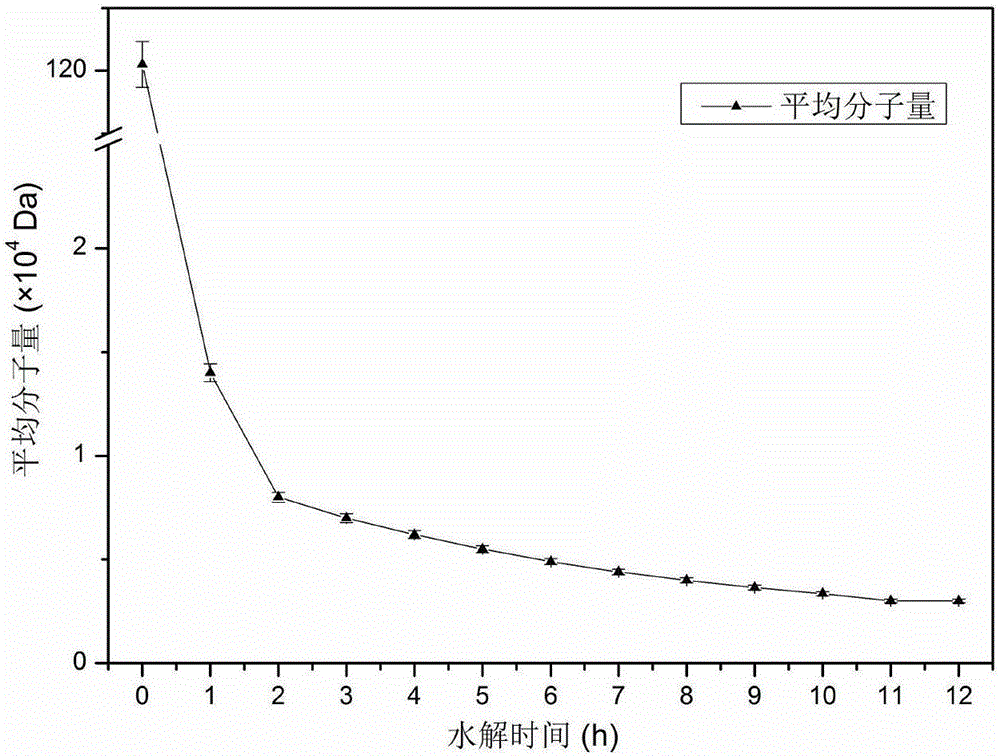
圖1是罐中酶活3.5×104U/mL的分子量變化趨勢圖;
圖2是水解產物的分離圖;
圖3是純化出的HA4的質譜圖;
圖4是純化出的HA6的質譜圖;
圖5是純化出的HA8的質譜圖;
圖6是純化出的HA10的質譜圖;
圖7是純化出的HA12的質譜圖;
圖8是純化出的HA14的質譜圖。
具體實施方式
水解產物分離方法:
水解產物15000r/min離心20min後取上清,緩衝液A:50mmol/L,pH 8.5的甘氨酸-氫氧化鈉緩衝液(稱取3.75g甘氨酸溶解於500mL去離子水,用5M NaOH溶液調節pH至8.5,加去離子水定容至1L);緩衝液B:pH 8.5,0.5mol/LNaCl緩衝液(稱取29.22gNaCl溶於800mL緩衝液A中,並定容至1L),使用柱子HiPrep 16/10Q FF(柱體積:20mL)美國GE公司。通過10倍色譜柱體積(CV)的洗脫劑,以2mL/min的流速對色譜柱進行線性洗脫,洗脫劑由緩衝液A、緩衝液B組成,其中NaCl濃度於100min內從0提高到0.2mol/L,AKTA蛋白純化系統美國Amersham Biosciences公司。AKTA蛋白純化系統配備有96孔板收集裝置,每個孔收集1mL的洗脫液。分離結束後,將96孔板從AKTA中取出,將收集的溶液放入冰中保存。
水解產物的質譜檢測方法:
洗脫樣品15000r/min離心20min後取上清,稀釋至1mg/mL上樣。BEHAmide(100mm×2.1mm,1.7μm)美國Waters公司;Waters Maldi synpat Q-TOF MS美國Waters公司,色譜條件:ESI-MS條件;色譜儀:Waters Acquity UPLC;分析色譜柱:BEHAmide 2.1×100mm1.7μm,柱溫:45℃,流速0.3mL/min,進樣量1μL,流動相:A:甲酸銨,B:乙腈,離子方式:ESI。質譜條件:離子源參數ESI,霧化器壓力:30psi;脫溶劑氣體流速50L/hour;溫度400℃;負離子模式。可檢測出分離產物的成分。
實施例1規模化製備特定分子量透明質酸寡糖
以水蛭來源的透明質酸酶對大分子量透明質酸進行水解,大分子量透明質酸的起始分子量大小為1.21×106Da。在發酵罐中加入900mL的水,並加入透明質酸酶3.5×107U和透明質酸40g,最後加水至1L,在45℃、轉速為700rpm條件下反應。每隔1小時取樣並將樣品在沸水中煮沸10分鐘以將酶滅活,然後採用0.22μm的濾膜過濾,使用凝膠柱進行分子量測定,繪製出分子量變化趨勢圖。如圖1所示的是,發酵罐中初始酶活3.5×104U/mL條件下透明質酸分子量隨時間的變化趨勢圖。
發酵罐在11小時高溫滅活,水解產物進行分離純化。將發酵罐中的水解樣品離心15000rpm、20min,並通過0.22μm的水繫膜過濾,取10ml樣品,待緩衝液A將柱子衝洗10倍柱體積後,將樣品注入AKTA系統。通過10倍色譜柱體積(CV)的洗脫劑,以2mL/min的流速對色譜柱進行線性洗脫,洗脫劑由緩衝液A、緩衝液B組成,其中NaCl濃度於100min內從0提高到0.2mol/L,AKTA蛋白純化系統配備有96孔板收集裝置,每個孔收集1mL的洗脫液。分離結束後,將96孔板從AKTA收集器中取出,如圖2所示水解產物的離子交換圖,將每個峰對應的96孔板中的洗脫液收集起來。將96孔板中收集的同一峰的洗脫液進行合併,合併後每一個峰的樣品通過透析袋進行脫鹽,之後將收集的樣品在-80℃進行冷凍,在冷凍乾燥機中進行凍幹。
凍幹後的樣品使用咪唑硫酸法測定寡糖的純度,其中HA4、HA6、HA8、HA10、HA12、HA14的產物得率分別為75%、64.5%、55%、43.5%、43%、40.5%。HA4、HA6、HA8、HA10、HA12、HA14的產物得率分別為94%、91%、88%、87.5%、85%、82%、80.5%。對純化的樣品進行質譜檢測,如圖3所示,是純化出HA4的質譜圖;如圖4所示,是純化出HA6的質譜圖;如圖5所示,是純化出HA8的質譜圖;如圖6所示,是純化出HA10的質譜圖;如圖7所示,是純化出HA12的質譜圖;如圖8所示,是純化出HA14的質譜圖。
