一種低分子量泡葉藻聚糖的製備方法及應用與流程
2023-05-17 11:15:19 3
本發明涉及低分子量海藻多糖製備的技術領域,尤其涉及一種低分子量泡葉藻聚糖的製備方法及應用。
背景技術:
泡葉藻(ascophyllumnodosum),又稱巖衣藻,是一種大型的海洋褐藻,主要在北大西洋沿岸生長繁殖。和其他褐藻(比如海帶)相似。泡葉藻含有豐富的褐藻膠(alginateacid)(約佔藻體所含總糖質的79%),是工業生產褐藻膠、碘和甘露醇的主要原料之一。除褐藻膠外,泡葉藻還含有約佔藻體總糖質的13%的泡葉藻聚糖(ascophyllan)和8%的巖藻聚糖(fucoidan)。在我國,泡葉藻在工業上主要被用作提取褐藻膠的原料;農業生產上用來製作化肥、飼料等;在食品行業中主要用來製作海藻粉。
高分子量泡葉藻聚糖分子量大(平均分子量約390kda)且結構複雜,其免疫誘導活性與糖分子結構的關係尚不明確,與此同時,大分子多糖不利於人體消化吸收。目前,國內外用於製備低分子量海藻聚糖的技術主要採用酸、鹼水解法及氧化法。這些方法雖然能夠降低海藻聚糖的分子量,但化學反應強烈,其後果是改變了多糖的立體結構,同時引起活性基團的部分脫落,最終降低了產品的生物活性甚至活性完全喪失。
有鑑於此,本發明人研究和設計了一種低分子量泡葉藻聚糖的製備方法及應用,本案由此產生。
技術實現要素:
本發明的目的在於提供一種低分子量泡葉藻聚糖的製備方法及應用,以獲得高純度且具有強免疫誘導活性的低分子量泡葉藻聚糖,用以提高其在人體消化吸收效率及免疫誘導活性。
為了實現上述目的,本發明解決其技術問題所採取的技術方案是:
一種低分子量泡葉藻聚糖的製備方法,包括以下步驟:
步驟一、泡葉藻粉的製備:
將泡葉藻洗淨、烘乾後、粉碎,過60目標準篩,製得泡葉藻粉;
步驟二、泡葉藻聚糖乾粉的製備:
稱量30g泡葉藻粉,按重量體積比1:30g/ml的比例加入去離子水,100℃下提取,提取過程中不斷攪拌2h,冷卻後5000×g離心20min,取上清液,加入3mhcl使之終濃度為ph1.3,離心去除褐藻酸沉澱後收集上清液,加入無水乙醇使之終濃度為體積50%,過夜離心,取沉澱物,透析凍幹後,製得泡葉藻聚糖乾粉;
步驟三、酶解泡葉藻聚糖:
將0.5g泡葉藻聚糖乾粉溶於0.02m的ph為3-7的醋酸鹽緩衝液,纖維素酶按照3-7u/ml添加到上述溶液中混合均勻,45-65℃下水解1-20h,在100℃滅活15min,終止水解反應,製得不同分子量片段的泡葉藻聚糖水溶液;
步驟四、分離:將製得的不同分子量片段的泡葉藻聚糖水溶液經過分子截留量為10kda的超濾膜分離,再經分子量截留1kda的透析袋透析凍幹,再經凝膠色譜柱分離收集多糖組分,冷凍乾燥後,製得泡葉藻聚糖片段as-c。
優選地,所述纖維素酶添加量5u/ml。
優選地,所述纖維素酶最適ph為6。
優選地,所述纖維素酶最適溫度為55℃。
一種低分子量泡葉藻聚糖的應用,所述泡葉藻聚糖具有免疫誘導活性,可用於功能性食品與藥品原料。
由於本發明採用了上述的技術方案,即通過纖維素酶降解泡葉藻聚糖,得到的小分子片段泡葉藻聚糖片段as-c的免疫誘導活性較原多糖活性,在特定濃度範圍內提高了20%,同時酶降解法反應條件溫和,切割位點固定,對產物結構及其生物活性的破壞作用弱。
附圖說明
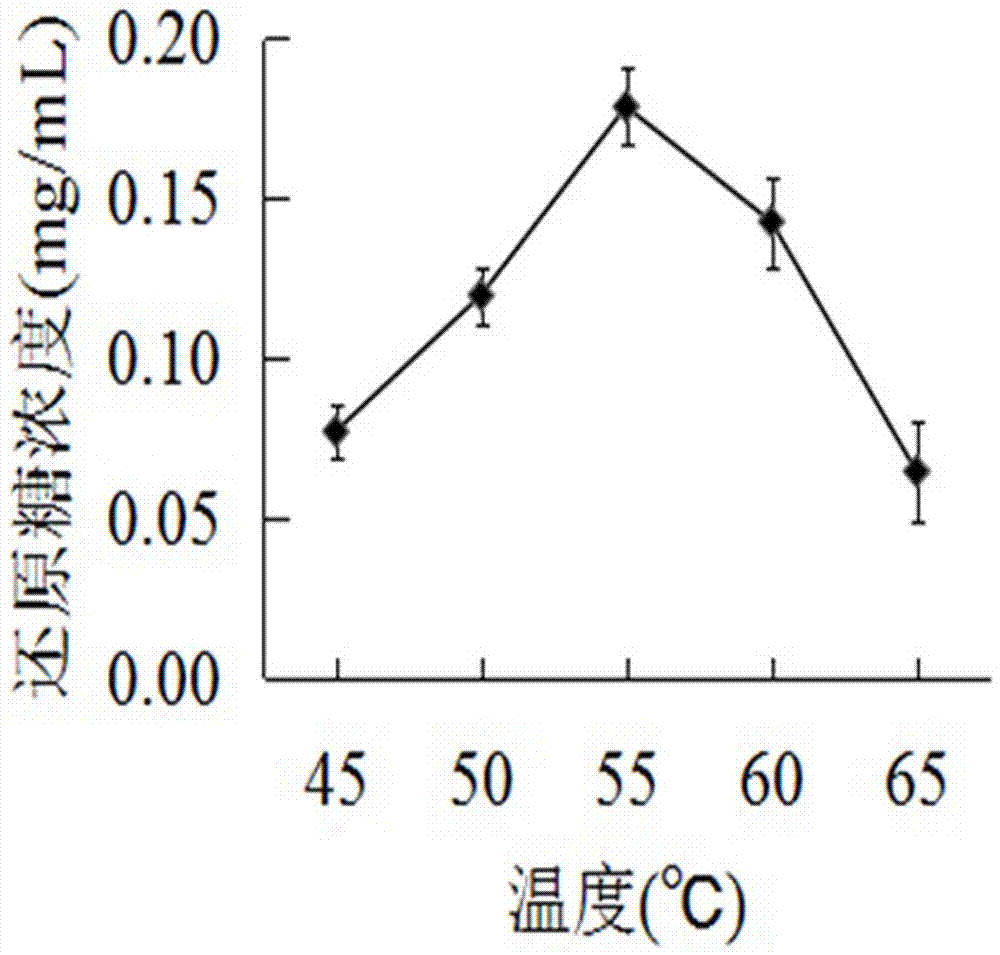
圖1溫度對纖維素酶降解泡葉藻聚糖的影響;
圖2酶濃度對纖維素酶降解泡葉藻聚糖的影響;
圖3ph對纖維素酶降解泡葉藻聚糖的影響;
圖4酶解片段對raw264.7細胞免疫活性誘導no含量測定的結果。
具體實施方式
實施例1
本發明揭示了一種低分子量泡葉藻聚糖的製備方法,包括以下步驟:
步驟一、泡葉藻粉的製備:
將泡葉藻洗淨、烘乾後、粉碎,過60目標準篩,製得泡葉藻粉;
步驟二、泡葉藻聚糖乾粉的製備:
稱量30g泡葉藻粉,按重量體積比1:30g/ml的比例加入去離子水,100℃下提取,提取過程中不斷攪拌2h,冷卻後5000×g離心20min,取上清液,加入3mhcl使之終濃度為ph1.3,離心去除褐藻酸沉澱後收集上清液,加入無水乙醇使之終濃度為體積50%,過夜離心,取沉澱物,透析凍幹後,製得泡葉藻聚糖乾粉;
步驟三、酶解泡葉藻聚糖:
將0.5g泡葉藻聚糖乾粉溶於0.02m的ph為3-7的醋酸鹽緩衝液,纖維素酶按照3-7u/ml添加到上述溶液中混合均勻,45-65℃下水解1-20h,在100℃滅活15min,終止水解反應,製得不同分子量片段的泡葉藻聚糖水溶液;
步驟四、分離:
將製得的不同分子片段的泡葉藻聚糖水溶液經過分子截留量為10kda的超濾膜分離,再經分子量截留1kda的透析袋透析凍幹,再經凝膠色譜柱分離收集多糖組分,冷凍乾燥後,製得泡葉藻聚糖片段as-c。
實施例2單因素酶解實驗
2.1溫度對纖維素酶降解泡葉藻聚糖的影響
在實施例1的步驟三中,考查不同溫度45℃,50℃,55℃,60℃,65℃對纖維素酶降解泡葉藻聚糖的影響,如圖1所示,在55℃時,還原糖濃度最高,即酶解效率最高。
2.2酶濃度對纖維素酶降解泡葉藻聚糖的影響
在實施例1的步驟三中,考查不同酶濃度3u/ml,4u/ml,5u/ml,6u/ml,7u/ml對纖維素酶降解泡葉藻聚糖的影響,如圖2所示,在酶濃度5u/ml時,還原糖濃度最高,即酶解效率最高。
2.3ph對纖維素酶降解泡葉藻聚糖的影響
在實施例1的步驟三中,考查ph為3,ph為4,ph為5,ph為6,ph為7對纖維素酶降解泡葉藻聚糖的影響,如圖2所示,在ph為6時,還原糖濃度最高,即酶解效率最高。
實施例3
將實施例1步驟二製得的0.5g泡葉藻聚糖乾粉分別通過纖維素酶、褐藻膠裂解酶、木聚糖酶降解得到低分子量泡葉藻聚糖片段,分別將含有所述不同分子片段的低聚泡葉藻聚糖水溶液採用小型超濾膜分離裝置進行不同分子量低聚泡葉藻聚糖的分離,蠕動泵以5.3l/min的流量將所述不同分子片段的低聚泡葉藻聚糖水溶液輸送到分子截留量為10kda的中空改性聚氯乙烯膜進行分離,壓力,當溶液體積濃縮至1/6時,停止超濾,收集分子截留量10kda以下的溶液,旋蒸濃縮至1/6時,停止濃縮,並收集濃縮液,得到分子截留量為10kda以下的低聚泡葉藻聚糖組分,將該濃縮液經(100da分子量截留透析膜)透析凍幹後經凝膠色譜柱進行純化得到低分子量泡葉藻聚糖as-c、as-a、as-x,分別用as-c、as-a、as-x對raw264.7細胞進行誘導並測定細胞產生no含量。
將raw264.7細胞按3×104cell/well,100μl加入到96孔板,6-8h貼壁後棄上清,將as-c、as-a、as-x、as(泡葉藻聚糖)分別用細胞培養基配製成0~200μg/ml的濃度樣品溶液,按照100μl/孔加到上述96孔板每個濃度設置4個重複孔。培養24h後取50μl上清,加入griess試劑100μl,避光反應20min後540nm下測其吸光度。以已知濃度的no2-標準溶液繪製標準曲線,計算培養上清中no2-的含量。
實驗結果表明,as-x對raw264.7細胞幾乎沒有no誘導活性,其上清中no2-濃度為9.2μm,as-a、as在200μg/ml濃度下誘導raw264.7細胞產生的no(37.5μm、40.2μm)含量明顯低於as-c(47.6μm)。進而,篩選出as-c作為理想的免疫誘導活性片段
以上所述,僅為本發明較佳實施例而已,故不能依此限定本發明實施的範圍,即依本發明專利範圍及說明書內容所作的等效變化與修飾,皆應仍屬本發明涵蓋的範圍內。
