用於表達EGFR的單細胞分選和多基因位點檢測的微流控晶片的製作方法
2023-05-04 05:00:22 5
本發明涉及微流控晶片技術領域,具體地說,涉及一種方於表達EGFR的單細胞分選和多基因位點檢測的微流控晶片。
背景技術:
近年來,肺癌的發病率和死亡率迅速上升,成為中國第一大癌症,雖然治療技術有了很大提高,但5年的生存率並沒有明顯改善。在肺癌中,非小細胞肺癌(NSCLC)最為代表性,佔80%左右。目前,針對EGFR的靶向治療成為人們研究的熱點,並且起到了很好的療效。EGFR(Epidermal Growth Factor Receptor)是上皮生長因子(EGF)細胞增殖和信號傳導的受體。EGFR屬於ErbB受體家族的一種,該家族包括EGFR(ErbB-1),HER2/c-neu(ErbB-2),Her 3(ErbB-3)和Her 4(ErbB-4)。目前已證實,EGFR與腫瘤細胞的增殖、血管生成、腫瘤侵襲、轉移及細胞凋亡的抑制有關。
由於EGFR絡氨酸激酶是信號傳導的必要條件,因此也成為腫瘤治療的重要靶分子。通過選擇性的酶抑制劑或者單克隆抗體競爭性結合細胞外配體結合位點來阻斷絡氨酸激酶活化,從而抑制EGFR的激活。而目前的研究主要是針對EGFR的第18、19、20和21外顯子進行。自從2004年發現上皮生長因子受體(EGFR)基因活化突變(以Del19或L858R為主)與EGFR酪氨酸激酶抑制劑(TKI)治療非小細胞肺癌的療效相關以來,已有多項前瞻性臨床研究證實,EGFR活化突變陽性的NSCLC患者對EGFR-TKI的反應率顯著高於EGFR野生型NSCLC患者,無進展生存(PFS)期和總生存(OS)期也顯著延長。因此,在臨床中也開始基於病人EGFR突變檢測進行精準治療。
但是由於檢測方法的靈敏度不夠以及分選技術的限制,長期以來EGFR基因突變分析只能進行細胞群體分析。有研究表明,不同細胞之間的基因也存在差異尤其是在癌細胞中。而通過細胞群體分析獲得的統計平均結果,掩蓋了單個細胞之間的差異並且會受到大量非目的細胞的影響,使生物學及醫學等很多領域的發展受到限制。
傳統的EGFR檢測多集中在蛋白水平,如以免疫組化(IHC)和酶聯反應吸附(ELISA)為代表的檢測方法。但是上述兩種方法只能大致反應EGFR蛋白的表達情況,並不能直接檢測基因的突變信息,無法直接指導靶向用藥。因此,一大批直接檢測基因突變的技術也用於EGFR突變檢測中,包括基因擴增後直接測序法(DS)、突變富集PCR法、擴增阻礙突變系統(ARMS)法、蠍形探針擴增阻滯突變系統(SARM)法、集落雜交法(CH)等。但這些技術也只是反應樣本群體信息,無法在單個細胞水平上進行檢測。由於細胞極小,直徑一般為5-500μm,體積為fL至nL級,組分含量少(fmol至zmol)、種類繁多,使得獲取操縱、擴增和分析單細胞的難度很大。在單細胞樣品的處理過程中也很容易造成樣品的遺失和損失,對後續分析造成影響,成功率較低。由於單細胞DNA的數量極其微小,對其分析之前必須進行DNA的擴增。而基於熱循環以PCR(聚合酶鏈式反應)為基礎的全基因組擴增技術,PCR過程中,在起始樣本非常稀少時,會向序列中引入很多錯誤和非特異性擴增產物,使擴增質量大大降低,並且一次只能通過特定引物對單個基因位點進行檢查,無法對同一樣品進行多位點基因擴增。
目前已公開的技術中,均沒有涉及高度集成針對EGFR腫瘤細胞篩選、鑑定、裂解,擴增和多基因位點分析的,從而實現對腫瘤細胞進行單細胞水平上的多位點EGFR基因突變檢測。
技術實現要素:
本發明的目的是提供一種用於表達EGFR的單細胞分選和多基因位點檢測的微流控晶片。
本發明的另一目的是提供一種用於EGFR基因多個突變位點單細胞水平檢測的系統。
為了實現本發明目的,本發明提供的一種用於表達EGFR的單細胞分選和多基因位點檢測的微流控晶片,所述微流控晶片包括依次疊放在一起並相互密封的四層結構,由上至下分別為頂蓋、微流體通道層、帶有微柱和微孔陣列的基板以及帶有腔體組的底板;
所述頂蓋上設有一個樣品入口、一個樣品出口以及一個廢液口;所述樣品入口與微流體通道層的U形主流道上的樣品進入口連通,所述樣品出口與微流體通道層的U形主流道上的樣品流出口連通,所述廢液出口與微流體通道層的分支流道上的廢液口連通;
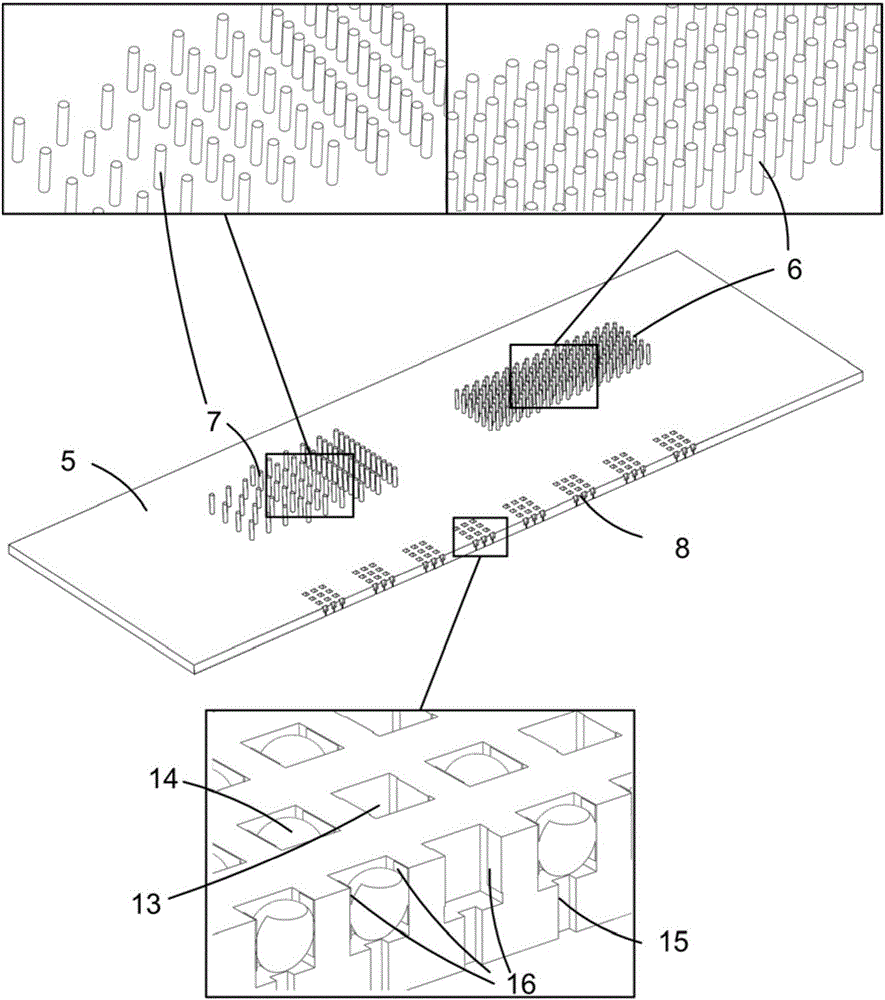
所述微流體通道層上設有一條U形主流道,U形主流道的一端設有樣品進入口,另一端設有樣品流出口;帶有樣品進入口一側的主流道的前段較寬,設有過濾區,用於過濾樣品,除去較大雜質;主流道的中段是分選區,用於分離腫瘤細胞;帶有樣品流出口一側的主流道的後段較窄,設有捕獲區,用於限定液體流動進行單細胞捕獲;主流道上還設有一條與分選區垂直設置的分支流道,分支流道的另一端設有廢液口,其與頂蓋上的廢液出口連通,用於廢液的流出(如圖1所示,水平寬度不同的單條流道,左邊的上下兩端分別作為入口和出口,右邊為廢液口);所述主流道的過濾區,分選區以及捕獲區分別位於基板上的過濾區、分選區和捕獲區上方;樣品在基板上流動,流道用於限制流體樣品的運動方向;
所述帶有微柱和微孔陣列的基板上設有過濾區、分選區和捕獲區;過濾區由間距漸變的排狀分布的微柱陣列組成;分選區由大小和間距統一的微柱陣列組成;捕獲區帶有微孔陣列,所有微柱和微孔的位置與相應的微流體通道層上各分區相匹配,即過濾區的微柱陣列設置在微流體通道層的主流道過濾區下方,分選區的微柱陣列設置在微流體通道層的主流道分選區下方,捕獲區的微孔陣列設置在微流體通道層的主流道捕獲區下方(圖1),微孔的內部設有電極,陰極和陽極成對設置在微孔側壁上;每個微孔具有與下層底板相連通的通道(即連通孔);每個分區由流道相連接,在流體的作用下依次進入過濾區、分選區和捕獲區;
所述帶有腔體組的底板上設有多個腔體,每個腔體由收集腔和擴增腔組成,收集腔通過連通孔與基板捕獲區對應的微孔相連,用於分開收集不同微孔中的細胞裂解液;收集腔和擴增腔之間用可以控制開關的微閥連接;擴增腔內預置有多重置換擴增(MDA)試劑和/或PCR擴增試劑,用於擴增細胞裂解液中的DNA以及檢測EGFR基因上的多個突變位點。
所述微流體通道層上設有的通道深度為10~200微米,主流道過濾區寬度為1~10毫米;主流道分選區寬度為1~10毫米,主流道捕獲區寬度為10~5000微米。流道(即微流體通道)過濾區、分選區和捕獲區的長度與對應基板上各分區的長度相匹配。優選地,過濾區、分選區長度為1000~22000微米,捕獲區長度為1000~42000微米。
所述帶有微柱和微孔陣列的基板,其每個微孔中的電極可以分別控制其是否通電。
所述帶有微柱和微孔陣列的基板,過濾區的微柱陣列由直徑為5~200微米,高為10~200微米的圓柱排狀分布組成,其微柱陣列的間距漸變,為50~500微米;分選區的微柱陣列由直徑為5~50微米,高為10~200微米的圓柱排狀分布組成,微柱間距為10~200微米;捕獲區的微孔深度為5~100微米,是邊長為5~100微米的正方形或長方形,或直徑為5~100微米的圓形。所述微孔陣列,其每個微孔與下層腔體相連通的通道(連通孔)直徑為1~10微米。
優選地,基板的過濾區、分選區長度為1000~20000微米,捕獲區的長度為1000~40000微米。
所述帶有腔體組的底板,其腔體組數量可變,可以多個微孔對應一個腔體,也可以每個腔體對應一個微孔,從而分別收集不同微孔中的細胞裂解液。
所述頂蓋是透明的。所述頂蓋、微流體通道層、帶有微孔陣列的基板以及帶有腔體組的底板由絕緣材料製成,或者由絕緣材料包裹著非絕緣材料製成。
所述樣品是來自於活體組織、血液或體外培養的細胞懸液。
所述帶有腔體組的底板,其擴增腔內所含PCR擴增試劑中包含EGFR基因第18、19、20和/或21外顯子特異性PCR擴增引物。
本發明的微流控晶片可以分別捕獲單個細胞,並實現對細胞的原位螢光鑑定、裂解和擴增。
圖1為本發明微流控晶片的結構示意圖。
本發明還提供一種用於EGFR基因多個突變位點單細胞水平檢測的系統,該系統集成了EGFR腫瘤細胞篩選、鑑定、裂解、擴增和多基因位點分析等功能。所述系統包括上述微流控晶片,螢光探針,螢光顯微鏡,圖像處理設備,注射泵,微閥控制器,恆溫水浴箱,電壓發生器和PCR擴增儀等。
所述螢光探針是指標記了螢光分子的抗體或多肽,可以單獨使用一種螢光探針來實現對單一蛋白(如EGFR)的鑑定,也可以同時使用多種螢光探針來實現對多種目的蛋白的鑑定。
本發明進一步提供一種用於表達EGFR的單細胞分選和多基因位點檢測的方法,向上述微流控晶片中流加細胞懸液,細胞經過基板上過濾區,大的雜質和細胞團被過濾掉,細胞以單細胞形式進入分選區,腫瘤細胞被分選出進入捕獲區,當所有細胞都落入微孔中後,向微流控晶片中通入帶有螢光的分子探針,使用螢光顯微鏡從晶片正面觀察微孔陣列,對於發出螢光的微孔施加電壓,在細胞兩側產生電場,該電場使得細胞膜發生破裂,細胞內容物流出,通過微孔底部的通道,流入下層底板的收集腔體內,將收集腔和擴增腔之間的連接閥打開,使細胞內容物與多重置換擴增(MDA)試劑混合,進行細胞基因組DNA擴增,最後分別加入針對EGFR基因不同位點設計的特異性引物進行PCR擴增,並對擴增產物進行測序,獲得突變信息。
如圖1和2所示,向微流控晶片中通入細胞懸液,樣品流經過濾區時,由於微柱的間距限制,大於微柱間距的雜質將被限制在微柱結構上,只有小於微柱間距的單個細胞可以通過過濾區,用於去除樣品中較大雜質;在流經晶片分選區時,由於流體力學作用,不同大小的細胞在流經微柱時的流動方向不同,因此,利用不同的出口位置可以收集較大的細胞(腫瘤細胞)進入後續捕獲區,而較小的細胞(非腫瘤細胞)從廢液口流出。進入捕獲區的腫瘤細胞在重力和流體的作用下會落入微孔中。當所有細胞都落入微孔陣列中以後,再向微流控晶片中通入帶有螢光標記的EGFR抗體(或多肽),EGFR抗體(或多肽)會與腫瘤細胞表面的EGFR蛋白結合,使用螢光顯微鏡從晶片正面觀察微孔陣列,確定哪些微孔中的細胞帶有EGFR蛋白,從而對細胞進行鑑定。根據鑑定結果,對特定微孔的電極施加電壓,在細胞兩側產生電場,該電場使細胞膜破裂,細胞內液流出,通過微孔底部的通道,流入下層底板的腔體內。然後打開連接底蓋上連接收集腔和擴增腔的微閥,將MDA試劑與細胞內DNA混合。將晶片放入恆溫水浴箱中,進行MDA擴增。最後從擴增腔室取出擴增好的基因產物。利用特殊設計的四種PCR引物,對MDA擴增後的基因產物分別進行PCR基因擴增,並直接對PCR擴增產物測序,檢測EGFR的不同突變信息。
本發明通過引入微加工技術和微流控晶片技術,開發出一種多層微結構晶片,實現了針對表達EGFR腫瘤細胞樣品進行單細胞篩選、捕獲、鑑定和全基因片上擴增,並對其EGFR基因位點進行檢測。為單細胞水平上的EGFR多位點突變檢測提供了一種新方法,能夠更高效,更準確,更高通量的對單細胞水平的多個EGFR位點突變進行檢測。
本發明具有以下優點:
(一)實現了單細胞水平上的分選、原位鑑定、裂解和擴增,特別是在非小細胞肺癌EGFR突變檢測的醫學診斷領域中,對單細胞的精確分析帶來了幾個顯著的優勢:首先,單細胞內的DNA量很少,非常容易遺失和損失,本發明提出的原位裂解、擴增技術,可以最大程度的減少在樣品液轉移過程中的損失,大大提高的檢測的可靠性;其次,和傳統技術相比,大大提高了分析的精確度,從而可以在大量細胞中篩選出極少的細胞,並對其EGFR突變信息進行分析;最後,所有的篩選、捕獲和裂解方法基於物理原理進行,而鑑定步驟利用特異性螢光探針來識別細胞表面的蛋白,均不會影響細胞內的DNA,從而減少對後續基因分析的影響。
(二)實現了多個實驗步驟的高度集成化,本發明利用微流控技術將繁瑣的細胞篩選、捕獲、鑑定、裂解和擴增步驟集成到一個微流控晶片上,與原有技術相比,大大減少了操作步驟,從而也提高了實驗成功率和可靠性。同時,依賴於高度集成化的晶片和簡化的操作步驟,本發明涉及的光學鑑定和基於注射泵對反應的控制都可以通過攝像、圖像分析、單片機處理及編程等自動化手段完成,在提高處理速度的同時大大提高了準確率,縮短了實驗時間,提高了樣品處理效率。
(三)本發明提供的微流控晶片、相應的檢測系統和檢測方法,可以同時檢測EGFR基因的不同位點,涵蓋了絕大多數對臨床有意義的突變位點,適用範圍廣,可以完全滿足目前臨床檢測需求。並且根據需要,可以通過更改檢測引物來對其他腫瘤基因進行檢測,而這些改變對本領域技術人員來說,是很容易實現的且幾乎不增加成本,大大拓展了該晶片及檢測系統的應用領域。
附圖說明
圖1為本發明微流控晶片的結構示意圖。
圖2為本發明實施例1中圖1微流控晶片的基板沿AA』的剖面圖,展示了晶片中過濾區、分選區和捕獲區的具體結構。
圖3為本發明實施例1中細胞捕獲、鑑定及裂解的過程示意圖。
圖中,1-分別為樣品入口(E1)和樣品出口(E2);2-頂蓋;3-廢液出口;4-U形微流體通道(主流道);5-帶有微柱和微孔陣列的基板;6-分選微柱;7-過濾微柱;8-捕獲微孔陣列;9-細胞內容物收集腔;10-帶有腔體組的底板;11-MDA試劑預置腔(擴增腔);12-控制微閥;13-單細胞捕獲微孔;14-細胞;15-連通孔;16-微孔內的電極;17-分支流道;18-過濾區;19-分選區;20-捕獲區;21-廢液口。
具體實施方式
以下實施例用於說明本發明,但不用來限制本發明的範圍。若未特別指明,實施例中所用的技術手段為本領域技術人員所熟知的常規手段,所用原料均為市售商品。
實施例1用於表達EGFR的單細胞分選和多基因位點檢測的微流控晶片及其製備方法
本實施例提供的微流控晶片包括依次疊放在一起並相互密封的四層結構,由上至下分別為頂蓋、微流體通道層、帶有微孔陣列的基板以及帶有腔體組的底板。
1、頂蓋和流體通道
在對細胞進行鑑定時,需要光線透過頂蓋,因此頂蓋需要採用透明材質;同時,頂蓋需要製作流體進入和流出的接口,所以需要能夠開孔;最後,頂蓋需要和流體通道封接在一起,並且實現密封,所以材質的選擇上要考慮和流體通道的兼容性。
基板材料可以是通過蒸鍍、切割及熱塑成型製成特定規格及形狀的材料。特別優選的是較薄並透明的絕緣聚合物。
流體通道起到約束細胞流動的作用,其特徵尺寸在毫米級別,所以需要採用便於加工,成本低廉,生物相容性好的材料。
頂蓋和流體通道的外廓尺寸要與微孔陣列基板相匹配。流體通道的寬度同樣也要與基板上結構的特徵尺寸(邊長或直徑)相匹配。
在圖1所示的優選實施方式中,頂蓋採用玻璃材料,而流體通道採用PDMS(聚二甲基矽氧烷)材料,二者採用鍵合的方式密封連接。在其它實施方式中,頂蓋和流體通道也可以採用同樣的材料(例如PDMS)一次成型,不需要分別製造再封接在一起。
在圖1所示的優選實施方式中,微流體過濾區通道的長為10毫米,寬度為10毫米;分選區流道長為15毫米,寬度為5毫米;捕獲區流道長為25毫米,寬為4毫米,所有流道高度均為40微米,這是應用於腫瘤細胞的最優條件。當需要處理其它細胞時,可由本領域技術人員自行選擇合適的微流體通道尺寸。
2、帶有微結構陣列的基板
在本實施例中,微孔陣列是用來容納細胞並對其進行處理的關鍵部件。為了適應細胞的尺寸,必須選擇能夠兼容現有微加工技術的材料。在圖2所示的優選實施方式中,選擇矽作為微柱和微孔陣列的材料,是因為矽可以很好的兼容基於光刻刻蝕和腐蝕的微加工工藝,從而很容易獲得與細胞尺寸相符的微孔陣列。本領域技術人員也可以根據需求選擇玻璃、PDMS等可加工的材料。值得注意的是,最終加工完成的微孔陣列表面需要是絕緣的,圖2所示的優選實施方式中採用對矽材料表面進行氧化以形成絕緣的二氧化矽層來滿足這一要求。
在圖2所示的優選實施方式中,過濾區域的微柱陣列直徑為50微米,高為40微米。不同排之間的間距為200微米,在同一排內的微柱間距按梯度變化排列(500微米、200微米、100微米和50微米)。
在圖2所示的優選實施方式中,分選區的微柱陣列如圖所示交錯排列,每個微柱的直徑為15微米,間距為30微米。
在圖2所示的優選實施方式中,每個微孔都是邊長為25微米的立方體,每兩個微孔之間的間距為25微米。每個陣列組為1毫米長,微孔陣列的整體由多個組構成,每個陣列組間距1毫米,整個捕獲陣列長20毫米,寬為4毫米,共有20000個微孔。上述是應用於腫瘤細胞的最優條件。當需要處理其它細胞時,可由本領域技術人員自行選擇合適的微孔尺寸及數量。
在每個微孔的側壁上,都設有相對布置的電極,分別作為陰極和陽極,用於細胞的裂解。電極可以由適當的導電材料或這些材料的複合物製成。優選材料為生物兼容性好的材料,例如金、鈦和摻有銀離子的PDMS(聚二甲基矽氧烷,一種常用的聚合物)。當採用多種材料時,例如一種導電材料(如金)鍍在另一種導電材料(如銅)上,最外層的材料優選為生物兼容性好的材料。
在如圖3所示的微流控晶片中,電極材料為鉻和金。首先在基板上濺射一層厚度為0.1微米的鉻,再濺射一層厚度為0.5微米的金。然後對整個基板進行光刻(濺射和光刻均為半導體加工工藝中常用的方法)得到需要的電極形狀。接著腐蝕掉金層和鉻層上不需要的部分,最終得到所需的電極。當然,電鍍等本領域公知的加工金屬的方法也可以用來製造電極。如圖3所示的實施方式中,採用鉻和金來製作電極,是因為金的生物兼容性很好,而鉻是為了增加金和基板材料之間的黏附性。根據不同的需求,其它的導電材料,例如鋁、銅或者導電聚合物都可以用來製造電極。如圖3所示的微流控晶片中,電極寬20微米,深25微米(和微孔陣列深度相同),厚度為0.6微米。
在每個微孔的底部,都有一條通往下層收集腔的通道,該通道起到阻擋細胞通過並讓細胞內容物通過的作用,所以其特徵尺寸要小於細胞的特徵尺寸,在圖3所示的優選實施方式中,該通道的截面為正方形,邊長為5微米。這是應用於EGFR非小細胞肺癌腫瘤細胞的最優條件,既可以保證細胞不通過,也可以保證細胞裂解液順暢通過。當需要處理其它細胞時,可由本領域技術人員自行選擇合適的通道尺寸。
3、底板
本實施例中,底板上有容納細胞裂解液的微腔。圖1及圖2所示的優選實施方式中,底板上有多個腔體組,每個腔體組由收集腔和擴增腔構成;底板的收集腔體與上面微孔陣列相對應;擴增腔與收集腔並排布置,收集腔和擴增腔用可控制開關的微閥連接。
圖1和圖3所示的優選實施方式中,底板的材料是玻璃。而矽、PDMS或不鏽鋼亦可以很方便的用作底板材料。對於底板上有多個腔體的情況來說,矽和PDMS更易加工。
4、封接方法
在圖1所示的優選實施方式中,頂蓋、微流體通道、陣列基板、底板的材料分別為玻璃、PDMS、矽、PDMS。採用氧等離子輔助鍵合的方法可以很好的實現玻璃和PDMS、矽和PDMS之間的良好密封封接;採用陽極鍵合的方法可以實現矽和玻璃之間的密封封接。
在其它實施方法中,可以根據頂蓋、微流體通道、微流體通道、底板的材料來選擇合適的封接方法。
5、晶片配套系統
本實施例中還提供用於EGFR基因多個突變位點單細胞水平檢測的系統。除了微流控晶片之外,還需要螢光探針(Probe)、螢光顯微鏡、圖像處理設備、MDA擴增試劑、注射泵、電壓發生器以及後續的PCR系統和特定PCR擴增引物來構成完整的系統。
螢光探針用於鑑定細胞,在圖2所示的優選實施方式中,採用標記了綠色螢光(FITC)的EGFR抗體作為螢光探針,用來識別腫瘤細胞表面的EGFR蛋白。在其它實施方式中,也可以針對不同的蛋白選擇不同的抗體或者多肽作為探針。
螢光顯微鏡用於檢測微孔陣列中的細胞是否有螢光,圖像處理設備用於分析螢光顯微鏡獲取的圖像並對電壓發生器發出指令,控制特定微孔中的電極完成細胞裂解。
注射泵用於驅動微流體;電壓發生器用於產生電壓裂解細胞。
MDA擴增用於細胞DNA的全基因組擴增,預置在檢測晶片的擴增腔室中。細胞裂解液收集到收集腔之後,打開中間的控制閥,將兩者混合,將細胞裂解液中的DNA進行全基因組擴增。
PCR系統和特定檢測引物,用於擴增經MDA初擴增然後的EGFR不同位點,進行測序,檢測突變信息。在其它實施方式中,也可以針對不同的基因位點設計不同的引物進行其他位點的突變檢測。
6、晶片的具體製作方法
採用以下兩套不同的製作工藝成功製造出所述微流控晶片及檢測系統。對於具體的製作方法是為了幫助本領域技術人員理解本發明的技術方案,而並不是對本發明所述器件的材料,尺寸和製造方法做出限定。
製作方法A:
頂蓋:採用4英寸Pyrex7740玻璃片(康寧公司),按照長4釐米,寬2釐米的外形尺寸切成長方形小片,用雷射在每塊小片的特定位置打三個孔。
微流體通道:採用N型4英寸矽片,在光刻出流道的平面形狀後,使用半導體常用的ICP幹法刻蝕(感應等離子刻蝕,即使用六氟化硫和四氟化碳的高能等離子來刻蝕矽)出40微米深的槽。將液態PDMS倒入槽中,待其凝固後脫模取出,切除PDMS多於部分,按照長4釐米,寬2釐米的外形尺寸切成長方形小片,即得微流體通道。
帶有矽微柱和微孔陣列的基板:採用N型4英寸矽片,在矽片正面光刻出微柱的平面位置,採用氫氧化鉀溼法腐蝕的方法將非微柱區域都向下腐蝕40微米,形成過濾區和分選區結構。然後對其採用溼法氧化,在矽片表面獲得一層0.5微米厚的氧化層,然後再利用幹法刻蝕的技術,在捕獲區向下刻蝕25微米的微孔。在矽片正面濺射0.1微米厚的鉻金屬層,再於鉻金屬層上濺射0.5微米厚的金層,濺射時將矽片傾斜45度並旋轉,以保證金屬對微孔側壁的覆蓋。對矽片正面進行真空輔助塗膠和光刻,形成所需電極的形狀,然後再使用碘化鉀溶液腐蝕金層,使用硝酸鈰銨腐蝕鉻層,這樣就得到了微孔中的電極。對矽片背面進行光刻,形成矽微孔底部的通道位置,採用ICP幹法刻蝕穿通該矽片,最終獲得完整的矽微孔陣列。
底板:採用4英寸Pyrex7740玻璃片,光刻出腔體的位置,使用氫氟酸腐蝕玻璃,形成腔體組,加入控制閥將收集腔室和擴增腔室連接。
封接:首先將矽基板和玻璃底板陽極鍵合在一起,再按長4釐米,寬2釐米的外形尺寸切成長方形小片,使用氧等離子體處理透明玻璃頂蓋的底面,微流體通道的兩面,矽基板的頂面,將它們依次鍵合在一起,最終獲得完整的晶片。
晶片系統:在微流體晶片的基礎上,使用普通塑料管連接泵和頂蓋上的流體出入口,在基板上外露的金電極上通過超聲波焊接進行電纜的引出,將電纜連接到圖像處理設備和電壓發生器上,再將電壓發生器和圖像處理設備連接在一起,並將晶片放置在螢光顯微鏡下,在需要MDA擴增時,將晶片密封,放入恆溫水浴鍋內,即可完成整套系統的構建。
製作方法B:
頂蓋和微流體通道:採用N型4英寸矽片,在光刻出流道的平面形狀後,使用ICP幹法刻蝕出40微米深的槽。將液態PDMS倒入槽中,待其凝固後脫模取出,按照長4釐米,寬2釐米的外形尺寸切成長方形小片,使用鑽頭在所需位置打孔,得到一體式的頂蓋和微流體通道。
帶有矽微孔陣列的基板:採用N型4英寸矽片,在矽片正面光刻出微柱的平面位置,採用ICP幹法刻蝕的方法將非微柱區全部向下刻蝕40微米,形成微柱結構。然後採用CVD(化學氣相沉積)的方法,在矽片表面獲得一層2微米厚的氧化層,再利用光刻和幹法刻蝕技術,在微孔區向下刻蝕25微米深。在矽片正面濺射0.1微米厚的鉻金屬層,再於鉻金屬層上電鍍3微米厚的金層,以保證對微孔側壁的覆蓋。對矽片正面進行真空輔助塗膠和光刻,形成所需電極的形狀,然後再使用碘化鉀溶液腐蝕金層,使用硝酸鈰銨腐蝕鉻層,得到微孔中的電極。對矽片背面進行光刻,形成矽微孔底部的通道位置,採用雷射刻蝕穿通該矽片,最終獲得完整的矽微孔陣列。將4英寸矽片按照長4釐米,寬2釐米的外形尺寸切成長方形小片。
底板:基於玻璃模板的加工技術製作出位置與晶片微孔區對應的,帶有多個腔室的模具。將PDMS澆築成型後脫模切割成長4釐米,寬2釐米的長方形,加入控制閥將收集腔室和擴增腔室連接。
封接:用紫外固化粘合劑將微流體通道、矽陣列基板和底板依次密封粘合在一起,即獲得完整的微流控晶片。
晶片系統:在微流體晶片的基礎上,使用聚四氟乙烯管連接泵和頂蓋上的流體出入口,在基板上外露的金電極上通過超聲波焊接進行電纜的引出,將電纜連接到電壓發生器上,再將電壓發生器和圖像處理設備連接在一起,並將晶片放置在螢光顯微鏡下,在需要MDA擴增時,將晶片密封,放入恆溫水浴鍋內,即可完成整套系統的構建。
7、具體應用方法
採用以下方法已將本發明所述微流控晶片及相應檢測系統成功應用於單細胞EGFR基因多位點檢測。提供的具體方法是為了幫助本領域技術人員理解本發明的功能及應用方法,而並不是對本發明所述裝置的適用範圍做出限定。
將NCI-1975、NCI-1650、A549三種細胞摻入未經處理的血液中製成混合樣本。稀釋10倍,通入微流控晶片中。在過濾區,大的細胞雜質和細胞團簇將被濾掉,不能進入下一部分。在分選區,血液中的白細胞等較小的非腫瘤細胞在流體與微柱的作用下將向下方移動,從廢液口流出,而直徑較大的腫瘤細胞將從上部流入捕獲區,經過靜置,待細胞捕獲完成後,向晶片內通入帶有綠色螢光的EGFR抗體對捕獲的細胞進行染色,使用螢光顯微鏡拍攝圖像並進行處理,不發螢光的細胞不加處理;發綠色螢光的說明是表達EGFR蛋白的目的腫瘤細胞。確認位置後,對相應細胞通電加以裂解,裂解液通過微孔下的連通孔進入下面的腔室中,打開底板的控制閥,裂解液與預置的MDA擴增試劑混合。將晶片放入30℃的恆溫水浴箱擴增3小時。然後取出擴增產物,分成4份,分別加入設計的EGFR基因第18、19、20和/21外顯子擴增的特異性引物進行PCR擴增。然後將擴增產物直接進行測序,得到突變信息。
雖然,上文中已經用一般性說明及具體實施方案對本發明作了詳盡的描述,但在本發明基礎上,可以對之作一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬於本發明要求保護的範圍。
