一種基於全細胞的藥物靶點停留時間的檢測方法與流程
2023-04-24 08:30:11
本發明屬於醫藥技術領域,涉及一種檢測未知化合物與藥物靶點的結合分子動力學特徵的檢測方法,具體涉及一種基於全細胞的藥物靶點停留時間的檢測方法。
背景技術:
藥物受體結合的保留時間是一項近年來新興的分子結合動力學概念。此概念定義為藥物與受體結合後,兩者形成複合體的存在時間。測定藥物與靶點結合的分子動力學特徵,在早期的藥物設計與篩選過程中具有重要的意義。研究表明,優化藥物在靶點上的停留時間可以改善藥物的臨床藥效或者藥物的毒性:針對藥物作用的靶點,長停留時間的藥物可以表現出更高,更持久的藥效,而對於其他非藥物作用靶點,具有短停留時間的藥物可以有效的避免脫靶效應,減少藥物產生的毒性。因此,建立新的檢測方法,測定未知化合物的分子動力學特徵,能夠為早期的藥物設計與篩選提供重要的工具。
目前,國內外對於藥物受體結合的分子動力學研究,已經取得了一定的進展,包括一系列檢測方法的建立。現階段分子動力學研究主要是依靠製備重組細胞膜,然後通過測定同位素標記的待測物在受體上的結合速率和離解速率。即將具有高度表達藥物靶點的細胞收集並分散打碎後,在製備的細胞膜系統上測定藥物受體分子動力學特徵。然而,這種方式存在著一定的局限性。首先,與使用完整的組織細胞相比,在打碎細胞後,藥物受體所處的微環境會產生變化,比如,細胞膜電壓、細胞骨架結構等。尤其對於G蛋白偶聯受體,製備細胞膜的過程會造成細胞內三磷酸鳥苷的流失,影響G蛋白的激活。此外,在細胞膜實驗中,大量的細胞器膜也會暴露在實驗系統中,與放射性配體進行結合,導致非特異性的放射性配體結合增加。因此,不能夠準確地反映藥物與受體在生理條件下的相互作用。其次,現階段的分子動力學測定方法,往往需要對待測化合物進行同位素或者螢光素標記,才能測定其分子動力學特徵。當需要進行大批量的測定待測化合物的分子動力學特徵時,對所有化合物都進行同位素標記往往是不現實的。因此,在早期的藥物研究與篩選過程中,迫切的需要在檢測方法上進行更新,以實現在全細胞上測量未被同位素標記的化合物的分子動力學特徵。
技術實現要素:
本發明的目的是為了克服上述現有技術的局限性,提供一種基於全細胞的藥物靶點停留時間的檢測方法,從而,一方面避免了製備細胞膜的繁瑣過程,以獲得更加接近於生理條件下的藥物受體結合的分子動力學特徵,尤其是藥物受體停留時間,另一方面,避免了對待測化合物進行同位素標記,能夠實現大規模測定藥物與受體結合的分子動力學特徵,從而為新藥的設計和發現提供更精準的依據。
本發明解決其技術問題所採用的技術方案:
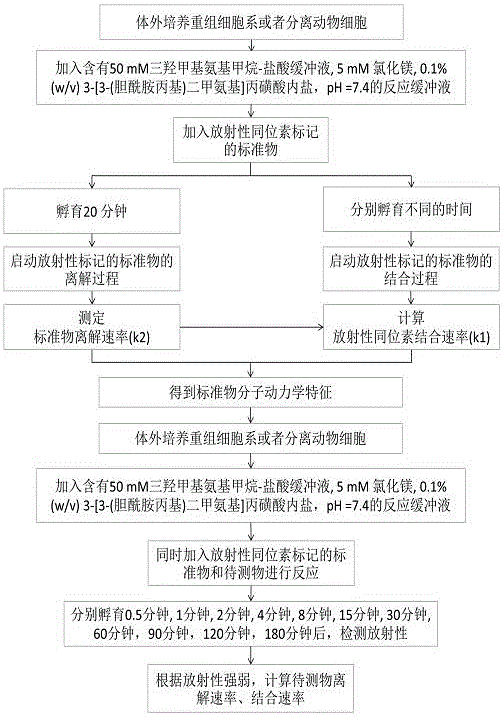
一種基於全細胞的藥物靶點停留時間的檢測方法,其方法為:
1.體外培養並收集重組細胞或者組織分離的動物細胞,分成三份,分別標記為a組、b組、c組;
2.將a組細胞分成12個小組,每小組重複2次,置於24個反應容器中,每個反應器中含3000個細胞;將上述細胞分散在含有50mM三羥甲基氨基甲烷-鹽酸緩衝液、5mM 氯化鎂、0.1% (w/v) 3-[3-(膽醯胺丙基)二甲氨基]丙磺酸內鹽、pH=7.4的反應緩衝液中,使a組細胞與放射性同位素標記的標準物在室溫孵育20分鐘;孵育20分鐘後,向a組的1-11小組的反應容器中加入高濃度的未被同位素標記的競爭取代物,與1-11小組的細胞混合液分別對應孵育不同的時間,即第1小組孵育0.5分鐘, 第2小組1分鐘, 第3小組2分鐘, 第4小組4分鐘, 第5小組8分鐘, 第6小組10分鐘, 第7小組12分鐘, 第8小組15分鐘, 第9小組20分鐘, 第10小組30分鐘, 第11小組60分鐘,以啟動同位素標記的標準物的離解過程;a組的第12小組的細胞在孵育20分鐘結束後,直接加入高濃度的未被同位素標記的競爭取代物,孵育60分鐘後測量標準物的非特異性同位素結合強弱;待a組細胞孵育測量結束後,使用快速真空抽濾方法,將1-12不同小組中的細胞收集在濾膜上,並使用含有三羥甲基氨基甲烷-鹽酸緩衝液、氯化鎂的洗脫液,分離游離態與結合態的放射性同位素標記的標準物,所得濾膜加入閃爍液後,用閃爍光譜法測定標準物的放射性,之後利用單相離解速率模型計算同位素標記的標準物的離解速率常數;
3.將b組細胞分成12個小組,每組重複2次,置於24個反應容器中,每個反應器中含3000個細胞,分散在含有50mM三羥甲基氨基甲烷-鹽酸緩衝液、5mM 氯化鎂、0.1% (w/v) 3-[3-(膽醯胺丙基)二甲氨基]丙磺酸內鹽、pH=7.4的反應緩衝液中,之後將放射性同位素標記的標準物加入到b組的1-11小組的反應容器中進行孵育,第1小組孵育0.5分鐘, 第2小組1分鐘, 第3小組2分鐘, 第4小組4分鐘, 第5小組8分鐘, 第6小組10分鐘, 第7小組12分鐘, 第8小組15分鐘, 第9小組20分鐘, 第10小組30分鐘, 第11小組60分鐘;孵育結束後測量放射性同位素標記的標準物在不同的孵育時間段與細胞的結合強度;在b組的第12小組反應容器中加入放射性同位素標記的標準物的同時,加入高濃度的未被同位素標記的競爭取代物,並在孵育60分鐘後測量第12小組反應容器中標準物非特異性的放射性結合強度;待b組細胞全部孵育測量結束後,使用快速真空抽濾方法,將1-12不同小組中的細胞收集在濾膜上,並使用含有三羥甲基氨基甲烷-鹽酸緩衝液、氯化鎂的洗脫液,分離游離態與結合態的放射性同位素標記的標準物,所得濾膜加入閃爍液後,用閃爍光譜法測定放射性,獲得數據後,使用單相結合速率模型計算同位素標記的標準物的結合速率常數;
4. 將c組細胞分成四大組即C1,C2,C3和C4,每一大組分為12個小組,每組重複2次,共96個反應容器,每個反應器中含3000個細胞;將上述細胞分散在50mM三羥甲基氨基甲烷-鹽酸緩衝液、5mM 氯化鎂、0.1% (w/v) 3-[3-(膽醯胺丙基)二甲氨基]丙磺酸內鹽、pH=7.4的反應緩衝液中;之後向C1組中的1-12小組加入反應緩衝液與放射性同位素標記的標準物混合液,向C2組中的1-12小組加入低濃度的待測物與放射性同位素標記的標準物混合液, 向C3組中的1-12小組加入中濃度的待測物與放射性同位素標記的標準物混合液,向C4組中的1-12小組加入高濃度的待測物與放射性同位素標記的標準物混合液;然後將C1,C2,C3和C4大組中的1-11小組的細胞混合液進行孵育,即第1小組孵育0.5分鐘, 第2小組1分鐘, 第3小組2分鐘, 第4小組4分鐘, 第5小組8分鐘, 第6小組15分鐘, 第7小組30分鐘, 第8小組60分鐘, 第9小組90分鐘, 第10小組120分鐘, 第11小組180分鐘,孵育結束後,檢測在不同的孵育時間段下,加入了不同濃度待測物的細胞的放射性;與此同時向C1,C2,C3和C4的第12小組反應容器中,加入高濃度的競爭取代物,並測量C1,C2,C3和C4的第12小組反應容器中標準物非特異性的放射性結合強度;待c組細胞全部孵育測量結束後,使用快速真空抽濾方法,將不同組中的細胞收集在GF/C濾膜上,並使用含有三羥甲基氨基甲烷-鹽酸緩衝液、氯化鎂的洗脫液,分離游離態與結合態的放射性同位素標記的標準物;所得濾膜加入閃爍液後,用閃爍光譜法測定放射性,利用Motulsky-Mahan數學模型,並根據步驟2和3中測定的放射性同位素標記的標準物的結合速率常數和離解速率常數,推算未被同位素標記的待測物的結合速率常數和離解速率常數,在此基礎上,測定藥物受體停留時間。
附圖說明
下面結合附圖和實施例對本實用新型進一步說明。
圖1是基於全細胞的藥物靶點停留時間的檢測方法操作流程圖。
具體實施方式
下面通過實例對本發明做進一步詳細說明
實例1、在大鼠脂肪細胞上測定藥物在腺苷A1受體上的停留時間
具體步驟如下:
1.體外培養並收集重組細胞或者組織分離的動物細胞,分成三份,分別標記為d組、e組、f組;
2. 將d組細胞分成12個小組,每小組重複2次,置於24個反應容器中,每個反應器中含3000個細胞;向d組的24個反應容器中加入濃度為2.5nM的[3H]-8-環戊-1,3-二丙基黃嘌呤(A1受體拮抗劑,同位素標記的標準物),並在含有50mM三羥甲基氨基甲烷-鹽酸緩衝液, 5mM 氯化鎂, 0.1% (w/v) 3-[3-(膽醯胺丙基)二甲氨基]丙磺酸內鹽,pH=7.4的反應緩衝液中,室溫條件下孵育20 分鐘;之後向1-11小組的反應容器中加入5 µL濃度為1μM的環戊腺苷即A1受體競爭取代物,第1小組孵育0.5分鐘, 第2小組1分鐘, 第3小組2分鐘, 第4小組4分鐘, 第5小組8分鐘, 第6小組10分鐘, 第7小組12分鐘, 第8小組15分鐘, 第9小組20分鐘, 第10小組30分鐘, 第11小組60分鐘,以檢測同位素標記的標準物的離解過程中的放射性強度;第12小組的反應容器中加入0.1mM環戊腺苷,並孵育60分鐘以測量標準物的非特異性同位素結合強弱;孵育測量結束後,使用快速真空抽濾方法,將大鼠脂肪細胞收集在GF/C濾膜上,並使用含有50mM三羥甲基氨基甲烷-鹽酸緩衝液、5 mM 氯化鎂,pH=7.4的洗脫液,分離游離態與結合態的[3H]-8-環戊-1,3-二丙基黃嘌呤。所得濾膜在低溫下,用洗滌緩衝液洗3次後,加入3.5 mL閃爍液;用閃爍光譜法測定其放射性。利用單相離解速率模型計算[3H]-8-環戊-1,3-二丙基黃嘌呤即同位素標記的標準物的離解速率常數。
3. 將e組細胞分成12個小組,每小組重複2次,置於24個反應容器中,每個反應器中含3000個細胞,分散在含有50mM三羥甲基氨基甲烷-鹽酸緩衝液、5mM 氯化鎂、0.1% (w/v) 3-[3-(膽醯胺丙基)二甲氨基]丙磺酸內鹽、pH =7.4的反應緩衝液中;之後將濃度為2.5nM的[3H]-8-環戊-1,3-二丙基黃嘌呤不重複的加入到1-12小組的反應容器中,並將1-11小組分別對應孵育0.5分鐘, 1分鐘, 2分鐘, 4分鐘, 8分鐘, 10分鐘, 12分鐘, 15分鐘, 20分鐘, 30分鐘, 60分鐘後,測量放射性同位素標記的標準物在不同的孵育時間段與細胞的結合強度;同時在第12小組反應容器中,加入0.1mM的環戊腺苷,孵育60分鐘後直接測量第12小組容器中非特異性同位素結合強弱;1-12組孵育結束後,使用快速真空抽濾方法,在GF/C濾膜上分離游離與結合的[3H]-8-環戊-1,3-二丙基黃嘌呤。所得濾膜在低溫下,使用含有50mM三羥甲基氨基甲烷-鹽酸緩衝液, 5mM 氯化鎂, pH=7.4的洗脫液,洗3次後,加入3.5 mL閃爍液。用閃爍光譜法測定放射性。獲得數據後,使用單相結合速率模型計算標記物的結合速率常數。
4. 將f組細胞分成四大組即f1,f2,f3和f4,每一大組分為12個小組,每組重複2次,共96個反應容器,每個反應器中含3000個細胞;將上述細胞分散在50mM三羥甲基氨基甲烷-鹽酸緩衝液、5mM 氯化鎂、0.1% (w/v) 3-[3-(膽醯胺丙基)二甲氨基]丙磺酸內鹽、pH=7.4的反應緩衝液中;之後向f1組中的1-11小組細胞中加入反應緩衝液與放射性同位素標記的標準物混合液,向f2組中的1-11小組細胞中加入1nM的待測物與放射性同位素標記的標準物混合液,向f3組中的1-11小組細胞中加入100nM的待測物與放射性同位素標記的標準物混合液,向f4組中加入10μM的待測物與放射性同位素標記的標準物混合液;之後將f1,f2,f3和f4組中1-11小組的細胞混合液分別對應孵育0.5分鐘, 1分鐘, 2分鐘, 4分鐘, 8分鐘, 15分鐘, 30分鐘, 60分鐘,90分鐘,120分鐘,180分鐘,之後檢測f1,f2,f3和f4組中1-11小組在不同孵育時間段下,加入了不同濃度待測物後,細胞的放射性;此外,在f1,f2,f3和f4組中的第12小組反應容器中,加入0.1mM的環戊腺苷,並測量f1,f2,f3和f4組中第12小組中標準物非特異性的放射性結合數據;孵育結束後,使用快速真空抽濾方法,在GF/C濾膜上,分離游離與結合的[3H]-8-環戊-1,3-二丙基黃嘌呤;所得濾膜在低溫下,用洗滌緩衝液洗3次後,加入3.5mL閃爍液;用閃爍光譜法測定放射性,利用Motulsky-Mahan數學模型,並根據步驟2和3中測定的放射性配體的結合速率常數和離解速率常數,推算未被同位素標記的待測物的結合速率常數和離解速率常數,在此基礎上,測定藥物受體停留時間。
