檢測飲用水中銀離子的方法與流程
2023-05-20 02:25:01 1
本發明涉及一種檢測飲用水中銀離子的方法。
背景技術:
銀元素是人類生產生活中應用最廣泛的重金屬之一。在古代,人類就將銀作為主要的流通貨幣和毒性檢測物。目前,單質銀及銀離子(Ag+)也被廣泛應用於材料、醫藥、電池、半導體及成像領域。尤其是在醫藥領域,銀的化合物因其獨特的抗菌性能而被作為抗菌藥、抗愛滋病毒藥物前驅體、植入假體和消毒試劑。然而,正是由於銀離子的應用廣泛,使其可以在人體的皮膚、肝臟和腎臟內大量富集,並引起一系列疾病。為了減少這些疾病的發生,世界衛生組織規定:飲用水中銀離子的濃度不得超過0.05ppm(約為4.6×10-7mol/L)。
螢光檢測法是用於檢測銀離子的常見方法之一。通過將銀離子與檢測物混合,使檢測物的螢光強度發生淬滅或者增強。然而,通過淬滅或者增強方法進行螢光檢測很難達到較低的檢測濃度。因此,以上方法難以符合檢測飲用水中銀離子濃度的世界衛生組織標準。
稀土配位聚合物是一類由有機配體和稀土離子通過配位鍵形成的晶態有機/無機雜化材料。在稀土配位聚合物中,除了稀土離子的特徵發射產生光以外,配體還能產生螢光。因此,通過調節配體和稀土離子的比例,能夠製備出可調發光或者白光材料。另一方面,稀土離子的發光強度對於配位環境十分敏感,因此可用作對小分子,氣體分子,金屬離子,陰離子,ph值,溫度的化學檢測試劑。在過去的20年中,利用稀土配位聚合物進行螢光檢測的文獻有很多,但是利用白光材料進行螢光檢測卻沒有報導。
技術實現要素:
本發明為了解決通過淬滅或者增強方法進行螢光檢測很難達到較低的檢測濃度的技術問題,提供了一種檢測飲用水中銀離子的方法。
檢測飲用水中銀離子的方法按照以下步驟進行:
一、將0.1g~100g二苯甲醯酒石酸稀土配合物,溶解於0.1mL~50mL的N,N』-二甲基甲醯胺溶劑中,製備成混合液;
二、將飲用水與混合液按照體積比1:1混合,採用波長為320nm~324nm的紫外光照射,觀察溶液顏色,當飲用水中銀離子濃度高於0.05ppm時,溶液顏色由白色變為紅色。
步驟一中所述二苯甲醯酒石酸稀土配合物為二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物按照1:1:3~6的質量比混合。
所述二苯甲醯酒石酸稀土配合物的製備方法如下:
將0.1g~100g二苯甲醯酒石酸加入到0.1mL~50mL的溶劑中,再加入0.1mL~2mL的去離子劑至溶解,加入0.01g~100g濃度為0.01~1mol/L的氯化稀土鹽水溶液,常溫攪拌2小時,過濾後分別用水和甲醇洗滌,並在55℃~65℃下真空乾燥,即得到二苯甲醯酒石酸稀土配合物;所述氯化稀土鹽為氯化釤、氯化鋱或氯化銪;所述溶劑為甲醇、水或乙醇;所述去離子劑為三乙胺、氫氧化鈉或氫氧化鉀。
所述二苯甲醯酒石酸稀土配合物的製備方法如下:
將0.1g~100g二苯甲醯酒石酸加入到0.1mL~50mL的溶劑中,再加入0.1mL~2mL的去離子劑至溶解,加入0.01g~100g濃度為0.01~1mol/L的硝酸稀土鹽溶液,常溫攪拌2小時,過濾後分別用水和甲醇洗滌,並在55℃~65℃下真空乾燥,即得到二苯甲醯酒石酸稀土配合物;所述硝酸稀土鹽為硝酸釤、硝酸鋱或硝酸銪;所述溶劑為甲醇、水或乙醇;所述去離子劑為三乙胺、氫氧化鈉或氫氧化鉀。
根據Dexter理論,配體的三線態和稀土離子的接受能級之間的分子間能量轉換對於稀土配位聚合物中三價稀土離子的螢光性能有決定作用。在本發明中,配體的單線態能級可以通過紫外吸收峰的邊界值計算得到(287nm,1ππ*=34800cm-1),三線態能級可以通過Gd配合物的低溫磷光的最低發射波長計算得到(475nm,3ππ*=21000cm-1)。根據Reinhoudt準則,當單線態和三線態能級差大於5000時會產生隙間穿越。本發明的能稽查為13300,說明能量可以從配體的單線態傳遞到三線態。此外,根據Latva經驗規則,配體的三線態能級與稀土離子的振動能級差為2500至4000時可以形成能量傳遞。經過計算,本發明中配體可以進行能量傳遞。
本發明的方法製備簡單、檢測濃度低,本發明利用白光材料檢測飲用水中的銀離子。當銀離子的濃度達到或者高於0.05ppm時,白光材料的顏色變為紅色,檢測限符合世界衛生組織標準。
附圖說明
圖1是實驗一中飲用水中銀離子濃度高於0.05ppm時,在322nm紫外光照射下的螢光圖片,溶液從白色變為紅色;
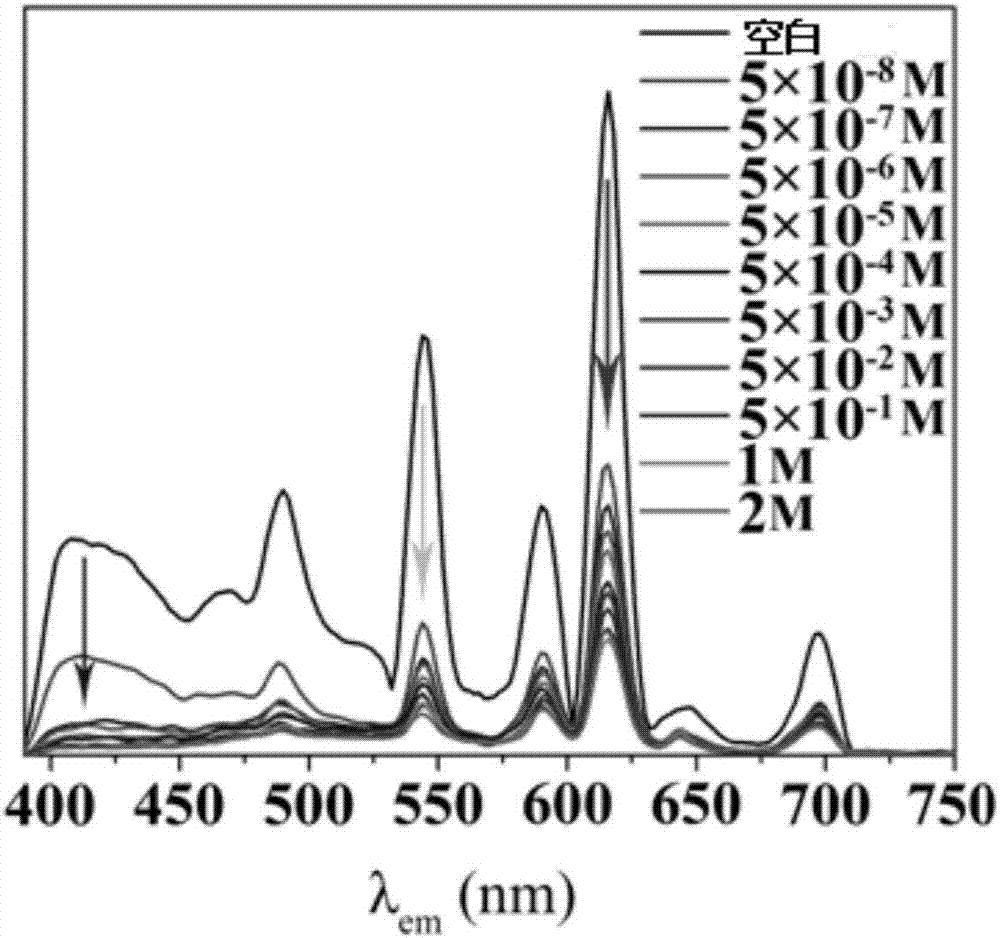
圖2是實驗一中為不同銀離子濃度下的發射光譜圖;
圖3是實驗一中二苯甲醯酒石酸稀土配合物單晶結構示意圖;
圖4是實驗一中二苯甲醯酒石酸稀土配合物單晶結構示意圖;
圖5是實驗一中二苯甲醯酒石酸銪配合物的堆積結構示意圖;
圖6是實驗一中二苯甲醯酒石酸銪配合物的堆積結構示意圖;
圖7是實驗一中二苯甲醯酒石酸、二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物、二苯甲醯酒石酸鋱配合物及二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物混合物的傅立葉變換紅外譜圖,圖中L-DBTA表示二苯甲醯酒石酸,1表示二苯甲醯酒石酸釤配合物,2表示二苯甲醯酒石酸銪配合物,3表示二苯甲醯酒石酸鋱配合物,4表示二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物混合物;
圖8是實驗一中二苯甲醯酒石酸、二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物、二苯甲醯酒石酸鋱配合物及二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物混合物的紫外譜圖,圖中L-DBTA表示二苯甲醯酒石酸,1表示二苯甲醯酒石酸釤配合物,2表示二苯甲醯酒石酸銪配合物,3表示二苯甲醯酒石酸鋱配合物,4表示二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物混合物;
圖9是實驗一中二苯甲醯酒石酸、二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物、二苯甲醯酒石酸鋱配合物及二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物混合物的紫外漫反射譜圖,圖中L-DBTA表示二苯甲醯酒石酸,1表示二苯甲醯酒石酸釤配合物,2表示二苯甲醯酒石酸銪配合物,3表示二苯甲醯酒石酸鋱配合物,4表示二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物混合物;
圖10是二苯甲醯酒石酸釤配合物的熱失重譜圖;
圖11是二苯甲醯酒石酸銪配合物的熱失重譜圖;
圖12是二苯甲醯酒石酸鋱配合物的熱失重譜圖;
圖13是二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物混合物的熱失重譜圖;
圖14是實驗一中二苯甲醯酒石酸、二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物及二苯甲醯酒石酸鋱配合物的三維螢光譜圖,圖中a表示二苯甲醯酒石酸,b表示二苯甲醯酒石酸釤配合物,c表示二苯甲醯酒石酸銪配合物,d表示二苯甲醯酒石酸鋱配合物;
圖15是實驗一中配合物4的三維螢光譜圖;
圖16是實驗一中配合物4的螢光檢測圖和對於銀離子的檢測敏感度曲線;
圖17是實驗一中配合物4顏色隨激發波長變化的CIE示意圖;
圖18是實驗一中Ag+@配合物4的時間依賴發射譜圖;
圖19是實驗一中Ag+@配合物4的PXRD譜圖;
圖20是圖16中空白髮射譜圖及螢光發射分峰擬合;
圖21是Ag+濃度為5×10-8mol/L的Ag+@配合物4發射譜圖分峰擬合譜圖;
圖22是Ag+濃度為5×10-7mol/L的Ag+@配合物4發射譜圖分峰擬合譜圖;
圖23是Ag+濃度為2mol/L的Ag+@配合物4發射譜圖分峰擬合譜圖;
圖24是實驗一中各配合物的XRD譜圖,圖中1表示二苯甲醯酒石酸釤配合物,2表示二苯甲醯酒石酸銪配合物,3表示二苯甲醯酒石酸鋱配合物,4表示二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物混合物,5表示二苯甲醯酒石酸銪配合物根據晶體結構擬合數據,6表示二苯甲醯酒石酸鋱配合物根據晶體結構擬合數據;
圖25是實驗一中二苯甲醯酒石酸釓配合物低溫磷光譜圖;
圖26是實驗一中二苯甲醯酒石酸鋱配合物的顏色隨激發波長變化的CIE示意圖;
圖27是實驗一中配合物4在固態的發射譜圖
圖28是實驗一中配合物4在濃度為0.01mol/L的DMF溶液中的發射譜圖。
具體實施方式
本發明技術方案不局限於以下所列舉具體實施方式,還包括各具體實施方式間的任意組合。
具體實施方式一:本實施方式中檢測飲用水中銀離子的方法按照以下步驟進行:
一、將0.1g~100g二苯甲醯酒石酸稀土配合物,溶解於0.1mL~50mL的N,N』-二甲基甲醯胺溶劑中,製備成混合液;
二、將飲用水與混合液按照體積比1:1混合,採用波長為320nm~324nm的紫外光照射,觀察溶液顏色,當飲用水中銀離子濃度高於0.05ppm時,溶液顏色由白色變為紅色。
具體實施方式二:本實施方式與具體實施方式一不同的是步驟一中所述二苯甲醯酒石酸稀土配合物為二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物按照1:1:3~6的質量比混合。其它與具體實施方式一相同。
具體實施方式三:本實施方式與具體實施方式一或二之一不同的是所述二苯甲醯酒石酸稀土配合物的製備方法如下:
將0.1g~100g二苯甲醯酒石酸加入到0.1mL~50mL的溶劑中,再加入0.1mL~2mL的去離子劑至溶解,加入0.01g~100g濃度為0.01~1mol/L的氯化稀土鹽水溶液,常溫攪拌2小時,過濾後分別用水和甲醇洗滌,並在55℃~65℃下真空乾燥,即得到二苯甲醯酒石酸稀土配合物;所述氯化稀土鹽為氯化釤、氯化鋱或氯化銪;所述溶劑為甲醇、水或乙醇;所述去離子劑為三乙胺、氫氧化鈉或氫氧化鉀。其它與具體實施方式一或二之一相同。
具體實施方式四:本實施方式與具體實施方式一至三之一不同的是所述二苯甲醯酒石酸稀土配合物的製備方法如下:
將0.1g~100g二苯甲醯酒石酸加入到0.1mL~50mL的溶劑中,再加入0.1mL~2mL的去離子劑至溶解,加入0.01g~100g濃度為0.01~1mol/L的硝酸稀土鹽溶液,常溫攪拌2小時,過濾後分別用水和甲醇洗滌,並在55℃~65℃下真空乾燥,即得到二苯甲醯酒石酸稀土配合物;所述硝酸稀土鹽為硝酸釤、硝酸鋱或硝酸銪;所述溶劑為甲醇、水或乙醇;所述去離子劑為三乙胺、氫氧化鈉或氫氧化鉀。其它與具體實施方式一至三之一相同。
具體實施方式五:本實施方式與具體實施方式一至四之一不同的是步驟一中將10g~50g二苯甲醯酒石酸稀土配合物,溶解於1mL~30mL的N,N』-二甲基甲醯胺溶劑中,製備成混合液。其它與具體實施方式一至四之一相同。
具體實施方式六:本實施方式與具體實施方式一至五之一不同的是步驟一中將20g~40g二苯甲醯酒石酸稀土配合物,溶解於20mL的N,N』-二甲基甲醯胺溶劑中,製備成混合液。其它與具體實施方式一至五之一相同。
具體實施方式七:本實施方式與具體實施方式一至六之一不同的是步驟二中採用波長為321nm的紫外光照射。其它與具體實施方式一至六之一相同。
具體實施方式八:本實施方式與具體實施方式一至七之一不同的是步驟二中採用波長為322nm的紫外光照射。其它與具體實施方式一至七之一相同。
具體實施方式九:本實施方式與具體實施方式一至八之一不同的是步驟二中採用波長為323nm的紫外光照射。其它與具體實施方式一至八之一相同。
具體實施方式十:本實施方式與具體實施方式一至九之一不同的是步驟二中採用波長為324nm的紫外光照射。其它與具體實施方式一至九之一相同。
具體實施方式十一:本實施方式與具體實施方式一至十之一不同的是步驟一中所述二苯甲醯酒石酸稀土配合物為二苯甲醯酒石酸釤、二苯甲醯酒石酸銪和二苯甲醯酒石酸鋱按照1:1:3的質量比混合。其它與具體實施方式一至十之一相同。
具體實施方式十二:本實施方式與具體實施方式一至十之一不同的是步驟一中所述二苯甲醯酒石酸稀土配合物為二苯甲醯酒石酸釤、二苯甲醯酒石酸銪和二苯甲醯酒石酸鋱按照1:1:4的質量比混合。其它與具體實施方式一至十之一相同。
具體實施方式十三:本實施方式與具體實施方式一至十之一不同的是步驟一中所述二苯甲醯酒石酸稀土配合物為二苯甲醯酒石酸釤、二苯甲醯酒石酸銪和二苯甲醯酒石酸鋱按照1:1:5的質量比混合。其它與具體實施方式一至十之一相同。
採用下述實驗驗證本發明效果:
實驗一:
一、二苯甲醯酒石酸稀土配合物的製備方法如下:
將10g二苯甲醯酒石酸加入到20mL的溶劑中,再加入1mL的去離子劑至溶解,加入10g濃度為0.5mol/L的氯化稀土鹽水溶液,常溫攪拌2小時,過濾後分別用水和甲醇洗滌,並在60℃下真空乾燥,即得到二苯甲醯酒石酸稀土配合物(二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物或二苯甲醯酒石酸鋱配合物);所述氯化稀土鹽為氯化釤、氯化鋱或氯化銪;所述溶劑為甲醇、水或乙醇;所述去離子劑為三乙胺、氫氧化鈉或氫氧化鉀。
二、將50g二苯甲醯酒石酸稀土配合物,溶解於20mL的N,N』-二甲基甲醯胺溶劑中,製備成混合液;
所述二苯甲醯酒石酸稀土配合物為二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物按照1:1:3的質量比混合。
三、將飲用水與混合液按照體積比1:1混合,採用波長為322nm的紫外光照射,觀察溶液顏色,當飲用水中銀離子濃度高於0.05ppm時,溶液顏色由白色變為紅色。
本實驗中使用的螢光光譜儀為Edinburgh公司FLS980螢光光譜儀。
當引用水中銀離子濃度高於0.05ppm時,在322nm紫外光照射下溶液顏色由白色變為紅色。通過螢光發射譜圖1可知,未加入銀離子的二苯甲醯酒石酸稀土混配物DMF溶液或懸濁液在400~500nm處(藍光區)存在寬峰,在544nm(綠光區)和614nm(紅光區)處存在尖峰。在紅、綠、藍三種顏色的混合下,二苯甲醯酒石酸稀土混配物DMF溶液或懸濁液呈現明顯的白色,CIE坐標為(0.333,0.334),接近於純白光的CIE坐標(0.333,0.333)。
通過銀離子濃度變化螢光發射譜圖可知,在二苯甲醯酒石酸稀土混配物N,N』-二甲基甲醯胺溶液或懸濁液中加入銀離子的水溶液,隨著銀離子濃度的不斷提升,藍光區、綠光區和紅光區的峰值均減弱,其中藍光區和綠光區的減弱速度大於紅光區的減弱速度,因此呈現出紅光。
二苯甲醯酒石酸稀土配合物單晶結構顯示該配合物具有一維鏈狀結構,屬於P21212空間群(見圖3、圖4)。每個不對稱單元包括兩個獨立的稀土離子,四個二苯甲醯酒石酸配體,八個溶劑分子和一個三乙胺分子。兩個稀土離子都是八配位結構,八個配位氧原子分別來自於四個羧酸根和溶劑分子,形成一個反四稜柱的結構。相鄰的稀土離子以(κ1-μ1)-(κ1-μ1)-μ2模式連接。所有的配體分子都具有相同的配位模式:每個羧酸根的其中一個氧原子與稀土離子相連。每對配體彼此之間相互垂直,形成一個一維鏈狀的結構。相鄰的一維鏈通過苯環上的分子間作用力結合成一個一維偽孔道結構的形狀。晶格水和三乙胺離子佔據著一維偽孔道的空間。紅外,紫外和熱失重數據能夠進一步證實配合物的結構(圖7-圖9)。
本實驗測試了配體和3個配合物的三維螢光譜圖。在320至400納米激發下,配體和二苯甲醯酒石酸釤配合物在400至550納米處有強的寬發射峰。這個發射峰覆蓋了整個藍光區域,在438納米波長處達到最大,屬於配體的π-π*躍遷。根據圖14a和圖14b中的照片來看,配體和二苯甲醯酒石酸釤配合物都呈現出明顯的藍色。通過檢測銪離子在614納米處的發射峰,二苯甲醯酒石酸銪配合物在300至340納米處展現了微弱的發射,並在394納米處展現了強的發射峰(圖14c)。發射峰的位置位於592、612、652和698納米處,對應著銪離子5D0→7FJ(J=1,2,3and 4)轉換。二苯甲醯酒石酸鋱配合物展現了配體和鋱離子的共發光(圖14d)。在400至500納米波長處,二苯甲醯酒石酸鋱配合物展現的配體的發射。在500至650納米處則展現了鋱離子的特徵發射。通過調節二苯甲醯酒石酸鋱配合物的激發波長,螢光顏色可以從綠色變為青色再變為藍色.
考慮到二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物及二苯甲醯酒石酸鋱配合物是同構的並且分別能展現藍色、紅色和綠色光,所以有可能通過調節摻雜比例來製備出白光發射的配合物4(二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物和二苯甲醯酒石酸鋱配合物按照1:1:3的質量比混合):{Et3NH[(Sm0.2Eu0.2Tb0.6)(L-DBTA)2(CH3OH)2(H2O)2]·2H2O}n。因此,三組分的混稀土白光配位聚合物被製備出來,粉末XRD數據顯示該材料與二苯甲醯酒石酸釤配合物、二苯甲醯酒石酸銪配合物及二苯甲醯酒石酸鋱配合物具有相同的結構。從圖15所示,該白光材料在不同激發波長處展現出了不同的發光顏色。在300納米激發波長下配合物4展現黃色;在322納米激發波長下,配合物4展現白色,且CIE坐標為(0.333,0.334),與純白光的CIE坐標(0.333,0.333)十分接近;在370納米激發波長下,配合物4展現藍色。
為了研究該白光材料的螢光檢測能力,將0.01M金屬離子(M(NO3)x(M=Ag+,Al3+,Ba3+,Ca2+,Cr3+,Cu2+,Fe3+,Hg2+,K+,Mg2+,Mn2+,Na+,Pb2+,Zn2+,x=1–3)or MClx(M=Fe2+,x=2))水溶液溶解在濃度為0.01mol/L的配合物4的DMF溶液中。根據圖16a所示,一些金屬離子仍然呈現白色,還有一些金屬離子呈現螢光淬滅。銀離子呈現紅色。另外,加入銀離子後的配合物4溶液展現了時間依賴行為(圖17)。在加入銀離子一周後,螢光強度降低了一個數量級。
為了評價配合物4對於銀離子的檢測敏感度,定量滴定實驗被操作。根據圖16b所示,在加入5×10-8M的銀離子後,溶液變成紅色,暗示著配合物4對於銀離子的檢測限低於5×10-8M。這樣低的檢測限要比以往文獻報導低很多,並且能滿足世界衛生組織和美國環境保護協會的要求。
在配合物4的DMF溶液中滴加銀離子,隨著銀離子濃度的不斷增加,配合物4的藍光部分淬滅,顯示出了紅色。對於變色檢測機理進行了研究。PXRD數據(圖19)顯示配合物4在加入銀離子後結構並未發生改變。發光壽命數據顯示配合物4在加入銀離子後壽命降低,說明加入的銀離子與配合物之間有相互作用,可能是來自於金屬π鍵耦合。此外,對於加入銀離子的螢光譜圖進行了分峰處理(圖19-圖23,表1)。加入銀離子後,
配體發射峰出現了藍移,說明配體的π*能級層提升,是的π*與稀土離子間的帶隙增加,有利於配體向稀土間的分子內能量傳遞。所以,稀土離子發光逐漸佔據主導地位。
表1不同Ag+濃度的Ag+@配合物4發射譜圖分峰擬合數據
