一種強化絲狀真菌蛋白質生產的方法與流程
2023-05-13 11:21:31 2
本發明屬於基因工程領域,一種提高絲狀真菌生產纖維素酶、半纖維素酶或其它蛋白的方法,涉及5個基因(五個轉錄因子基因分別為NCU10006、NCU06487、NCU05383、NCU05994、NCU05051),特別是提供脈孢菌屬、毀絲黴屬宿主。
背景技術:
木質纖維素是自然界中存在最廣泛、最豐富的碳水化合物。隨著地球資源的快速消耗、環境汙染和能源危機的日益加劇,纖維素作為潛力巨大、環境友好的可再生能源成為研究的重點。作為地球上數量最大的可再生資源,纖維素的利用效率卻遠遠低於社會發展的要求,若能將其高效地轉化為可利用的能源、食料和化學原料等,勢必將會對人類社會的健康發展起到關鍵作用。要利用這些儲量巨大的生物質資源,需要糖化和發酵兩個基本步驟。其中,糖化過程中所需要的木質纖維素水解酶(纖維素酶、半纖維素酶等)的生產成本過高已成為制約整個生物煉製產業發展的核心問題,如何高效、廉價的生產這些酶製劑或是如何低成本的將生物質高效地降解為可發酵的單體化合物(葡萄糖、木糖等)、低聚化合物(纖維寡糖、木寡糖等)已成迫切需要解決的問題。
在自然界中,多種微生物都具有降解、利用纖維素的能力,特別是子囊菌和擔子菌等絲狀真菌可以分泌多種木質纖維素水解酶,與其它微生物相比,其具有完整的纖維素酶系,這種特性使其成為研究纖維素利用和纖維素酶生產過程中的熱點。在提高生物質降解效率的研究中,傳統誘變技術已經取得了重大進步。儘管纖維素水解酶的產量已經達到100 g/L以上水平,但在整個工藝成本中佔有極大比重,不符合工業大規模生產的基本要求。近年來,研究表明絲狀真菌木質纖維素水解酶的表達與轉錄水平密切相關。通過對相關轉錄因子的表達水平的調控可以大幅提高水解酶的表達水平。此外,絲狀真菌是工業蛋白質最主要的生產宿主之一,其具有強大的分泌能力和高等真核細胞中的蛋白質修飾功能,而且具有發酵工藝簡單經濟等特點。因此,高分泌型宿主和眾多強啟動子(如纖維素酶CBH I啟動子等)使得絲狀真菌宿主在生產其它蛋白質具有很大的潛力。專利WO2011151515提供了一種在裡氏木黴中通過過表達調節因子來達到提高纖維素酶表達水平的方法。參與木質纖維素水解酶基因表達的這一途徑的基因眾多,然而目前為止僅有數十個相關轉錄因子被克隆、鑑定。因此,本領域迫切需要鑑定這一途徑中其它關鍵調控因子,從而開發能夠提高纖維素酶等蛋白質生產的技術和方法。
技術實現要素:
本發明的目的是提供一種提高木質纖維素降解及纖維素酶、半纖維素酶表達的方法及其應用。
本發明第一方面,提供了一種提高絲狀真菌纖維素酶和/或半纖維酶的表達、和/或提高絲狀真菌的纖維素降解活性的方法,包括步驟:
強化絲狀真菌的纖維素降解相關鋅指轉錄因子或其基因的表達和/或活性,從而提高絲狀真菌纖維素和/或半纖維酶的表達、和/或提高絲狀真菌的纖維素降解活性。
在另一優選例中,所述的絲狀真菌包括:脈孢菌(Neurospora)、或側孢黴(Sporotrichum)。
在另一優選例中,所述的絲狀真菌還包括麴黴(Aspergillus)、木黴(Trichoderma)、青黴(Penicillium)、鐮刀黴(Fusarium)、或毀絲酶(Myceliophthora)。
在另一優選例中,所述纖維素降解相關鋅指轉錄因子包括:
(a)SEQ ID NO: 1、3、5、7、或9所示序列的一種或多種。
在另一優選例中,所述的纖維素降解相關鋅指轉錄因子還包括:
(b)與SEQ ID NO: 1、3、5、7、或9所示序列同源性為50%以上,較佳地為60%以上,更佳地為65%以上的纖維素降解相關鋅指轉錄因子。
在另一優選例中,所述強化包括過表達和/或上調所述的纖維素降解相關鋅指轉錄因子的表達和/或活性。
在另一優選例中,所述的纖維素降解相關鋅指轉錄因子至少包括SEQ ID NO: 1、3、5、7、或9所示序列的一種或多種。
在另一優選例中,所述的絲狀真菌為脈胞菌,較佳地,為粗糙脈胞菌。
在另一方面,本發明提供降低一組蛋白質的生產的方法,所述蛋白質為分泌蛋白質,達到在生產例如異源蛋白質時降低不期望得到的副產品的生產。
本發明第二方面,提供了一種用於降解纖維素的工程菌,所述工程菌中纖維素降解相關鋅指轉錄因子被強化表達。
在另一優選例中,所述的工程菌中纖維素降解相關鋅指轉錄因子的表達和/或活性得到提高。
在另一優選例中,所述的「強化表達」指的是與野生型菌株相比,所述工程菌纖維素降解相關鋅指轉錄因子的表達量至少提高了10%,較佳地,至少提高了20-90%,更佳地,至少提高了100-600%。
在另一優選例中,與野生型菌株相比,所述工程菌纖維素酶和/或半纖維素酶的表達量和/或活性至少提高了20%,較佳地,至少提高了50-80%,更佳地,至少提高了100-500%。
在另一優選例中,所述的纖維素降解相關鋅指轉錄因子包括選自SEQ ID NO: 1、3、5、7、或9所示序列的一種或多種。
在另一優選例中,所述工程菌包括改造自以下野生菌的菌株:脈孢菌(Neurospora)、或側孢黴(Sporotrichum)、麴黴(Aspergillus)、木黴(Trichoderma)、青黴(Penicillium)、鐮刀黴(Fusarium)、或毀絲酶(Myceliophthora)。
本發明第三方面,提供了一種生產纖維素酶和/或半纖維素酶的方法,在纖維素原料的存在下,培養本發明第三方面所述的工程菌,並從培養物中分離提純所述的纖維素酶和/或半纖維素酶。
在另一優選例中,所述的誘導物即纖維素原料包括木質纖維素、結晶纖維素、木聚糖、木質纖維素水解物、木寡糖、纖維寡糖、木糖、或阿拉伯糖。
本發明第四方面,提供了一種降解纖維素並獲得纖維素降解產物的方法,在木質素原料的存在下,培養本發明第三方面所述的工程菌,從而降解木質素並獲得木質素降解產物。
本發明第五方面,提供了本發明第三方面所述工程菌的用途,用於製備纖維素酶和/或半纖維素酶、和/或用於提高纖維素的降解。
該方法是利用強化鋅指轉錄因子基因表達的微生物菌株降解木質纖維素或是生產纖維素酶、半纖維素酶的方法,所述微生物為脈孢菌(Neurospora)、麴黴(Aspergillus)、木黴(Trichoderma)、青黴(Penicillium)、鐮刀黴(Fusarium)或側孢黴(Sporotrichum)。
所述鋅指轉錄因子基因包括NCU10006、NCU06487、NCU05383、NCU05994和NCU05051,過表達其中的任意轉錄因子,或突變任意一個轉錄因子的部分鹼基提高其活性。
所述鋅指家族轉錄因子基因NCU10006的核苷酸序列如序列表中序列2所示,編碼序列表中序列1所示蛋白;所述鋅指家族轉錄因子基因NCU06487的核苷酸序列如序列表中序列4所示,編碼序列表中序列3所示蛋白;所述鋅指家族轉錄因子基因NCU05383的核苷酸序列如序列表中序列6所示,編碼序列表中序列5所示蛋白。所述鋅指家族轉錄因子基因NCU05994的核苷酸序列如序列表中序列8所示,編碼序列表中序列7所示蛋白。所述鋅指家族轉錄因子基因NCU05051的核苷酸序列如序列表中序列10所示,編碼序列表中序列9所示蛋白。
具體的,該方法利用以下任一菌株:以脈孢菌(Neurospora)為出發菌株構建過表達轉錄因子NCU10006基因的菌株;以脈孢菌(Neurospora)為出發菌株構建過表達轉錄因子NCU06487基因的菌株;以脈孢菌(Neurospora)為出發菌株構建過表達轉錄因子NCU05383基因的菌株;以脈孢菌(Neurospora)為出發菌株構建過表達轉錄因子NCU05994基因的菌株;以脈孢菌(Neurospora)為出發菌株構建過表達轉錄因子NCU05051基因的菌株。
本發明提供的提高木質纖維素降解和纖維素酶、半纖維素酶表達的方法,是以微生物為出發菌株,過表達其中鋅指家族轉錄因子基因而得到,或是提高任意鋅指家族轉錄因子的活性而得到。所述微生物為脈孢菌(Neurospora)、麴黴(Aspergillus)、木黴(Trichoderma)、青黴(Penicillium)、鐮刀黴(Fusarium)或側孢黴(Sporotrichum)。所述過表達基因是針對鋅指家族轉錄因子基因NCU10006、NCU06487、NCU05383、NCU05994和NCU05051。
本發明方法的應用是廣泛的,其為高效表達生產纖維素酶、半纖維素酶或其它蛋白質。其中:
生產纖維素酶的方法,是以木質纖維素、結晶纖維素、經過預處理的木質纖維素、纖維寡糖為誘導物,發酵所述的方法得到纖維素酶。
生產半纖維素酶的方法,是以木質纖維素、木聚糖、經過預處理的木質纖維素、阿拉伯糖、木寡糖、木糖為誘導物,發酵所述方法得到半纖維素酶。
生產其它蛋白的方法,包括將編碼蛋白功能片段的基因導入所述受體菌中形成工程菌,再發酵該工程菌生產蛋白的過程。
因此,本發明還涉及這些轉錄因子基因在構建功能性工程菌中的應用。該應用是將編碼蛋白功能片段的基因導入所述的出發菌株中形成的工程菌。
由此形成的高效表達蛋白的工程菌也屬於本發明的技術內容。
應理解,在本發明範圍內中,本發明的上述各技術特徵和在下文(如實施例)中具體描述的各技術特徵之間都可以互相組合,從而構成新的或優選的技術方案。限於篇幅,在此不再一一累述。
附圖說明
圖1:NCU10006和NCU06487過表達菌株在2%微晶纖維素培養基上培養7天,取發酵液上清液,測量蛋白濃度、木聚糖酶活和纖維素內切酶酶活。
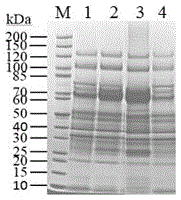
圖2:NCU10006和NCU06487過表達菌株在2%微晶纖維素培養基上培養7天,發酵液上清液中蛋白SDS-PAGE分析(1和4為出發菌株,2為TCG-10006,3為TCG-6487)。
圖3:NCU05383和NCU05994過表達菌株在2%微晶纖維素培養基上培養4天,取發酵液上清液,測量蛋白濃度、木聚糖酶活和纖維素內切酶酶活。
圖4:NCU05383過表達菌株在2%微晶纖維素培養基上培養4天,發酵液上清液中蛋白SDS-PAGE分析。
圖5:NCU05994過表達菌株在2%微晶纖維素培養基上培養4天,發酵液上清液中蛋白SDS-PAGE分析。
圖6: NCU05051在2%微晶纖維素培養基上培養7天後,取發酵液上清液,測量蛋白濃度、纖維素內切酶酶活以及木聚糖酶活。
具體實施方式
本發明人經過廣泛而深入的研究,首次意外地發現,絲狀真菌中存在一系列與纖維素降解酶表達調控相關的鋅指轉錄因子。實驗證明,當這些鋅指轉錄因子的表達提高時,絲狀真菌中的纖維素酶或半纖維素酶的表達量會上升,從而能夠提高菌株對木質纖維素的利用,並增強木質纖維素的降解。在此基礎上,完成了本發明。
纖維素降解相關鋅指轉錄因子
如本文所用,術語「纖維素降解相關鋅指轉錄因子」、「本發明轉錄因子」、「本發明鋅指蛋白」均指在絲狀真菌中屬於鋅指家族且具有調控(半)纖維素酶表達或活性從而與纖維素降解相關的蛋白或其編碼基因。
實驗證明,當過表達本發明轉錄因子後,能夠有效地提高絲狀真菌中(半)纖維素酶的表達,並進一步提高絲狀真菌對木質纖維素的利用從而加強其降解。
優選地,本發明轉錄因子指的是在脈胞菌中的鋅指轉錄因子,例如,如SEQ ID NO: 1、3、5、7、或9所示序列的一種或多種。編碼這些轉錄因子的核苷酸序列分別如SEQ ID NO: 2、4、6、8、或10所示。
此外,本發明轉錄因子還包括來自多種絲狀真菌的鋅指家族的轉錄因子。例如,所述的絲狀真菌包括麴黴、木黴、青黴、鐮刀黴或毀絲酶。在這些絲狀真菌的轉錄因子中,可以找到與本發明SEQ ID NO: 1、3、5、7、或9所示序列具有一定同源性的轉錄因子。優選地,這些轉錄因子中與本發明SEQ ID NO: 1、3、5、7、或9所示序列同源性大於30%,較佳地大於50%,更佳地大於65%的轉錄因子與纖維素降解有密切的相關性。
同時,本領域技術人員可以根據本發明在其他絲狀真菌中找到同源性較高且與纖維素降解相關的鋅指家族轉錄因子。
過表達基因
通過向真菌宿主中引入另一份或多份拷貝的目標基因,或通過另一個啟動子使所述基因的表達增加,或將宿主進行遺傳操作使基因表達水平更高或基因產物的活性提高。
纖維素、纖維素酶、半纖維素酶
纖維素是自然界中存在最廣泛、最豐富的碳水化合物。多種微生物都具有降解、利用纖維素的能力,其可以分泌多種纖維素水解酶。
纖維素酶是一種多酶體系,由多種組份組成。按底物特異性可將纖維素酶分為以下組分:(1)外切β-1,4-葡萄糖酶(exo-beta-1,4-glucanase,EC.3.2.1.91)簡稱為外切酶,又稱為纖維二糖水解酶(cellobiohydrolases)。纖維二糖水解酶可以水解纖維素結晶區,從纖維素鏈的非還原端/還原端開始水解並釋放纖維二糖。(2)內切β-1,4-葡聚糖酶(endo-beta-1,4-glucanase,EC3.2.1.74)簡稱內切酶。纖維素內切酶能夠在纖維素多糖鏈上無定形部分隨機切斷糖苷鍵,產生新的糖鏈末端和長度不一的纖維寡糖。(3)β-1,4-葡萄糖苷酶(beta-1,4-glucosidase,EC3.2.1.21)簡稱纖維二糖酶。纖維二糖水解酶水解可溶性的纖維糊精和纖維二糖生成葡萄糖。(4)其它組分,除了以上三大組分外還有纖維二糖脫氫酶、纖維二糖醌氧化還原酶、磷酸化酶、纖維素酶小體等都會參與纖維素降解過程。
半纖維素具有與纖維素一樣的負責結構,其降解需要多種半纖維素酶的共同作用。其中主要有兩種:β-1,4-木聚糖酶和β-木糖苷酶。前者從半纖維素主鏈內部作用於木糖苷鍵,分解成低聚木糖,後者作用於低聚木糖的末端,釋放出單糖。除此之外,降解半纖維素還需要多種側鏈裂解酶的共同作用,主要有乙醯木聚糖酯酶、α-葡萄糖醛酸糖苷酶、α-阿拉伯呋喃糖苷酶等。
宿主菌
本發明「宿主菌」、「突變體」可互換使用,均是指將出發菌株中纖維素降解相關鋅指轉錄因子過表達後獲得的具有(增強的)降解纖維素活性的工程菌株。其中,本發明宿主菌在改造後,纖維素降解相關鋅指轉錄因子表達顯著提高。
本領域技術人員應理解,當獲得了鋅指轉錄因子的序列後,可以通過多種常規技術使某出發菌株中的鋅指轉錄因子的表達得到提高。通常,可採用隨機整合的方法,採用某標記(或抗性)基因將鋅指轉錄因子基因整合至出發菌株基因組中一個或多個位點上。
應用
通過過表達本發明鋅指蛋白,可以人為地提高絲狀真菌中(半)纖維素酶的表達量和/或活性,從而增加菌株對纖維素(尤其是木質纖維素)的利用。
例如,當獲得了本發明的工程菌後,可以通過加入纖維素原料的誘導,對所述的工程菌進行培養。此時,所述的菌株會分泌纖維素酶和半纖維素酶,對其進行分離並提純後,就可以獲得較純的纖維素酶和半纖維素酶。
由於產生纖維素酶和半纖維素酶的過程中,纖維素原料受其降解,形成降解產物。因此當進一步對培養物進行分離時,就可以獲得纖維素的多種降解產物,例如多種單體化合物:葡萄糖、木糖等。
本發明有益效果
本發明通過改造絲狀真菌在纖維素降解的調控因子及調控網絡,增強了絲狀真菌對纖維素的利用,提高了生物質降解,從而成為能量利用中的新途徑。
下面結合具體實施例,進一步闡述本發明。應理解,這些實施例僅用於說明本發明而不用於限制本發明的範圍。下列實施例中未註明具體條件的實驗方法,通常按照常規條件,例如Sambrook等人, 分子克隆:實驗室手冊(New York: Cold Spring Harbor Laboratory Press, 1989)中所述的條件,或按照製造廠商所建議的條件。除非另外說明,否則百分比和份數是重量百分比和重量份數。
本發明所採用的原始出發菌株商購於美國Fungal Genetics Stock Center(FGSC),其餘所用材料均為商購。
實施例1 NCU10006和NCU06487過表達菌株的構建
以粗糙脈胞菌組氨酸營養缺陷型菌株(FGSC #6103)(購自FGSC)出發,根據同源重組的原理,將NCU10006的整個開放閱讀框(Open Reading Frame, ORF)整合至his-3位點。
開放閱讀框特異性引物:
NCU10006F: TCTAGAATGCTGAGCTCACAGAACCCG (SEQ ID NO: 11);
NCU10006R: TTAATTAACGAAGCCAATCGCGCC (SEQ ID NO: 12)
NCU06487F:TCTAGAATGAGTACGACGGCCGCTT (SEQ ID NO: 13)
NCU06487R:TTAATTAAGCTTGGCCCACCTCTTCGT (SEQ ID NO: 14)
擴增NCU10006和NCU06487的開放閱讀框;然後分別通過酶切插入質粒pMF272中Xba I和Pac I酶切位點間,得到質粒pMF272-10006和pMF272-6487。將10 µg pMF272-10006電擊轉化至組氨酸營養缺陷型菌株(FGSC #6103,A),通過平板篩選陽性轉化子。提取轉化子基因組DNA,以其為模板,利用引物Pccg1-F和NCU10006R或進行擴增,如果可以擴增得到目的片段,則說明目標基因的開放閱讀框已整合到基因組中。引物如下所示:
Pccg1-F:GTCCTCCCACCTCCCCAAT (SEQ ID NO: 15)
將10 µg pMF272-6487電擊轉化至組氨酸營養缺陷型菌株(FGSC #6103,A),通過平板篩選陽性轉化子。提取轉化子基因組DNA,以其為模板,利用引物Pccg1-F和NCU06487R或進行擴增,如果可以擴增得到目的片段,則說明目標基因的開放閱讀框已整合到基因組中。
將上述所獲得的轉化子與野生型菌株雜交(FGSC #4200,a),將雜交得到的子囊孢子熱激(60℃, 45min)後,稀釋塗布在平板上,萌發後挑至斜面上,生長7天後,提取基因組,利用PCR進行鑑定,從而獲得過表達菌株的純合子TCG-10006和TCG-6487。
實施例2 NCU05383和NCU05994過表達菌株的構建
NCBI Database搜索粗糙脈胞菌全基因組序列,設計引物擴增組成型強啟動子tef片段,以及擴增NCU05383和NCU05994開放閱讀框所需引物,引物如下所示:
NCU05383F:GCTCTAGAATGTCCAATCATCATGAGAATCCTG (SEQ ID NO: 16)
NCU05383R:GGACTAGTAACGGGTGCGAAAACCGCAG (SEQ ID NO: 17)
NCU05994F:GCTCTAGAATGTCCGTTCCCAGTGCCGTC (SEQ ID NO: 18)
NCU05994R:GGACTAGTGTCCGCCAGCCCAGCCATTC (SEQ ID NO: 19)
tef-F:GAATGCGGCCGCTCATCAACAGTCGCTTGTCCAC (SEQ ID NO: 20)
tef-R:TGCTCTAGATTTGACGGTTGATGTGCTGACTG (SEQ ID NO: 21)
利用引物tef-F和tef-R擴增粗糙脈孢菌tef啟動子片段,將其插入至質粒pMF272的Xba I和Not I酶切位點之間,替換原有ccg-1啟動子片段,得到質粒pMF272-tef。擴增NCU05383和NCU05994的開放閱讀框;然後分別通過酶切插入質粒pMF272-tef中Xba I和Pac I酶切位點間,得到質粒pMF272-tef-5383和pMF272-tef-5994。
將10 µg 質粒電擊轉化至組氨酸營養缺陷型菌株(FGSC #6103,A),通過平板篩選陽性轉化子。提取轉化子基因組DNA,以其為模板,利用引物tef-F /NCU05383R和tef-F /NCU05994R進行擴增,如果可以擴增得到目的片段,則說明目標基因的開放閱讀框已整合到基因組中。引物如下所示:
將上述所獲得的轉化子與野生型菌株雜交(FGSC #4200,a),將雜交得到的子囊孢子熱激(60℃, 45min)後,稀釋塗布在平板上,萌發後挑至斜面上,生長7天後,提取基因組,利用PCR進行鑑定,從而獲得過表達菌株的純合子TCG-5383和TCG-5994。
實施例3 NCU05051過表達菌株的構建
以粗糙脈胞菌組氨酸營養缺陷型菌株(FGSC #6103)(購自FGSC)出發,根據同源重組的原理,將NCU05051的整個開放閱讀框(Open Reading Frame, ORF)整合至his-3位點。
開放閱讀框特異性引物:
NCU05051F: TCTAGAATGCTGAGCTCACAGAACCCG (SEQ ID NO: 22);
NCU05051R: CCTTAATTAATTGATAGCCTGGCATCTGAGGGTTG (SEQ ID NO: 23)
擴增NCU05051的開放閱讀框;然後分別通過酶切插入質粒pMF272中Xba I和Pac I酶切位點間,得到質粒pMF272-5051。將10 µg pMF272-5051電擊轉化至組氨酸營養缺陷型菌株(FGSC #6103,A),通過平板篩選陽性轉化子。提取轉化子基因組DNA,以其為模板,利用引物Pccg1-F和NCU05051R或進行擴增,如果可以擴增得到目的片段,則說明目標基因的開放閱讀框已整合到基因組中。引物如下所示:
Pccg1-F:GTCCTCCCACCTCCCCAAT (SEQ ID NO: 15)
將上述所獲得的轉化子與野生型菌株雜交(FGSC #4200,a),將雜交得到的子囊孢子熱激(60 ℃,45 min)後,稀釋塗布在平板上,萌發後挑至斜面上,生長7天後,提取基因組,利用PCR進行鑑定,從而獲得過表達菌株的純合子TCG-5051。
實施例4過表達菌株產纖維素酶、半纖維素酶實驗
轉錄因子工程菌和野生型粗糙脈孢菌分別在2%結晶纖維素培養基上培養7天,取培養基上清,離心後進行一系列驗證試驗。
4.1 方法:
4.1.1 蛋白濃度測定:
1. 標準蛋白溶液蛋白標準曲線制定:於1 mL去離子水中加入10 mg牛血清蛋白,得到10 mg/mL 標準貯液。以標準貯液稀釋濃度為0.2 mg/mL,0.4 mg/mL,0.6 mg/mL,0.8 mg/mL,1.0 mg/mL,1.2 mg/mL 的標準蛋白溶液,取20 µL標準蛋白溶液於1 mL Bradford 溶液中,混勻,室溫靜置5 min,測其OD595,得到縱坐標值,作為橫坐標值為BSA標準蛋白溶液濃度,以此製作標準曲線。
2. 待測蛋白溶液準備:吸取絲狀真菌發酵不同時間的發酵液於1.5 mL離心管,14000 rpm離心5 min,取上清置於新離心管中。
3. 蛋白濃度測定:1 mL Bradford中加入上述20 µL發酵液,對照為1 mL Bradford加入20 µL超純水。上下顛倒混勻後靜置反應5 min,在OD595條件下測定吸光度值。
4.1.2 CMCase(內切β-1,4-葡聚糖酶)酶活測定方法:
1. 反應酶液準備:根據蛋白濃度測定值,待測定發酵酶液以0.1 M pH 4.6醋酸鈉緩衝液稀釋至合適範圍。
2. 酶液與底物反應:0.2 mL稀釋的發酵液酶液與0.2 mL AZO-CMC底物分別於45 ℃預熱5 min。
3. 酶液與AZO-CMC底物混勻,45 ℃條件下水浴10 min,取1 mL沉澱劑,劇烈震蕩10 s終止酶和底物的反應,常溫靜置10 min,振蕩混勻,常溫下1000 g離心10 min。
4. 取上清於比色皿中OD590測定吸光度值Abs。空白對照採用滅活的發酵酶液。
5. 內切β-1,4-葡聚糖酶酶活(U/mL)計算公式: Units/mL=milli U/assay=(412.5×Abs-6)×2×1/1000×N
4.1.3 XYLANase(木聚糖酶)酶活測定方法:
1. 反應酶液準備:根據蛋白濃度測定值,待測定發酵酶液以0.1 M pH 4.6醋酸鈉緩衝液稀釋至合適範圍。
2. 酶液與底物反應:0.2 mL稀釋的發酵液酶液與0.2 mL AZO-XYLAN底物分別於45 ℃預熱5 min,酶液與AZO-XYLAN底物混勻,45 ℃溫度下反應10 min。
3. 取1 mL無水乙醇於上述離心管,劇烈振蕩10 s終止酶和底物的反應,室溫靜置5 min,振蕩混勻,常溫下1500 g離心10 min。
4. 取上清於比色皿中OD590測定吸光度值Abs。空白對照採用滅活的發酵酶液。
5. 木聚糖酶酶活(U/mL)計算公式: Units/ml= milli U/assay=(66.6×Abs2+105×Abs+3.9)×2×1/1000×N。
4.1.4 蛋白質SDS-PAGE實驗:
實驗中所用的蛋白預製膠均購自Life technologies公司,樣品製備操作如下:等體積上樣量(60 µL體系)蛋白電泳中所有樣品都取相同體積,NuPAGE RLDS Sample Buffer添加15 µL,NuPAGE Reducing Agent添加6 µL,剩餘體積用超純水補齊。混勻後的蛋白上樣液體置於70 ℃條件下10 min。
1×SDS Runing Buffer電泳緩衝液配置如下:取50 mL NuPAGERMES Running Buffer 於950 mL超純水中混合均勻,向電泳槽中加入600 mL電泳緩衝液,取200 mL電泳緩衝液中加入500 µL NuPAGERAntioxidant,混合均勻後加入上層電泳槽中。上樣完成後採用電壓200V,電泳45 min。
上述使用蛋白膠快速染色液考馬斯亮藍購自Solarbio公司,具體染色方法如下:
(1)溶液B 100 mL,與溶液A 2 mL充分混勻,染色液製備完成。
(2)將電泳完成後的蛋白膠置於容器中,加入100 mL超純水微波加熱至沸騰1 min,脫色搖床放振蕩5 min,棄液體。
(3)用雙蒸水輕輕衝洗兩次,加入適量染色液,微波至沸騰後持續1 min,脫色搖床振蕩5 min。棄染色液。
(4)雙蒸水衝洗兩次,加入50 mL雙蒸水加熱至沸騰1 min,置脫色搖床上振蕩10 min,棄液體,用雙蒸水衝洗兩次,再加入雙蒸水,置脫色搖床上振蕩過夜。
(5)蛋白膠置於凝膠成像儀中白光觀察,拍照。
4.2 結果:
在2%結晶纖維素條件下培養7天,Pc-10006過表達菌株TCG-10006培養基上清液中的蛋白濃度、纖維素酶酶活以及木聚糖酶酶活顯著提高,分別為出發菌株的2.4倍、1.5倍和1.7倍(圖1)。而Pc-6487過表達菌株TCG-6487培養基上清液中的蛋白濃度、纖維素酶酶活及木聚糖酶活也顯著升高,分別為出發菌株的1.8倍、1.2倍和1.7倍(圖1)。SDS-PAGE分析顯示,過表達菌株與出發菌株相比,蛋白條帶有所加深,尤其是72 kDa左右的纖維素酶CBH I和CBH II條帶變化最為明顯(圖2)。
NCU05383過表達菌株TCG-5383和NCU05994過表達菌株TCG-5994的搖瓶發酵實驗表明,在以2%結晶纖維素為碳源的條件下發酵4天後,其發酵液中蛋白含量分別提高了85%和120%。與出發菌株相比,TCG-5383和TCG-5994的纖維素酶酶活分別提高了90%和105%,並且其木聚糖酶活分別提高了150%和200%(圖3)。SDS-PAGE分析也證實了這一現象,與出發菌株相比,過表達菌株在72 KD處外切纖維素酶CBH I和CBH II的條帶加深(圖4-圖5)。
另外,在2%結晶纖維素條件下培養7天,與出發菌株相比較,NCU05051過表達菌株TCG-5051培養基上清液中的蛋白濃度和纖維素酶酶活分別提高了20%和80%,而木聚糖酶酶活顯則無明顯差異(圖6)。
此外應理解,在閱讀了本發明的上述講授內容之後,本領域技術人員可以對本發明作各種改動或修改,這些等價形式同樣落於本申請所附權利要求書所限定的範圍。
